Оригинальные исследования
ОБОСНОВАНИЕ. В 2018 г. в России появилась система флеш-мониторирования глюкозы (ФМГ) — FreeStyle Libre Flash Glucose Monitoring, которая стала потенциальной альтернативой традиционному самоконтролю глюкозы крови (СМГК). Проведенные к настоящему времени исследования показали преимущества ФМГ по сравнению с СМГК, однако лишь отдельные из них относятся к реальной клинической практике, особенно у детей с СД1.
ЦЕЛЬ. Оценить эффективность ФМГ у детей с сахарным диабетом 1 типа (СД1) в отношении показателей гликемического контроля, возникновения тяжелой гипогликемии и диабетического кетоацидоза, а также удовлетворенность пациентов и их родителей применением ФМГ.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое проспективное обсервационное когортное исследование. К участию в исследовании были приглашены дети 4–18 лет с СД1 и уровнем гликированного гемоглобина (HbA1c) менее 10,0% на интенсифицированной инсулинотерапии (путем множественных инъекций — МИИ или непрерывной подкожной инфузии инсулина — НПИИ). Длительность участия пациента в исследовании составляла 6 мес. Исходно и далее каждые 3 мес проводились очные консультации с оценкой общего состояния, исследованием HbA1c, оценкой показателей гликемии, прогресса в отношении целевых показателей гликемического контроля и коррекцией проводимой терапии. Всего в исследование были включены 228 пациентов (110 мальчиков и 118 девочек), подходящих по критериям включения. Медиана возраста составила 11,2 (8,6–14,7) года, длительность СД1 — 3,8 (2–7,1) года, 136 пациентов получали инсулинотерапию путем НПИИ в течение 1,3 (0,8–2,6) года.
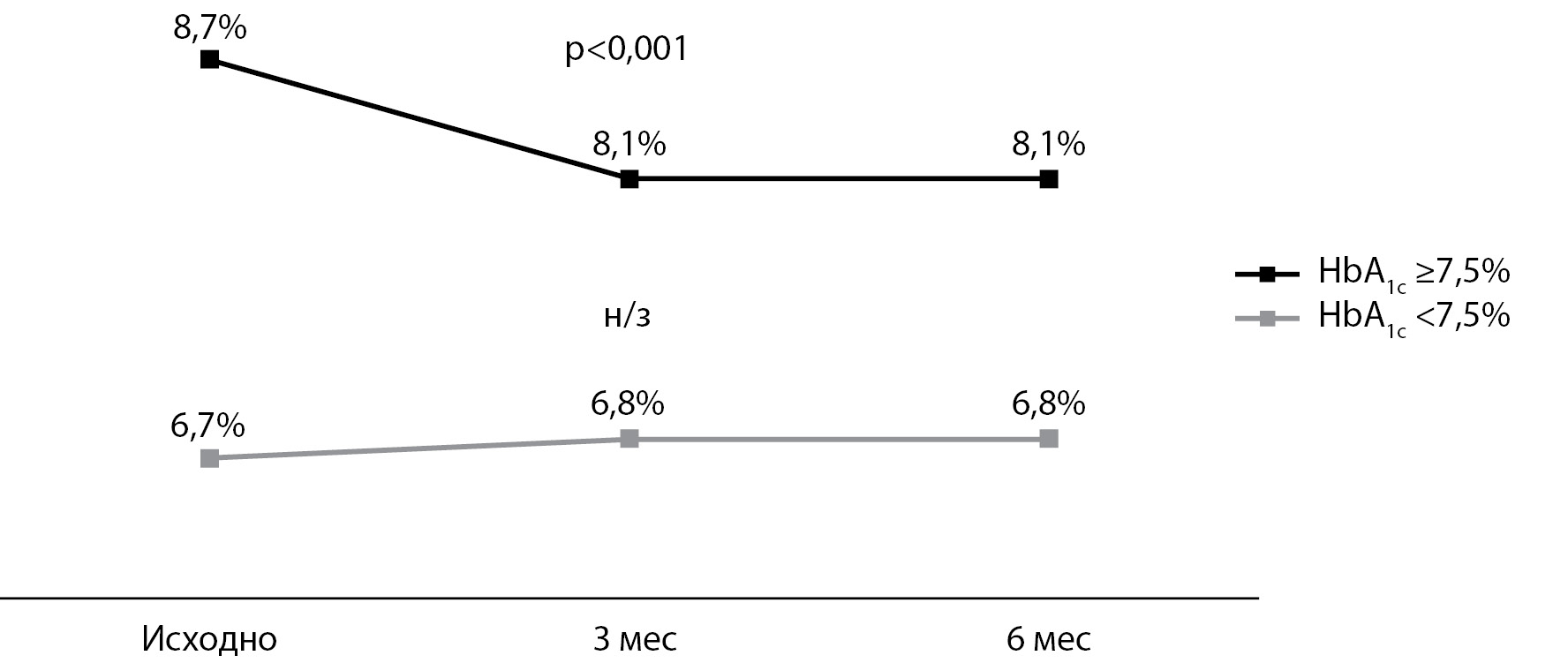
РЕЗУЛЬТАТЫ. В общей группе пациентов, через 3 и 6 мес после начала использования ФМГ, показатели HbA1c статистически значимо снизились на 0,2%. Помимо этого, увеличилось количество детей с уровнем HbA1c <7,5% на 6,1 и 4,9% на 3-м и 6-м месяце соответственно, однако данные изменения не были статистически значимыми. Число случаев диабетического кетоацидоза при использовании ФМГ снизилось на 74%, а число случаев тяжелой гипогликемии — на 83%, таким образом, число эпизодов снизилось в 4 и 6 раз соответственно. Удобство применения и свой опыт использования ФМГ пациенты и/или их родители оценивали по шкале от 0 (полностью согласен) до 4 (совсем не согласен). Большинство детей и родителей положительно (0 или 1) оценили удобство установки и ношения датчика (72,7–98,2%) и использование системы ФМГ в целом (75,0–96,4%) по сравнению с СМГК глюкометром (92,3–98,2%).
ЗАКЛЮЧЕНИЕ. Установка и использование ФМГ являются удобными и комфортными для абсолютного большинства детей и родителей, при этом по сравнению с СМГК применение ФМГ удобнее и проще, а измерение глюкозы гораздо быстрее и менее болезненно.
ОБОСНОВАНИЕ. «Порочный круг» ассоциаций сахарного диабета (СД) с патологией поджелудочной железы (ПЖ), когда заболевания ПЖ могут инициировать СД, а СД 2 типа (СД2) может вызвать функциональную и органическую патологию ПЖ, обуславливает поиск возможных ассоциаций. Отдельные исследования установили связь полиморфизма TNF, ТР53 или с СД, или с заболеваниями ПЖ.
ЦЕЛЬ. Оценить и сравнить показатели глюкозы плазмы натощак и частоту гипергликемии у больных острым панкреатитом (ОП), хроническим панкреатитом (ХП), раком поджелудочной железы (РПЖ) в зависимости от пола, формы, этиологии или стадии заболевания, полиморфизма -308G/A гена TNF у всех больных и полиморфизма 72Arg/Pro гена TP53 у больных РПЖ.
МЕТОДЫ. В ходе наблюдательного многоцентрового клинического кросс-секционного неконтролируемого исследования обследованы 44 больных ОП, 97 больных ХП и 45 больных РПЖ, группы были сравнимы по полу/ возрасту. Письменное информированное согласие на участие в исследовании было получено от каждого пациента. Основной исход исследования: частота гипергликемии у больных ОП, ХП, РПЖ с учетом полиморфизма генов TNF и TP53.
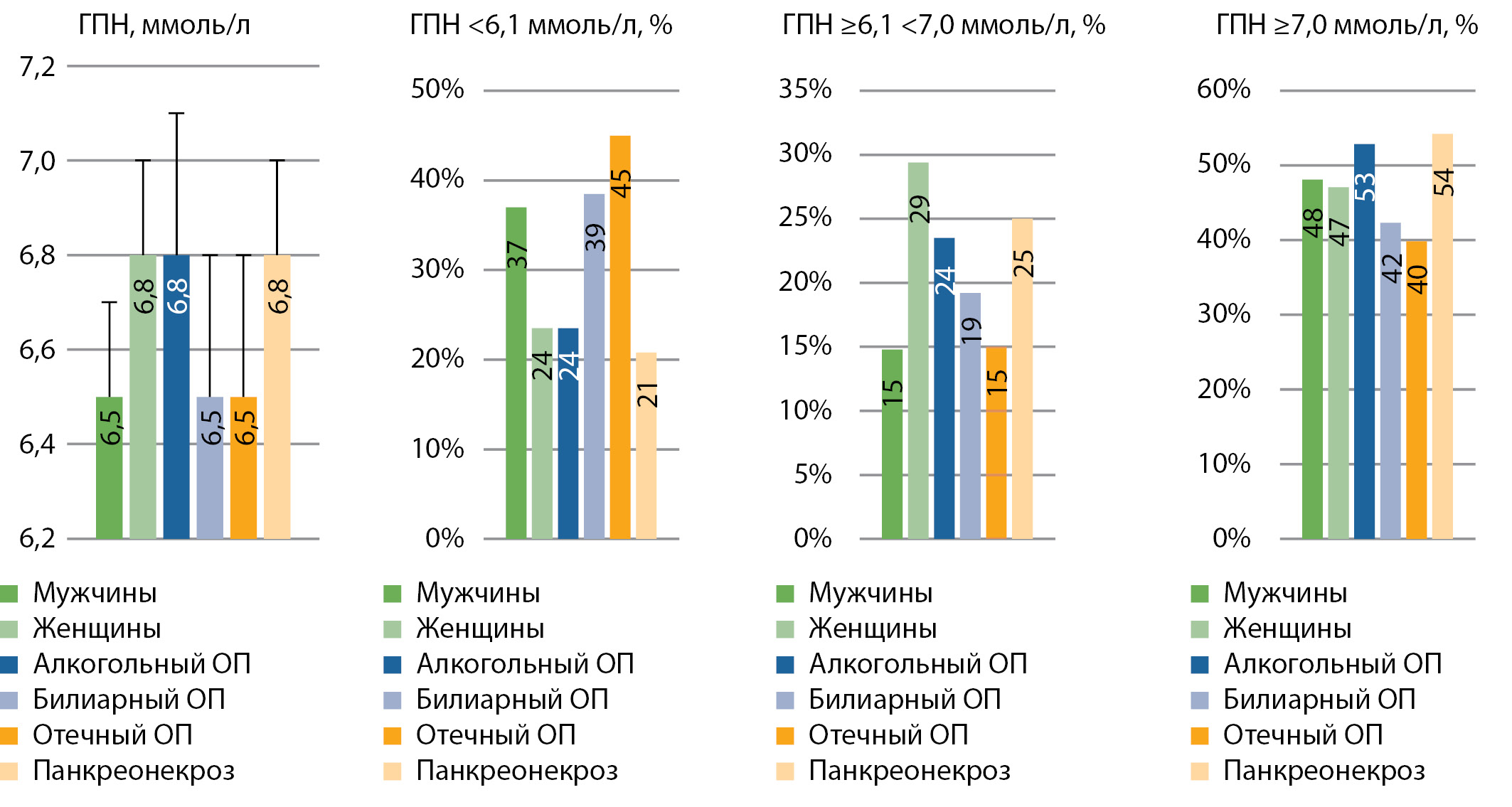
РЕЗУЛЬТАТЫ. Наиболее низкие стандартизованные по возрасту показатели глюкозы плазмы натощак (ГПН) определены у больных ХП (6,2±0,2 ммоль/л), чем у больных ОП (6,7±0,2 ммоль/л; p=0,041). У больных РПЖ (6,6±0,2 ммоль/л) средние уровни ГПН существенно не различались при сравнении с больными ОП (p=0,749) или ХП (p=0,092). У больных ОП норму ГПН выявляли реже (31,8%), чем у больных ХП (54,6%; χ2 =6,3; p=0,012), у больных РПЖ частота нормы ГПН (48,9%) практически не различалась с таковой у больных ОП или ХП. Частота ГПН ≥6,1<7,0 ммоль/л не различалась у больных ОП (20,5%), ХП (9,3%) или РПЖ (17,8%). Частота ГПН≥7,0 ммоль/л не различалась у больных ОП, ХП и РПЖ: 47,7, 36,1, 33,3%. Логистический регрессионный анализ у больных РПЖ выявил тенденцию к повышению шанса наличия 3–4 стадии РПЖ при ГПН≥7,0 ммоль/л (Exp (B)=3,205; 95% ДИ 0,866–11,855; p=0,081), но не у больных с панкреонекрозом или «определенным» ХП. Частоты генотипов G/G (71,4, 74,7, 76,2%), G/A (26,2, 24,1, 23,8%) полиморфизма -308G/A TNF не различались у больных ОП, ХП или РПЖ; p>0,05. У больных РПЖ генотипы Arg/Arg, Arg/Pro, Pro/Pro гена полиморфизма 72 Arg/Pro TP53 определены в 2,4, 35,7, 61,9% случаев. Не выявлено ассоциаций между уровнем ГПН ≥7,0 ммоль/л и полиморфизмом гена TNF у больных ОП, ХП, РПЖ или полиморфизмом гена ТР53 — у больных РПЖ.
ЗАКЛЮЧЕНИЕ. Частота ГПН ≥7,0 ммоль/л не отличалась при различной патологии ПЖ и не была ассоциирована с риском панкреонекроза и «определенного» ХП. Полиморфизм -308G/A гена TNF не различался у больных ОП, ХП или РПЖ и не был ассоциирован с нарушением углеводного обмена. Полиморфизм 72Arg/Pro гена TP53 у больных РПЖ не был ассоциирован с нарушением углеводного обмена.
ОБОСНОВАНИЕ. Подагра ассоциируется с высокой частотой сахарного диабета 2 типа (СД2).
ЦЕЛЬ. Рассчитать риск СД2 по шкале FINDRISС, оценить чувствительность и специфичность шкалы у пациентов с подагрой по результатам проспективного наблюдения.
МАТЕРИАЛЫ И МЕТОДЫ. В проспективное одноцентровое исследование включены 444 пациента c подагрой старше 18 лет (49 женщин, 395 мужчин), не имеющих СД. Длительность наблюдения варьировала от 2 до 8 лет. Исходно рассчитывали риск развития СД2 по российской версии шкалы FINDRISС. Риск развития СД2 оценивался как низкий при суммарном счете (СС) <7 баллов, слегка повышенный — от 7 до 11, умеренный — от 12 до 14, высокий — от 15 до 20 и очень высокий — ≥20 баллов. Для оценки валидности использования шкалы FINDRISС были проведены анализ чувствительности, специфичности, построение ROC-кривой с определением площади под кривой. Определяли наличие и количество подкожных тофусов, количество приступов артрита за последний год, число пораженных суставов за время болезни, сывороточные уровни креатинина, мочевой кислоты, С-реактивного белка, гликированного гемоглобина.
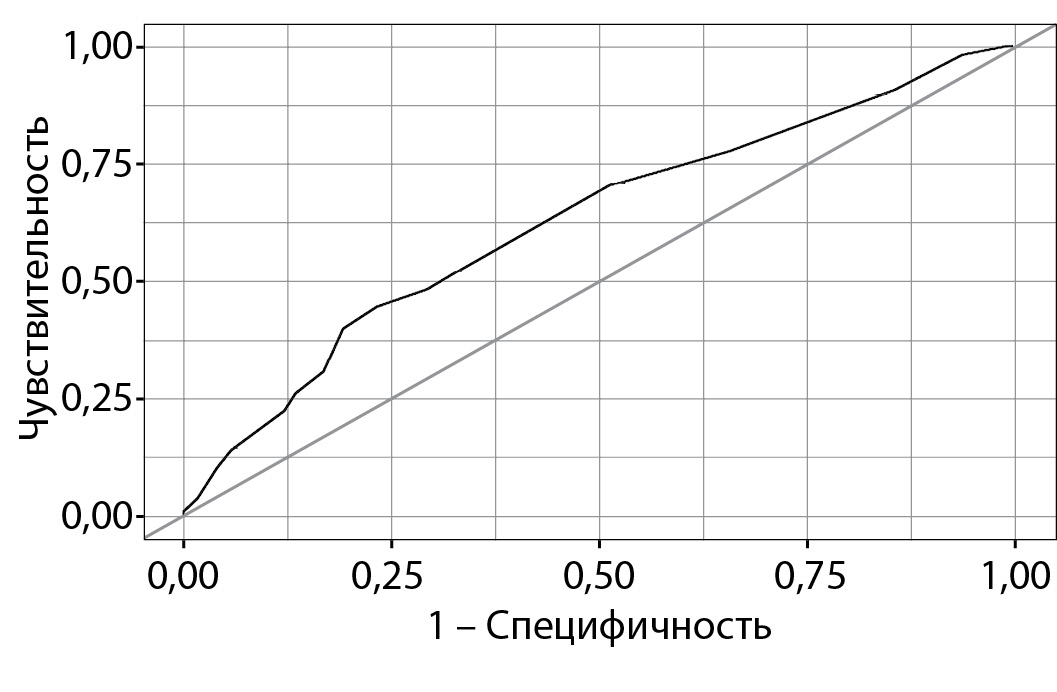
РЕЗУЛЬТАТЫ. За 5,66 [2,69; 7,64] года наблюдения СД2 развился у 108 пациентов (24,3%). По шкале FINDRISС низкий риск выявлен у 16 (4%), слегка повышенный — у 187 (42%), умеренный — у 98 (22%), высокий — у 80 (18%), очень высокий — у 63 (14%) пациентов. Наиболее часто встречающимися факторами риска СД2, входящими в FINDRISС, были индекс массы тела >25 кг/м2 — 85,6%, прием гипотензивных препаратов — 81,3%, возраст старше 45 лет — 70,5% пациентов. Чувствительность и специфичность шкалы FINDRISС составили 52,8 и 66,3% соответственно. Согласно этим данным, качество модели было оценено как среднее. У пациентов, имевших умеренный/высокий/очень высокий риск (n=228), значимо чаще, чем у пациентов с низким или слегка повышенным риском (n=177), выявлялись подкожные тофусы (42,9% vs 31,1% (р=0,014)), сывороточный уровень мочевой кислоты ≤300 мкмоль/л. СД2 развился у 33,3% пациентов с умеренным/высоким/очень высоким риском и у 18,1% пациентов с низким или слегка повышенным риском (p=0,0002).
ЗАКЛЮЧЕНИЕ. Шкала FINDRISС может обладать достаточной чувствительностью (52,8%) и специфичностью (66,3%) и применяться для расчета риска СД2 у пациентов с подагрой.
ОБОСНОВАНИЕ. Нарушения углеводного обмена являются частыми осложнениями после комплексного лечения онкологических заболеваний. Раннее выявление данных нарушений позволяет модифицировать образ жизни, при необходимости применить медикаментозную терапию и вовремя скорректировать выявленные изменения, что впоследствии приведет к снижению сердечно-сосудистых рисков, улучшению качества и увеличению продолжительности жизни этой группы пациентов.
ЦЕЛЬ. Выявить частоту встречаемости и определить оптимальные методы ранней диагностики нарушений углеводного обмена у детей после комплексного лечения медуллобластомы.
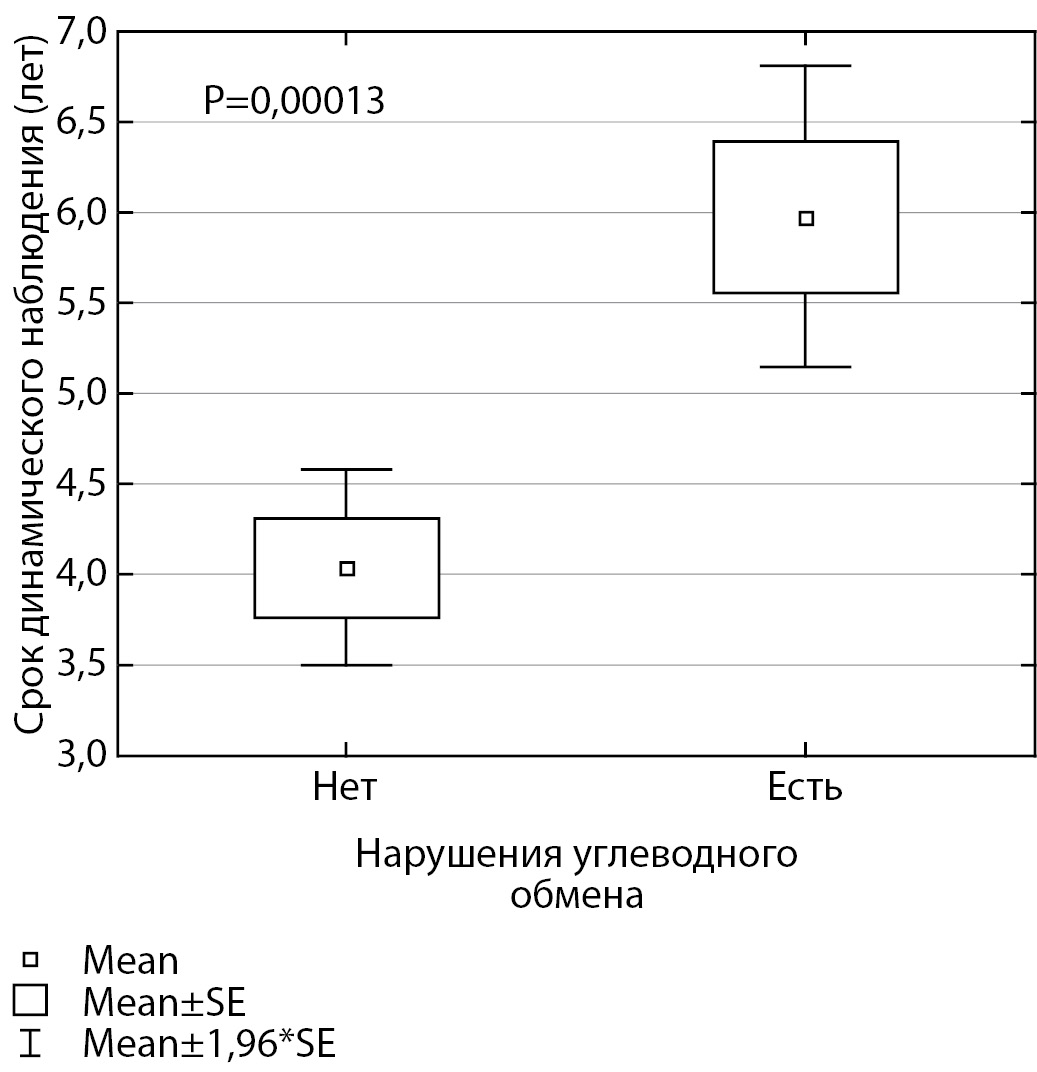
МАТЕРИАЛЫ И МЕТОДЫ. Обследованы 97 пациентов (64 мальчика, 33 девочки) после комплексного лечения медуллобластомы (оперативное лечение, краниоспинальная лучевая терапия, химиотерапия). Медиана возраста на момент обследования составляла 11,2 (5,29–17,9) года. Средний срок динамического наблюдения после окончания всех видов лечения — 4,7 (0,59–11,94) года. На момент обследования все пациенты были скомпенсированы по гипотиреозу и гипокортицизму (при наличии), и никто не находился на терапии гормоном роста. Всем пациентам проведены стандартный оральный глюкозотолерантный тест (ОГТТ) и определение уровня гликированного гемоглобина (HbA1c).
РЕЗУЛЬТАТЫ. Ни у одного пациента уровень базальной гликемии не превышал 5,5 ммоль/л. Нарушение толерантности к глюкозе (НТГ; гликемия на 120-й минуте ≥7,8 ммоль/л и <11,09 ммоль/л) выявлено у 10 из 97 пациентов (10,3%). У 7 пациентов с НТГ отмечалась инсулинорезистентность (по индексу MATSUDA), при этом у 1 из них индекс HOMA-IR был в норме. Только у одного пациента с НТГ отмечалось повышение уровня HbA1c до 6,2%. Инсулинорезистентность (по индексу MATSUDA) имелась у 30 пациентов, причем у 11 из них индекс HOMA-IR был в норме. Таким образом, 34 (35,1%) пациента из 97 имели нарушения углеводного обмена (НТГ и/или инсулинорезистентность). При этом уровень HbA1c отражал нарушения только в одном случае, а базальный уровень гликемии не был информативен ни в одном случае.
ЗАКЛЮЧЕНИЕ. Оценка базальных уровней гликемии и инсулина, а также HbA1c недостаточна для исключения нарушений углеводного обмена у пациентов после комплексного лечения медуллобластомы. Целесообразно проведение стандартного ОГТТ.
ОБОСНОВАНИЕ. Сахарный диабет (СД) 2 типа является одним из важных маркеров развития неблагоприятных кардиоваскулярных событий после каротидной эндартерэктомии (КЭЭ). Однако исследования по данному вопросу построены на небольших выборках больных и не учитывают вид операции как дополнительный фактор потенциально негативного влияния на течение послеоперационного периода.
ЦЕЛЬ. Анализ госпитальных и отдаленных результатов эверсионной и классической КЭЭ с пластикой зоны реконструкции биологической заплатой у пациентов с СД 2 типа (СД2) и без него.
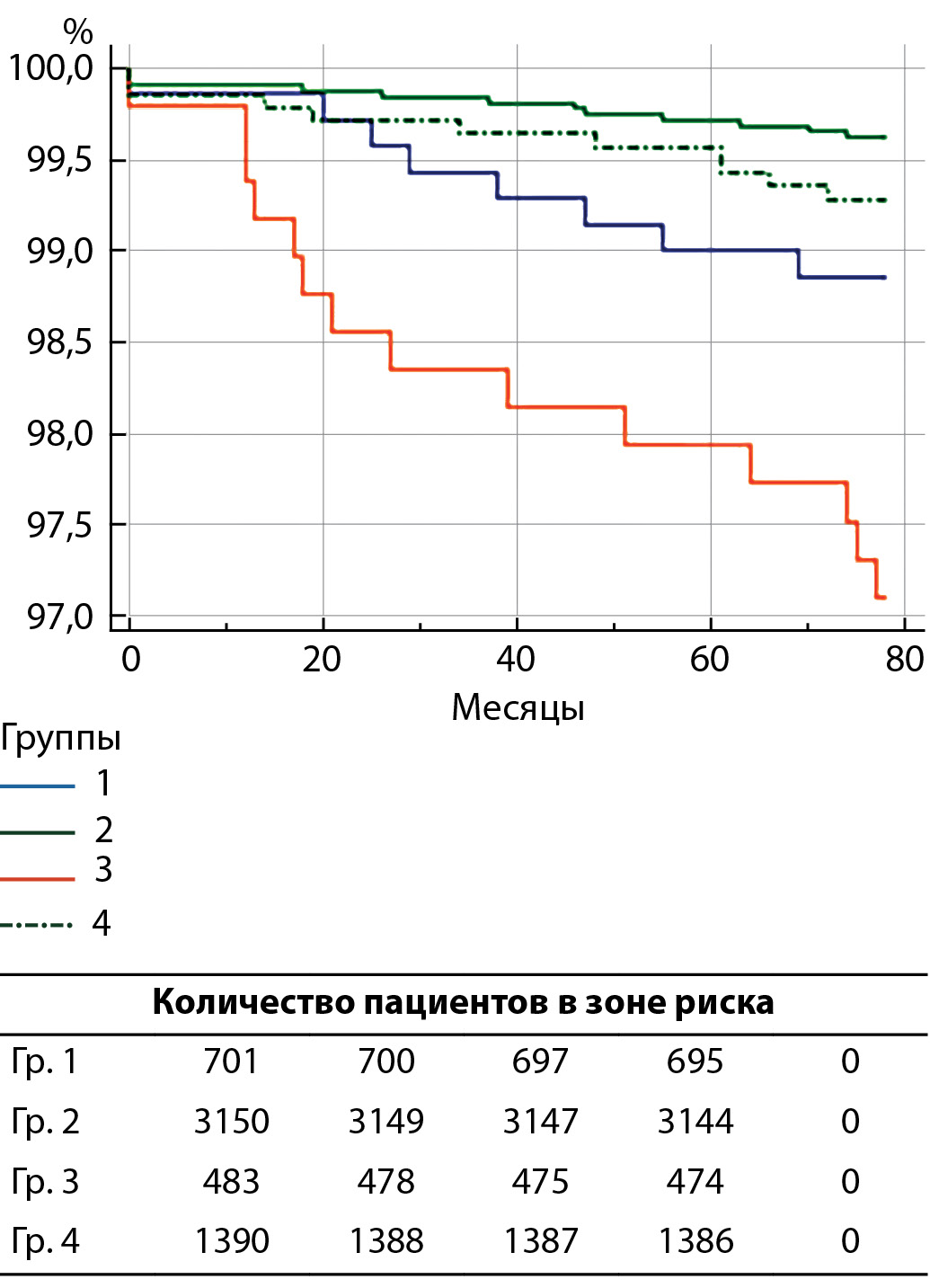
МАТЕРИАЛЫ И МЕТОДЫ. В данное многоцентровое ретроспективное исследование за период с января 2010 по декабрь 2020 гг. включен 5731 пациент. В зависимости от наличия/отсутствия СД2 и вида реализованной КЭЭ было сформировано 4 группы: 1-я группа — 12,2% (n=702) — пациенты с СД2 после эверсионной КЭЭ; 2-я группа — 55,0% (n=3153) — пациенты без СД2 после эверсионной КЭЭ; 3-я группа — 8,5% (n=484) — пациенты с СД2 после классической КЭЭ; 4-я группа — 24,3% (n=1392) — пациенты без СД2 после классической КЭЭ. Длительность послеоперационного наблюдения составила 78,6±39,2 мес.
РЕЗУЛЬТАТЫ. На отдаленном этапе наблюдения пациенты с СД2 после классической техники операции продемонстрировали наибольшие показатели всех вариантов осложнений: смерть (р<0,0001), инфаркт миокарда (р=0,011), ишемический инсульт (р<0,0001), рестеноз/окклюзия внутренних сонных артерий (ВСА) (р<0,0001), комбинированная конечная точка (р<0,0001). При этом вторую позицию по распространенности неблагоприятных событий заняла группа эверсионной КЭЭ с нарушением углеводного обмена. Такие обстоятельства демонстрируют, что имплантация заплаты сопровождается повышенным риском развития не только инфаркта миокарда, но и рестеноза зоны реконструкции, а также связанного с ним ишемического инсульта, что продемонстрировали наши результаты.
ЗАКЛЮЧЕНИЕ. Пациенты с СД2 и КЭЭ в анамнезе подвержены повышенному риску развития ишемического инсульта на госпитальном этапе наблюдения и всех неблагоприятных кардиоваскулярных состояний (летальный исход, инфаркт миокарда, ишемический инсульт, рестеноз или окклюзия ВСА в зоне реконструкции) в отдаленном послеоперационном периоде.
ВВЕДЕНИЕ. Распространенность синдрома диабетической стопы среди населения Индии увеличивается. Синдром диабетической стопы — это триада неврологических, сосудистых и биомеханических изменений, вызванных длительным сахарным диабетом (СД). Изменение распределения давления подошвы является фактором риска развития язв диабетической стопы.
ЦЕЛЬ. Оценить распределение и параметры подошвенного давления при СД 2 типа (СД2) с синдромом диабетической стопы.
МЕТОДЫ. В этом исследовании приняли участие 60 пациентов с СД2. Всего было выделено 3 группы пациентов: 20 пациентов без диабетической нейропатии, 20 с диабетической дистальной нейропатией без поражения сосудов и 20 с диабетической дистальной нейропатией с поражением периферических артерий. Затем мы сравнили параметры подошвенного давления, такие как максимальное подошвенное давление, интеграл давления и времени и общую площадь контакта, которые были измерены с использованием системы подошвенного давления WinTrack.
РЕЗУЛЬТАТЫ. Группа диабетической дистальной нейропатии с поражением периферических сосудов показала значительную разницу во всех измеренных параметрах подошвенного давления по сравнению с группой диабетической дистальной нейропатии без поражения сосудов. Было увеличено максимальное подошвенное давление, интегральное давление-время, а также уменьшена общая площадь контакта стопы (р<0,05).
ЗАКЛЮЧЕНИЕ. Пациенты с дистальной нейропатией и поражением периферических сосудов имеют повышенное распределение подошвенного давления, подвержены более высокому риску развития нейроишемического поражения, что в дальнейшем приводит к язвам стопы.
Обзоры
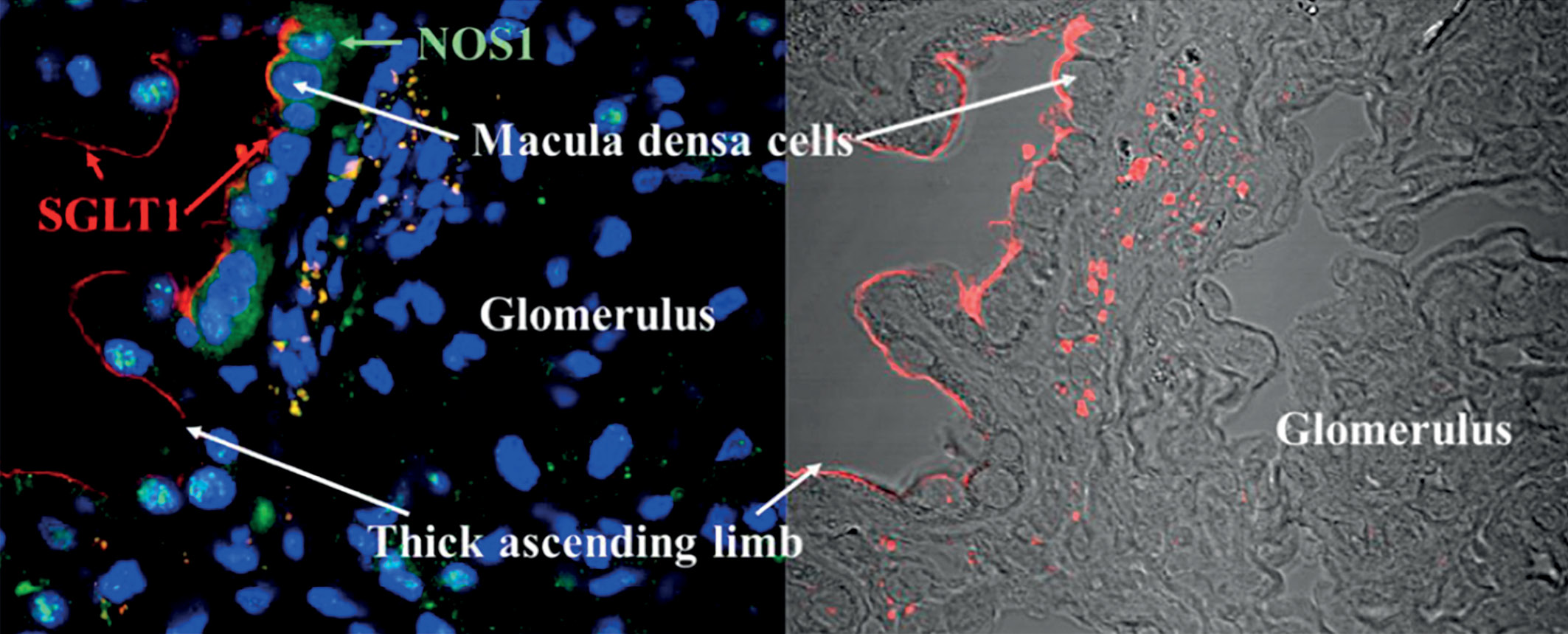
Результаты ряда крупных международных исследований по оценке влияния ингибиторов натрийглюкозного котранспортера 2-го типа (SGLT2) на сердечно-сосудистый риск продемонстрировали нефропротективный потенциал этих препаратов. Канаглифлозин в исследовании CREDENCE, которое было первым исследованием с первичным фокусом на оценке нефропротективных свойств глифлозинов, убедительно показал возможность замедления прогрессирования почечной патологии. В статье обобщены результаты последовавших субанализов CREDENCE: эффективность канаглифлозина в зависимости от исходного уровня расчетной скорости клубочковой фильтрации (рСКФ); эффекты у лиц с рСКФ <30 мл/мин/1,73 м2 ; влияние на развитие и течение анемии; влияние на уровень калия в крови; эффекты в отношении сердечной недостаточности и сердечно-сосудистой смертности. С учетом доказанных преимуществ современные алгоритмы лечения пациентов с сахарным диабетом 2 типа и хронической болезнью почек отдают приоритет использованию глифлозинов. Канаглифлозин является препаратом с относительно низким соотношением селективности к SGLT1/SGLT2. Описаны механизмы, опосредованные ингибированием SGLT1 транспорта в почке и в кишечнике, что, помимо уменьшения постпрандиальной гликемии, возможно, имеет дополнительный потенциал для нефропротекции.
Распространенность сахарного диабета 2 типа (СД2) резко увеличивается во всем мире. Консервативные методики лечения приносят нестойкий и зачастую недостаточный эффект, не говоря уже об отсутствии перспективы излечения заболевания. Однако накопленные данные указывают на то, что полная ремиссия СД2 возможна на фоне хирургического лечения. Эффективность бариатрической хирургии, в частности в достижении гликемического контроля, выдвинула оперативное лечение на первый план в качестве возможности достижения излечения СД2. По сравнению с интенсивной медикаментозной терапией и коррекцией образа жизни метаболическая хирургия показала превосходство благодаря уменьшению количества принимаемых лекарственных препаратов и улучшению метаболических показателей, что приводит к долгосрочным преимуществам в отношении прогрессирования СД2 и развития осложнений. Понимание же факторов, прогнозирующих ремиссию диабета после выполнения операции, поможет в отборе пациентов для выполнения бариатрической операции и в выборе наиболее эффективного типа вмешательства. В данном обзоре литературы проведен анализ исследований наиболее значимых клинических и биохимических предикторов ремиссии СД2 после бариатрических вмешательств, а также освещены известные математические модели прогнозирования.
Метформин является одним из наиболее часто назначаемых для лечения и профилактики сахарного диабета 2 типа (СД2) лекарственных препаратов. Накапливаются многочисленные свидетельства, указывающие, что в основе неблагоприятных побочных эффектов метформина, а также индивидуальных различий ответа пациентов на лечение лежат как генетические, так и средовые факторы. В настоящем обзоре обобщена информация о генетических факторах и средовых модификаторах, определяющих индивидуальную реакцию пациентов на лечение метформином. Обобщены данные о роли полиморфизма наиболее значимых генов и кодируемых ими белковых продуктов как в развитии неблагоприятных эффектов, так и в определении терапевтического ответа, а также обсуждено место метформина в реализации фенотипических эффектов данных генов.
Рассмотрены эндогенные условия и экзогенные воздействия, модифицирующие ответ на метформин. Среди них факторы, влияющие на функциональное состояние генома (уровень метилирования генов, так или иначе связанных с ответом на метформин, и др.), отражающие биологические особенности организма (половая принадлежность, возраст), уровень здоровья (наличие сопутствующих заболеваний, обеспеченность организма биометаллами и витаминами), прием других лекарственных препаратов и т.д. Таким образом, существует широкий спектр модифицирующих ответ на метформин факторов, которые, в отличие от генетических особенностей, являются в большинстве своем управляемыми. При этом и генетические, и средовые факторы могут различаться по значимости в разных этно-территориальных группах населения. Данную информацию необходимо принимать во внимание при разработке персонализированного подхода к назначению метформина для лечения СД2, а также при рекомендации его использовать для лечения других болезней.
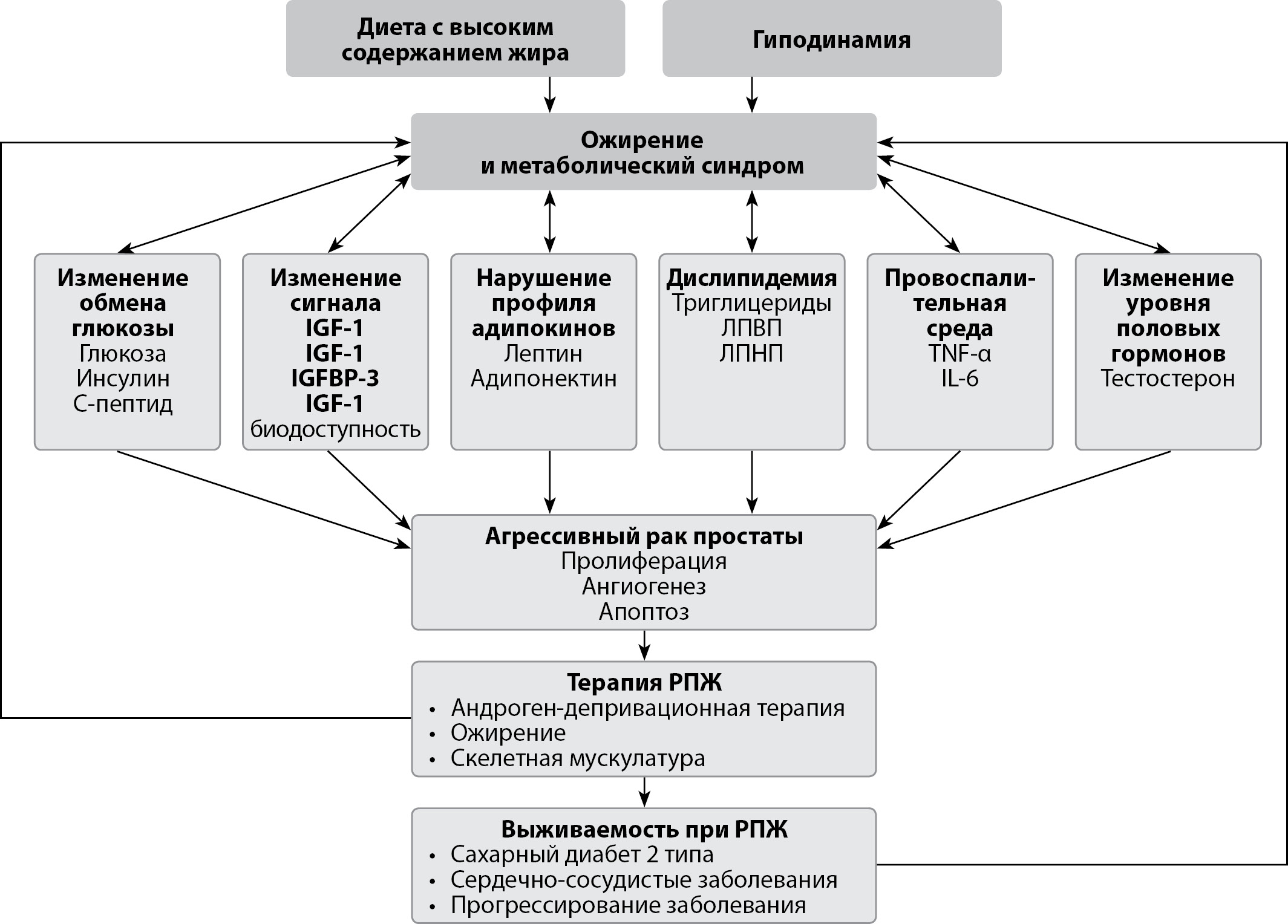
Сахарный диабет 2 типа (СД2) и рак предстательной железы являются широко распространенными заболеваниями во всем мире. СД2 выражается нарушением контроля гликемии, гиперинсулинемией, инсулинорезистентностью (ИР). Накопление глюкозы и липидов приводит к уменьшению плотности инсулиновых рецепторов и развитию ИР в жировой ткани. Это способствует развитию гиперинсулинемии, что подавляет распад жиров и приводит к прогрессированию ожирения. Развивается порочный круг: ИР → гиперинсулинемия → ожирение → ИР. В исследованиях последнего времени показана сильная прямая корреляционная связь между уровнем инсулина натощак и смертностью от рака у мужчин. Это может быть особенно актуально у пациентов старше 65 лет, которые в первую очередь более склонны к развитию рака простаты, чем молодые пациенты. Стоит отметить, что именно инсулин, а не глюкоза, связан с риском развития онкологических заболеваний. Инсулин оказывает влияние на прогрессирование клеточного цикла, пролиферацию и метастатическую активность опухоли. Гиперинсулинемия, которая часто возникает в результате андрогенной депривационной терапии (АДТ) — стандартного лечения рака предстательной железы, связана с высокой агрессивностью опухоли и более быстрой неэффективностью проводимой терапии — развитием кастрат-рефрактерного рака предстательной железы. Разумно предположить, что гиперинсулинемия — какими бы обстоятельствами она ни вызывалась, будь то АДТ или неправильное питание и другие факторы образа жизни — может оказывать такое же негативное влияние на передачу сигналов клетками.
Метаболический синдром — по существу, хронически повышенный уровень инсулина — тесно связан с рецидивом онкологических заболеваний и худшими исходами после лечения, что побудило исследователей усомниться в общепринятых диетических рекомендациях для больных раком, особенно когда они проходят лечение или выздоравливают после лечения, которое может включать рекомендации употреблять все, что поможет поддерживать или восстанавливать вес тела, независимо от содержания углеводов или его влияния на уровень инсулина. Большое количество пациентов живут с гиперинсулинемией, но нормогликемией. Хроническая гиперинсулинемия является основной движущей силой кардиометаболических заболеваний, даже когда уровень глюкозы в крови в пределах референсных значений. Масштаб данной проблемы не осознан медицинским и научным сообществом.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).
ISSN 2072-0378 (Online)