Перейти к:
Результаты различных видов каротидной эндартерэктомии у пациентов с сахарным диабетом 2 типа
https://doi.org/10.14341/DM12722
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет (СД) 2 типа является одним из важных маркеров развития неблагоприятных кардиоваскулярных событий после каротидной эндартерэктомии (КЭЭ). Однако исследования по данному вопросу построены на небольших выборках больных и не учитывают вид операции как дополнительный фактор потенциально негативного влияния на течение послеоперационного периода.
ЦЕЛЬ. Анализ госпитальных и отдаленных результатов эверсионной и классической КЭЭ с пластикой зоны реконструкции биологической заплатой у пациентов с СД 2 типа (СД2) и без него.
МАТЕРИАЛЫ И МЕТОДЫ. В данное многоцентровое ретроспективное исследование за период с января 2010 по декабрь 2020 гг. включен 5731 пациент. В зависимости от наличия/отсутствия СД2 и вида реализованной КЭЭ было сформировано 4 группы: 1-я группа — 12,2% (n=702) — пациенты с СД2 после эверсионной КЭЭ; 2-я группа — 55,0% (n=3153) — пациенты без СД2 после эверсионной КЭЭ; 3-я группа — 8,5% (n=484) — пациенты с СД2 после классической КЭЭ; 4-я группа — 24,3% (n=1392) — пациенты без СД2 после классической КЭЭ. Длительность послеоперационного наблюдения составила 78,6±39,2 мес.
РЕЗУЛЬТАТЫ. На отдаленном этапе наблюдения пациенты с СД2 после классической техники операции продемонстрировали наибольшие показатели всех вариантов осложнений: смерть (р<0,0001), инфаркт миокарда (р=0,011), ишемический инсульт (р<0,0001), рестеноз/окклюзия внутренних сонных артерий (ВСА) (р<0,0001), комбинированная конечная точка (р<0,0001). При этом вторую позицию по распространенности неблагоприятных событий заняла группа эверсионной КЭЭ с нарушением углеводного обмена. Такие обстоятельства демонстрируют, что имплантация заплаты сопровождается повышенным риском развития не только инфаркта миокарда, но и рестеноза зоны реконструкции, а также связанного с ним ишемического инсульта, что продемонстрировали наши результаты.
ЗАКЛЮЧЕНИЕ. Пациенты с СД2 и КЭЭ в анамнезе подвержены повышенному риску развития ишемического инсульта на госпитальном этапе наблюдения и всех неблагоприятных кардиоваскулярных состояний (летальный исход, инфаркт миокарда, ишемический инсульт, рестеноз или окклюзия ВСА в зоне реконструкции) в отдаленном послеоперационном периоде.
Ключевые слова
Для цитирования:
Казанцев А.Н., Виноградов Р.А., Чернявский М.А., Кравчук В.Н., Шматов Д.В., Сорокин А.А., Ерофеев А.А., Луценко В.А., Султанов Р.В., Шабаев А.Р., Раджабов И.М., Баздавадзе Г.Ш., Заркуа Н.Э., Матусевич В.В., Вайман Е.Ф., Солобуев А.И., Артюхов С.В., Лидер Р.Ю., Порханов В.А., Хубулава Г.Г. Результаты различных видов каротидной эндартерэктомии у пациентов с сахарным диабетом 2 типа. Сахарный диабет. 2021;24(6):536-547. https://doi.org/10.14341/DM12722
For citation:
Kazantsev А.N., Vinogradov R.A., Chernyavsky M.A., Kravchuk V.N., Shmatov D.V., Sorokin A.A., Erofeev A.A., Lutsenko V.A., Sultanov R.V., Shabaev A.R., Radjabov I.M., Bagdavadze G.Sh., Zarkua N.E., Matusevich V.V., Vaiman E.F., Solobuev A.I., Artyukhov S.V., Lider R.Yu., Porkhanov V.A., Khubulava G.G. Results of different kinds of carotid endarterectomy in patients with and without type 2 diabetes mellitus. Diabetes mellitus. 2021;24(6):536-547. (In Russ.) https://doi.org/10.14341/DM12722
Сахарный диабет 2 типа (СД2) всегда играл одну из ключевых ролей в прогрессировании каротидного атеросклероза [1][2]. Известно, что комбинация в виде нарушения углеводного обмена и стенозов экстракраниальных артерий диагностируется у каждого третьего пациента с мультифокальным атеросклерозом (МФА), повышая риск развития острого нарушения мозгового кровообращения/транзиторной ишемической атаки (ОНМК/ТИА) до 74% [3–5]. Золотым стандартом хирургического лечения больных с гемодинамически значимыми стенозами внутренних сонных артерий (ВСА) является каротидная эндартерэктомия (КЭЭ) [6][7]. Существует два наиболее распространенных варианта этой операции — классическая с пластикой зоны реконструкции заплатой и эверсионная [7][8]. При классической КЭЭ производится продольная артериотомия общей сонной артерии с переходом на внутреннюю сонную артерию (ВСА). Затем открытым способом из просвета артерий удаляется атеросклеротическая бляшка. После этого производится пластика зоны реконструкции заплатой (биологической, синтетической, аутовенозной) [7][8].
Эверсионная КЭЭ чаще всего выполняется по одной из методик, наиболее распространенные из которых в разные годы описали А.В. Покровский, А.Н. Казанцев, Р.А. Виноградов и др. [6][8]. Техника всегда начинается с отсечения ВСА от устья. Далее атеросклеротическая бляшка из просвета артерии удаляется путем ее выворачивания. После этого ВСА имплантируется на прежнее место [6][8].
Выбор техники операции по данным действующих рекомендаций осуществляется оперирующим хирургом [1–5]. При этом СД2 не рассматривается как противопоказание для того или иного вида КЭЭ [1–5].
По мнению ряда авторов, СД2 является одним из важных маркеров развития неблагоприятных кардиоваскулярных событий после КЭЭ [9][10]. В других работах доказан вклад данной патологии в формирование рестеноза ВСА [11][12]. Однако все эти исследования построены на небольших выборках больных и не учитывают вид операции как дополнительный фактор потенциально негативного влияния на течение послеоперационного периода. Само по себе наличие инородного материала — заплаты при классической КЭЭ — на фоне СД2, вероятно, может ассоциироваться с непредсказуемыми изменениями в зоне анастомоза с последующей активацией воспаления, гиперплазии неоинтимы, отторжением. Таким образом, является ли СД2 катализатором этих процессов при реализации различных видов КЭЭ, — остается неясным.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучение госпитальных и отдаленных результатов эверсионной и классической КЭЭ с пластикой зоны реконструкции заплатой у пациентов с СД2 и без него.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. В данном исследовании приняло участие 13 учреждений: ГБУЗ «Городская Александровская больница», г. Санкт-Петербург; ГБУЗ «НИИ Краевая клиническая больница №1 им. проф. С.В. Очаповского», г. Краснодар; Кафедра хирургии №1 ФПК и ППС Кубанского государственного медицинского университета, г. Краснодар; ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России, г. Санкт-Петербург; ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова», г. Санкт-Петербург; ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова», г. Санкт-Петербург; Клиника высоких медицинских технологий им. Н.И. Пирогова СПБГУ, г. Санкт-Петербург; ГБУЗ «Городская многопрофильная больница №2», г. Санкт-Петербург; ГАУЗ КО «Кемеровская областная клиническая больница» им. С.В. Беляева, г. Кемерово; ГБУЗ Кемеровской области «Кемеровский областной клинический кардиологический диспансер им. акад. Л.С. Барбараш», г. Кемерово; ФГБУ «Главный военный клинический госпиталь им. акад. Н.Н. Бурденко» Министерства обороны Российской Федерации, г. Москва; ФГБОУ ВО «Кемеровский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Кемерово; Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, г. Санкт-Петербург.
Время исследования. С января 2010 по декабрь 2020 гг.
Изучаемые популяции (одна или несколько)
В исследование включен 5731 пациент с гемодинамически значимыми стенозами ВСА. В зависимости от наличия/отсутствия СД2 и вида реализованной КЭЭ было сформировано 4 группы:
1-я группа — 12,2% (n=702) — пациенты с СД2 после эверсионной КЭЭ;
2-я группа — 55,0% (n=3153) — пациенты без СД2 после эверсионной КЭЭ;
3-я группа — 8,5% (n=484) — пациенты с СД2 после классической КЭЭ;
4-я группа — 24,3% (n=1392) — пациенты без СД2 после классической КЭЭ;
Критерии включения. Показания для КЭЭ согласно действующим рекомендациям.
Критерии исключения. Наличие СД2, установленного эндокринологом (в 1-й и 3-й группах); отсутствие патологии, лимитирующей наблюдение пациента в отдаленном периоде наблюдения (онкология и т.д.). Критерии исключения подразумевали показатели, не удовлетворяющие вышеизложенным пунктам включения.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборка формировалась путем сплошного включения наблюдений.
Дизайн исследования
Настоящее исследование является многоцентровым обсервационным динамическим ретроспективным четырехвыборочным сравнительным контролируемым нерандомизированным. Минимальный срок между началом и окончанием наблюдения участников исследования составил 5 мес. Максимальный срок между началом и окончанием наблюдения участников исследования составил 120 мес.
Методы
Выбор стратегии реваскуляризации осуществлялся мультидисциплинарным консилиумом, включающим сердечно-сосудистого хирурга, эндоваскулярного хирурга, нейрохирурга, кардиолога, невролога, анестезиолога, реаниматолога, эндокринолога. При выполнении классической КЭЭ использовалась заплата из диэпоксиобработанного ксеноперикарда.
Для определения глюкозы натощак исследовалась плазма венозной крови. Тяжесть коронарного атеросклероза рассчитывалась при помощи интерактивного калькулятора SYNTAX Score (www.syntaxscore.com). По тяжести поражения на основании данного калькулятора выделяется следующая градация: низкий уровень поражения (≤22 баллов), промежуточный (23–32 балла) и тяжелый (≥33 баллов). Визуализация стенозов ВСА производилась при помощи цветного дуплексного сканирования с последующей ангиографией (АГ) или мультиспиральной компьютерной томографией с АГ (МСКТ АГ). Выраженность поражения оценивалась по классификации NASCET (https://www.openneuro.ru/doctors/cerebrovascular/carotid-stenoses).
Компенсаторные возможности церебрального кровотока во время КЭЭ оценивались следующим образом. При уровне систолического артериального давления (САД) ≤160 мм рт.ст. выполнялось фармакологическое повышение артериального давления (АД) до 190/100 мм рт.ст. Затем внутривенно вводилось 5 тысяч ЕД гепарина, осуществлялось пережатие артерий. Производилось инвазивное измерение ретроградного давления во ВСА. При уровне АД менее 60% от системного применялся временный шунт (ВШ).
Под контрольными точками понималось развитие таких неблагоприятных кардиоваскулярных событий, как летальный исход, инфаркт миокарда (ИМ), ОНМК/ТИА, тромбоз в зоне реконструкции, кровотечение типа 3b и выше по шкале Bleeding Academic Research Consortium (BARC), комбинированная конечная точка (смерть + ОНМК/ТИА + ИМ). Визуализация зоны реконструкции выполнялась посредством цветного дуплексного сканирования после операции. Длительность отдаленного периода составила 78,6±39,2 мес. Информация о состоянии больных была получена путем телефонного анкетирования, вызова в клинику для прохождения скринингового обследования.
Статистический анализ
Определение типа распределения осуществлялось с помощью критерия Колмогорова–Смирнова. Сравнение групп проводили с применением критерия Краскела–Уоллиса и хи-квадрата Пирсона (χ2) . При сравнении качественных показателей групп по парам применялся критерий χ2 с поправкой Йейтса. Графики выживаемости строились на основе анализа Каплана–Мейера. Сравнение графиков производилось при помощи Logrank test. Различия оценивались как значимые при р<0,05. При наличии значимых различий между всеми группами (робщ) указывались конкретные группы, между которыми также выявлялось р<0,05. С целью выявления факторов риска развития осложнений была проведена бинарная логистическая регрессия с пошаговым включением и исключением предикторов (stepwise logistic regression). Результаты исследований обработаны при помощи пакета прикладных программ Graph Pad Prism (www.graphpad.com) и MedCalc 19.2.1 (www.medcalc.org).
Этическая экспертиза
Исследование выполнялось в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Все пациенты подписали согласие на реализованную стратегию лечения. Исследование не противоречит законам Российской Федерации.
РЕЗУЛЬТАТЫ
По клинико-анамнестическим показателям группы оказались не полностью сопоставимы. Ожидаемо больные СД2 были моложе, среди них чаще всего диагностировались хроническая почечная недостаточность, МФА, ожирение. Ввиду выраженной коморбидности показатель EuroSCORE II составил наибольшие значения именно в этой когорте пациентов (табл. 1).
По показателям эхокардиографии и коронарографии (с учетом, в том числе, резидуального SYNTAX score) группы были сопоставимы. По данным ангиографии каротидных артерий среди пациентов с СД2 чаще визуализировались двусторонние стенозы ВСА, нестабильная атеросклеротическая бляшка (табл. 2).
В госпитальном послеоперационном периоде пациенты были несопоставимы по показателю ОНМК/ТИА. Наибольшее количество ишемических инсультов было зафиксировано в группах эверсионной и классической КЭЭ среди больных с СД2. Такая тенденция привела к максимальным значениям комбинированной конечной точки в этих когортах (табл. 3).
На отдаленном этапе наблюдения пациенты с СД2 после классической техники операции продемонстрировали наибольшие показатели всех вариантов осложнений: смерть (р<0,0001), ИМ (р=0,011), ишемический инсульт (р<0,0001), рестеноз/окклюзия ВСА (р<0,0001), комбинированная конечная точка (р<0,0001).
При этом вторую позицию по распространенности неблагоприятных событий заняла группа эверсионной КЭЭ с нарушением углеводного обмена (табл. 4). Однако следует отметить, что по частоте развития всех осложнений между классической КЭЭ без СД2 и эверсионной КЭЭ с СД2 статистических различий получено не было. Такие обстоятельства демонстрируют, что имплантация заплаты, независимо от сопутствующих факторов, сопровождается повышенным риском развития не только ИМ, но и рестеноза, а также связанного с ним ишемического инсульта.
Таблица 1. Клинико-анамнестические показатели и показатели углеводного обмена
Показатель | Эверсионная КЭЭ и СД2 | Эверсионная КЭЭ без СД2 | Классическая КЭЭ и СД2 | Классическая КЭЭ без СД2 | p | ||||
n=702 | % | n=3153 | % | n=484 | % | n=1392 | % | ||
Возраст, n (%) | 60,6±3,3 | 65,3±2,5 | 61,4±3,2 | 66,0±2,7 | робщ*: 0,074 | ||||
Мужской пол, n (%) | 518 | 73,8 | 2380 | 75,5 | 356 | 73,5 | 1041 | 74,8 | робщ: 0,681 |
ПИКС, n (%) | 113 | 16,1 | 532 | 16,9 | 79 | 16,3 | 233 | 16,7 | робщ: 0,955 |
ЧКВ в анамнезе, n (%) | 138 | 19,6 | 612 | 19,4 | 98 | 20,2 | 279 | 20,0 | робщ: 0,923 |
КШ в анамнезе, n (%) | 12 | 1,7 | 48 | 1,5 | 9 | 1,8 | 25 | 1,8 | робщ: 0,884 |
ХПН, n (%) | 52 | 7,4 | 83 | 2,6 | 34 | 7,0 | 31 | 2,2 | робщ: <0,0001 р1–2: <0,0001 (ОШ 2,95; 95% ДИ 2,07–4,22) р1–4: <0,0001 (ОШ 3,51; 95% ДИ 2,22–5,53) р2–3: <0,0001 (ОШ 0,35; 95% ДИ 0,23–0,53) р3–4: <0,0001 (ОШ 3,31; 95% ДИ 2,01–5,46) |
МФА (субклинический), n (%) | 276 | 39,3 | 945 | 29,9 | 187 | 38,6 | 395 | 28,4 | робщ: <0,0001 р1–2: <0,0001 (ОШ 1,51; 95% ДИ 1,27–1,79) р1–4: <0,0001 (ОШ 1,63; 95% ДИ 1,35–1,98) р2–3: 0,0002 (ОШ 0,67; 95% ДИ 0,55–0,82) р3–4: <0,0001 (ОШ 1,58; 95% ДИ 1,27–1,97) |
ХОБЛ, n (%) | 5 | 0,7 | 27 | 0,8 | 4 | 0,8 | 9 | 0,6 | робщ: 0,891 |
ОНМК/ТИА в анамнезе, n (%) | 463 | 65,9 | 2141 | 67,9 | 332 | 68,6 | 945 | 67,9 | робщ: 0,742 |
Ожирение, n (%) | 473 | 67,4 | 1823 | 57,8 | 318 | 65,7 | 765 | 54,9 | робщ: <0,0001 р1–2: <0,0001 (ОШ 1,5; 95% ДИ 1,26–1,79) р1–4: <0,0001 (ОШ 1,69; 95% ДИ 1,4–2,04) р2–3: 0,001 (ОШ 0,71; 95% ДИ 0,58–0,87) р3–4: <0,0001 (ОШ 1,57; 95% ДИ 1,26–1,94) |
ИМТ, М±m, кг/м2 | 30,5±5,1 | 27,4±2,5 | 31,2±1,8 | 27,7±2,8 | робщ: 0,001 р1–2: 0,001 р1–4: 0,053 р2–3: 0,022 р3–4: 0,002 | ||||
Показатели углеводного обмена до операции | |||||||||
Глюкоза натощак, М±m, ммоль/л | 8,43±1,62 | 4,1±1,31 | 8,22±1,74 | 4,0±1,23 | робщ: 0,001 р1–2: 0,003 р1–4: 0,001 р2–3: 0,001 р3–4: 0,002 | ||||
Примечание: ЧКВ — чрескожное коронарное вмешательство; ХОБЛ — хроническая обструктивная болезнь легких; ОНМК — острое нарушение мозгового кровообращения; ТИА — транзиторная ишемическая атака; ПИКС – постинфарктный кардиосклероз; КШ – коронарное шунтирование.
Таблица 2. Результаты инструментальных методов визуализации, периоперационные показатели
Показатель | Эверсионная КЭЭ и СД 2 типа | Эверсионная КЭЭ без СД2 | Классическая КЭЭ и СД2 | Классическая КЭЭ без СД2 | р | ||||
n=702 | % | n=3153 | % | n=484 | % | n=1392 | % | ||
Эхокардиография | |||||||||
ФВ ЛЖ, М±m, % | 58,6±4,8 | 59,5±4,7 | 58,8±5,3 | 58,3±5,0 | робщ*: >0,9999 | ||||
Аневризма ЛЖ, n (%) | 2 | 0,28 | 4 | 0,12 | 1 | 0,2 | 2 | 0,14 | робщ: 0,793 |
ДЛА ср., М±m, мм рт.ст. | 19,1±4,0 | 19,6±5,1 | 20,1±5,3 | 20,0±4,0 | робщ: >0,9999 | ||||
Коронарография | |||||||||
SYNTAX score (в том числе резидуальный), М±m | 11,9±3,2 | 10,6±2,8 | 14,3±3,4 | 13,7±3,1 | робщ: >0,9999 | ||||
Ангиография БЦА | |||||||||
Двустороннее поражение ВСА (более 60%), n (%) | 254 | 36,2 | 735 | 23,3 | 189 | 39,0 | 315 | 22,6 | робщ: <0,0001 р1–2: <0,0001 (ОШ 1,86; 95% ДИ 1,56–2,22) р1–4: <0,0001 (ОШ 1,93; 95% ДИ 1,58–2,36) р2–3: <0,0001 (ОШ 0,47; 95% ДИ 0,38–0,57) р3–4: <0,0001 (ОШ 2,19; 95% ДИ 1,75–2,73) |
Нестабильная АСБ, n (%) | 126 | 17,9 | 436 | 13,8 | 115 | 23,7 | 218 | 15,6 | робщ: <0,0001 р1–2: 0,006 (ОШ 1,36; 95% ДИ 1,09–1,69) р1–3: 0,011 (ОШ 0,70; 95% ДИ 0,52–0,93) р2–3: <0,0001 (ОШ 0,51; 95% ДИ 0,4–0,64) р3–4: <0,0001 (ОШ 1,67; 95% ДИ 1,3–2,16) |
ВСА слева, М±m, % | 74,9±8,1 | 78,4±8,2 | 76,9±7,2 | 77,3±8,3 | робщ: >0,9999 | ||||
ВСА справа, М±m, % | 77,5±8,1 | 76,4±7,9 | 79,1±6,9 | 78,6±6,6 | робщ: >0,9999 | ||||
Периоперационные показатели | |||||||||
Время пережатия ВСА, М±m, минут | 27,1±8,1 | 26,0±8,1 | 28,1±7,3 | 27,9±7,4 | робщ: >0,9999 | ||||
Применение временного шунта, n (%) | 0 | 0 | 0 | 0 | 34 | 7,02 | 167 | 11,9 | робщ: <0,0001 р1–3: <0,0001 (ОШ 0,009; 95% ДИ 0,0005–0,15) р1–4: <0,0001 (ОШ 0,005; 95% ДИ 0,0003–0,08) р2–3: <0,0001 (ОШ 0,002; 95% ДИ 0,0001–0,03) р2–4: <0,0001 (ОШ 0,001; 95% ДИ 7,215–005–9,019) р3–4: 0,003 (ОШ 0,55; 95% ДИ 0,37–0,81) |
Примечание: ВСА — внутренняя сонная артерия; КЭЭ — каротидная эндартерэктомия; ФВ — фракция выброса; ЛЖ — левый желудочек; ДЛА — давление в легочной артерии; ВСА — внутренняя сонная артерия; АСБ — атеросклеротическая бляшка.
Таблица 3. Осложнения в госпитальном периоде наблюдения
Показатель | Эверсионная КЭЭ и СД2 | Эверсионная КЭЭ без СД2 | Классическая КЭЭ и СД2 | Классическая КЭЭ без СД2 | р | ||||
n=702 | % | n=3153 | % | n=484 | % | n=1392 | % | ||
Смерть, n (%) | 1 | 0,14 | 3 | 0,09 | 1 | 0,2 | 2 | 0,14 | робщ*: 0,923 |
ИМ, n (%) | 2 | 0,28 | 2 | 0,06 | 0 | 0 | 2 | 0,14 | робщ: 0,33 |
ОНМК/ТИА, n (%) | 4 | 0,56 | 2 | 0,06 | 5 | 1,03 | 1 | 0,07 | робщ: <0,0001 р1–2: 0,011 (ОШ 9,02; 95% ДИ 1,65–49,41) р2–3: <0,0001 (ОШ 0,06; 95% ДИ 0,01–0,31) р3–4: 0,005 (ОШ 14,52; 95% ДИ 1,69–124,7) |
Кровотечение типа 3b и выше по шкале BARC, n (%) | 1 | 0,14 | 2 | 0,06 | 1 | 0,2 | 1 | 0,07 | робщ: 0,73 |
Комбинированная конечная точка (летальный исход + ИМ + ОНМК/ТИА), n (%) | 7 | 0,99 | 7 | 0,22 | 6 | 1,23 | 5 | 0,35 | робщ: 0,0012 р1–2: 0,006 (ОШ 4,52; 95% ДИ 1,58–12,95) р2–3: 0,002 (ОШ 0,17; 95% ДИ 0,05–0,52) |
Примечание: ОНМК — острое нарушение мозгового кровообращения; ТИА — транзиторная ишемическая атака; ИМ — инфаркт миокарда.
Таблица 4. Осложнения в отдаленном периоде наблюдения
Показатель | Эверсионная КЭЭ и СД2 | Эверсионная КЭЭ без СД2 | Классическая КЭЭ и СД2 | Классическая КЭЭ без СД2 | р | ||||
n=702 | % | n=3153 | % | n=484 | % | n=1392 | % | ||
Смерть, n (%) | 7 | 0,99 | 9 | 0,28 | 13 | 2,68 | 8 | 0,57 | робщ*: <0,0001 р1–2: 0,011 (ОШ 3,51; 95% ДИ 1,30–9,35) р1–3: 0,042 (ОШ 0,36; 95% ДИ 0,14–0,92) р2–3: <0,0001 (ОШ 0,1; 95% ДИ 0,04–0,24) р3–4: 0,0004 (ОШ 4,77; 95% ДИ 1,96–11,59) |
ИМ, n (%) | 6 | 0,85 | 7 | 0,22 | 5 | 1,03 | 5 | 0,35 | робщ: 0,011 р1–2: 0,021 (ОШ 3,87; 95% ДИ 1,29–11,57) р2–3: 0,012 (ОШ 0,21; 95% ДИ 0,06–0,67) |
ОНМК/ТИА, n (%) | 11 | 1,56 | 7 | 0,22 | 21 | 4,33 | 12 | 0,86 | робщ: <0,0001 р1–2: <0,0001 (ОШ 7,15; 95% ДИ 2,76–18,53) р1–3: 0,006 (ОШ 0,35; 95% ДИ 0,16–0,73) р2–3: <0,0001 (ОШ 0,04; 95% ДИ 0,02–0,11) р2–4: 0,004 (ОШ 0,25; 95% ДИ 0,10–0,65) р3–4: <0,0001 (ОШ 5,21; 95% ДИ 2,54–10,69) |
Рестеноз/окклюзия ВСА, n (%) | 7 | 0,99 | 10 | 0,31 | 29 | 5,99 | 16 | 1,14 | робщ: <0,0001 р1–2: 0,031 (ОШ 3,16; 95% ДИ 1,2–8,34) р1–3: <0,0001 (ОШ 0,15; 95% ДИ 0,06–0,36) р2–3: <0,0001 (ОШ 0,04; 95% ДИ 0,02–0,1) р2–4: 0,001 (ОШ 0,27; 95% ДИ 0,12–0,60) р3–4: <0,0001 (ОШ 5,48; 95% ДИ 2,95–10,19) |
Комбинированная конечная точка (летальный исход + ИМ + ОНМК/ТИА), n (%) | 24 | 3,41 | 23 | 0,72 | 39 | 8,05 | 25 | 1,79 | робщ: <0,0001 р1–2: <0,0001 (ОШ 4,81; 95% ДИ 2,7–8,58) р1–3: 0,0008 (ОШ 0,4; 95% ДИ 0,23–0,68) р1–4: 0,031 (ОШ 1,93; 95% ДИ 1,09–3,41) р2–3: <0,0001 (ОШ 0,08; 95% ДИ 0,04–0,14) р2–4: 0,002 (ОШ 0,4; 95% ДИ 0,22–0,71) р3–4: <0,0001 (ОШ 4,79; 95% ДИ 2,86–8,0) |
Примечание: ОНМК — острое нарушение мозгового кровообращения; ТИА — транзиторная ишемическая атака; ИМ — инфаркт миокарда.
При анализе графиков выживаемости выявлена та же тенденция: группа классической КЭЭ с пластикой зоны реконструкции заплатой характеризуется наибольшими значениями всех видов осложнений (рис. 1–4). При этом только по показателю ИМ она сопоставима с результатами эверсионной техники. Такая особенность позволяет подтвердить заключение о том, что имплантация заплаты сопряжена с более высокой вероятностью развития ассоциированных с ней состояний — рестеноза, ишемического инсульта, летального исхода. Дополнительно необходимо отметить, что в группах классической КЭЭ подавляющее количество ОНМК/ТИА было зафиксировано в первый год наблюдения, что связано с развитием ранних рестенозов зоны ВСА в зоне реконструкции.

Рисунок 1. Выживаемость, свободная от летального исхода (р<0,0001).

Рисунок 2. Выживаемость, свободная от инфаркта миокарда (р=0,009).

Рисунок 3. Выживаемость, свободная от острого нарушения мозгового кровообращения/транзиторной ишемической атаки (р<0,0001).
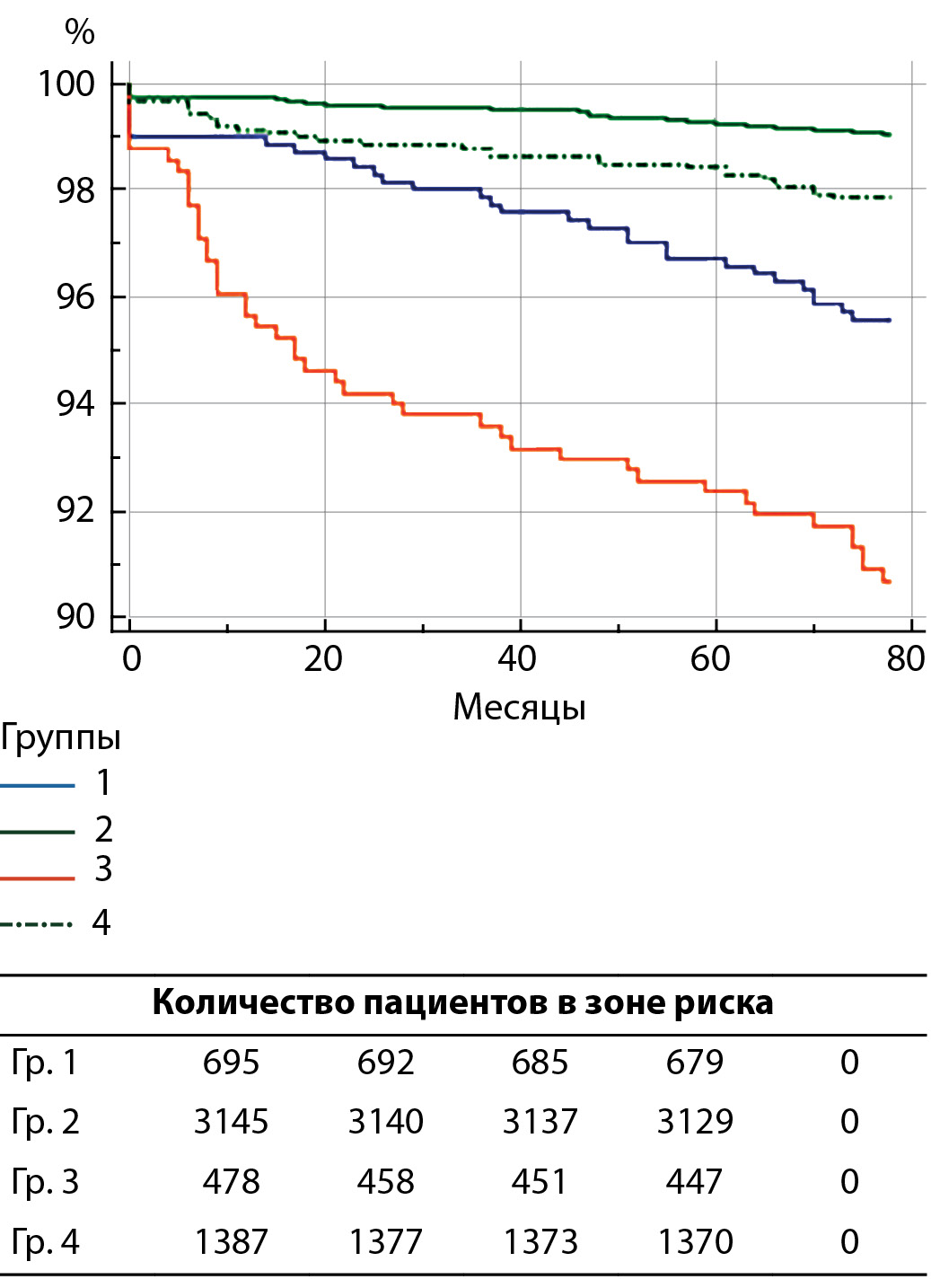
Рисунок 4. Выживаемость, свободная от комбинированной конечной точки (р<0,0001).
По результатам бинарной логистической регрессии с пошаговым включением и исключением предикторов были выявлены следующие факторы риска: СД2, требующий терапии инсулином; билатеральные стенозы ВСА; реализация классической КЭЭ с пластикой зоны реконструкции заплатой (табл. 5).
Таблица 5. Предикторы развития отдаленных осложнений в общей выборке больных
ОШ и 95% ДИ | ||
Переменная | ОШ | 95% ДИ |
СД2, требующий терапии инсулином | 3,41 | 1,72–6,63 |
Билатеральные стенозы ВСА | 3,61 | 1,82–7,58 |
Реализация классической КЭЭ с пластикой зоны реконструкции заплатой | 2,23 | 1,02–5,88 |
Анализ ROC-кривой | ||
Площадь под ROC-кривой | 0,659 | |
Стандартная ошибка | 0,0328 | |
95% ДИ | 2,623–3,811 | |
ОБСУЖДЕНИЕ
Сопоставление с другими публикациями
Первая статья в отечественной литературе, посвященная результатам КЭЭ при наличии СД, по данным электронной библиотеки elibrary.ru, была опубликована в 2008 г. А.И. Мешкаускене и соавт. [13]. На базе Вильнюсского университета (Литва) авторы проанализировали результаты операций 100 пациентов с СД и 607 — без него за период 1995–2005 гг. Было отмечено, что для больных с нарушением углеводного обмена более характерны молодой возраст (р<0,05), ожирение (р<0,001), билатеральные стенозы ВСА (р<0,01), курение (р<0,001) [13]. Среди них же чаще диагностировалось развитие ишемического инсульта и летального исхода в послеоперационном периоде (12% против 3,4%; р<0,001) [13]. Взаимосвязь между ростом числа ОНМК/ТИА и уровнем гликемии более 8 ммоль/л была также отмечена и в исследовании М.М. Танашян и соавт. [14]. Результаты нашей работы также продемонстрировали, что на госпитальном этапе наблюдения, независимо от вида КЭЭ, у пациентов с СД2 возрастает частота развития ишемических инсультов. Однако объяснить причину такой отрицательной динамики одной лишь тяжестью коморбидного фона невозможно. Изучая патофизиологические механизмы большей склонности больных СД к формированию церебральной ишемии при пережатии ВСА, О.В. Каменская и соавт. пришли к интересным выводам [15]. На основе анализа газового и электролитного состава крови авторы установили, что у этих пациентов отмечается возрастание экстракции кислорода из крови. Такая особенность свидетельствует о повышенных затратах резервов газотранспортной системы крови для адекватного обеспечения головного мозга [15]. В свою очередь, в условиях наличия двусторонних стенозов ВСА и удовлетворительных показателей ретроградного давления/церебральной оксиметрии на фоне пережатия артерий и отсутствия показаний для установки ВШ может развиться гипоксия с последующими необратимыми последствиями [15]. В итоге эти больные подвергаются КЭЭ с большим риском развития церебральных осложнений. Таким образом, учитывая полученные данные, показания для установки ВШ в условиях нарушения углеводного обмена и билатеральных стенозов ВСА нужно рассматривать более прецизионно.
Говоря об отдаленных результатах КЭЭ в зависимости от наличия/отсутствия СД2, единственная отечественная работа, посвященная этому вопросу, была проведена под руководством Ю.И. Казакова и соавт. Авторы сообщили, что в группе больных с СД2 кумулятивная выживаемость через 5 лет составила 54,2±7,2% относительно контрольной группы — 86,1±4,3%; показатель свободы от рестеноза — 74,5±8,0% против 92,3±7,3% [16]. Было продемонстрировано, что предикторами летальных исходов являются возраст >65 лет, длительность СД >5 лет, уровень гликированного гемоглобина более 7,5% [16].
В недавнем корейском исследовании авторы доказали, что высокий уровень гликемии, требующий терапии инсулином, сопряжен с ростом летальности в отдаленном послеоперационном периоде [17]. Эта закономерность объясняется в первую очередь тяжестью коморбидного фона, который сопровождает СД2, проявляющегося в формировании ангиопатии, поражении почек, сердца, печени и т.д. [17]. Таким образом, в своем исследовании авторы получили статистически значимые межгрупповые различия по показателям ОНМК (р=0,006) и комбинированной конечной точки (р=0,04), подтвердив, что СД2 является независимым фактором риска развития осложнений отдаленного периода [17].
A.B. Pothof и соавт. пришли к аналогичным выводам. Однако дизайн исследования несколько отличался. Пациенты были разделены на три группы: 1-я — без СД2; 2-я — с СД2, требующим инсулинотерапии; 3-я — с СД2, требующим приема оральных гипогликемических препаратов [18]. Авторы продемонстрировали, что в 30-дневном послеоперационном периоде в 1-й группе отмечается статистически меньшая частота развития показателя ОНМК+смерть относительно 2-й группы (1,5% против 3,4%; р<0,001) [18]. При этом значимых различий между 1-й и 3-й группами выявлено не было ввиду того, что пациенты с более мягким течением СД имеют более благоприятный коморбидный фон, что обеспечивает им сопоставимую стабильность послеоперационных результатов (1,5% против 2,1%; р=0,1) [18].
M.A. Hussain и соавт. провели крупный метаанализ 1241 исследования за период с 1946–2015 гг., посвященного госпитальным и отдаленным исходам КЭЭ в зависимости от наличия СД2 [19]. По результатам работы авторы пришли к выводам, что реваскуляризация у больных СД2 сопряжена с более высоким риском следующих исходов: периоперационный инсульт, госпитальная смерть, смерть в отдаленном периоде наблюдения [19]. Итоги нашего исследования согласуются с данными мировой литературы. В отдаленном периоде наблюдения у пациентов с СД2 статистически значимо возрастает число всех неблагоприятных кардиоваскулярных событий. Предикторами этих событий стали СД2, требующий терапии инсулином, билатеральные стенозы ВСА, реализация классической КЭЭ с пластикой зоны реконструкции заплатой. Тяжелое течение СД2 всегда сопровождается выраженным коморбидным фоном, дающим негативный прогноз продолжительности и качества жизни пациента. И бесспорно, что больной, нуждающийся в инсулинотерапии, чаще всего имеет большую длительность СД, сопряженную с сопутствующими этой патологии состояниями, относительно пациентов, принимающих оральную гипогликемическую терапию [14][16–18]. Поэтому наличие данного фактора будет свидетельствовать о повышенном риске развития сердечно-сосудистых осложнений после реализованной реваскуляризации.
Другим важным идентификатором негативного прогноза стало формирование двусторонних стенозов ВСА. Такое состояние может отражать более агрессивное течение МФА с возможным включением в процесс коронарного и периферического русла [20]. Диффузное многососудистое поражение в литературе неоднократно рассматривалось как угрожающее состояние, даже несмотря на реализованную реваскуляризацию всех заинтересованных бассейнов [20]. А совокупное течение СД2 только усугубляет процесс развития рестенозов и прогрессирования атеросклероза с последующей окклюзией и/или тромбозом зоны реконструкции [12][20].
Возвращаясь к генезу каротидного рестеноза, следует отметить, что этот процесс является мультитаргетным. В литературе неоднократно упоминалось, что мощный вклад в развитие потери просвета сосуда вносят как наследственность, так и особенности образа жизни, наличие метаболического синдрома [2][3][13]. Поэтому сопутствующее течение СД2 приводит к более раннему формированию рестеноза [12]. С другой стороны, применение заплаты во время КЭЭ расширяет каротидную луковицу, провоцируя нарушение физических показателей гемоциркуляции в этой зоне [12]. Образование участков пристеночного застоя и турбулентного кровотока катализирует процесс гиперплазии неоинтимы, вызывая потерю просвета сосуда уже через полгода после реваскуляризации. На этом фоне СД2 только ускоряет негативный тренд, ведущий к необратимым изменениям с последующими нежелательными явлениями, что подтвердили данные нашей работы [12]. В группе больных СД2, которым реализовывалась классическая техника операции с пластикой зоны реконструкции заплатой, было идентифицировано наибольшее количество всех неблагоприятных кардиоваскулярных событий в отдаленном периоде наблюдения. Таким образом, данная техника операции является наименее предпочтительной в этой когорте пациентов.
Выводы
Необходимо отметить, что наша работа является первым крупным отечественным многоцентровым ретроспективным исследованием, посвященным результатам КЭЭ в зависимости от наличия/отсутствия СД2. Дефицит российских статей на эту тему демонстрирует низкий интерес сосудистых хирургов к влиянию нарушения углеводного обмена на непосредственные и отдаленные исходы реваскуляризации головного мозга. Таким образом, полученные нами результаты привлекут дополнительное внимание медицинского сообщества к проблеме долгосрочной курации и прецизионному ведению пациентов с СД2 и КЭЭ в анамнезе.
Ограничения исследования
Ретроспективный характер исследования. Отсутствие рандомизации.
ЗАКЛЮЧЕНИЕ
Пациенты с СД2 и КЭЭ в анамнезе подвержены повышенному риску развития ишемического инсульта на госпитальном этапе наблюдения и неблагоприятных кардиоваскулярных состояний в отдаленном послеоперационном периоде. Классическая техника операции с пластикой зоны реконструкции биологической заплатой является наименее предпочтительной для больных с СД2 ввиду высокого риска рестеноза уже через 6 мес после реваскуляризации.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Казанцев А.Н. — концепция и дизайн, написание статьи; Виноградов Р.А. — анализ полученных данных; Чернявский М.А. — анализ полученных данных; Кравчук В.Н. — анализ полученных данных; Шматов Д.В. — анализ полученных данных; Сорокин А.А. — сбор и обработка материалов; Ерофеев А.А. — сбор и обработка материалов; Луценко В.А. — сбор и обработка материалов; Султанов Р.В. — сбор и обработка материалов; Шабаев А.Р. — обзор литературы; Раджабов И.М. — сбор и обработка материалов; Багдавадзе Г.Ш. — сбор и обработка материалов; Заркуа Н.Э. — сбор и обработка материалов; Матусевич В.В. — сбор и обработка материалов; Вайман Е.Ф. — сбор и обработка материалов; Солобуев А.И. — сбор и обработка материалов; Артюхов С.В. — сбор и обработка материалов; Лидер Р.Ю. — сбор и обработка материалов; Порханов В.А. — концепция и дизайн; Хубулава Г.Г. — концепция и дизайн.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Казанцев А.Н., Тарасов Р.С., Бурков Н.Н., и др. Прогрессирование прецеребрального атеросклероза и предикторы ишемических осложнений у пациентов кардиохирургического профиля // Хирургия. Журнал им. Н.И. Пирогова. — 2020. — №7. — С. 31-38. doi: https://doi.org/10.17116/hirurgia202007131
2. Грачева С.А., Клефортова И.И., Шамхалова М.Ш. Распространенность сочетанного атеросклеротического поражения сосудов у больных сахарным диабетом // Сахарный диабет. — 2012. — Т. 15. — №1. — С. 49-55. doi: https://doi.org/10.14341/2072-0351-5979
3. Танашян М.М., Антонова К.В., Медведев Р.Б., и др. Симптомная и асимптомная ишемия головного мозга (по данным МРТ) у больных сахарным диабетом 2 типа после каротидной реваскуляризации // Сахарный диабет. — 2019. — Т. 22. — №1. — С. 14-24. doi: https://doi.org/10.14341/DM9633
4. Казанцев А.Н., Тарасов Р.С., Бурков Н.Н., и др. Госпитальные результаты чрескожного коронарного вмешательства и каротидной эндартерэктомии в гибридном и поэтапном режимах // Ангиология и сосудистая хирургия. — 2019. — Т. 25. — №1. — С. 101-107. doi: https://doi.org/10.33529/angio2019114
5. Виноградов Р.А., Пыхтеев В.С., Мартиросова К.И., Лашевич К.А. Прогнозирование периоперационных осложнений при каротидной эндартерэктомии // Хирургия. Журнал им. Н.И. Пирогова. — 2018. — №1. — С. 82-85. doi: https://doi.org/10.17116/hirurgia2018182-85
6. Казанцев А.Н., Черных К.П., Лидер Р.Ю., и др. Гломус-сберегающая каротидная эндартерэктомия по А.Н. Казанцеву. Госпитальные и среднеотдаленные результаты // Патология кровообращения и кардиохирургия. — 2020. — Т. 24. — №3. — С. 70-79. doi: https://doi.org/10.21688/1681-3472-2020-3-70-79
7. Гавриленко А.В., Куклин А.В., Аль-Юсеф Н.Н., и др. Метаанализ результатов эверсионной каротидной эндартерэктомии и эндартерэктомии с пластикой заплатой // Ангиология и сосудистая хирургия. — 2020. — Т. 26. — №1. — С. 176-183. doi: https://doi.org/10.33529/ANGIO2020121
8. Казанцев А.Н., Черных К.П., Заркуа Н.Э., и др. Новый способ гломуссберегающей каротидной эндартерэктомии по А.Н. Казанцеву: отсечение внутренней сонной артерии на площадке из наружной и общей сонной артерии // Российский кардиологический журнал. — 2020. — Т. 25. — №8. — С. 10-17. doi: https://doi.org/10.15829/1560-4071-2020-3851
9. Шмырев В.И., Носенко Е.М., Романова М.С., и др. Клинические и ультразвуковые маркеры осложнений каротидной эндартерэктомии в послеоперационном периоде у больных с сосудистой мозговой недостаточностью // Хирургия. Журнал им. Н.И. Пирогова. — 2015. — №2. — С. 13-24. doi: https://doi.org/10.17116/hirurgia2015213-24
10. Зыбин А.В., Покровский А.В., Тимина И.Е., и др. Оценка отдаленных результатов каротидной эндартерэктомии у пациентов на фоне терапии статинами // Диагностическая и интервенционная радиология. — 2018. — Т. 12. — № 3. — С. 20-28. doi: https://doi.org/10.25512/DIR.2018.12.3.02
11. Казанцев А.Н., Бурков Н.Н., Борисов В.Г., и др. Компьютерное моделирование гемодинамических показателей в бифуркации сонных артерий после каротидной эндартерэктомии // Ангиология и сосудистая хирургия. — 2019. — Т. 25. — №3. — С. 107-112. doi: https://doi.org/10.33529/ANGIO2019311
12. Казанцев А.Н., Богомолова А.В., Бурков Н.Н., и др. Морфология рестеноза после классической каротидной эндартерэктомии с применением заплаты из диэпоксиобработанного ксеноперикарда // Кардиология и сердечно-сосудистая хирургия. — 2020. — Т. 13. — №1. — С. 68-71. doi: https://doi.org/10.17116/kardio202013011168
13. Мешкаускене А.И., Баркаускас Е.М., Гайгалайте В.Б. Взаимосвязь сахарного диабета с другими сердечно-сосудистыми факторами риска у больных стенозом внутренней сонной артерии // Терапевтический архив. — 2008. — Т. 80. — №1. — С. 49-52. [Meshkauskene AI, Barkauskas EM, Gaigalaite VB. The relationship of diabetes mellitus with other cardiovascular risk factors in patients with stenosis of the internal carotid artery. Therapeutic archive. 2008;80(1):49-52. (In Russ.)].
14. Танашян М.М., Скрылев С.И., Антонова К.В., Медведев Р.Б. Каротидная реваскуляризация у больных сахарным диабетом 2 типа. Значение хронической гипергликемии // Ангиология и сосудистая хирургия. — 2017. — Т. 23. — №4. — С. 99-106.
15. Каменская О.В., Левичева Е.Н., Логинова И.Ю., Карпенко А.А. Патофизиологические аспекты энергетического обмена головного мозга при сочетании системного атеросклероза и сахарного диабета 2-го типа // Кардиология и сердечнососудистая хирургия. — 2012. — Т. 5. — №1. — С. 60-63.
16. Казаков Ю.И., Касьяненко А.П., Соколова Н.Ю., и др. Отдаленные результаты каротидной эндартерэктомии у больных с сахарным диабетом II типа // Ангиология и сосудистая хирургия. — 2017. — Т. 23. — №2. — С. 98-106.
17. Jeong MJ, Kwon H, Jung CH, et al. Comparison of outcomes after carotid endarterectomy between type 2 diabetic and non-diabetic patients with significant carotid stenosis. Cardiovasc Diabetol. 2019;18(1):41. doi: https://doi.org/10.1186/s12933-019-0848-7
18. Pothof AB, O’Donnell TFX, Swerdlow NJ, et al. Risk of insulindependent diabetes mellitus in patients undergoing carotid endarterectomy. J Vasc Surg. 2019;69(3):814-823. doi: https://doi.org/10.1016/j.jvs.2018.05.250.
19. Назаренко М.С., Марков А.В., Королева Ю.А., и др. Идентификация дифференциально метилированных генов, потенциально связанных с атеросклерозом у человека // Российский кардиологический журнал. — 2017. — Т. 22. — №10. — С. 42-48. doi: https://doi.org/10.15829/1560-4071-2017-10-42-48
20. Тарасов Р.С., Казанцев А.Н., Иванов С.В., и др. Хирургическое лечение мультифокального атеросклероза: патология коронарного и брахиоцефального бассейнов и предикторы развития ранних неблагоприятных событий // Кардиоваскулярная терапия и профилактика. — 2017. — Т. 16. — №4. — С. 37-44. doi: https://doi.org/10.15829/1728-8800-2017-4-37-44
Об авторах
А. Н. КазанцевРоссия
Казанцев Антон Николаевич, сердечно-сосудистый хирург
SPIN: 8396-1845
193312, Санкт-Петербург, пр. Солидарности, д. 4
Конфликт интересов:
нет
Р. А. Виноградов
Россия
Виноградов Роман Александрович, д.м.н., доцент
SPIN: 7211-3229
Краснодар
Конфликт интересов:
нет
М. А. Чернявский
Россия
Чернявский Михаил Александрович, д.м.н., гл.н.с.
SPIN: 5009-7818
Санкт-Петербург
Конфликт интересов:
нет
В. Н. Кравчук
Россия
Кравчук Вячеслав Николаевич, д.м.н., профессор
SPIN: 4227-2846
Санкт-Петербург
Конфликт интересов:
нет
Д. В. Шматов
Россия
Шматов Дмитрий Викторович, д.м.н., профессор
SPIN: 4242-2812
Санкт-Петербург
Конфликт интересов:
нет
А. А. Сорокин
Россия
Сорокин Андрей Александрович, сердечно-сосудистый хирург [
SPIN: 3463-1021
Санкт-Петербург
Конфликт интересов:
нет
А. А. Ерофеев
Россия
Ерофеев Александр Алексеевмч, к.м.н., зам. главного врача по хирургии, полковник медицинской службы
SPIN: 4321-2821
Санкт-Петербург
Конфликт интересов:
нет
В. А. Луценко
Россия
Луценко Виктор Анатольевич, к.м.н., сердечно-сосудистый хирург
SPIN: 4251-2281
Кемерово
Конфликт интересов:
нет
Р. В. Султанов
Россия
Султанов Роман Владимирович, к.м.н.
SPIN: 1382-1295
Кемерово
Конфликт интересов:
нет
А. Р. Шабаев
Россия
Шабаев Амин Рашитович, сердечно-сосудистый хирург
SPIN: 6119-0504
Кемерово
Конфликт интересов:
нет
И. М. Раджабов
Россия
Раджабов Ислам Магомедович, зав. отделением сосудистой хирургии
SPIN: 2075-2131
Москва
Конфликт интересов:
нет
Г. Ш. Баздавадзе
Россия
Багдавадзе Годерзи Шотаевич, ординатор
SPIN: 2801-9655
Санкт-Петербург
Конфликт интересов:
нет
Н. Э. Заркуа
Россия
Заркуа Нонна Энриковна, д.м.н., доцент
SPIN: 1319-2534
Санкт-Петербург
Конфликт интересов:
нет
В. В. Матусевич
Россия
Матусевич Вячеслав Викторович, сердечно-сосудистый хирург [
SPIN: 1139-0513
Краснодар
Конфликт интересов:
нет
Е. Ф. Вайман
Россия
Вайман Евгений Федорович, к.м.н., доцент
SPIN: 3124-0413
Кемерово
Конфликт интересов:
нет
А. И. Солобуев
Россия
Солобуев Алексей Игоревич, ассистент кафедры
SPIN: 2859-1096
Кемерово
Конфликт интересов:
нет
С. В. Артюхов
Россия
Артюхов Сергей Викторович, к.м.н.
SPIN: 1894-6265
Санкт-Петербург
Конфликт интересов:
нет
Р. Ю. Лидер
Россия
Лидер Роман Юрьевич, студент
SPIN: 3723-4648
Кемерово
Конфликт интересов:
нет
В. А. Порханов
Россия
Порханов Владимир Алексеевич, д.м.н., профессор, академик РАН
SPIN: 2446-5933
Краснодар
Конфликт интересов:
нет
Г. Г. Хубулава
Россия
Хубулава Геннадий Григорьевич, д.м.н., профессор, академик РАН
SPIN: 1007-8730
Санкт-Петербург
Конфликт интересов:
нет
Дополнительные файлы
|
|
1. Рисунок 1. Выживаемость, свободная от летального исхода (р<0,0001). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(174KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Выживаемость, свободная от инфаркта миокарда (р=0,009). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(175KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Выживаемость, свободная от острого нарушения мозгового кровообращения/транзиторной ишемической атаки (р<0,0001). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(171KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Выживаемость, свободная от комбинированной конечной точки (р<0,0001). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(173KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Казанцев А.Н., Виноградов Р.А., Чернявский М.А., Кравчук В.Н., Шматов Д.В., Сорокин А.А., Ерофеев А.А., Луценко В.А., Султанов Р.В., Шабаев А.Р., Раджабов И.М., Баздавадзе Г.Ш., Заркуа Н.Э., Матусевич В.В., Вайман Е.Ф., Солобуев А.И., Артюхов С.В., Лидер Р.Ю., Порханов В.А., Хубулава Г.Г. Результаты различных видов каротидной эндартерэктомии у пациентов с сахарным диабетом 2 типа. Сахарный диабет. 2021;24(6):536-547. https://doi.org/10.14341/DM12722
For citation:
Kazantsev А.N., Vinogradov R.A., Chernyavsky M.A., Kravchuk V.N., Shmatov D.V., Sorokin A.A., Erofeev A.A., Lutsenko V.A., Sultanov R.V., Shabaev A.R., Radjabov I.M., Bagdavadze G.Sh., Zarkua N.E., Matusevich V.V., Vaiman E.F., Solobuev A.I., Artyukhov S.V., Lider R.Yu., Porkhanov V.A., Khubulava G.G. Results of different kinds of carotid endarterectomy in patients with and without type 2 diabetes mellitus. Diabetes mellitus. 2021;24(6):536-547. (In Russ.) https://doi.org/10.14341/DM12722

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































