Перейти к:
Оценка риска развития сахарного диабета 2-го типа у пациентов с подагрой на основе шкалы FINDRISС
https://doi.org/10.14341/DM12804
Аннотация
ОБОСНОВАНИЕ. Подагра ассоциируется с высокой частотой сахарного диабета 2 типа (СД2).
ЦЕЛЬ. Рассчитать риск СД2 по шкале FINDRISС, оценить чувствительность и специфичность шкалы у пациентов с подагрой по результатам проспективного наблюдения.
МАТЕРИАЛЫ И МЕТОДЫ. В проспективное одноцентровое исследование включены 444 пациента c подагрой старше 18 лет (49 женщин, 395 мужчин), не имеющих СД. Длительность наблюдения варьировала от 2 до 8 лет. Исходно рассчитывали риск развития СД2 по российской версии шкалы FINDRISС. Риск развития СД2 оценивался как низкий при суммарном счете (СС) <7 баллов, слегка повышенный — от 7 до 11, умеренный — от 12 до 14, высокий — от 15 до 20 и очень высокий — ≥20 баллов. Для оценки валидности использования шкалы FINDRISС были проведены анализ чувствительности, специфичности, построение ROC-кривой с определением площади под кривой. Определяли наличие и количество подкожных тофусов, количество приступов артрита за последний год, число пораженных суставов за время болезни, сывороточные уровни креатинина, мочевой кислоты, С-реактивного белка, гликированного гемоглобина.
РЕЗУЛЬТАТЫ. За 5,66 [2,69; 7,64] года наблюдения СД2 развился у 108 пациентов (24,3%). По шкале FINDRISС низкий риск выявлен у 16 (4%), слегка повышенный — у 187 (42%), умеренный — у 98 (22%), высокий — у 80 (18%), очень высокий — у 63 (14%) пациентов. Наиболее часто встречающимися факторами риска СД2, входящими в FINDRISС, были индекс массы тела >25 кг/м2 — 85,6%, прием гипотензивных препаратов — 81,3%, возраст старше 45 лет — 70,5% пациентов. Чувствительность и специфичность шкалы FINDRISС составили 52,8 и 66,3% соответственно. Согласно этим данным, качество модели было оценено как среднее. У пациентов, имевших умеренный/высокий/очень высокий риск (n=228), значимо чаще, чем у пациентов с низким или слегка повышенным риском (n=177), выявлялись подкожные тофусы (42,9% vs 31,1% (р=0,014)), сывороточный уровень мочевой кислоты ≤300 мкмоль/л. СД2 развился у 33,3% пациентов с умеренным/высоким/очень высоким риском и у 18,1% пациентов с низким или слегка повышенным риском (p=0,0002).
ЗАКЛЮЧЕНИЕ. Шкала FINDRISС может обладать достаточной чувствительностью (52,8%) и специфичностью (66,3%) и применяться для расчета риска СД2 у пациентов с подагрой.
Для цитирования:
Желябина О.В., Елисеев М.С., Чикина М.Н., Паневин Т.С. Оценка риска развития сахарного диабета 2-го типа у пациентов с подагрой на основе шкалы FINDRISС. Сахарный диабет. 2021;24(6):521-528. https://doi.org/10.14341/DM12804
For citation:
Zhelyabina O.V., Eliseev M.S., Chikina M.N., Panevin T.S. Assessment of the risk of developing type 2 diabetes mellitus in patients with gout based on the FINDRISС scale. Diabetes mellitus. 2021;24(6):521-528. (In Russ.) https://doi.org/10.14341/DM12804
Улучшение диагностики и внедрение в практику новых принципов терапии подагры, направленных на достижение и поддержание целевого уровня мочевой кислоты (МК), привели к возможности полного контроля над болезнью у большинства пациентов [1]. Однако высокая частота выявления у пациентов с подагрой сопутствующих заболеваний, приводящих вкупе с воздействием гиперурикемии (ГУ) к увеличению смертности и снижению качества жизни, требуют от врача знаний как о диагностике и лечении собственно подагры, так и сопутствующих патологий [2]. Так, подагра ассоциируется с высокой, по некоторым данным, в 2–3 раза превышающей популяционную, частотой сахарного диабета 2 типа (СД2) [3]. Предполагают, что в основе дисбаланса метаболизма глюкозы при подагре лежит нарушение секреции инсулина и чувствительности к нему периферических тканей под действием традиционных факторов риска (ФР) диабета [4]. Кроме того, рассматривается возможность негативного влияния на развитие диабета и его осложнений собственно подагры и свойственной ей ГУ [5]. Примечательно, однако, что результаты исследований, посвященных изучению роли ГУ в генезе СД2 продемонстрировали дифференцированную связь между исходным уровнем МК сыворотки и развитием СД2 [6]. С одной стороны, метаанализ показал, что риск СД2 повышается на 6–17% на каждый прирост на 1 мг/дл сывороточного уровня МК [7]. С другой — МК тесно связана с другими факторами риска СД2, особенно с ожирением, что затрудняет установление того, действительно ли наблюдаемые ассоциации независимы; кроме того, недавние рандомизированные исследования продемонстрировали, что генетические локусы, связанные с ГУ, не влияют на прогнозирование риска диабета [8]. В любом случае СД2 при подагре является важным предиктором сердечно-сосудистых и инфекционных осложнений, а также поражения почек [9], что делает актуальным своевременное выявление пациентов с высоким риском его развития и проведение у них первичной профилактики нарушений углеводного обмена. Международная федерация диабета и Российская ассоциация эндокринологов рекомендуют применять для оценки риска развития СД2 шкалу FINDRISС (Diabetes Risk Assessment Form), валидированную во многих странах, включая Россию [10–11]. На сегодняшний день шкала FINDRISС является надежным инструментом, позволяющим выявить группу риска развития СД2 на популяционном уровне [12]. Однако, несмотря на простоту метода, для стратификации риска СД2 у пациентов с подагрой она ранее не использовалась.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить распространенность факторов риска развития СД2 у пациентов с подагрой, рассчитать у них 10-летний риск развития СД2 типа с помощью шкалы FINDRISС, а также оценить ее чувствительность и специфичность.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн проведения
Проведено одноцентровое проспективное нерандомизированное исследование.
Условия проведения
В исследование включались пациенты с подагрой, обращающиеся в Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт ревматологии имени В.А. Насоновой».
Критерии соответствия
Критериями включения были возраст старше 18 лет, диагноз подагры по критериям S. Wallace и соавт. Критериями исключения являлись наличие СД, беременность. Для выставления диагноза СД2 использовались критерии диагностики Всемирной Организации Здравоохранения 1999 гг.
Описание вмешательства
Данные на каждого пациента заносили в индивидуальную регистрационную карту на визитах, динамическое наблюдение осуществлялось не реже 1 раза в 2 года, охватывало период от 2 до 8 лет.
Оценивались антропометрические параметры: рост, масса тела, окружность талии (ОТ), индекс массы тела (ИМТ) от 18,5 до 24,9 кг/м2 расценивался как нормальный, от 25 до 29,9 кг/м2 — соответствовал избыточной массе тела, >30 кг/м2 — ожирению. Абдоминальное ожирение (АО) диагностировалось при ОТ ≥94 см у мужчин и ≥80 см у женщин. Определяли наличие и количество подкожных тофусов, количество приступов за прошедший год, число пораженных суставов за время болезни.
Лабораторные исследования включали определение сывороточного уровня холестерина, триглицеридов, глюкозы, креатинина, МК, С-реактивного белка, гликированного гемоглобина.
Риск развития в последующие 10 лет СД2 у пациентов с подагрой оценивали по российской версии шкалы FINDRISС, включающей такие факторы, как возраст, избыточная масса тела, АО, СД у родственников, отсутствие достаточной физической активности, несбалансированное питание, прием гипотензивных препаратов (как эквивалент артериальной гипертензии), эпизоды гипергликемии в анамнезе. Пациенты самостоятельно заполняли опросник, ответ на каждый из восьми вопросов оценивался в баллах, затем вычислялся суммарный счет (СС), который соответствовал определенному риску развития СД2 в ближайшую декаду жизни («низкий», «слегка повышенный», «умеренный», «высокий» и «очень высокий»). Риск развития СД2 оценивался как «низкий» при СС <7 баллов, «слегка повышенный» — от 7 до 11 баллов, «умеренный» — от 12 до 14 баллов, «высокий» — от 15 до 20 баллов и «очень высокий» — ≥20 баллов (максимально возможная сумма баллов — 26) [13].
Этическая экспертиза
Протокол исследования одобрен локальным Этическим комитетом НИИ ревматологии (протокол №9 от 24.03.2011 г.), все пациенты подписали информированное согласие.
Статистический анализ
Статистическая обработка данных проводилась на персональном компьютере с использованием методов параметрической и непараметрической статистики прикладных программ Statistica 12.0 (StatSoft. Inc., США). Для качественных признаков представлены абсолютные и относительные величины (n, %), для количественных — медиана, 25-й и 75-й перцентили. При сравнении двух независимых групп по количественным признакам применяли критерий Манна–Уитни, по качественным — χ2. Взаимосвязь признаков оценивали с использованием критерия ранговой корреляции Спирмена (r). Различия считались статистически значимыми при р<0,05. Для оценки валидности использования шкалы в отношении повышения выявляемости нарушений углеводного обмена были проведены расчет чувствительности, специфичности, построение ROC-кривой с определением площади под кривой.
РЕЗУЛЬТАТЫ
В исследование включены 444 пациента (49 женщин, 395 мужчин) c подагрой, Исходная характеристика больных представлена в табл. 1.
Таблица 1. Характеристика включенных в исследование больных подагрой (n=444)
Показатель | Значение |
Мужчины, n (%) | 395 (88,9) |
Возраст, полных лет | 51,18±11,73 |
Длительность наблюдения, полных лет | 5,66 [ 2,69; 7,64 ] |
Длительность подагры, полных лет | 5,58 [ 1,62; 7,19 ] |
Хроническое течение подагры, n (%) | 243 (54,7) |
Наличие тофусов, n (%) | 176 (39,6) |
Более 4 приступов в год, n (%) | 181 (40,8) |
Соблюдение гипопуриновой диеты, n (%) | 88 (19,8) |
Количество пораженных суставов за время болезни ≥5, n (%) | 339 (76,4) |
Курение, n (%) | 101 (22,7) |
Развили СД2 за время наблюдения, n (%) | 108 (24,3) |
Средние балы по шкале FINDRISС | 12,76±4,05 |
Факторы риска по шкале FINDRISС | |
ИМТ, кг/м2 | 29,97±4,8 |
ИМТ ≥25 кг/м2, n (%) | 380 (85,6) |
ИМТ≥30 кг/м2, n (%) | 213 (47,9) |
Абдоминальное ожирение, n (%) | 253 (56,9) |
СД у родственников 1-й и 2-й линии родства, n (%) | 99 (22,3) |
СД у родственников 1-й линии родства, n (%) | 94 (21,2) |
СД у родственников 2-й линии родства, n (%) | 86 (19,4) |
Возраст ≥45 лет, n (%) | 313 (70,5) |
Недостаточная физическая активность, n (%) | 327 (73,6) |
Несбалансированное питание, n (%) | 344 (77,5) |
Прием гипотензивных препаратов, n (%) | 361 (81,3) |
Эпизоды гипергликемии в анамнезе, n (%) | 245 (55,2) |
Лабораторные показатели | |
СРБhs, мг/л | 14,7 [ 4,9; 19,7 ] |
СРБhs ≥5 мг/л, n (%) | 318 (71,6) |
Глюкоза, ммоль/л | 5,42±0,82 |
Глюкоза >6,1 ммоль/л, n (%) | 96 (21,6) |
Гликированный гемоглобин, % | 5,46±0,45 |
Холестерин, ммоль/л | 5,65±1,37 |
Холестерин >5 ммоль/л, n (%) | 302 (68,0) |
Креатинин, мкмоль/л | 101,53±31,15 |
рСКФ <60 мл/мин/1,73 м2, n (%) | 48 (10,8) |
Мочевая кислота, мкмоль/л | 500,0±111,7 |
Мочевая кислота <360 мкмоль/л, n (%) | 203 (45,7) |
Мочевая кислота <300 мкмоль/л, n (%) | 127 (28,6) |
Уровень триглицеридов>2,5 ммоль/л | 173 (38,9) |
рСКФ — расчетная скорость клубочковой фильтрации
Наиболее часто встречающимися традиционными ФР развития СД2, входящими в FINDRISС, у пациентов с подагрой были избыточная масса тела (по ИМТ) — у 380 (85,6%) пациентов, прием гипотензивных препаратов — у 361 (81,3%) пациента, возраст старше 45 лет — у 313 (70,5%) пациентов. Распространенность других ФР оказалась следующей: АО — у 253 (56,9%) пациентов, отягощенная наследственность — у 99 (22,3%) пациентов, несбалансированное питание — у 344 (77,5%) пациентов, эпизоды гипергликемии в анамнезе — у 245 (55,2%) пациентов. После подсчета баллов по шкале FINDRISС пациенты были распределены на 5 групп в зависимости от количества набранных баллов (табл. 2). Так, оказалось, что лишь у 4% пациентов риск был низким, тогда как высоким и очень высоким — почти у трети (32%).
Таблица 2. Распределение по группам риска развития сахарного диабета 2 типа по шкале FINDRISС пациентов с подагрой (n=444)
Суммарный счет | n, % |
<7, «низкий», n (%) | 16 (4) |
7–11, «слегка повышенный», n (%) | 187 (42) |
12–14, «умеренный», n (%) | 98 (22) |
15–20, «высокий», n (%) | 80 (18) |
>20, «очень высокий», n (%) | 63 (14) |
За период наблюдения СД2 развился у 108 пациентов (24,3%), умерли 34 пациента, отказались от дальнейшего наблюдения 5 пациентов.
При оценке зависимости вероятности выявления развития СД2 от количества баллов по шкалe FINDRISС с помощью ROC-анализа была получена следующая кривая (рис. 1).
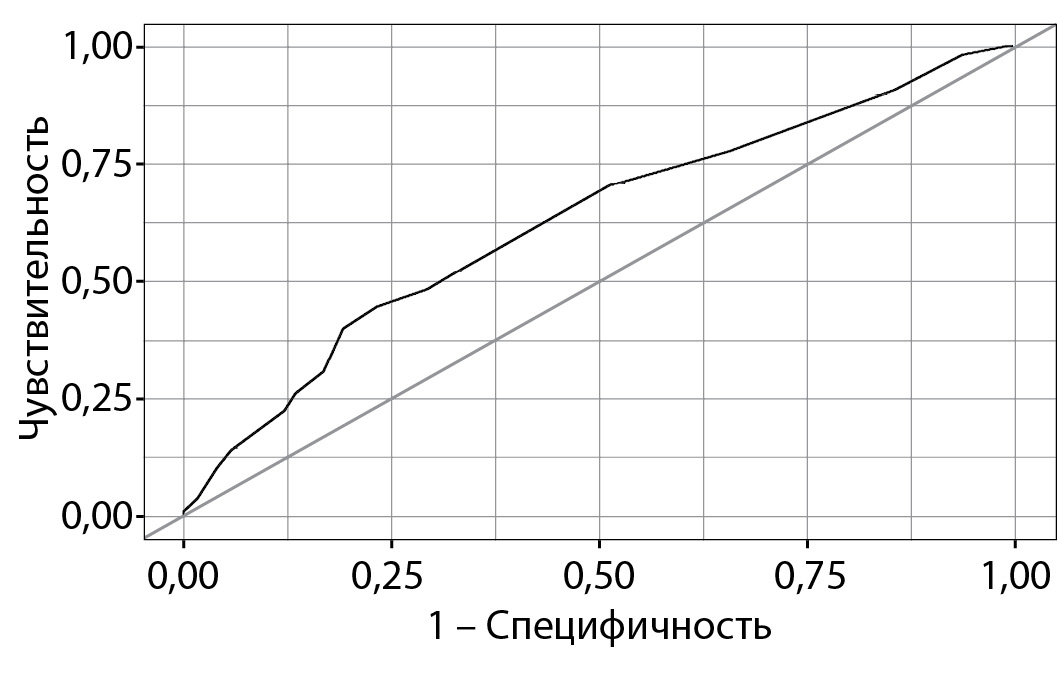
Рисунок 1. ROC-кривая, характеризующая зависимость вероятности развития сахарного диабета 2 типа от баллов по шкале FINDRISС.
Площадь под ROC-кривой составила 0,626±0,032; 95% доверительный интервал (ДИ) 0,562–0,690. Полученная модель была статистически значимой (p<0,001). Пороговое значение функции (1) в точке cut-off составляло 13 баллов — значения функции, равные или превышающие данное значение, соответствовали прогнозу высокого риска СД2. Чувствительность шкалы FINDRISС составила 52,8%, специфичность — 66,3%.
Пациенты с развившимся СД2 за период наблюдения чаще имели исходно высокий и очень высокий риск по шкале FINDRISС, чем не развившие СД2 — 22,9% vs 44,4% (p<0,05). Напротив, лиц с умеренным риском выявлено в 2 раза больше среди пациентов, не развивших СД2 (p<0,001). Сравнение результатов стратификации риска развития СД2 по шкале FINDRISС у пациентов, развивших (n=108) и с не развившимся СД2 (n=297) в процессе наблюдения, представлено на рис. 2.
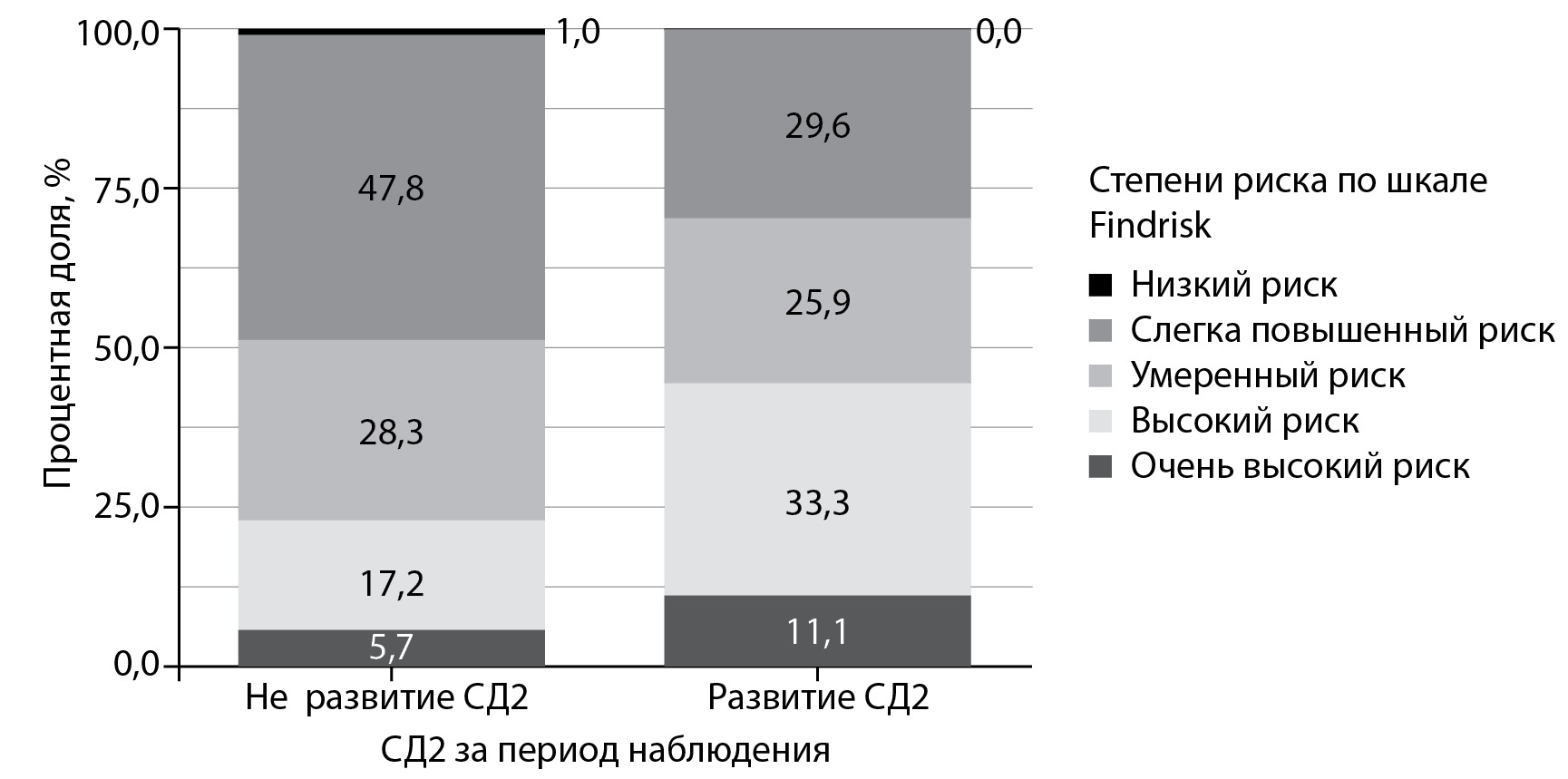
Рисунок 2. Сравнение результатов стратификации риска развития сахарного диабета 2 типа по шкале FINDRISС.
В дальнейшем для облегчения статистического анализа пациенты были разделены на две группы: «низкий/слегка повышенный» (n=177) и «умеренный/высокий/очень высокий» (n=228). Такое деление основано на принципе необходимости профилактических мероприятий: при «умеренном», «высоком» и «очень высоком» риске показаны активное наблюдение, коррекция образа жизни, а иногда и применение сахароснижающих препаратов. Характеристика пациентов с подагрой в зависимости от риска (низкий/слегка повышенный vs умеренный/высокий/очень высокий) развития СД2 представлена в табл. 3.
Таблица 3. Характеристика пациентов с подагрой в зависимости от риска развития сахарного диабета 2 типа, (n=405)
Параметры | Риск СД 2-го типа | ||
низкий/слегка повышенный (n=177) | умеренный/высокий/очень высокий (n=228) | p | |
Мужчины, n (%) | 158 (89,3) | 203 (89) | 0,941 |
Возраст, полных лет | 49,07±11,65 | 51,7±11,75 | 0,025 |
Наличие тофусов, n (%) | 55 (31,1) | 98 (42,9) | 0,014 |
Более 4 приступов в год, n (%) | 69 (38,9) | 98 (42,9) | 0,417 |
Полиартрит более 5 суставов, n (%) | 127 (71,7) | 179 (78,5) | 0,117 |
Лабораторные показатели | |||
Мочевая кислота, мкмоль/л | 491,72±104,38 | 505,30±112,91 | 0,215 |
Мочевая кислота <360 мкмоль/л, n (%) | 73 (41,2) | 92 (40,4) | 0,856 |
Мочевая кислота <300 мкмоль/л, n (%) | 50 (28,2) | 42 (18,4) | 0,019 |
Абдоминальное ожирение, n (%) | 90 (51) | 136 (60) | 0,077 |
Как видно из представленных в табл. 3 данных, у пациентов, имеющих умеренный/высокий/очень высокий риск СД2, достоверно чаще выявлялись некоторые факторы, относящиеся непосредственно к подагре: наличие тофусов (p=0,014), уровень МК сыворотки ≤300 мкмоль/л (p=0,005). При этом СД2 развился у 33,3% (76 пациентов) из числа пациентов с умеренным/высоким/очень высоким риском и 18,1% (32 пациента) из имеющих низкий или слегка повышенный риск (p=0,0002).
ОБСУЖДЕНИЕ
Во всем мире СД2 представляет собой серьезную проблему для общественного здравоохранения из-за его высокой распространенности и тенденции к увеличению связанных с ним заболеваемости и смертности, а также огромного экономического бремени. Распространенность СД2 среди населения составляла в 2014 г. 8,3% [14]. Частота развития СД2 у пациентов с подагрой выше, чем в популяции, и может достигать 12–26% [15]. По нашим данным, в процессе 6-летнего проспективного наблюдения СД2 развился у 24,3% (108 из 444) пациентов с подагрой. Таким образом, наши данные как минимум соотносятся с данными литературы и превышают таковые в популяции. Y. Tung и соавт. выявили, что подагра является сильным и независимым фактором риска СД2: за период наблюдения у 13,24% больных подагрой развился СД2 при отношении рисков 1,70 (95% ДИ 1,62–1,77) в сравнении с контрольной группой [16]. Метаанализ, включивший 23 исследования, показал, что распространенность СД у больных подагрой составила 16% [17]. В более ранней работе, проведенной в ФГБНУ НИИР им. В.А. Насоновой, целенаправленное обследование 195 пациентов с подагрой позволило диагностировать СД2 у 34,3% пациентов, а еще у 23,1% — предшествующие СД2 нарушения углеводного обмена (нарушенная гликемия натощак или нарушение толерантности к глюкозе) [18]. Некоторые различия, связанные со столь высокой частотой выявления нами СД2, возможно, были связаны с целенаправленной диагностикой диабета при проспективном наблюдении, а также наличием эпизодов гипергликемии в анамнезе у 55,2% пациентов, что, безусловно, увеличивало вероятность развития заболевания уже в ближайшие годы.
Расчет риска развития СД2 при помощи шкалы FINDRISС у пациентов с подагрой был проведен нами впервые и показал, что более чем 50% пациентов с подагрой имеют умеренный/высокий/очень высокий развития СД2. Это было больше, чем в аналогичном исследовании Л.В. Кондратьевой и соавт., обследовавших 418 пациентов с ревматоидным артритом (РА) сопоставимого возраста (медиана — 54 года), большинство из которых были женщинами (86%), где таких пациентов было 40% [19]. Частота несбалансированного питания как фактора риска СД2 встречалась у каждого второго пациента с РА, хотя и реже, чем у пациентов с подагрой, тогда как число пациентов с избыточным весом при РА было меньшим.
Вполне объяснимо наличие высокой частоты ожирения (47,9%) и несбалансированного питания (77,5%) у обследованных нами пациентов, так как они являются не только факторами риска развития СД2, но также ГУ и подагры [20]. Адипоциты и макрофаги жировой ткани при ожирении способны продуцировать различные провоспалительные цитокины (фактор некроза опухоли альфа, интерлейкин-6 и другие) и поддерживать воспалительные реакции, а провоспалительные цитокины, в свою очередь, способствуют развитию инсулинорезистентности, снижая чувствительность адипоцитов к инсулину и замыкая порочный круг [21].
Что касается другого фактора риска СД2, низкой физической активности, выявленной у 73,6% наших пациентов, этому могло способствовать наличие хронического артрита, частых острых приступов артрита, наличие тофусов, то есть, собственно проявлений подагры [22]. Хотя конкретных рекомендаций по физической активности при подагре не разработано, она входит в перечень консервативных методов лечения и профилактики заболевания [2]. Имеются данные, что физическая активность на модели подагры у мышей, получавших упражнения низкой и умеренной интенсивности, по сравнению с животными, которые не выполняли упражнения, предотвращает острое воспаление за счет подавления Toll-подобных рецепторов на циркулирующих нейтрофилах, ингибирования сывороточного хемоаттрактанта нейтрофилов CXCL1 и снижения активности NF-κB [23]. Кроме того, эпидемиологические исследования показывают, что регулярные физические упражнения обладают иммуномодулирующим эффектом, а в контексте ревматических заболеваний — противовоспалительным действием и способны улучшить общее состояние здоровья за счет снижения частоты сопутствующих заболеваний [24]. К тому же регулярная физическая активность способствует поддержанию нормального уровня глюкозы в крови и снижает риск возникновения СД2, при этом положительно влияя на показатели липидов, артериального давления, сердечно-сосудистые заболевания, смертность и качество жизни. Таким образом, этот модифицируемый, часто встречаемый у пациентов с подагрой фактор риска СД2 возможно и необходимо устранять.
Интересно, что популяционная частота в Российской Федерации как ожирения (29,7%) и несбалансированного питания (41,9%), так и низкой физической активности (38,8%) намного меньше, чем у обследованных нами пациентов с подагрой. По данным популяционного исследования Ю.А Балановой и соавт., была выявлена гораздо меньшая, чем в нашем исследовании, частота и ожирения (29,7%), и несбалансированного питания (41,9%), и низкой физической активности (38,8%) при сопоставимом возрасте [25]. Эти различия могут быть одними из возможных причин высокой частоты встречаемости СД2 при подагре.
По нашим данным, СД2 развился не только у 33% пациентов с подагрой из группы умеренный/высокий/очень высокий риск, но и 18% пациентов из группы низкого/слегка повышенного риска. То есть, возможно, что в генезе СД2 может иметь значение собственно подагра. Так, наличие высокого риска, что отчасти находит подтверждение в показанной нами ассоциации между выраженностью клинических проявлений подагры (наличие тофусов, частота приступов артрита, больший уровень МК сыворотки) и результатами стратификации по шкале FINDRISС.
Влияние уровня МК на углеводный обмен и риск развития СД2 обсуждается давно, однако имеющейся информации, чтобы говорить о ГУ как о независимом факторе риска категорично, недостаточно. Эксперименты показали, что повышение уровня МК с участием фруктозы может вызвать инсулинорезистентность (ИР), ключевой признак СД2 у крыс, а снижение уровня МК в сыворотке крови улучшает чувствительность к инсулину [26]. Взаимосвязь между ИР и ГУ в популяциях СД2 изучалась в ограниченном количестве исследований. Избыток МК приводит к увеличению продукции активных форм кислорода, что вызывает воспаление. Окислительный стресс может повлиять на экспрессию гена инсулина, вызывая снижение секреции инсулина [27]. Анализ 1983 пациентов с впервые диагностированным СД2 позволил изучить связь между уровнем МК плазмы и ИР. Выявлено, что более высокие уровни МК в плазме были связаны с более высокими уровнями ИР. Однако ассоциации не были подтверждены анализом генетических инструментальных переменных, основанным на концепции менделевской рандомизации [6].
Предполагается, что способствовать увеличению риска СД2 может не только и даже не столько ГУ, но и оксидативный стресс, связанный с активностью ксантиноксидазы — фермента, катализирующего окисление гипоксантина до ксантина, а затем до МК. Помимо своей роли в производстве МК, ксантиноксидаза также генерирует окислители, которые являются ключевыми игроками в процессе развития СД2 [28].
Возможно, что по аналогии с сердечно-сосудистыми заболеваниями наличие подагры в большей степени связано с риском СД2, чем асимптоматическая ГУ [29]. Так, согласно нашим данным, более 70% пациентов имели уровень СРБ ≥5 мг/л. При этом известно, что уровень СРБ независимо связан с развитием СД [30]. Тем не менее применение уратснижающей терапии в немногих исследованиях, в которых изучалась возможность снижения риска СД2 путем уменьшения сывороточного уровня МК, к желаемому результату в основном не привели [31].
Наконец, при расчете чувствительности и специфичности шкалы FINDRISC качество модели было оценено как среднее, что отличалось от данных некоторых других исследований в общей популяции, где качество модели было в основном хорошим, то есть определялась площадь под кривой 0,7 и более [13]. Тем не менее можно констатировать, что расчет по шкале позволяет довольно точно прогнозировать развитие СД2 у пациентов с подагрой. Причинами относительно невысокой точности прогнозирования может быть, во-первых, то, что для оценки AUC ROC выборка в несколько сотен объектов может быть недостаточной, во-вторых, шкала не учитывает уже обсужденные нами факторы, относящиеся собственно к подагре.
К ограничениям нашего исследования следует отнести факт включения в анализ пациентов, начиная с 18-летнего возраста, хотя применение шкалы FINDRISC целесообразно у лиц старше 45 лет. Тем не менее, учитывая, что пациентов в данной возрастной группе (19–23 года) в нашем исследовании было всего 5 (ни один из них не развил СД2), что не повлияло на конечные результаты, зато было максимально приближено к клинической практике. Несмотря на то что нами не был выдержан 10-летний срок наблюдения, а примененная шкала FINDRISC оценивает именно 10-летний риск развития СД2, даже в среднем за 6-летний период наблюдения более чем четверть пациентов достигли первичной конечной точки. В этой связи нами представляется обоснованной предварительная оценка валидности данной шкалы, тем более, что существуют веские аргументы в пользу как можно более раннего скрининга субъектов, которые подвержены повышенному риску диабета [32], таковыми, по данным исследований и наших данных, являются большая часть пациентов с подагрой. Кроме того, несмотря на возможности шкалы оценивать риск развития не только СД2, но и других нарушений углеводного обмена, в задачи данной части исследования нами были включены в анализ именно случаи выявленного СД2 у пациентов с подагрой, что, вероятно, занижает полученные результаты, однако является целью первого этапа исследования, результаты тестирования для выявления риска других нарушений углеводного обмена требуют дополнительной обработки.
ЗАКЛЮЧЕНИЕ
Можно констатировать, что шкала FINDRISС позволяет довольно точно прогнозировать риск развития СД2 и может быть рекомендована к применению у пациентов с подагрой. Своевременное определение групп высокого риска развития СД2 позволит разработать меры первичной его профилактики. Также, по всей вероятности, у пациентов с подагрой следует рассматривать возможность влияния на развитие нарушений углеводного обмена факторов, непосредственно связанных с заболеванием (ГУ, хроническое микрокристаллическое воспаление). Не вызывает сомнений, что для оценки роли отдельных факторов риска развития СД2 у пациентов с подагрой необходимы дальнейшие исследования.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Желябина О.В., Чикина М.Н., Паневин Т.С — сбор и обработка материала, анализ полученных данных, написание текста; Елисеев М.С. — концепция и дизайн исследования, написание текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Чикина М.Н., Елисеев М.С., Желябина О.В. Практическое применение национальных клинических рекомендаций по лечению подагры (предварительные данные) // Современная ревматология. — 2020. — Т. 14. — №2. — С. 97-103. doi: https://doi.org/10.14412/1996-7012-2020-2-97-103
2. Елисеев М.С. Обновленные рекомендации EULAR по лечению подагры. Комментарии к некоторым позициям // Научно-практическая ревматология. — 2017. — Т. 55. — №6. — С. 600-609. doi: https://doi.org/10.14412/1995-4484-2017-600-609
3. Liu Q, Gamble G, Pickering K, et al. Prevalence and clinical factors associated with gout in patients with diabetes and prediabetes. Rheumatology (Oxford). 2012;51(4):757-759. doi: https://doi.org/10.1093/rheumatology/ker384
4. Li C, Hsieh MC, Chang SJ. Metabolic syndrome, diabetes, and hyperuricemia. Curr Opin Rheumatol. 2013;25(2):210-216. doi: https://doi.org/10.1097/BOR.0b013e32835d951e
5. Mauer M, Doria A. Uric Acid and Diabetic Nephropathy Risk. Contrib Nephrol. 2018;192:103-109. doi: https://doi.org/10.1159/000484284.
6. Hu X, Rong S, Wang Q, et al. Association between plasma uric acid and insulin resistance in type 2 diabetes: A Mendelian randomization analysis. Diabetes Res Clin Pract. 2021;171:108542. doi: https://doi.org/10.1016/j.diabres.2020.108542
7. Lv Q, Meng XF, He FF, et al. High serum uric acid and increased risk of type 2 diabetes: a systemic review and meta-analysis of prospective cohort studies. PLoS One. 2013;8(2):e56864. doi: https://doi.org/10.1371/journal.pone.0056864
8. Sluijs I, Holmes MV, van der Schouw YT, et al. A Mendelian Randomization Study of Circulating Uric Acid and Type 2 Diabetes. Diabetes. 2015;64(8):3028-3036. doi: https://doi.org/10.2337/db14-0742
9. Borghi C, Agabiti-Rosei E, Johnson RJ, et al. Hyperuricaemia and gout in cardiovascular, metabolic and kidney disease. Eur J Intern Med. 2020;80:1-11. doi: https://doi.org/10.1016/j.ejim.2020.07.006
10. Lindstrom J, Tuomilehto J. The diabetes risk score: a practical tool to predict type 2 diabetes risk. Diabetes Care. 2003:26(3):725-731. doi: https://doi.org/10.2337/diacare.26.3.725
11. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. (9-й выпуск) // Сахарный диабет. — 2019. — Т. 22. — №1S1 — C. 1-144. doi: https://doi.org/10.14341/DM221S1
12. Jølle A, Midthjell K, Holmen J, et al. Validity of the FINDRISC as a prediction tool for diabetes in a contemporary Norwegian population: a 10-year follow-up of the HUNT study. BMJ Open Diabetes Res Care. 2019;7(1):e000769. doi: https://doi.org/10.1136/bmjdrc-2019-000769
13. Мустафина С.В., Рымар О.Д., Сазонова О.В., и др. Валидизация финской шкалы риска «FINDRISC» на европеоидной популяции Сибири // Сахарный диабет. — 2016. — Т. 19. — №2. — С. 113-118. doi: https://doi.org/10.14341/DM200418-10
14. Kaiser AB, Zhang N, Pluijm VW. Global Prevalence of Type 2 Diabetes over the Next Ten Years (2018–2028). Diabetes. 2018;67(S1). doi: https://doi.org/10.2337/db18-202-LB
15. Zhu Y, Pandya BJ, Choi HK. Comorbidities of gout and hyperuricemia in the US general population: NHANES 2007-2008. Am J Med. 2012;125(7):679-687. doi: https://doi.org/10.1016/j.amjmed.2011.09.033
16. Tung Y-C, Lee S-S, Tsai W-C, et al. Association Between Gout and Incident Type 2 Diabetes Mellitus: A Retrospective Cohort Study. Am J Med. 2016;129(11):1219.e17-1219.e25. doi: https://doi.org/10.1016/j.amjmed.2016.06.041
17. Zhao R, Wang Y, Fu T, et al. Gout and risk of diabetes mellitus: metaanalysis of observational studies. Psychol Health Med. 2020;25(8):917-930. doi: https://doi.org/10.1080/13548506.2019.1707241
18. Елисеев М.С., Барскова В.Г. Нарушения углеводного обмена при подагре: частота выявления и клинические особенности // Терапевтический архив. — 2010. — Т. 82. — №5. — С. 50-54.
19. Кондратьева Л.В., Попкова Т.В., Насонов Е.Л. Оценка риска развития сахарного диабета 2-го типа у больных ревматоидным артритом c помощью шкалы FINDRISС // Научно-практическая ревматология. — 2017. — Т. 55. — №5. — С. 504-508. [Kondratyeva LV, Popkova TV, Nasonov EL. Type 2 diabetes mellitus risk assessment using FINDRISC in patients with rheumatoid arthritis. Rheumatol Sci Pract. 2017;55(5):504-508. (In Russ.)]. doi: https://doi.org/10.14412/1995-4484-2017-504-508
20. Singh JA, Reddy SG, Kundukulam J. Risk factors for gout and prevention: a systematic review of the literature. Curr Opin Rheumatol. 2011;23(2):192-202. doi: https://doi.org/10.1097/BOR.0b013e3283438e13
21. Wu H, Ballantyne CM. Metabolic Inflammation and Insulin Resistance in Obesity. Circ Res. 2020;126(11):1549-1564. doi: https://doi.org/10.1161/CIRCRESAHA.119.315896
22. Елисеев М.С., Мукагова М.В., Глухова С.И. Связь клинических проявлений и коморбидных заболеваний с показателями качества жизни у больных подагрой // Научно-практическая ревматология. — 2015. — Т. 55. — №1. — С. 45-50. doi: https://doi.org/10.14412/1995-4484-2015-45-50
23. Jablonski K, Young NA, Henry C, et al. Physical activity prevents acute inflammation in a gout model by downregulation of TLR2 on circulating neutrophils as well as inhibition of serum CXCL1 and is associated with decreased pain and inflammation in gout patients. PLoS One. 2020;15(10):e0237520. doi: https://doi.org/10.1371/journal.pone.0237520
24. Benatti FB, Pedersen BK. Exercise as an anti-inflammatory therapy for rheumatic diseases—myokine regulation. Nat Rev Rheumatol. 2015;11(2):86-97. doi: https://doi.org/10.1038/nrrheum.2014.193
25. Баланова Ю.А., Концевая А.В., Шальнова С.А., и др. Распространенность поведенческих факторов риска сердечнососудистых заболеваний в российской популяции по результатам исследования ЭССЕ-РФ // Профилактическая медицина. — 2014. — Т. 17. — №5. — С. 42-52.
26. Katsiki N, Papanas N, Fonseca VA, et al. Uric acid and diabetes: Is there a link? Curr Pharm Des. 2013;19(27):4930-4937. doi: https://doi.org/10.2174/1381612811319270016
27. Yu M-A, Sánchez-Lozada LG, Johnson RJ, Kang D-H. Oxidative stress with an activation of the renin– angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction. J Hypertens. 2010;28(6):1234-1242. doi: https://doi.org/10.1097/HJH.0b013e328337da1d
28. Li X, Meng X, Gao X, et al. Elevated Serum Xanthine Oxidase Activity Is Associated With the Development of Type 2 Diabetes: A Prospective Cohort Study [published correction appears in Diabetes Care. 2019;42(3):494]. Diabetes Care. 2018;41(4):884-890. doi: https://doi.org/10.2337/dc17-1434
29. Kuo CF, See LC, Luo SF, et al. Gout: an independent risk factor for all-cause and cardiovascular mortality. Rheumatology (Oxford). 2010;49(1):141-146. doi: https://doi.org/10.1093/rheumatology/kep364
30. Mazidi M, Toth PP, Banach M. C-reactive Protein Is Associated With Prevalence of the Metabolic Syndrome, Hypertension, and Diabetes Mellitus in US Adults. Angiology. 2018;69(5):438-442. doi: https://doi.org/10.1177/0003319717729288
31. Slobodnick A, Toprover M, Greenberg J, et al. Allopurinol use and type 2 diabetes incidence among patients with gout: A VA retrospective cohort study. Medicine (Baltimore). 2020;99(35):e21675. doi: https://doi.org/10.1097/MD.0000000000021675
32. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2018. Diabetes Care. 2018;41(Suppl 1):S13-S27. doi: https://doi.org/10.2337/dc18-S002
Об авторах
О. В. ЖелябинаЖелябина Ольга Владимировна, м.н.с.
SPIN: 8038-6195
Москва
Конфликт интересов:
нет
М. С. Елисеев
Елисеев Максим Сергеевич, к.м.н., ст.н.с.
SPIN: 2524-7320
Москва
Конфликт интересов:
нет
М. Н. Чикина
Чикина Мария Николаевна, м.н.с.
SPIN: 3159-0586
Москва
Конфликт интересов:
нет
Т. С. Паневин
Паневин Тарас Сергеевич, к.м.н., н.с.
SPIN: 7839-3145
Москва
Конфликт интересов:
нет
Дополнительные файлы
|
|
1. Рисунок 1. ROC-кривая, характеризующая зависимость вероятности развития сахарного диабета 2 типа от баллов по шкале FINDRISС. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(99KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Сравнение результатов стратификации риска развития сахарного диабета 2 типа по шкале FINDRISС. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(144KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Желябина О.В., Елисеев М.С., Чикина М.Н., Паневин Т.С. Оценка риска развития сахарного диабета 2-го типа у пациентов с подагрой на основе шкалы FINDRISС. Сахарный диабет. 2021;24(6):521-528. https://doi.org/10.14341/DM12804
For citation:
Zhelyabina O.V., Eliseev M.S., Chikina M.N., Panevin T.S. Assessment of the risk of developing type 2 diabetes mellitus in patients with gout based on the FINDRISС scale. Diabetes mellitus. 2021;24(6):521-528. (In Russ.) https://doi.org/10.14341/DM12804

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































