Перейти к:
Особенности хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных резистентной артериальной гипертонией в сочетании с сахарным диабетом 2-го типа
https://doi.org/10.14341/DM12732
Аннотация
ОБОСНОВАНИЕ. Хроническая сердечная недостаточность с сохраненной фракцией выброса (ХСНсФВ) ассоциируется с высокой заболеваемостью и смертностью. Артериальная гипертония (АГ) и сахарный диабет (СД) относятся к основным факторам риска ХСНсФВ, а развитие резистентной АГ (РАГ) еще более ухудшает сердечно-сосудистый прогноз. Тем не менее данные, касающиеся частоты ХСНсФВ у селективной группы больных РАГ в сочетании с СД, до настоящего времени отсутствуют, а патофизиологические и молекулярные механизмы ее формирования изучены недостаточно.
ЦЕЛЬ. Оценить особенности ХСНсФВ у больных РАГ в сочетании с СД 2 типа (СД2), а также определить факторы, связанные с ее развитием.
МЕТОДЫ. Проведено одномоментное сравнительное исследование с участием 36 больных РАГ в сочетании с СД2 (средний возраст 61,4±6,4 года, 14 мужчин) и 33 пациентов с РАГ без СД, сопоставимых по полу, возрасту и уровню систолического артериального давления (АД). Всем больным проводили измерение офисного и 24-часового АД, ЭхоКГ с оценкой диастолической функции, лабораторные тесты (базальная гликемия, гликированный гемоглобин (HbA1c), креатинин, альдостерон, фактор некроза опухоли альфа (ФНО-α), высокочувствительный С-реактивный белок, мозговой натрийуретический пептид (МНУП), матриксные металлопротеиназы 2-го, 9-го типов (ММП-2, ММП-9) и тканевой ингибитор ММП 1-го типа (ТИМП-1)).
РЕЗУЛЬТАТЫ. ХСНсФВ у больных РАГ с СД2 встречалась значимо чаще, чем у лиц без СД (89% и 70% соответственно; p=0,045), что во многом было обусловлено более высокой частотой среднего отношения E/e’≥15 (p=0,042), а также тенденцией к более высокой частоте увеличения объемов левого предсердия (p=0,081) и повышению МНУП (p=0,110). Несмотря на сопоставимую частоту диастолической дисфункции у больных РАГ с наличием и отсутствием СД (100% и 97% соответственно), больные с СД2 отличались от лиц без СД большей выраженностью нарушений трансмитрального кровотока. Ухудшение показателей диастолической функции и ее псевдонормализация у больных РАГ с СД2 были взаимосвязаны не только с продолжительностью и тяжестью нарушений углеводного обмена, но и с уровнем пульсового АД, значениями ФНО-α, ТИМП-1 и ТИМП-1/ММП-2, которые, наряду с частотой атеросклероза, при СД были выше, чем у лиц без СД.
ЗАКЛЮЧЕНИЕ. Таким образом, ХСНсФВ встречается у подавляющего большинства больных РАГ в сочетании с СД2, а ее частота значимо превышает таковую у пациентов с РАГ без СД. Прогрессивное развитие ХСНсФВ при СД определяется большей выраженностью диастолической дисфункции, в развитии которой существенная роль принадлежит не только метаболическим нарушениям, но и повышению активности хронического субклинического воспаления, профибротическому состоянию и большей выраженности сосудистых изменений в виде атеросклероза и повышения артериальной жесткости.
Ключевые слова
Для цитирования:
Манукян М.А., Фальковская А.Ю., Мордовин В.Ф., Рябова Т.Р., Зюбанова И.В., Гусакова А.М., Суслова Т.Е. Особенности хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных резистентной артериальной гипертонией в сочетании с сахарным диабетом 2-го типа. Сахарный диабет. 2021;24(4):304-314. https://doi.org/10.14341/DM12732
For citation:
Manukyan M.A., Falkovskaya A.Y., Mordovin V.F., Ryabova T.R., Zyubanova I.V., Gusakova A.M., Suslova T.E. Features of heart failure with preserved ejection fraction (HFpEF) in diabetic patients with resistant hypertension. Diabetes mellitus. 2021;24(4):304-314. (In Russ.) https://doi.org/10.14341/DM12732
ВВЕДЕНИЕ
Учитывая высокую прогностическую значимость фракции выброса левого желудочка, современная классификация хронической сердечной недостаточности (ХСН) выделяет ХСН с низкой (<40%), промежуточной (от 40 до 50%) и сохранной фракцией выброса (>50%) [1]. По данным мировых эпидемиологических исследований, ХСН с сохранной фракцией выброса (ХСНсФВ) встречается у 50% госпитализированных больных по поводу ХСН и ассоциируется с высокой заболеваемостью и смертностью [2]. Характерной чертой ХСНсФВ является высокая коморбидность, и у половины пациентов встречается пять или более сопутствующих заболеваний [3]. Однако к наиболее частым из них следует отнести артериальную гипертонию (АГ) и сахарный диабет (СД), распространенность которых при ХСНсФВ составляет до 90 и 40% соответственно [3]. Резистентная АГ (РАГ) ассоциируется с трехкратным возрастанием риска ХСН [4], а наличие СД повышает вероятность ее развития на 40% [5]. Более того, СД относится к независимым предикторам смерти при ХСНсФВ, увеличивающим ее риск на 30% [6]. Согласно результатам Федерального регистра пациентов с сахарным диабетом, ХСН продолжает оставаться лидирующей причиной их смерти в Российской Федерации, а ее частота в 2017 г. составляла 28,6% [7].
Согласно современным представлениям, ХСНсФВ — это системное метаболическое заболевание, патофизиологической основой которого служат дисбаланс внутриклеточного обмена, повышенный окислительный стресс, а также снижение уровней оксида азота (NO) и циклического гуанозинмонофосфата (цГМФ), что в итоге повышает жесткость миокарда, замедляет его расслабление, нарушает процессы его наполнения и приводит к диастолической дисфункции (ДД) [8]. Это послужило основанием для использования второго термина ХСНсФВ — «диастолическая сердечная недостаточность» [8]. Тем не менее, патофизиология ХСНсФВ достаточно сложна, а сам термин не ограничивается ДД и включает дополнительно структурные и биомаркерные критерии [9–11]. К специфическим структурным изменениям при ХСНсФВ относятся гипертрофия кардиомиоцитов, воспаление, интерстициальный фиброз и поражение коронарных артерий [12].
Как известно, СД вызывает структурные и функциональные изменения в сердце независимо от ишемической болезни сердца и АГ, а нарушение диастолической функции является ранним проявлением диабетической кардиомиопатии [12][13]. Сочетание СД 2 типа (СД2) и РАГ представляет собой комбинацию гемодинамической нагрузки и метаболических нарушений, что ускоряет биохимические, анатомические и функциональные изменения сердечной мышцы и может определять ускоренное развитие ДД и ХСНсФВ [14]. Ожидается, что неуклонный рост заболеваемости СД и РАГ, наряду с увеличением продолжительности жизни, приведет к заметному увеличению доли больных с ХСНсФВ [3]. В связи с этим выявление патофизиологических механизмов ее развития в будущем может стать основой персонализированной таргетной терапии. Тем не менее данные, касающиеся частоты ХСНсФВ у селективной группы больных РАГ в сочетании с СД, до настоящего времени отсутствуют, а патофизиологические и молекулярные механизмы ее формирования изучены недостаточно.
ЦЕЛЬ
Оценить особенности ХСНсФВ у больных РАГ в сочетании с СД2, а также определить факторы, связанные с ее развитием.
МЕТОДЫ
Дизайн исследования
Одномоментное одноцентровое сравнительное исследование с включением исходных данных больных интервенционных исследований, зарегистрированных на сайте ClinicalTrial.gov (NCT02667912 и NCT01499810).
Место и время проведения исследования
Исследование проведено в НИИ кардиологии Томского НИМЦ Российской академии наук. Включение и обследование пациентов проводились с мая 2012 г. по декабрь 2019 г.
Изучаемые популяции
Популяцию больных составили пациенты с РАГ в сочетании с СД2 (основная группа) и больные РАГ без СД (группа сравнения). В исследование включались лица обоего пола с РАГ в возрасте от 18 до 80 лет. Диагноз РАГ верифицировался согласно действующим национальным рекомендациям [15]. Критериями исключения были фибрилляция предсердий, патология митрального и аортального клапанов, фракция выброса левого желудочка (ФВ ЛЖ) <50%, заболевания миокарда и перикарда, расчетная скорость клубочковой фильтрации (рСКФ) <30 мл/мин/1,73 м2, беременность, тяжелое течение СД (гликированный гемоглобин (HbA1c) >10%).
Способ формирования выборки из изучаемой популяции
Основная группа формировалась путем сплошного включения наблюдений. Для формирования группы сравнения использовался способ стратометрического подбора по полу и возрасту.
Метод регистрации исходов
Клинико-инструментальное обследование включало измерение офисного, 24-часового артериального давления, эхокардиографию и лабораторные тесты. Для оценки гликемического контроля измеряли уровень HbА1c и базальной гликемии. Функцию почек определяли по концентрации креатинина сыворотки крови расчетом СКФ. В ходе иммуноферментного анализа измеряли уровень альдостерона (DBC), концентрацию высокочувствительного С-реактивного белка (вчСРБ (Biomerica)), фактора некроза опухоли альфа (ФНО-α («Вектор-Бест»)), мозгового натрийуретического пептида (МНУП (Biomerica)), матриксных металлопротеиназ (ММП) 2-го типа (R&D Systems), тканевого ингибитора ММП 1-го типа (ТИМП-1) и ММП 9-го типа (affymetrix eBioscience). Информацию о принимаемых препаратах получали по данным опроса.
Эхокардиографию выполняли на аппарате ультразвуковой системы экспертного класса согласно стандартному протоколу. Расчет массы миокарда (ММ) ЛЖ проводили по формуле Troy B.L. и соавт. в модификации Devereux R.B. и соавт. [16]. Показатели объема левого предсердия (ЛП), ММ ЛЖ индексировали к площади поверхности тела (ППТ). ППТ вычисляли по формуле:
ППТ=0,0072×вес (кг)0,425×рост (см)0,725.
Диастолическую функцию ЛЖ оценивали согласно рекомендациям Европейской ассоциации по кардиоваскулярной визуализации от 2016 г. [17]. Определяли пиковые скорости трансмитрального кровотока в фазу раннего диастолического наполнения (Е, см/с) и во время систолы предсердий (А, см/с), их соотношение (Е/А). Время изоволюмического расслабления (ВИР) ЛЖ рассчитывали в апикальной 5-камерной позиции. Дополнительно использовали показатели e` и Е/e`, где e` — скорость движения боковых отделов фиброзного кольца митрального клапана в фазу ранней диастолы, рассчитываемая в режиме импульсно-волнового тканевого допплеровского исследования. Признаками ДД у лиц без систолической дисфункции считали: 1) среднее соотношение septal E/e` и lateral E/e` >14; 2) септальную скорость e’ (septal e’) <7 или латеральную скорость e’ (lateral e’) <10; 3) объемный индекс левого предсердия ≥34 мл/м2; 4) скорость трикуспидальной регургитации >2,8 м/с. ДД диагностировали, если присутствовали более 50% из вышеописанных признаков. Кроме того, в зависимости от значений ВИР, Е/А и времени замедления раннего наполнения ЛЖ (ВЗ Е, мс) проводили разделение диастолической дисфункции на 3 традиционных типа: 1-й тип — гипертрофический (ВИР >100 мс, Е/А <1, ВЗ Е >240 мс), 2-й тип — псевдонормальный (ВИР 70–100 мс, Е/А >1, ВЗ Е 150–240 мс), 3-й тип — рестриктивный (ВИР <70 мс, Е/А >2, ВЗ Е <150 мс) [18].
Диагноз ХСНсФВ выставляли в соответствии с рекомендациями Американского общества эхокардиографии и Европейского общества кардиологов 2019 г., представленными в табл. 1, на основе суммирования баллов больших (2 балла) и малых (1 балл) функциональных, структурных и биомаркерных критериев [11].
Таблица 1. Критерии хронической сердечной недостаточности с сохранной фракцией выброса у пациентов с синусовым ритмом
Функциональные | Структурные | Биомаркерные | |
Большие (2 балла) | Septal e’ <7 см/с Lateral e’ <10 см/с Среднее Е/е’ ≥15 Скорость ТР >2,8 м/с | ИОЛП >34 мл/м2 или ИММ ЛЖ ≥149/122 мл/м2 (м/ж) и ОТС ЛЖ >0,42 | проМНУП >220 пг/мл МНУП >80 пг/мл |
Малые (1 балл) | Среднее Е/e’ 9–14 ГПС <16% | ИОЛП 29–34 мл/м2 ИММ ЛЖ >115/95 мл/м2 (м/ж) ОТС >0,42 толщина стенки ЛЖ ≥12 мм | проМНУП 125–220 пг/мл МНУП >35–80 пг/мл |
≥5 баллов — подтвержденный диагноз ХСНсФВ | |||
Этическая экспертиза
Исследование получило одобрение Комитета по биомедицинской этике при НИИ кардиологии (выписка из протокола № 139 от 18.11.2015). До включения в исследование все пациенты подписали форму информированного согласия.
Статистический анализ
Статистическую обработку проводили с использованием пакета программ STATISTICA ver. 10.0 for Windows. Согласие с нормальным законом распределения признаков проверяли критериями Шапиро–Вилка и Колмогорова–Смирнова. При нормальном распределении непрерывные переменные представляли в виде средней величины (M) и стандартного отклонения (SD): M±SD, при отсутствии нормального распределения — в виде медианы и 25–75% квартилей: Me [ 25; 75% ]. Качественные значения выражались в абсолютных и относительных величинах (n (%)). Категориальные переменные выражали в абсолютных и относительных величинах (n (%)). Использовали стандартные методы описательной статистики, выявляли различия непрерывных переменных в независимых выборках (t-критерий, U-критерий Манна–Уитни). При анализе качественных данных применяли анализ таблиц сопряженности (хи-квадрат Пирсона или точный критерий Фишера (для таблиц 2×2)). Для поиска возможных взаимосвязей — корреляционный анализ количественных признаков (параметрический корреляционный анализа Пирсона). Критическим уровнем значимости p для всех используемых процедур статистического анализа считали 0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование включены 36 больных РАГ в сочетании с СД2 (основная группа). Группу сравнения составили 33 пациента с РАГ без СД, сопоставимых по половозрастному составу, уровню систолического АД и антигипертензивной терапии. Как следует из табл. 2, пациенты сравниваемых групп были сопоставимы по основным клиническим данным.
Таблица 2. Клиническая характеристика пациентов
Показатели | РАГ+СД (n=36) | РАГ (n=33) | P | |
Возраст, годы, M±SD | 61,4±6,4 | 58,6±5,6 | 0,070 | |
Мужской пол, n (%) | 14 (38,9%) | 19 (58%) | 0,095 | |
ИМТ, кг/м2, M±SD | 35,2±5,4 | 33,5±5,4 | 0,193 | |
Продолжительность АГ, годы, M±SD | 23,3±10,4 | 22,3±12,2 | 0,702 | |
Продолжительность СД, годы, M±SD | 8,6±5,9 | - | - | |
ИБС | n, % | 23 (63,9) | 13 (39,4) | 0,036* |
Периферический атеросклероз | 34 (94,4) | 23 (69,7) | 0,008* | |
Дислипидемия | 36 (100) | 31 (93,9) | 0,225 | |
Абдоминальное ожирение | 30 (83,3) | 25 (75,8) | 0,315 | |
ИСАГ | (48,6) | (23,3) | 0,043* | |
ГЛЖ | 32 (88,9) | 28 (84,9) | 0,443 | |
ИММ ЛЖ, г/м2, M±SD | 126,9±23,7 | 125,3±29 | 0,803 | |
ФВ ЛЖ, %, M±SD | 66,9±5,38 | 65,4±5,07 | 0,242 | |
Офисное САД/ДАД, мм рт.ст., M±SD | 172,1±17,3/89,8±16,4 | 165,5±19,7/95,9±11,7 | 0,143/0,083 | |
Офисная ЧСС, уд/мин | 71±10,5 | 69±9,7 | 0,414 | |
САД/ДАД-24, мм рт.ст., M±SD | 158,6±15,2/79,8±12,7 | 159,2±13,8/89,6±10,9 | 0,859/0,001* | |
Пульсовое АД-24, мм рт.ст., M±SD | 78,5±12,2 | 69,1±12 | 0,003* | |
HbA1c, %, M±SD | 7,2±1,2 | 5,3±0,7 | 0,003* | |
Базальная гликемия, ммоль/л, M±SD | 8,6±2,3 | 6,1±0,5 | 0,001* | |
рСКФ, мл/мин/1,73 м2, M±SD | 70,8±22,2 | 76,6±13,6 | 0,195 | |
Кол-во антигипертензивных препаратов, M±SD | 4,5±1 | 4,1±0,9 | 0,060 | |
•Бета-блокаторы | n, % | 28 (77,8) | 26 (78,8) | 0,576 |
•Блокаторы РААС | 35 (97,2) | 33 (100) | 0,522 | |
•Диуретики | 35 (97,2) | 30 (90,1) | 0,275 | |
•Антагонисты кальция | 30 (83,3) | 22 (66,7) | 0,092 | |
Терапия СД | ||||
•ИТ + метформин | n (%) | 14 (38) | ||
•Монотерапия метформином | 10 (27,8) | |||
•Метформин + ПСМ | 7 (19,4) | |||
•Монотерапия ПСМ без метформина | 7 (19,4) | |||
•Диетотерапия | 2 (5,6) | |||
Статины, n (%) | 36 (100) | 13 (39,4) | 0,036* | |
Вместе с тем, больные РАГ в сочетании с СД2 отличались от больных РАГ без СД более высокой частотой коронарного и периферического атеросклероза, а также изолированной систолической АГ (ИСАГ). Несмотря на тенденцию к использованию большего количества антигипертензивных препаратов пациентами группы РАГ+СД2 (p=0,06), показатели суточного профиля АД были сопоставимы, за исключением более низкого уровня диастолического АД (ДАД) и, соответственно, более высоких значений пульсового АД в сравнении с больными РАГ без СД. В обеих группах основу терапии составляли блокаторы ренин-ангиотензин-альдостероновой системы (РААС), бета-блокаторы и диуретики.
Основные результаты исследования
Частота ХСНсФВ у больных РАГ с СД2 была значимо выше, чем у лиц без СД (32 (88,9%) и 23 (69,7%), p=0,045), что являлось следствием более высокой частоты такого большого функционального критерия, как среднее E/e’≥15 (p=0,042) (рис. 1). Различия по частоте большого лабораторного критерия (МНУП >80 пг/мл), а также увеличения ИОЛП в категории больших и малых морфологических признаков имели характер тенденции. Частота других критериев ХСНсФВ была сопоставимой.
В соответствии с различиями по частоте среднего E/e’ ≥15, у пациентов с РАГ и СД2 средние значения e` lat были существенно ниже, а показатели Sep E/e`, Lat E/e` и E/e`, напротив, выше, чем у больных РАГ без СД (рис. 2).
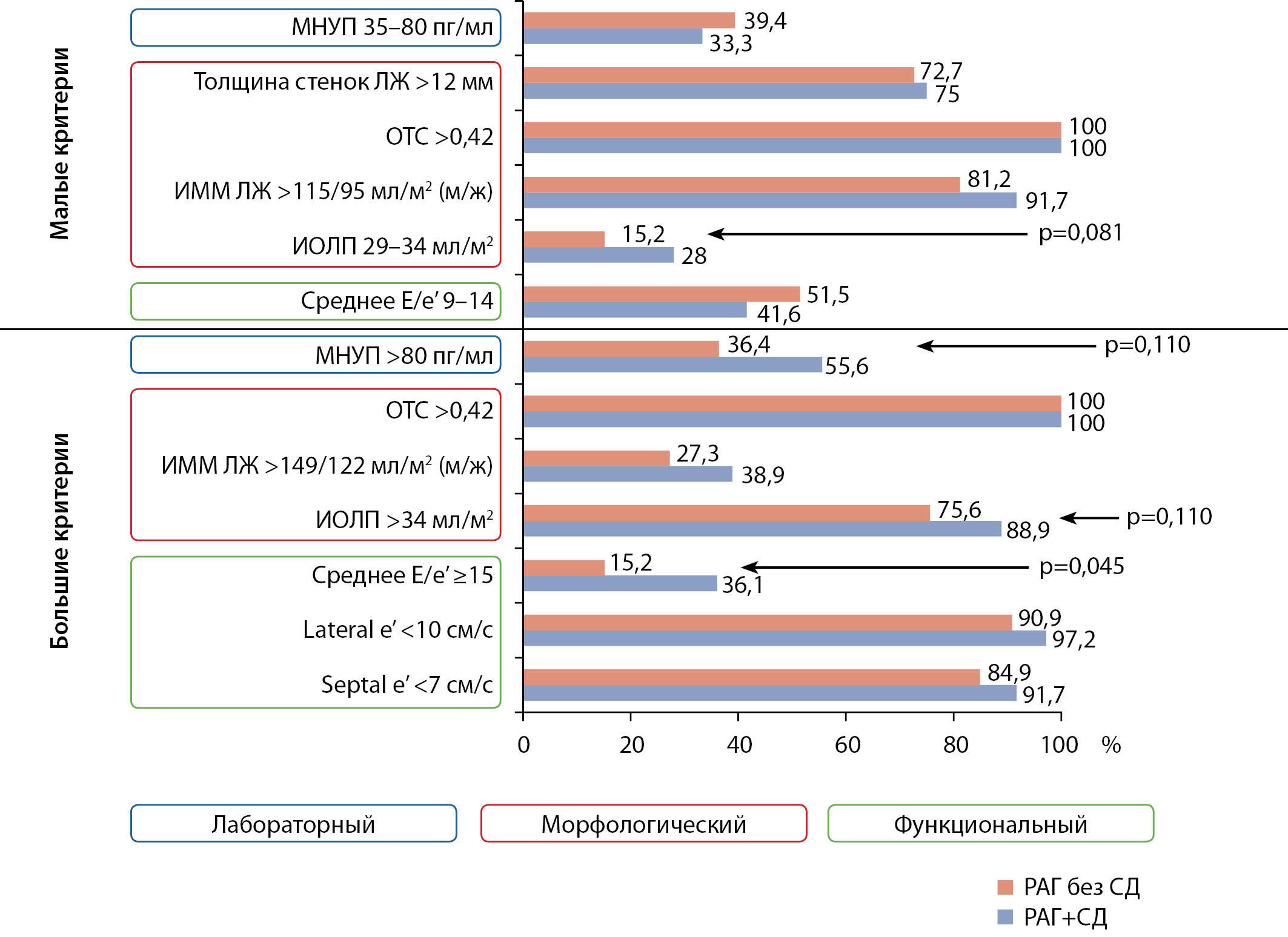
Рисунок 1. Частота больших и малых критериев хронической сердечной недостаточности с сохранной фракцией выброса у больных резистентной артериальной гипертензией с наличием и отсутствием сахарного диабета. Примечание: ИОЛП — индексированный объем левого предсердия (в систолу); ИММ ЛЖ — индекс массы миокарда левого желудочка; ОТС — относительная толщина стенки левого желудочка; МНУП — мозговой натрийуретический пептид.
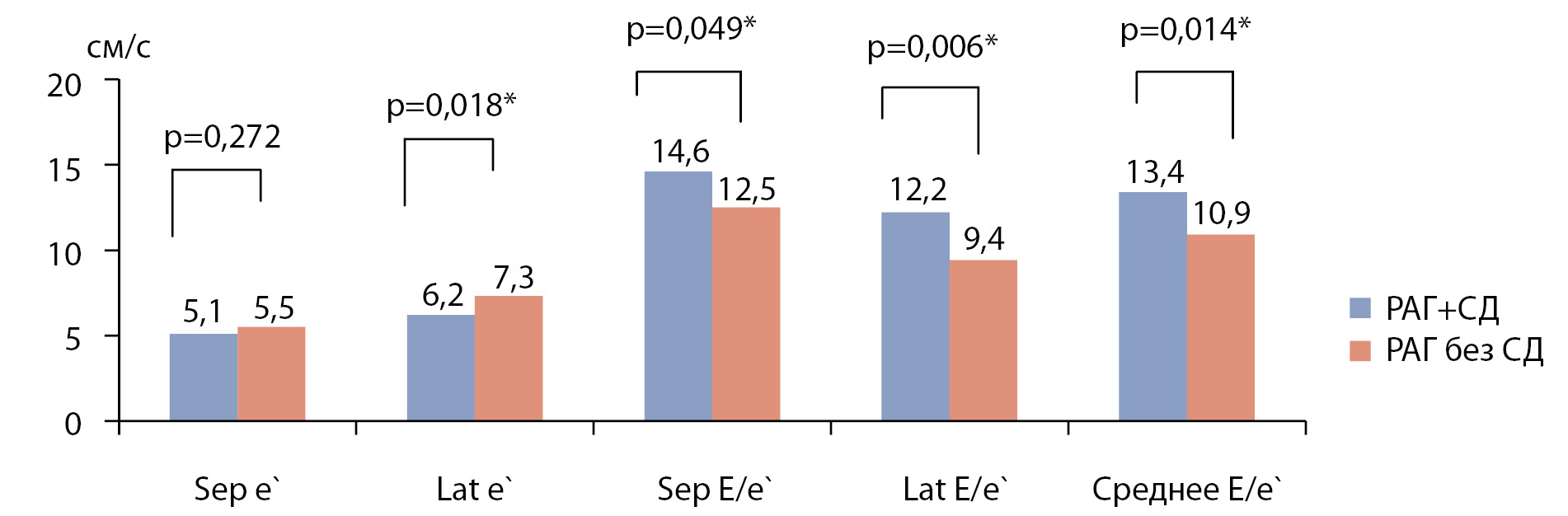
Рисунок 2. Показатели диастолической функции у больных резистентной артериальной гипертензией с наличием и отсутствием сахарного диабета. Примечания: Sep e` и Lat e` — ранняя диастолическая скорость септальной и латеральной створок фиброзного кольца митрального клапана, Е — скорость трансмитрального кровотока в фазу диастолического наполнения; t-критерий Стьюдента.* — статистически значимые различия.
В целом ДД имела место у подавляющего большинства больных обеих групп (100% в группе с СД2 и 97% — в группе без СД). Тем не менее частота ДД 2-го типа в группе больных с СД была незначимо выше, чем у больных РАГ без СД (55,6% против 33,3%; p=0,065).
Принимая во внимание то, что в патофизиологии повышения миокардиальной жесткости существенную роль играет увеличение уровня альдостерона, а также дисбаланс в системе ММП и их ингибиторов, мы сравнили эти показатели у больных РАГ с наличием и отсутствием СД. Как видно из таблицы 3, существенных различий нейрогормонального профиля, уровня МНУП и маркеров фиброза выявлено не было, тем не менее уровень ТИМП-1 и соотношение ТИМП-1/ММП-2 у больных СД2 было незначимо выше, чем у пациентов с РАГ без СД (p=0,060). Кроме того, средние значения ФНО-α у больных РАГ с СД2 были существенно больше, чем в группе РАГ без СД, несмотря на сопоставимый уровень вчСРБ.
Таблица 3. Показатели лабораторных тестов у больных резистентной артериальной гипертензией с наличием и отсутствием сахарного диабета
Показатели | РАГ+СД2 (n=36) | РАГ (n=33) | P |
Альдостерон, пг/мл, M±SD | 217,2±68,9 | 196±110,9 | 0,458 |
TИMП-1, нг/мл, M±SD | 560±226 | 427,6±261,1 | 0,083 |
ММП-9, нг/мл, M±SD | 366,9±247,6 | 378,6±249,9 | 0,895 |
ММП-2, нг/мл, M±SD | 260,3±75,8 | 266,8±59,5 | 0,752 |
TИMП-1/ММП-9, M±SD | 2,1±1,8 | 1,3±0,9 | 0,121 |
TИMП-1/ММП-2, M±SD | 2,1±0,9 | 1,5±1,1 | 0,060* |
МНУП, пг/мл, M±SD | 95,1±56,8 | 71,9±54,6 | 0,245 |
вчСРБ, мг/л, M±SD | 4,9±4 | 4,3±3 | 0,567 |
ФНО-α, пг/мл, Me [ 25%; 75% ] | 6,9 [ 2,0;7,8 ] | 1,3 [ 0,9;1,6 ] | 0,001* |
Учитывая патогенетическую связь нарушения диастолической функции с атеросклерозом коронарных и периферических артерий, частота которого у больных СД2 была существенно выше, чем у лиц без СД, мы сравнили показатели отношения E/e’ у лиц с подтвержденным атеросклерозом в зависимости от наличия и отсутствия СД. По результатам такого сравнения различия средних значений E/e’ у больных с наличием и отсутствием СД сохранялись (15,3±4,7 и 11,9±3,4 соответственно; p=0,035). Кроме того, межгрупповые различия продолжали быть значимыми и в отношении ФНО-α (5,6 [ 2,4; 7,6 ] для больных с СД2 и 1,3 [ 1,0; 1,6 ] пг/мл для лиц без СД; p<0,001).
В дальнейшем мы проанализировали, насколько выявленные межгрупповые различия гемодинамических и лабораторных показателей могли определять большую степень нарушения диастолической функции. По результатам корреляционного анализа, представленного в табл. 4, гемодинамические и биохимические маркеры сосудистой жесткости, наряду с выраженностью и длительностью нарушений углеводного обмена, имели взаимосвязи с большинством функциональных критериев ХСНсФВ по данным тканевой допплерографии. Так, ухудшение состояния показателей трансмитрального кровотока в виде уменьшения скорости движения фиброзного кольца митрального клапана (e`) и увеличения среднего соотношения E/e’ было напрямую взаимосвязано с уровнем HbA1c, длительностью СД2, значениями пульсового АД. Однако интересен тот факт, что связь ухудшения указанных показателей трансмитрального кровотока с уровнем ММП-9, ТИМП-1 и соотношением ТИМП-1/ММП-2 носила обратный характер.
Таблица 4. Корреляционные связи функциональных критериев хронической сердечной недостаточности с сохранной фракцией выброса с клиническими и лабораторными данными у больных резистентной артериальной гипертензией с сахарным диабетом 2 типа
Клинико-лабораторные данные | Показатели диастолической дисфункции | |
АД | ДАД | e` sept (R=-0,50; p=0,002) |
ПАД | ср. E/e’ (R=0,35; p=0,037) | |
Вариабельность ПАД | e` sept (R=- 0,38; p=0,026); ср. E/e` (R=0,42; p=0,012) | |
СД | HbA1c, % | e` sept (R=-0,37; p=0,046) |
Длительность СД, годы | e` lat (R=-0,38; p=0,023); ср. E/e’ (R=0,46; p=0,005) | |
Маркеры фиброза | ТИМП-1 | ср. E/e` (R=-0,46; p=0,031) |
ТИМП-1/ММП-2 | ср. E/e ` (R=-0,46; p=0,028) | |
ММП-9 | e` lat (R=0,52; p=0,007); e` sept (R=0,52; p=0,008); ср. E/e (R=-0,48; p=0,016) | |
Прямых взаимосвязей уровня ФНО-α с показателями трансмитрального кровотока выявлено не было. Тем не менее, согласно данным, представленным в табл. 5, повышение уровня этого показателя, наряду с увеличением концентрации биомаркеров фиброза и ростом пульсового АД, ассоциировалось с псевдонормализацией диастолической функции.
Таблица 5. Значимые отличия клинико-лабораторных показателей в зависимости от типа диастолической дисфункции среди больных резистентной артериальной гипертензией с сахарным диабетом 2 типа
Показатели | ДД 1-го типа | ДД 2-го типа | P |
Пульсовое АД-24, мм рт.ст. | 74,1±13,5 | 83,2±11,1 | 0,034* |
Вариабельность ПАД, мм рт.ст. | 12±2,9 | 14,3±3,4 | 0,041* |
ФНО-α, пг/мл | 3,6±3,4 | 6,9±2,4 | 0,015* |
ММП-2, нг/мл | 210,8±48,9 | 318,3±90,1 | 0,002* |
ТИМП-1/ММП-2 | 3,1±1,4 | 1,8±0,8 | 0,009* |
Таким образом, прогрессивное развитие ДД и ХСНсФВ у больных РАГ в сочетании с СД2 по сравнению с лицами без СД могло быть следствием более выраженных сосудистых изменений в виде атеросклероза и повышения жесткости, а также более высокой степени низкоинтенсивного воспаления и профибротической активности.
ОБСУЖДЕНИЕ
Представленная работа стала одной из первых, проанализировавших особенности ХСНсФВ и ее взаимосвязь с лабораторно-инструментальными и клиническими данными у селективной группы больных с РАГ в сочетании с СД2. Согласно полученным данным, распространенность ХСНсФВ у этой категории больных оказалась достаточно высокой и составила 89%. Частота ХСНсФВ у больных СД превышала таковую у лиц без СД, несмотря на сопоставимо высокую частоту ДД в обеих группах (100 и 97% соответственно). Наибольший вклад в такое различие вносили функциональные критерии в виде более выраженных нарушений трансмитрального кровотока, тогда как различия по структурным и биомаркерным критериям не достигали критериев значимости.
Частота повышения МНУП у больных обеих групп была небольшой, и уровень МНУП >80 пг/мл определялся у чуть более половины больных СД2 и около трети больных без СД. Наши данные соответствуют результатам Ю.В. Мареева и соавт., согласно которым повышенный уровень МНУП у больных с ХСНсФВ определялся лишь в 45% случаев [19]. Ранее в работе Reddy Y.N.V. и соавт. было показано, что до 20% пациентов с инвазивно подтвержденной ХСНсФВ имеют нормальный уровень МНУП [9]. Таким образом, нормальный уровень этого пептида не исключает наличие ХСНсФВ, особенно при наличии ожирения [20], поскольку жировая ткань синтезирует рецепторы к НУП, после связывания с которыми НУП поглощается жировой клеткой и подвергается протеолизу [21]. В этой связи следует отметить, что в нашем исследовании ожирение присутствовало у подавляющего большинства пациентов.
Как известно, ДД развивается вследствие нарушения релаксации, снижения диастолической растяжимости и нарушения наполнения [12]. Нарушение релаксации может быть результатом любого процесса, который влияет на удаление кальция из цитозоля и разъединение актино-миозинового мостика, являющегося энергозатратным процессом, тогда как снижение растяжимости камеры ЛЖ может быть связано с изменениями в составе миокарда, включая интерстициальный фиброз, изменения фосфорилирования титина и увеличение содержания микротрубочек в кардиомиоцитах [12].
Причинами повышения частоты ХСНсФВ при СД могли быть более высокая встречаемость коронарного атеросклероза [1], изолированной систолической гипертензии и повышение пульсового АД, которое служит гемодинамическим маркером сосудистой жесткости и тесно связано с диастолической функцией сердца [22].
В настоящее время одними из самых важных индикаторов ХСНсФВ являются повышение отношения E/e` и увеличение объема левого предсердия, которые коррелируют с давлением наполнения левого желудочка [9]. Согласно нашим данным, повышение отношения E/e` и снижение e`, относящиеся к большим функциональным критериям ХСНсФВ, коррелировали с выраженностью и продолжительностью нарушений углеводного обмена, гемодинамическими и лабораторными маркерами сосудистой жесткости. Поскольку указанные показатели значимо отличались между двумя сравниваемыми группами больных с РАГ, возможно предположить, что именно эти факторы в значительной степени определяли повышение частоты ХСНсФВ у больных СД2.
Профиброгенная роль гипергликемии достаточно хорошо изучена и опосредована влиянием инсулина на процессы коллагенообразования [23], действием продуктов гликирования и окислительного стресса на структуру стенки миокарда и сосудов [24]. Конечные продукты гликирования активируют сигнальные системы, участвующие в иммуновоспалительных реакциях, апоптозе, пролиферации и миграции клеток, а также усиливают связи молекул коллагена между собой, делая их устойчивыми к действию металлопротеиназ. Исходом этих процессов служит снижение растяжимости миокарда. Крайне важно и то, что при СД отмечается снижение энергетического обеспечения миокарда вследствие нарушения работы саркоплазматического ретикулума, а также микроциркуляторных расстройств, что приводит к нарушению релаксации. Независимая от атерогенеза значимость гипергликемии в отношении повышения миокардиальной жесткости и нарушения процессов релаксации была подтверждена результатами сравнения соотношения E/e’ у лиц с атеросклерозом в зависимости от наличия и отсутствия СД.
Структурная прочность миокарда обеспечивается экстрацеллюлярным матриксом, который также служит резервуаром для цитокинов, факторов роста и иных белков [25]. Содержание коллагена в экстрацеллюлярном матриксе регулируется ММП и их тканевыми ингибиторами, синтезируемыми кардиомиоцитами, фибробластами и макрофагами. В физиологических условиях система ММП уравновешивается их ингибиторами, однако при патологических состояниях это равновесие может смещаться в ту или иную сторону. Так, по данным Д.А. Лебедева и соавт., для больных СД с ХСНсФВ было характерно снижение антифибротических процессов в виде уменьшения продукции ММП-2 и -9 и повышения образования ТИМП-1 [26]. По результатам нашей работы, соотношение TИMП-1/ММП-2 у больных РАГ с СД2 было статистически значимо выше, чем у лиц без СД, что также отражает уменьшение катаболизма компонентов внеклеточного матрикса и формирование биохимической основы для фиброза. Следует отметить, что повышение жесткости при РАГ зачастую носит адаптивный характер и направлено на повышение устойчивости стенок сердца и сосудов к длительной гемодинамической нагрузке. Однако со временем эти изменения ухудшают кровоснабжение органов-мишеней и могут сместить равновесие в сторону повышения продукции ММП. В связи с этим следует отметить обнаруженные нами более высокие значения ММП-2 у больных с ДД 2 типа, что может носить компенсаторный характер с целью подавления фиброгенеза. Вместе с тем взаимосвязи ММП с диастолической функцией у больных РАГ в сочетании с СД2 остаются малоизученными, и однозначная интерпретация полученных нами результатов достаточно сложна. Тем не менее в целом наши данные могут демонстрировать напряжение системы протеолитических ферментов как одного из адаптивных процессов, направленных на коррекцию повышенной миокардиальной жесткости. В выполненной нами ранее работе повышение уровня ММП-9 и уменьшение соотношения ТИМП-1/ММП-9 у больных РАГ, ассоциированной с СД2, сопровождалось улучшением внутрипочечного кровотока и фильтрационной функции почек, что согласуется с высказанным предположением и подтверждает адаптивный характер изменения уровня данных биомаркеров [27].
Прямой зависимости маркеров воспаления с показателями ДД нами выявлено не было. Вместе с тем уровень ФНО-α у больных РАГ с СД2 оказался существенно выше, чем у лиц без СД. Это различие может быть следствием активирующего влияния гипергликемии на активность низкоинтенсивного воспаления [23][28], исходом которого служит фиброз. Следует отметить, что воспалительная концепция патогенеза ХСНсФВ в последние годы получает все больше подтверждений [29], а само воспаление рассматривается как новая терапевтическая мишень. В представленной работе «псевдонормализация» диастолической функции как показатель ее прогрессирующего ухудшения ассоциировалась не только с более высокими значениями пульсового АД и концентрации ММП-2, но и с повышением уровня ФНО-α, что вполне соответствует этой концепции.
Ограничения исследования
Наше исследование было ограничено оценкой приверженности к лечению по данным опроса и небольшим количеством больных.
Предметом будущих работ могут стать исследования на большей выборке больных, сравнение клинического и биомаркерного профиля больных ХСНсФВ с различной степенью нарушений углеводного обмена. Представляется перспективной оценка влияния на течение ХСНсФВ противовоспалительной и иной таргетной терапии с воздействием на конечные продукты гликозилирования и маркеры фиброза. Кроме того, учитывая значимую роль симпатической гиперактивации в генезе РАГ и ХСН, в дальнейших исследованиях нуждается изучение возможностей эффективности эндоваскулярного симпатолитического лечения ХСНсФВ, показавшего свою антигипертензивную эффективность [30].
ЗАКЛЮЧЕНИЕ
Таким образом, ХСНсФВ встречается у подавляющего большинства больных РАГ в сочетании с СД2, а ее частота значимо превышает таковую у пациентов с РАГ без СД. Более прогрессивное развитие ХСНсФВ при СД2 определяется большей выраженностью ДД, в развитии которой существенная роль принадлежит не только метаболическим нарушениям, но и повышению активности хронического субклинического воспаления, профибротическому состоянию и большей выраженности сосудистых изменений в виде атеросклероза и повышения артериальной жесткости.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Финансирование. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-315-90068 и Гос. задания НИИК Томского НИМЦ, гос. регистрация: АААА-А15-115123110026-3 от 31.12.2015.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Манукян М.А. — сбор и обработка материалов, анализ полученных данных, написание текста; Фальковская А.Ю. — концепция и дизайн исследования, анализ полученных данных, написание текста; Мордовин В.Ф. — концепция и дизайн исследования, консультативная помощь, проверка критически важного интеллектуального содержания; Рябова Т.Р. — сбор и обработка материалов эхокардиографического исследования, проверка критически важного интеллектуального содержания; Зюбанова И.В. — сбор и обработка материалов, проверка критически важного интеллектуального содержания; Гусакова А.М. — сбор и обработка материалов лабораторных тестов, проверка критически важного интеллектуального содержания; Суслова Т.Е. — сбор и обработка материалов лабораторных тестов, проверка критически важного интеллектуального содержания. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН-РКО-РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. // Кардиология. – 2018. – Т.58. –№6S. –С. 8-158. doi:https://doi.org/10.18087 / cardio. 2475
2. Shah KS, Xu H, Matsouaka RA, Bhatt DL. et al. Heart failure with preserved, borderline, and reduced ejection fraction: 5-year outcomes. J Am Coll Cardiol 2017;70:2476–86. doi:https://doi.org/10.1016/j.jacc.2017.08.074
3. Dunlay S M , Roger V L , Redfield MM. Epidemiology of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2017; 14(10):591-602
4. Rimoldi SF, Messerli FH, Bangalore S, Scherrer U. Resistant hypertension: what the cardiologist needs to know. Eur Heart J. 2015; 36(40): 2686–2695. doi:https://doi.org/10.1093/eurheartj/ehv392
5. Кобалава Ж.Д., Ешниязов Н.Б., Медовщиков В.В., Хасанова Э.Р. Сахарный диабет 2-го типа и сердечная недостаточность: инновационные возможности управления прогнозом. Кардиология. 2019;59(4):76–87.doi:https://doi.org/10.18087/cardio.2019.4.10253
6. Johansson I, Dahlström U, Edner M et al. Type 2 diabetes and heart failure: Characteristics and prognosis in preserved, mid-range and reduced ventricular function. Diab Vasc Dis Res. 2018;15(6):494-503. doi:https://doi.org/10.1177/1479164118794619
7. Дедов И.И., Шестакова М.В., Викулова О.К., Железнякова А.В., Исаков М.А. Сахарный диабет в Российской Федерации: распространенность, заболеваемость, смертность, параметры углеводного обмена и структура сахароснижающей терапии по данным Федерального регистра сахарного диабета, статус 2017 г. // Сахарный диабет. – 2018. – Т. 21. – №3. – С. 144-159. doi:https://doi.org/10.14341/DM9686
8. Гаврюшина С.В., Агеев Ф.Т. Сердечная недостаточность с сохраненной фракцией выброса левого желудочка: эпидемиология, «портрет» больного, клиника, диагностика //Кардиология. – 2018. – Т. 58. – №. 4S. – С. 55-64. doi:https://doi.org/10.18087 / cardio. 2467.
9. Reddy YNV, Carter RE, Obokata et al. A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction. Circulation. 2018; 138, 861–870 DOI: 10.1161/CIRCULATIONAHA.118.034646.
10. Драпкина О.М., Джиоева О.Н. Современные эхокардиографические критерии сердечной недостаточности с сохраненной фракцией выброса: не только диастолическая дисфункция // Кардиоваскулярная терапия и профилактика. – 2020. – Т. 19. – №. 2.doi:https://doi.org/10.15829/1728-8800-2020-2454.
11. Pieske B, Tschöpe C, Boer RA et al. How to diagnose heart failure with preserved ejection fraction: the HFA–PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur Heart J. 2019; 40: 3297–3317. doi:https://doi.org/10.1093/eurheartj/ehz641
12. Nadruz W, Shah AM., Solomon SD. Diastolic Dysfunction and Hypertension. Surg Clin North Am2017;101(1): 7–17. https: //doi.org/10.1016/j.mcna.2016.08.013.
13. Murarka S, Movahed MR. Diabetic cardiomyopathy. J Card Fail. 2010;16:971–9.
14. Kosmala W, Marwick T H. Asymptomatic Left Ventricular Diastolic Dysfunction: Predicting Progression to Symptomatic Heart Failure. JACC Cardiovasc Imaging. 2018; 13(1 Pt 2):215–227. doi:https://doi.org/10.1016/j.jcmg.2018.10.039
15. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:https://doi.org/10.15829/1560-4071-2020-3-3786
16. Lang RM, Badano LP, Mor-Avi V et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3): 233-271. doi:https://doi.org/10.1093/ehjci/jev014.
17. Nagueh SF., Appleton CP., Gillebert TC. et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016; 17(12):1321-1360. doi:https://doi.org/10.1093/ehjci/jew082
18. Naqvi TZ. Diastolic function assessment incorporating new techniques in Doppler echocardiography. Rev Cardiovasc Med. 2003 Spring;4(2):81-99. PMID: 12776017.
19. Мареев Ю.В., Гарганеева А.А., Тукиш О.В. и др. Сложности в диагностике сердечной недостаточности с сохраненной фракцией выброса в реальной клинической практике: диссонанс между клиникой, эхокардиографическими изменениями, величиной атрийуретических пептидов и шкалой H2FPEF. Кардиология. 2019;59(12S):37-45. doi:https://doi.org/10.18087/cardio.n695
20. Buckley LF, Canada JM, Del Buono MG et al. Low NT-proBNP levels in overweight and obese patients do not rule out a diagnosis of heart failure with preserved ejection fraction. ESC Heart Fail 2018;5:372–378
21. Pivovarova O., Gögebakan Ö., Klöting N. et al. Insulin up-regulates natriuretic peptide clearance receptor expression in the subcutaneous fat depot in obese subjects: a missing link between CVD risk and obesity? J Clin Endocrinol Metab 2012; 97(5): E731-9
22. Kaess BM, Rong J, Larson MG et al. Relations of central hemodynamics and aortic stiffness with left ventricular structure and function: the Framingham Heart Study. J Am Heart Assoc 2016;4:e002693. doi:https://doi.org/10.1161/JAHA.115.002693
23. Салухов В.В., Халимов Ю.Ш., Шустов С. Б., Кадин Д. В. Снижение кардиоваскулярного риска у пациентов с сахарным диабетом 2 типа: обзор основных стратегий и клинических исследований. //Сахарный диабет. – 2018. – Т. 21. – №. 3. –С. 193-205.doi:https://doi.org/10.14341/DM9570
24. Шевцова А.И. Конечные продукты гликирования и их рецепторы при сердечно-сосудистых заболеваниях / А. И. Шевцова, В. А. Ткаченко // Журнал Гродненского государственного медицинского университета. – 2019. – Т. 17. – № 1. – С. 11–16.doi:https://doi.org/10.25298/2221-8785-2019-17-1-11-106.
25. Гриценко О.В., Чумакова Г.А., Шевляков И.В. и др. Внеклеточный матрикс сердца и его изменения при фиброзе миокарда / // Кардиология. – 2020. – Т. 60, № 6. – С.107–112. doi:https://doi.org/10.18087/cardio.2020.6.n773
26. Лебедев Д. А., Лясникова Е.А., Васильева А.А. и др. (2020). Молекулярный биомаркерный профиль хронической сердечной недостаточности с промежуточной и сохраненной фракцией выброса левого желудочка на фоне сахарного диабета 2 типа. /Российский кардиологический журнал. – 2020. – №. 10. doi:https://doi.org/10.18087/cardio.2020.6.n773
27. Фальковская А. Ю., Мордовин В. Ф., Пекарский С. Е. и др. Система матриксных металлопротеиназ у больных резистентной артериальной гипертензией, ассоциированной с сахарным диабетом 2-го типа: связь с состоянием почечного кровотока и функцией почек / // Артериальная гипертензия. – 2019. – Т. 25. – № 1. – С. 34–45. doi:https://doi.org/10.18705/1607-419X-2019-25-1-34-45.
28. Yuan T, Yang T, Chen H et al. New insights into oxidative stress and inflammation during diabetes mellitus-accelerated atherosclerosis. Redox biology. 2019; 20:247-260. doi:https://doi.org/10.1016/j.redox.2018.09.025
29. Mocan M, Mocan Hognogi LD, Anton FP et al. Biomarkers of inflammation in left ventricular diastolic dysfunction. Dis Markers. 2019 Article ID 7583690, 14 pages. doi:https://doi.org/10.1155/2019/7583690.
30. Зюбанова И.В., Мордовин В.Ф., Фальковская А.Ю., Пекарский С.Е. Изменения показателей суточного мониторирования артериального давления под влиянием ренальной денервации в течение 12-месячного наблюдения. Сибирский медицинский журнал (г. Томск). 2015. Т. 30. № 3. С. 41-44.
Об авторах
М. А. МанукянРоссия
Манукян Мушег Айкович, аспирант [Musheg A. Manukyan, Graduate student]
634012, Томск, ул. Киевская, д. 111а
eLibrary SPIN: 3993-1733
А. Ю. Фальковская
Россия
Фальковская Алла Юрьевна, к.м.н.
eLibrary SPIN: 1418-2726
Томск
В. Ф. Мордовин
Россия
Мордовин Виктор Федорович, д.м.н., профессор
eLibrary SPIN: 4948-0425
Томск
Т. Р. Рябова
Россия
Рябова Тамара Ростиславовна, к.м.н.
eLibrary SPIN: 2742-1245
Томск
И. В. Зюбанова
Россия
Зюбанова Ирина Владимировна, к.м.н.
eLibrary SPIN: 9032-8376
Томск
А. М. Гусакова
Россия
Гусакова Анна Михайловна, к.ф.н.
eLibrary SPIN: 6513-2800
Томск
Т. Е. Суслова
Россия
Суслова Татьяна Евгеньевна, к.м.н.
eLibrary SPIN: 6513-2800
Томск
Дополнительные файлы
|
|
1. Рисунок 1. Частота больших и малых критериев хронической сердечной недостаточности с сохранной фракцией выброса у больных резистентной артериальной гипертензией с наличием и отсутствием сахарного диабета | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(407KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Показатели диастолической функции у больных резистентной артериальной гипертензией с наличием и отсутствием сахарного диабета. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(105KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Манукян М.А., Фальковская А.Ю., Мордовин В.Ф., Рябова Т.Р., Зюбанова И.В., Гусакова А.М., Суслова Т.Е. Особенности хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных резистентной артериальной гипертонией в сочетании с сахарным диабетом 2-го типа. Сахарный диабет. 2021;24(4):304-314. https://doi.org/10.14341/DM12732
For citation:
Manukyan M.A., Falkovskaya A.Y., Mordovin V.F., Ryabova T.R., Zyubanova I.V., Gusakova A.M., Suslova T.E. Features of heart failure with preserved ejection fraction (HFpEF) in diabetic patients with resistant hypertension. Diabetes mellitus. 2021;24(4):304-314. (In Russ.) https://doi.org/10.14341/DM12732
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































