Перейти к:
Маркеры воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии у пациентов с длительным течением сахарного диабета 1 типа
https://doi.org/10.14341/DM13332
Аннотация
ОБОСНОВАНИЕ. Комплексная оценка биомаркеров системного воспаления у пациентов с длительным течением сахарного диабета 1 типа (СД1), сопровождающегося кардиальной и почечной патологиями, может позволить стратифицировать пациентов по уровню воспалительной активности и помочь в поиске новых терапевтических возможностей профилактики и лечения.
ЦЕЛЬ. Оценить маркеры воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии у пациентов с длительным течением СД1 (≥20 лет).
МАТЕРИАЛЫ И МЕТОДЫ. Исследование состояло из 2-х этапов. В рамках первого этапа было проведено одноцентровое одномоментное исследование 133 пациентов. Из них 87 пациентов, у которых были доступны данные 10-летней давности, были включены во второй этап исследования с динамической оценкой показателей. Все пациенты проходили обследование и лечение в ФГБУ «НМИЦ эндокринологии» Минздрава России с 2011 по 2024 гг. Пациенты были распределены на несколько групп: без хронической болезни почек (ХБП) и с ХБП на разных стадиях. Помимо стандартных лабораторных показателей, исследованы уровни матриксной металлопротеиназы-9 (ММР-9), мозгового натрийуретического гормона (Na-рroBNP), трансформирующего фактора роста бета-1 (TGF-β1), асимметричного диметиларгинина (ADMA), моноцитарного хемотаксического фактора-1 (MCP-1), остеопонтина, рецепторов фактора некроза опухоли 1 (TNFRSF1A) и 2 (TNFRSF1B) типов, цистатина С в крови, нефрина, подоцина в моче с использованием коммерческих наборов в соответствии с рекомендациями производителей.
РЕЗУЛЬТАТЫ. Сохранная функция почек согласно критериям ХБП наблюдалась у 43,2% пациентов (n=54), остальные находились на различных стадиях ХБП. У лиц с ХБП отмечалось повышение уровней ADMA (Р<0,005), TNFRSF1A и TNFRSF1В (Р<0,001) и снижение уровня TGF-β1 (Р<0,006) по сравнению с лицами без ХБП. В группе динамического контроля (n=87) обнаружены статистически значимое повышение уровня TGF-β1, нефрина, подоцина, снижение расчетной скорости клубочковой фильтрации (рСКФ) (Р<0,001) в течение периода наблюдения на фоне прогрессирования ХБП и ССЗ. В этой же группе определена обратная корреляционная связь (сильная и заметная) рСКФ с TNFRSF1A и TNFRSF1В, ADMA. Исходя из значений регрессионных коэффициентов, рСКФ имела обратную связь с развитием хронической сердечной недостаточности (ХСН), подоцин — положительную с острым повреждением почек (ОПП). При повышении рСКФ на 1 мл/мин/1,73 м2 уменьшается шанс развития ХСН в 1,12 раза (95% ДИ: 1,02; 1,22, Р=0,015). Увеличение подоцина на 1 нг/мл ассоциировано с повышением эпизодов ОПП в 1,43 раза (95% ДИ: 1,01; 2,03), Р=0,047.
ЗАКЛЮЧЕНИЕ. У лиц с длительным анамнезом СД1 определена значимая роль факторов эндотелиальной дисфункции, воспаления и фиброза, подоцитопатии в развитии и прогрессировании ХБП c вовлечением в патологический процесс сердечно-сосудистой системы.
Ключевые слова
Для цитирования:
Евлоева М.И., Арутюнова М.С., Никанкина Л.В., Слепцова А.И., Науменко О.Н., Зураева З.Т., Северина А.С., Трубицына Н.П., Шамхалова М.Ш., Шестакова М.В. Маркеры воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии у пациентов с длительным течением сахарного диабета 1 типа. Сахарный диабет. 2025;28(2):151-163. https://doi.org/10.14341/DM13332
For citation:
Yevloyeva M.I., Arutyunova M.S., Nikankina L.V., Sleptsova A.I., Naumenko O.N., Zuraeva Z.T., Severina A.S., Trubitsyna N.P., Shamkhalova M.S., Shestakova М.V. Markers of inflammation, fibrosis, endothelial dysfunction, and podocytopathy in patients with long-term type 1 diabetes mellitus. Diabetes mellitus. 2025;28(2):151-163. (In Russ.) https://doi.org/10.14341/DM13332
ВВЕДЕНИЕ
Ранняя манифестация сахарного диабета 1 типа (СД1) способствует развитию тяжелых сосудистых осложнений, что существенно снижает качество и продолжительность жизни пациентов в период профессиональной и социальной активности, когда человек достигает пика физической и умственной работоспособности, а также занимает ключевые позиции в обществе [1].
Диабетическая нефропатия (ДН) в рамках хронической болезни почек (ХБП) занимает 3 место среди прочих поздних осложнений СД в Российской Федерации (РФ) (до 20–30%) с увеличением с 21,5 до 27,1% (в 1,3 раза) за период 2010–2022 гг. у взрослых пациентов с СД1 [2]. Пациенты с СД1 и почечной патологией подвержены высокому риску развития терминальной ХБП (тХБП) и сердечно-сосудистых заболеваний (ССЗ). Именно ССЗ, по данным Базы клинико-эпидемиологического мониторинга СД, на территории РФ являются основными причинами смерти пациентов с СД1 (38,6%) [3]. Смертность от всех причин у лиц с ДН примерно в 30 раз выше, чем у пациентов с диабетом без нефропатии, и подавляющее большинство пациентов с ДН умирает от ССЗ до достижения тХБП [4].
Патологическое взаимодействие между почечной и сердечной дисфункцией при СД1, классифицируемое как нефрокардиальный синдром, требует тонкого понимания механизмов, общих для повреждений обеих систем. Развитие и прогрессирование ХБП и ССЗ при диабете обусловлено метаболическими и гемодинамическими факторами, нейрогормональной активностью, эндотелиальной дисфункцией, окислительным стрессом (ОС), активацией воспалительных и профиброзных путей, митохондриальной дисфункцией, стрессом эндоплазматического ретикулума, нарушением регуляции генов. Эти процессы взаимодействуют друг с другом в патологическом прямом цикле, в итоге приводя к функциональным и структурным аномалиям почек и сердечно-сосудистой системы (ССС).
Текущее лечение пациентов с СД1 и ХБП сосредоточено на контроле гликемии, ингибировании ренин-ангиотензин-альдостероновой системы (РААС) и контроле факторов риска, включая артериальное давление (АД), дислипидемию, избыточный вес. Выявление специфических биомаркеров и новых механизмов, основанных на конкретных мишенях, имеют решающее значение для разработки подходов точной медицины к лечению и профилактике ХБП и ССЗ у лиц с СД1.
Убедительные данные указывают на то, что субклиническое хроническое воспаление играет ключевую роль в развитии и прогрессировании ДН. Протеомное профилирование циркулирующих белков у субъектов из трех независимых когорт с СД1 и СД2 выявило чрезвычайно сильную воспалительную характеристику, состоящую из 17 белков, обогащенных членами суперсемейства рецепторов фактора некроза опухоли (TNF), что было связано с 10-летним риском тХБП [5].
Воспалительная среда может вызывать и прямое повреждение кардиомиоцитов, что приводит к дисфункции миокарда. Кроме того, воспаление способствует формированию и прогрессированию атеросклероза, ключевого фактора развития ССЗ. Было описано несколько системных воспалительных биомаркеров, связанных с ССЗ, включая хроническую сердечную недостаточность (ХСН) [6]. В экспериментальных моделях СД1 показаны повышенная инфильтрация макрофагами, высокие уровни провоспалительных цитокинов ((фактора некроза опухоли α (TNF-α), интерлейкинов-1β и 6 (IL-1β и 6)), увеличение экспрессии молекулы адгезии, снижение активности разрушающей коллаген матриксной металлопротеиназы-9 (MMP-9), что приводило к профибротическим реакциям и ремоделированию сердца [6][7].
Наиболее важными провоспалительными цитокинами являются IL-6 и TNF-α, а основным фактором транскрипции, ответственным за инициирование провоспалительного ответа, является ядерный фактор транскрипции каппа-би (NF-kB), нисходящие эффекты которого являются провоспалительными через регуляцию моноцитарного хемотаксического фактора-1 (MCP-1), TNF- α и IL-6 [8]. В последнее время исследования, посвященные изучению ДН, расширяют ряд потенциальных маркеров ее развития и прогрессирования. Выделены рецепторы 1-го (TNFRSF1A) и 2-го типов (TNFRSF1B) фактора некроза опухоли, задействованных в процессах воспаления, пролиферации, дифференцировке, миграции клеток и индукции их гибели [9].
Фиброз почек — наиболее распространенный гистологический признак ХБП, характеризующийся повышенным накоплением компонентов внеклеточного матрикса (ВКМ) в интерстиции [10]. Подобные фиброзные изменения, реализуемые избыточным образованием активных форм кислорода (АФК), факторов роста, накоплением конечных продуктов гликирования (AGE), профибротическими цитокинами, также наблюдаются в тканях сердца, что приводит к диабетическому поражению миокарда [11].
Белковые компоненты подоцитарной щелевой диафрагмы (ЩД) широко изучены как биомаркеры заболеваний почек. Основными белками этой группы являются нефрин — трансмембранный белок, внеклеточный домен которого является компонентом ЩД, и подоцин-мембранно-ассоциированный белок, взаимодействующий с цитоплазматическим доменом нефрина и отвечающий за соединение нефрина с актиновым цитоскелетом подоцитов. В исследовании FinnDiane пациентов с СД1 и разной степенью альбуминурии [12] нефрин мочи определен как возможный прогностический маркер раннего поражения почечного барьера на доальбуминурической стадии, причем чаще у женщин, чем у мужчин (35% vs 19%, P=0,02).
Список биомаркеров почечных и сердечно-сосудистых повреждений у лиц с СД1 неумолимо нарастает. Интеграция новых биомаркеров в диагностику и лечение ХБП и связанных с ней ССЗ является многообещающей.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить уровни маркеров воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии у пациентов с длительным течением СД1 (≥20 лет).
МАТЕРИАЛЫ И МЕТОДЫ
Изучаемая популяция
Все участники исследования — пациенты с СД1 длительностью ≥20 лет.
Все пациенты проходили обследование и лечение в ФГБУ «НМИЦ эндокринологии» Минздрава России с 2011 по 2024 гг.
Пациенты были распределены на несколько групп: без ХБП и с ХБП на разных стадиях. Критерии диагностики ХБП: расчетная скорость клубочковой фильтрации (рСКФ)<60 мл/мин/1,73 м² (по формуле CKD-EPI) и/или повышение соотношения альбумин/креатинин в утренней разовой порции мочи до 3–30 мг/ммоль (30–300 мг/г) (А2) и >30 мг/ммоль (>300 мг/г) (А3) или альбумина в утренней разовой порции мочи 20–200 мг/л и >200 мг/л соответственно, или повышение скорости экскреции альбумина 30–300 мг/сутки, >300 мг/сутки соответственно.
Дизайн исследования
Исследование состояло из двух этапов. В рамках первого этапа было проведено одноцентровое одномоментное исследование 133 пациентов. Из них 87 пациентов, у которых были доступны данные 10-летней давности, были включены во второй этап исследования с динамической оценкой показателей.
Методы
В клинико-диагностической лаборатории ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России (зав. лабораторией — к.м.н. Л.В. Никанкина) проведена оценка контроля углеводного обмена, исходя из определения уровня гликированного гемоглобина (HbA1c) методом жидкостной ионнообменной хроматографии «Diastat» («BioRad», США). Функциональное состояние почек оценивалось путем определения рСКФ по уровню креатинина сыворотки крови и альбуминурии. Расчет СКФ проводился по формуле CKD-EPI [12]: СКФ (мл/мин/1,73 м²) = 141 х [ min креатинин плазмы (мг/дл)/ k или 1]α х [ max креатинин плазмы (мг/дл)/k или 1]-1,209 х 0,993 возраст (лет) х 1,018 (для женщин) х 1,159 (для представителей негроидной расы). k — 0,7 для женщин и 0,9 для мужчин, α — (-0,329) для женщин и (-0,411) для мужчин, креатинин (мкмоль/л) = креатинин (мг/дл) х 88,4. Альбуминурия оценивалась в утренней порции мочи на автоматическом анализаторе «ARCHITECT c8000 pro (Abbott, США) с использованием реактивов того же производителя согласно стандартной методике. Биохимические показатели крови (холестерин общий, холестерин ЛПНП, холестерин ЛПВП, триглицериды, креатинин, мочевина, кальций общий, альбумин, фосфор, железо, ферритин, трансферрин, общий белок, натрий, калий, хлор) оценивались на аппарате ARCHITECT c8000 (Abbott, США), паратгормон (ПТГ) — на электрохемилюминесцентном анализаторе Cobas 6000 («Roche», Германия) с использованием реактивов того же производителя согласно стандартной методике. Исследование ММР-9, MCP-1, TNFRSF1A, TNFRSF1B, мозгового натрийуретического пептида (Na-рroBNP), трансформирующего фактора роста бета-1 (TGF-β1), асимметричного диметиларгинина (ADMA), остеопонтина, цистатина С в крови, нефрина и подоцина в моче проводилось с использованием коммерческих наборов в соответствии с рекомендациями производителей.
Эхокардиографическое исследование осуществлялось на аппарате iE 33 Xmatrix (Agilent Technologist, США). С целью оценки распространенности атеросклеротического поражения периферических артерий всем пациентам было проведено ультразвуковое дуплексное сканирование (УЗДС) брахиоцефальных артерий (БЦА), артерий нижних конечностей (АНК) на аппарате Voluson expert E8 (General Electric Medical Systems). Ключевым критерием для диагностики гемодинамически значимого стеноза являлось сужение просвета артерии более чем на 50%.
Офтальмологическое исследование проводилось всем пациентам на базе «Лечебно-диагностического отделения диабетической ретинопатии и офтальмохирургии» ФГБУ «НМИЦ эндокринологии». Диагноз «Диабетическая ретинопатия» (ДР) верифицировался согласно действующей классификации стадий ДР. Диагнозы «Диабетическая полинейропатия, синдром диабетической стопы (СДС), диабетическая нейроостеоартропатия (ДНОАП)» верифицированы специалистами отделения диабетической стопы.
Статистический анализ
Статистический анализ проведен в программном пакете Statistica v.13 (StatSoft, США), Statistical Package for the Social Sciences» (SPSS, версия IBM SPSS Statistics 22, 2013). Для определения соответствия распределения количественных данных нормальному закону использовался критерий Колмогорова-Смирнова. Описательная статистика количественных показателей представлена медианами, первым и третьим квартилями в виде Me [ Q1; Q3], качественных в виде абсолютных и относительных частот. Критический уровень статистической значимости при проверке статистических гипотез принят равным 0,05. Для сравнения зависимых наблюдений по количественным и порядковым признакам применен критерий Уилкоксона, для сравнения зависимых наблюдений — ANOVA Краскела-Уоллиса с дальнейшим post-hoc анализом. Сравнение количественных данных при последовательных измерениях выполнялось с помощью критерия Уилкоксона. Статистически значимым признавали уровень ошибки первого рода менее 0,05. Для нивелирования проблем множественных сравнений применялась поправка Бонферрони. После применения поправки значения Р в диапазоне между рассчитанными и 0,05 интерпретировались как статистическая тенденция. Прогностическая модель, характеризующая зависимость количественной переменной от факторов, разрабатывалась с помощью метода логистической регрессии. Критический уровень статистической значимости Р0 при проверке статистических гипотез принят равным 0,05. При множественных сравнениях применяли поправку Бонферрони. Значения Р в диапазоне от критического до 0,05 интерпретировали как индикаторы статистической тенденции
Этическая экспертиза
Протокол исследования №18 от 12 октября 2022 г. был рассмотрен локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава РФ, принято положительное решение. Информированные согласия пациентов по поводу участия в исследования были получены.
РЕЗУЛЬТАТЫ
Общая характеристика пациентов, включенных в 1 этап исследования, представлена в табл. 1.
Таблица 1. Общая характеристика обследованных пациентов
|
Параметры |
Число пациентов |
Значение |
|
Ж/М, n (%) |
133 |
89 (66,9) / 44 (33,1) |
|
Возраст, годы |
133 |
48 [ 36; 58] |
|
ИМТ, кг/м² |
133 |
23,9 [ 21,7; 27,3] |
|
Возраст дебюта СД1, годы |
133 |
13 [ 6; 17] |
|
Длительность СД1, годы |
133 |
40 [ 36; 41] |
|
Начало ХБП после дебюта СД1, годы |
133 |
15 [ 11; 24] |
|
Длительность ХБП, годы |
133 |
21,5 [ 18,5; 25,5] |
|
рСКФ, мл/мин/1,73 м² |
127 |
42,9 [ 31,0; 70,0] |
|
Альбуминурия, мг/ммоль |
114 |
6,89 [ 1,58; 15,92] |
|
HbA1c, % |
130 |
8,4 [ 7,8; 9,2] |
|
ЛПНП, ммоль/л |
130 |
1,88 [ 1,51; 2,33] |
|
ТГ, ммоль/л |
130 |
0,96 [ 0,81; 1,07] |
|
Кальций, скорректированный на альбумин, ммоль/л |
102 |
2,39 [ 2,29; 2,48] |
|
ПТГ, пг/мл |
79 |
49,4 [ 31,8; 82,0] |
|
Гемоглобин, г/л |
133 |
111,5 [ 104,5; 122,5] |
|
Ферритин, нг/мл |
84 |
65,9 [ 39,8; 142,7] |
|
НТЖ, % |
84 |
27,9 [ 18,9; 32,5] |
|
Без ХБП, n (%) |
54 (43,2) |
|
|
ХБП С1-2 А2-А3, n (%) |
7 (5,6) |
|
|
ХБП С3-5 (додиализные), n (%) |
30 (24,0) |
|
|
ХБП (ЗПТ), n (%) |
34 (27,2) |
|
|
Диабетическая ретинопатия, n (%) |
121 (97,6) |
|
|
- непролиферативная стадия, n (%) |
38 (31,4) |
|
|
- препролиферативная стадия, n (%) |
6 (5) |
|
|
- пролиферативная стадия, n (%) |
77 (63,6) |
|
|
- отсутствуют диабетические микрососудистые изменения глазного дна, n (%) |
3 (2,4) |
|
|
Диабетическая нейропатия: |
||
|
- дистальная, n (%) |
123 (92,5) |
|
|
- автономная, n (%) |
57 (42,9) |
|
|
АГ, n (%) |
96 (72,2) |
|
|
Длительность АГ, годы |
96 |
21 [ 11; 24] |
|
ИБС, n (%) |
19 (14,3) |
|
|
ЦВБ, n (%) |
8 (6) |
|
|
ОИМ, n (%) |
8 (6) |
|
|
ОНМК, n (%) |
5 (3,8) |
|
|
ХСН, n (%) |
20 (15%) |
|
|
ГЛЖ, n (%) |
64 (48,1%) |
|
|
NT-proBNP, пг/мл |
52 |
15,51 [ 4,84; 94,1] |
|
Атеросклероз периферических артерий, n (%) |
106 (79,7) |
|
|
Ингибиторы РААС, n (%) |
103 (77,4) |
|
|
Гиполипидемическая терапия, n (%) |
98 (72,2) |
|
|
Антиагреганты, n (%) |
87 (65,4) |
|
Примечание. ИМТ — индекс массы тела; СД1 — сахарный диабет 1 типа; ХБП — хроническая болезнь почек; рСКФ — расчетная скорость клубочковой фильтрации; HbA1c — гликированный гемоглобин; ЛПНП — липопротеиды низкой плотности; ТГ — триглицериды; ПТГ — паратиреоидный гормон; НТЖ — насыщение трансферрина железом; ИБС — ишемическая болезнь сердца; ОИМ — острый инфаркт миокарда; ОНМК — острое нарушение мозгового кровообращения; АГ — артериальная гипертензия; РААС — ренин-ангиотензин-альдостероновая система; ХСН — хроническая сердечная недостаточность; ГЛЖ — гипертрофия левого желудочка; NT-proBNP — мозговой натрийуретический гормон.
При анализе возраста манифестации СД1 получены следующие данные: дебют СД1 в возрасте до 7 лет наблюдался у 19 (14,3%) пациентов, от 7 до 17 лет — у 81 (60,9%), от 18 лет и старше — у 33 (24,8%) исследуемых. СД1 дебютировал с кетоацидотической комы у 17 (12,8%) пациентов, диабетического кетоацидоза — у 45 (33,8%). В анамнезе хотя бы 1 гипогликемическая или гипергликемическая комы развились у 24 (18%) и 35 (26,3%) пациентов соответственно. Эпизоды острого повреждения почек (ОПП) отмечались у 15 (11,3%) исследуемых. Целевой уровень углеводного обмена по показателю HbA1c достигнут лишь у 34 (25,6%) исследуемых, целевой уровень контроля ЛПНП достигнут только у 13 (9,7%) человек.
У всех пациентов исследованы маркеры воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии в зависимости от стадии ХБП (табл. 2).
Таблица 2. Сравнение показателей специфических биомаркеров крови и мочи у пациентов с сахарным диабетом 1 типа 20 и более лет на момент контрольного исследования в зависимости от стадии хронической болезни почки (n=125)
|
Без ХБП (n=54) (группа №1) |
ХБП С1-2А2-3 (n=7) (группа №2 |
ХБП С3-5* (n=30) (группа №3) |
ХБП ЗПТ (n=34) (группа №4) |
Р-value, K-W test |
|
|
TGF-β1, пг/мл, (n=122) |
42302,52 [ 36264,42; 47300,28] |
23026,02 [ 18169,05; 24777,63] |
39466,98 [ 23922,78; 47156,46] |
27237,45 [ 17134,20; 33920,61] |
Р=0,006 Р1-2=0,010 |
|
ADMA, мкмоль/л, (n=58) |
0,59 [ 0,53; 0,62] |
0,66 [ 0,66; 0,68] |
0,66 [ 0,63; 0,72] |
0,65 [ 0,56; 0,71] |
Р=0,005 Р1-3=0,004 |
|
Нефрин, нг/мл, (n=113) |
4,783 [ 3,317; 7,515] |
5,261 [ 3,979; 6,778] |
6,434 [ 3,982; 8,517] |
4,265 [ 2,041; 8,419] |
Р=0,466 |
|
Подоцин, нг/мл, (n=113) |
5,708 [ 3,518; 13,612] |
7,619 [ 5,050; 11,485] |
7,106 [ 4,418; 14,263] |
9,301 [ 3,885; 14,770] |
Р=0,644 |
|
Цистатин С, нг/мл, (n=125) |
11104 [ 8314; 12227] |
10398 [ 9652; 11014] |
17514 [ 14082; 23686] |
19854 [ 12723; 31178] |
Р=0,478 |
|
TNFRSF1A, пг/мл, (n=123) |
1135,12 [ 955,48; 1467,67] |
1715,24 [ 1183,85; 2069,95] |
2140,45 [ 1794,43; 3596,75] |
4248,23 [ 3076,49; 9299,89] |
Р<0,001 Р1-3<0,001 Р1-4<0,001 Р2-3=0,028 Р2-4=0,006 |
|
TNFRSF1B, пг/мл, (n=123) |
3040,26 [ 2566,03; 3749,47] |
3985,45 [ 3187,79; 5232,10] |
4142,45 [ 3741,61; 9400,48] |
9917,49 [ 7265,82 [ 17144,4]] |
Р<0,001 Р1-3<0,001 Р1-4<0,001 Р2-3=0,010 Р2-4=0,007 |
|
MMP-9, нг/мл (n=129) |
421,6 [ 357,3; 503,8] |
226,5 [ 183,1; 303,9] |
463,3 [ 283,2; 541,1] |
438,1 [ 346,3; 699,0] |
Р=0,324 |
|
МСР-1, пг/мл (n=122) |
502,21 [ 408,97; 665,64] |
711,53 [ 481,30; 713,28] |
526,21 [ 389,60; 584,75] |
533,38 [ 429,06; 609,28] |
Р=0,819 |
|
Остеопонтин, нг/мл, (n=119) |
157,07 [ 55,13; 259,72] |
38,42 [ 28,79; 136,62] |
132,69 [ 27,61; 215,02] |
144,88 [ 27,57; 204,27] |
Р=0,500 |
Примечание. MMP-9 — матриксная металлопротеиназа-9; MCP-1 — моноцитарный хемотаксический фактор-1; TGF-β1 — трансформирующий фактор роста бета 1; TNFRSF1A — рецептор фактора некроза опухоли 1 типа; TNFRSF1B — рецептор фактора некроза опухоли 2 типа; ADMA — асимметричный диметиларгинин; *додиализные.
Согласно критерию Краскела-Уоллиса с поправкой Бонферрони, выявлены статистически значимые различия уровней TGF-β1 (Р=0,006), TNFRSF1A и TNFRSF1B (Р<0,001), ADMA (Р=0,005) в зависимости от стадии ХБП. При парных сравнениях с использованием критерия Данна и поправки Бонферрони уровень TGF-β1 был значимо выше в 1‑й группе, чем во 2‑й группе; ADMA значимо выше в 3‑й группе, чем в 1‑й; TNFRSF1A, TNFRSF1B значимо выше в 3‑й и 4‑й группах в сравнении с 1‑й и 2‑й группами.
Отдельно проанализирована группа пациентов (n=87), которым удалось провести оценку искомых параметров в динамике с 2011–2015 гг. по 2022–2025 гг.
Общая характеристика 87 пациентов, включенных во 2‑й этап исследования, представлена в табл. 3.
Таблица 3. Общая характеристика обследованных 87 пациентов на момент контрольного исследования
|
Параметры |
Число пациентов |
Значение |
|
Ж/М, n (%) |
52 (59,8) / 35 (40,2) |
|
|
Возраст, годы |
87 |
48 [ 43; 56] |
|
ИМТ, кг/м² |
87 |
25,3 [ 22,0; 28,3] |
|
Возраст дебюта СД1, годы |
87 |
13 [ 10; 18] |
|
Длительность СД1, годы |
87 |
35 [ 30; 41] |
|
Начало ХБП после дебюта СД1, годы |
87 |
14 [ 0; 21] |
|
Длительность ХБП, годы |
87 |
13 [ 0; 19] |
|
рСКФ, мл/мин/1,73 м² |
82 |
72,5 [ 43,0; 91,0] |
|
Альбуминурия, мг/ммоль |
87 |
1,30 [ 0,72; 4,56] |
|
HbA1c, % |
130 |
8,1 [ 7,3; 9,2] |
|
ЛПНП, ммоль/л |
87 |
2,39 [ 1,88; 3,12] |
|
ТГ, ммоль/л |
87 |
0,91 [ 0,70; 1,29] |
|
Кальций, скорректированный на альбумин, ммоль/л |
80 |
2,29 [ 2,22; 2,41] |
|
ПТГ, пг/мл |
62 |
55,3 [ 36,3; 87,7] |
|
Гемоглобин, г/л |
78 |
128,5 [ 113,0; 146,0] |
|
Ферритин, нг/мл |
51 |
81,0 [ 37,3; 141,1] |
|
Без ХБП, n (%) |
39 (44,8) |
|
|
ХБП С1-2 А2-А3, n (%) |
9 (10,3) |
|
|
ХБП С3-5 (додиализные) |
23 (26,4) |
|
|
ХБП (ЗПТ), n (%) |
16 (18,4) |
|
|
Диабетическая ретинопатия, n (%) |
76 (98,7) |
|
|
- непролиферативная стадия, n (%) |
27 (35,5) |
|
|
- препролиферативная стадия, n (%) |
4 (5,3) |
|
|
- пролиферативная стадия, n (%) |
45 (59,2) |
|
|
- отсутствуют диабетические микрососудистые изменения глазного дна, n (%) |
1 (1,3) |
|
|
Диабетическая нейропатия: |
||
|
- дистальная, n (%) |
77 (88,5) |
|
|
- автономная, n (%) |
34 (39,1) |
|
|
АГ, n (%) |
81 |
60 (74,1) |
|
Длительность АГ, годы |
81 |
21 [ 11; 24] |
|
ИБС, n (%) |
79 |
13 (16,5) |
|
ЦВБ, n (%) |
79 |
5 (6,3) |
|
ОИМ, n (%) |
75 |
6 (8,0) |
|
ОНМК, n (%) |
77 |
3 (3,9) |
|
ХСН, n (%) |
75 |
11 (14,7) |
|
ГЛЖ, n (%) |
62 |
33 (53,2) |
|
NT-proBNP, пг/мл |
40 |
8,99 [ 3,88; 22,09] |
|
Атеросклероз периферических артерий, n (%) |
56 |
55 (98,2) |
|
Ингибиторы РААС, n (%) |
47 (54) |
|
|
Гиполипидемическая терапия, n (%) |
61 (70,1) |
|
|
Антиагреганты, n (%) |
34 (39,1) |
|
Примечание: ИМТ — индекс массы тела; СД1 — сахарный диабет 1 типа; ХБП — хроническая болезнь почек; рСКФ — расчетная скорость клубочковой фильтрации; HbA1c — гликированный гемоглобин; ЛПНП — липопротеиды низкой плотности; ТГ — триглицериды; ПТГ — паратиреоидный гормон; НТЖ — насыщение трансферрина железом; ИБС — ишемическая болезнь сердца; ОИМ — острый инфаркт миокарда; ОНМК — острое нарушение мозгового кровообращения; АГ — артериальная гипертензия; РААС — ренин-ангиотензин-альдостероновая система; ХСН — хроническая сердечная недостаточность; ГЛЖ — гипертрофия левого желудочка; NT-proBNP — мозговой натрийуретический гормон.
Медиана наблюдения 87 пациентов составила 10 лет [ 9; 12]. Дебют СД1 в возрасте до 7 лет наблюдался у 11 пациентов (12,6%), от 7 до 17 лет — у 52 (59,8%), от 18 лет и старше — у 24 исследуемых (27,6%). СД1 дебютировал с кетоацидотической комы у 12 пациентов (13,8%), диабетического кетоацидоза — у 21 (24,1%). В анамнезе хотя бы 1 гипогликемическая или гипергликемическая кома развивалась у 13 (14,9%) и 25 (28,7%) пациентов соответственно. Эпизоды ОПП отмечались у 9 исследуемых (10,3%). ИМ у 6 (8,0%), ОНМК у 3 пациентов (3,9%), ХСН развилась у 11 (14,7%). Целевой уровень контроля углеводного обмена по уровню HbA1c достигнут лишь у 16 исследуемых (18,4%). Среди 60 пациентов с артериальной гипертензией (АГ) на фоне антигипертензивной терапии нормотония достигнута у 33 пациентов (55%), целевой уровень ЛПНП на фоне липидоснижающей терапии достигнут лишь у 10 человек.
За этот период оценена динамика почечной функции у 81 пациента в соответствии с рСКФ и альбуминурией (на момент начала исследования и через 10 лет) (рис. 1).
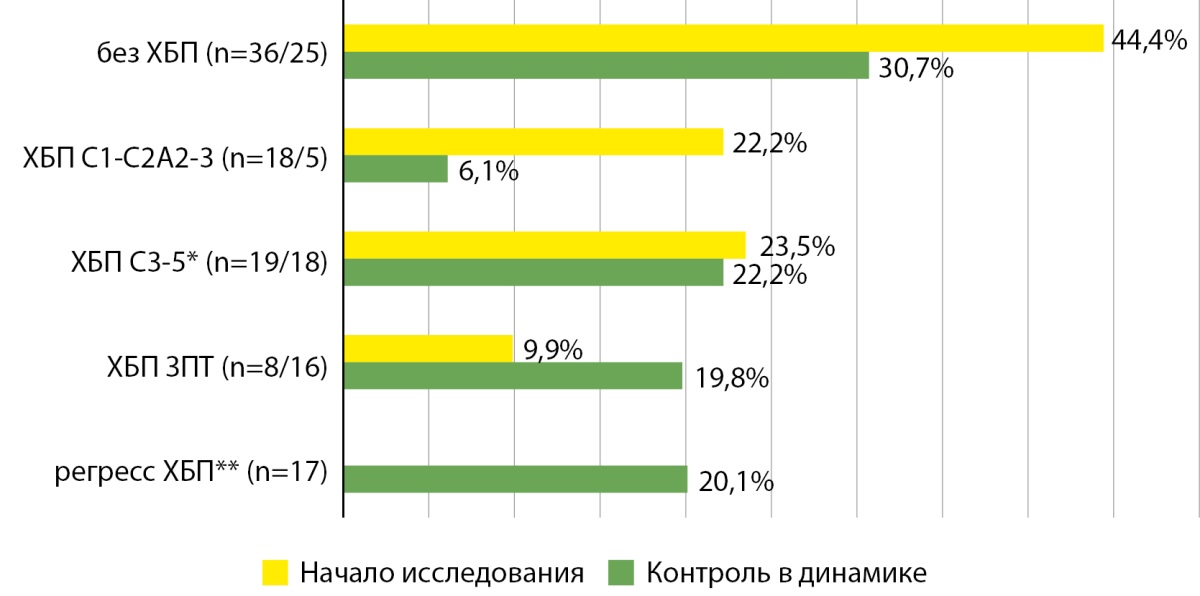
Рисунок 1. Распределение пациентов с сахарным диабетом 1 типа длительного течения (20 и более лет) в соответствии с расчетной скоростью клубочковой фильтрации и альбуминурией на момент начала исследования (выделены желтым) и при контроле в динамике (выделены зеленым).
Примечание: ХБП — хроническая болезнь почек; С — стадия хронической болезни почек; А — степень альбуминурии; *додиализные; **на фоне регулярной нефропротективной терапии.
В начале исследования 8 пациентов находились на заместительной почечной терапии (ЗПТ) программным гемодиализом (ПГД), к моменту проведения контрольного исследования 16 пациентов находились на ЗПТ: 13 пациентам проведена изолированная трансплантация почки (ИТП) или сочетанная трансплантация с поджелудочной железой (СТПиПЖ): у 5 сохранилась нормальная функция почечного трансплантата, у 8 развилась ХБП вплоть до возобновления ПГД (n=2). Еще 2 пациентам была инициирована ЗПТ ПГД в период наблюдения, 1 пациентка получала ЗПТ ПГД в течение 19 лет.
В табл. 4 представлены результаты анализа HbA1c, рСКФ, альбуминурии в динамике.
Таблица 4. Динамика гликированного гемоглобина, расчетной скорости клубочковой фильтрации, альбуминурии
|
Показатели |
Исходные значения |
Значения при динамическом контроле |
Р-value, W-test |
||
|
n |
Ме [ Q1; Q3] |
n |
Ме [ Q1; Q3] |
||
|
HbA1c, % |
83 |
8,4 [ 7,6; 9,2] |
83 |
8,1 [ 7,3; 9,2] |
0,181 |
|
рСКФ, мл/мин/1,73 м² |
82 |
88,0 [ 43,0; 105,0] |
82 |
72,5 [ 43,0; 91,0] |
<0,001 |
|
Альбумин/креатинин в утренней моче, мг/ммоль |
57 |
1,23 [ 0,61; 3,04], n=57 |
87 |
1,30 [ 0,72; 4,56], n=87 |
0,717 |
Примечание: HbA1c — гликированный гемоглобин; рСКФ — расчетная скорость клубочковой фильтрации.
В табл. 5 представлена динамика маркеров воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии среди 87 пациентов.
Таблица 5. Динамика показателей и концентрации специфических маркеров воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии среди 87 пациентов
|
Показатели |
Исходные значения |
Значения при динамическом контроле |
Р-value, W-test |
||
|
n |
Ме [ Q1; Q3] |
n |
Ме [ Q1; Q3] |
||
|
MMP-9 сыворотки крови, нг/мл, n=26 |
26 |
2500,4 [ 309,6; 655,0] |
26 |
387,0 [ 340,5; 675,2] |
0,925 |
|
TGF-β1 сыворотки крови, пг/мл, n=38 |
38 |
8071,9 [ 1905,0; 12136,2] |
38 |
43669,1 [ 28350,1; 48368,5] |
<0,001 |
|
ADMA плазмы крови, мкмоль/л, n=33 |
33 |
0,68 [ 0,60; 0,78] |
33 |
0,66 [ 0,59; 0,71] |
0,551 |
|
MCP-1 сыворотки крови, пг/мл, n=42 |
42 |
610,4 [ 389,7; 1355,9] |
42 |
496,2 [ 287,4; 612,6] |
0,140 |
|
Остеопонтин сыворотки крови, нг/мл |
33 |
76,4 [ 60,7; 110,5] |
32 |
102,3 [ 15,6; 234,8] |
0,140 |
|
Нефрин в моче, нг/мл, n=33 |
33 |
0,11 [ 0,06; 0,18] |
33 |
4,28 [ 3,14; 5,26] |
<0,001 |
|
Подоцин в моче, нг/мл, n=35 |
35 |
0,34 [ 0,12; 0,73] |
35 |
4,64 [ 3,52; 5,87] |
<0,001 |
|
Цистатин С плазмы крови, нг/мл, n=34 |
34 |
1189,95 [ 897,38; 1943,49] |
34 |
12272,0 [ 9082,0; 12652,0] |
0,011 |
Примечание: P0=0,05/8=0,006 (поправка Бонферрони);
MMP-9 — матриксная металлопротеиназа-9; MCP-1 — моноцитарный хемотаксический фактор-1; TGF-β1 — трансформирующий фактор роста бета 1; ADMA — асимметричный диметиларгинин.
Согласно критерию Уилкоксона (с поправкой Бонферрони) обнаружены статистически значимые повышения уровней TGF-β1, нефрина, подоцина, снижение рСКФ (Р<0,001), а также статистическая тенденция в отношении повышения цистатина С.
По результатам проведенного корреляционного анализа были установлены следующие статистически значимые связи среди исследуемых показателей у 87 пациентов (табл. 6).
Таблица 6. Статистически значимые корреляционные связи специфических биомаркеров у 87 пациентов с сахарным диабетом 1 типа длительностью 20 и более лет
|
N |
Показатели |
Значение уровня коэффициента корреляции (r) и P-value |
Оценка тесноты корреляционной связи по шкале Чеддока |
|
прямые связи |
|||
|
80 |
нефрин и подоцин |
r= 0,914; Р<0,001 |
весьма высокая связь |
|
62 |
ADMA и TNFRSF1A |
r=0,670; Р<0,001 |
заметная связь |
|
62 |
ADMA и TNFRSF1B |
r=0,655; Р<0,001 |
|
|
85 |
TNFRSF1A и цистатин С |
r=0,642; Р<0,001 |
|
|
85 |
TNFRSF1B и цистатин С |
r=0,657; Р<0,001 |
|
|
54 |
TNFRSF1А и альбуминурия |
r=0,544; Р<0,001 |
|
|
54 |
TNFRSF1B и альбуминурия |
r=0,512; Р<0,001 |
|
|
обратные связи |
|||
|
78 |
рСКФ и TNFRSF1A |
r=-0,831; Р<0,001 |
высокая связь |
|
78 |
рСКФ и TNFRSF1B |
r=-0,791; Р<0,001 |
|
|
78 |
рСКФ и цистатин С |
r=-0,629; Р<0,001 |
заметная связь |
|
57 |
рСКФ и ADMA |
r=-0,523; Р<0,001 |
|
Примечание: ADMA — асимметричный диметиларгинин; TNFRSF1A — рецептор фактора некроза опухоли 1 типа; TNFRSF1B — рецептор фактора некроза опухоли 2 типа.
Была проведена логистическая регрессия для определения отношения шансов увеличения рисков ХСН, ИМ, ОНМК, гипогликемической и гипергликемической комы, ОПП с возрастом пациентов, длительностью СД1 и ХБП, длительностью АГ в зависимости от повышения уровней специфических биомаркеров, рСКФ, HbA1c, альбуминурии. Исходя из значений регрессионных коэффициентов, рСКФ имеет обратную связь с развитием ХСН, подоцин положительную с ОПП. При повышении рСКФ на 1 мл/мин/1,73 м² уменьшается шанс развития ХСН в 1,12 раза (95% ДИ: 1,02; 1,22, Р=0,015). Увеличение подоцина на 1 нг/мл ассоциировано с повышением эпизодов ОПП в 1,43 раза (95% ДИ: 1,01; 2,03), Р= 0,047.
ОБСУЖДЕНИЕ
Нефрокардиальный синдром при СД1 требует глубокого понимания механизмов повреждения почек и сердца, обусловленных метаболическими и гемодинамическими нарушениями, нейрогормональной активностью, эндотелиальной дисфункцией, ОС, воспалением и фиброзом. Эти факторы формируют патологический цикл, ведущий к дисфункции обоих органов.
Медиана возраста начала СД1 в исследуемой когорте пациентов составила 13 лет, что соответствует установленным представлениям о повышенном риске развития ХБП при дебюте заболевания в период полового созревания. Подростки и молодые люди с хроническими заболеваниями демонстрируют низкую приверженность к режиму приема медикаментов и общим рекомендациям.
В нашем исследовании в дебюте СД1 диабетический кетоацидоз (ДКА) был у 33,8%, кетоацидотическая кома зарегистрирована у 12,8% пациентов, повторные случаи развития кетоацидотических ком в анамнезе у 6%, причем у 1 пациентки как минимум 22 раза. Эпизоды ОПП впоследствии случились у 11,3%. Возраст дебюта СД1 и сопутствующие проблемы в данной когорте пациентов, вероятно, способствовали достаточно раннему развитию ХБП через 15 лет, что согласуется с информацией в Базе данных клинико-эпидемиологического мониторинга СД на территории Российской Федерации, где средняя длительность до начала ХБП с момента дебюта СД1 составляет 14,8 года [2]. Сохранная функция почек согласно критериям ХБП наблюдалась у 43,2% пациентов (n=54), остальные находились на различных стадиях ХБП, включая лиц на ЗПТ (n=34). Медиана длительности ХБП составила 21,5 года. В обзоре Rivetti G. и соавт. [14] вопросу дебюта и острых осложнений СД1 уделено особое внимание: ДКА в дебюте увеличивает число случаев ОПП до 65%, повторные эпизоды ДКА — до 81%. В свою очередь, каждый эпизод ОПП увеличивает риски развития микроальбуминурии в 1,56 раза, ХБП — в 2 раза, АГ — в 1,22 раза. В нашем исследовании у 72,2% подтверждена АГ, медиана длительности которой составила 21 год. Ингибиторы ренин-ангиотензин-альдостероновой системы (РААС) получали 77,4%, из них 7 пациентов (6,8%) исключительно с целью нефропротекции. Нормотония на фоне антигипертензивной терапии достигнута у 57,3% пациентов, несмотря на применение современных средств управления заболеванием (при всех ее ограничениях для лиц с СД1). В популяционном ретроспективном когортном исследовании лиц с дебютом СД1 в возрасте до 15 лет (n=1500) в 1970–1999 гг. (база данных Финского института здравоохранения и социального обеспечения) достижение тХБП через 15 лет после диагностики макроальбуминурии наблюдалось у 36% пациентов. Важно отметить, что частота макроальбуминурии в когорте 1980–1989 гг. снизилась примерно вдвое по сравнению с когортой 1970–1979 гг. (отношение рисков (ОР) 0,55 (95% ДИ: 0,42–0,72), Р<0,0001), тогда как между когортами 1980–1989 гг. и 1990–1999 гг. дальнейшего снижения не наблюдалось (ОР 0,83 (95% ДИ: 0,54–1,26), Р=0,38) [15]. Улучшение, наблюдаемое в когорте 1980-х гг., совпало с появлением блокаторов РААС, но отсутствие дальнейшей положительной динамики после 1980-х гг. подчеркивает острую необходимость в создании новых нефро- и кардиопротективных препаратов для лиц с СД1.
Из 133 пациентов 26,3% достигли целевого уровня HbA1c, при этом регулярный самоконтроль гликемии проводился только 55,6% исследуемыми. Нарушение распознавания гипогликемии отмечено у 48,1% исследуемых, что также оказывает влияние на возможности компенсации углеводного обмена. Как доклинические, так и клинические данные убедительно свидетельствуют о том, что гипергликемия играет причинную роль в развитии ХСН, связанной с диабетом [6]. Стойкая гипергликемия вызывает деструктивные изменения в метаболизме и функции клеток почек и миокарда посредством различных механизмов: активация внутриклеточных сигнальных процессов, нарушающих синтез компонентов базальной мембраны клубочков (БМК), внеклеточного матрикса (ВКМ), проницаемость сосудистой стенки, эндотелий-зависимую вазодилатацию и инициирующих окислительный стресс (ОС), эндотелиальную дисфункцию, профиброзные пути [16].
В ходе оценки распространенности других поздних осложнений СД более чем у половины пациентов диагностирована пролиферативная стадия ДР, почти у 100% — дистальная форма диабетической нейропатии, у 43,6% — кардиоваскулярная форма автономной нейропатии (КАН). По результатам субанализа DCCT/EDIC [17], наличие микрососудистых диабетических осложнений (особенно макроальбуминурия и снижение рСКФ <60 мл/мин/1,73 м²) и КАН повышало риски ССЗ, в частности неблагоприятных ССЗ (нефатальный инфаркт миокарда (ИМ), нефатальное острое нарушение мозгового кровообращения (ОНМК), внезапная сердечная смерть).
Дислипидемия — частое осложнение ХБП, способствующее развитию атеросклероза и, соответственно, повышению сердечно-сосудистой нагрузки у пациентов с ХБП. В нашем исследовании медиана уровня ЛПНП составила 1,88 мМ/л, ТГ — 0,96 мМ/л, только у 9,7% были достигнуты целевые значения ЛПНП на фоне регулярной гиполипидемической терапии, хотя эту терапию получали 72,2% пациентов. Атеросклероз периферических артерий диагностирован у 79,7%, в частности коронарных артерий у 6 пациентов, еще по 2 пациента с атеросклерозом аорты и почечных артерий, подвздошной артерии у одного. Эндоваскулярное хирургическое лечение было проведено 8 пациентам. Проблема дислипидемии особенно принципиальна для пациентов с СД1: высокие уровни холестерина ЛПНП и их окисление вносят свой вклад в развитие гломерулярного склероза, свободные жирные кислоты напрямую повреждают подоциты [18].
После разделения 125 пациентов на 4 группы в зависимости от почечной функции проведено сравнение уровней маркеров воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии (ММР-9, Na-рroBNP, TGF-β1, ADMA, MCP-1, остеопонтин, TNFRSF1A, TNFRSF1B, цистатин С, нефрин, подоцин) между группами, что продемонстрировало нарастание практически всех биомаркеров этих процессов в зависимости от стадии ХБП. TNFRSF1A и TNFRSF1B, задействованные в процессах воспаления, пролиферации, дифференцировке, миграции клеток и индукции их гибели [9], нарастали особенно ярко и значимо (Р<0,001). Недавние исследования определили TNFRSF1A и TNFRSF1B как значимые детерминанты почечной дисфункции [19][20]. Статистически значимые различия также были выявлены в отношении ADMA (Р=0,005) и TGF-β1 (Р=0,006). У лиц с ХБП отмечалось повышение уровня ADMA и снижение уровня TGF-β1 относительно лиц без ХБП. Повышение ADMA у пациентов с ХБП связано со снижением его выведения почками. ADMA выделен как независимый маркер риска ССЗ и сердечно-сосудистой смертности у пациентов с тХБП: было доказано, что высокие уровни ADMA крови связаны с развитием эндотелиальной дисфункции и повышенным риском атеросклероза [21][22]. В группе пациентов на ЗПТ незначительное снижение уровня маркера может быть обусловлено изменением клеточного и молекулярного состава крови в ходе диализной терапии, а также нормализацией почечной функции после аллотрансплантации.
Нетипичное снижение TGF-β1 по мере прогрессирования ХБП, наблюдающееся в нашем исследовании и обозначенное как статистически значимое, упомянуто в нескольких работах. В исследовании Швангирадзе Т.А. и соавт. [23] среди пациентов с СД2 и ССЗ отмечалась отрицательная корреляция TGF-β с факторами, определяющими прогрессирование и тяжесть ССЗ, и регистрировалась среди пациентов с более тяжелыми стадиями ХБП (низкие значения TGF-β были ассоциированы с высоким сердечно-сосудистым риском). В работе Stefoni S. и соавт. [24] уровень TGF-β1 был значимо снижен у пациентов на гемодиализе, в частности у пациентов с тяжелыми ССЗ. В работе Zhao L. и соавт. [25] и Sharma K. и соавт. [26] подобное снижение объяснялось подавлением активности РААС за счет ингибиторов ангиотензинпревращающего фермента (иАПФ) и блокаторов рецепторов ангиотензина-II (БРА-II). Исследования продемонстрировали, что ангиотензин II (AII) стимулирует выработку матрикса в клетках гладких мышц сосудов, мезангиальных клетках и эпителиальных клетках канальцев, опосредованной индуцированной AII аутокринной выработкой TGF-β. В исследованиях на животных лечение крыс с СД ингибиторами РААС снизило повышенную экспрессию TGF-β в клубочках. В исследованиях на людях было продемонстрировано влияние лозартана и каптоприла на уровень TGF-β1: они значимо снижали его уровень, в том числе среди пациентов с СД1. Yuan Q. и соавт. [27] подошли к данному вопросу с другой стороны: они предложили идею сохраняющейся секреторной функции миофибробластов (ключевых эффекторов фиброза ткани) даже в условиях гипоксии, утраты нормальной функции, однако в более низкой концентрации в сравнении со здоровыми клетками. Тем более интересно поведение этого маркера (значимое нарастание) у лиц с динамическим наблюдением в течение 10 лет. Не исключен «эффект ускользания» от блокады РААС и многофакторность контроля TGF-β в условиях прогрессирования почечной дисфункции у лиц с длительным течением СД1.
Выделенная для динамического контроля группа пациентов из 87 человек по многим анамнестическим и клиническим параметрам соответствует общей группе. Можно предположить, что продемонстрированная динамика структуры ХБП за 10 лет отражает эволюцию развития патологии. С одной стороны, снизилась численность лиц без ХБП (с 44,4 до 30,7%), с начальными стадиями патологии (с 22,2 до 6,1%) и увеличилось количество пациентов на ЗПТ (с 9,9 до 19,8%). С другой стороны, появилась группа пациентов в состоянии регресса ХБП на фоне нефропротективной терапии (20,1%). Невольно возникает вопрос о причинах. Известен факт спонтанного регресса почечной дисфункции, преимущественно за счет нормализации патологической альбуминурии [28]. Подтверждением этого может служить стабильность альбуминурии за 10 лет наблюдения. Высока вероятность эффективности проводимой нефропротективной терапии, несмотря на все ее ограничения при СД1. Могла ли быть она выше при нацеливании на воспалительные пути или применении современных сахароснижающих средств при СД2 с кардио- и нефропротективным воздействием?
В ходе сравнения групп с исходными значениями и значениями в динамике нашлись статистически значимые различия относительно рСКФ (P<0,001), уровней TGF-β1 крови, нефрина и подоцина мочи (P<0,001). Очевидны снижение рСКФ по мере прогрессирования ХБП, а также увеличение уровней TGF-β1, нефрина и подоцина. Повышение уровней компонентов подоцитарной ЩД свидетельствует об изменениях подоцитов. Гипергликемия способна изменять их фенотип, вызывая потерю нефрина, отслоение подоцитов, нарушение аутофагии, гипертрофию и их апоптоз, вовлекая TGF-β1 [10][29]. Нарушение специфической цитоархитектоники упорядоченных актиновых волокон вдоль оси ножек лишает подоциты пластичности, способности сокращаться и прикрепляться к БМК [30][31]. Сглаживание ножек на ранних стадиях ХБП имеет обратимый характер при компенсации углеводного обмена, в противном случае повреждение прогрессирует до полного исчезновения отростков [10]. Подоциты относятся к постмитотическим клеткам [30][32], поэтому апоптоз подоцитов — необратимый процесс, сопровождающийся развитием тяжелых осложнений [33]. В нашем исследовании увеличение уровня подоцина в моче на 1 нг/мл (как результат их повреждения) было ассоциировано с повышением эпизодов ОПП в 1,43 раза (95% ДИ: 1,01; 2,03), Р=0,047. Известно, что повторные эпизоды ОПП ведут к необратимой потере числа подоцитов, ускоряя прогрессирование почечной дисфункции.
За период наблюдения 87 пациентов ИМ развился у 6 (8,0%), ОНМК — у 3 пациентов (3,4%), ХСН — у 11 (14,7%). СД и ХБП связаны с повышенным риском возникновения ХСН. Роль биомаркеров воспаления и эндотелиальной дисфункции в динамике ХБП и ССЗ у пациентов динамического контроля несомненна. Она отражена в достаточно сильных прямых корреляционных связах TNFRSF1A, TNFRSF1B с ADMA, а также с цистатином С и альбуминурией. Высокая обратная связь определена между TNFRSF1A, TNFRSF1B, ADMA и рСКФ. Прямое и опосредованное через рСКФ влияние этих факторов определяет и риск прогрессирования ССЗ. Показательно, что при повышении рСКФ на 1 мл/мин/1,73 м² уменьшается шанс развития ХСН в 1,12 раза (95% ДИ: 1,02; 1,22, Р=0,015). Сочетание этих 3 заболеваний связано со значительно повышенным риском госпитализации и смертности. Механизмы, лежащие в основе взаимоотношений между ХСН, СД и ХБП, сложны, но, вероятно, связаны с общими сердечно-сосудистыми и метаболическими факторами риска, а также с последующими эффектами на воспаление, ОС и нейрогормональные пути. Кроме того, связь ХБП с ХСН обусловлена наряду с высокой распространенностью традиционных, а также связанных с уремией факторов риска (анемия, минерально-костные нарушения при ХБП, гипоальбуминемия, альбуминурия, электролитные нарушения и др.). Важно, что большинство жизненно важных методов лечения сердечной патологии имеет прямое влияние на почечную гемодинамику, что в ряде случает может быть лимитирующим фактором.
Ограничения исследования
- Одноцентровое исследование с преимущественным включением пациентов из специализированного отделения.
- Использование разных коммерческих наборов реагентов при анализе специфических биомаркеров на момент включения в исследование и при контроле в динамике.
- Отсутствие валидации и неопределенность клинической значимости исследуемых биомаркеров в различных группах населения.
ЗАКЛЮЧЕНИЕ
Таким образом, биомаркеры повреждения сердца и почек играют решающую роль в диагностике и прогнозировании ХБП и ССЗ у пациентов с длительным течением СД1. Они предоставляют ценную информацию о прогрессировании патологии и помогают врачам адаптировать стратегии лечения, включая мониторинг реакции на вмешательство. Список биомаркеров почечных и сердечно-сосудистых повреждений у лиц с СД1 неумолимо увеличивается. Интеграция новых биомаркеров в диагностику и лечение ХБП и связанных с ней ССЗ является многообещающей.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование проведено в рамках выполнения Государственного задания Минздрава России (№123021000038-6).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Шамхалова М.Ш. — анализ полученных данных, коррекция текста, окончательное утверждение для публикации рукописи; Зураева З.Т. — проведение лабораторных исследований, интерпретация данных, коррекция текста; Слепцова А.И. — проведение лабораторных исследований, интерпретация данных, коррекция текста; Никанкина Л.В. — проведение лабораторных исследований, интерпретация данных, финальное утверждение текста; Северина А.С. — разработка концепции и дизайна, проверка критически важного интеллектуального содержания; Евлоева М.И. — сбор, анализ и интерпретация данных, написание текста; Арутюнова М.С., Науменко О.Н. — сбор, анализ и интерпретация данных, написание текста; Трубицына Н.П. — сбор данных, коррекция текста; Шестакова М.В. — разработка концепции исследования, анализ данных, редактирование текста статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Gregory GA, Robinson TIG, Linklater SE, et al. Global incidence, prevalence, and mortality of type 1 diabetes in 2021 with projection to 2040: a modelling study [published correction appears in Lancet Diabetes Endocrinol. 2022 Nov;10(11):e11. doi: https://doi.org/10.1016/S2213-8587(22)00280-7.]. Lancet Diabetes Endocrinol. 2022;10(10):741-760. doi: https://doi.org/10.1016/S2213-8587(22)00218-2
2. Шамхалова М.Ш., Викулова О.К., Железнякова А.В., и др. Эпидемиология хронической болезни почек у пациентов с диабетом в Российской Федерации по данным Федерального регистра сахарного диабета (2010–2022 гг.) // Сахарный диабет. — 2023. — Т. 26. — № 5. — С. 404-417. doi: https://doi.org/10.14341/DM13090
3. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг // Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. doi: https://doi.org/10.14341/DM13035
4. Sagoo MK, Gnudi L. Diabetic Nephropathy: An Overview. Methods Mol Biol. 2020;2067:3-7. doi: https://doi.org/10.1007/978-1-4939-9841-8_1
5. Niewczas MA, Pavkov ME, Skupien J, et al. A signature of circulating inflammatory proteins and development of endstage renal disease in diabetes. Nat Med. 2019;25(5):805-813. doi: https://doi.org/10.1038/s41591-019-0415-5
6. Julián MT, Pérez-Montes de Oca A, Julve J, Alonso N. The double burden: type 1 diabetes and heart failure-a comprehensive review. Cardiovasc Diabetol. 2024;23(1):65. doi: https://doi.org/10.1186/s12933-024-02136-y
7. Riehle C, Bauersachs J. Key inflammatory mechanisms underlying heart failure. Herz. 2019;44(2):96-106. doi: https://doi.org/10.1007/s00059-019-4785-8
8. Jha J, Banal C, Chow B, et al. Diabetes and Kidney Disease: Role of Oxidative Stress. Antioxid Redox Signal. 2016 Oct 20;25(12):657-684. doi: https://doi.org/10.1089/ars.2016.6664
9. Kucka K, Wajant H. Receptor Oligomerization and Its Relevance for Signaling by Receptors of the Tumor Necrosis Factor Receptor Superfamily. Front Cell Dev Biol. 2021;8:615141. doi: https://doi.org/10.3389/fcell.2020.615141
10. Barutta F, Bellini S, Gruden G. Mechanisms of podocyte injury and implications for diabetic nephropathy. Clin Sci (Lond). 2022;136(7):493-520. doi: https://doi.org/10.1042/CS20210625
11. Tuleta I, Frangogiannis NG. Diabetic fibrosis. Biochim Biophys Acta Mol Basis Dis. 2021;1867(4):166044. doi: https://doi.org/10.1016/j.bbadis.2020.166044
12. Pätäri A, Forsblom C, Havana M, et al. Nephrinuria in diabetic nephropathy of type 1 diabetes. Diabetes. 2003;52(12):2969-74. doi: https://doi.org/10.2337/diabetes.52.12.2969
13. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск // Сахарный диабет. — 2023. — Т. 26. — № 2S. — С. 1-157. doi: https://doi.org/10.14341/DM13042
14. Rivetti G, Hursh BE, Miraglia Del Giudice E, Marzuillo P. Acute and chronic kidney complications in children with type 1 diabetes mellitus. Pediatr Nephrol. 2023;38(5):1449-1458. doi: https://doi.org/10.1007/s00467-022-05689-w
15. Jansson Sigfrids F, Groop PH, Harjutsalo V. Incidence rate patterns, cumulative incidence, and time trends for moderate and severe albuminuria in individuals diagnosed with type 1 diabetes aged 0-14 years: a population-based retrospective cohort study [published correction appears in Lancet Diabetes Endocrinol. 2023 Jan;11(1):e1. doi: https://doi/org/10.1016/S2213-8587(22)00347-3.]. Lancet Diabetes Endocrinol. 2022;10(7):489-498. doi: https://doi.org/10.1016/S2213-8587(22)00099-7
16. Pan D, Xu L, Guo M. The role of protein kinase C in diabetic microvascular complications. Front Endocrinol (Lausanne). 2022;13:973058. doi: https://doi.org/10.3389/fendo.2022.973058
17. Gubitosi-Klug R, Gao X, Pop-Busui R, et al.; DCCT/EDIC Research Group. Associations of microvascular complications with the risk of cardiovascular disease in type 1 diabetes. Diabetes Care. 2021;44(7):1499-1505. doi: https://doi.org/10.2337/dc20-3104
18. Kawanami D, Matoba K, Utsunomiya K. Dyslipidemia in diabetic nephropathy. Ren Replace Ther. 2016;2:16. doi: https://doi.org/10.1186/s41100-016-0028-0
19. Krolewski AS, Niewczas MA, Skupien J, et al. Early progressive renal decline precedes the onset of microalbuminuria and its progression to macroalbuminuria. Diabetes Care. 2014;37(1):226-34. doi: https://doi.org/10.2337/dc13-0985
20. Murakoshi M, Gohda T, Suzuki Y. Circulating Tumor Necrosis Factor Receptors: A Potential Biomarker for the Progression of Diabetic Kidney Disease. Int J Mol Sci. 2020;21(6):1957. doi: https://doi.org/10.3390/ijms21061957
21. Altinova AA, Arslan M, Sepici-Dincel A, et al. Uncomplicated type 1 diabetes is associated with increased asymmetric dimethylarginine concentrations, The Journal of Clinical Endocrinology & Metabolism. 2007;92(5):1881-1885. doi: https://doi.org/10.1210/jc.2006-2643
22. Liu X, Xu X, Shang R, Chen Y. Asymmetric dimethylarginine (ADMA) as an important risk factor for the increased cardiovascular diseases and heart failure in chronic kidney disease. Nitric Oxide. 2018;78:113-120. doi: https://doi.org/10.1016/j.niox.2018.06.004
23. Швангирадзе Т.А., Бондаренко И.З., Трошина Е.А., и соавт. Влияние ангиотензина II и трансформирующего фактора роста β на сердечно-сосудистые заболевания и поражение почек у пациентов с сахарным диабетом 2 типа // Ожирение и метаболизм. — 2019. — Т.16. — № 3. — С. 55-61. doi: https://doi.org/10.14341/omet10346
24. Stefoni S, Cianciolo G, Donati G, et al. Low TGF-beta1 serum levels are a risk factor for atherosclerosis disease in ESRD patients. Kidney Int. 2002;61(1):324-35. doi: https://doi.org/10.1046/j.1523-1755.2002.00119.x
25. Zhao L, Zou Y, Liu F. Transforming Growth Factor-Beta1 in Diabetic Kidney Disease. Front Cell Dev Biol. 2020;8:187. doi: https://doi.org/10.3389/fcell.2020.00187
26. Sharma K, McGowan TA. TGF-beta in diabetic kidney disease: role of novel signaling pathways. Cytokine Growth Factor Rev. 2000;11(1-2):115-23. doi: https://doi.org/10.1016/s1359-6101(99)00035-0
27. Yuan Q, Tan RJ, Liu Y. Myofibroblast in kidney fibrosis: origin, activation, and regulation. Adv Exp Med Biol. 2019;1165:253-283. doi: https://doi.org/10.1007/978-981-13-8871-2_12
28. Perkins BA, Ficociello LH, Silva KH, et al. Regression of microalbuminuria in type 1 diabetes. N Engl J Med. 2003;348(23):2285-93. doi: https://doi.org/10.1056/NEJMoa021835
29. Zhang L, Wen Z, Han L, et al. Research Progress on the Pathological Mechanisms of Podocytes in Diabetic Nephropathy. J Diabetes Res. 2020;2020:7504798. doi: https://doi.org/10.1155/2020/7504798
30. Reiser J, Lee HW, Gupta V, Altintas MM. A high-content screening technology for quantitatively studying podocyte dynamics. Adv Chronic Kidney Dis. 2017;24(3):183-188. doi: https://doi.org/10.1053/j.ackd.2017.04.001
31. Garg P. A review of podocyte biology. Am J Nephrol. 2018;47 Suppl 1:3-13. doi: https://doi.org/10.1159/000481633
32. Shankland SJ, Rule AD, Kutz JN, et al. Podocyte senescence and aging. Kidney360. 2023;4(12):1784-1793. doi: https://doi.org/10.34067/KID.0000000000000284
33. Lasagni L, Lazzeri E, Shankland SJ, et al. Podocyte mitosis - a catastrophe. Curr Mol Med. 2013;13(1):13-23. doi: https://doi.org/10.2174/1566524011307010013
Об авторах
М. И. ЕвлоеваРоссия
Евлоева Мадина Иссаевна, аспирант
117292, г. Москва, ул. Дмитрия Ульянова, д. 11
М. С. Арутюнова
Россия
Арутюнова Маргарита Станиславовна
Москва
Л. В. Никанкина
Россия
Никанкина Лариса Вячеславовна, к.м.н.
Москва
А. И. Слепцова
Россия
Слепцова Арина Игоревна
Москва
О. Н. Науменко
Россия
Науменко Оксана Николаевна
Москва
З. Т. Зураева
Россия
Зураева Замира Тотразовна, к.м.н.
Москва
А. С. Северина
Россия
Северина Анастасия Сергеевна, к.м.н., в.н.с.
Москва
Н. П. Трубицына
Россия
Трубицына Наталья Петровна, к.м.н., в.н.с.
Москва
М. Ш. Шамхалова
Россия
Шамхалова Минара Шамхаловна, д.м.н.
Москва
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Распределение пациентов с сахарным диабетом 1 типа длительного течения (20 и более лет) в соответствии с расчетной скоростью клубочковой фильтрации и альбуминурией на момент начала исследования (выделены желтым) и при контроле в динамике (выделены зеленым). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(238KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Евлоева М.И., Арутюнова М.С., Никанкина Л.В., Слепцова А.И., Науменко О.Н., Зураева З.Т., Северина А.С., Трубицына Н.П., Шамхалова М.Ш., Шестакова М.В. Маркеры воспаления, фиброза, эндотелиальной дисфункции, подоцитопатии у пациентов с длительным течением сахарного диабета 1 типа. Сахарный диабет. 2025;28(2):151-163. https://doi.org/10.14341/DM13332
For citation:
Yevloyeva M.I., Arutyunova M.S., Nikankina L.V., Sleptsova A.I., Naumenko O.N., Zuraeva Z.T., Severina A.S., Trubitsyna N.P., Shamkhalova M.S., Shestakova М.V. Markers of inflammation, fibrosis, endothelial dysfunction, and podocytopathy in patients with long-term type 1 diabetes mellitus. Diabetes mellitus. 2025;28(2):151-163. (In Russ.) https://doi.org/10.14341/DM13332
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































