Перейти к:
Влияние времени приема пищи на постпрандиальную гликемию у пациентов с сахарным диабетом 2 типа и ожирением, не получающих инсулин
https://doi.org/10.14341/DM13023
Аннотация
ОБОСНОВАНИЕ. Риск развития микро- и макрососудистых заболеваний у пациентов с сахарным диабетом 2 типа (СД2) увеличивается на фоне постпрандиальной гипергликемии (ППГ). Циркадные ритмы могут оказывать влияние на ППГ, которая может определять вариабельность гликемии в течение дня. По данным литературы, у лиц без СД2 ППГ максимальна после ужина. Особенности постпрандиального ответа у пациентов с СД2 недостаточно изучены.
ЦЕЛЬ. Изучить вариабельность постпрандиальной гликемии на основании флеш-мониторинга глюкозы в зависимости от времени приема пищи (завтрак, обед, ужин) у пациентов с СД2, не получающих инсулин.
МАТЕРИАЛЫ И МЕТОДЫ. В открытое проспективное исследование включались пациенты с СД2, не получающие инсулин. Всем были установлены датчики для проведения флеш-мониторирования гликемии (ФМГ) FreeStyleLibre. Каждому пациенту проведено 9 тестов с различными видами пищевых нагрузок (вареной гречкой 250 г, яблоком 200 г и белым хлебом 30 г) в завтрак, обед и ужин.
Проведены статистический анализ ППГ по площади под гликемической кривой глюкозы крови (AUC ГК) и площади под гликемической кривой за вычетом базового уровня гликемии глюкозы крови (delta AUC ГК), анализ гликемии перед приемами пищи (Start_gly). Статистический анализ был выполнен в среде разработки RStudio 2022.02.3 с помощью языка R версии 4.1.2. Для количественных переменных представлены средние арифметические значения и стандартные отклонения (M±SD).
РЕЗУЛЬТАТЫ. Всего в исследование включены 48 пациентов с СД2, не получающих инсулин. В окончательный анализ включены данные 35 пациентов, 315 тестов с пищевыми нагрузками. Было показано, что время приема пищи (р=0,003) оказывает значительное влияние на ППГ AUC ГК. Максимальные значения AUC ГК наблюдались после завтрака (р=0,005 по сравнению с ужином, р<0,001 по сравнению с обедом). Для delta AUC ГК также выявлено значимое влияние времени приема пищи (р=0,001).
ЗАКЛЮЧЕНИЕ. У пациентов с СД2, не получающих инсулин, максимальный подъем гликемии в ответ на прием пищи отмечен в утренние часы, тогда как, по имеющимся литературным данным, у лиц с нормогликемией ППГ максимальна после ужина. Это расхождение в постпрандиальном ответе в зависимости от времени приема пищи, возможно, связано с нарушениями циркадных ритмов у пациентов с СД2.
Ключевые слова
Для цитирования:
Мисникова И.В., Золоева Д.Э., Глазков А.А. Влияние времени приема пищи на постпрандиальную гликемию у пациентов с сахарным диабетом 2 типа и ожирением, не получающих инсулин. Сахарный диабет. 2023;26(5):455-463. https://doi.org/10.14341/DM13023
For citation:
Misnikova I.V., Zoloeva D.E., Glazkov A.A. Effect of meal time on postprandial glycemia in patients with type 2 diabetes mellitus and obesity not receiving insulin. Diabetes mellitus. 2023;26(5):455-463. (In Russ.) https://doi.org/10.14341/DM13023
ОБОСНОВАНИЕ
В настоящее время суточный мониторинг гликемии признан, наряду с определением уровня гликированного гемоглобина, важным методом контроля эффективности лечения у пациентов с сахарным диабетом (СД). В Алгоритмах специализированной помощи от 2022 г. отмечено, что для пациентов, осуществляющих самоконтроль с помощью систем непрерывного мониторирования глюкозы, необходимо определять цели гликемического контроля, а именно время в целевом диапазоне, а также время выше и ниже целевого диапазона [1]. Все больший интерес вызывает использование непрерывного мониторирования глюкозы у пациентов с СД 2 типа (СД2), в том числе без инсулинотерапии, для усиления контроля за вариабельностью гликемии и увеличения времени нахождения в целевом диапазоне [2][3].
Постпрандиальная гипергликемия (ППГ) у пациентов с СД2 является независимым фактором риска развития микро- и макрососудистых заболеваний, поражений периферических нервов [4][5]. Выраженность постпрандиальных пиков зависит от состава и количества съеденной пищи. В литературе имеются данные о влиянии времени суток на секрецию инсулина и постпрандиальный подъем гликемии [6]. В статье представлены результаты исследования ППГ в зависимости от приема пищи в различное время суток.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить вариабельность ППГ на основании флеш-мониторинга глюкозы (ФМГ) в зависимости от времени приема пищи (завтрак, обед, ужин) у пациентов с СД2, не получающих инсулин.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения
В исследование были включены пациенты с СД2, обратившиеся за медицинской помощью в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского», а также в другие медицинские организации Московской области.
Время исследования
Анализ материала, собранного с 2021 по 2023 гг.
Изучаемая популяция
В исследование включались пациенты, соответствующие следующим критериям: подтвержденный диагноз СД2; возраст до 70 лет; прием таблетированных сахароснижающих препаратов в стабильной дозе не менее месяца, а именно метформин и ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГТЛ2); индекс массы тела (ИМТ) более 35 кг/м² (классификация ожирения по индексу массы тела (Всемирная организация здравоохранения (ВОЗ), 1997); достаточные когнитивные способности, умение пользоваться смартфоном и компьютером; подписанное информированное согласие. Не включались пациенты на инсулинотерапии или получавшие инсулин менее чем за 6 мес до включения в исследование; пациенты, получающие терапию агонистами рецепторов глюкагоноподобного пептида-1 (ар-ГПП1), сульфонилмочевиной, ингибиторами дипептидилпептидазы-4 (иДПП4); с длительностью СД2 более 25 лет, с тяжелыми соматическими заболеваниями, затрудняющими участие в исследовании.
Способ формирования выборки из изучаемой популяции
В данном исследовании назначался произвольный способ формирования выборки.
Дизайн исследования
Открытое проспективное одномоментное исследование.
Всем пациентам, соответствующим критериям включения/невключения, назначался тест с пищевыми нагрузками. Первое тестирование проводилось не ранее чем через сутки после установки датчика FreeStyle Libre. В качестве тестируемых пищевых нагрузок использовались вареная гречка (250 г=50 г углеводов, пищевые волокна 10 г), белый хлеб (30 г=15 г углеводов, пищевые волокна 0,81 г), одно среднее яблоко (~ 200 г ~ 19 г углеводов, пищевые волокна 4,8 г). Каждый продукт использовался в завтрак с 6:00 до 11:00, обед с 12:00 до 16:00 и ужин с 18:00 до 20:00. Пищевые тесты проводились в качестве основного приема пищи. Пищевые нагрузки различались по количеству углеводов и пищевых волокон, так как не стояла задача в сравнении постпрандиальных пиков в ответ на прием различных пищевых стимулов. За 14 дней пациенту необходимо было выполнить 9 тестов с пищевой нагрузкой. Каждый пациент в день выполнял до 3 тестов с различными видами пищевой нагрузки. Уровень глюкозы определялся при помощи датчика ФМГ перед и каждые 15 минут в течение 2 ч после пищевой нагрузки. Следующий пищевой тест проводился не ранее чем через 2 ч после приема пищи. Пациенты находились на плановом стационарном лечении в отделении терапевтической эндокринологии, получали основной вариант диеты 9. Во время проведения пищевого теста ограничивались любой прием пищи, а также физическая активность. Данные измерений фиксировались в дневнике самоконтроля гликемии.
Методы
Мониторирование гликемии
Всем пациентам были установлены датчики для проведения ФМГ FreeStyle Libre в режиме реального времени. С пациентами проведено обучение технике использования датчика ФМГ. Пациентам рекомендовалось проводить считывание ридером/пультом либо смартфоном с установленным специальным приложением FreeStyle LibreLink не реже чем каждые 8 ч и не менее 14 раз в сутки.
Основной гипотезой исследования являлось наличие различий в ППГ, рассчитанной как площадь под кривой, и площади под кривой постпрандиальной гликемии за вычетом базового уровня гликемии, пиковой гликемии в зависимости от времени приема пищи (в завтрак, обед, ужин).
Оценка гликемических кривых
Способ расчета показателей, характеризующих кривые ППГ, представлен на рис. 1. Рассчитывали стартовый, минимальный и максимальный уровни гликемии в ммоль/л (рис. 1А), а также площадь под графиком гликемии за 120 минут в мин. × ммоль/л (рис. 1Б), площадь под графиком гликемии за вычетом базального уровня гликемии в мин. × ммоль/л (рис. 1В). Если пациент несколько раз проводил тест для одного и того же типа пищи и времени приема пищи, рассчитанные для нескольких кривых ППГ показатели усредняли.

Рисунок 1. Способы расчета показателей,
характеризующих гликемическую кривую:
А — анализ стартового, минимального и максимального уровня гликемии;
Б — анализ площади под кривой постпрандиальной глюкозы крови (AUC ГК);
В — расчет площади под кривой постпрандиальной глюкозы крови
за вычетом базового уровня гликемии (delta AUC ГК).
Статистические методы
Статистический анализ был выполнен в среде разработки RStudio 2022.02.3 (RStudio PBC, USA) с помощью языка R версии 4.1.2. Нормальность распределения количественных переменных проверяли с помощью критерия Шапиро–Уилка и построения диаграмм квантиль-квантиль (QQ-plot). Для нормально распределенных переменных рассчитывали средние арифметические значения и стандартные отклонения (на графиках представлены средние арифметические значения и двусторонние 95% доверительные интервалы для средних значений), для переменных с распределением, отличным от нормального, рассчитывали медианы и квартили. Так как распределение показателей, характеризующих гликемические кривые, не отличалось от нормального, анализ влияния времени приема пищи и типа пищи на данные показатели проводили с помощью двухфакторного дисперсионного анализа для повторных измерений (two-wayrepeatedmeasures ANOVA). Оценивались как влияние самих факторов, так и их взаимодействие (Тип: время приема). В случае нарушения допущения о сферичности ковариационно-дисперсионной матрицы применялась поправка Гринхауса–Гейсера. Апостериорные попарные сравнения проводили с помощью критерия Стьюдента для зависимых выборок с поправкой Хольма–Бонферрони на множественные сравнения. Вероятность ошибки первого рода (α) была установлена равной 0,05. Нулевые гипотезы отвергали при p<α.
Этическая экспертиза
Проведение исследования было одобрено независимым комитетом по этике при ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского»: выписка из протокола заседания № 14 от сентября 2021 г. Перед включением в исследование все пациенты подписали информированное согласие.
РЕЗУЛЬТАТЫ
Всего тесты с пищевыми нагрузками были выполнены 48 пациентами с СД2, в окончательный анализ включены данные 35 пациентов. Данные 13 пациентов не вошли в анализ в связи с неполным выполнением пациентами всех запланированных тестов. В окончательный анализ включены результаты 315 тестов с пищевыми нагрузками и 25 515 измерений гликемии с помощью датчика ФМГ. Характеристика пациентов, включенных в исследование, представлена в табл. 1.
Таблица 1. Характеристика пациентов, включенных в исследование
|
Параметр |
Характеристика пациентов N=35 |
|
|
Пол |
Женский, n (%) |
22 (62,9) |
|
Мужской, n (%) |
13 (37,1) |
|
|
Возраст, Me [ Q1; Q3] |
51 [ 46; 59,5] |
|
|
Длительность СД, лет, Me [ Q1; Q3] |
4 [ 2; 9] |
|
|
Исходный вес, кг, Me [ Q1; Q3] |
126 [ 108,5; 145] |
|
|
ИМТ, кг/м², Me [ Q1; Q3] |
45,15 [ 39,75; 49,03] |
|
|
НbА1с исходный, %, Me [ Q1; Q3] |
6,7 [ 6,15; 7,4] |
|
|
Активное время, %, Me [ Q1; Q3] |
66 [ 57; 88] |
|
|
НМГ (время в целевом диапазоне), Me [ Q1; Q3] |
92 [ 80,5; 97] |
|
|
% выше пределах целевого диапазона, Me [ Q1; Q3] |
0 [ 0; 7,5] |
|
|
% ниже целевого диапазона, Me [ Q1; Q3] |
4 [ 0; 9] |
|
|
Вариабельность уровня глюкозы, %, Me [ Q1; Q3] |
18,9 [ 15,7; 21,1] |
|
Примечание: Результаты представлены
в виде среднего значения и стандартного отклонения [ M±SD],
а также медианы и межквартильного размаха (Me [ Q1; Q3]).
HbA1c — гликированный гемоглобин,
ИМТ — индекс массы тела,
НМГ — непрерывное мониторирование глюкозы.
Пациенты получали метформин — 53%, иНГТЛ2 — 9%, метформин в комбинации с иНГТЛ2 — 38% (расчет проведен по 34 пациентам, 1 пациент из группы наблюдения не получал сахароснижающие препараты).
Результаты оценки показателей, характеризующих кривые ППГ, представлены в табл. 2.
Таблица 2. Описательная статистика для показателей,
характеризующих гликемические кривые
|
Параметр |
Прием пищи |
Вид пищи |
||
|
белый хлеб |
гречка |
яблоко |
||
|
Стартовая гликемия, ммоль/л |
завтрак |
6±1,6 |
6,2±1,8 |
6,1±1,6 |
|
обед |
5,9±1,5 |
5,8±1,6 |
6±1,4 |
|
|
ужин |
6,4±1,7 |
6,3±2,2 |
6,3±2,5 |
|
|
Минимальная гликемия, ммоль/л |
завтрак |
5,7±1,7 |
5,9±1,9 |
5,6±1,5 |
|
обед |
5,3±1,3 |
5,3±1,3 |
5,1±1 |
|
|
ужин |
5,6±1,4 |
5,4±1,8 |
5,5±1,8 |
|
|
Максимальная гликемия, ммоль/л |
завтрак |
8,3±2,1 |
9±2,4 |
7,8±2 |
|
обед |
7,3±1,5 |
7,8±1,8 |
6,7±1,4 |
|
|
ужин |
7,6±1,8 |
8,2±2,3 |
7,4±2,2 |
|
|
AUC ГК, мин. × ммоль/л |
завтрак |
849,6±233,1 |
913,2±268,9 |
805,8±199,6 |
|
обед |
747,2±152,3 |
786,4±171,5 |
707,2±133,9 |
|
|
ужин |
791,9±181,2 |
830,8±244,3 |
781,9±242,1 |
|
|
Delta AUC ГК, мин. × ммоль/л |
завтрак |
130,9±87,2 |
165,1±115,1 |
75,9±109,1 |
|
обед |
35,8±113,6 |
88±115,9 |
-18,6±105,2 |
|
|
ужин |
22,2±90,1 |
78,6±132 |
21,1±106,4 |
|
Примечание: Результаты представлены
в виде среднего значения и стандартного отклонения [ M±SD].
В табл. 3 представлены результаты анализа влияния типа пищи и времени приема пищи на данные показатели с помощью двухфакторного дисперсионного анализа для повторных измерений.
Таблица 3. Результаты дисперсионного анализа,
эффект типа пищи и времени приема пищи на показатели,
характеризующие гликемические кривые
|
Параметр |
Анализируемый |
Результаты дисперсионного анализа |
|||
|
DFn |
DFd |
F |
Значение р |
||
|
Стартовая гликемия, ммоль/л |
Тип пищи |
2 |
68 |
0,068 |
0,934 |
|
Время приема пищи |
2 |
68 |
2,206 |
0,118 |
|
|
Тип: время приема |
1,95 |
66,29 |
0,365 |
0,69 |
|
|
Минимальная гликемия, ммоль/л |
Тип пищи |
1,66 |
56,29 |
1,474 |
0,238 |
|
Время приема пищи |
2 |
68 |
6,365 |
0,003* |
|
|
Тип: время приема |
1,82 |
61,98 |
0,514 |
0,584 |
|
|
Максимальная гликемия, ммоль/л |
Тип пищи |
2 |
68 |
13,82 |
<0,001* |
|
Время приема пищи |
2 |
68 |
16,784 |
<0,001* |
|
|
Тип: время приема |
2,44 |
82,95 |
0,376 |
0,729 |
|
|
AUC ГК, мин. × ммоль/л |
Тип пищи |
2 |
68 |
12,565 |
<0,001* |
|
Время приема пищи |
2 |
68 |
16,582 |
<0,001* |
|
|
Тип: время приема |
1,98 |
67,29 |
0,522 |
0,594 |
|
|
Delta AUC ГК, мин. × ммоль/л |
Тип пищи |
2 |
68 |
13,827 |
<0,001* |
|
Время приема пищи |
2 |
68 |
19,045 |
<0,001* |
|
|
Тип: время приема |
3,18 |
108,13 |
1,315 |
0,273 |
|
Примечание: *p-критерий менее 0,05.
В строке «Тип: время приема» анализируется совместное влияние факторов.
DFn, DFd – степени свободы в числителе и в знаменателе,
F – статистика критерия.
Стартовый уровень гликемии был выше перед завтраком по сравнению с обедом и ужином.
На максимальный уровень гликемии было обнаружено влияние времени ее приема (p=0,004). После завтрака максимальный уровень гликемии был выше, чем после обеда (p<0,001) и после ужина (p=0,004), при этом в обед отмечался более низкий уровень максимальной гликемии в сравнении с ужином (p=0,006) (рис. 2).
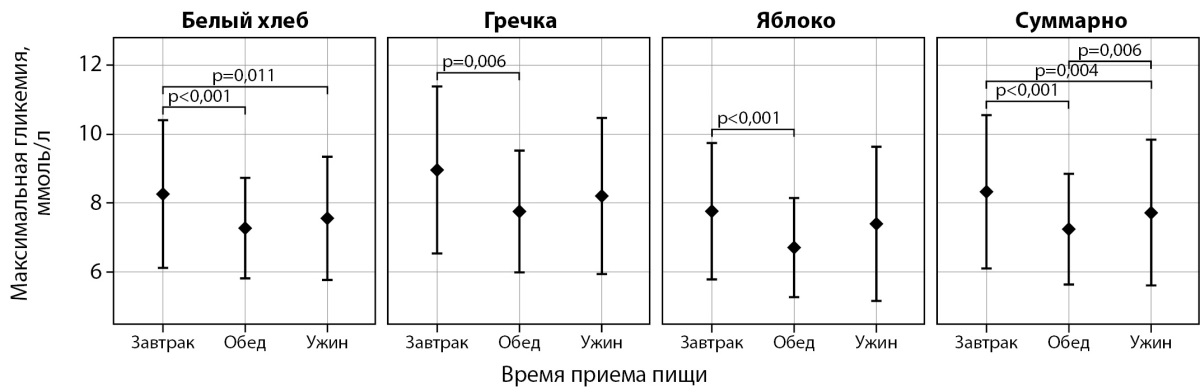
Рисунок 2. Анализ влияния времени приема пищи
на максимальный уровень постпрандиальной гликемии.
На графиках представлены средние значения и стандартные отклонения.
Значения p приведены для t-теста для зависимых выборок
с поправкой Хольма–Бонферрони.
Аналогичная картина наблюдалась и для AUC ГК: на этот показатель время приема пищи также оказывало значимое влияние (p<0,001). AUC ГК на завтрак была значимо выше, чем в обед (p<0,001) или на ужин (p=0,01), при этом значения на ужин были выше, чем в обед (p=0,002) (рис. 3).
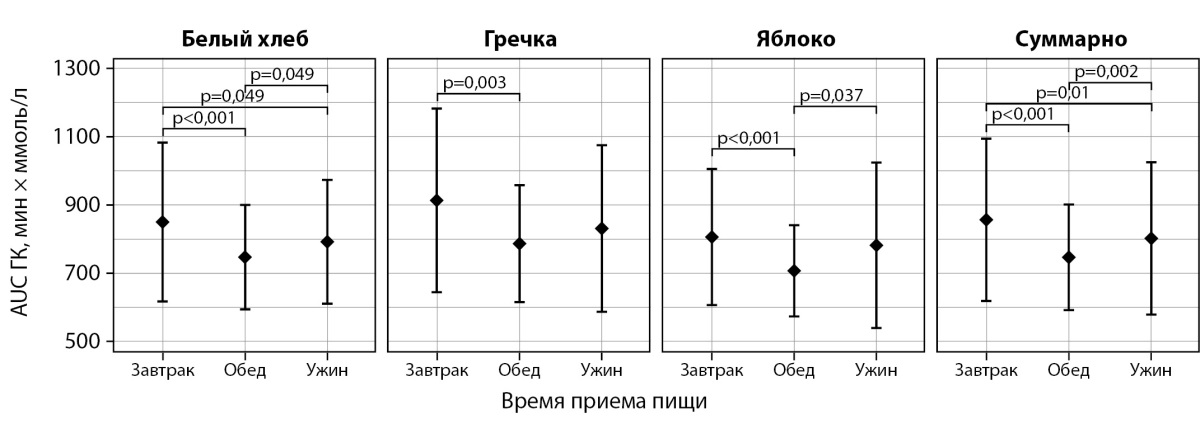
Рисунок 3. Анализ влияния времени приема пищи на показатель AUC ГК
(площадь под кривой постпрандиальной глюкозы крови).
На графиках представлены средние значения и стандартные отклонения.
Значения p приведены для t-теста для зависимых выборок
с поправкой Хольма–Бонферрони.
Для delta AUC ГК также было обнаружено значимое влияние времени ее приема (p<0,001). При оценке ППГ в зависимости от времени приема пищи показатель delta AUC ГК был статистически значимо выше на завтрак по сравнению со значениями в обед (p<0,001) и на ужин (p<0,001) (рис. 4).
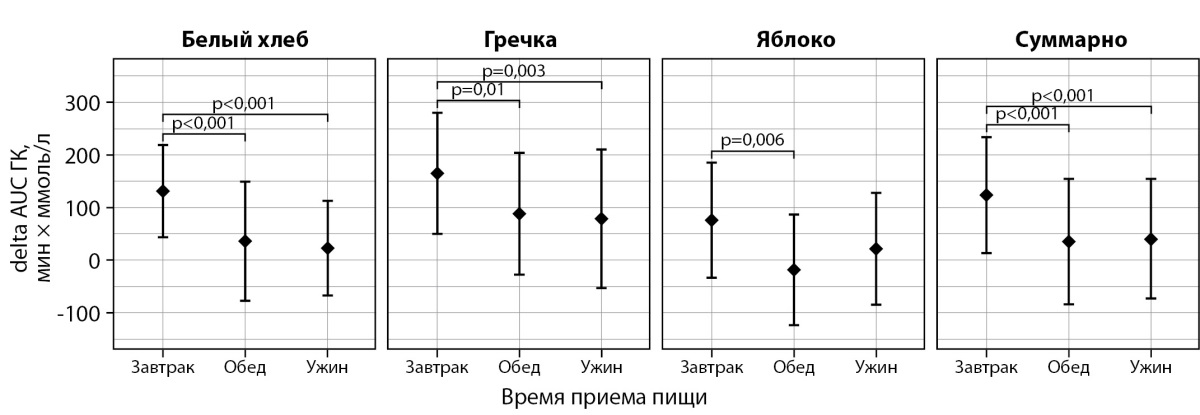
Рисунок 4. Анализ влияния времени приема пищи
на показатель delta AUC ГК
(площадь под кривой постпрандиальной глюкозы крови
за вычетом базового уровня гликемии).
На графиках представлены средние значения и стандартные отклонения.
Значения p приведены для t-теста для зависимых выборок
с поправкой Хольма–Бонферрони.
ОБСУЖДЕНИЕ
ППГ ассоциирована с целым рядом патологических состояний. К ним относятся накопление микро- и макрососудистых повреждений [7], усиление гликирования белков и системного воспаления, прогрессирование эндотелиальной дисфункции [8]. Именно ППГ, а не HbA1c и глюкоза натощак, ассоциирована с увеличением риска сердечно-сосудистой смертности, инфарктом миокарда, инсультом или госпитализацией по поводу сердечной недостаточности у пациентов с ишемической болезнью сердца без СД2 в анамнезе [9]. По данным ряда исследований, ППГ может влиять на развитие цирроза печени, а также рака кишечника и желчного пузыря [10]. Кроме того, у пациентов с СД2, не получающих инсулин, ППГ может вносить существенный вклад в суточную вариабельность гликемии.
Совокупная длительность постпрандиального периода составляет около 16 ч в сутки. В постпрандиальное состояние вовлекается целый ряд факторов, которые определяют реакцию организма и оказывают мощное воздействие на обмен веществ, хроническое воспаление и здоровье.
Достижение контроля ППГ снижает риск сердечно-сосудистых заболеваний [11] и смертности [12]. Эффективный контроль и мониторинг ППГ является важной задачей лечения пациентов с СД2. Основным фактором, влияющим на ППГ, является количество принятых углеводов. Вместе с тем целый ряд факторов могут оказывать воздействие на ППГ, что объясняет как межличностные, так и внутриличностные различия в гликемическом ответе на одинаковый по количеству углеводов прием пищи. Постпрандиальный гликемический ответ больше при приеме углеводистой пищи с высоким содержанием белков и жиров по сравнению с приемом пищи, преимущественно содержащей углеводы [13]. На ППГ оказывают влияние генетические аспекты (например, ген, определяющий активность амилазы слюны), образ жизни, непереносимость лактозы и/или других олиго-, ди-, моносахаридов, состав и особенность микробиоты кишечника, частота пережевывание пищи [14]. В литературе описан феномен второго приема пищи, который заключается в меньшем постпрандиальном подъеме гликемии после обеда при условии съеденного завтрака. Эта закономерность отмечена как у лиц с нормогликемией, так и у пациентов с СД2. Прием пищи на завтрак уменьшает постпрандиальный подъем гликемии в обед [15].
Результаты ряда исследований показывают, что время приема пищи также может влиять на гликемический ответ и вносить вклад во внутриличностную вариабельность ППГ. Это можно объяснить влиянием циркадных ритмов на секрецию инсулина и выраженность инсулинорезистентности. Известно, что у здоровых людей с нормальным углеводным обменом вечером чувствительность к инсулину ниже, чем в утренние часы. Следовательно, прием углеводов на ужин приводит к большему подъему гликемии, чем то же количество углеводов, съеденное на завтрак [16]. Относительная инсулинорезистентность в вечернее время может быть связана с суточными колебаниями в уровне свободных жирных кислот (СЖК) и их влиянием на утилизацию глюкозы мышцами. Повышенный уровень СЖК плазмы в вечернее время может способствовать снижению чувствительности к инсулину мышцами. Повышение уровня СЖК перед ужином связано с гидролизом липидов, полученных с пищей, съеденной в предыдущий прием пищи, а не с увеличением липолиза триглицеридов жировой ткани. Кроме того, отмечена повышенная активность в вечернее время часовых генов, стимулирующих липогенез в мышечной ткани, и пониженная активность часовых генов, регулирующих окисление жирных кислот. Продукция специфических метаболитов жирных кислот, нарушающих действие инсулина, может способствовать инсулинорезистентности вечером [17].
Биологические часы в супрахиазмальном ядре гипоталамуса (СЯГ) регулируют физиологические суточные ритмы эндогенной продукции глюкозы и чувствительность к инсулину печени посредством нейрогуморальных механизмов. Последние исследования показывают, что у лиц с нормогликемией повышение чувствительности к инсулину в утренние часы связано с часовым репрессором Rev-Erbα/β, который экспрессируется в мозге, печени, сердце, легких, жировой ткани, скелетных мышцах. Rev-Erbα/β признан в качестве основного регулятора метаболизма, митохондриального биогенеза, воспалительного ответа и фиброза [18]. Через свои рецепторы в СЯГ он контролирует суточный ритм инсулин-опосредованного подавления продукции глюкозы печенью [19]. Нарушение на молекулярном уровне в центральных циркадных часах СЯГ, в частности в регуляторной функции Rev-Erbα/β, связано с синдромом «утренней зари», который возникает примерно у половины пациентов с СД1 и СД2 и заключается в повышении уровня гликемии в ранние утренние часы, примерно с 3 ч ночи до 8 ч утра [20].
В нашем исследовании у пациентов с СД2 самая высокая гликемия перед едой отмечалась во время завтрака, что подтверждает наличие феномена «утренней зари» у пациентов с СД2. Также после завтрака максимальный уровень ППГ был выше, чем после обеда и после ужина (рис. 2). Более высокие показатели ППГ после завтрака связаны с более высоким уровнем гликемии перед завтраком. При оценке площади под гликемической кривой выявлено, что на данный показатель влияет время приема пищи. AUC ГК во время завтрака была значимо выше, чем в обед (p<0,001). ППГ после приема яблока была ниже, чем после гречки (p<0,001). Возможно, это отличие объясняется различиями в содержании клетчатки в пищевой нагрузке и, следовательно, влиянием пищи на кишечный микробиом, который также подвержен циркадным колебаниям [21].
После оценки delta AUC ГК также отмечено значимое повышение ППГ на завтрак (р<0,001). Интересно, что вариабельность гликемического ответа в зависимости от времени приема пищи отличалась после употребления различных пищевых нагрузок. Также отмечена тенденция к снижению ППГ в обеденное время по сравнению с завтраком.
Ограничения исследования
В анализ включены 315 тестов с пищевой нагрузкой 35 пациентов с СД2. Так как характер проводимой сахароснижающей терапии был достаточно однородным, то возможное влияние различных сахароснижающих препаратов на показатели гликемии перед приемами пищи и ППГ в разное время суток не оценивалось. Однако нельзя исключить влияние различных типов сахароснижающей терапии на циркадную регуляцию и различий ППГ в различное время дня — это может быть предметом для дальнейшего изучения.
ЗАКЛЮЧЕНИЕ
Существуют определенные отличия в средней гликемии перед приемом пищи и ППГ в зависимости от времени суток. У пациентов с СД2 средняя гликемия перед завтраком была выше, чем перед обедом и ужином, что может быть обусловлено феноменом «утренней зари». У пациентов с СД2, не получающих инсулин, максимальный подъем гликемии в ответ на прием пищи отмечен в утренние часы, тогда как, по имеющимся литературным данным, у лиц с нормогликемией ППГ максимальна после ужина. Это расхождение в постпрандиальном ответе в зависимости от времени приема пищи, возможно, связано с нарушениями циркадных ритмов у пациентов с СД2.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Мисникова И.В. — существенный вклад в концепцию и дизайн исследования, обработка научного материала, написание текста, утверждение окончательного варианта статьи для публикации; Золоева Д.Э. — участие в разработке дизайна, набор пациентов в исследование, сбор материала, написание текста, работа с базой данных, утверждение окончательного варианта статьи для публикации; Глазков А.А. — существенный вклад в анализ данных, работа с базой данных, редактирование текста, утверждение окончательного варианта статьи для публикации.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (10-й выпуск) // Сахарный диабет. — 2021. — Т. 24. — №S1. — С. 1-235. doi: https://doi.org/10.14341/DM12802
2. Климонтов В.В., Маякина Н.Е. Вариабельность гликемии при сахарном диабете: инструмент для оценки качества гликемического контроля и риска осложнений // Сахарный диабет. — 2014. — Т. 17. — №2. — С. 76-82. doi: https://doi.org/10.14341/DM2014276-82
3. Суплотова Л.А., Судницына А.С., Романова Н.В., и др. Время нахождения в целевом диапазоне гликемии — инструмент оценки качества гликемического контроля при сахарном диабете // Сахарный диабет. — 2021. — Т. 24. — №3. — С. 282-290. doi: https://doi.org/10.14341/DM12703
4. Петеркова В.А., Аметов А.С., Майоров А.Ю., и др. Резолюция научно-консультативного совета «Применение технологии непрерывного мониторинга глюкозы с периодическим сканированием в достижении гликемического контроля» // Сахарный диабет. — 2021. — Т. 24. — №2. — С. 185-192. doi: https://doi.org/10.14341/DM12753
5. Scott ES, Januszewski AS, O'Connell R, et al. Longterm glycemic variability and vascular complications in type 2 diabetes: Post hoc analysis of the FIELD study. J Clin Endocrinol Metab. 2020;105(10):e3638-e3649. doi: https://doi.org/10.1210/clinem/dgaa361
6. Silva FM, Kramer CK, Crispim D, Azevedo MJ. A high-glycemic index, low-fiber breakfast affects the postprandial plasma glucose, insulin, and ghrelin responses of patients with type 2 diabetes in a randomized clinical trial1-3. J Nutr. 2015;145(4):736-741. doi: https://doi.org/10.3945/jn.114.195339
7. Kodama S, Saito K, Tanaka S, et al. Fasting and postchallenge glucose as quantitative cardiovascular risk factors: a meta-analysis. J AtherosclerThromb. 2012;19(4):385-396. doi: https://doi.org/10.5551/jat.10975
8. Meessen EC, Warmbrunn MV, Nieuwdorp M, et al. Human postprandial nutrient metabolism and low-grade inflammation: A narrative review. Nutrients. 2019;11(12):3000. doi: https://doi.org/10.3390/nu11123000
9. Shahim B, De Bacquer D, De Backer G, et al. The prognostic value of fasting plasma glucose, two-hour postload glucose, and HbA1c in patients with coronary artery disease: A report from EUROASPIRE IV. Diabetes Care. 2017;40(9):1233-1240. doi: https://doi.org/10.2337/dc17-0245
10. Al-Damry NT, Attia HA, Al-Rasheed NM, et al. Sitagliptin attenuates myocardial apoptosis via activating LKB-1/AMPK/Akt pathway and suppressing the activity of GSK-Зв and p38a/MAPK in a rat model of diabetic cardiomyopathy. Biomed Pharmacother. 2018;107(9):347-358. doi: https://doi.org/10.1016/j.biopha.2018.07.126
11. Augustin LSA, Kendall CWC, Jenkins DJA, et al. Glycemic index, glycemic load and glycemic response: An International Scientific Consensus Summit from the International Carbohydrate Quality Consortium (ICQC). Nutr Metab Cardiovasc Dis. 2015;25(9):795-815. doi: https://doi.org/10.1016/j.numecd.2015.05.005
12. Nathan DM, Buse JB, Davidson MB, et al. Medical management of hyperglycemia in type 2 diabetes: A consensus algorithm for the initiation and adjustment of therapy. Diabetes Care. 2009;32(1):193-203. doi: https://doi.org/10.2337/dc08-9025
13. Bell KJ, Smart CE, Steil GM, et al. Impact of fat, protein, and glycemic index on postprandial glucose control in type 1 diabetes: implications for intensive diabetes management in the continuous glucose monitoring era. Diabetes Care. 2015;38(6):1008-1015. doi: https://doi.org/10.2337/dc15-0100
14. Walther B, Lett AM, Bordoni A, et al. GutSelf: Interindividual variability in the processing of dietary compounds by the human gastrointestinal tract. Mol Nutr Food Res. 2019;63(21). doi: https://doi.org/10.1002/mnfr.201900677
15. Chang CR, Francois ME, Little JP. Restricting carbohydrates at breakfast is sufficient to reduce 24-hour exposure to postprandial hyperglycemia and improve glycemic variability. Am J Clin Nutr. 2019;109(5):1302-1309. doi: https://doi.org/10.1093/ajcn/nqy261
16. Saad A, Dalla Man C, Nandy DK, et al. Diurnal pattern to insulin secretion and insulin action in healthy individuals. Diabetes. 2012;61(11):2691-2700. doi: https://doi.org/10.2337/db11-1478
17. Yoshino J, Almeda-Valdes P, Patterson BW, et al. Diurnal variation in insulin sensitivity of glucose metabolism is associated with diurnal variations in whole-body and cellular fatty acid metabolism in metabolically normal women. J Clin Endocrinol Metab. 2014;99(9):E1666-E1670. doi: https://doi.org/10.1210/jc.2014-1579
18. Raza GS, Sodum N, Kaya Y, Herzig K-H. Role of circadian transcription factor rev-erb in metabolism and tissue fibrosis. Int J Mol Sci. 2022;23(21):12954. doi: https://doi.org/10.3390/ijms232112954
19. Ding G, Li X, Hou X, et al. REV-ERB in GABAergic neurons controls diurnal hepatic insulin sensitivity. Nature. 2021;592(7856):763-767. doi: https://doi.org/10.1038/s41586-021-03358-w
20. Peng F, Li X, Xiao F, et al. Circadian clock, diurnal glucose metabolic rhythm, and dawn phenomenon. Trends Neurosci. 2022;45(6):471-482. doi: https://doi.org/10.1016/j.tins.2022.03.010
21. Matenchuk BA, Mandhane PJ, Kozyrskyj AL. Sleep, circadian rhythm, and gut microbiota. Sleep Med Rev. 2020;53(6):101340. doi: https://doi.org/10.1016/j.smrv.2020.101340
Об авторах
И. В. МисниковаРоссия
Мисникова Инна Владимировна – доктор медицинских наук.
Москва
Scopus Author ID: 559756
Конфликт интересов:
Нет
Д. Э. Золоева
Россия
Золоева Дзерасса Эльбрусовна.
129110, Москва, ул. Щепкина, д. 61/2
Конфликт интересов:
Нет
А. А. Глазков
Россия
Глазков Алексей Андреевич – кандидат медицинских наук.
Москва
Scopus Author ID: 57199329515, Researcher ID: R-7373-2016
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Способы расчета показателей, характеризующих гликемическую кривую: А — анализ стартового, минимального и максимального уровня гликемии; Б — анализ площади под кривой постпрандиальной глюкозы крови (AUC ГК); В — расчет площади под кривой постпрандиальной глюкозы крови за вычетом базового уровня гликемии (delta AUC ГК). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(538KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Анализ влияния времени приема пищи на максимальный уровень постпрандиальной гликемии. На графиках представлены средние значения и стандартные отклонения. Значения p приведены для t-теста для зависимых выборок с поправкой Хольма–Бонферрони. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(177KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Анализ влияния времени приема пищи на показатель AUC ГК (площадь под кривой постпрандиальной глюкозы крови). На графиках представлены средние значения и стандартные отклонения. Значения p приведены для t-теста для зависимых выборок с поправкой Хольма–Бонферрони. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(208KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Анализ влияния времени приема пищи на показатель delta AUC ГК (площадь под кривой постпрандиальной глюкозы крови за вычетом базового уровня гликемии). На графиках представлены средние значения и стандартные отклонения. Значения p приведены для t-теста для зависимых выборок с поправкой Хольма–Бонферрони. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(225KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мисникова И.В., Золоева Д.Э., Глазков А.А. Влияние времени приема пищи на постпрандиальную гликемию у пациентов с сахарным диабетом 2 типа и ожирением, не получающих инсулин. Сахарный диабет. 2023;26(5):455-463. https://doi.org/10.14341/DM13023
For citation:
Misnikova I.V., Zoloeva D.E., Glazkov A.A. Effect of meal time on postprandial glycemia in patients with type 2 diabetes mellitus and obesity not receiving insulin. Diabetes mellitus. 2023;26(5):455-463. (In Russ.) https://doi.org/10.14341/DM13023
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































