Перейти к:
Инсулинорезистентность и хроническая сердечная недостаточность с сохраненной фракцией выброса. Патогенетические и терапевтические перекрестки
https://doi.org/10.14341/DM12916
Аннотация
Инсулинорезистентность, являющаяся фундаментальным патогенетическим фактором предиабета, тесно связана с абдоминальным ожирением, с одной стороны, и развитием сердечно-сосудистых заболеваний, хронической сердечной недостаточности (ХСН), — с другой. Патогенетическая роль инсулинорезистентности многогранна и заключается в акселерации атеросклероза, формировании гипертрофии миокарда левого желудочка, в том числе через механизмы, не зависящие от артериального давления, а также развитии его диастолической дисфункции. Последняя является отправной точкой для старта ХСН с сохраненной фракцией выброса (ХСНсФВ).
По сравнению с пациентами с ХСН со сниженной фракцией выброса наличие ХСНсФВ определяет большую частоту госпитализаций не в связи с декомпенсацией сердечной недостаточности, а из-за сопутствующих заболеваний, таких как дестабилизация течения артериальной гипертензии, декомпенсация сахарного диабета 2 типа, курация которых в целом оказывает большее влияние с точки зрения улучшения прогноза. Таким образом, у пациентов с предиабетом и ХСНсФВ коррекция инсулинорезистентности как первопричины и триггера кардиометаболических нарушений потенциально может улучшить не только показатели инсулин-глюкозного гомеостаза, но и параметры диастолической функции миокарда. Данный литературный обзор посвящен накопленному опыту применения метформина как «стратегического» антидиабетического препарата при ХСНсФВ и рассмотрению потенциально новых точек его приложения в роли протектора сердечно-сосудистой системы.
Ключевые слова
Для цитирования:
Цыганкова О.В., Евдокимова Н.Е., Веретюк В.В., Латынцева Л.Д., Аметов А.С. Инсулинорезистентность и хроническая сердечная недостаточность с сохраненной фракцией выброса. Патогенетические и терапевтические перекрестки. Сахарный диабет. 2022;25(6):535-547. https://doi.org/10.14341/DM12916
For citation:
Tsygankova O.V., Evdokimova N.E., Veretyuk V.V., Latyntseva L.D., Ametov A.S. Insulin resistance and heart failure with preserved ejection fraction. Pathogenetic and therapeutic crossroads. Diabetes mellitus. 2022;25(6):535-547. (In Russ.) https://doi.org/10.14341/DM12916
ВВЕДЕНИЕ
Проблемы хронической сердечной недостаточности (ХСН) приобретают все большую значимость в связи с возрастающим распространением сердечно-сосудистых заболеваний (ССЗ), результирующих ее развитием, а также воздействием на миокард различных метаболических факторов, ожирения, эндокринных дисфункций, вклад которых нарастает лавинообразно, а также цитотоксических лекарственных препаратов, промышленных поллютантов. Выделение в актуальных клинических рекомендациях в рамках ХСН инструментальных фенотипов с сохраненной, умеренно сниженной и низкой фракцией выброса (ФВ) позволяет ранжировать доказательную базу и выделить группы пациентов с предпочтительными стратегиями медикаментозного вмешательства, направленными на достижение 6 целей лечения пациентов с ХСН и, прежде всего, снижение общей смертности [1]. В структуре ХСН все больший интерес в последние годы уделяется изучению ХСН с сохраненной фракцией выброса (ХСНсФВ) левого желудочка (ЛЖ), что обусловлено как широкой распространенностью, так и трудностями диагностики этого состояния. Риск смерти у пациентов с ХСНсФВ возрастает с увеличением бремени сопутствующих заболеваний [2]. Отдельного внимания заслуживает тот факт, что, в отличие от ХСН со сниженной ФВ ЛЖ (ХСНнФВ), при которой общепринятые алгоритмы лечения могут значительно улучшить прогноз, при ХСНсФВ этого не наблюдается, возможно, в связи с недостаточно изученными звеньями патогенеза данного процесса и гетерогенностью пациентов [3][4].
Роль сопутствующей патологии при ХСНсФВ, в частности, нарушений углеводного обмена (НУО), абдоминального ожирения, в последние годы широко обсуждается с позиций выделения особого фенотипа ХСН у таких пациентов [1]. Действительно, инсулинорезистентность, являющаяся ключевым патогенетическим драйвером предиабета, тесно связана с абдоминальным ожирением, с одной стороны, и коррелирует с развитием ХСН, прежде всего с ХСНсФВ, — с другой [5]. Метформин как классический инсулинсенситайзер может назначаться на протяжении всего континуума дисгликемии, выполняя плейотропную роль кардиоваскулярного протектора. В то же время, несмотря на обилие данных нерандомизированных, наблюдательных протоколов, регистров, в досье препарата отсутствуют рандомизированные плацебо-контролируемые исследования, изучающие его эффекты у пациентов с предиабетом и ХСНсФВ. Освещению накопленного пула данных по данной проблематике, а также нерешенных, острых вопросов кардиометаболических патогенетических перекрестков инсулинорезистентности и ХСН и посвящен настоящий обзор.
РОЛЬ НАРУШЕНИЙ УГЛЕВОДНОГО ОБМЕНА В ПАТОГЕНЕЗЕ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ С СОХРАНЕННОЙ ФРАКЦИЕЙ ВЫБРОСА
Пациенты с ХСН являются уязвимой группой в плане развития НУО: сахарного диабета 2 типа (СД2) и предиабета [6]. Так, по разным источникам, СД2 встречается у пациентов с ХСН в 12–46% случаев [7][8]. В ходе исследования PARADIGM-HF среди 8399 больных с ХСНнФВ II–IV функциональных классов (NYHA) распространенность латентных НУО оказалась весьма значительной, составив 38%: впервые выявленный предиабет — 25% и СД2 de novo — 13% [9]. Аналогичным образом, высокая распространенность предиабета была продемонстрирована у пациентов с ХСНнФВ в исследовании S.V. Arnold и соавт. (2019), что также было связано с худшими кардиологическими исходами по сравнению с теми, кто имел нормогликемию [10]. Стоит отметить, что о распространенности НУО среди больных ХСНсФВ известно гораздо меньше. Результаты исследования PARAGON-HF, опубликованные в 2021 г., позволили изучить частоту встречаемости СД2 и предиабета в большой многонациональной когорте пациентов с ХСНсФВ [11]. Из 4796 обследованных 2388 (49,8%) страдали СД2, у 334 (14% «диабетической» когорты) диагноз был установлен впервые. Кроме того, 874 пациента (18% общего количества) составили лица с предиабетом. Только 1534 (32,2%) имели нормальный уровень гликированного гемоглобина. Известно, что наличие НУО увеличивает риск смерти и госпитализаций в связи с декомпенсацией течения ХСН как при ХСНнФВ, так и при ХСНсФВ [12]. Помимо этого, верна и обратная зависимость — предиабет или СД2 эскалируют риски развития ХСН [13].
Наличие НУО ассоциировано с высокой распространенностью таких значимых факторов риска ХСН, как артериальная гипертензия (АГ) и ишемическая болезнь сердца (ИБС) [14]. У половины пациентов с СД2 в возрасте старше 40 лет возникает по меньшей мере одно ССЗ [15]. Вместе с тем уже с этапа недиабетической гипергликемии фиксируются структурные изменения миокарда [12][16]. Таким образом, НУО и ХСН — два хронических сопутствующих взаимоотягчающих состояния, которые не могут рассматриваться как две отдельные сущности, обсуждаемые изолированно. Наблюдаемая коморбидность НУО и ХСН может быть объяснена посредством нескольких механизмов. НУО влияют на метаболизм глюкозы и жирных кислот в миокарде [17], что ведет к накоплению триглицеридов в кардиомиоцитах и, через механизмы липотоксичности, — к ухудшению сократимости [18][19], увеличивается внутриклеточная концентрация кальция [20], ускоряется развитие коронарного атеросклероза [21], микрососудистой дисфункции [22][23], нейрогормональной дисрегуляции [17][22], увеличивается сердечный фиброз [12]. Множественное сочетание этих патофизиологических аномалий увеличивает риск развития сердечной дисфункции и добавляет нагрузку на уже обремененный миокард. В то же время пациенты с ХСН характеризуются нарушенным метаболизмом глюкозы и высокими показателями резистентности к инсулину, что еще более увеличивает риск развития несостоятельности миокарда [18]. В связи с этим ключевая роль в континууме ХСН и НУО многими авторами отдается инсулинорезистентности [12][18][22].
Важный механизм, посредством которого гипергликемия может способствовать развитию ХСН, связан с повышенной выработкой конечных продуктов гликирования (рис. 1) [12]. Подвергшиеся гликированию белки и углеводы взаимодействуют со специфическими рецепторами конечных продуктов гликирования и активируют их, запуская выработку активных форм кислорода, которые, в свою очередь, вызывают воспаление как в миокарде, так и в микроциркуляторном русле, инициируя и поддерживая процессы эндотелиальной дисфункции. Самоподдерживающиеся процессы окислительного стресса и воспаления приводят к апоптозу кардиомиоцитов [17], дисфункции митохондрий, в результате чего снижается выработка аденозинтрифосфата, выполняющего основную энергетическую роль в клетке, снижается поглощение кальция саркоплазматическим ретикулумом, что уменьшает силу сокращения сердца, то есть формируется и закрепляется отрицательный инотропный эффект [21]. Высокие концентрации конечных продуктов гликирования приводят и к органическим изменениям — развивается интерстициальный фиброз миокарда. Все эти факторы в совокупности определяют высокие риски развития ХСНсФВ [17]. С другой стороны, патогенез ХСНсФВ тесно связан и с классическими путями развития ХСН — активацией ренин-ангиотензин-альдостероновой системы, приводящей к задержке ионов натрия и воды, а также симпатической нервной системы, стимулирующей липолиз, что в сочетании с диетой «по западному образцу» и ожирением приводит к инсулинорезистентности или усугубляет уже имеющуюся, тем самым замыкая порочный круг [12].

Рисунок 1. Порочный круг между нарушениями углеводного обмена и хронической сердечной недостаточностью (адаптировано по E. Braunwald [12]).
Примечание: РААС — ренин-ангиотензин-альдостероновая система; ЛЖ — левый желудочек; ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса; ХСНнФВ — хроническая сердечная недостаточность со сниженной фракцией выброса; КПГ — конечные продукты гликирования.
Важно понимать, что механизмы формирования эндотелиальной дисфункции (сосудистое ремоделирование, накопление висцеральной (в т.ч. периваскулярной) жировой ткани, гипергликемия) начинают реализовываться задолго до развития СД2, ужена стадии инсулинорезистентности и предиабета [9][16]. Ряд авторов описывают инсулинорезистентность как автономный, независимый от ранее установленных фактор риска развития ХСН [24][25]. Все это дает возможность рассматривать снижение чувствительности к инсулину как патогенетическую мишень в лечении пациентов с НУО и ХСНсФВ.
ВИСЦЕРАЛЬНОЕ ОЖИРЕНИЕ КАК ОСНОВНОЕ ЗВЕНО В ЦЕПИ РАЗВИТИЯ НАРУШЕНИЙ УГЛЕВОДНОГО ОБМЕНА И ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ С СОХРАНЕННОЙ ФРАКЦИЕЙ ВЫБРОСА
В последние 10 лет появилось множество публикаций, свидетельствующих о том, что ожирение является важным причинным фактором развития ХСНсФВ, увеличивая эти риски более чем на 50%, поскольку оно привносит дополнительные патофизиологические механизмы, которые не наблюдаются у пациентов с ХСНсФВ и нормальным весом (рис. 2) [26][27].

Рисунок 2. Механизмы развития легочной гипертензии и хронической сердечной недостаточности у пациентов с ожирением (адаптировано по W. Paulus et al. [2]).
Примечания: ОЦК — объем циркулирующей крови; УО — ударный объем; ЛЖ — левый желудочек; ПЖ — правый желудочек; СОАС — синдром обструктивного апноэ сна.
При ХСНсФВ, когда систолическая функция сохранена, но растяжимость сердца нарушена из-за воспаления и/или фиброза, задержка натрия и увеличение объема плазмы приводят к переполнению сердца кровью, а не к его дилатации [28]. У пациентов с висцеральным ожирением высокие концентрации адипокинов усиливают передачу сигналов через лептиновые рецепторы, что и способствует ретенции натрия за счет прямого действия на почечные канальцы, увеличения активности ренальных симпатических нервов и стимуляции выработки альдостерона, вызывая тем самым гиперактивность неприлизина на фоне потери уравновешивающих эффектов натрийуретических пептидов (рис. 3) [28–30]. Эти сложные нейрогуморальные взаимодействия приводят к увеличению объема плазмы, а также к неблагоприятному ремоделированию желудочков и фиброзу сердца [31]. В свою очередь, повышенная активность альдостерона и неприлизина, ассоциированная с ожирением, способствует адипогенезу и дисфункции адипоцитов, замыкая петлю положительной обратной связи [32].
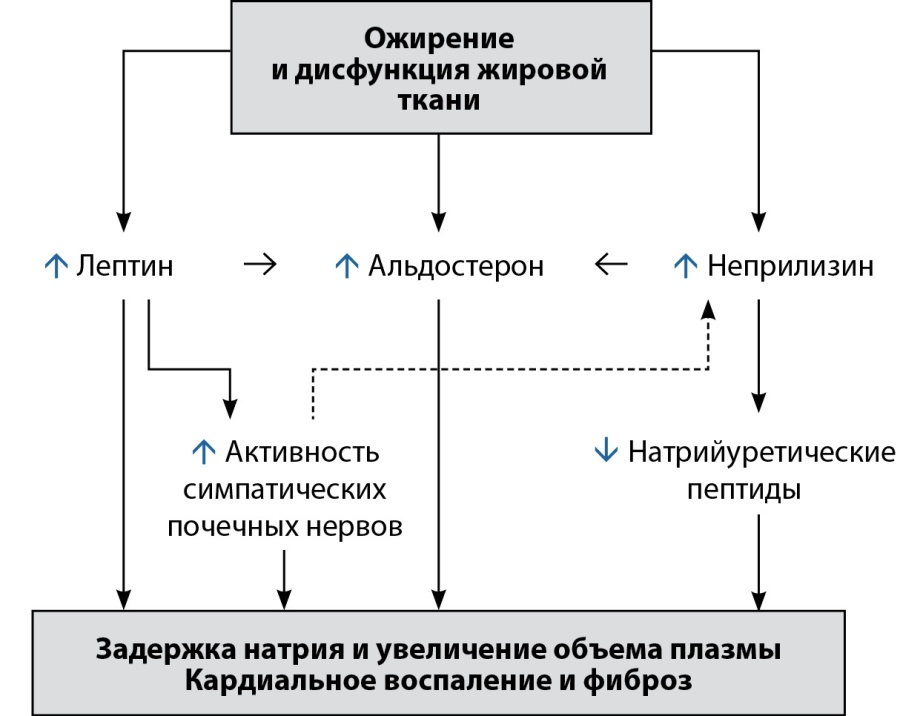
Рисунок 3. Ожирение и роль оси «лептин-альдостерон-неприлизин» в патогенезе хронической сердечной недостаточности (адаптировано по M. Packer [33]).
Результаты крупного наблюдательного исследования E.J. Rhee и соавт. (2020) показали связь между ожирением, гликемическим статусом и развитием ХСН. В рамках этого протокола 9 720 220 корейцев без ХСН, прошедшие Национальный скрининг здоровья, наблюдались в течение 6,3 года [34]. Участники с нарушенной толерантностью к глюкозе и СД2 показали значительно повышенный риск развития ХСН с любой ФВ ЛЖ (в 1,08 и 1,86 раза соответственно) по сравнению с участниками снормогликемией. Вероятность развития ХСН была еще более высокой у пациентов с дефицитом массы тела (индекс массы тела (ИМТ) <18,5 кг/м2) и ожирением II степени в сравнении с теми, кто имел нормальный ИМТ. Кроме того, все большее внимание исследователей уделяется не самому факту наличия ожирения, а качественному составу и распределению жировой ткани в организме человека.
Избыточное накопление интраабдоминального жира, независимо от массы тела, ведет к дислипидемии, инсулинорезистентности, АГ, увеличивает риск ИБС, ХСН, в том числе ХСНсФВ [35–37]. В продольном многоэтническом когортном исследовании (MESA Study) его величина, измеренная с помощью компьютерной томографии (КТ), предсказывала скорректированный риск госпитализаций по поводу ХСНсФВ, но не ХСНнФВ [38]. Избыточное количество висцерального жира может повышать риск развития ХСНсФВ даже среди тех, кто не имеет избыточного веса или ожирения, что актуализирует ограничения стандартной антропометрии [36]. Исследования, посвященные влиянию редукции интраабдоминального жира на параметры диастолической дисфункции, предотвращение новых случаев развития или госпитализаций, связанных с ухудшением течения ХСНсФВ, при литературном поиске нами не найдены.
Эпикардиальная жировая ткань (ЭЖТ) — это стратегическое депо висцерального жира, экспрессирующее рецепторы глюкагоноподобного пептида-1 (ГПП-1), которое считают изменяемым кардиометаболическим фактором риска и терапевтической целью [39]. ЭЖТ можно измерить путем количественной оценки толщины эпикардиального жира с использованием неинвазивных методов визуализации, которые включают двумерную трансторакальную эхокардиографию [40], КТ [41] и магнитно-резонансную томографию (МРТ), обеспечивающую максимальную воспроизводимость измерений по объему и толщине ЭЖТ [42]. В настоящее время особое внимание уделяется величине ЭЖТ при ХСНсФВ, поскольку выявлена связь данного показателя с параметрами диастолической дисфункции ЛЖ [43]. На рис. 4 продемонстрирована связь между метаболическими нарушениями, в частности, увеличенным объемом ЭЖТ, и развитием миопатии желудочков и предсердий, приводящей кформированию фибрилляции предсердий (ФП) и ХСНсФВ [44]. Таким образом, по сравнению с величиной подкожного жира, скопление висцерального жира в депо (в том числе интраабдоминальном и эпикардиальном) привносит больший вклад в увеличение рисков, ассоциированных с ХСНсФВ, и требует модификации в рамках единой стратегии кардиометаболического здоровья.

Рисунок 4. Механизмы развития и клинические эффекты миопатии предсердий и желудочков при ожирении (адаптировано по M. Packer [44]).
Примечание: СД — сахарный диабет; ЭЖТ — эпикардиальная жировая ткань; ФП — фибрилляция предсердий; ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса.
ПЕРСПЕКТИВЫ ПРИМЕНЕНИЯ МЕТФОРМИНА У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ С СОХРАНЕННОЙ ФРАКЦИЕЙ ВЫБРОСА ЛЕВОГО ЖЕЛУДОЧКА И НАРУШЕНИЯМИ УГЛЕВОДНОГО ОБМЕНА
Первоначально диастолическая дисфункция была основной мишенью исследований патогенетических аспектов ХСНсФВ. Не оспаривая ее центральную роль, в последние годы выявлено множество других значимых механизмов, таких как эндотелиальная дисфункция, аномальное сердечно-сосудистое сопряжение, потокзависимая и опосредованная физической нагрузкой коронарная вазодилатация, хронотропная недостаточность, легочная гипертензия, повышенное отложение коллагена в миокарде, хроническое низкоэнергетическое воспаление (повышенные уровни интерлейкина (ИЛ)-1, ИЛ-6 и фактора некроза опухоли (ФНО)-α плазмы) [4][5][45]. В поддержании системного воспаления принимают участие также С-реактивный белок (СРБ), фактор дифференцировки роста-15 и растворимая форма белка — супрессора онкогенности-2 (sST2), которые ряд исследователей считают возможными маркерами степени нарушения диастолической функции [46–48].
Метформин, который, несмотря на появление инновационных молекул, согласно рекомендациям ведущих мировых экспертных сообществ, продолжает оставаться базисным сахароснижающим препаратом, долгие годы, «по следам» UKPDS, выступал в качестве своеобразного эталона макрососудистой протекции. В то же время многоплановость его метаболических эффектов вкупе с высоким уровнем безопасности привлекают внимание в свете потенциального воздействия препарата на множественные механизмы патогенеза ХСНсФВ (рис. 5) [49]. Так, ряд публикаций посвящен системным противовоспалительным эффектам бигуанида. В частности, в исследовании З.А. Шаенко и соавт. (2015) терапия метформином в дозе 1500–2500 мгв сутки в сочетании с пиоглитазоном у пациентов с ИБС и СД2 в течение 6 мес привела к статистически значимому снижению уровней ФНО-α (с 4,89±2,00 до 2,23±0,90 пг/мл, р<0,001) и ИЛ-6 (с 5,08±2,37 до 1,98±0,80 пг/мл, р=0,013) [50]. В крупное мультицентровое исследование BARI 2D были включены 2368 человек с ИБС и СД2. Среди пациентов, рандомизированных в группу лечения метформином и/или тиазолидиндионом, в течение пятилетнего периода наблюдения отмечались статистически значимо более низкие значения СРБ, фибриногена и ингибитора активатора плазминогена-1 в сравнении с теми, кто получал препараты сульфонилмочевины или меглитиниды при сопоставимом уровне контроля гликемии [51].

Рисунок 5. Механизмы антигипергликемического и кардиопротективного действия метформина (адаптировано по G. Schernthaner, et al. [49]).
У пациентов с ожирением и предиабетом без ССЗ в исследовании C. Sardu и соавт. (2018) на фоне терапии метформином в дозе 850 мг 2 раза в день на протяжении года было продемонстрировано статистически значимое снижение таких воспалительных маркеров плазмы, как ИЛ-6, ФНО-α, СРБ и нитротирозин [52]. Кроме того, в группе принимающих метформин наблюдалась инверсия патологического ремоделирования сердца и сосудистой стенки в сравнении с группой тех, кто принимал плацебо: уменьшение толщины комплекса интима-медиа сонной артерии (1,01±0,15 против 0,86±0,15 мм), межжелудочковой перегородки (14±2,5 против 10,5±2 мм), задней стенки ЛЖ (11±1,5 против 8±1 мм), массы миокарда ЛЖ (192,5±49,5 против 133,2±37,6 г) и индекса работоспособности миокарда (MPI) (0,58±0,03 против 0,38±0,02), p<0,05.
Важно отметить, что положительные гуморальные и метаболические эффекты при приеме метформина также связаны с повышением уровня адипонектина и подавлением продукции лептина и резистина, что было продемонстрировано в исследовании P.V. Dludla и соавт. (2021) [53]. Помимо описанных влияний, действие препарата распространяется на баланс иммунных клеток жировой ткани. Выделяют 2 типа макрофагов: М1- и М2-фенотипы, различающиеся по экспрессии поверхностных маркеров и профилю вырабатываемых цитокинов [54]. Метформин снижает содержание провоспалительного фенотипа М1, ответственного за выработку ИЛ-6 и ФНО-α, и увеличивает количество макрофагов М2-фенотипа, вырабатывающих антивоспалительные цитокины, таких как ИЛ-10, трансформирующий фактор роста-β. Показано, что сдвиг содержания макрофагов в сторону преобладания провоспалительного М1-фенотипа в конечном итоге нарушает проведение сигналов инсулина [55].
A.R. Cameron и соавт. (2016) в опыте с гепатоцитами здоровых животных показали, что метформин подавлял воспалительную реакцию, ингибируя экспрессию хемокинов ИЛ-1β, ИЛ-6, CXCL1 и CXCL2 [56]. С целью подтверждения его противовоспалительного эффекта в популяции лиц с ХСН и нормальным углеводным обменом теми же авторами было проведено рандомизированное плацебо-контролируемое исследование, включающее 33 пациентов. Через 4 мес в группе ежедневного приема метформина в дозе 2000 мг наблюдалось значимое снижение ИМТ и таких провоспалительных цитокинов, как ИЛ-2, CCL11, CCL22 и CXCL12. Таким образом, положительное влияние на «метавоспаление» можно рассматривать как один из механизмов, обеспечивающих кардиопротективное влияние данного препарата, что может сыграть значимую роль в терапии пациентов с ХСНсФВ [57]. Безусловно, необходимы дальнейшие исследования для успешной трансляции этих данных в кардиологию и другие отрасли клинической медицины.
Возвращаясь к роли висцеральных эктопических жировых депо в развитии ХСН, интересно отметить, что A. Elsanhoury и соавт. (2021) выделяют особый фенотип ХСНсФВ с увеличенным содержанием ЭЖТ, поскольку она может обострять воспаление миокарда и усиливать фибротические процессы посредством различных локальных паракринных и вазокринных сигналов [58]. Кроме того, чрезмерно большая прослойка ЭЖТ вызывает механическую нагрузку на сердце через перикардиальное ограничение [40]. Одним из лекарственных препаратов, доказавших свою эффективность по снижению содержания ЭЖТ, является метформин. Это продемонстрировано, в том числе, в недавнем исследовании М. Ziyrek и соавт. (2019), в котором стандартная монотерапия метформином в течение 3 мес в дозе 1000 мг 2 раза в сутки снизила толщину ЭЖТ (оценивалась эхокардиографическим методом) у пациентов с впервые выявленным СД2 (толщина ЭЖТ исходно 5,07±1,33 мм; через 3 мес терапии — 4,76±1,32 мм, p<0,001) [59]. Кроме того, ИМТ также статистически значимо снизился (28,27±2,71 против 27,29±2,10 кг/м2, p<0,0001). Исследования, посвященные применению метформина при предиабете с позиций изменения ЭЖТ, в доступной нам литературе отсутствуют. Точный механизм этого влияния до конца не ясен, однако исследователи склоняются к уже установленным метаболическим эффектам препарата, в частности, перестройке обменных процессов в сторону окисления жиров и усиления термогенеза [28][59][60].
Ингибирование активированной оси лептин-альдостерон-неприлизин также представляет собой новую перспективную цель в терапии ХСНсФВ, особенно при наличии ожирения. В недавнем проспективном исследовании C. Sardu и соавт. (2021) авторы оценили влияние терапии метформином (прием препарата как минимум в течение 6 мес до процедуры аортокоронарного шунтирования (АКШ)) на уровни лептина, сиртуина-6 и натрийзависимых котранспортеров глюкозы (SGLT2) вперикоронарной жировой ткани у лиц с предиабетом, перенесших АКШ по поводу острого инфаркта миокарда, в сравнении с подобными пациентами без сахароснижающей терапии [61]. У тех, кто не принимал бигуанид, в перикоронарном жире наблюдались более высокие уровни SGLT2 и лептина (p<0,05). Кроме того, пациенты на метформине продемонстрировали более низкий уровень серьезных нежелательных сердечно-сосудистых событий (MACE – англ. major adverse cardiovascular events) через 12 мес наблюдения (развитие ССЗ (ИБС, заболевания периферических артерий, инсульт/транзиторная ишемическая атака, процедура реваскуляризации), госпитализация по поводу СН и ишемических сердечно-сосудистых событий, p <0,01). В этой связи исследователи предложили использовать терапию метформином в качестве регулятора экспрессии оси SGLT2/лептин в перикоронарном жире с целью улучшения клинических исходов у пациентов с предиабетом, перенесших АКШ.
В рандомизированном плацебо-контролируемом исследовании MET-REMODEL авторы изучили влияние метформина на гипертрофию миокарда ЛЖ у пациентов с ИБС, инсулинорезистентностью и/или предиабетом [62]. Инсулинорезистентность оценивалась по индексу инсулинорезистентности натощак (FIRI), рассчитываемому по формуле: FIRI = глюкоза натощак × инсулин натощак/25, значения FIRI≥2,7 свидетельствовали о ее наличии. В исследование были включены 68 пациентов, средний возраст 65±8 лет, которые были распределены в две группы: пациенты 1-й группы получали метформин по 1000 мг 2 раза в день (при непереносимости доза могла быть снижена до 1000 мг в день), а 2-й — плацебо. За 12 мес наблюдения метформин статистически значимо снизил массу миокарда ЛЖ, оцениваемую с помощью МРТ и стандартизированную по росту пациента (-2,71±2,31 г/м1,7), по сравнению с группой, принимавшей плацебо (-1,34±2,65 г/м1,7; p=0,033), абсолютная средняя разница составила -1,37 (95% ДИ -2,63–-0,12). Кроме того, было отмечено положительное влияние препарата на такие параметры, как масса миокарда ЛЖ (р=0,032), масса тела (р=0,001), толщина подкожно-жировой клетчатки, оцениваемая методикой МРТ (р=0,024), офисное систолическое артериальное давление (р=0,022) и концентрация тиобарбитуровой кислоты — биомаркера окислительного стресса (р=0,04).
Принципиально важным рандомизированным двойным слепым плацебо-контролируемым исследованием, которое посвящено влиянию метформина пролонгированного высвобождения на «твердые» конечные точки — сердечно-сосудистые исходы упациентов с установленным атеросклеротическим ССЗ и предиабетом, является VA-IMPACT [63]. Планируемый период наблюдения пациентов составляет 4,5 года, а расширенная первичная конечная точка тестирует гипотезу о том, влияет ли терапия метформином на смертность, частоту развития несмертельного инфаркта миокарда, инсульта, госпитализации по поводу нестабильной стенокардии, обострения ХСН и реваскуляризацию коронарных артерий у данной категории пациентов. Вследствие пандемии COVID-19 и рекомендаций регуляторных органов, осуществляющих надзор за исследованиями, с марта 2020 г. скрининг пациентов был временно приостановлен [63]. В продолжающемся рандомизированном двухфакторном плацебо-контролируемом исследовании DANHEART оценивается влияние метформина и сочетания гидралазина с изосорбида динитратом на клинические исходы у 1500 пациентов с СД2 и ХСНнФВ [49]. Доза метформина составляет 2000 мг в сутки (1000 мг в сутки при расчетной скорости клубочковой фильтрации 35–60 мл/мин/1,73 м2) в течение 4 лет. Первичной конечной точкой является комбинация случаев смерти и госпитализаций по поводу ХСН, инфаркта миокарда или инсульта, результаты ожидаются к середине 2023 г. В то же время крупные протоколы, изучающие частоту госпитализаций по поводу ХСН, уровни натрийуретических пептидов у пациентов с предиабетом и ХСНсФВ на фоне терапии метформином, не проводятся и, согласно доступным литературным источникам, не планируются.
В рекомендации ESC/EACTS по диагностике и лечению пациентов с ФП (2020 г.) отражена роль метформина как препарата, ассоциирующегося с низким долгосрочным риском развития ФП у пациентов с СД2 [64]. В этой связи привлекают внимание результаты исследования Chang S.H. и соавт. (2014), в которое были включены 645 710 пациентов из Национальной программы медицинского страхования Тайваня с 1999 по 2010 гг., проанализировавшего влияние приема метформина на развитие ФПу пациентов с впервые выявленным СД2 без предшествующей сахароснижающей терапии [65]. В группе пациентов, принимавших метформин, при сравнении с группой получавших прочую сахароснижающую терапию была выявлена более низкая частота ФП (p<0,001), которая сохраняла статистическую значимость при поправке на возраст, пол и наличие сопутствующих заболеваний. Возможным объяснением данного эффекта может быть работа, выполненная на культуре клеток предсердий мышей HL-1, где авторы выявили протективный эффект бигуанида на ключевые триггеры развития ФП: степень индуцированного электрокардиостимуляцией миолиза и продукции активных форм кислорода [66]. Принимая во внимание роль ФП как причины формирования ХСН, в т.ч. ХСНсФВ, представляется перспективным изучение дополнительных возможностей применения метформина с целью первичной и вторичной профилактики ФП у пациентов с ранними стадиями НУО.
Снижение массы тела как стратегия уменьшения числа эпизодов ФП и симптомов также закреплена в рекомендации ESC/EACTS 2020 г. (класс рекомендаций IIA, уровень доказательности — B) [64]. Метформин обладает положительным влиянием на динамику массы тела, что, в том числе, обусловлено коррекцией инсулинорезистентности. Так, терапия препаратом в дозе 1000 мг в сутки в течение 6 мес в открытом неконтролируемом исследовании у пациентов с метаболическим синдромом и АГ 1-й степени в возрасте от 30 до 60 лет привела к достоверному снижению веса с 98,4±3,66 до 94,9±3,43 кг (р<0,001), отношение окружности талии к окружности бедер снизилось с 0,94±0,04 до 0,92±0,04 (р<0,001). Всем пациентам проводилась оценка объема висцерального жира методом КТ и измерялся индекс висцерального жира при помощи биоэлектрического импеданса. Наряду с уменьшением антропометрических показателей зафиксировано снижение индекса висцерального жира с 14,8±0,97до 13,1±0,9 (р=0,003) и объема висцерального жира с 6122±256 до 6109±258 мм3 (р=0,005) [67].
Предметом исследования R. Ladeiras-Lopes и соавт. (2021) было изучение влияния метформина на показатели метаболического синдрома и диастолической функции у пациентов без СД2 [68]. Были включены 49 пациентов в возрасте от 40 до 65 лет, которые в ходе рандомизации были распределены на 2 группы: в 1-й рекомендовалась модификация образа жизни, а во 2-й — аналогичный подход в сочетании с приемом метформина 1000 мг 2 раза в день, длительность наблюдения составила два года. Согласно полученным результатам, прием бигуанида значительно улучшил пиковую скорость раннего диастолического наполнения (Е) в трех временных точках (6, 12 и 24 мес). Стоит отметить, что данный эффект не зависел от статуса предиабета, изменения индекса массы миокарда ЛЖ и ФВ ЛЖ, однако был более выражен при большем снижении массы тела. Помимо этого, прием метформина был ассоциирован со статистически значимым снижением индекса HOMA (абсолютная средняя разница -2,43, p=0,030) через 12 мес, а также значительным снижением массы тела через 6 мес (абсолютная средняя разница -2,47 кг, p=0,015) и окружности талии во всех временных точках (абсолютная средняя разница -5,79 см через 24 мес, p=0,008).
Механизм снижения массы тела на фоне применения метформина во многом обусловлен его непосредственным влиянием на центральную нервную систему [54]. Преодолев гематоэнцефалический барьер, он активирует нейроны в дугообразных ядрах гипоталамуса, тем самым стимулируя продукцию анорексигенного нейромедиатора проопиомеланокортина, и ингибирует нейроны, ответственные за выработку орексигенных нейромедиаторов: агути-подобного белка и нейропептида Y. Кроме того, прием метформина связан с повышением нейрональной активности не только гипоталамуса, но и других областей головного мозга, задействованных в контроле пищевого поведения, например, в миндалине, прилежащих ядрах, ядрах одиночного тракта, области area postrema [53]. В свете новой патогенетической оси развития ожирения: кишечник/блуждающий нерв/гипоталамус интересна еще одна метаболическая страта действия метформина — плейотропизм в отношении микробиоты желудочно-кишечного тракта. Метаболиты, выделяемые кишечными бактериями, играют важную роль в контроле массы тела, стимулируя выделение гормонов насыщения, контролируя метаболизм липидов, влияя на передачу сигналов инсулина [69]. Кроме того, под влиянием метформина подавляется секреция гормона голода — грелина — в желудке, за счет этого увеличивается содержание ГПП-1, обладающего анорексигенным эффектом на уровне центральной нервной системы [70].
Отдельная важная глава в «послужном списке» метформина, касающемся начальных этапов диабетического континуума, представлена 3-летним исследованием Diabetes Prevention Program (DPP) и ставшим его продолжением Diabetes Prevention Program Outcomes Study (DPPOS) [71]. Участникам, получавшим метформин в протоколе DPP и имевшим показания для пролонгации лечения в соответствии с текущими рекомендациями, было предложено продолжить терапию в прежней дозе — 850 мг 2 раза в день (рис. 6) [72]. Терапия плацебо, ранее применяемая в DPP, была прекращена у пациентов исследования DPPOS. Все пациенты, как соблюдающие рекомендации «стандартной» модификации образа жизни, так и его «интенсивного» изменения, дополнительно прошли обучение по немедикаментозным мероприятиям профилактики СД2. Тем, кто ранее был рандомизирован в группу интенсивного поведенческого вмешательства, при пролонгации наблюдения метформин также не назначался и каждые 6 мес проводилась дополнительная поддержка изменения поведенческой стратегии в виде консультирования в клинике. В DPPOS были включены 88% пациентов популяции DPP: 589 человек из группы интенсивного поведенческого вмешательства, 599 пациентов из группы метформина, которые продолжили прием препарата, и 605 участников из группы плацебо, которым, соответственно, не инициировали прием бигуанида при отсроченном наблюдении [71].
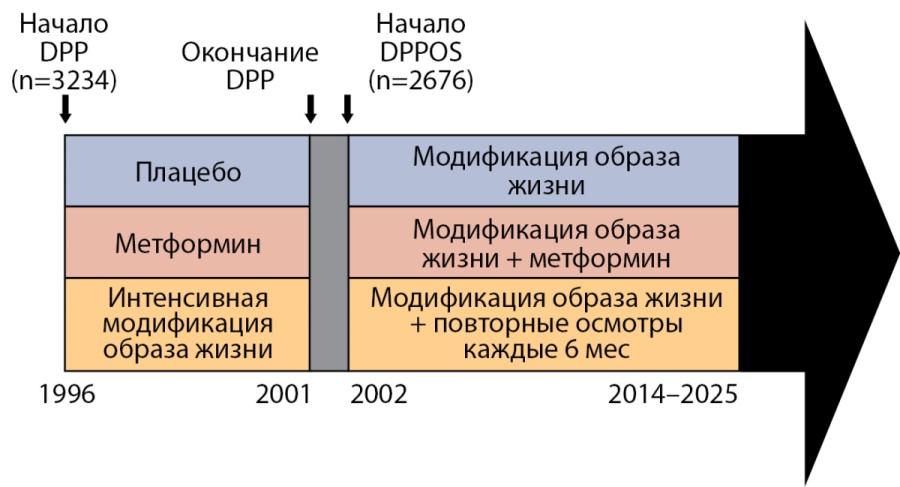
Рисунок 6. Дизайн исследований DPP и DPPOS (адаптировано по J.W. Apolzan, et al. [72]).
Результаты 15-летнего наблюдения за популяцией DPPOS были опубликованы в 2015 г. [73], однако данные за 22-летний период были доложены только на конгрессе Американской диабетической ассоциации в 2020 г. и до настоящего момента не представлены в виде полнотекстовой статьи [74]. Замедление конверсии предиабета в СД2 по-прежнему сохраняется у пациентов, принимавших метформин исходно и в последующем, при наблюдении в течение 15 и 22 лет. Так, по сравнению сгруппой, получавшей в рамках DPP плацебо, снижение заболеваемости СД2 в когорте пациентов, получавших ранее и продолживших принимать метформин, составило 18% в обеих временных точках, а в группе интенсивной модификации образа жизни — 27 и 25% соответственно (рис. 7) [75]. Таким образом, долгосрочная профилактика СД возможна при соблюдении стратегии интенсивного немедикаментозного вмешательства, но ее эффективность со временем в некоторой степени уменьшается. Анализ 15-летнего наблюдения DPPOS показал, что метформин был особенно эффективен в профилактике СД у женщин с гестационным СД в анамнезе, у пациентов с исходно более выраженными значениями гликемии натощак и уровнем гликированного гемоглобина 6,0–6,4% [73].
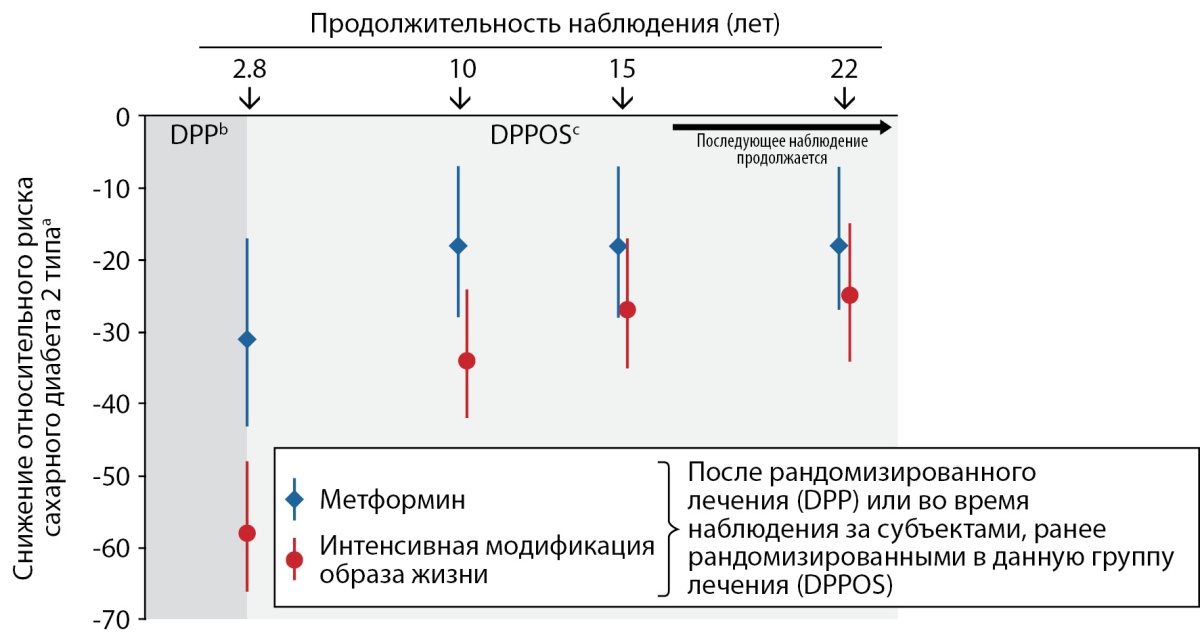
Рисунок 7. Снижение риска развития сахарного диабета 2 типа в исследовании DPP в течение последующего 22-летнего наблюдения в рамках DPPOS.
a По сравнению с плацебо (DPP) или субъектами, ранее рандомизированными для плацебо (DPPOS). b Рандомизированная фаза.
с Эпидемиологическое наблюдение. Столбцы — 95% доверительный интервал. Все пары измерений были сделаны в одни и те же моменты времени
(адаптировано по U. Hostalek et al. [75]).
Через 22 года наблюдения не было выявлено статистически значимых микрососудистых или макроваскулярных преимуществ, связанных с любым видом вмешательств. Однако профилактика СД как таковая была связана со снижением риска развития заболеваний глаз (на 57%), почек (на 37%) и сердечно-сосудистых заболеваний (на 39%) [76]. Ранее, по результатам 14-летнего наблюдения, у 2029 участников программы DPPOS изучалась выраженность коронарного кальциноза с использованием КТ — оценивали индекс коронарного кальциноза и тяжесть коронарного кальциноза (CAC), полученную из логарифмически преобразованной оценки индекса коронарного кальция (log(CAC+1)), а также факта наличия (CAC>0) или отсутствия коронарного кальциноза в целом. Параметры тяжести коронарного кальциноза были достоверно ниже у мужчин, принимающих метформин, по сравнению с пациентами без такой терапии (с поправкой на возраст средняя тяжесть САС: 39,5 против 66,9, р=0,04; факт наличия коронарного кальциноза: 75% против 84% соответственно, р=0,02). При этом в многофакторном анализе антиатерогенный эффект метформина у лиц мужского пола не зависел от демографических, антропометрических или метаболических факторов, наличия/отсутствия статинотерапии, а также развития СД2 в будущем, что еще раз демонстрирует многогранность кардиопротективных эффектов препарата [77].
Поскольку снижение массы тела является важной детерминантой профилактики развития СД, в DPPOS этот параметр также оценивался. Во время основной фазы наблюдения (протокол DPP) средняя потеря массы тела была выше в группе активной интенсификации образа жизни в сравнении с другими группами, но сохранение долгосрочной потери веса с 6-го по 15-й год наблюдения в DPPOS было наибольшим для тех, кто принимал метформин [78]. Результаты 22-летнего наблюдения, касающиеся снижения массы тела, еще предстоит проанализировать после их официальной публикации.
ЗАКЛЮЧЕНИЕ
Не вызывает сомнений, что ХСНсФВ у пациентов с предиабетом и абдоминальным ожирением — значимая проблема XXI в. Имеющиеся клинические данные и патогенетические предпосылки позволяют предположить множественные плейотропные эффекты метформина на различные структурно-функциональные параметры сердечно-сосудистой системы, в том числе у лиц с начальными этапами континуума дисгликемии и ХСНсФВ. К сожалению, вопросы подхода к его назначению при сочетании данных патологий с позиций кардиометаболической протекции остаются открытыми и малоизученными, хотя сегодня имеются доказательства защиты сердечно-сосудистой системы при использовании метформина, продемонстрированные врандомизированных клинических наблюдательных и экспериментальных исследованиях, суммированных нами выше. Более того, метформин пытается удержать лидерские позиции у пациентов с СД2, текущее исследование SMARTEST (NCT03982381) — его первое непосредственное сравнением с ингибитором SGLT2 по влиянию на сердечно-сосудистые исходы, финал которого будет известен в 2024 г. [49].
Учитывая патогенетическую роль инсулинорезистентности в развитии как НУО, ожирения, так и ХСН, влияние гипергликемии на ухудшение прогноза в отношении ССЗ, а также доказанную кардиобезопасность и эффективность метформина у пациентов с СД2, существует необходимость более детального изучения возможностей его использования в качестве патогенетического и, возможно, болезнь-модифицирующего агента у пациентов с ХСНсФВ в сочетании с предиабетом иабдоминальным ожирением, используя лабораторные, инструментальные и клинические маркеры ее эволюции.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа частично выполнена по Государственному заданию в рамках бюджетной темы №122031700094-5.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Цыганкова О.В. — концепция и дизайн статьи, анализ литературы, редактирование текста, утверждение итогового варианта текста рукописи; Евдокимова Н.Е. — анализ литературы, написание статьи; Веретюк В.В. — редактирование текста, утверждение итогового варианта текста рукописи; Латынцева Л.Д. — редактирование текста, утверждение итогового варианта текста рукописи; Аметов А.С. — редактирование текста, утверждение итогового варианта текста рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Цыганкова О.В., Веретюк В.В. Фенотипические кластеры пациентов с хронической сердечной недостаточностью с сохраненной и промежуточной фракцией выброса: новые данные и перспективы // Российский кардиологический журнал. — 2021. — Т. 26. — №4. — С. 4436. doi: https://doi.org/10.15829/1560-4071-2021-4436
2. Paulus W, Tschope C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and Remodeling through coronary microvascular endothelial inflammation. J Am Coll Cardiol. 2013;62(4):263-271. doi: https://doi.org/10.1016/j.jacc.2013.02.092
3. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. // Российский кардиологический журнал. — 2020. — T. 25. — №11. — C. 4083. doi: https://doi.org/10.15829/1560-4071-2020-4083
4. Драпкина О.М., Палаткина Л.О. Новые акценты в изучении патогенеза хронической сердечной недостаточности с сохраненной фракцией выброса: фокус на маркеры воспаления // Рациональная Фармакотерапия в Кардиологии. — 2014. — T. 10. — №3. — С. 317-321. doi: https://doi.org/10.20996/1819-6446-2014-10-3-317-321
5. Pfeffer MA, Shah AM, Borlaug BA. Heart Failure With Preserved Ejection Fraction In Perspective. Circ Res. 2019;124(11):1598-1617. doi: https://doi.org/10.1161/CIRCRESAHA.119.313572
6. Вайсберг А.Р., Тарловская Е.И., Фомин И.В., и др. Нарушения углеводного обмена у пациентов с хронической сердечной недостаточностью по данным локального регистра // Российский кардиологический журнал. — 2021. — T. 26. — №3. — C. 4330. doi: https://doi.org/10.15829/1560-4071-2021-4330
7. Юрьева М.Ю., Дворяшина И.В. Значение гипергликемии и вариабельности гликемии у пациентов с декомпенсацией хронической сердечной недостаточности в зависимости от выраженности нарушений углеводного обмена // Кардиология. — 2017. — T. 57. — №S4. — С.38–46. doi: https://doi.org/10.18087/cardio.2403
8. Ather S, Chan W, Bozkurt B, et al. Impact of Noncardiac Comorbidities on Morbidity and Mortality in a Predominantly Male Population with Heart Failure and Preserved versus Reduced Ejection Fraction. J Am Coll Cardiol. 2012;59(11):998-1005. doi: https://doi.org/10.1016/j.jacc.2011.11.040
9. Kristensen SL, Preiss D, Jhund PS, et al. Risk related to pre-diabetes mellitus and diabetes mellitus in heart failure with reduced ejection fraction. Circ Heart Fail. 2016;9:e002560. doi: https://doi.org/10.1161/CIRCHEARTFAILURE.115.002560
10. Arnold SV, de Lemos JA, Rosenson RS, et al. GOULD Investigators. Use of Guideline-Recommended Risk Reduction Strategies Among Patients With Diabetes and Atherosclerotic Cardiovascular Disease. Circulation. 2019;140(7):618-620. doi: https://doi.org/10.1161/CIRCULATIONAHA.119.041730
11. Jackson AM, Rørth R, Liu J, et al. Diabetes and pre-diabetes in patients with heart failure and preserved ejection fraction. Eur J Heart Fail. 2022;24(3):497-509. doi: https://doi.org/10.1002/ejhf.2403
12. Braunwald E. Diabetes, heart failure, and renal dysfunction: The vicious circles. Prog Cardiovasc Dis. 2019;62(4):298-302. doi: https://doi.org/10.1016/j.pcad.2019.07.003
13. Cosentino F, Grant PJ, Aboyans V, et al. 2019 Рекомендации ЕSC/EASD по сахарному диабету, предиабету и сердечно-сосудистым заболеваниям // Российский кардиологический журнал. — 2020. — Т. 25. — №4 — С. 3839. doi: https://doi.org/10.15829/1560-4071-2020-3839
14. Платонов Д.Ю., Костюк Т.А, Брандт А.И., Цыганкова О.В. Комплексная оценка профилактического поведения в отношении сердечно-сосудистых заболеваний и факторов риска их развития у больных гипертонической болезнью и хронической ишемической болезнью сердца // Профилактическая медицина. — 2012. — Т. 15. — №1. — С. 26-31.
15. Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (10-й выпуск) // Сахарный диабет. — 2021. — Т. 24 — №S1. — С. 1-235. doi: https://doi.org/10.14341/DM12802
16. Барбараш О.Л., Воевода М.И., Галстян Г.Р., и др. Предиабет как междисциплинарная проблема: определение, риски, подходы к диагностике и профилактике сахарного диабета 2 типа и сердечно-сосудистых осложнений // Российский кардиологический журнал. — 2019. — Т. 24. — №4. — С. 83-91. doi: https://doi.org/10.15829/1560-4071-2019-4-83-91
17. Ritchie RH, Abel ED. Basic Mechanisms of Diabetic Heart Disease. Circ Res. 2020;126(11):1501-1525. doi: https://doi.org/10.1161/CIRCRESAHA.120.315913
18. Saotome M, Ikoma T, Hasan P, et al. Cardiac insulin resistance in heart failure: the role of mitochondrial dynamics. Int J Mol Sci. 2019;20(14):3552. doi: https://doi.org/10.3390/ijms20143552
19. Goldberg IJ, Trent CM, Schulze PC. Lipid metabolism and toxicity in the heart. Cell Metab. 2012;15(6):805-812. doi: https://doi.org/10.1016/j.cmet.2012.04.006
20. Lu T, Forgetta V, Yu OHY, et al. Polygenic risk for coronary heart disease acts through atherosclerosis in type 2 diabetes. Cardiovasc Diabetol. 2020;19(1):12. doi: https://doi.org/10.1186/s12933-020-0988-9
21. Diaz-Juarez J, Suarez JA, Dillmann WH, et al. Mitochondrial calcium handling and heart disease in diabetes mellitus. Biochim Biophys Acta Mol Basis Dis. 2021;1867(1):165984. doi: https://doi.org/10.1016/j.bbadis.2020.165984
22. Tentolouris A, Eleftheriadou I, Tzeravini E, et al. Endothelium as a therapeutic target in diabetes mellitus: From basic mechanisms to clinical practice. Curr Med Chem. 2020;27(7):1089-1131. doi: https://doi.org/10.2174/0929867326666190119154152
23. Попыхова Э.Б., Степанова Т.В., Лагутина Д.Д., и др. Роль сахарного диабета в возникновении и развитии эндотелиальной дисфункции // Проблемы Эндокринологии. — 2020. — Т. 66. — №1. — С. 47-55. doi: https://doi.org/10.14341/probl12212
24. Wong AK, AlZadjali MA, Choy AM, et al. Insulin resistance: a potential new target for therapy in patients with heart failure. Cardiovasc Ther. 2008;26(3):203-213. doi: https://doi.org/10.1111/j.1755-5922.2008.00053.x
25. Wong AK, Struthers AD, Choy AM, et al. Insulin sensitization therapy and the heart: focus on metformin and thiazolidinediones. Heart Fail Clin. 2012;8(4):539-550. doi: https://doi.org/10.1016/j.hfc.2012.06.002
26. Pandey A, LaMonte M, Klein L, et al. Relationship Between Physical Activity, Body Mass Index, and Risk of Heart Failure. J Am Coll Cardiol. 2017;69(9):1129-1142. doi: https://doi.org/10.1016/j.jacc.2016.11.081
27. Дедов И.И., Шестакова М.В., Мельниченко Г.А., и др. Междисциплинарные клинические рекомендации «Лечение ожирения и коморбидных заболеваний» // Ожирение и метаболизм. — 2021. — T. 18. — №1. — C. 5-99. doi: https://doi.org/10.14341/omet12714
28. Obokata M, Reddy YNV, Pislaru SV, et al. Evidence Supporting the Existence of a Distinct Obese Phenotype of Heart Failure With Preserved Ejection Fraction. Circulation. 2017;136(1):6-19. doi: https://doi.org/10.1161/CIRCULATIONAHA.116.026807
29. Bentley-Lewis R, Adler GK, Perlstein T, et al. Body Mass Index Predicts Aldosterone Production in Normotensive Adults on a High-Salt Diet. J Clin Endocrinol Metab. 2007;92(11):4472-4475. doi: https://doi.org/10.1210/jc.2007-1088
30. Vatutin NT, Shevelyok AN. Relationship between blood aldosterone and somatometric parameters in patients with chronic heart failure and preserved ejection fraction of left ventricle. Clin Med (Russian Journal). 2016;94(4):265-269. doi: https://doi.org/10.18821/0023-2149-2016-94-4-265-269
31. Borlaug BA, Carter RE, Melenovsky V, et al. Percutaneous pericardial resection: a novel potential treatment for heart failure with preserved ejection fraction. Circ Heart Fail. 2017;10(4):e003612. doi: https://doi.org/10.1161/CIRCHEARTFAILURE.116.0036
32. Achike FI, To N-HP, Wang H, Kwan C-Y. Obesity, metabolic syndrome, adipocytes and vascular function: A holistic viewpoint. Clin Exp Pharmacol Physiol. 2011;38(1):1-10. doi: https://doi.org/10.1111/j.1440-1681.2010.05460.x
33. Packer M. Leptin-Aldosterone-Neprilysin Axis. Circulation. 2018;137(15):1614-1631. doi: https://doi.org/10.1161/CIRCULATIONAHA.117.032474
34. Rhee EJ, Kwon H, Park SE, et al. Associations among Obesity Degree, Glycemic Status, and Risk of Heart Failure in 9,720,220 Korean Adults. Diabetes Metab J. 2020;44(4):592-601. doi: https://doi.org/10.4093/dmj.2019.0104.
35. Liu L, Feng J, Zhang G, et al. Visceral adipose tissue is more strongly associated with insulin resistance than subcutaneous adipose tissue in Chinese subjects with pre-diabetes. Curr Med Res Opin. 2018;34(1):123-129. doi: https://doi.org/10.1080/03007995.2017.1364226
36. Rao VN, Fudim M, Mentz RJ, et al. Regional adiposity and heart failure with preserved ejection fraction. Eur J Heart Fail. 2020;22(9):1540-1550. doi: https://doi.org/10.1002/ejhf.1956
37. Gruzdeva O, Borodkina D, Uchasova E, et al. Localization of fat depots and cardiovascular risk. Lipids Health Dis. 2018;17(1):218. doi: https://doi.org/10.1186/s12944-018-0856-8
38. Rao VN, Zhao D, Allison MA, et al. Adiposity and incident heart failure and its subtypes. JACC Hear Fail. 2018;6(12):999-1007. doi: https://doi.org/10.1016/j.jchf.2018.07.009
39. Аметов А.С., Цыганкова О.В. Комплексная метаболическая протекция как современная стратегия управления сахарным диабетом 2 типа // Эндокринология: новости, мнения, обучение. — 2021. — Т. 10. — № 2. — C. 93-104. doi: https://doi.org/10.33029/2304-9529-2021-10-2-93-104
40. Iacobellis G, Willens HJ. Echocardiographic epicardial fat: A review of research and clinical applications. J Am Soc Echocardiogr. 2009;22(12):1311-1319. doi: https://doi.org/10.1016/j.echo.2009.10.013
41. Nakazato R, Shmilovich H, Tamarappoo BK, et al. Interscan reproducibility of computer-aided epicardial and thoracic fat measurement from noncontrast cardiac CT. J Cardiovasc Comput Tomogr. 2011;5(3):172-179. doi: https://doi.org/10.1016/j.jcct.2011.03.009.
42. Doesch C, Streitner F, Bellm S, et al. Epicardial adipose tissue assessed by cardiac magnetic resonance imaging in patients with heart failure due to dilated cardiomyopathy. Obesity (Silver Spring). 2013;21:E253-E261. doi: https://doi.org/10.1002/oby.20149
43. Nagy E, Jermendy AL, Merkely B, et al. Clinical importance of epicardial adipose tissue. Arch Med Sci. 2017;13(4):864-874. doi: https://doi.org/10.5114/aoms.2016.63259
44. Packer M. Do most patients with obesity or type 2 diabetes, and atrial fibrillation, also have undiagnosed heart failure? A critical conceptual framework for understanding mechanisms and improving diagnosis and treatment. Eur J Heart Fail. 2020;22(2):214-227. doi: https://doi.org/10.1002/ejhf.1646
45. Hanna A, Frangogiannis NG. Inflammatory cytokines and chemokines as therapeutic targets in heart failure. Cardiovasc Drugs Ther. 2020;34(6):849-863. doi: https://doi.org/10.1007/s10557-020-07071-0
46. Mitic VT, Stojanovic DR, Deljanin Ilic MZ, et al. Cardiac remodeling biomarkers as potential circulating markers of left ventricular hypertrophy in heart failure with preserved ejection fraction. Tohoku J Exp Med. 2020;250(4):233-242. doi: https://doi.org/10.1620/tjem.250.233
47. Kuster N, Huet F, Dupuy AM, et al. Multimarker approach including CRP, sST2 and GDF-15 for prognostic stratification in stable heart failure. ESC Heart Fail. 2020;7(5):2230-2239. doi: https://doi.org/10.1002/ehf2.12680
48. Sardu C, Pieretti G, D’Onofrio N, et al. Inflammatory cytokines and SIRT1 levels in subcutaneous abdominal fat: relationship with cardiac performance in overweight pre-diabetics patients. Front Physiol. 2018;9(12):1311-1319. doi: https://doi.org/10.3389/fphys.2018.01030
49. Schernthaner G, Brand K, Bailey CJ. Metformin and the heart: Update on mechanisms of cardiovascular protection with special reference to comorbid type 2 diabetes and heart failure. Metabolism. 2022;130(12):155160. doi: https://doi.org/10.1016/j.metabol.2022.155160
50. Шаенко З.А., Расин М.С. Эффективность и безопасность метформина и пиоглитазона у пациентов с ишемической болезнью сердца и сахарным диабетом 2-го типа // Международный эндокринологический журнал. — 2015. — №2. — С. 66-70.
51. Sobel BE, Hardison RM, Genuth S, et al. BARI 2D Investigators. Profibrinolytic, antithrombotic, and antiinflammatory effects of an insulin-sensitizing strategy in patients in the Bypass Angioplasty Revascularization Investigation 2 Diabetes (BARI 2D) trial. Circulation. 2011;124(6):695-703. doi: https://doi.org/10.1161/CIRCULATIONAHA.110.014860
52. Sardu C, Pieretti G, D’Onofrio N, et al. Inflammatory cytokines and SIRT1 levels in subcutaneous abdominal fat: relationship with cardiac performance in overweight pre-diabetics patients. Front Physiol. 2018;9(4):3-17. doi: https://doi.org/10.3389/fphys.2018.01030
53. Dludla PV, Nkambule BB, Mazibuko-Mbeje SE, et al. Adipokines as a therapeutic target by metformin to improve metabolic function: A systematic review of randomized controlled trials. Pharmacol Res. 2021;163(4):105219. doi: https://doi.org/10.1016/j.phrs.2020.105219
54. Романцова Т.И., Сыч Ю.П. Иммунометаболизм и метавоспаление при ожирении. // Ожирение и метаболизм. — 2019. — Т. 16. — №4. — C. 3-17. doi: https://doi.org/10.14341/omet12218
55. Caslin HL, Bhanot M, Bolus WR, et al. Adipose tissue macrophages: Unique polarization and bioenergetics in obesity. Immunol Rev. 2020;295(1):101-113. doi: https://doi.org/10.1111/imr.12853
56. Cameron AR, Morrison VL, Levin D, et al. Anti-inflammatory effects of metformin irrespective of diabetes status. Circ Res. 2016;119(5):652-665. doi: https://doi.org/10.1161/CIRCRESAHA.116.308445
57. Nesti L, Natali A. Metformin effects on the heart and the cardiovascular system: A review of experimental and clinical data. Nutr Metab Cardiovasc Dis. 2017;27(8):657-669. doi: https://doi.org/10.1016/j.numecd.2017.04.009
58. Elsanhoury A, Nelki V, Kelle S, et al. Epicardial fat expansion in diabetic and obese patients with heart failure and preserved ejection fraction—A specific HFpEF phenotype. Front Cardiovasc Med. 2021;8(4):105219. doi: https://doi.org/10.3389/fcvm.2021.720690
59. Ziyrek M, Kahraman S, Ozdemir E, et al. Metformin monotherapy significantly decreases epicardial adipose tissue thickness in newly diagnosed type 2 diabetes patients. Rev Port Cardiol (Engl Ed). 2019;38(6):419-423. doi: https://doi.org/10.1016/j.repc.2018.08.010
60. Kristófi R, Eriksson JW. Metformin as an anti-inflammatory agent: a short review. J Endocrinol. 2021;251(2):R11-R22. doi: https://doi.org/10.1530/JOE-21-0194
61. Sardu C, D’Onofrio N, Torella M, et al. Metformin therapy effects on the expression of sodium-glucose cotransporter 2, leptin, and SIRT6 levels in pericoronary fat excised from pre-diabetic patients with acute myocardial infarction. Biomedicines. 2021;9(8):904. doi: https://doi.org/10.3390/biomedicines9080904
62. Mohan M, Al-Talabany S, McKinnie A, et al. Metformin regresses left ventricular hypertrophy in normotensive patients with coronary artery disease without type 2 diabetes mellitus — the met-remodel trial. Heart. 2018;104:A6. doi: https://doi.org/10.1136/heartjnl-2018-BCS.6
63. Investigation of metformin in pre-diabetes on atherosclerotic cardiovascular outcomes (VA-IMPACT). Available from: https://clinicaltrials.gov/ct2/show/NCT02915198 [cited February 2022].
64. Hindricks G, Potpara T, Dagres N, et al. Рекомендации ESC 2020 по диагностике и лечению пациентов с фибрилляцией предсердий, разработанные совместно с европейской ассоциацией кардиоторакальной хирургии (EACTS) // Российский кардиологический журнал. — 2021. — T. 26. — №9. — C. 4701. doi: https://doi.org/10.15829/1560-4071-2021-4701
65. Chang S-H, Wu L-S, Chiou M-J, et al. Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus: a population-based dynamic cohort and in vitro studies. Cardiovasc Diabetol. 2014;13(1):123. doi: https://doi.org/10.1186/s12933-014-0123-x
66. Yeh Y-H, Kuo C-T, Lee Y-S, et al. Region-specific gene expression profiles in the left atria of patients with valvular atrial fibrillation. Hear Rhythm. 2013;10(3):383-391. doi: https://doi.org/10.1016/j.hrthm.2012.11.013
67. Иванов К.П., Мычка В.Б., Масенко В.П. Влияние метформина на множественные факторы сердечно-сосудистого риска // Эффективная фармакотерапия. — 2012. — №33. — С. 4-8.
68. Ladeiras-Lopes R, Sampaio F, Leite S, et al. Metformin in non-diabetic patients with metabolic syndrome and diastolic dysfunction: the MET-DIME randomized trial. Endocrine. 2021;72(3):699-710. doi: https://doi.org/10.1007/s12020-021-02687-0
69. Дедов И.И., Романцова Т.И., Шестакова М.В. Рациональный подход к терапии пациентов с СД2 и ожирением: итоги Всероссийской наблюдательной программы «АВРОРА» // Ожирение и метаболизм. — 2018. — Т. 15. — №4. — С. 48-58. doi: https://doi.org/10.14341/omet10076
70. Zhang Q, Hu N. Effects of Metformin on the Gut Microbiota in Obesity and Type 2 Diabetes Mellitus. Diabetes, Metab Syndr Obes Targets Ther. 2020;13(3):5003-5014. doi: https://doi.org/10.2147/DMSO.S286430
71. Diabetes Prevention Program Outcomes Study (DPPOS). Available from: http://www.clinicaltrials.gov/show/NCT00038727 [cited February 2022].
72. Apolzan JW, Venditti EM, Edelstein SL, et al; Diabetes Prevention Program Research Group. Long-Term Weight Loss With Metformin or Lifestyle Intervention in the Diabetes Prevention Program Outcomes Study. Ann Intern Med. 2019;170(10):682-690. doi: https://doi.org/10.7326/M18-1605. Erratum in: Ann Intern Med. 2020;173(6):508.
73. Zhang Q, Hu N. Long-term effects of lifestyle intervention or metformin on diabetes development and microvascular complications over 15-year follow-up: the Diabetes Prevention Program Outcomes Study. Lancet Diabetes Endocrinol. 2015;3(11):866-875. doi: https://doi.org/10.1016/S2213-8587(15)00291-0
74. American Diabetes Association. New data from Diabetes Prevention Program Outcomes Study shows persistent reduction of type 2 diabetes development over 22-year average follow-up. 2020. Available from: https://www.diabetes.org/newsroom/press-releases/2020/new-data-from-diabetes-prevention-program-outcomes-study-shows-persistent-reduction-of-t2d-development-over-22-year-average-follow-up [cited February 2022].
75. Hostalek U, Campbell I. Metformin for diabetes prevention: update of the evidence base. Curr Med Res Opin. 2021;37(10):1705-1717. doi: https://doi.org/10.1080/03007995.2021.1955667
76. Busko M. DPPOS at 22 years: ‘diabetes prevention is possible’ long term. Medscape Diabetes & Endocrinology. Available from: https://www.medscape.com/viewarticle/932876 [cited February 2022].
77. Goldberg RB, Aroda VR, Bluemke DA, et al. Diabetes Prevention Program Research Group. Effect of Long-Term Metformin and Lifestyle in the Diabetes Prevention Program and Its Outcome Study on Coronary Artery Calcium. Circulation. 2017;136(1):52-64. doi: https://doi.org/10.1161/CIRCULATIONAHA.116.025483
78. Nathan DM, Knowler WC, Edelstein S, et al. Long-term Effects of Metformin on Diabetes Prevention: Identification of Subgroups That Benefited Most in the Diabetes Prevention Program and Diabetes Prevention Program Outcomes Study. Diabetes Care. 2019;42(4):601-608. doi: https://doi.org/10.2337/dc18-1970
Об авторах
О. В. ЦыганковаРоссия
Цыганкова Оксана Васильевна, д.м.н., профессор
Researcher ID: AAZ-2192-2020, Scopus Author ID: 16835397600, eLibrary SPIN: 1817-4484
Новосибирск
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Н. Е. Евдокимова
Россия
Евдокимова Наталья Евгеньевна, аспирант
Researcher ID: AAQ-2766-2021; Scopus Author ID: 57219415522; eLibrary SPIN: 6411-5230
630089, Новосибирск, ул. Б. Богаткова, д. 175/1
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
В. В. Веретюк
Россия
Веретюк Варвара Васильевна
Researcher ID: T-9586-2017, Scopus Author ID: 57208568882 , eLibrary SPIN: 1718-1649
Новосибирск
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Л. Д. Латынцева
Россия
Латынцева Людмила Дмитриевна, к.м.н.
eLibrary SPIN: 8647-6536
Новосибирск
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
А. С. Аметов
Россия
Аметов Александр Сергеевич, д.м.н., профессор
eLibrary SPIN: 9511-1413
Москва
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Порочный круг между нарушениями углеводного обмена и хронической сердечной недостаточностью (адаптировано по E. Braunwald [12]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(388KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Механизмы развития легочной гипертензии и хронической сердечной недостаточности у пациентов с ожирением (адаптировано по W. Paulus et al. [2]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(297KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Ожирение и роль оси «лептин-альдостерон-неприлизин» в патогенезе хронической сердечной недостаточности (адаптировано по M. Packer [33]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(152KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Механизмы развития и клинические эффекты миопатии предсердий и желудочков при ожирении (адаптировано по M. Packer [44]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(254KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Механизмы антигипергликемического и кардиопротективного действия метформина (адаптировано по G. Schernthaner, et al. [49]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(439KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Дизайн исследований DPP и DPPOS (адаптировано по J.W. Apolzan, et al. [72]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(176KB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. Снижение риска развития сахарного диабета 2 типа в исследовании DPP в течение последующего 22-летнего наблюдения в рамках DPPOS. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(198KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Цыганкова О.В., Евдокимова Н.Е., Веретюк В.В., Латынцева Л.Д., Аметов А.С. Инсулинорезистентность и хроническая сердечная недостаточность с сохраненной фракцией выброса. Патогенетические и терапевтические перекрестки. Сахарный диабет. 2022;25(6):535-547. https://doi.org/10.14341/DM12916
For citation:
Tsygankova O.V., Evdokimova N.E., Veretyuk V.V., Latyntseva L.D., Ametov A.S. Insulin resistance and heart failure with preserved ejection fraction. Pathogenetic and therapeutic crossroads. Diabetes mellitus. 2022;25(6):535-547. (In Russ.) https://doi.org/10.14341/DM12916

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































