Перейти к:
Цереброваскулярная патология у больных резистентной артериальной гипертонией в сочетании с сахарным диабетом 2 типа
https://doi.org/10.14341/DM12779
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет (СД) и артериальная гипертония (АГ) относятся к независимым детерминантам риска мозгового инсульта, а их сочетание многократно повышает частоту церебральных осложнений. Выявление факторов, связанных с развитием доклинических повреждений головного мозга, может изменить терапевтическую стратегию предупреждения развития мозговых катастроф. Тем не менее, данных по этому вопросу для больных СД в сочетании с резистентной АГ (РАГ) по-прежнему недостаточно.
ЦЕЛЬ. Изучить характер церебрососудистых изменений по данным магнитно-резонансной томографии (МРТ) головного мозга у больных СД 2 типа (СД2) в сочетании с РАГ и выявить факторы, вовлеченные в их развитие.
МАТЕРИАЛЫ И МЕТОДЫ. В одноцентровое наблюдательное одномоментное одновыборочное неконтролируемое исследование включены 46 больных СД2 с РАГ. Анализировали данные МРТ головного мозга (1,5 Тесла) с измерениями индекса Эванса (ИЭ), общеклинические и лабораторные показатели (глюкоза, инсулин, С-пептид, лептин, резистин, альдостерон, высокочувствительный С-реактивный белок (вчСРБ), фактор некроза опухоли альфа (ФНО-альфа), инсулиноподобный фактор роста-1 (ИПФР-1)), офисное и среднесуточное артериальное давление (АД), периферическую и церебральную вазореактивность (тест с гипервентиляцией и задержкой дыхания).
РЕЗУЛЬТАТЫ. Наиболее частыми МРТ-изменениями были расширения желудочков (45%) и субарахноидальных пространств (65%), повреждения белого вещества (ПБВ) фокального характера (52%) и в перивентрикулярной области (ПВО) (89%). Выявлены множественные прямые корреляционные взаимосвязи показателей углеводного обмена (гликированный гемоглобин, глюкоза, инсулин, С-пептид) со степенью ПБВ в ПВО, плотностью МРТ-сигнала от базальных ядер и значениями ИЭ. Уровни адипокинов имели прямую связь с поперечным размером хиазмальной цистерны и значениями ИЭ (для резистина), а также с плотностью МРТ-сигнала от базальных ядер и с увеличением ИЭ (для лептина). Увеличение значений ИЭ было дополнительно взаимосвязано с возрастанием уровня ИПФР-1. Уровень альдостерона коррелировал с поперечным размером III желудочка. Повышение концентраций ФНО-α и вчСРБ сопровождалось увеличением плотности МРТ-сигнала в ПВО. Нарушение цереброваскулярной реактивности было связано с повышением плотности МРТ-сигнала в ПВО и выраженностью косвенных признаков атрофии головного мозга (увеличение ИЭ, расширение цистерн, боковых желудочков). Снижение периферической вазореактивности ассоциировалось с увеличением значений ИЭ и расширением III желудочка. Прямых корреляционных связей выраженности структурных изменений головного мозга с показателями АД не обнаружено.
ЗАКЛЮЧЕНИЕ. Для сочетания СД2 с РАГ характерна высокая частота повреждения белого вещества и расширения ликворных пространств, выраженность которых коррелирует с тяжестью метаболических, нейрогормональных и гемодинамических расстройств в отсутствие прямой связи со степенью повышения АД.
Ключевые слова
Для цитирования:
Фальковская А.Ю., Мордовин В.Ф., Сухарева А.Е., Зюбанова И.В., Манукян М.А., Личикаки В.А., Цой Е.И., Гусакова А.М., Дорожкина Н.В. Цереброваскулярная патология у больных резистентной артериальной гипертонией в сочетании с сахарным диабетом 2 типа. Сахарный диабет. 2022;25(2):128-135. https://doi.org/10.14341/DM12779
For citation:
Falkovskaya A.Yu., Mordovin V.F., Sukhareva A.E., Zyubanova I.V., Manukyan M.A., Lichikaki V.A., Tsoi E.I., Gusakova A.M., Dorozhkina N.V. Cerebrovascular disorders in patients with type 2 diabetes mellitus and resistant hypertension. Diabetes mellitus. 2022;25(2):128-135. (In Russ.) https://doi.org/10.14341/DM12779
ОБОСНОВАНИЕ
Острые нарушения мозгового кровообращения занимают 2-е место среди всех причин смерти больных сахарным диабетом (СД) [1] и влекут за собой колоссальные экономические потери [2]. По данным метаанализа 102 проспективных исследований, включавшего 689 782 пациента, наличие СД 2 типа (СД2) ассоциировано с повышением риска ишемического инсульта в 2,27 раза, геморрагического — в 1,5 раза, неклассифицированного — в 1,84 раза [3]. До 80% больных СД страдают артериальной гипертонией (АГ) [4], что сопровождается двукратным возрастанием частоты мозговых катастроф [5].
Современные возможности магнитно-резонансной томографии (МРТ) позволили визуализировать ранние доклинические изменения органов-мишеней [6], включая церебрососудистые повреждения [7], которые предшествуют развитию мозговых инсультов и деменции и являются наиболее перспективными с точки зрения терапевтических вмешательств и влияния на прогноз. К таковым относятся повреждения белого вещества (ПБВ), немые ишемические очаги (лакунарные инфаркты и фокальные ПБВ), микрокровоизлияния и атрофия головного мозга [8].
Немаловажно, что для АГ и СД2 характерно развитие нарушений ликвородинамики в виде увеличения объемов желудочков мозга и субарахноидальных пространств. Подобные ликвородинамические расстройства могут вызывать компрессию тканей головного мозга избыточным количеством жидкости и его атрофию. С другой стороны, расширение ликворных пространств может носить заместительный характер вследствие первичной утраты вещества головного мозга, что позволяет считать их косвенным признаком церебральной атрофии [9].
У больных с сочетанием АГ и СД2 наиболее значимой причиной возникновения патологии головного мозга считается прогрессирующее ухудшение его кровоснабжения. Ограниченность анастомозов и коллатералей, питающих кортикальные и перивентрикулярные области (ПВО), обуславливает особую уязвимость этих регионов к снижению мозгового кровотока на фоне макро- и микроциркуляторных нарушений, а также к перепадам артериального давления (АД). Дополнительное значение в повышении риска церебральных осложнений у данной категории больных имеет развитие нейродегенерации, вызванной гипергликемией, гиперинсулинемией, а также ятрогенной гипогликемией и нарушением тканевой утилизации глюкозы [10].
Следует отметить, что накопленные к настоящему времени данные о ранних структурно-функциональных изменениях головного мозга относятся к общей группе больных с СД2 в сочетании с АГ, без учета тяжести последней. Тем не менее, данные о характере МРТ-признаков церебральных повреждений и факторах, связанных с их прогрессированием в селективной группе больных СД2 с резистентными формами АГ (РАГ), до сих пор отсутствуют. Вместе с тем, учитывая неуклонное увеличение распространенности СД2 и АГ [1][11], выявление этих факторов представляется весьма актуальным, поскольку может стать основой таргетной терапии.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить характер церебрососудистых изменений по данным МРТ головного мозга у больных СД2 в сочетании с РАГ и выявить факторы, вовлеченные в их развитие.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Научно-исследовательский институт кардиологии, Томский национальный исследовательский медицинский центр Российской академии наук, Томск, Россия.
Время исследования. Набор данных проводили в отделении артериальных гипертоний с марта 2010 г. по декабрь 2018 г.
Изучаемая популяция: больные СД2 в сочетании с РАГ. Критерии включения: 1) лица обоего пола от 18 до 80 лет; 2) РАГ; 3) СД2; 3) подписанное информированное согласие. Критерии исключения: 1) псевдорезистентность; 2) вторичная АГ; 3) СД 1 типа; 4) уровень гликированного гемоглобина (HbA1с) >10%; 5) расчетная скорость клубочковой фильтрации (рСКФ) <30 мл/мин/1,73 м2; 6) беременность; 7) перенесенные менее года назад острые сосудистые осложнения; 8) нестабильная стенокардия; 9) хроническая сердечная недостаточность выше II функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA); 10) тяжелые сопутствующие заболевания; 11) прием препаратов, влияющих на уровень АД (нестероидных противовоспалительных средств, симпатомиметиков, пероральных контрацептивов и др.).
Дизайн исследования: одноцентровое наблюдательное одномоментное одновыборочное неконтролируемое исследование.
Методы
Диагноз РАГ подтверждали на основании сохранения АД более 140/90 мм рт. ст., несмотря на прием 3 и более антигипертензивных препаратов, включая диуретик, после исключения псевдорезистентности и вторичных форм АГ, кроме синдрома обструктивного апноэ сна. Для выявления вторичных форм АГ в соответствии со стандартами медицинской практики выполняли комплексное лабораторно-инструментальное обследование с оценкой нейроэндокринного профиля (альдостерон, ренин, кортизол плазмы, тиреоидная панель, метанефрины и норметанефрины суточной мочи) и данных визуализирующих методов исследования (МРТ, ультразвуковое сканирование) сосудов (аорта, почечные артерии), почек, надпочечников.
Всем пациентам проводили МРТ головного мозга (аппарат Titan Vantage, Toshiba Medical 1,5 Тесла), толщина срезов — 3–5 мм. Исследование выполняли в трех плоскостях: аксиальной, сагиттальной и фронтальной. Использовали Т1- и Т2-режимы с импульсной последовательностью Spin-Echo. Параметры Т1-взвешенных изображений в аксиальной и сагиттальной плоскостях: TR=450 мс, TE=15 мс, угол a=70°. Параметры Т2-изображений в аксиальной плоскости: TR=6000 мс, TE=117 мс. По данным МРТ выявляли признаки внутричерепной гипертензии, нарушения ликвородинамики и участки цереброваскулярной ишемии (фокальные повреждения белого вещества и лакунарные инфаркты). К признакам внутричерепной гипертензии относили ПБВ в ПВО и расширение борозд больших полушарий головного мозга. Состояние ликвородинамики оценивали на основании измерения поперечных размеров тел, передних и задних рогов боковых желудочков, тела третьего желудочка и субарахноидального пространства фронтальных, париетальных и окципитальных областей в аксиальной плоскости в Т2-режиме. Нормальными считали ширину боковых желудочков не более 1,5 см, а поперечного размера субарахноидальных пространств — не более 0,25 см. Для оценки утраты вещества головного мозга рассчитывали индекс Эванса (ИЭ) (отношение расстояния между самыми латеральными участками передних рогов к максимальному расстоянию между внутренними пластинками костей черепа) [9]. Критерием атрофии головного мозга считали увеличение ИЭ≥0,30 [9]. К фокальным ПБВ головного мозга относили очаги гиперинтенсивности в режиме Т2 без снижения интенсивности МРТ-сигнала в Т1-изображениях (по типу локального отека при увеличении проницаемости сосудистой стенки) размерами от 3 до 15 мм. К лакунарным инфарктам относили очаговые изменения вещества головного мозга с гиперинтенсивным МРТ-сигналом в Т2-режиме и гипоинтенсивным в Т1 — признаки кистозной трансформации мозгового вещества размерами от 5 до 15 мм. Для выявления распространенности очагов ПБВ исследовали следующие области мозга: I — субкортикальная область (мозжечок, подкорковое белое вещество, кора); II — область базальных ганглиев (базальные ганглии, внутренняя капсула, таламус); III — область ствола мозга (продолговатый мозг, мост, ножки мозга). Дополнительно измеряли плотность МРТ-сигнала в проекции базальных ядер (головка хвостатого ядра, таламус и скорлупа с двух сторон). В зону измерения не включали лакунарные инфаркты, если таковые имели место быть. Распространенность и выраженность ПБВ в ПВО оценивали согласно пятиступенчатой классификации перивентрикулярного гиперинтенсивного сигнала, предложенной Н. Fukuda и М. Kitani в 1995 г. Первую степень диагностировали при наличии «колпаков» только на передних рогах латеральных желудочков на уровне базальных ядер; 2-ю — при распространении «колпаков» на оба передних и задних рога боковых желудочков или нерегулярном перивентрикулярном гиперинтенсивном сигнале в пределах внутренней (медиальной) половины белого вещества на уровне тел боковых желудочков; 3-й степени соответствовало распространение сигнала на другую половину белого вещества в любом регионе; 4-й — распространение на всю область белого вещества.
Лабораторные тесты включали определение уровня гликированного гемоглобина (HbA1c; ионообменный способ, наборы BIOCON, Germany); базального и постпрандиального уровней глюкозы (глюкозооксидантный метод), инсулина и С-пептида в сыворотке крови («Монобайд Инк», США); лептина, резистина крови (наборы Mediagnost, Германия); высокочувствительного С-реактивного белка (вчСРБ; наборы Biomerica, Германия); инсулиноподобного фактора роста 1 (ИПФР-1; наборы IGF-1 ELISA Kit, Immunodiagnostics Systems Ltd (IDS Ltd), Германия); альдостерона крови (наборы DBC, Канада); фактора некроза опухоли альфа (ФНО-α; специализированные тест-системы фирмы «Вектор-Бест», Новосибирск). Количественное определение биохимических показателей осуществлялось методом иммуноферментного анализа согласно инструкциям производителей.
Офисное АД измеряли аускультативно-осциллометрическим методом по стандартной методике Н.С. Короткова; для суточного мониторирования АД использовали систему автоматического измерения АВРМ-04 (Meditech, Венгрия).
Оценку церебрального кровотока проводили по данным транскраниальной допплерографии средних мозговых артерий (СМА) по стандартной методике в режиме транскраниального сканирования через темпоральный доступ (ультразвуковая диагностическая система экспертного класса, темпоральный датчик 2,5–4 мГц). Для определения вазореактивности СМА использовали пробу с задержкой дыхания и гипервентиляцией (30 с) Во время гиперкапнической пробы пациентов просили задержать дыхание в течение 30 с или максимально долго при неспособности выдержать 30 с полностью (минимум 20 с). Скорости кровотока регистрировали сразу после окончания теста. Индекс гиперкапнии, или коэффициент реактивности на гиперкапническую нагрузку (К(+)), отражающий резерв вазодилатации, рассчитывали как отношение изменения пиковой скорости кровотока в ответ на задержку дыхания к исходному значению, выраженное в процентах. Коэффициент реактивности на гипокапнию (К(-)), характеризующий резерв вазоконстрикции, вычисляли как отношение изменения пиковой скорости кровотока в ответ на гипервентиляцию к исходному значению, выраженному в процентах. Вазореактивность плечевой артерии (эндотелий-зависимую вазодилатацию) определяли по данным пробы с реактивной гиперемией, предложенной D. Celermajer и соавт. в 1992 г. Приверженность к лечению оценивали со слов пациента.
Статистический анализ
Статистический анализ полученных данных проводили с использованием пакета программ Statistica 10.0 for Windows. Согласие с нормальным законом распределения признаков проверяли с помощью критерия Шапиро–Уилка. Непрерывные переменные при нормальном распределении представлены в виде средней величины и стандартного отклонения (M±SD) при отсутствии нормального распределения — в виде медианы (Me) и интерквартильного размаха (Q25; Q75 — 25-й и 75-й процентили). Категориальные переменные отражены количественно и в процентном отношении. Применяли коэффициент парных корреляций Пирсона. Критическим уровнем значимости p считали 0,05.
Этическая экспертиза
Исследование было одобрено комитетом по биомедицинской этике НИИ кардиологии Томского НИМЦ (выписка из протокола № 139 от 18.11.2015).
РЕЗУЛЬТАТЫ
В исследование были включены 46 больных СД2 в сочетании с РАГ, клиническая характеристика которых представлена в табл. 1. Следует отметить, что окклюзирующее поражение сонных артерий в данной группе отсутствовало, частота фибрилляции предсердий как возможной причины тромбоэмболических осложнений была невысока (16%), и все эти пациенты принимали оральные антикоагулянты.
Сахароснижающая терапия у 70% пациентов включала метформин, его комбинацию с инсулином использовали 16% больных, частота приема препаратов сульфонилмочевины, так же как и диетотерапии, составила 7%. Статины принимали все обследованные пациенты.
Частота церебральных повреждений по данным МРТ отражена на рис. 1, согласно которому преобладающими изменениями были ПБВ в перивентрикулярной зоне. У более половины больных было документировано наличие фокальных ПБВ и расширение субарахноидальных пространств.
Лакунарные инфаркты и крупнофокальные ПБВ занимали, как правило, 1 регион, тогда как мелкофокальные повреждения носили более распространенный характер и в большинстве случаев выявлялись одновременно в двух регионах (рис. 2).
Частота увеличения ИЭ, являющегося признаком церебральной атрофии, составила 36,4%.
Для оценки связи МРТ-признаков церебральных повреждений с клиническими и лабораторно-инструментальными данными был проведен корреляционный анализ. Установлено, что повышение плотности МРТ-сигнала от базальных ядер было взаимосвязано с метаболическими нарушениями — увеличением концентрации в крови лептина, постпрандиальных уровней глюкозы, инсулина и С-пептида, базальной инсулинемией (табл. 2).
Увеличение средней плотности МРТ-сигнала в ПВО ассоциировалось с ростом концентрации ФНО-α (r=0,55; p=0,011) и недостаточным ответом кровотока в СМА на гиперкапнию (r=-0,66; p=0,021), а повышение максимальной его плотности коррелировало с увеличением уровня вчСРБ (r=0,64; p=0,045). Степень выраженности ПБВ в ПВО напрямую зависела от уровней базальной гликемии (r=0,35; p=0,020) и HbА1c (r=0,37; p=0,041).
Для МРТ-признаков нарушения ликвородинамики также были характерны связи с уровнями биохимических маркеров и со снижением вазореактивности. Так, поперечный размер хиазмальной цистерны имел прямую связь с концентрацией резистина крови (r=0,43; p=0,030), а поперечный размер III желудочка — со значениями альдостерона (r=0,51; p=0,013). Увеличение поперечного размера III желудочка, кроме того, было взаимосвязано с нарушением периферической вазореактивности (r=-0,60; p=0,014). Расширение хиазмальной цистерны ассоциировалось с недостаточной реакцией кровотока СМА на гиперкапнию (r=-0,66; p=0,026) и с избыточным ответом на гипервентиляцию (r=0,67; p=0,042). Увеличение линейных размеров тела и рогов боковых желудочков (БЖ), а также длины квадригеминальной цистерны мозга (КЦ) коррелировало с недостаточной реакцией СМА на гиперкапнию (r=-0,64; p=0,025 для тела БЖ; r=-0,60; p=0,039 для рогов БЖ; r=-0,61; p=0,045 для КЦ).
Значения ИЭ напрямую коррелировали с комплексом метаболических маркеров, снижением периферической и церебральной вазореактивности (в тесте с гиперкапнией), а также с увеличением исходной скорости кровотока по СМА (табл. 3).
Корреляционных взаимосвязей выраженности структурных изменений головного мозга с показателями АД, клинико-демографическими данными выявлено не было.
Таблица 1. Клиническая характеристика пациентов (M±SD, Me (Q25; Q75), n (%))
Показатели | n=46 | |
Возраст, годы | 60,3±7,9 | |
Пол (ж) | 27 (59) | |
Известная продолжительность АГ, годы | 22 (15; 33) | |
Известная продолжительность СД, годы | 10 (5; 14) | |
Индекс массы тела, кг/м2 | 34,9±6,1 | |
Ишемическая болезнь сердца | ,n (%) | 28 (62) |
Мозговой инсульт в анамнезе | 7 (15) | |
Гипертрофия левого желудочка | 43 (95) | |
Фибрилляция предсердий | 5 (16) | |
Абдоминальное ожирение | 38 (82) | |
Атеросклероз каротидных артерий | 35 (78) | |
Средняя степень стеноза сонных артерий, % | 20 (15; 30) | |
Офисное АД (систолическое/диастолическое), мм рт.ст. | 169,0±16,4/89,0±14,7 | |
Гликемия натощак, ммоль/л | 8,9±2,7 | |
HbA1c, % | 7,4±1,3 | |
рСКФ (формула СKD-EPI), мл/мин/1,73 м2 | 72,2±21,8 | |
Частота приема статинов, % | 100 | |
Количество антигипертензивных препаратов, n | 4,4±1 | |
Бета-блокаторы | ,n (%) | 78 |
Ингибиторы АПФ/сартаны | 98 | |
Диуретики | 95 | |
Антагонисты кальция | 63 | |
Примечание. АГ — артериальная гипертония; HbA1c — гликированный гемоглобин; АД — артериальное давление; СКФ — скорость клубочковой фильтрации; АПФ — ангиотензинпревращающий фермент.
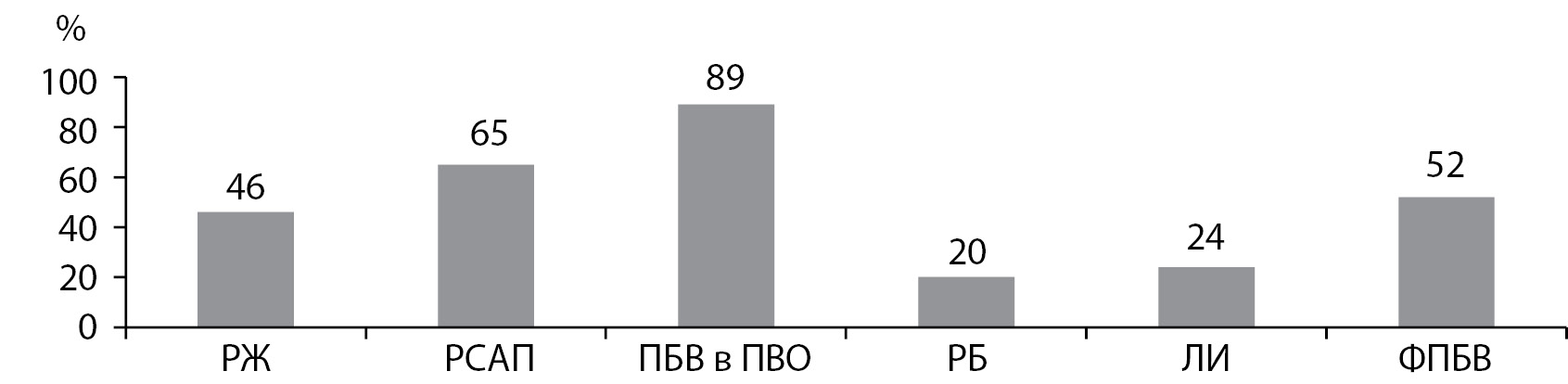
Рисунок 1. Частота встречаемости МРТ-признаков цереброваскулярных изменений у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2 типа.
Примечание. РЖ — расширение желудочков; РСАП — расширение субарахноидальных пространств; ПБВ в ПВО — повреждение белого вещества в перивентрикулярной области; РБ — расширение борозд; ЛИ — лакунарные инфаркты; ФПБВ — фокальные повреждения белого вещества.
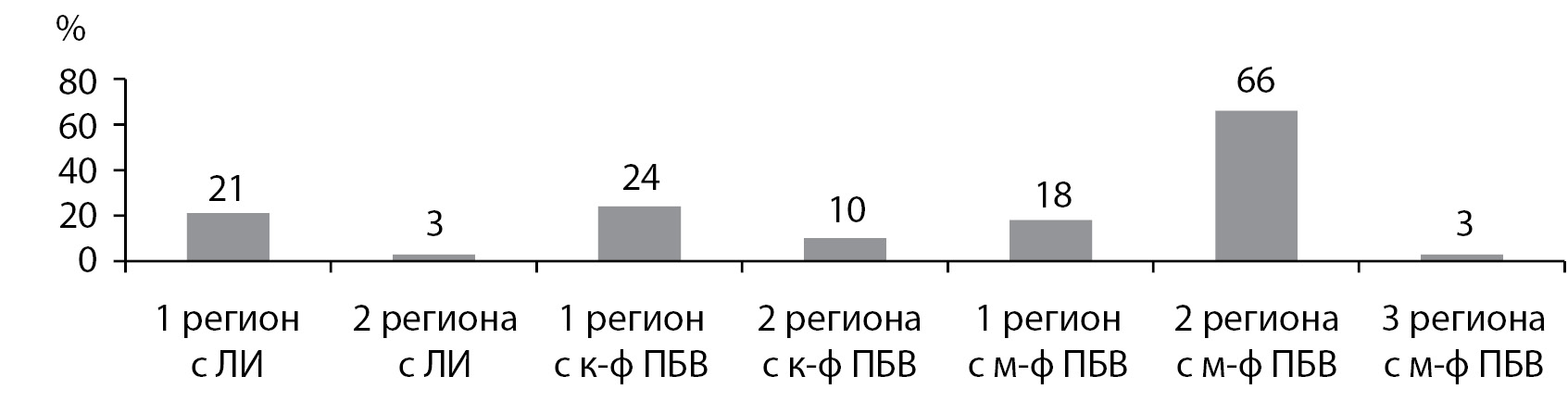
Рисунок 2. Частота лакун и фокальных повреждений белого вещества головного мозга в зависимости от количества занимаемых ими регионов.
Примечание. ЛИ — лакунарные инфаркты; ПБВ — повреждения белого вещества; к-ф — крупнофокальные; м-ф — мелкофокальные.
Таблица 2. Корреляционные взаимосвязи плотности МРТ-сигнала в области базальных ядер с лабораторными показателями
Лабораторные показатели | Головка хвостатого ядра | Скорлупа | Таламус |
Постпрандиальная гликемия | r=0,48; p=0,030 | r=0,48; p=0,025 | r=0,46; p=0,040 |
Базальный инсулин | r=0,52; p=0,007 | r=0,52; p=0,007 | r=0,48; p=0,012 |
Постпрандиальный инсулин | r=0,53; p=0,014 | r=0,54; p=0,011 | r=0,52; p=0,017 |
Постпрандиальный С-пептид | r=0,47; p=0,031 | r=0,49; p=0,023 | r=0,46; p=0,037 |
Лептин | r=0,41; p=0,020 | r=0,40; p=0,027 | r=0,36; p=0,048 |
Таблица 3. Значимые корреляционные взаимосвязи индекса Эванса с клинико-инструментальными и лабораторными показателями
Показатели | ИЭ |
HbA1c | r=0,58; p=0,030 |
ИПФР-1 | r=0,89; p=0,015 |
Резистин | r=0,58; p=0,030 |
Коэффициент гиперкапнии СМА | r=-0,65; p=0,030 |
Эндотелий-зависимая вазодилатация плечевой артерии | r=-0,77; p=0,002 |
Пиковая линейная скорость кровотока СМА | r=0,83; p=0,010 |
Средняя линейная скорость кровотока СМА | r=0,84; p=0,001 |
ОБСУЖДЕНИЕ
Клиническая характеристика обследованных нами больных отражает типичный фенотип пациента с СД2 в сочетании с РАГ, для которого характерны средний возраст более 60 лет, длительное течение АГ, высокая частота ожирения и периферического атеросклероза [12], что в определенной степени позволяет экстраполировать полученные нами результаты на целевую популяцию.
Наше исследование стало одним из первых, оценивших характер церебрососудистой патологии у селективной группы больных СД2 в сочетании с тяжелыми формами АГ. Согласно полученным результатам, частота МРТ-признаков церебральных повреждений у данной категории пациентов оказалась достаточно высокой. В большей степени это касается ПБВ в ПВО, которые, согласно накопленным данным, тесно связаны с риском мозгового инсульта и когнитивными нарушениями [8]. Расширения ликворных пространств определялись более чем у половины обследованных пациентов. Обращало на себя внимание и то, что почти у трети больных, согласно значениям ИЭ, имели место косвенные признаки атрофии головного мозга.
Нами впервые были изучены связи МРТ-признаков повреждений головного мозга с лабораторно-инструментальными показателями у больных СД2 в сочетании с РАГ. О сложном и комплексном механизме формирования структурных церебральных изменений свидетельствует отсутствие прямой связи повреждений мозговой ткани с уровнем АД, продолжительностью СД и АГ, а также иными клинико-демографическими данными. Вместе с тем выраженность ПБВ и значений ИЭ напрямую зависела от состояния углеводного обмена. Ранее A. Schneider и соавт. также документировали ассоциацию ПБВ с уровнем HbA1c [13]. В работе N. Ogama и соавт. была описана корреляция глобальной мозговой атрофии и ПБВ с уровнем постпрандиальной гликемии [14]. Негативное влияние гипергликемии на мозговую ткань связывают с образованием супероксидных анионов и свободных радикалов, а также накоплением конечных продуктов гликирования [10].
Рост постпрандиальных уровней глюкозы, инсулина и С-пептида, а также базальной инсулинемии в нашем исследовании был взаимосвязан с повышением плотности МРТ-сигнала от базальных ядер, отвечающих за планирование и осуществление сложных двигательных программ, когнитивные функции и формирование эмоций.
Установленная нами связь расширения III желудочка мозга с уровнем альдостерона может быть следствием участия последнего в оксидативном стрессе и ускоренном сосудистом старении [15], которые сопровождаются атрофией мозговой ткани. Кроме того, по сообщениям R. Climie и соавт. [16], одним из факторов развития церебральной атрофии у больных СД2 является абдоминальное ожирение, что может быть обусловлено адипокиновым дисбалансом и стимуляцией лептином альдостероновых рецепторов [17], бо́льшей степенью инсулинорезистентности, а также повышенным образованием конечных продуктов гликирования. Эту гипотезу подтверждают выявленные нами взаимосвязи интенсивности МРТ-сигнала в области базальных ядер с уровнем лептина, а также корреляция ИЭ с плазменной концентрацией резистина.
Микрососудистая патология и эндотелиальная дисфункция являются одними из ведущих звеньев патогенеза цереброваскулярных осложнений [10][18] вследствие развития атеросклероза и его атеротромботических осложнений. Дополнительное значение имеют повышение проницаемости гематоэнцефалического барьера с утратой иммунологической толерантности к тканям мозга и проникновение в них цитотоксических субстанций, вызывающих нейрональное повреждение и ннейродегенерацию [18]. По данным нашей работы, нарушение периферической и церебральной вазореактивности ассоциировалось с косвенными признаками утраты вещества головного мозга в виде увеличения ИЭ, расширения III желудочка и повышения интенсивности МРТ-сигнала в ПВО.
В настоящее время особо значимую роль в церебральном повреждении придают хроническому низкоинтенсивному воспалению [17]. Согласно нашим результатам, повышение уровней ФНО-α и вчСРБ сопровождалось возрастанием интенсивности МРТ-сигнала в ПВО. Негативное влияние ФНО-α на ткани головного мозга связывают с его способностью вызывать вазоконстрикцию и редукцию мозгового кровотока, а также нарушать тканевой гомеостаз и целостность гематоэнцефалического барьера [19].
Что касается выявленной нами связи увеличения ИЭ с ускорением мозгового кровотока, можно предположить, что эти гемодинамические изменения служат отражением механизма отрицательной обратной связи и направлены на улучшение мозговой перфузии.
Отсутствие прямой связи церебральных повреждений с уровнем АД у больных РАГ в сочетании с СД2 может быть обусловлено прежде всего тем, что метаболические нарушения при СД2 существенно изменяют патофизиологию церебральных осложнений [10]. Вполне вероятно, что при длительном течении АГ выраженность повреждения головного мозга определяется уже не столько уровнем АД, сколько теми изменениями гемодинамики, которые сопутствуют АГ и усугубляются наличием СД2. Так, негативное влияние повышенной гемодинамической нагрузки на стенку питающих мозг артерий в отношении тканей головного мозга может реализоваться через эндотелиальную дисфункцию и ее тромботические осложнения, разрежение сосудистого русла, развитие атеросклероза, а также повышение сосудистой жесткости, усиливающей гидродинамическое воздействие пульсирующего кровотока на микрососудистое русло церебральных артерий [15].
Клиническая значимость результатов
Наши данные позволили выявить факторы, связанные с выраженностью МРТ-признаков церебрального повреждения, которые могут в перспективе стать основой таргетной терапии.
Ограничения исследования: небольшой размер выборки, оценка приверженности к лечению по данным опроса.
Направления дальнейших исследований
В дальнейшем изучении нуждается возможность замедления прогрессирования церебральных осложнений или их обратного развития под воздействием противовоспалительной и метаболической терапии. Перспективным лечебным направлением для больных резистентной АГ может стать использование инвазивных вмешательств. Это в большей степени касается ренальной денервации, для которой доказано наличие противовоспалительных и нейромодулирующих эффектов [20].
ЗАКЛЮЧЕНИЕ
Таким образом, для сочетания СД2 с РАГ характерна высокая частота ПБВ и расширения ликворных пространств, выраженность которых коррелирует с тяжестью метаболических, нейрогормональных и гемодинамических расстройств в отсутствие прямой связи со степенью повышения АД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование выполнено за счет средств Гос. задания НИИК Томского НИМЦ, гос. регистрация: АААА-А15-115123110026-3 от 31.12.2015.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Фальковская А.Ю. — концепция и дизайн исследования; сбор и обработка материалов; анализ полученных данных, написание текста; Мордовин В.Ф. — концепция и дизайн исследования, консультативная помощь, проверка критически важного интеллектуального содержания; Сухарева А.Е. — сбор и обработка материалов МРТ головного мозга, проверка критически важного интеллектуального содержания; Зюбанова И.В. — сбор и обработка материалов, проверка критически важного интеллектуального содержания; Манукян М.А. — сбор и обработка материалов, проверка критически важного интеллектуального содержания; Гусакова А.М. — сбор и обработка материалов лабораторных тестов, проверка критически важного интеллектуального содержания; Цой Е.И. — обработка материалов, проверка критически важного интеллектуального содержания; Дорожкина Н.В. — сбор и обработка материалов лабораторных тестов, проверка критически важного интеллектуального содержания. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Атлас регистра сахарного диабета Российской Федерации. Статус 2018 г. // Сахарный диабет. — 2019. — Т. 22. — №2S. — С. 4-61. doi: https://doi.org/10.14341/DM12208
2. Дедов И.И., Калашникова М.Ф., Белоусов Д.Ю., и др. Анализ стоимости болезни сахарного диабета 2 типа в Российской Федерации: результаты Российского многоцентрового наблюдательного фармакоэпидемиологического исследования ФОРСАЙТ-СД2 // Сахарный диабет. — 2017. — Т. 20. — №6. — С. 403-419. doi: https://doi.org/10.14341/DM9278
3. Emerging Risk Factors Collaboration, Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010;375(9733):2215-2222. doi: https://doi.org/10.1016/S0140-6736(10)60484-9
4. Colosia AD, Palencia R, Khan S. Prevalence of hypertension and obesity in patients with type 2 diabetes mellitus in observational studies: a systematic literature review. Diabetes Metab Syndr Obes. 2013;6:327-338. doi: https://doi.org/10.2147/DMSO.S51325
5. Zhang Y, Jiang X, Bo J, et al. Risk of stroke and coronary heart disease among various levels of blood pressure in diabetic and nondiabetic Chinese patients. Journal of Hypertension. 2018;36(1):93-100. doi: https://doi.org/10.1097/HJH.0000000000001528
6. Рюмшина Н.И., Баев А.Е., Фальковская А.Ю. и др. МРТ сосудистой стенки с парамагнитным контрастным усилением в оценке терапевтического воздействия радиочастотной абляции симпатических сплетений почечных артерий при лечении резистентной артериальной гипертонии // Медицинская визуализация. — 2019. — №1. — С. 56-64. doi: https://doi.org/10.24835/1607-0763-2019-1-56-64
7. Усов В.Ю., Ярошевский С.П., Тлюняева А.М., и др. Сочетанное применение количественной обработки Т2-взвешенных изображений и МРТ-кортикометрии у пациентов с атеросклерозом сонных артерий для прогнозирования церебральных осложнений инвазивных и хирургических вмешательств // Лучевая диагностика и терапия. — 2018. — №4. — С. 48-56. doi: https://doi.org/10.22328/2079-5343-2018-4-48-56
8. Debette S, Schilling S, Duperron MG, et al. Clinical significance of magnetic resonance imaging markers of vascular brain injury: a systematic review and meta-analysis. JAMA Neurology. 2019;76(1):81-94. doi: https://doi.org/10.1001/jamaneurol.2018.3122
9. Гребенников Д.А., Ситников Е.В., Ананьев В.К. Дифференциальная диагностика гидроцефалии и атрофии головного мозга // Здравоохранение Дальнего Востока. — 2017. — Т. 72. — №2. — С. 51-54.
10. Petrie JR, Guzik TJ, Touyz RM. Diabetes, hypertension, and cardiovascular disease: clinical insights and vascular mechanisms. Canadian Journal of Cardiology. 2018;34(5):575-584. doi: https://doi.org/10.1016/j.cjca.2017.12.005
11. Zhou B, Carrillo-Larco RM, Danaei G, et al. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: a pooled analysis of 1201 population-representative studies with 104 million participants. The Lancet. 2021;398(10304):957-980. doi: https://doi.org/10.1016/S0140-6736(21)01330-1
12. Mohammad А, Abujbara М, Alshraideh J, et al. The Prevalence of Resistant Hypertension Among Type 2 Diabetic Patients Attending the National Center for Diabetes, Endocrinology, and Genetics. Journal of Endocrinology and Metabolism. 2017;7(5):153-158. doi: https://doi.org/10.14740/jem448e
13. Schneider ALC, Selvin E, Sharrett AR, et al. Diabetes, prediabetes, and brain volumes and subclinical cerebrovascular disease on MRI: the atherosclerosis risk in communities neurocognitive study (ARIC-NCS). Diabetes Care. 2017;40:1514-1521. doi: https://doi.org/10.2337/dc17-1185.
14. Ogama N, Sakurai T, Kawashima S, et al. Postprandial hyperglycemia is associated with white matter hyperintensity and brain atrophy in older patients with type 2 diabetes mellitus. Front. Aging Neurosci. 2018;10:273. doi: https://doi.org/10.3389/fnagi.2018.00273
15. Sun Z. Aging, arterial stiffness, and hypertension. Hypertension. 2015;(65):252-256. doi: https://doi.org/10.1161/HYPERTENSIONAHA.114.03617
16. Climie RE, Moran C, Callisaya M, et al. Abdominal Obesity and Brain Atrophy in Type 2 Diabetes Mellitus. PLoS One. 2015;10(11):e0142589. doi: https://doi.org/10.1371/journal.pone.0142589
17. Guzik TJ, Touyz RM. Oxidative stress, inflammation, and vascular aging in hypertension. Hypertension. 2017;70(4):660-667. doi: https://doi.org/10.1161/HYPERTENSIONAHA.117.07802
18. Cuadrado-Godia E, Dwivedi P, Sharma S, et al. Cerebral small vessel disease: a review focusing on pathophysiology, biomarkers, and machine learning strategies. Journal of Stroke. 2018;20(3):302. doi: https://doi.org/10.5853/jos.2017.02922
19. Ni Y, Teng T, Li R, et al. TNF-α alters occludin and cerebral endothelial permeability: Role of p38MAPK. PLoS One. 2017;12(2):e0170346. doi: https://doi.org/10.1371/journal.pone.0170346
20. Зюбанова И.В., Мордовин В.Ф., Пекарский С.Е., и др. Возможные механизмы отдаленных кардиальных эффектов ренальной денервации // Артериальная гипертензия. — 2019. — Т. 25. — №4. — С. 423-432. doi: https://doi.org/10.18705/1607-419X-2019-25-4-423-432
Об авторах
А. Ю. ФальковскаяРоссия
Фальковская Алла Юрьевна, кандидат медицинских наук
634012, Томск, ул. Киевская, д. 111А
eLibrary SPIN: 1418-2726
В. Ф. Мордовин
Россия
Мордовин Виктор Федорович, доктор медицинских наук , профессор
Томск
eLibrary SPIN: 4948-0425
А. Е. Сухарева
Россия
Сухарева Анна Евгеньевна, кандидат медицинских наук
Томск
eLibrary SPIN: 7914-3111
И. В. Зюбанова
Россия
Зюбанова Ирина Владимировна, кандидат медицинских наук
Томск
eLibrary SPIN: 9032-8376
М. А. Манукян
Россия
Манукян Мушег Айкович, аспирант
Томск
eLibrary SPIN: 3993-1733
В. А. Личикаки
Россия
Личикаки Валерия Анатольевна, кандидат медицинских наук
Томск
eLibrary SPIN: 6551-7304
Е. И. Цой
Россия
Цой Екатерина Игоревна, кандидат медицинских наук
Томск
eLibrary SPIN: 5739-0105
А. М. Гусакова
Россия
Гусакова Анна Михайловна, кандидат физических наук
Томск
eLibrary SPIN: 6513-2800
Н. В. Дорожкина
Россия
Дорожкина Наталья Викторовна
Томск
Дополнительные файлы
|
|
1. Рисунок 1. Частота встречаемости МРТ-признаков цереброваскулярных изменений у больных резистентной артериальной гипертензией в сочетании с сахарным диабетом 2 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(52KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Частота лакун и фокальных повреждений белого вещества головного мозга в зависимости от количества занимаемых ими регионов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(72KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Фальковская А.Ю., Мордовин В.Ф., Сухарева А.Е., Зюбанова И.В., Манукян М.А., Личикаки В.А., Цой Е.И., Гусакова А.М., Дорожкина Н.В. Цереброваскулярная патология у больных резистентной артериальной гипертонией в сочетании с сахарным диабетом 2 типа. Сахарный диабет. 2022;25(2):128-135. https://doi.org/10.14341/DM12779
For citation:
Falkovskaya A.Yu., Mordovin V.F., Sukhareva A.E., Zyubanova I.V., Manukyan M.A., Lichikaki V.A., Tsoi E.I., Gusakova A.M., Dorozhkina N.V. Cerebrovascular disorders in patients with type 2 diabetes mellitus and resistant hypertension. Diabetes mellitus. 2022;25(2):128-135. (In Russ.) https://doi.org/10.14341/DM12779
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































