Перейти к:
Клиническая характеристика пациентов с COVID-19 в зависимости от получаемой терапии и наличия сахарного диабета 2 типа
https://doi.org/10.14341/DM12764
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет 2 типа (СД2) является независимым фактором риска развития неблагоприятных клинических исходов у пациентов с COVID-19. На данный момент накоплено недостаточно данных, оценивающих эффективность и безопасность использования лекарственных препаратов для лечения COVID-19, особенно у пациентов с СД2.
ЦЕЛЬ. Целью исследования являлось выявление ассоциативной связи между используемыми лекарственными препаратами и клиническими исходами пациентов с COVID-19 и СД2.
МЕТОДЫ. Проведен ретроспективный анализ клинических исходов 1753 пациентов с ПЦР-положительным COVID-19, которые были госпитализированы в перепрофилированные отделения многопрофильной городской клинической больницы им В.П. Демихова в период с 23.03.2020 по 01.06.2020 гг.
РЕЗУЛЬТАТЫ. Общее количество пациентов — 1753, из которых 311 (17,7%) — пациенты с СД2. Терапию по поводу COVID-19 получали 92,6% пациентов. При этом 91,4% пациентов получали антибиотики (АБ), 61,5% — бронхолитики, 56,6% — инъекционные антикоагулянты (АК), 45,2% — гидроксихлорохин, 6,3% — противовирусные препараты (ПВП), 5,4% — пероральные АК, 4,6% — глюкокортикостероиды (ГКС), 1,9% — тоцилизумаб. Снижение риска смерти пациентов с COVID-19 отмечалось на фоне терапии АБ (OR 0,07; 95% ДИ 0,05–0,11; р<0,05), бронхолитиками (OR 0,12; 95% ДИ 0,08–0,18; р<0,05) и инъекционными АК (OR 0,47; 95% ДИ 0,34–0,67; р<0,05). При этом среди пациентов с СД2 по сравнению с пациентами без СД2 отмечалось более выраженное снижение риска смерти на фоне терапии инъекционными АК: среди пациентов с СД2 риск смерти снижался в 2,6 раза (OR 0,39; 95% ДИ 0,21–0,73; р<0,05), среди пациентов без СД2 — в 2,1 раза (OR 0,47; 95% ДИ 0,31–0,71; р<0,05). Терапия ПВП ассоциировалась с увеличением шансов смерти как среди пациентов без СД2 (OR 2,64; 95% ДИ 1,44–4,86; р<0,05), так и среди пациентов с СД2 (OR 4,98; 95% ДИ 2,11–11,75; р<0,05).
ЗАКЛЮЧЕНИЕ. Значимое снижение риска смерти среди пациентов с COVID-19 отмечалось на фоне терапии АБ, бронхолитиками, инъекционными АК. Увеличение риска смерти отмечалось на фоне терапии ПВП.
Ключевые слова
Для цитирования:
Демидова Т.Ю., Лобанова К.Г., Переходов С.Н., Анциферов М.Б. Клиническая характеристика пациентов с COVID-19 в зависимости от получаемой терапии и наличия сахарного диабета 2 типа. Сахарный диабет. 2021;24(3):231-242. https://doi.org/10.14341/DM12764
For citation:
Lobanova K.G., Demidova T.Y., Perekhodov S.N., Antsiferov M.B. Clinical characteristics of patients with COVID-19 depending on the treatment received and the presence of type 2 diabetes mellitus. Diabetes mellitus. 2021;24(3):231-242. (In Russ.) https://doi.org/10.14341/DM12764
ОБОСНОВАНИЕ
Коронавирусная инфекция 2019 (COVID-19) — инфекционное заболевание, возникающее в результате инфицирования вирусным агентом SARS-CoV-2 и характеризующееся поражением дыхательных путей: верхних дыхательных путей (ВДП) при легком течении заболевания и развитием интерстициальной пневмонии и острого респираторного дистресс-синдрома (ОРДС) при тяжелом течении заболевания [1].
Клиническое развитие интерстициальной пневмонии при COVID-19 протекает в три фазы. Первая фаза, или фаза ранней инфекции, возникает после трансмиссии вирусных агентов в эпителиоциты ВДП и пневмоциты 2 типа [2][3]. Данная фаза характеризуется неконтролируемой репликацией вирусных частиц на фоне задержки интерферонового ответа. Продолжительность данной фазы, как правило, не превышает 5 сут [4]. Клинически фаза ранней инфекции проявляется лихорадкой, миалгией, сухим кашлем, болью в горле, головной болью, слабостью [3]. Вторая фаза, или легочная, характеризуется прямым цитопатическим действием вируса SARS-CoV-2 на пневмоциты 2 типа и эндотелиоциты легочных сосудов, что способствует повреждению альвеолярной базальной мембраны и активации апоптоза клеток-мишеней [4]. Также особенностью второй фазы является активация врожденного иммунитета, что приводит к гиперпродукции оксида азота, трансформирующего фактора роста-β, интерлейкина-6 (ИЛ-6), фактора некроза опухоли-α (ФНО-α) моноцитами, макрофагами и нейтрофилами, инфильтрирующими легочную ткань [4][5]. Гиперпродукция биологически активных пептидов способствует вазодилятации, повышенной проницаемости легочных сосудов, микрососудистой гиперкоагуляции. Тромбоз легочных сосудов приводит к увеличению мертвого пространства дыхательных путей, что клинически проявляется симптомами гипоксии: одышкой, тахипноэ, тахикардией. Так как легочная фаза характеризуется неадекватной активацией врожденного иммунитета, то по мере синтеза биологически активных пептидов увеличивается трансмиссия вирусных агентов через аэрогематический барьер, развивается виремия [5]. Заболевание переходит в третью фазу, или фазу гипервоспаления. Фаза гипервоспаления, как правило, возникает на 9–12-й день после появления первых клинических симптомов и характеризуется системной гиперпродукцией цитокинов: ИЛ-6, ИЛ-1, ИЛ-8, ИЛ-17, ФНО-α [4]. В результате «цитокинового шторма» развиваются системная эндотелиальная дисфункция, микрососудистая гиперкоагуляция. Клинически данная фаза проявляется развитием ОРДС, септического шока, полиорганной недостаточности, диссеминированного внутрисосудистого свертывания крови, вторичных бактериальных инфекций [3].
Учитывая особенности клинического течения COVID-19, лечение пациентов с данным заболеванием должно включать не только симптоматическую терапию и терапию, направленную на предупреждение трансмиссии и репликации вирусных агентов в клетках-мишенях, но и иммуносупрессивную, противовоспалительную, антикоагулянтную, антибактериальную терапию. На данный момент накоплено недостаточно данных, оценивающих эффективность и безопасность использования лекарственных препаратов для лечения COVID-19, особенно у пациентов с сахарным диабетом 2 типа (СД2).
ЦЕЛЬ ИССЛЕДОВАНИЯ
Целью исследования являлось выявление ассоциативной связи между используемыми лекарственными препаратами и клиническими исходами пациентов с COVID-19 и СД2.
МЕТОДЫ
Место и время проведения исследования
Место проведения. Все пациенты, включенные в исследование, были госпитализированы в перепрофилированные отделения многопрофильной городской клинической больницы (ГКБ) им В.П. Демихова.
Время исследования. В анализируемую группу вошли пациенты, госпитализированные в период с 23.03.2020 по 01.06.2020 гг. (во время первой волны коронавирусной инфекции).
Изучаемые популяции (одна или несколько)
Проведен ретроспективный анализ данных медицинской документации 1753 пациентов с подтвержденным диагнозом COVID-19 путем обнаружения вирусного агента SARS-CoV2 в мазках из зева методом полимеразной цепной реакции. Все пациенты были разделены на 2 группы: без сопутствующего СД2 и с наличием СД2. Отличительной особенностью проведенного исследования являлась оценка клинических исходов «выписан/умер» у пациентов с тяжелыми клиническими проявлениями заболевания, которым требовалось стационарное лечение.
Критерии включения. Подтвержденный диагноз COVID-19 путем обнаружения вирусного агента SARS-CoV2 в мазках из зева методом полимеразной цепной реакции; госпитализация в перепрофилированные отделения многопрофильной городской клинической больницы им В.П. Демихова в период с 23.03.2020 по 01.06.2020 гг. (во время первой волны коронавирусной инфекции).
Критерии исключения: наличие сопутствующего СД 1 типа.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Анализируемая группа была сформирована методом сплошной выборки: все пациенты, госпитализированные в ГКБ им. В.П. Демихова во время первой волны коронавирусной инфекции с подтвержденным диагнозом COVID-19, были включены в ретроспективный анализ.
Дизайн исследования
Проведено одноцентровое обсервационное ретроспективное исследование пациентов с подтвержденным диагнозом COVID-19, которые были госпитализированы в перепрофилированные отделения ГКБ им. В.П. Демихова. Всем пациентам, госпитализированным по поводу COVID-19, проводился клинико-лабораторный мониторинг вплоть до достижения клинического исхода заболевания: выздоровление или смерть. Пациенты, включенные в ретроспективный анализ, были разделены на 2 группы: с наличием сопутствующего СД2 и без СД2. Проводилась сравнительная оценка клинических исходов пациентов без СД2 и с СД2 в зависимости от получаемой лекарственной терапии.
Описание медицинского вмешательства
Все пациенты, госпитализированные в многопрофильную ГКБ им. В.П. Демихова ДЗ г. Москвы по поводу COVID-19, получали лечение по поводу основного (COVID-19) и сопутствующих заболеваний (СД2, АГ, дислипидемии и т.д.). На фоне лечения проводился клинико-лабораторный мониторинг вплоть до наступления исхода заболевания: выздоровление или смерть.
Методы
Проведен анализ медицинских карт пациентов, госпитализированных в ГКБ им. В.П. Демихова во время первой волны коронавирусной инфекции. Алгоритм диагностики сопутствующих заболеваний основан на анализе данных медицинской документации. Информация о получаемой терапии и клинических исходах пациентов также получена из медицинских карт пациентов.
Статистический анализ
Статистический анализ выполнялся в программе STATISTICA 10.0. Проверка нормальности распределения количественных признаков проводилась при помощи критерия Колмогорова−Смирнова (n>50) или критерия Шапиро–Уилка (n<50). Для описания признаков с нормальным распределением использовали среднее значение с указанием 95% доверительного интервала (ДИ). При описании признаков с ненормальным распределением использовали медиану с указанием межквартильного диапазона [25-й и 75-й процентили]. Данные из совокупностей с нормальным распределением сравнивались с помощью t-критерия Стьюдента. Данные из совокупностей с ненормальным распределением сравнивались по критерию Манна–Уитни. Сравнение качественных данных проводилось при использовании таблиц сопряженности по критерию χ² Пирсона и точному критерию Фишера. Различия расценивались как статистически значимые при р<0,05. Частота выявления клинических исходов «выздоровление» или «смерть» в зависимости от наличия/отсутствия признака оценивалась на основании определения отношения шансов (OR). Для оценки значимости OR рассчитывались границы 95% ДИ. Статистическая значимость оценивалась как достоверная при p<0,05. Общая летальность рассчитывалась как процентное отношение умерших пациентов к количеству заболевших COVID-19.
Этическая экспертиза
Проверка протокола исследования этическим комитетом не осуществлялась ввиду того, что ретроспективный анализ проводился на основании данных медицинской документации, существовавшей до начала исследовательского проекта, следовательно, какая-либо возможность идентификации испытуемых была исключена.
РЕЗУЛЬТАТЫ
Общее количество пациентов — 1753, из которых 909 пациентов (51,85%) — мужчины, 844 пациента (48,15%) — женщины. Средний возраст пациентов, включенных в ретроспективный анализ, составил 57,29±15,04 года. Медиана индекса массы тела (ИМТ) для пациентов без СД2 составила 30,9 [ 24,3; 37,0] кг/м2, для пациентов с СД2 — 31,2 [ 29,4; 31,9] кг/м2. Признаки поражения легочной ткани по данным компьютерной томографии, соответствующие критериям COVID-19, были выявлены у 1655 (94,4%) пациентов. При этом поражение легочной ткани до 25% отмечалось в 17,7% случаев (n=310); от 25 до 50% — в 39,3% случаев (n=689); от 50 до 75% — в 23,5% случаев (n=412); более 75% — в 2,1% случаев (n=37). У 17,5% пациентов (n=206) степень поражения легочной ткани не уточнялась. Среди пациентов с COVID-2019 у 1143 (65,2%) отмечалось хотя бы одно сопутствующее заболевание. Из общего количества пациентов с COVID-2019 42,8% пациентов имели артериальную гипертензию, 19,3% — ишемическую болезнь сердца, 17,7% — СД2, 12,8% — хроническую болезнь почек, 10,4% — ожирение, 2,2% — хроническую обструктивную болезнь легких, 2,2% — бронхиальную астму, 1,8% — злокачественные образования.
Всего выписаны 1596 пациентов (91,0%): 1335 пациентов без СД2 (76,1%) и 261 пациент с СД2 (14,9%); умерли 157 пациентов (7,9%): 107 пациентов без СД2 (6,1%) и 50 пациентов с СД2 (2,8%). Летальность пациентов без СД2 составила 7,4%. В случае если COVID-19 сопутствовал СД2, летальность достигала 16,1%. Средний возраст умерших пациентов, включенных в исследование, составил 70,8 (68,1; 73,5) года — без СД2 и 70,9 (68,2; 73,7) года — при СД2. Летальность среди мужчин без СД2 составила 7,8%, с СД2 — 17,5%. Летальность среди женщин без СД2 не превышала 7,0% и составляла 14,9% при наличии сопутствующего СД2. Длительность госпитализации умерших пациентов без СД2 в среднем составляла 9 [ 6; 15] койко-дней, умерших пациентов с СД2 — 7,5 [ 4; 11] койко-дней. Таким образом, наличие СД2 существенно увеличивало риск смерти у пациентов с COVID-19. Общая характеристика пациентов представлена в табл.1.
Таблица 1. Общая характеристика пациентов с COVID-19
|
Признак |
Число исходов |
Летальность, % |
p |
||
|
выздоровление1 |
смерть1 |
без СД22 |
СД22 |
||
|
Пациенты, n=1753 |
91,0% (1596 из 1753) |
9,0% (157 из 1753) |
7,4% (107 из 1442) |
16,1% (50 из 311) |
p2=0,000001 |
|
пол: мужской |
90,8% (825 из 909) |
9,2% (84 из 909) |
7,8% (60 из 772) |
17,5% (24 из 137) |
p2=0,000283 |
|
пол: женский |
91,4% (771 из 844) |
8,6% (73 из 844) |
7,0% (47 из 670) |
14,9% (26 из 174) |
p2=0,000918 |
|
Возраст, лет |
56 (55,2; 56,7) |
70,7 (68,6; 72,7) |
70,8 (68,1; 73,5) |
70,9 (68,2; 73,7) |
p1=0 |
|
Длительность госпитализации, сут |
11 [ 9; 15] |
8 [ 5; 15] |
9 [ 6; 15] |
7,5 [ 4; 11] |
p1=0 p2=0,024490 |
|
ИМТ, кг/м2 |
32,9 (30,9; 34,9) |
31,2 [ 24,7; 37,0] |
30,9 [ 24,3; 37,0] |
31,2 [ 29,4; 31,9] |
|
|
АД сист., мм рт.ст. |
120 [ 120; 130] |
130 [ 110; 132] |
122,5 [ 110; 130] |
130 [ 110; 140] |
|
|
АД диаст., мм рт.ст. |
80 [ 70; 80] |
72 [ 68; 80] |
70 [ 68; 80] |
76,0 (71,6; 80,3) |
|
|
рСКФ (CKD-EPI), мл/мин/1,73 м2 |
70,2 [ 57,5; 83,0] |
49,5 (45,0; 54,0) |
50,4 (44,6; 56,1) |
47,8 (40,6; 54,9) |
p1=0 |
|
Гемоглобин, г/л |
141 [ 130; 151] |
131,0 [ 111,0; 142,0] |
128 [ 111; 146] |
133,5 [ 119,5; 141,5] |
|
|
Холестерин общий, ммоль/л |
3,9 [ 3,2; 4,5] |
3,2 [ 2,6; 4,1] |
3,1 [ 2,8; 4,0] |
3,3 [ 2,4; 4,5] |
|
|
Курение |
88,7% (55 из 62) |
11,3% (7 из 62) |
9,1% (5 из 55) |
28,6% (2 из 7) |
|
По результатам ретроспективного анализа данных медицинской документации в общей выборке было выявлено, что у 120 пациентов (6,84%) на фоне COVID-19 развилась реактивная гипергликемия, которая ассоциировалась с более высоким процентом летальности. Так, при гликемии натощак менее 6,1 ммоль/л летальность составляла 4,1%, при гликемии более 7,0 ммоль/л — 10,8%. При этом среди пациентов с СД2, которые имели гликемию натощак более 7,0 ммоль/л, летальность достигала 15,6%, что значимо выше летальности пациентов с реактивной гипергликемией (10,8%), р<0,001. Таким образом, неблагоприятные клинические исходы COVID-19 коррелируют с уровнем гликемии пациентов. Это определяет необходимость постоянного мониторинга уровня глюкозы в крови на фоне проводимого лечения не только среди групп с установленным диагнозом СД2, но и среди пациентов, не имеющих углеводных нарушений.
При оценке влияния воспалительного ответа на клинические исходы пациентов с COVID-19 было выявлено, что лейкоцитоз, лимфопения и повышение уровня С-реактивного белка (СРБ) в дебюте заболевания были ассоциированы с большим процентом летальности, особенно среди пациентов с СД2. Летальность пациентов при уровне лейкоцитов 4–10×109: 4,4% — без СД2 и 11,3% — на фоне СД2; при уровне лейкоцитов более 10×109: 17,5% — без СД2 и 21% — на фоне СД2, разница статистически незначима. Летальность при уровне лимфоцитов 17–38%: 5,6% — без СД2 и 8,2% — на фоне СД2, при уровне лимфоцитов менее 17%: 14,6% — без СД2 и 32,7% — на фоне СД2, р<0,005. Летальность при уровне СРБ менее 0,5 мг/л: 0% — без СД2 и 16,7% — на фоне СД2, при уровне СРБ более 0,5 мг/л: 6,4% — без СД2 и 14,2% — на фоне СД2, разница статистически незначима. Полученные данные указывают на то, что пациенты с СД2 имеют более высокий риск тяжелого течения и неблагоприятных клинических исходов COVID-19 ввиду более выраженной амплитуды воспалительного ответа (повышение СРБ на фоне лейкоцитоза и лимфопении) по сравнению с пациентами, не имеющими СД2.
При анализе показателей коагуляции у пациентов с COVID-19 было отмечено, что более высокий процент летальности отмечался при повышении уровня D-димера и снижении активированного частичного тромбопластинового времени (АЧТВ), особенно у пациентов с СД2. Летальность при повышении уровня D-димера отмечалась в 8,0% случаев у пациентов без СД2 и в 28,6% случаев среди пациентов с СД2, разница статистически незначима ввиду недостаточности имеющихся данных. Летальность на фоне снижения АЧТВ достигала 10,3% у пациентов без СД2, 27,3% — при СД2, разница статистически незначима. Таким образом, сопутствующий СД2 ухудшал исходы пациентов с нарушениями процессов свертываемости крови, которые возникали на фоне COVID-19. Летальность пациентов с COVID-19 в зависимости от показателей гликемии, маркеров воспалительного ответа и параметров коагуляции представлена в табл. 2.
Таблица 2. Летальность пациентов с COVID-19 в зависимости от показателей гликемии, маркеров воспалительного ответа и параметров коагуляции
|
Признак |
Число исходов |
Летальность, % |
p |
||
|
выздоровление1 |
смерть1 |
без СД22 |
СД22 |
||
|
Глюкоза натощак, ммоль/л |
5,7 [ 5,1; 7,0] |
7,2 [ 5,6; 9,3] |
6 [ 5,4; 7,7] |
10,2 [ 7,2; 15,9] |
p1=0,000015 p2=0,000116 |
|
<6,1 |
95,9% (471 из 491) |
4,1% (20 из 491) |
3,7% (17 из 455) |
8,3% (3 из 36) |
p1=0,000917 |
|
6,1–7,0 |
97,2% (106 из 109) |
2,8% (3 из 109) |
1,1% (1 из 92) |
11,8% (2 из 17) |
p2=0,013425 |
|
≥7,0 |
86,9% (199 из 229) |
13,1% (30 из 229) |
10,8% (13 из 120) |
15,6% (17 из 109) |
p1=0,000001 |
|
Лейкоциты, ×109 |
6,7 [ 5,2; 9,6] |
10,4 [ 6,6; 101] |
10,4 [ 6,0; 101] |
10,55 [ 7,5; 101] |
|
|
Менее 4 |
92,8% (103 из 111) |
7,2% (8 из 111) |
6,9% (7 из 101) |
10% (1 из 10) |
p1=0 |
|
4–10 (норма) |
94,5% (1112 из 1177) |
5,5% (65 из 1177) |
4,4% (43 из 982) |
11,3% (22 из 195) |
p1=0 p2=0,000116 |
|
Более 10 |
81,6% (186 из 228) |
18,4% (42 из 228) |
17,5% (29 из 166) |
21% (13 из 62) |
p1=0 |
|
Лимфоциты, % |
26,6 [ 19,6; 35,2] |
29,0 [ 20,7; 36,7] |
30,2 [ 21,3; 36] |
27,3 [ 19,1; 38,2] |
|
|
Менее 17 |
91,5% (212 из 260) |
18,5% (48 из 260) |
14,6% (30 из 205) |
32,7% (18 из 55) |
p1=0 p2=0,002134 |
|
17–38 (норма) |
94% (902 из 960) |
6% (58 из 960) |
5,6% (44 из 790) |
8,2% (14 из 170) |
p1=0 |
|
Более 38 |
97% (252 из 260) |
3% (8 из 260) |
1,7% (4 из 229) |
10,8% (4 из 37) |
p1=0 p2=0,003267 |
|
СРБ, мг/л |
49,6 [ 18; 100,7] |
118,6 [ 53,7; 204,6] |
107 [ 48,8; 191,6] |
145,2 [ 71,7; 212,7] |
p1=0 |
|
Менее 0,5 (норма) |
98,1% (51 из 52) |
1,9% (1 из 52) |
0% (0 из 46) |
16,7% (1 из 6) |
p2=0,005176 |
|
Более 0,5 |
92,1% (962 из 1045) |
7,9% (83 из 1045) |
6,4% (54 из 841) |
14,2% (29 из 204) |
p2=0,000221 |
|
D-димер, нг/мл |
373 [ 290; 516] |
665,5 [ 216,5; 1299,5] |
1299,5 [ 999; 1600] |
216,5 [ 101; 332] |
|
|
Менее 250 (норма) |
100% (5 из 5) |
0% |
0% |
- |
|
|
Более 250 |
87,5% (28 из 32) |
12,5% (4 из 32) |
8% (2 из 25) |
28,6% (2 из 7) |
|
|
АЧТВ, с |
30,8 [ 27,6; 35,3] |
32,4 [ 27,8; 38,8] |
33,1 [ 29,3; 40,9] |
31 [ 25,8; 38,6] |
|
|
Менее 24,3 |
86% (43 из 50) |
14% (7 из 50) |
10,3% (4 из 39) |
27,3% (3 из 11) |
p1=0,025649 |
|
24,3–35 (норма) |
93% (468 из 503) |
7% (35 из 503) |
5,8% (23 из 400) |
11,7% (12 из 103) |
p1=0,025649 p2=0,035838 |
|
Более 35 |
87,4% (181 из 207) |
12,6% (26 из 207) |
10,5% (18 из 171) |
22,2% (8 из 36) |
p1=0,025649 |
Основными причинами смерти госпитализированных пациентов с COVID-19 являлись тяжелые проявления осложнений вирусной инфекции. Осложнения новой коронавирусной инфекции, к которым мы отнесли тромбозы и тромбоэмболии, сепсис, ОРДС, острую почечную недостаточность (ОПН) и полиорганную недостаточность, развивались у 5,0% пациентов в общей выборке. Среди пациентов с СД2 встречаемость осложнений COVID-19 достигала 8,7%. При этом тромботические осложнения (тромбозы, тромбоэмболии) развивались у 3,6% пациентов без СД2 и у 7,4% пациентов с СД2, полиорганная недостаточность встречалась у 1,73% пациентов без СД2 и у 4,5% пациентов с СД2, развитие ОПН — у 0,4% пациентов без СД2 и у 1,9% пациентов с СД2, сепсис — у 1,5% пациентов без СД2 и у 2,9% пациентов с СД2, ОРДС — у 1,0% пациентов без СД2 и у 1,6% пациентов с СД2. Таким образом, наиболее частыми осложнениями у пациентов с COVID-19 были тромботические осложнения, полиорганная недостаточность и сепсис. При этом более высокая распространенность осложнений отмечалась в группе пациентов с СД2. Это подтверждает тот факт, что гипергликемия ассоциирована с более тяжелым течением COVID-19.
Лечение COVID-19: частота встречаемости терапии и летальность пациентов
Из общего количества пациентов, получающих терапию по поводу COVID-19, 91,4% пациентов получали антибиотики (АБ), 61,5% — бронхолитики, 53,6% — инъекционные антикоагулянты (АК), 45,2% — гидроксихлорохин, 6,3% — противовирусные препараты (ПВП), 5,4% — пероральные (per os) АК, 4,6% — глюкокортикостероиды (ГКС), 1,9% — тоцилизумаб. Также 6,1% пациентов находились на искусственной вентиляции легких (ИВЛ), 5,6% получали оксигенотерапию. Частота назначения терапии среди пациентов с COVID-19 представлена на рис. 1.

Рис. 1. Частота назначения терапии среди пациентов с COVID-19.
У пациентов с COVID-19 вне зависимости от наличия или отсутствия СД2 статистически значимое снижение летальности ассоциировалось с терапией гидроксихлорохином (без терапии — 13,2%, на фоне лечения — 3,8%, р<0,001), АБ (без терапии — 44,7%, на фоне лечения — 5,6%, р<0,001), бронхолитиками (без терапии — 19,0%, на фоне лечения — 2,7%, р<0,001) и инъекционными АК (без терапии — 12,2%, на фоне лечения — 6,2%, р<0,001) Статистически значимой разницы в отношении летальности пациентов с COVID-19, получающих ГКС и per os АК, выявлено не было. Использование ПВП и тоцилизумаба у пациентов с COVID-19 ассоциировалось с более высоким процентом летальности. Так, на фоне приема ПВП летальность достигала 22,5%. В случае отсутствия приема ПВП летальность не превышала 8,0%, р<0,001. Аналогично, на фоне приема тоцилизумаба летальность среди пациентов с COVID-19 достигала 21,2%, при отсутствии приема препарата летальность составляла 8,7%, р=0,012.
При сравнении клинических исходов пациентов без СД2 и с СД2 было выявлено, что наличие СД2 было ассоциировано с более высоким риском летальности (р<0,001). Так, летальность пациентов без СД2 на фоне терапии по поводу COVID-19 составляла 4,7%; летальность пациентов с СД2, получающих лечение по поводу COVID-19, достигала 12,3%. При этом в группе пациентов с СД2 по сравнению с пациентами без СД2 отмечалось статистически значимое увеличение летальности пациентов на фоне лечения бронхолитиками (7,3% против 1,8%; p<0,001); гидроксихлорохином (9,0% против 3,0%; p=0,003); АБ (11,5% против 4,4%; p<0,001); ПВП (44,0% против 16,3%; p=0,003) и инъекционными АК (10,9% против 5,0%; p=0,003). Несмотря на то, что на фоне терапии ГКС отмечалось увеличение летальности в группе пациентов с СД2 (16,7% против 7,2%), статистической значимости выявлено не было. На фоне терапии тоцилизумабом и per os АК отмечалось некоторое снижение летальности (в 1,3 и в 2 раза соответственно) в группе пациентов с СД2 по сравнению с пациентами без СД2, однако значимость не была подтверждена ввиду недостаточной выборки пациентов. Летальность пациентов на фоне лечения COVID-19 представлена на рис. 2.
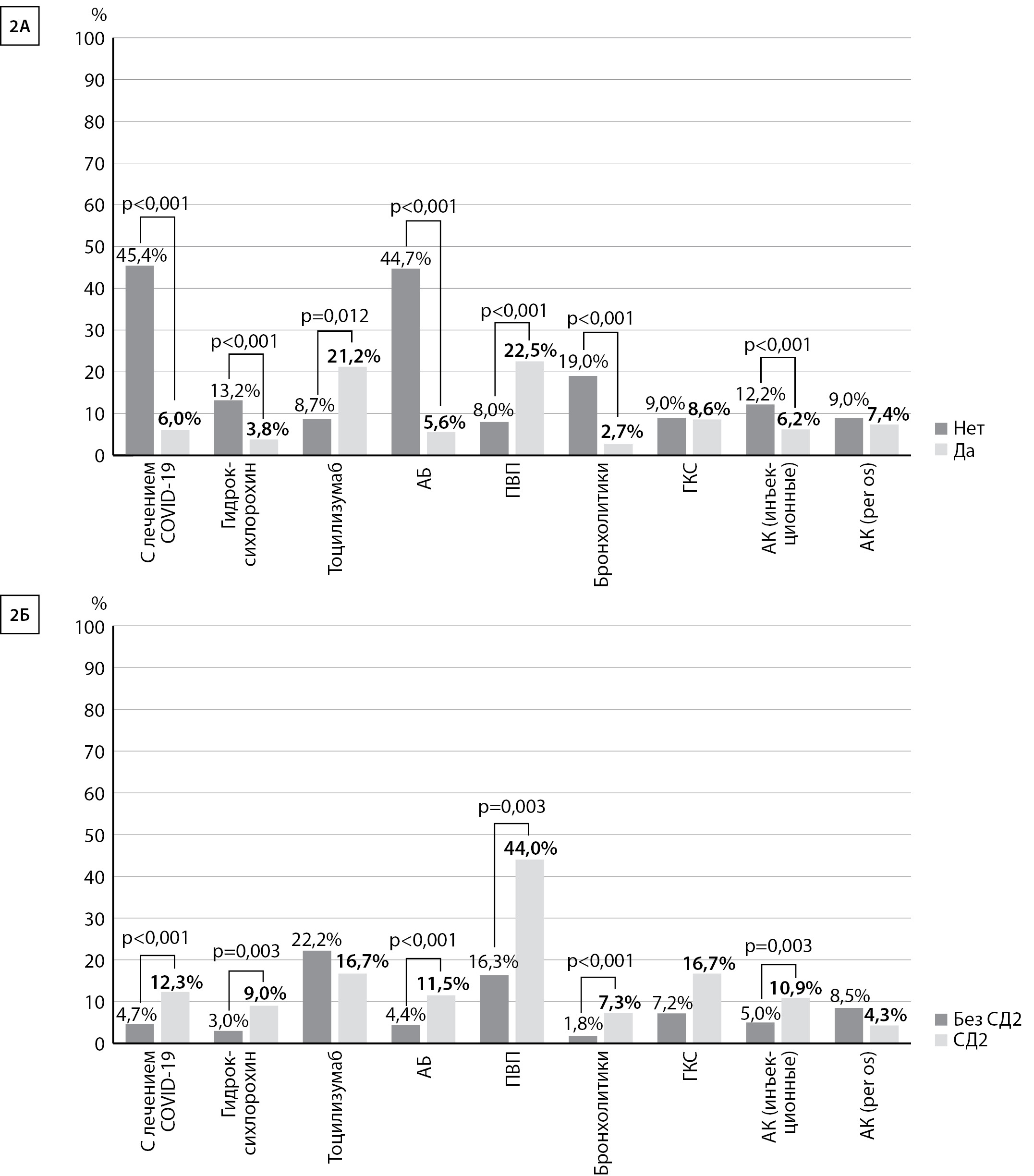
Рис. 2. Летальность пациентов на фоне лечения COVID-19. 2А — общая летальность пациентов на фоне лечения COVID-19; 2Б — летальность пациентов с сахарным диабетом 2 типа и без сахарного диабета 2 типа на фоне лечения COVID-19.
Примечание: АБ — антибиотики; ПВП — противовирусные препараты; ГКС — глюкокортикостероиды; АК — антикоагулянты; per os — перорально.
Вероятность выздоровления/смерти в зависимости от получаемой терапии
Вероятность выздоровления/смерти в зависимости от получаемого лечения оценивалась в трех группах на основании расчета OR: в общей группе (n=1753), среди пациентов без СД2 (n=1442), среди пациентов с СД2 (n=311).
При сравнении OR выздоровления/смерти в общей группе было выявлено, что значимое снижение риска смерти отмечалось на фоне терапии гидроксихлорохином (OR 0,26; 95% ДИ 0,17–0,39; р<0,05), АБ (OR 0,07; 95% ДИ 0,05–0,11; р<0,05), бронхолитиками (OR 0,12; 95% ДИ 0,08–0,18; р<0,05) и инъекционными АК (OR 0,47; 95% ДИ 0,34–0,67; р<0,05). При этом среди пациентов с СД2 по сравнению с пациентами без СД2 отмечалось более выраженное снижение риска смерти на фоне терапии инъекционными АК: среди пациентов с СД2 риск смерти снижался в 2,6 раза (OR 0,39; 95% ДИ 0,21–0,73; р<0,05), среди пациентов без СД2 — в 2,1 раза (OR 0,47; 95% ДИ 0,31–0,71; р<0,05).
Терапия ПВП среди госпитализированных пациентов ассоциировалась с увеличением шансов смерти во всех группах в среднем в 3 раза: OR 3,33; 95% ДИ 2,06–5,37; р<0,05 — для общей группы. Назначение тоцилизумаба увеличивало шанс смерти в общей группе в 2,8 раза (OR 2,82; 95% ДИ 1,2–6,6; р<0,05) преимущественно за счет увеличения риска смерти среди пациентов без СД2 (OR 3,7; 95% ДИ 0,47–9,42). Среди пациентов c СД2 терапия тоцилизумабом не влияла на клинические исходы (OR 1,05; 95% ДИ 0,12–9,14), однако статистическая значимость не была подтверждена. Вероятность развития выздоровления/смерти в зависимости от получаемой терапии представлена на рис. 3.

Рис. 3. Вероятность развития выздоровления/смерти в зависимости от получаемой терапии.
Примечание: желтая линия — OR общей группы (n=1753), синяя линия — OR пациентов без СД2 (n=1442), красная линия — OR пациентов с СД2 (n=311). Наблюдаемые различия оценивались как статистически значимые при р<0,05; при р≥0,05 указывался прочерк «-». Сокращения: АБ — антибиотики; ПВП — противовирусные препараты; АК — антикоагулянты; per os — перорально; у — умер, в — выздоровел.
ОБСУЖДЕНИЕ
Проведен ретроспективный анализ данных медицинской документации 1753 пациентов с ПЦР-положительным диагнозом COVID-19, из которых 311 пациентов имели СД2. В исследовании проводилось сравнение клинических исходов «выздоровление/смерть» между группами пациентов с СД2 и без СД2 на фоне получаемой терапии. Особенностью исследуемой выборки являлось то, что данные пациенты были госпитализированы в перепрофилированные под COVID-19 отделения ввиду тяжелого соматического состояния в первую волну коронавирусной инфекции (с 23.03.2020 по 01.06.2020 гг.).
Учитывая тот факт, что причиной развития COVID-19 является вирусный агент SARS-CоV-2, в настоящее время активно обсуждается использование ПВП в качестве основного лечения заболевания. Однако, по данным большинства опубликованных исследований, ПВП не улучшают клиническую симптоматику и исходы COVID-19 [6–9]. В нашем исследовании прием ПВП ассоциируется с увеличением риска развития неблагоприятных исходов, особенно в группе пациентов с СД2: увеличение риска смерти в 2,6 раза среди пациентов без СД2 (OR 2,64; 95% ДИ 1,44–4,85; р<0,05), в 5 раз среди пациентов с СД2 (OR 4,98; 95% ДИ 2,11–11,75; р<0,05). Таким образом, по результатам большинства опубликованных исследований, используемые в лечении COVID-19 ПВП не доказали свою эффективность. Необходимо проведение дальнейших исследований, направленных на поиск новых ПВП и их безопасных комбинаций, улучшающих клинические исходы пациентов с COVID-19.
Возможная эффективность гидроксихлорохина и хлорохина в лечении COVID-19 объясняется способностью препаратов связываться с ангиотензинпревращающим ферментом-2 и предотвращать попадание вирусных агентов в клетки-мишени [10]. Так, по данным Gautret и соавт., лечение гидроксихлорохином, особенно в комбинации с азитромицином, было ассоциировано со снижением вирусной нагрузки в носоглотке у пациентов с COVID-19 [11]. Более того, в метаанализе Elavarasi и соавт. было продемонстрировано, что использование гидроксихлорохина по сравнению со стандартной терапией (ПВП, ГКС) связано с улучшением клинического состояния и снижением летальности пациентов с COVID-19 [12]. В нашем исследовании лечение гидроксихлорохином было ассоциировано со снижением риска смерти. При этом среди пациентов без СД2 риск смерти снижался в 4 раза (OR 0,24; 95% ДИ 0,15–0,39; р<0,05), среди пациентов с СД2 — в 2,4 раза (OR 0,41; 95% ДИ 0,19–0,88; р<0,05). Полученные нами результаты следует интерпретировать с осторожностью. Вероятно, улучшение клинических исходов объясняется тем, что пациенты, получающие противомалярийную терапию, имели более легкую степень тяжести основного заболевания, не имели сопутствующих патологий, существенно отягощающих течение COVID-19, и получали адекватную патогенетически обоснованную и сопутствующую терапию. Важно, что большинство исследований опровергают данные об эффективности и безопасности противомалярийных препаратов среди пациентов с коронавирусной инфекцией. Так, по данным исследования RECOVERY, значимых отличий в отношении 28-дневной смертности между группами пациентов, принимающих гидроксихлорохин и стандартную терапию, выявлено не было (отношение рисков (ОР) 1,11; 95% ДИ 0,98–1,26; p=0,10) [13]. При этом, по данным ряда исследований, терапия гидроксихлорохином ухудшала прогноз пациентов с COVID-19 ввиду развития ряда побочных эффектов. Двойное слепое плацебо-контролируемое исследование CloroCOVID-19, оценивающее эффективность и безопасность гидроксихлорохина среди госпитализированных пациентов с COVID-19, пришлось преждевременно прекратить из-за возникновения удлинения интервала Q–T у четверти пациентов и увеличения летальности до 13,5% среди испытуемых (95% ДИ: 6,9–23,0%) [14]. По данным метаанализа Thoguluva и соавт. с участием 5207 пациентов с COVID-19, терапия гидроксихлорохином была связана со значительным увеличением нежелательных явлений (нарушение зрения, удлинение интервала Q–T, желудочковая тахикардия, расстройства стула и др.) и больничной летальности. При этом никаких преимуществ гидроксихлорохина по сравнению с другими препаратами (ремдезивир, лопинавир, тоцилизумаб) в отношении снижения прогрессирования коронавирусной инфекции, вирусной нагрузки и продолжительности госпитализации выявлено не было [15]. Учитывая накопленный научный и клинический опыт в отношении эффективности и безопасности гидроксихлорохина среди пациентов с COVID-19, 15 июня 2020 г. управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration (FDA)) отозвало разрешение на использование противомалярийных препаратов для лечения пациентов с коронавирусной инфекцией [16]. В настоящее время, по данным международных и российских клинических рекомендаций, использование гидроксихлорохина и хлорохина у пациентов с COVID-19 не рекомендовано [17].
Отличительной особенностью воспалительного ответа на фоне COVID-19 является резкое повышение уровня провоспалительных цитокинов, в частности ИЛ-6 [18]. Уровень ИЛ-6 напрямую связан с тяжестью и неблагоприятным исходом новой коронавирусной инфекции [18][19]. В среднем среди пациентов с осложненным течением COVID-19 уровень ИЛ-6 в крови в 2,9 раза выше, чем у пациентов, не имеющих осложнений [18]. Одним из наиболее распространенных сопутствующих заболеваний, ухудшающих течение коронавирусной инфекции, является СД2. Ключевой гипотезой, объясняющей развитие неблагоприятных клинических событий у пациентов с СД2 и инфекционными заболеваниями, является неполноценность клеточного иммунного ответа в условиях хронической гипергликемии, ведущей к резкому повышению выработки ИЛ-6 на фоне выраженного снижения ФНО-альфа и ИЛ-1 [20][21]. Таким образом, патогенетически обоснованной терапией у пациентов с осложненным и тяжелым течением COVID-19, особенно в случае наличия сопутствующего СД2, является использование тоцилизумаба — препарата, связывающегося с рецепторами к ИЛ-6 и предотвращающего реализацию провоспалительных эффектов данного цитокина [18]. В настоящее время имеются противоречивые данные об эффективности тоцилизумаба среди пациентов с новой коронавирусной инфекцией. Так, по данным Maeda и соавт., тоцилизумаб не улучшал исходы пациентов с COVID-19 [22]. В метаанализе Lan и соавт., несмотря на то, что на фоне терапии тоцилизумабом отмечалось снижение смертности на 7,8% по сравнению с контрольной группой, статистическая значимость не была подтверждена [23]. Однако в более раннем и более крупном метаанализе, включающем 1675 пациентов с тяжелым течением COVID-19, отмечалось значимое снижение летальности на 8,8% в группе пациентов, получающих тоцилизумаб, по сравнению с пациентами, получающими стандартное лечение гидроксихлорохином, АБ или ПВП [24]. В нашем исследовании терапия тоцилизумабом несколько увеличивала шанс смерти среди пациентов без СД2 (OR 3,72; 95% ДИ 0,47–9,42, достоверность не подтверждена) и не влияла на клинические исходы COVID-19 пациентов с СД2 (OR 1,05; 95% ДИ 0,12–9,14, достоверность не подтверждена). Принимая во внимание ограниченную выборку пациентов, получающих тоцилизумаб (n=33; 1,9% пациентов), преимущественное назначение данного препарата пациентам с пневмонией тяжелой степени тяжести по данным компьютерной томографии, а также отсутствие многофакторного анализа, который бы позволил более достоверно говорить о влиянии тоцилизумаба на клинические исходы COVID-19, полученные данные стоит интерпретировать с осторожностью. В настоящее время, согласно отечественным рекомендациям, лечение тоцилизумабом/сарилумабом оправдано только при наличии среднетяжелой/тяжелой степени COVID-19 по данным компьютерной томографии в сочетании как минимум с двумя из перечисленных признаков: одышка в покое, температура тела >38°С в течение более 5 дней, уровень СРБ, в 9 раз превышающий верхнюю границу нормы, число лейкоцитов <3,0×109/л, абсолютное число лимфоцитов <1,0×109/л, уровень ферритина крови ≥250 нг/мл, уровень ИЛ-6 >40 пк/мл [17]. Несмотря на накапливающийся клинический и научный опыт в отношении использования тоцилизумаба у пациентов с тяжелым течением COVID-19, необходимы дальнейшие исследования, оценивающие эффективность и безопасность тоцилизумаба, в том числе среди пациентов с СД2.
В связи с тем, что COVID-19 характеризуется развитием гипервоспалительной реакции, одной из возможных групп препаратов, использующихся в лечении данного заболевания, являются ГКС. Учитывая фазность течения новой коронавирусной инфекции, назначение ГКС оправдано после окончания виремии и при развитии фазы гипервоспаления, клинически проявляющейся лихорадкой, высокими биохимическими показателями воспалительной реакции, развитием дыхательной недостаточности, ОРДС и других системных осложнений COVID-19 [25]. Наиболее крупным исследованием, оценивающим эффективность терапии ГКС у пациентов с COVID-19, является исследование RECOVERY, в котором терапия дексаметазоном в дозе 6 мг/сут ассоциировалась со снижением 28-дневной смертности на 2,7%, при этом снижение смертности отмечалось в группе пациентов тяжелого течения новой коронавирусной инфекции [26]. Однако, по данным метаанализа Ni и соавт., терапия ГКС по сравнению с плацебо увеличивала смертность (OR 1,75; 95% ДИ 1,30–2,36; p=0,0002), продолжительность пребывания в отделении интенсивной терапии (OR 2,14; 95% ДИ 1,17–3,10; p<0,0001) и риск развития вторичных легочных инфекций (OR 1,98; 95% ДИ 1,04–3,78; p = 0,04) у пациентов с COVID-19 [27]. В нашем исследовании терапия ГКС не влияла на клинические исходы пациентов с COVID-19, в том числе с сопутствующим СД2. Однако в связи с тем, что одним из побочных эффектов ГКС является гипергликемия, пациенты с СД2 имеют более высокий риск развития декомпенсации углеводного обмена, являющейся фактором риска неблагоприятного прогноза у пациентов с COVID-19 [28]. Таким образом, назначение ГКС у пациентов с COVID-19 и СД2 должно сопровождаться постоянным мониторированием уровня гликемии и, возможно, увеличением дозы сахароснижающих препаратов.
Одной из причин, ухудшающих клинические исходы пациентов с COVID-19, является развитие вторичных легочных инфекций [29]. По данным исследования Huttner и соавт., бактериальная пневмония среди умерших итальянских пациентов с COVID-19 встречалась в 11% случаев [30], однако точная распространенность бактериальных инфекций на фоне COVID-19 в настоящее время неизвестна. Считается, что среди пациентов, инфицированных респираторными вирусами, количество случаев вторичной бактериальной пневмонии колеблется в интервале от 11 до 35% [31]. Поэтому назначение АБ оправдано среди пациентов с COVID-19, особенно в случае наличия сопутствующего СД2, увеличивающего риск развития инфекционных осложнений. В нашем исследовании терапия АБ ассоциировалась со снижением риска смерти в 14 раз среди пациентов без СД2 (OR 0,07; 95% ДИ 0,04–0,1; р<0,05) и в 10 раз среди пациентов с СД2 (OR 0,1; 95% ДИ 0,05–0,22; р<0,05). По данным ранее опубликованного исследования Gautret и соавт., добавление азитромицина к терапии гидроксихлорохином было связано с более эффективной элиминацией вирусных агентов из организма пациентов с тяжелым течением COVID-19 [32]. В более крупном исследовании Arshad и соавт. также подтверждалось увеличение эффективности противомалярийных препаратов при добавлении к ним АБ: на фоне терапии гидроксихлорохином отмечалось снижение риска смерти на 66% (p<0,001), на фоне комбинированной терапии гидроксихлорохином и азитромицином риск смерти снижался на 71% (p<0,001) [33]. Несмотря на имеющиеся данные, подтверждающие эффективность АБ, особенно при одновременном назначении данных препаратов с гидроксихлорохином, остаются открытыми вопросы о показаниях к назначению и сроках назначения АБ у пациентов с новой коронавирусной инфекцией. В настоящее время проводится крупномасштабное исследование ACTION, результаты которого позволят подтвердить эффективность и безопасность АБ у пациентов с COVID-19, а также определить критерии назначения АБ при COVID-19 [34].
Также среди пациентов с COVID-19 имеется повышенный риск развития тромботических осложнений. В исследовании Klok и соавт. отмечалось, что тромботические осложнения развивались у 31% пациентов с новой коронавирусной инфекцией, несмотря на проводимую фармакологическую профилактику тромбозов [35]. Следовательно, всем пациентам с COVID-19, тем более в случае наличия сопутствующего СД2, увеличивающего риск развития гиперкоагуляции, необходима адекватная антикоагулянтная терапия. В нашем исследовании использование инъекционных АК было ассоциировано с достоверным снижением риска смерти, особенно среди пациентов с СД2: OR 0,47; 95% ДИ 0,31–0,71; р<0,05 — без СД2; OR 0,39; 95% ДИ 0,21–0,73; р<0,05 — с СД2. Полученные результаты согласуются с данными ранее опубликованных исследований, в которых использование инъекционных АК было ассоциировано со снижением летальности пациентов с COVID-19 [36][37]. В настоящее время имеется недостаточное количество данных, подтверждающих эффективность и безопасность АК-терапии у пациентов с новой коронавирусной инфекцией. Необходимо проведение дальнейших исследований, направленных на определение показаний к назначению АК-терапии у пациентов COVID-19, в том числе с сопутствующим СД2.
Ограничения исследования
Результаты исследования следует интерпретировать с осторожностью из-за наличия некоторых ограничений. Во-первых, преимущественно оценивались клинические исходы пациентов с COVID-19, которые были госпитализированы в перепрофилированные отделения многопрофильного стационара во время первой волны коронавирусной инфекции, когда имелся недостаточный объем данных о клиническом и научном опыте использования лекарственных средств для лечения данного заболевания, особенно при сопутствующем СД2. Следовательно, оценивалась главным образом внутрибольничная летальность на фоне получаемых препаратов без учета фазового течения заболевания, о котором известно в настоящее время. Во-вторых, при оценке клинических исходов пациентов на фоне проводимой терапии не учитывались факторы, отягощающие течение COVID-19: возраст и пол пациентов, наличие сопутствующей патологии и осложнений.
ЗАКЛЮЧЕНИЕ
Результаты проведенного ретроспективного анализа пациентов со среднетяжелым и тяжелым течением COVID-19 позволяют оценить ассоциативную связь основных лекарственных средств, использующихся для лечения данного заболевания при наличии или отсутствии СД2, с клиническими исходами коронавирусной инфекции. Так, по данным исследования, терапия АБ, бронхолитиками и инъекционными АК ассоциирована с улучшением клинических исходов пациентов с COVID-19 как при наличии СД2, так и без СД2. При этом в группе пациентов с СД2 отмечается более низкий шанс выздоровления на фоне данной терапии по сравнению с пациентами без СД2, что, скорее всего, объясняется прямой зависимостью между выраженностью гипергликемии и летальностью пациентов. Увеличение риска смерти отмечается на фоне терапии ПВП, особенно в группе пациентов с СД2.
Таким образом, результаты ретроспективного анализа демонстрируют ассоциативную связь между клиническими исходами заболевания и получаемой терапией без учета факторов, определяющих выбор терапии и влияющих на летальность пациентов. В связи с чем полученные данные следует интерпретировать с осторожностью. Требуется проведение дальнейших исследований, оценивающих влияние основных лекарственных средств, использующихся для лечения пациентов с COVID-19, на клинические исходы данного заболевания.
Список литературы
1. Авдеев С.Н., Адамян Л.В., Алексеева Е.И. и соавт. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Министерство здравоохранения Российской Федерации. Версия 7. 03.06.2020г.
2. Robert J. Mason. Pathogenesis of COVID-19 from a cell biologic perspective. Eur Respir J. 2020 Apr 9 : 2000607. doi: 10.1183/13993003.00607-2020
3. Stefano Romagnoli, Adriano Peris, A. Raffaele De Gaudio et al. SARS-CoV-2 and COVID-19: From the Bench to the Bedside. Physiol Rev. 2020 Oct 1; 100(4): 1455–1466. doi: 10.1152/physrev.00020.2020
4. Sumanth Khadke, Nayla Ahmed, Nausheen Ahmed et al. Harnessing the immune system to overcome cytokine storm and reduce viral load in COVID-19: a review of the phases of illness and therapeutic agents. Virol J. 2020; 17: 154. doi:10.1186/s12985-020-01415-w
5. Francois Henri Jacques and Erik Apedaile. Immunopathogenesis of COVID-19: Summary and Possible Interventions. Front Immunol. 2020; 11: 564925. doi: 10.3389/fimmu.2020.564925
6. Qi Tan, Limin Duan, Yan Ling Ma, et al. Is oseltamivir suitable for fighting against COVID-19: In silico assessment, in vitro and retrospective study. Bioorganic Chemistry, Volume 104, November 2020. https://doi.org/10.1016/j.bioorg.2020.104257
7. Wei Liu, Pengxiang Zhou, Ken Chen, et al. Efficacy and safety of antiviral treatment for COVID-19 from evidence in studies of SARS-CoV-2 and other acute viral infections: a systematic review and meta-analysis. CMAJ. 2020 Jul 6;192(27):E734-E744. doi: 10.1503/cmaj.200647.
8. Slomski A. No Benefit for Lopinavir-Ritonavir in Severe COVID-19. JAMA – Journal of the American Medical Association. 2020;323:1999. doi:10.1001/jama.2020.6793
9. Cao B, Wang Y, Wen D, et al. A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe COVID-19. New England Journal of Medicine. 2020;382:1787–1799. doi:10.1056/NEJMoa2001282
10. Jacques Fantini, Coralie Di Scala, Henri Chahinian et al. Structural and molecular modelling studies reveal a new mechanism of action of chloroquine and hydroxychloroquine against SARS-CoV-2 infection. Int J Antimicrob Agents. 2020 May;55(5):105960. doi: 10.1016/j.ijantimicag.2020.105960.
11. Gautret P, Lagier J-C, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020;56(1):105949. doi: https://doi.org/10.1016/j.ijantimicag.2020.105949
12. Elavarasi A, Prasad M, Seth T, et al. Chloroquine and Hydroxychloroquine for the Treatment of COVID-19: a Systematic Review and Meta-analysis. J Gen Intern Med. 2020;35(11):3308-3314. doi: https://doi.org/10.1007/s11606-020-06146-w
13. No clinical benefit from use of hydroxychloroquine in hospitalised patients with COVID-19 — RECOVERY Trial. University of Oxford. [Internet]. Published online 2020. Available from: http://www.ox.ac.uk/news/2020-06-05-no-clinical-benefit-use-hydroxychloroquine-hospitalised-patients-COVID-19
14. Borba M, Val FdA, Sampaio VS, et al. Chloroquine diphosphate in two different dosages as adjunctive therapy of hospitalized patients with severe respiratory syndrome in the context of coronavirus (SARS-CoV-2) infection: preliminary safety results of a randomized, double-blinded, phase IIb clinical trial (CloroCovid-19 Study). medRxiv 2020. DOI: 10.1101/2020.04.07.20056424
15. Thoguluva Chandrasekar V, Venkatesalu B, Patel HK, et al. Systematic review and meta-analysis of effectiveness of treatment options against SARS-CoV-2 infection. J Med Virol. 2021;93(2):775-785. doi:10.1002/jmv.26302
16. FDA.gov [Internet]: FDA cautions against use of hydroxychloroquine or chloroquine for COVID-19 outside of the hospital setting or a clinical trial due to risk of heart rhythm problems. Available from: https://www.fda.gov/drugs/drug-safety-and-availability/fda-cautions-against-use-hydroxychloroquine-or-chloroquine-covid-19-outside-hospital-setting-or
17. Министерство здравоохранения Российской Федерации. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (Сovid-19).Версия 11 (07.05.2021).
18. Eric A. Coomes and Hourmazd Haghbayan. Interleukin‐6 in Covid‐19: A systematic review and meta‐analysis. Rev Med Virol. 2020 Aug 26 : e2141. doi: 10.1002/rmv.2141
19. Ruan Q, Yang K, Wang W, et al. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46(5):846-848. doi: https://doi.org/10.1007/s00134-020-05991-x
20. William S. Azar, Rachel Njeim, Angie H. Fares, et al. COVID-19 and diabetes mellitus: how one pandemic worsens the other. Rev Endocr Metab Disord. 2020 Aug 2 : 1–13. doi: 10.1007/s11154-020-09573-6.
21. Maddaloni E., Buzzetti R. Covid-19 and diabetes mellitus: unveiling the interaction of two pandemics. Diabetes Metab Res Rev. 2020 Mar 31 doi: 10.1002/dmrr.3321.e33213321
22. Tetsuro Maeda, Reiichiro Obata, Dahlia Rizk, et al. The association of interleukin-6 value, interleukin inhibitors, and outcomes of patients with COVID-19 in New York City. J Med Virol. 2020 Jul 28. doi: 10.1002/jmv.26365.
23. Lan S-H, Lai C-C, Huang H-T, et al. Tocilizumab for severe COVID-19: a systematic review and meta-analysis. Int J Antimicrob Agents. 2020;56(3):106103. doi: https://doi.org/10.1016/j.ijantimicag.2020.106103
24. Zhao J, Cui W, Tian B. Efficacy of tocilizumab treatment in severely ill COVID-19 patients. Crit Care. 2020;24(1):524. doi: https://doi.org/10.1186/s13054-020-03224-7
25. Rello J, Waterer GW, Bourdiol A, Roquilly A. COVID-19, steroids and other immunomodulators: The jigsaw is not complete. Anaesth Crit Care Pain Med. 2020;39(6):699-701. doi: https://doi.org/10.1016/j.accpm.2020.10.011
26. Horby P, Lim WS, Emberson J, et al. Effect of Dexamethasone in Hospitalized Patients with COVID-19 – Preliminary Report. N Engl J Med. 2020. doi: https://doi.org/10.1101/2020.06.22.20137273
27. Ni Y-N, Chen G, Sun J, et al. The effect of corticosteroids on mortality of patients with influenza pneumonia: a systematic review and meta-analysis. Crit Care. 2019;23(1):99. doi: https://doi.org/10.1186/s13054-019-2395-8
28. Hussain A, Bhowmik B, do Vale Moreira NC. COVID-19 and diabetes: Knowledge in progress. Diabetes Res Clin Pract. 2020;162:108142. doi: https://doi.org/10.1016/j.diabres.2020.108142
29. Chen X, Liao B, Cheng L, et al. The microbial coinfection in COVID-19. Appl Microbiol Biotechnol. 2020;104(18):7777-7785. doi: https://doi.org/10.1007/s00253-020-10814-6
30. Huttner BD, Catho G, Pano-Pardo JR, et al. COVID-19: don’t neglect antimicrobial stewardship principles! Clin Microbiol Infect. 2020;26(7):808-810. doi: https://doi.org/10.1016/j.cmi.2020.04.024
31. Klein EY, Monteforte B, Gupta A, et al. The frequency of influenza and bacterial coinfection: a systematic review and meta‐analysis. Influenza Other Respi Viruses. 2016;10(5):394-403. doi: https://doi.org/10.1111/irv.12398
32. Gautret P, Lagier J-C, Parola P, et al. Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial. Int J Antimicrob Agents. 2020;56(1):105949. doi: https://doi.org/10.1016/j.ijantimicag.2020.105949
33. Arshad S, Kilgore P, Chaudhry ZS, et al. Treatment with hydroxychloroquine, azithromycin, and combination in patients hospitalized with COVID-19. Int J Infect Dis. 2020;97:396-403. doi: https://doi.org/10.1016/j.ijid.2020.06.099
34. Azithromycin for COVID-19 Treatment in Outpatients Nationwide – Full Text View – ClinicalTrials.gov. ClinicalTrials.gov. [Internet]. Published online 2020. Available from: https://clinicaltrials.gov/ct2/show/NCT04332107
35. Klok FA, Kruip MJHA, van der Meer NJM, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res. 2020;191:145-147. doi: https://doi.org/10.1016/j.thromres.2020.04.013
36. Tang N, Bai H, Chen X, et al. Anticoagulant treatment is associated with decreased mortality in severe coronavirus disease 2019 patients with coagulopathy. J Thromb Haemost. 2020;18(5):1094-1099. doi: https://doi.org/10.1111/jth.14817
37. Paranjpe I, Fuster V, Lala A, et al. Association of Treatment Dose Anticoagulation With In-Hospital Survival Among Hospitalized Patients With COVID-19. J Am Coll Cardiol. 2020;76(1):122-124. doi: https://doi.org/10.1016/j.jacc.2020.05.001
Об авторах
Т. Ю. ДемидоваРоссия
Демидова Татьяна Юльевна, доктор медицинских наук, профессор
Москва
eLibrary SPIN: 9600-9796;
Scopus Author ID: 7003771623
К. Г. Лобанова
Россия
Лобанова Кристина Геннадьевна, ассистент
117997, г. Москва, ул. Островитянова, д. 1
eLibrary SPIN: 6044-1684
С. Н. Переходов
Переходов Сергей Николаевич, доктор медицинских наук, профессор
Москва
eLibrary SPIN: 8770-6877
М. Б. Анциферов
Анциферов Михаил Борисович, доктор медицинских наук, профессор
Москва
eLibrary SPIN: 1035-4773;
Scopus Author ID: 57215677072
Дополнительные файлы
Рецензия
Для цитирования:
Демидова Т.Ю., Лобанова К.Г., Переходов С.Н., Анциферов М.Б. Клиническая характеристика пациентов с COVID-19 в зависимости от получаемой терапии и наличия сахарного диабета 2 типа. Сахарный диабет. 2021;24(3):231-242. https://doi.org/10.14341/DM12764
For citation:
Lobanova K.G., Demidova T.Y., Perekhodov S.N., Antsiferov M.B. Clinical characteristics of patients with COVID-19 depending on the treatment received and the presence of type 2 diabetes mellitus. Diabetes mellitus. 2021;24(3):231-242. (In Russ.) https://doi.org/10.14341/DM12764

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































