Перейти к:
Безопасность и эффективность ипраглифлозина у пациентов из Японии с сахарным диабетом 2-го типа и нарушением функции почек: анализ в подгруппах 3-летнего постмаркетингового наблюдательного исследования (STELLA-LONG TERM)
https://doi.org/10.14341/DM12758
Аннотация
Трехлетнее постмаркетинговое наблюдательное исследование STELLA-LONG TERM было посвящено оценке безопасности и эффективности применения ингибитора натрий-глюкозного котранспортера 2-го типа (НГЛТ-2) у пациентов из Японии с сахарным диабетом 2-го типа (СД2). Окончательные результаты анализа безопасности (n=6697) и эффективности (n=5625) в популяциях оценивали на основании стратификации пациентов в зависимости от исходной расчетной скорости клубочковой фильтрации (рСКФ, мл/мин/1,73 м2) с формированием четырех (≥90, от 60 до <90, от 45 до <60 и <45) и двух подгрупп (≥60 и <60). Оценивали частоту нежелательных реакций на препарат (НРП) и изменения уровня гликированного гемоглобина (НbА1с), массы тела и рСКФ относительно исходных величин. Доли пациентов с НРП и серьезными НРП были сходными в большинстве подгрупп рСКФ. Наиболее распространенной НРП являлась полиурия/поллакиурия. В подгруппах с более выраженным нарушением функции почек на начало исследования частота таких НРП, как осложнения со стороны почек и гиповолемия, была выше по сравнению с пациентами с рСКФ от 60 до <90 или ≥90 мл/мин/1,73 м2. Снижение уровня массы тела и НbА1с отмечалось во всех подгруппах; степень уменьшения последнего показателя варьировала от –0,91 до –0,40% (р<0,05 по сравнению с исходными величинами). В подгруппе рСКФ от 45 до <60 мл/мин/1,73 м2 установлено увеличение этого параметра (+1,42±8,77 мл/мин/1,73 м2; р=0,006). В подгруппах ≥90 и от 60 до <90 мл/мин/1,73 м2 рСКФ снизилась (–8,27±13,73 и –1,22±10,34 мл/мин/1,73 м2; р <0,001), в отличие от пациентов с исходной рСКФ <60 мл/мин/1,73 м2. Таким образом, у пациентов из Японии с СД2, получавших ипраглифлозин, не было выявлено новых или неожиданных данных по безопасности, а долгосрочное улучшение уровня НbА1с и массы тела не зависело от функции почек.
Ключевые слова
Для цитирования:
Tobe K., Maegawa H., Nakamura I., Uno S. Безопасность и эффективность ипраглифлозина у пациентов из Японии с сахарным диабетом 2-го типа и нарушением функции почек: анализ в подгруппах 3-летнего постмаркетингового наблюдательного исследования (STELLA-LONG TERM). Сахарный диабет. 2021;24(2):141-155. https://doi.org/10.14341/DM12758
For citation:
Tobe K., Maegawa H., Nakamura I., Uno S. Safety and effectiveness of ipragliflozin in Japanese patients with type 2 diabetes mellitus and impaired renal function: subgroup analysis of a 3-year post-marketing surveillance study (STELLA-LONG TERM). Diabetes mellitus. 2021;24(2):141-155. (In Russ.) https://doi.org/10.14341/DM12758
ВВЕДЕНИЕ
Распространенность хронической болезни почек (ХБП) во всем мире составляет 11–13% и характеризуется тенденцией к росту, главным образом в связи с увеличением распространенности сахарного диабета 2-го типа (СД2) [1]. В Японии диабетическая нефропатия является ведущей причиной развития почечной недостаточности, требующей проведения диализа (43,8% пациентов впервые потребовался диализ) [2]. С учетом такой высокой распространенности и серьезности этого осложнения при принятии клинических решений у пациентов с СД2 необходимо учитывать функцию почек.
Ингибиторы натрийглюкозного котранспортера 2-го типа (НГЛТ-2) — это класс пероральных сахароснижающих препаратов, ингибирующих реабсорбцию глюкозы в проксимальных почечных канальцах [3]. Данные исследований свидетельствуют об эффективности и хорошей переносимости ингибиторов НГЛТ-2 у пациентов с нарушением функции почек, а также о возможных ренопротективных эффектах указанных препаратов в этой популяции пациентов [4–10]. На сегодняшний день в Японии доступны 6 ингибиторов НГЛТ-2 [11][12]; этот класс сахароснижающих препаратов относится к числу лекарственных средств, рекомендованных японскими клиническими руководствами для лечения пациентов с СД [13]. Положительный эффект ингибиторов НГЛТ-2 у пациентов с диабетическим поражением почек, ранее продемонстрированный в масштабных исследованиях в крупной популяции пациентов неазиатского происхождения, пока полностью не исследован у пациентов с СД из Азии [14]. Ранее безопасность и эффективность ипраглифлозина были продемонстрированы у пациентов из Японии [12][15][16], однако его долгосрочная безопасность и эффективность у японских пациентов с СД2 с нарушением функции почек остаются не до конца изученными. 24-недельное рандомизированное исследование LANTERN показало эффективность ипраглифлозина в отношении улучшения контроля гликемии у японских пациентов с СД2 с нарушением функции почек легкой степени, но не у пациентов с нарушением функции почек средней степени тяжести [16].
Предметом изучения постмаркетингового наблюдательного исследования STELLA-LONG TERM являлись безопасность и эффективность долгосрочного применения ипраглифлозина в Японии [17–25]. Результаты исследования STELLA-LONG TERM за 2 года продемонстрировали переносимость и эффективность ипраглифлозина у японских пациентов с СД2 в условиях клинической практики; применение препарата у участников с нарушением функции почек ассоциировалось с ее улучшением [22]. В ходе исследования STELLA-LONG TERM функцию почек оценивали на основании анализа изменений расчетной скорости клубочковой фильтрации (рСКФ). Этот параметр может быть хорошим суррогатным маркером прогрессирования ХБП в клинических исследованиях, особенно в исследованиях длительностью ≥3 года, а также у участников с высоким риском ХБП [26], таких как пациенты с СД2.
В настоящей статье представлены окончательные результаты анализа в подгруппах постмаркетингового наблюдательного исследования STELLA-LONG TERM, посвященного изучению эффектов ипраглифлозина у пациентов с различной степенью выраженности нарушения функции почек. В этой публикации впервые оценены отдаленные изменения функции почек у пациентов с СД2 из Японии, получавших ингибитор НГЛТ-2.
ПАЦИЕНТЫ И МЕТОДЫ
Целью 3-летнего наблюдательного многоцентрового постмаркетингового исследования STELLA-LONG TERM, выполненного в Японии, являлась оценка безопасности и эффективности ипраглифлозина в условиях повседневной клинической практики (идентификационный номер на ClinicalTrials.gov: NCT02479399) [27]. Подробное описание дизайна исследования было представлено ранее [18].
Вкратце, в исследование были включены все пациенты из Японии с СД2, которым ипраглифлозин был впервые назначен в период с 17 июля 2014 г. до 16 октября 2015 г.; в исследовании принимал участие 2431 клинический центр. Для настоящей публикации использовали данные, полученные до 30 сентября 2019 г. Пациентам назначали ипраглифлозин 50 мг 1 раз в сутки, до или после завтрака, в соответствии с инструкцией по применению препарата. Препарат разрешалось назначать в дозе 100 мг 1 раз в сутки, если эффективность меньшей дозы расценивалась лечащим врачом как недостаточная. У пациентов с тяжелым нарушением функции печени препарат назначали с осторожностью; врачи могли рекомендовать таким пациентам прием препарата в меньшей дозе.
Исследование было выполнено в соответствии с принятыми в Японии правилами проведения качественных постмаркетинговых исследований (Good Post-marketing Study Practice, GPSP); протокол исследования был одобрен Министерством здравоохранения, труда и благосостояния Японии. Подписания информированного согласия не требовалось, так как анализ проводили на основании обезличенных данных.
ОЦЕНИВАЕМЫЕ ПАРАМЕТРЫ
Все данные, собранные в электронном виде с использованием электронных форм наблюдения, были загружены в базу данных [18]. Вкратце, к параметрам, включенным в программу наблюдения, относились демографические характеристики, подробные сведения о лечении ипраглифлозином, приеме сопутствующих препаратов, данные оценки жизненно важных функций пациента и результаты лабораторных тестов. Сбор подробных сведений о нежелательных реакциях на препарат (НРП) (MedDRA/J, версия 22.0) и НРП, представляющих особый интерес, степени тяжести НРП, времени начала НРП и их исходах осуществляли по методике, описанной ранее [27]. Под НРП подразумевали нежелательные явления (НЯ), для которых лечащий врач не мог исключить причинно-следственной взаимосвязи с лечением ипраглифлозином.
СКФ вычисляли по следующим формулам:
194 × креатинин [мг/дл] – 1,094 × возраст [годы] – 0,287 (для мужчин) и 194 × креатинин [мг/дл] – 1,094 × возраст [годы] – 0,287 × 0,739 (для женщин).
Анализ данных проводили в двух различных категориях рСКФ: 1) 1-я категория рСКФ состояла из подгрупп ≥90 мл/мин/1,73 м2, от 60 до <90 мл/мин/1,73 м2, от 45 до <60 мл/мин/1,73 м2 и <45 мл/мин/1,73 м2 и 2) 2-я категория рСКФ включала подгруппы ≥60 и <60 мл/мин/1,73 м2.
К параметрам оценки эффективности ипраглифлозина относилось изменение уровня гликированного гемоглобина (НbА1с) и массы тела относительно исходных величин. Также оценивали изменения рСКФ, уровня гемоглобина, азота мочевины крови (АМК), альбумина сыворотки, креатинина сыворотки и других лабораторных параметров. Сбор данных осуществляли через 1, 3, 6, 12, 24 и 36 мес после начала лечения.
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Выбор периода для настоящего исследования и расчеты размера выборки обоснованы в более ранней публикации, содержащей данные промежуточного отчета [18]. Категориальные переменные представлены как n (%), а непрерывные — как среднее ± стандартное отклонение (SD). Для сравнения демографических характеристик пациентов, клинических данных и исходов лечения у пациентов различных категорий функции почек использовали тест χ2, двусторонний t-критерий или односторонний дисперсионный анализ (ANOVA). Для оценки изменений лабораторных параметров в определенной контрольной точке по сравнению с исходными величинами применяли парный t-критерий. Различия считали статистически значимыми при р<0,05; коррекцию для ошибки I типа (тестирование множественных гипотез) не проводили. Для оценки изменений различных параметров в динамике рассчитывали коэффициент корреляции Пирсона. Все статистические анализы были выполнены с использованием программного обеспечения SAS, версия 9.4 (SAS Institute, Кэри, Северная Каролина, США).
РЕЗУЛЬТАТЫ
Распределение пациентов
Данные 11 424 пациентов были получены в 2431 медицинском центре. Параметры 11 289 пациентов были внесены в формы наблюдения; 11 051 человек был включен в популяцию анализа безопасности, а 8763 пациента — в популяцию анализа эффективности. Подробные сведения представлены в окончательной публикации результатов исследования [27].
Характеристика пациентов
В популяции анализа безопасности данные об исходной рСКФ были доступны у 6697 пациентов; у 4354 участников этот показатель был неизвестен. Средняя рСКФ на начало исследования составила 81,23 мл/мин/1,73 м2. В 1-й категории рСКФ 2095 пациентов вошли в состав подгруппы рСКФ ≥90 мл/мин/1,73 м2, 3688 человек составили подгруппу от 60 до <90 мл/мин/1,73 м2, 724 участника — подгруппу от 45 до <60 мл/мин/1,73 м2 и у 190 человек рСКФ не превышала 45 мл/мин/1,73 м2 (табл. 1). Во 2-й категории рСКФ у 5783 пациентов этот показатель составил ≥60 мл/мин/1,73 м2, а 914 участников вошли в подгруппу с рСКФ <60 мл/мин/1,73 м2 (табл. 2).
Таблица 1. Характеристики пациентов — 1-я категория расчетной скорости клубочковой фильтрации — популяция анализа безопасности
рСКФ (мл/мин/1,73 м2) | |||||||||||
<45 | От 45 до <60 | От 60 до <90 | ≥90 | pa | Неизвестно | ||||||
n | % | n | % | N | % | n | % | n | % | ||
Всего | 190 | (100,00) | 724 | (100,00) | 3688 | (100,00) | 2095 | (100,00) | 4354 | (100,00) | |
Пол | |||||||||||
мужчины женщины | 88 102 | (46,3) (53,7) | 433 291 | (59,8) (40,2) | 2290 1398 | (62,1) (37,9) | 1292 803 | (61,7) (38,3) | (1) <0,001 | 2610 1744 | (59,9) (40,1) |
Возраст, годы | |||||||||||
n Среднее ± SD | 190 69,0±10,4 | 724 65,9±10,2 | 3688 58,5±10,5 | 2095 50,1±11,5 | (2) <0,001 | 4354 56,9±12,4 | |||||
Масса тела, кг | |||||||||||
n Среднее ± SD | 159 71,95±13,81 | 589 74,95±15,65 | 3218 77,42±16,49 | 1836 81,62±19,39 | (2) <0,001 | 2370 77,60±16,85 | |||||
ИМТ, кг/м2 | |||||||||||
n Среднее ± SD | 151 28,57±4,54 | 549 28,54±4,76 | 3012 28,79±5,04 | 1741 29,90±6,02 | (2) <0,001 | 2039 28,99±5,12 | |||||
Длительность сахарного диабета, годы | |||||||||||
n Среднее ± SD | 127 12,43±8,83 | 482 10,46±7,37 | 2560 8,33±6,50 | 1507 6,91±5,83 | (2) <0,001 | 2572 7,53±6,17 | |||||
Осложнения | |||||||||||
нет да неизвестно | 3 187 0 | (1,6) (98,4) (0,0) | 23 699 2 | (3,2) (96,5) (0,3) | 383 3297 8 | (10,4) (89,4) (0,2) | 231 1860 4 | (11,0) (88,8) (0,2) | – | 959 3322 73 | (22,0) (76,3) (1,7) |
Тип осложнений (у некоторых пациентов было диагностировано более одного осложнения) | |||||||||||
Диабетическая нейропатия Диабетическая нефропатия Диабетическая ретинопатия Сердечно-сосудистые/цереброваскулярные заболевания -Инфаркт миокарда -Стенокардия -Сердечная недостаточность -Облитерирующий артериосклероз -Цереброваскулярное заболевание Артериальная гипертензия Дислипидемия (гиперлипидемия) Остеопороз Подагра/гиперурикемия Инфекции мочевыводящих путей Инфекции половых органов Злокачественные новообразования Неизвестно | 42 127 34 59 7 26 24 7 16 165 159 16 76 2 0 1 116 | (22,1) (66,8) (17,9) (31,1) (3,7) (13,7) (12,6) (3,7) (8,4) (86,8) (83,7) (8,4) (40,0) (1,1) (0,0) (0,5) (61,1) | 89 328 98 139 17 71 36 16 29 560 557 23 144 1 0 10 338 | (12,3) (45,3) (13,5) (19,2) (2,3) (9,8) (5,0) (2,2) (4,0) (77,3) (76,9) (3,2) (19,9) (0,1) (0,0) (1,4) (46,7) | 357 607 332 438 58 188 83 50 142 2250 2643 62 400 9 2 32 1499 | (9,7) (16,5) (9,0) (11,9) (1,6) (5,1) (2,3) (1,4) (3,9) (61,0) (71,7) (1,7) (9,8) (0,2) (0,1) (0,9) (40,6) | 180 343 146 113 17 48 17 16 38 1079 1461 20 158 5 5 9 885 | (8,6) (16,4) (7,0) (5,4) (0,8) (2,3) (0,8) (0,8) (1,8) (51,5) (69,7) (1,0) (7,5) (0,2) (0,2) (0,4) (42,2) | 295 441 276 378 48 156 75 69 112 2172 2316 71 283 7 3 35 1324 | (6,8) (10,1) (6,3) (8,7) (1,1) (3,6) (1,7) (1,6) (2,6) (49,9) (53,2) (1,6) (6,5) (0,2) (0,1) (0,8) (30,4) | |
рСКФ, мл/мин/1,73 м2 | |||||||||||
n Среднее ± SD | 190 36,83±7,39 | 724 53,95±4,05 | 3688 75,71±8,24 | 2095 104,40±11,83 | – | 0 – | |||||
НbА1с, % | |||||||||||
<8,0 ≥8,0 неизвестно | 119 67 4 | (62,6) (35,3) (2,1) | 443 272 9 | (61,2) (37,6) (1,2) | 2222 1429 37 | (60,2) (38,7) (1,0) | 956 1116 23 | (45,6) (53,3) (1,1) | (1) <0,001 | 2095 1598 661 | (48,1) (36,7) (15,2) |
Систолическое артериальное давление, мм рт.ст. | |||||||||||
n Среднее ± SD | 169 136,6±18,0 | 650 133,4±15,9 | 3344 133,0±15,1 | 1894 133,8±15,0 | (2) 0,08 | 2506 133,0±15,4 | |||||
Диастолическое артериальное давление, мм рт.ст. | |||||||||||
n Среднее ± SD | 163 73,3±11,5 | 643 75,5±10,6 | 3314 77,9±10,4 | 1869 79,5±10,3 | (2) 0,001 | 2478 77,7±10,5 | |||||
Холестерин ЛПНП, мг/дл | |||||||||||
n Среднее ± SD | 159 103,5±31,9 | 618 111,3±31,6 | 3158 113,1±30,8 | 1794 117,4±33,0 | (2) <0,001 | 658 116,3±31,8 | |||||
Холестерин ЛПВП, мг/дл | |||||||||||
n Среднее ± SD | 167 48,1±15,1 | 633 49,7±13,0 | 3304 51,5±13,7 | 1901 50,7±13,5 | (2) <0,001 | 663 50,2±12,8 | |||||
Холестерин не-ЛПВП, мг/дл | |||||||||||
n Среднее ± SD | 102 137,3±37,3 | 410 142,1±36,1 | 2089 140,0±33,5 | 1151 148,0±35,9 | (2) <0,001 | 332 148,0±37,1 | |||||
Триглицериды, мг/дл | |||||||||||
n Среднее ± SD | 173 201,1±149,3 | 660 192,2±127,7 | 3451 183,1±138,4 | 1965 215,4±233,1 | (2) <0,001 | 737 207,3±227,5 | |||||
Мочевая кислота, мг/дл | |||||||||||
n Среднее ± SD | 165 6,20±1,55 | 632 5,99±1,24 | 3240 5,33±1,28 | 1809 5,03±1,27 | (2) <0,001 | 322 5,34±1,37 | |||||
Гематокрит, % | |||||||||||
n Среднее ± SD | 155 39,75±4,43 | 616 41,96±4,20 | 3101 43,19±3,99 | 1753 43,90±3,96 | (2) <0,001 | 403 43,20±3,83 | |||||
АСТ, ЕД/л | |||||||||||
n Среднее ± SD | 165 24,6±10,9 | 671 28,4±19,9 | 3472 29,2±17,7 | 1984 31,2±21,3 | (2) <0,001 | 633 32,8±22,2 | |||||
АЛТ, ЕД/л | |||||||||||
n Среднее ± SD | 172 24,6±14,8 | 674 30,4±24,2 | 3506 36,0±26,7 | 2006 42,1±33,1 | (2) <0,001 | 642 43,4±31,8 | |||||
γ-ГТП (мужчины), ЕД/л | |||||||||||
n Среднее ± SD | 69 38,2±26,5 | 364 55,9±64,0 | 2016 63,9±74,8 | 1153 75,3±88,1 | (2) <0,001 | 326 71,9±107,1 | |||||
γ-ГТП (женщины), ЕД/л | |||||||||||
n Среднее ± SD | 89 47,9±104,2 | 250 41,0±59,4 | 1223 41,3±39,6 | 706 49,6±47,0 | (2) 0,002 | 225 52,3±45,2 | |||||
аВеличины р в подгруппах оценивали с использованием (1) теста χ2 или (2) двустороннего t-критерия; статистические сравнения для отдельных осложнений между группами не проводили.
НbА1с — гликированный гемоглобин; SD (standard deviation) — стандартное отклонение; γ-ГТП — гамма-глутамилтранспептидаза; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ИМТ — индекс массы тела; ЛПВП — липопротеины высокой плотности; ЛПНП — липопротеины низкой плотности; рСКФ — расчетная скорость клубочковой фильтрации.
Таблица 2. Характеристики пациентов — 2-я категория расчетной скорости клубочковой фильтрации — популяция анализа безопасности
рСКФ (мл/мин/1,73 м2) | |||||||
<60 | ≥60 | pa | Неизвестно | ||||
N | % | n | % | n | % | ||
Всего | 914 | (100,00) | 5783 | (100,00) | 4354 | (100,00) | |
Пол | |||||||
мужчины женщины | 521 393 | (57,0) (43,0) | 3582 2201 | (61,9) (38,1) | (1) 0,004 | 2610 1744 | (59,9) (40,1) |
Возраст, годы | |||||||
n Среднее ± SD | 914 66,5±10,3 | 5783 55,4±11,6 | (2) <0,001 | 4354 56,9±12,4 | |||
Масса тела, кг | |||||||
n Среднее ± SD | 748 74,31±15,32 | 5054 78,95±17,71 | (2) <0,001 | 2370 77,60±16,85 | |||
ИМТ, кг/м2 | |||||||
n Среднее ± SD | 700 28,54±4,71 | 4753 29,20±5,45 | (2) 0,003 | 2039 28,99±5,12 | |||
Длительность сахарного диабета, годы | |||||||
n Среднее ± SD | 609 10,87±7,73 | 4067 7,80±6,30 | (2) <0,001 | 2572 7,53±6,17 | |||
Осложнения | |||||||
нет да неизвестно | 26 886 2 | (2,8) (96,9) (0,2) | 614 5157 12 | (10,6) (89,2) (0,2) | (1) <0,001 | 950 3322 73 | (22,0) (76,3) (1,7) |
Тип осложнений (у некоторых пациентов было диагностировано более одного осложнения) | |||||||
Диабетическая нейропатия Диабетическая нефропатия Диабетическая ретинопатия Сердечно-сосудистые/ -Инфаркт миокарда -Стенокардия -Сердечная недостаточность -Облитерирующий артериосклероз -Цереброваскулярное заболевание Артериальная гипертензия Дислипидемия (гиперлипидемия) Остеопороз Подагра/гиперурикемия Инфекции мочевыводящих путей Инфекции половых органов Злокачественные новообразования Неизвестно | 131 455 132 198 24 97 60 23 45 725 716 39 220 3 0 11 454 | (14,3) (49,8) (14,4) (21,7) (2,6) (10,6) (6,6) (2,5) (4,9) (79,3) (78,3) (4,3) (24,1) (0,3) (0,0) (1,2) (49,7) | 537 950 478 551 75 236 100 66 180 3329 4104 82 558 14 7 41 2384 | (9,3) (16,4) (8,3) (9,5) (1,3) (4,1) (1,7) (1,1) (3,1) (57,6) (71,0) (1,4) (9,6) (0,2) (0,1) (0,7) (41,2) | 295 441 276 378 48 156 75 69 112 2172 2316 71 283 7 3 35 1324 | (6,8) (10,1) (6,3) (8,7) (1,1) (3,6) (1,7) (1,6) (2,6) (49,9) (53,2) (1,6) (6,5) (0,2) (0,1) (0,8) (30,4) | |
рСКФ, мл/мин/1,73 м2 | |||||||
n Среднее ± SD | 914 50,39±8,52 | 5783 86,10±16,86 | – | 0 – | |||
НbА1с, % | |||||||
<8,0 ≥8,0 Неизвестно | 562 339 13 | (61,5) (37,1) (1,4) | 3178 2545 60 | (55,0) (44,0) (1,0) | (1) <0,001 | 2095 1598 661 | (48,1) (36,7) (15,2) |
Систолическое артериальное давление, мм рт.ст. | |||||||
n Среднее ± SD | 819 134,1±16,4 | 5238 133,3±15,1 | (2) 0,167 | 2506 133,0±15,4 | |||
Диастолическое артериальное давление, мм рт.ст. | |||||||
n Среднее ± SD | 806 75,0±10,8 | 5183 78,4±10,4 | (2) <0,001 | 2478 77,7±10,5 | |||
Холестерин ЛПНП, мг/дл | |||||||
n Среднее ± SD | 777 109,7±31,8 | 4952 114,7±31,7 | (2) <0,001 | 658 116,3±31,8 | |||
Холестерин ЛПВП, мг/дл | |||||||
n Среднее ± SD | 800 49,4±13,4 | 5205 51,2±13,6 | (2) <0,001 | 663 50,2±12,8 | |||
Холестерин не-ЛПВП, мг/дл | |||||||
n Среднее ± SD | 512 141,1±36,3 | 3240 142,8±34,6 | (2) 0,307 | 332 148,0±37,1 | |||
Триглицериды, мг/дл | |||||||
n Среднее ± SD | 833 194,0±132,5 | 5416 194,8±179,3 | (2) 0,905 | 737 207,3±227,5 | |||
Мочевая кислота, мг/дл | |||||||
n Среднее ± SD | 797 6,03±1,31 | 5049 5,22±1,29 | (2) <0,001 | 322 5,34±1,37 | |||
Гематокрит, % | |||||||
n Среднее ± SD | 771 41,52±4,34 | 4854 43,45±3,99 | (2) <0,001 | 403 43,20±3,83 | |||
АСТ, ЕД/л | |||||||
n Среднее ± SD | 836 27,7±18,5 | 5456 30,0±19,1 | (2) 0,001 | 633 32,8±22,2 | |||
АЛТ, ЕД/л | |||||||
n Среднее ± SD | 846 29,2±22,8 | 5512 38,2±29,3 | (2) <0,001 | 642 43,4±31,8 | |||
γ-ГТП (мужчины), ЕД/л | |||||||
n Среднее ± SD | 433 53,1±60,0 | 3169 68,1±80,1 | (2) <0,001 | 326 71,9±107,1 | |||
γ-ГТП (женщины), ЕД/л | |||||||
n Среднее ± SD | 339 42,8±73,7 | 1929 44,3±42,6 | (2) 0,592 | 225 52,3±45,2 | |||
а Величины р в подгруппах оценивали с использованием (1) теста χ2 или (2) двустороннего t-критерия; статистические сравнения для отдельных осложнений между группами не проводили.
НbА1с — гликированный гемоглобин; SD (standard deviation) — стандартное отклонение; γ-ГТП — гамма-глутаматтранспептидаза; АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ИМТ — индекс массы тела; ЛПВП — липопротеины высокой плотности; ЛПНП — липопротеины низкой плотности; рСКФ — расчетная скорость клубочковой фильтрации.
В каждой категории анализа рСКФ между участниками с различным статусом функции почек были выявлены значимые различия распределения пациентов по полу, возрасту, массе тела, индексу массы тела (ИМТ), длительности СД2, уровню НbА1с, систолического и диастолического артериального давления, параметрам липидного профиля и функции печени (см. табл. 1 и 2). Для категорий с меньшими показателями рСКФ была характерна бóльшая доля женщин и пациентов старшего возраста при меньшей массе тела и ИМТ по сравнению с категориями более высоких показателей рСКФ. У пациентов с меньшими показателями рСКФ длительность СД2 и частота осложнений на начало исследования превышали аналогичные показатели в подгруппах с более высокой рСКФ. Среди пациентов с меньшими исходными показателями рСКФ была характерна более высокая доля пациентов с НbА1с <8,0% (см. табл. 1 и 2).
Сходные результаты были получены в популяции анализа эффективности (табл. S1 и S2 приложения). В этой популяции средний уровень НbА1с±SD на начало исследования в подгруппе рСКФ ≥60 мл/мин/1,73 м2 превосходил аналогичный показатель подгруппы рСКФ <60 мл/мин/1,73 м2 (8,12±1,50% против 7,84±1,24%; табл. S2 приложения).
Безопасность
В целом НРП были зарегистрированы у 2129 (19,27%) пациентов, при этом у 210 (1,90%) участников НРП носили характер серьезных (табл. 3). Доли пациентов с НРП и серьезными НРП были в целом сходными во всех подгруппах рСКФ в обеих категориях рСКФ (1-я и 2-я категории рСКФ). Общая частота НРП составила 21,10–25,26% во всех подгруппах рСКФ в обеих категориях и не отличалась между различными подгруппами рСКФ в пределах 1-й (р=0,559) или 2-й категории (р=0,298). Частота серьезных НРП в подгруппах рСКФ составила 1,72–3,16%. Среди НРП, представляющих особый интерес, наиболее распространенным НРП во всех подгруппах рСКФ была полиурия/поллакиурия, за исключением подгруппы с исходной рСКФ <45 мл/мин/1,73 м2, в которой частота нарушений со стороны почек была самой высокой (см. табл. 3). Частота развития патологических состояний со стороны почек и событий, ассоциирующихся с гиповолемией, таких как дегидратация, была выше у пациентов с более выраженными нарушениями функции почек на начало исследования (рСКФ <45 или от 45 до <60 мл/мин/1,73 м2) по сравнению с подгруппами с исходной рСКФ от 60 до <90 или ≥90 мл/мин/1,73 м2 (1-я категория рСКФ). Сходная тенденция была отмечена во 2-й категории рСКФ: в подгруппе рСКФ <60 мл/мин/1,73 м2 частота нарушений со стороны почек составила 5,47% по сравнению с 1,56% в подгруппе рСКФ ≥60 мл/мин/1,73 м2; события, ассоциирующиеся с гиповолемией, отмечались у 4,16 против 2,42% пациентов соответственно.
Таблица 3. Нежелательные реакции на препарат
1-я категория рСКФ | 2-я категория рСКФ | Исходная рСКФ | Всего | |||||
≥90 | От 60 до<90 | От 45 до<60 | <45 | ≥60 | <60 | |||
n (%) | 2095 | 3688 | 724 | 190 | 5783 | 914 | 4354 | 11 051 |
НРП | 444 | 778 | 159 | 48 | 1222 | 207 | 700 | 2129 |
Серьезные НРП | 36 (1,72) | 83 (2,25) | 19 (2,62) | 6 (3,16) | 119 (2,06) | 25 (2,74) | 66 (1,52) | 210 (1,90) |
НРП, представляющие особый интерес | ||||||||
Гипогликемия | 5 (0,24) | 20 (0,54) | 6 (0,83) | 2 (1,05) | 25 (0,43) | 8 (0,88) | 24 (0,55) | 57 (0,52) |
Инфекции половых органов | 41 (1,96) | 48 (1,30) | 8 (1,10) | 4 (2,11) | 89 (1,54) | 12 (1,31) | 60 (1,38) | 161 (1,46) |
Инфекции мочевыводящих путей | 44 (2,10) | 60 (1,63) | 12 (1,66) | 5 (2,63) | 104 (1,80) | 17 (1,86) | 49 (1,13) | 170 (1,54) |
Полиурия/поллакиурия | 150 (7,16) | 215 (5,83) | 38 (5,25) | 12 (6,32) | 365 (6,31) | 50 (5,47) | 197 (4,52) | 612 (5,54) |
События, связанные с гиповолемией, включая дегидратацию | 44 (2,10) | 96 (2,60) | 30 (4,14) | 8 (4,21) | 140 (2,42) | 38 (4,16) | 65 (1,49) | 243 (2,20) |
Нарушения со стороны почек | 22 (1,05) | 68 (1,84) | 36 (4,97) | 14 (7,37) | 90 (1,56) | 50 (5,47) | 51 (1,17) | 191 (1,73) |
Нарушения со стороны печени | 30 (1,43) | 52 (1,41) | 10 (1,38) | 3 (1,58) | 82 (1,42) | 13 (1,42) | 38 (0,87) | 133 (1,20) |
Переломы | 1 (0,05) | 2 (0,05) | 0 | 0 | 3 (0,05) | 0 | 1 (0,02) | 4 (0,04) |
Злокачественные новообразования | 5 (0,24) | 22 (0,60) | 3 (0,41) | 0 | 27 (0,47) | 3 (0,33) | 21 (0,48) | 51 (0,46) |
Заболевания | 13 (0,62) | 24 (0,65) | 4 (0,55) | 3 (1,58) | 37 (0,64) | 7 (0,77) | 23 (0,53) | 67 (0,61) |
Цереброваскулярные заболевания | 6 (0,29) | 25 (0,68) | 5 (0,69) | 1 (0,53) | 31 (0,54) | 6 (0,66) | 11 (0,25) | 48 (0,43) |
Осложнения со стороны кожи | 37 (1,77) | 71 (1,93) | 11 (1,52) | 8 (4,21) | 108 (1,87) | 19 (2,08) | 71 (1,63) | 198 (1,79) |
Кетоацидоз, события, связанные с повышением уровня кетоновых тел | 2 (0,10) | 4 (0,11) | 0 | 0 | 6 (0,10) | 0 | 1 (0,02) | 7 (0,06) |
Ампутация нижних конечностей | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Эффективность
В течение 3 лет во всех подгруппах обеих категорий рСКФ наблюдалось стабильное и значимое снижение уровня НbА1с по сравнению с исходными величинами (рис. 1а, b). Среднее ± SD изменение уровня НbА1с через 3 года по сравнению с исходными величинами составило –0,91±1,48% в группе рСКФ ≥90 мл/мин/1,73 м2 (р<0,001), –0,60±1,23% в группе рСКФ от 60 до <90 мл/мин/1,73 м2 (р<0,001), –0,54±1,18% в группе рСКФ от 45 до <60 мл/мин/1,73 м2 (р<0,001) и –0,40±1,15% (р=0,013) в подгруппе рСКФ <45 мл/мин/1,73 м2. Во 2-й категории рСКФ среднее ± SD изменение уровня НbА1с через 3 года по сравнению с исходными величинами составило –0,71±1,34% в группе рСКФ ≥60 мл/мин/1,73 м2 (р<0,001) и –0,52±1,17% в группе рСКФ <60 мл/мин/1,73 м2 (р<0,001).
Во всех подгруппах рСКФ продемонстрировано стойкое значимое уменьшение массы тела в течение 3 лет (рис. 1с, d). В 1-й категории рСКФ среднее ± SD изменение массы тела через 3 года по сравнению с исходными величинами составило –3,37±4,83 кг (р<0,001), –3,42±4,25 кг (р<0,001), –3,47±4,26 кг (p<0,001) и –2,80±5,53 кг (р=0,001) в подгруппах рСКФ ≥90, от 60 до <90, от 45 до <60 и <45 мл/мин/1,73 м2 соответственно. Во 2-й категории рСКФ среднее ± SD изменение массы тела через 3 года по сравнению с исходными величинами составило –3,40±4,47 кг в подгруппе рСКФ ≥60 мл/мин/1,73 м2 (р<0,001) и –3,37±4,48 кг в подгруппе рСКФ <60 мл/мин/1,73 м2 (р<0,001).
Изменения других лабораторных показателей во 2-й категории рСКФ представлены в таблице S3 приложения. Было отмечено значимое увеличение уровня гемоглобина в динамике в подгруппах рСКФ ≥60 и <60 мл/мин/1,73 м2 от исходного среднего показателя 14,56±1,47 г/дл до 15,05±1,42 г/дл через 3 года в подгруппе рСКФ ≥60 мл/мин/1,73 м2 и с 13,77±1,64 г/дл до 14,38±1,63 г/дл в подгруппе <60 мл/мин/1,73 м2 (р<0,001 для среднего изменения через 3 года по сравнению с исходными величинами). В подгруппе рСКФ ≥60 мл/мин/1,73 м2 было отмечено увеличение уровня АМК с 14,04±3,67 мг/дл на начало исследования до 15,54±3,88 мг/дл через 3 года (р<0,001), однако в подгруппе рСКФ <60 мл/мин/1,73 м2 изменение этого показателя было небольшим (с 19,50±5,76 мг/дл на начало исследования до 19,52±5,51 мг/дл через 3 года; р=0,026).
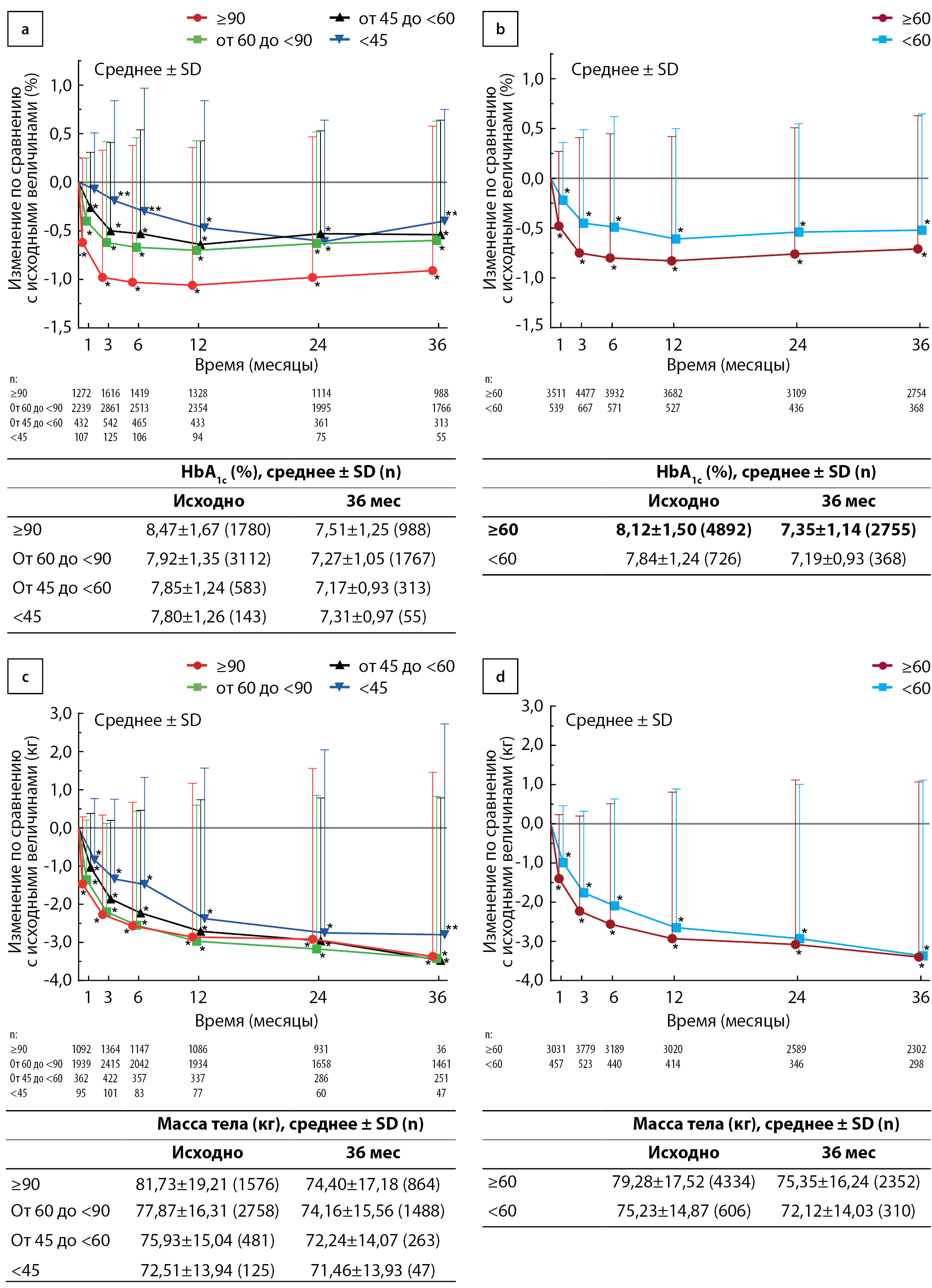
Рисунок 1. Среднее ± стандартное отклонение (SD) изменений уровня гликированного гемоглобина в подгруппах расчетной скорости клубочковой фильтрации (рСКФ) в 1-й категории рСКФ (а) и во 2-й категории рСКФ (b) и массы тела в подгруппах рСКФ в 1-й категории рСКФ (с) и во 2-й категории рСКФ (d) в популяции анализа эффективности. В таблицах представлены актуальные данные в начале исследования и через 3 года. * р <0,001, ** p <0,05 по сравнению с исходными величинами (односторонний t-критерий).
Функция почек
Изменения рСКФ в популяции анализа эффективности представлены на рис. 2. В четырех подгруппах функции почек 1-й категории рСКФ (рис. 2а) значимое уменьшение рСКФ через 1 мес после начала лечения ипраглифлозином наблюдалось в двух подгруппах с наибольшей рСКФ (≥90 и от 60 до <90 мл/мин/1,73 м2; р<0,001 в обеих категориях), при этом среднее ± SD изменение составило –6,13±11,20 и –2,03±7,94 мл/мин/1,73 м2 соответственно. Снижение рСКФ по сравнению с исходными величинами оставалось значимым через 3 года в обеих этих подгруппах (–8,27±13,73 и –1,22±10,34 мл/мин/1,73 м2 соответственно; р<0,001). В подгруппе исходной рСКФ от 45 до <60 мл/мин/1,73 м2 отмечалось значимое увеличение рСКФ через 3 мес на 0,64±7,20 мл/мин/1,73 м2 (р=0,049) с дальнейшим увеличением на 1,42±8,77 мл/мин/1,73 м2 через 3 года (р=0,006). В подгруппе исходной рСКФ <45 мл/мин/1,73 м2 значимых изменений рСКФ в течение 3 лет отмечено не было при исходном среднем ± SD, равном 37,12±7,25 мл/мин/1,73 м2 против 39,13±12,68 через 3 года (среднее изменение ± SD +1,02±10,55; р=0,495).
Во 2-й категории рСКФ (рис. 2b) было зарегистрировано значимое увеличение рСКФ через 3 года по сравнению с исходными величинами на 1,36±9,05 мл/мин/1,73 м2 (р=0,006) в подгруппе с исходной рСКФ <60 мл/мин/1,73 м2, в то время как у пациентов с исходной рСКФ ≥60 мл/мин/1,73 м2 отмечалось значимое уменьшение этого показателя на –3,72±12,13 мл/мин/1,73 м2 (р<0,001). Изменения рСКФ в каждой подгруппе рСКФ популяции анализа безопасности также представлены на рис. S1 приложения.
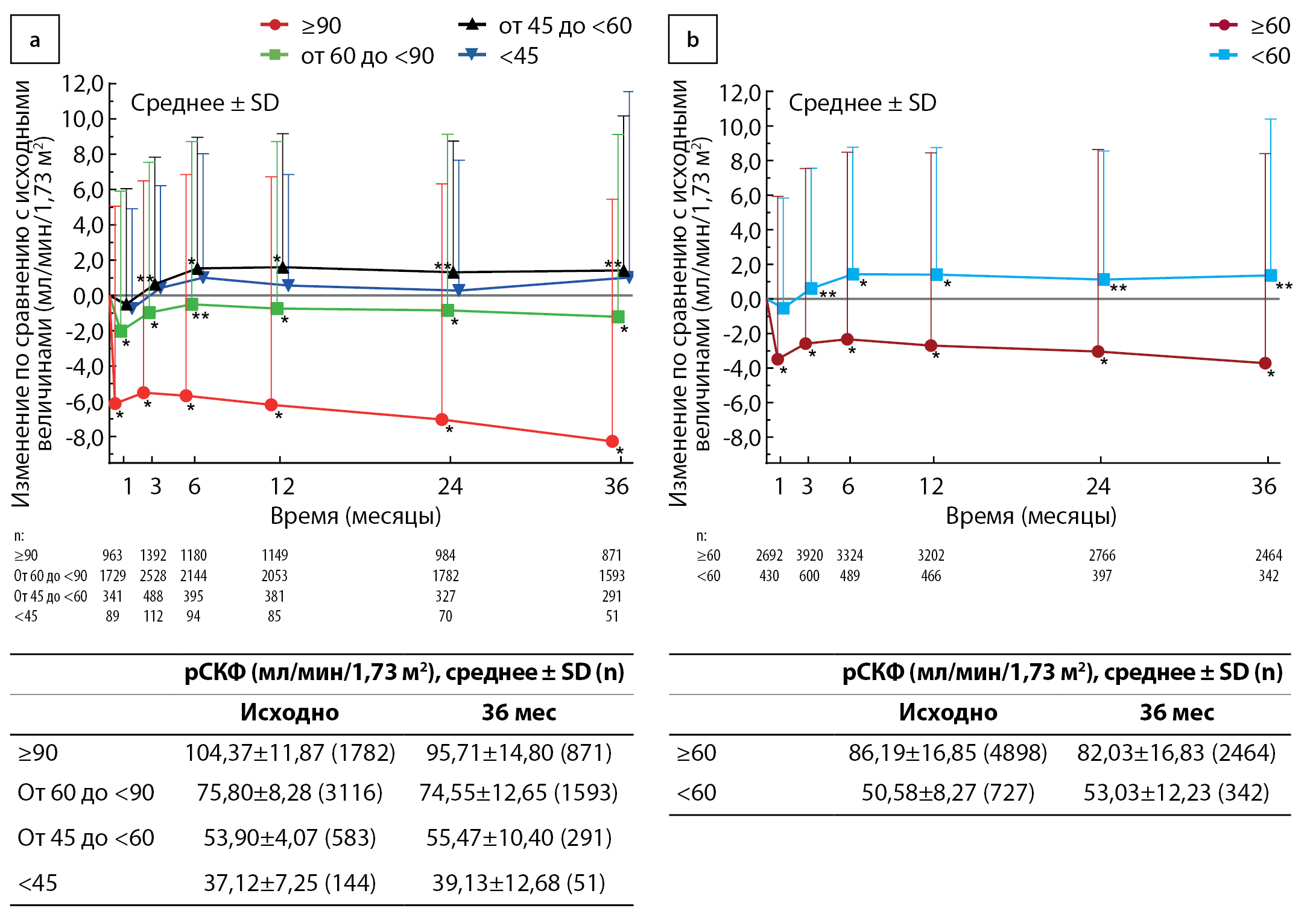
Рисунок 2. Среднее ± стандартное отклонение (SD) изменение расчетной скорости клубочковой фильтрации (рСКФ) в подгруппах рСКФ в 1-й категории рСКФ (а) и во 2-й категории рСКФ (b) в популяции анализа эффективности. В таблицах представлены актуальные данные в начале исследования и через 3 года. * р <0,001, ** p <0,05 по сравнению с исходными величинами (односторонний t-критерий).
Корреляции с изменениями рСКФ
В целом значимых корреляций между изменениями рСКФ и другими параметрами у пациентов с рСКФ <60 или ≥60 мл/мин/1,73 м2 выявлено не было (табл. 4). Под «значимой корреляцией» подразумевали умеренную или высокую корреляцию в любом направлении (≥0,4 или ≤0,4), также обладавшую статистической значимостью (р<0,05). Однако в подгруппе рСКФ <60 мл/мин/1,73 м2 были выявлены значимые корреляции между изменениями рСКФ через 3 года и уровнем АМК через 3 года (коэффициент корреляции Пирсона –0,465; р<0,001).
Таблица 4. Коэффициенты корреляции Пирсона между изменениями расчетной скорости клубочковой фильтрации и другими параметрами в подгруппах пациентов на основании исходной расчетной скорости клубочковой фильтрации (2-я категория рСКФ)
рСКФ <60 мл/мин/1,73 м2 | рСКФ ≥60 мл/мин/1,73 м2 | |||||
N | r | p | n | r | p | |
НbА1с через 3 года | 339 | 0,060 | 0,271 | 2435 | 0,155 | < 0,001 |
Изменение через 3 года | ||||||
ГПН | 180 | –0,161 | 0,031 | 1369 | 0,100 | <0,001 |
Инсулин натощак | 10 | –0,445 | 0,197 | 92 | 0,051 | 0,628 |
Масса тела | 278 | –0,078 | 0,196 | 2101 | –0,102 | <0,001 |
Окружность талии | 53 | –0,353 | 0,009 | 409 | –0,014 | 0,773 |
ИМТ | 259 | –0,080 | 0,197 | 2013 | –0,103 | <0,001 |
САД | 306 | 0,028 | 0,630 | 2220 | 0,079 | <0,001 |
ДАД | 305 | 0,052 | 0,370 | 2190 | 0,057 | 0,007 |
Частота сердечных сокращений | 183 | –0,011 | 0,879 | 1366 | –0,021 | 0,448 |
Число лейкоцитов | 296 | –0,010 | 0,862 | 2042 | –0,014 | 0,530 |
Число эритроцитов | 298 | 0,001 | 0,991 | 2043 | –0,011 | 0,609 |
Гемоглобин | 297 | 0,057 | 0,327 | 2059 | 0,002 | 0,917 |
Гематокрит | 294 | 0,054 | 0,357 | 2044 | –0,026 | 0,246 |
АСТ | 315 | 0,017 | 0,768 | 2320 | 0,020 | 0,343 |
АЛТ | 321 | 0,009 | 0,879 | 2348 | 0,040 | 0,051 |
Γ-ГТП | 291 | 0,020 | 0,733 | 2163 | 0,041 | 0,059 |
ЩФ | 154 | 0,119 | 0,143 | 1203 | 0,120 | <0,001 |
Общий билирубин | 148 | 0,094 | 0,256 | 1060 | –0,063 | 0,041 |
Общий холестерин | 179 | –0,067 | 0,372 | 1343 | –0,039 | 0,158 |
Холестерин ЛПНП | 281 | –0,066 | 0,268 | 2035 | –0,090 | <0,001 |
Холестерин ЛПВП | 291 | 0,044 | 0,452 | 2170 | 0,050 | 0,019 |
Холестерин не-ЛПВП | 166 | –0,061 | 0,435 | 1240 | –0,022 | 0,440 |
Триглицериды | 309 | 0,047 | 0,415 | 2268 | 0,042 | 0,045 |
Мочевая кислота | 285 | –0,256 | <0,001 | 2059 | –0,256 | <0,001 |
АМК | 284 | –0,465 | <0,001 | 2048 | –0,266 | <0,001 |
Альбумин сыворотки | 137 | –0,337 | <0,001 | 922 | –0,050 | 0,131 |
Na | 215 | –0,019 | 0,784 | 1553 | –0,078 | 0,002 |
Cl | 208 | 0,012 | 0,866 | 1526 | –0,039 | 0,124 |
K | 224 | –0,134 | 0,045 | 1593 | –0,129 | <0,001 |
Ca | 69 | –0,216 | 0,074 | 429 | –0,234 | <0,001 |
P | 25 | –0,010 | 0,962 | 193 | –0,091 | 0,208 |
Mg | 10 | –0,326 | 0,358 | 57 | –0,292 | 0,028 |
Кетоновые тела сыворотки | 3 | –0,851 | – | 30 | 0,233 | 0,216 |
С-пептид натощак | 8 | –0,418 | – | 54 | –0,199 | 0,150 |
Индекс С-пептида | 8 | –0,443 | – | 49 | –0,148 | 0,311 |
рН | 134 | 0,213 | 0,013 | 1015 | 0,058 | 0,064 |
Альбумин мочи | 14 | 0,353 | 0,215 | 178 | –0,013 | 0,860 |
Креатинин мочи | 17 | 0,035 | 0,893 | 109 | –0,187 | 0,051 |
Индекс стеатоза печени | 45 | –0,216 | 0,155 | 383 | 0,022 | 0,674 |
HOMA-IR | 2 | –1,000 | – | 23 | 0,253 | 0,244 |
HOMA-β | 10 | 0,038 | 0,917 | 90 | 0,003 | 0,981 |
Влияние ИМТ на корреляции с изменениями рСКФ
В таблицах S4 и S5 приложения представлены корреляции между изменениями рСКФ и другими параметрами у пациентов с рСКФ <60 или ≥60 мл/мин/1,73 м2, стратифицированных в зависимости от исходного ИМТ. Среди участников с нарушениями функции почек значимая корреляция между изменениями рСКФ и изменениями уровня мочевой кислоты через 3 года (коэффициент корреляции Пирсона –0,509; р<0,001) была продемонстрирована у пациентов с самым высоким ИМТ (≥30 кг/м2), а у участников с самым низким ИМТ (<25 кг/м2) была выявлена значимая корреляция между изменениями рСКФ и уровня холестерина, не относящегося к липопротеинам высокой плотности (не-ЛПВП) (коэффициент корреляции Пирсона 0,410; р=0,030). Кроме того, значимые корреляции были установлены между изменениями рСКФ и уровнем АМК во всех подгруппах ИМТ, за исключением пациентов с самым низким ИМТ (таблицы S4, S5 приложения). В группе рСКФ ≥60 мл/мин/1,73 м2 (таблица S5 приложения) была выявлена значимая корреляция между рСКФ и изменениями уровня магния через 3 года у пациентов с ИМТ ≥30 кг/м2 (коэффициент корреляции Пирсона –0,442; р=0,045), а также изменениями уровня креатинина мочи через 3 года у пациентов с самым низким ИМТ (коэффициент корреляции Пирсона –0,489; р=0,015).
ОБСУЖДЕНИЕ
Анализ по подгруппам, сформированным в зависимости от состояния функции почек, в постмаркетинговом наблюдательном исследовании STELLA-LONG TERM представил первые результаты по итогам 3-летней оценки влияния функции почек на безопасность и эффективность ингибитора НГЛТ-2 у пациентов из Японии с СД2. В целом частота НРП и серьезных НРП была сходной во всех подгруппах в пределах категорий рСКФ; однако у пациентов с исходной рСКФ <45 или от 45 до <60 мл/мин/1,73 м2 наблюдалась тенденция к большей частоте нарушений со стороны почек и событий, ассоциирующихся с гиповолемией, по сравнению с участниками с менее выраженными нарушениями функции почек (рСКФ от 60 до <90 или ≥90 мл/мин/1,73 м2). Тем не менее полученные данные по безопасности свидетельствуют о том, что длительное непрерывное лечение ипраглифлозином, по-видимому, не сопровождается увеличением частоты НРП, поскольку частота НРП или серьезных НРП через 3 года была сходной с показателями через 12 мес и через 2 года после начала лечения при отсутствии новых данных в отношении безопасности [18][21][22].
Безопасность ипраглифлозина была в целом сопоставимой во всех подгруппах по рСКФ при одном существенном отличии частоты НРП, представляющих особый интерес, а именно частота нарушений со стороны почек и событий, связанных с гиповолемией, была выше у пациентов с умеренным или тяжелым нарушением функции почек по сравнению с участниками с нормальной функцией почек или ее незначительным нарушением. Это наблюдение согласуется с результатами основного анализа настоящего постмаркетингового исследования [27], продемонстрировавшего, что нарушение функции почек средней степени тяжести является фактором риска событий, ассоциирующихся с гиповолемией, а нарушение функции почек легкой/средней степени тяжести — фактор риска развития нарушений со стороны почек. Тем не менее, частота наиболее распространенной НРП, представляющей особый интерес, — полиурии/поллакиурии — была сходной в большинстве подгрупп рСКФ.
Что касается эффективности ипраглифлозина, анализ показал статистически значимое снижение уровня НbА1с и массы тела во всех подгруппах рСКФ через 3 мес лечения по сравнению с исходными величинами; этот результат сохранялся на протяжении 3 лет. Полученные данные свидетельствуют о долгосрочной стойкой эффективности ипраглифлозина в отношении контроля гликемии и массы тела при использовании препарата в условиях повседневной клинической практики.
Данные о стойкой эффективности ипраглифлозина имеют особое значение, поскольку в более ранних публикациях авторы отмечали ограниченную эффективность ингибиторов НГЛТ-2 в отношении контроля гликемии у пациентов с СД2 с нарушением функции почек [16][28]. В рандомизированном исследовании LANTERN для пациентов с нарушением функции почек средней степени тяжести (рСКФ от 30 до <60 мл/мин/1,73 м2) были характерны менее выраженные изменения уровня НbА1с в течение 24 нед лечения ипраглифлозином (среднее –0,28%) по сравнению с участниками с нарушением функции почек легкой степени (–0,56% у пациентов с рСКФ от 60 до <90 мл/мин/1,73 м2) [16]. Однако настоящее исследование в условиях повседневной клинической практики не выявило различий между подгруппами с различной степенью нарушения функции почек при численно сходном изменении уровня НbА1с через 6 мес в подгруппах рСКФ от 60 до <90 и от 45 до <60 мл/мин/1,73 м2 (среднее –0,67 и –0,53% соответственно). Как в исследовании LANTERN, так и в настоящем исследовании отмечалось значимое уменьшение массы тела по сравнению с исходными показателями, причем степень выраженности этого изменения была сходной во всех подгруппах рСКФ.
У пациентов с исходной рСКФ <60 мл/мин/1,73 м2 установлен однозначный ренопротективный эффект ипраглифлозина; значимое увеличение рСКФ было отмечено начиная с 3 мес лечения, причем этот эффект сохранялся на протяжении 3 лет. Однако этот эффект, по-видимому, ограничивался пациентами с рСКФ от 45 до <60 мл/мин/1,73 м2, при этом через 3 года в этой подгруппе также наблюдалось значимое увеличение рСКФ в отличие от подгруппы пациентов с наиболее выраженным нарушением функции почек (рСКФ <45 мл/мин/1,73 м2), у которых значимых изменений рСКФ по сравнению с исходными величинами выявлено не было. Маловероятно, что этот феномен можно объяснить высокой частотой выбывания среди пациентов с исходной рСКФ <60 мл/мин/1,73 м2, поскольку в соответствии с анализом в подгруппах в основной публикации результатов исследования STELLA-LONG TERM доля пациентов с исходным нарушением функции почек, прекративших или временно прервавших лечение, составила лишь 12,57% (24/191) [27]. Более того, результаты недавнего проспективного многоцентрового исследования длительностью 104 нед, выполненного в Японии, у пациентов с СД2, получающих ипраглифлозин 50 мг/сут, свидетельствуют о способности ипраглифлозина улучшать рСКФ у пациентов с исходно низкой рСКФ [29]. В настоящем анализе у пациентов с исходной рСКФ ≥60 мл/мин/1,73 м2 (2-я категория), наоборот, отмечено стойкое значимое снижение рСКФ через 3 года; однако средняя рСКФ в этой контрольной точке (82,03 мл/мин/1,73 м2) оставалась ≥60 мл/мин/1,73 м2. Полученный результат подтверждает эффект снижения рСКФ у пациентов с клубочковой гиперфильтрацией на фоне терапии ипраглифлозином; это наблюдение также подтверждают результаты 104-недельного многоцентрового исследования ипраглифлозина [29].
Возможные механизмы ренопротективного эффекта ингибиторов НГЛТ-2 включают прямое и косвенное влияние на функцию почек [30]. Можно предположить, что применение этих препаратов непосредственно улучшает клубочковую гиперфильтрацию, снижает потребление кислорода почками, уменьшает воспалительные изменения ткани почек и восстанавливает энергетический метаболизм клеток [30]. К непрямым эффектам можно отнести снижение уровня гликемии, артериального давления, уровня глюкагона, инсулина, стимуляцию диуреза, снижение массы тела и уровня мочевой кислоты [30].
Распространенным состоянием у пациентов с СД2 является ожирение; его наличие увеличивает риск осложнений [31], а лечение пациентов с СД2 со сниженной функцией почек и ожирением представляет собой сложную задачу. Возможным фактором риска развития ХБП является мочевая кислота [32], а увеличение массы тела повышает риск гиперурикемии и подагры [33][34]. С другой стороны, для пациентов с СД или предиабетом зачастую характерна низкая частота урикемии по сравнению со здоровыми людьми [35][36]. Вероятно, этот феномен основан на стимуляции экскреции мочевой кислоты почками на фоне гипергликемии, что способствует снижению уровня мочевой кислоты, циркулирующей в крови [36]. Сходным образом ингибиторы НГЛТ-2 способствуют снижению уровня мочевой кислоты за счет увеличения ее экскреции с мочой [37]. Изучение рСКФ и ИМТ в настоящем исследовании показало, что изменение уровня мочевой кислоты в крови через 3 года значимо коррелировало с изменениями рСКФ у пациентов с рСКФ <60 мл/мин/1,73 м2 и ИМТ ≥30 кг/м2. Однако корреляция не означает причинно-следственную взаимосвязь; вот почему нельзя утверждать, что увеличение рСКФ на фоне лечения ипраглифлозином способствует снижению уровня мочевой кислоты сыворотки крови у пациентов с нарушением функции почек и ожирением. Тем не менее полученные результаты согласуются с данными предшествующего исследования ипраглифлозина, показавшего, что улучшение функции почек сопровождалось снижением уровня мочевой кислоты сыворотки крови [38].
К основным ограничениям настоящего исследования относятся его наблюдательный характер с формированием одной терапевтической группы и проведение исследования в условиях повседневной клинической практики, а также то, что в отсутствие контрольной группы некоторые параметры безопасности и эффективности могли быть обусловлены другими факторами, такими как прием сопутствующих препаратов и наличие сопутствующих заболеваний, а не терапией ипраглифлозином. Кроме того, у значительной доли пациентов в нашем исследовании (40%) отсутствовали сведения об исходном показателе рСКФ; также наблюдение за пациентами, завершившими или прекратившими лечение ипраглифлозином, не проводилось, что может определять наличие систематической ошибки.
ВЫВОДЫ
Применение ипраглифлозина в течение 3 лет ассоциировалось со стойким улучшением уровня НbА1с во всех подгруппах по рСКФ, однако у пациентов с СД2 со сниженной функцией почек степень улучшения была менее выраженной. Снижение массы тела на фоне терапии ипраглифлозином отмечено во всех подгруппах, сформированных в зависимости от состояния функции почек. Доля пациентов с НРП и серьезными НРП была сходной в большинстве подгрупп рСКФ. Только у пациентов со сниженной рСКФ наблюдалась тенденция к большей частоте развития нарушений со стороны почек и событий, ассоциирующихся с гиповолемией, таких как дегидратация. Важно отметить, что у пациентов со сниженной рСКФ (исходная рСКФ от 45 до <60 мл/мин/1,73 м2) улучшение функции почек (на основании рСКФ) сохранялось в течение 3 лет.
Список литературы
1. Hill NR, Fatoba ST, Oke JL, et al. Global Prevalence of Chronic Kidney Disease – A Systematic Review and Meta-Analysis. PLoS One. 2016;11(7):e0158765. doi: https://doi.org/10.1371/journal.pone.0158765
2. Masakane I, Nakai S, Ogata S, et al. An Overview of Regular Dialysis Treatment in Japan (As of 31 December 2013). Ther Apher Dial. 2015;19(6):540-574. doi: https://doi.org/10.1111/1744-9987.12378
3. Arnott C, Li Q, Kang A, et al. Sodium‐Glucose Cotransporter 2 Inhibition for the Prevention of Cardiovascular Events in Patients With Type 2 Diabetes Mellitus: A Systematic Review and Meta‐Analysis. J Am Heart Assoc. 2020;9(3):e014908. doi: https://doi.org/10.1161/JAHA.119.014908
4. Barnett AH, Mithal A, Manassie J, et al. Efficacy and safety of empagliflozin added to existing antidiabetes treatment in patients with type 2 diabetes and chronic kidney disease: a randomised, double-blind, placebo-controlled trial. Lancet Diabetes Endocrinol. 2014;2(5):369-384. doi: https://doi.org/10.1016/S2213-8587(13)70208-0.
5. Heerspink HJL, Karasik A, Thuresson M, et al. Kidney outcomes associated with use of SGLT2 inhibitors in real-world clinical practice (CVD-REAL 3): a multinational observational cohort study. Lancet Diabetes Endocrinol. 2020;8(1):27-35. doi: https://doi.org/10.1016/S2213-8587(19)30384-5
6. Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med. 2019;380(24):2295-2306. doi: https://doi.org/10.1056/NEJMoa1811744.
7. Yale J ‐F., Bakris G, Cariou B, et al. Efficacy and safety of canagliflozin in subjects with type 2 diabetes and chronic kidney disease. Diabetes, Obes Metab. 2013;15(5):463-473. doi: https://doi.org/10.1111/dom.12090
8. Zhang X, Zhong Z, Li Y, Li W. Long‐term renal outcomes associated with sodium glucose cotransporter 2 inhibitors in patients with type 2 diabetes mellitus: A systematic review and meta‐analysis. Diabetes Metab Res Rev. 2020;36(5). doi: https://doi.org/10.1002/dmrr.3303.
9. Takeuchi M, Ogura M, Minoura T, et al. Comparative Effectiveness of Sodium-Glucose Cotransporter-2 Inhibitors Versus Other Classes of Glucose-Lowering Medications on Renal Outcome in Type 2 Diabetes. Mayo Clin Proc. 2020;95(2):265-273. doi: https://doi.org/10.1016/j.mayocp.2019.12.004
10. Kitada M, Hirai T, Koya D. Significance of SGLT2 inhibitors: lessons from renal clinical outcomes in patients with type 2 diabetes and basic researches. Diabetol Int. 2020;11(3):245-251. doi: https://doi.org/10.1007/s13340-020-00444-8
11. Ito Y, Van Schyndle J, Nishimura T, et al. Characteristics of Patients with Diabetes Initiating Sodium Glucose Co-transporter-2 Inhibitors (SGLT2i): Real-World Results from Three Administrative Databases in Japan. Diabetes Ther. 2019;10(2):549-562. doi: https://doi.org/10.1007/s13300-019-0577-7
12. Poole RM, Dungo RT. Ipragliflozin: First Global Approval. Drugs. 2014;74(5):611-617. doi: https://doi.org/10.1007/s40265-014-0204-x.
13. Araki E, Goto A, Kondo T, et al. Japanese Clinical Practice Guideline for Diabetes 2019. Diabetol Int. 2020;11(3):165-223. doi: https://doi.org/10.1007/s13340-020-00439-5
14. Watada H. Current understanding of the effect of sodium–glucose co-transporter-2 inhibitors in Asian patients with diabetes mellitus. Diabetol Int. 2020;11(3):242-244. doi: https://doi.org/10.1007/s13340-020-00443-9
15. Kadokura T, Akiyama N, Kashiwagi A, et al. Pharmacokinetic and pharmacodynamic study of ipragliflozin in Japanese patients with type 2 diabetes mellitus: A randomized, double-blind, placebo-controlled study. Diabetes Res Clin Pract. 2014;106(1):50-56. doi: https://doi.org/10.1016/j.diabres.2014.07.020
16. Kashiwagi A, Takahashi H, Ishikawa H, et al. A randomized, double‐blind, placebo‐controlled study on long‐term efficacy and safety of ipragliflozin treatment in patients with type 2 diabetes mellitus and renal impairment: results of the Long‐Term <scp>ASP1941</scp> Safety Evaluation in Patients with. Diabetes, Obes Metab. 2015;17(2):152-160. doi: https://doi.org/10.1111/dom.12403
17. Maegawa H, Tobe K, Nakamura I, Uno S. Safety and effectiveness of ipragliflozin in elderly versus non-elderly Japanese type 2 diabetes mellitus patients: 12 month interim results of the STELLA-LONG TERM study. Curr Med Res Opin. 2019;35(11):1901-1910. doi: https://doi.org/10.1080/03007995.2019.1647503
18. Maegawa H, Tobe K, Tabuchi H, Nakamura I. Baseline characteristics and interim (3-month) efficacy and safety data from STELLA-LONG TERM, a long-term post-marketing surveillance study of ipragliflozin in Japanese patients with type 2 diabetes in real-world clinical practice. Expert Opin Pharmacother. 2016;17(15):1985-1994. doi: https://doi.org/10.1080/14656566.2016.1217994
19. Maegawa H, Tobe K, Tabuchi H, et al. Safety and efficacy of ipragliflozin in elderly versus non-elderly Japanese patients with type 2 diabetes mellitus: a subgroup analysis of the STELLA-LONG TERM study. Expert Opin Pharmacother. 2018;19(4):327-336. doi: https://doi.org/10.1080/14656566.2018.1434145
20. Nakamura I, Maegawa H, Tobe K, et al. Safety and efficacy of ipragliflozin in Japanese patients with type 2 diabetes in real-world clinical practice: interim results of the STELLA-LONG TERM post-marketing surveillance study. Expert Opin Pharmacother. 2018;19(3):189-201. doi: https://doi.org/10.1080/14656566.2017.1408792
21. Nakamura I, Maegawa H, Tobe K, Uno S. Safety and Effectiveness of Ipragliflozin for Type 2 Diabetes in Japan: 12-Month Interim Results of the STELLA-LONG TERM Post-Marketing Surveillance Study. Adv Ther. 2019;36(4):923-949. doi: https://doi.org/10.1007/s12325-019-0895-1.
22. Nakamura I, Tobe K, Maegawa H, Uno S. Safety and effectiveness of ipragliflozin in Japanese patients with type 2 diabetes mellitus: 24-month interim results of the STELLA-LONG TERM post-marketing surveillance study. Jpn Pharmacol Ther. 2019;47(11):1765-1789.
23. Tabuchi H, Maegawa H, Tobe K, et al. Effect of ipragliflozin on liver function in Japanese type 2 diabetes mellitus patients: a subgroup analysis of the STELLA-LONG TERM study (3-month interim results). Endocr J. 2019;66(1):31-41. doi: https://doi.org/10.1507/endocrj.EJ18-0217
24. Tobe K, Maegawa H, Nakamura H, Uno S. Safety and effectiveness of ipragliflozin in Japanese patients with type 2 diabetes mellitus stratified by body mass index: a subgroup analysis of 24-month interim reports from the STELLA-LONG TERM post-marketing surveillance study. Jpn Pharmacol Ther. 2019;47(11):1791–1805.
25. Tobe K, Maegawa H, Tabuchi H, et al. Impact of body mass index on the efficacy and safety of ipragliflozin in Japanese patients with type 2 diabetes mellitus: A subgroup analysis of 3‐month interim results from the Specified Drug Use Results Survey of Ipragliflozin Treatment in Type 2 Diabet. J Diabetes Investig. 2019;10(5):1262-1271. doi: https://doi.org/10.1111/jdi.13021
26. Grams ME, Sang Y, Ballew SH, et al. Evaluating Glomerular Filtration Rate Slope as a Surrogate End Point for ESKD in Clinical Trials: An Individual Participant Meta-Analysis of Observational Data. J Am Soc Nephrol. 2019;30(9):1746-1755. doi: https://doi.org/10.1681/ASN.2019010008
27. Nakamura I, Maegawa H, Tobe K, Uno S. Real-World Evidence for Long-Term Safety and Effectiveness of Ipragliflozin in Japanese Patients with Type 2 Diabetes Mellitus: final Results of a 3-Year Post-Marketing Surveillance Study (STELLA-LONG TERM). Expert Opin Pharmacother. 2021;22(3):373-387. doi: https://doi.org/10.1080/14656566.2020.1817388
28. Fioretto P, Zambon A, Rossato M, et al. SGLT2 Inhibitors and the Diabetic Kidney. Diabetes Care. 2016;39(2):S165-S171. doi: https://doi.org/10.2337/dcS15-3006
29. Matsuba I, Kawata T, Iemitsu K, et al. Effects of ipragliflozin on the development and progression of kidney disease in patients with type 2 diabetes: An analysis from a multicenter prospective intervention study. J Diabetes Investig. 2020;11(5):1248-1257. doi: https://doi.org/10.1111/jdi.13248
30. Ni L, Yuan C, Chen G, et al. SGLT2i: beyond the glucose-lowering effect. Cardiovasc Diabetol. 2020;19(1):98. doi: https://doi.org/10.1186/s12933-020-01071-y
31. Hollander P. The role of anti-obesity drugs in patients with type 2 diabetes. US Endocrinol. 2013;9(2):101–107. doi: https://doi.org/10.17925/use.2013.09.02.101.
32. Kumagai T, Ota T, Tamura Y, et al. Time to target uric acid to retard CKD progression. Clin Exp Nephrol. 2017;21(2):182-192. doi: https://doi.org/10.1007/s10157-016-1288-2
33. Choi HK, Atkinson K, Karlson EW, Curhan G. Obesity, Weight Change, Hypertension, Diuretic Use, and Risk of Gout in Men. Arch Intern Med. 2005;165(7):742. doi: https://doi.org/10.1001/archinte.165.7.742
34. Takahashi S, Yamamoto T, Tsutsumi Z, et al. Close correlation between visceral fat accumulation and uric acid metabolism in healthy men. Metabolism. 1997;46(10):1162-1165. doi: https://doi.org/10.1016/S0026-0495(97)90210-9
35. Haque T, Rahman S, Islam S, et al. Assessment of the relationship between serum uric acid and glucose levels in healthy, prediabetic and diabetic individuals. Diabetol Metab Syndr. 2019;11(1):49. doi: https://doi.org/10.1186/s13098-019-0446-6
36. Herman JB, Medalie JH, Goldbourt U. Diabetes, prediabetes and uricaemia. Diabetologia. 1976;12(1):47-52. doi: https://doi.org/10.1007/BF01221964
37. Chino Y, Samukawa Y, Sakai S, et al. SGLT2 inhibitor lowers serum uric acid through alteration of uric acid transport activity in renal tubule by increased glycosuria. Biopharm Drug Dispos. 2014;35(7):391-404. doi: https://doi.org/10.1002/bdd.1909
38. Tanaka M, Yamakage H, Inoue T, et al. Beneficial Effects of Ipragliflozin on the Renal Function and Serum Uric Acid Levels in Japanese Patients with Type 2 Diabetes: A Randomized, 12-week, Open-label, Active-controlled Trial. Intern Med. 2020;59(5):601-609. doi: https://doi.org/10.2169/internalmedicine.3473-19
Об авторах
K. TobeЯпония
Kazuyki Tome
Токио
Конфликт интересов:
Получал вознаграждения за чтение лекций от MSD K.K., Novo Nordisk Pharma Ltd., Kowa Pharmaceutical Co. Ltd.; гранты от Daiichi Sankyo Co. Ltd., Ono Pharmaceutical Co. Ltd., Takeda Pharmaceutical Co. Ltd., Nippon Boehringer Ingelheim Co. Ltd., MSD K.K., Mitsubishi Tanabe Pharma Corporation, Teijin Pharma Limited, Eli Lilly Japan K.K., Asahi Kasei Pharma Corporation, The Mitsubishi Foundation и Suntory Global Innovation Center Ltd.
H. Maegawa
Япония
Kiroshi Maegawa - Department of Medicine.
Сига
Конфликт интересов:
Получил вознаграждения за чтение лекций от MSD K.K., Sanofi K.K., Astellas Pharma Inc., Nippon Boehringer Ingelheim Co. Ltd., Takeda Pharmaceutical Co. Ltd., Mitsubishi Tanabe Pharma Corporation, Daiichi Sankyo Co. Ltd., Astra Zeneca K.K., Eli Lilly Japan K.K., Novo Nordisk Pharma Ltd. и Sumitomo Dainippon Pharma Co. Ltd.; поддержку исследований от Astellas Pharma Inc., Astra Zeneca K.K., Nippon Boehringer Ingelheim Co. Ltd., Sunstar Inc., Mitsubishi Tanabe Pharma Corporation, Kyowa Kirin Co. Ltd., Nissan Chemical Corporation и MIKI Corporation; гранты от Takeda Pharmaceutical Co. Ltd., Astellas Pharma Inc., MSD K.K., Nippon Boehringer Ingelheim Co. Ltd., Mitsubishi Tanabe Pharma Corporation, Daiichi Sankyo Co. Ltd., Sumitomo Dainippon Pharma Co. Ltd., Kowa Pharmaceutical Co. Ltd., Taisho Pharma Co. Ltd., Ono Pharmaceutical Co. Ltd., Sanofi K.K., Sanwa Kagaku Kenkyusho Co. Ltd., Eli Lilly Japan K.K., Novo Nordisk Pharma Ltd., Bayer Yakuhin Ltd., Teijin Pharma Limited, Shionogi & Co. Ltd., Novartis Pharma K.K. и Nipro Corporation.
I. Nakamura
Япония
Ichiro Nakamura - Operational Excellence, Medical Affairs Japan
Токио
Конфликт интересов:
Сотрудник Astellas Pharma Inc.
S. Uno
Япония
Satoshi Uno - Data Science, Development.
Токио
Конфликт интересов:
Сотрудник Astellas Pharma Inc.
Дополнительные файлы
Рецензия
Для цитирования:
Tobe K., Maegawa H., Nakamura I., Uno S. Безопасность и эффективность ипраглифлозина у пациентов из Японии с сахарным диабетом 2-го типа и нарушением функции почек: анализ в подгруппах 3-летнего постмаркетингового наблюдательного исследования (STELLA-LONG TERM). Сахарный диабет. 2021;24(2):141-155. https://doi.org/10.14341/DM12758
For citation:
Tobe K., Maegawa H., Nakamura I., Uno S. Safety and effectiveness of ipragliflozin in Japanese patients with type 2 diabetes mellitus and impaired renal function: subgroup analysis of a 3-year post-marketing surveillance study (STELLA-LONG TERM). Diabetes mellitus. 2021;24(2):141-155. (In Russ.) https://doi.org/10.14341/DM12758

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































