Перейти к:
Ипраглифлозин улучшает состояние печени у пациентов с сахарным диабетом с неалкогольной жировой болезнью печени
https://doi.org/10.14341/DM13340
Аннотация
Ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) широко применяются для лечения сахарного диабета, однако их влияние на неалкогольную жировую болезнь печени (НАЖБП) еще предстоит определить.
Цель нашего исследования — оценка влияния иНГЛТ-2 на патогенез НАЖБП. Проведено многоцентровое рандомизированное контролируемое исследование с участием пациентов с сахарным диабетом 2 типа, страдающих НАЖБП. Сравнивали изменения гликемического контроля, жировой массы и патологии печени между группой участников, получавших ипраглифлозин (50 мг/сут в течение 72 нед.; группа ИПР), и группой участников, которые не принимали иНГЛТ-2, пиоглитазон, аналоги глюкагоноподобного пептида-1 или инсулин (контрольная группа, КОНТР). В группе ИПР (n=25) за период исследования установлено статистически значимое снижение концентрации гликированного гемоглобина (HbA1c) и индекса массы тела (ИМТ) (HbA1c: –0,41%, P<0,01; ИМТ: –1,06 кг/m2, P<0,01), в то время как в контрольной группе (n=26) эти показатели не изменились. Морфологическое состояние печени было оценено у 21 участника в группе ИПР и у 25 участников в контрольной группе. Исходно у 17 (81%) пациентов в группе ИПР и у 18 (72%) в контрольной группе КОНТР имелся фиброз печени. Показатели фиброза улучшились у 70,6% (12 из 17) участников в группе ИПР и у 22% (4 из 18) участников в контрольной группе (Р<0,01). Разрешение неалкогольного стеатогепатита (НАСГ) отмечено у 66,7% пациентов, получавших ипраглифлозин, и у 27,3% участников контрольной группы. Ни у одного из пациентов в группе ИПР не развился НАСГ, тогда как в контрольной группе НАСГ развился у 33,3% участников.
ЗАКЛЮЧЕНИЕ. Длительное лечение ипраглифлозином улучшает показатели фиброза печени у пациентов с НАЖБП. Следовательно, ипраглифлозин может быть эффективен для лечения и профилактики НАСГ у пациентов с сахарным диабетом, а также для улучшения гликемического контроля и уменьшения жировой массы. Таким образом, иНГЛТ-2 представляют перспективный вариант лечения пациентов с сахарным диабетом с НАЖБП, однако для подтверждения обнаруженных эффектов требуются дальнейшие более крупные исследования (Hepatology Communications 2022;6:120-132).
Ключевые слова
Для цитирования:
Takahashi H., Kessoku T., Kawanaka M., Nonaka M., Hyogo H., Fujii H., Nakajima T., Imajo K., Tanaka K., Kubotsu Y., Isoda H., Oeda S., Kurai O., Yoneda M., Ono M., Kitajima Y., Tajiri R., Takamori A., Kawaguchi A., Aishima Sh., Kage M., Nakajima A., Eguchi Yu., Anzai K. Ипраглифлозин улучшает состояние печени у пациентов с сахарным диабетом с неалкогольной жировой болезнью печени. Сахарный диабет. 2025;28(2):210-227. https://doi.org/10.14341/DM13340
For citation:
Takahashi H., Kessoku T., Kawanaka M., Nonaka M., Hyogo H., Fujii H., Nakajima T., Imajo K., Tanaka K., Kubotsu Y., Isoda H., Oeda S., Kurai O., Yoneda M., Ono M., Kitajima Y., Tajiri R., Takamori A., Kawaguchi A., Aishima Sh., Kage M., Nakajima A., Eguchi Yu., Anzai K. Ipragliflozin improves the hepatic outcomes of patients with diabetes with NAFLD. Diabetes mellitus. 2025;28(2):210-227. (In Russ.) https://doi.org/10.14341/DM13340
СОКРАЩЕНИЯ:
- НЯ — нежелательное явление;
- АЛТ — аланинаминотрансфераза;
- АСТ — аспартатаминотрансфераза;
- ИМТ — индекс массы тела;
- КТ — компьютерная томография;
- КОНТР — контрольная группа;
- ССЗ — сердечно-сосудистое заболевание;
- FIB-4 — индекс фиброза 4;
- ГПП-1 — глюкагоноподобный пептид-1;
- ГГТ — гамма-глутамилтранспептидаза;
- HbA1c — гликированный гемоглобин (A1c);
- ИПР — группа лечения ипраглифлозином;
- M2BPGi — изомер Mac2-связывающего белка гликозилирования;
- НАБЖП — неалкогольная жировая болезнь печени;
- NAS — шкала оценки активности НАБЖП;
- НАСГ — неалкогольный стеатогепатит;
- РКИ — рандомизированное контролируемое исследование;
- иНГЛТ-2 — ингибиторы натрий-глюкозного контранспортера 2-го типа.
Распространенность неалкогольной жировой болезни печени (НАЖБП) и неалкогольного стеатогепатита (НАСГ) в общей популяции составляет соответственно около 25% и 5%, и эти показатели растут [1]. Кроме того, согласно прогнозам, к 2030 г. экономическая нагрузка, связанная с НАЖБП, увеличится в два раза [2][3], однако эффективных препаратов для лечения этого заболевания пока не существует. НАЖБП тесно связана с сахарным диабетом (СД). Распространенность СД среди пациентов с НАЖБП составляет 23%, а среди пациентов с НАСГ — 47% [4]. Согласно результатам одного недавнего метаанализа, у пациентов с НАЖБП риск развития СД 2 типа (СД2) в два раза выше, чем у лиц без НАЖБП [5]. Кроме того, результаты эпидемиологических исследований показывают, что нарушение метаболизма глюкозы и/или СД у лиц с НАБЖП ассоциированы с прогрессированием фиброза печени и повышенной частотой гепатоцеллюлярного рака [6]. Сочетание СД и НАЖБП ускоряет прогрессирование обоих заболеваний, усугубляет поражение печени, повышает общую смертность, в том числе от сердечно-сосудистых заболеваний (ССЗ) [7][8].
Недавние исследования показали, что тяжесть фиброза печени служит наиболее значимым независимым фактором риска смерти и осложнений со стороны печени при НАЖБП [8][9]. В связи с этим фиброз печени следует рассматривать в качестве основного исследуемого показателя в ходе клинических исследований потенциальных лекарственных препаратов. Ингибиторы натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) — это гипогликемические препараты, снижающие уровень глюкозы в крови за счет ингибирования реабсорбции глюкозы в почках. Результаты клинических исследований «EMPA-REG OUTCOME», «CANVAS» и соответствующих субанализов показали, что иНГЛТ-2 эмпаглифлозин и канаглифлозин снижают риск ССЗ и улучшают почечные исходы у пациентов с СД [10–12]. В результате профессиональные сообщества Америки и Европы пришли к общему мнению о приоритетном использовании иНГЛТ-2 у пациентов с СД2, когда модификация образа жизни и лечение метформином не обеспечивают достаточный гликемический контроль [13]. Также имеются данные о влиянии иНГЛТ-2 на НАЖБП. Так было продемонстрировано уменьшение активности аланинаминотрансферазы (АЛТ), стеатоза печени и фиброза печени на основании расчета индекса фиброза 4 (FIB-4) [14][15], однако до настоящего времени не проводилось рандомизированных контролируемых исследований, направленных на оценку изменений в печени. В частности, важно установить, уменьшают ли иНГЛТ-2 степень фиброза печени, который, как известно, является наиболее значимым фактором риска смертельного исхода у пациентов с НАЖБП. В связи с этим нами проведено рандомизированное контролируемое исследование (РКИ), направленное на оценку влияния ипраглифлозина на патологические изменения печени, а также на гликемический контроль и жировую массу у пациентов с СД2 в сочетании с НАЖБП.
МАТЕРИАЛЫ И МЕТОДЫ
Пациенты
Для участия в исследовании в период с августа 2015-го по сентябрь 2017 гг. в семи медицинских центрах Японии набирали пациентов с СД2, у которых в течение последних 6 месяцев клинически и с помощью биопсии печени (первая биопсия печени) была диагностирована НАЖБП.
Критериями включения в исследование были:
1) возраст 20–80 лет;
2) гистологический диагноз НАЖБП, поставленный назначенным в рамках исследования патологоанатомом;
3) концентрация гемоглобина А1с (HbA1c)>6,0%;
4) отсутствие приема иНГЛТ-2, пиоглитазона, аналога рецепторов глюкагоноподобного пептида-1 (арГПП-1) или инсулина;
5) стеатоз >5% паренхимы печени при биопсии, выполненной исходно.
Критерии, исключающие участие в исследовании:
1) наличие тяжелых осложнений СД, включая тяжелую диабетическую нефропатию (скорость клубочковой фильтрации <30 мл/мин/1,73 м²) [16] и/или диабетическую ретинопатию более тяжелой стадии, чем простая диабетическая ретинопатия;
2) СД 1 типа (СД1);
3) тяжелое ССЗ в анамнезе, в том числе ишемическая болезнь сердца, хроническая сердечная недостаточность, инфаркт мозга и/или заболевания периферических сосудов;
4) наличие этиологических факторов, указывающих на другое заболевание печени, в частности регулярное употребление алкоголя (>30 г/сут и >210 г/нед. у мужчин и >20 г/сут и >140 г/нед. у женщин), наличие поверхностного антигена вируса гепатита В, антител к вирусу гепатита C, изменение концентрации гормонов щитовидной железы в сыворотке;
5) аутоиммунное заболевание печени, лекарственное токсическое поражение печени, гемохроматоз, болезнь Вильсона-Коновалова.
Протокол исследования был утвержден комитетами по этике клинических исследований каждого учреждения и Сертифицированным экспертным советом клиники Университета Саги в соответствии с принципами Хельсинкской декларации 1975 г. с поправками 2013 г., рекомендациями CONSORT 2010 г. и Законом Японии о клинических исследованиях. Краткое содержание протокола исследования и результаты зарегистрированы в регистре клинических исследований UMIN (UMIN000015727) и Японском регистре клинических исследований (jRCTs071180069). Все участники дали письменное информированное согласие.
Дизайн исследования
В ходе этого многоцентрового открытого РКИ сравнивали результаты применения в течение 72 недель ипраглифлозина в дозе 50 мг один раз в сутки (группа ИПР) с результатами контрольной группы (КОНТР), участники которой модифицировали образ жизни, включая диету и уровень физической нагрузки и/или принимали противодиабетические препараты, за исключением иНГЛТ-2, пиоглитазона и арГПП-1 (рис. 1). Рандомизация была выполнена таким образом, чтобы группы были сопоставимы по уровню HbA1c и индексу массы тела (ИМТ). После первой биопсии печени и на протяжении всего исследования пациенты продолжали антидиабетическую терапию, за исключением случаев с недостаточным гликемическим контролем, когда уровень HbA1c превышал 7,0%. В этих случаях допускалось применение дополнительного противодиабетического препарата, за исключением иНГЛТ-2, пиоглитазона и арГПП-1. В группе ИРП пациенты продолжали следовать диете, режиму физической активности и принимать препараты в течение всего периода исследования.
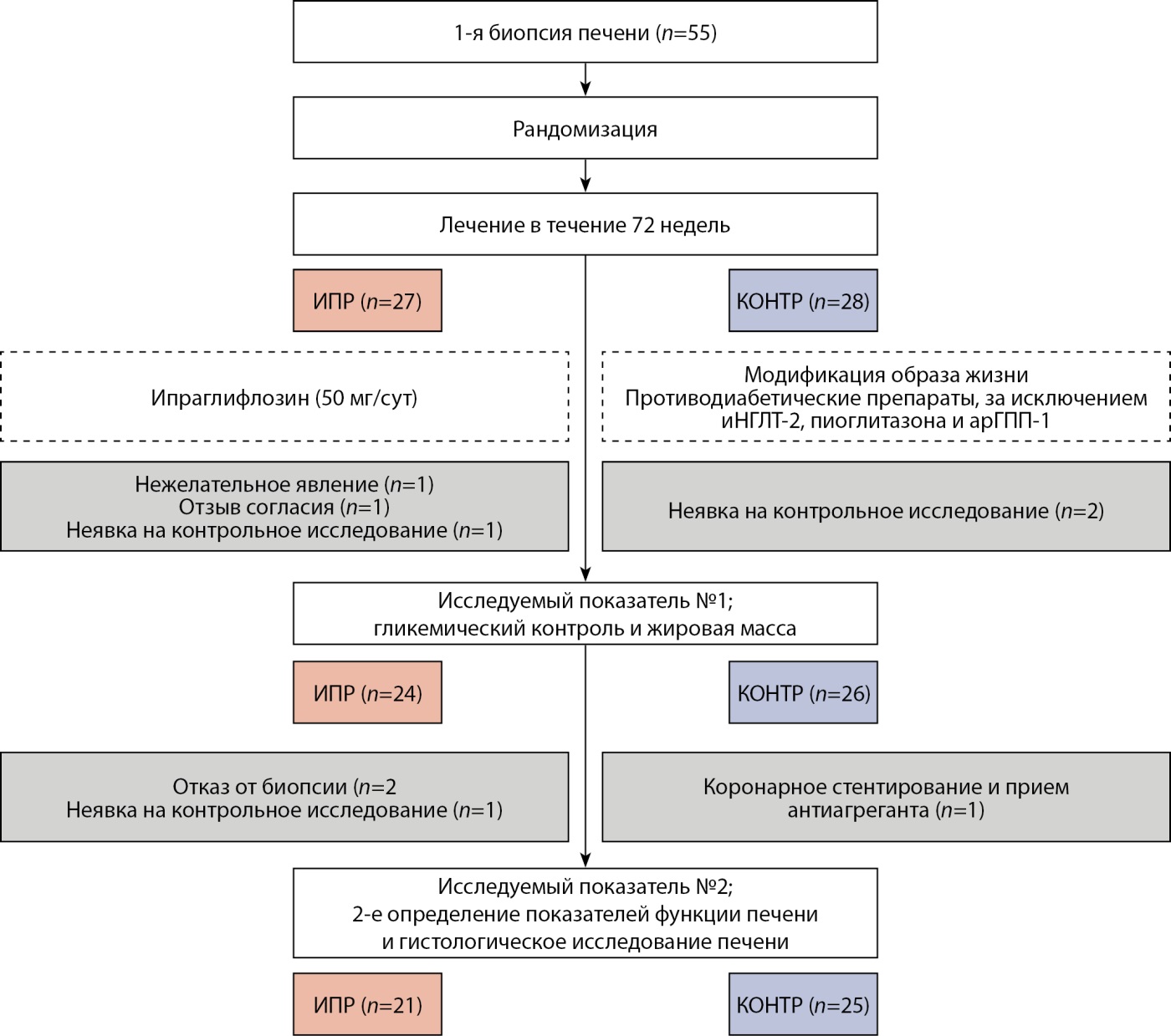
Рисунок 1. Блок-схема распределения участников исследования.
Примечение. ИПР — группа ипраглифлозина; КОНТР — группа контроля; иНГЛТ-2 — ингибитор натрий-глюкозного котранспортера-2; арГПП-1 — агонист рецепторов глюкагоноподобного пептида-1.
Исследуемым показателем №1 был гликемический контроль и показатели жировой массы, исследуемым показателем №2 было состояние печени (в том числе изменения морфологических показателей между первой и второй биопсиями). Из анализа показателя №1 были исключены 3 участника группы ИПР из-за развившегося рака желудка, который был зарегистрирован как нежелательное явление (НЯ) (см. подраздел «Безопасность»), отзыва информированного согласия и неявки на контрольное исследование, а также 2 участника контрольной группы из-за неявки на контрольные исследования. Из анализа показателя №2 были исключены 3 участника из группы ИПР из-за отказа от проведения биопсии печени или неявки на контрольные исследования, а также 1 участник из контрольной группы, который начал принимать антиагрегант после коронарного стентирования (см. подраздел «Безопасность»). Таким образом, показатель №1 удалось оценить у 24 участников в группе ИПР и у 26 участников контрольной группы, показатель №2 — у 21 участника в группе ИПР и у 25 участников контрольной группы. Безопасность вмешательств оценивали у всех участников.
Физикальное исследование и биохимические показатели сыворотки крови
В образцах венозной крови, взятых утром натощак, определяли уровень тромбоцитов, концентрацию глюкозы в плазме натощак, активность печеночных ферментов, общий билирубин, общий холестерин, холестерин липопротеинов высокой плотности (ЛПВП), холестерин липопротеинов низкой плотности (ЛПНП), триглицериды, креатинин, С-пептид, ферритин и HbA1c. Все анализы выполняли стандартными методами. Инсулинорезистентность оценивали с использованием гомеостатической модели (HOMA-IR) по формуле (инсулин натощак [МЕ/мл] x глюкоза крови натощак [мг/дл]/450) [17]. Домен 7s коллагена IV типа определяли с помощью изотопного иммунологического анализа [18]. Изомер гликозилирования Mac-2-связывающего белка (M2BPGi) определяли с помощью иммунологического анализа с использованием антител к гликанам [19]. Все лабораторные исследования проводили в лаборатории SRL Co. Ltd. (Токио, Япония). Площадь подкожного жира (см²) и площадь висцерального жира (см²) измеряли на уровне пупка по данным компьютерной томографии (КТ) с использованием программы Fat Scan (N2 System Co., Япония) [20].
Оценка морфологических изменений
Участникам исследования выполняли биопсию печени с использованием иглы 16G под ультразвуковым контролем. Все полученные биоптаты имели длину не менее 20 мм. Срезы биоптатов печени окрашивали гематоксилином и эозином, а также азаном по Гейденгайну. Препараты исследовали два опытных патологоанатома (M.K. и S.A.), специализирующихся на диагностике заболеваний печени. Клинические данные этим патологоанатомам не предоставляли, однако они были осведомлены о распределении участников в соответствующие группы. Оба специалиста параллельно исследовали каждый препарат, обсуждали оценку и согласовывали диагноз. На начальном этапе исследования патологоанатомы изучили все срезы для проверки соответствия критериям включения. На заключительном этапе все срезы были исследованы повторно без указания на их принадлежность к исходным или итоговым образцам. Стеатоз печени, лобулярное воспаление и баллонную дистрофию гепатоцитов оценивали по шкале активности НАЖБП (NAS) [21]. Фиброз печени классифицировали в соответствии с критериями Kleiner et al. [21] и Brunt et al. [22]. Распространенность стеатоза оценивали по четырехбалльной шкале от 0 до 3 (0 баллов — <5% площади биоптата; 1 балл — 5–33%; 2 балла — 34–66%; 3 балла — >66%). Выраженность фиброза оценивали по пятибалльной шкале от 0 до 4 (стадия 0 — отсутствие фиброза; стадия 1 — перисинусоидальный или перипортальный фиброз; стадия 2 — перисинусоидальный и портальный/перипортальный фиброз; стадия 3 — мостовидный фиброз; стадия 4 — цирроз). Диагноз НАЖБП устанавливали при распространенности стеатоза, соответствующей 1 баллу и выше. НАЖБП типа 3 или 4 рассматривали как НАСГ в соответствии с классификацией Маттеони [23]. В соответствии с рекомендациями Администрации США по контролю за пищевыми продуктами и лекарственными средствами (https://www.fda.gov/media/119044/download), разрешением НАСГ считали отсутствие стеатогепатита, 0–1 балл по шкале NAS для воспаления, 0 баллов для баллонной дистрофии и любое значение для стеатоза при условии отсутствия прогрессирования фиброза. НАЖБП 1 и 2 типов рассматривали как поражение печени без НАСГ. На основании этих критериев у 10 участников группы ИПР и 12 участников контрольной группы исходно был исключен НАСГ. Эти участники были включены в анализ исследуемого показателя №2. Случаи фиброза без баллонной дистрофии печени рассматривали как «неклассифицированную НАЖБП». К этой категории исходно были отнесены два участника (1 участник в группе ИПР с оценкой стеатоза 1 балл, воспалением 0, баллонной дистрофией 0, фиброзом 1‑й стадии; 1 участник в контрольной группе с оценкой стеатоза 1 балл, воспалением 0, баллонной дистрофией 0, фиброзом 2‑й стадии). Этих участников включили в анализ исследуемого показателя №2. У двух участников с циррозом, у которых ранее по данным биопсии ранее была диагностирована НАЖБП и которые наблюдались в учреждениях здравоохранения по месту жительства, имелась нулевая оценка стеатоза (так называемый «выгоревший» НАСГ). После подтверждения диагноза патологоанатомом, участвующим в исследовании, и руководителем исследования (K.A.), а также согласования с лечащим врачом и пациентом, этих участников включили в исследование.
Оценки безопасности
Данные по безопасности собирали на протяжении всего периода исследования — от момента рандомизации до 30 дней после завершения лечения. Для оценки использовали результаты лабораторных и физикальных исследований, а также данные о НЯ. НЯ и их тяжесть учитывали в соответствии с Общими терминологическими критериями нежелательных явлений (https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm).
Статистический анализ
Размер выборки для исследуемого показателя №1 был рассчитан на основе данных предыдущего исследования ипраглифлозина [24]. Предполагалось, что изменение уровня HbA1c относительно исходного состояния в группе ИПР составит –0,76±0,69%, а в контрольной группе — и 0±0,98%. При мощности 80% и двустороннем уровне значимости 0,05, расчетное число пациентов на группу составило n=21. Сравнение групп по исходным характеристикам проводили с использованием критерия хи-квадрат (для категориальных переменных) и t-критерия Крамера-Уэлча. С помощью t-критерия Крамера-Уэлча сравнивали изменения непрерывных данных относительно исходного уровня между группами, а также показатели биопсии печени при оценке исследуемого показателя №2. Для сравнения парных непрерывных данных использовали одновыборочный t-критерий. Для оценки изменений HbA1c за период исследования использовали модель смешанных эффектов с учетом исходных значений HbA1c, ИМТ и приема противодиабетических препаратов. Все статистические анализы выполняли с использованием языка R версии 3.6.1. Для анализа модели смешанных эффектов применяли пакет lmerTest 3.1-1. Различия считали статистически значимыми при двустороннем уровне значимости P<0,05.
РЕЗУЛЬТАТЫ
Демографические характеристики и исходные показатели
Исходные характеристики участников для оценки показателя №1 кратко представлены в табл. 1; все данные приведены в доп. табл. S1. Между группами не выявлено статистически значимых различий по возрасту, полу, ИМТ, а также наличию сопутствующих заболеваний, связанных с образом жизни. В контрольной группе уровень общего холестерина была выше, чем в группе ИПР, однако статистически значимых различий по уровням ЛПВП и ЛПНП не имелось. Также между группами не было статистически значимых различий по концентрации глюкозы натощак и уровню HbA1c. В исследовании участвовали пациенты с фиброзом печени разной стадии, однако статистически значимых различий между группами по этому показателю не было. Кроме того, группы не различались по площадям висцерального и абдоминального подкожного жира. Исходные характеристики для исследуемого показателя №2 представлены в доп. табл. S2; они аналогичны характеристикам для показателя №1. Лекарственные препараты, применявшиеся для лечения сопутствующих заболеваний, связанных с образом жизни, в частности СД, дислипидемии и артериальной гипертензии, перечислены в доп. табл. S3.
Таблица 1. Характеристики пациентов для исследуемого показателя №1
|
Характеристики |
ИПР |
КОНТР |
Уровень значимости Р |
|
n = 24 |
n = 26 |
||
|
Возраст, лет |
59,0 (46,8–64,3) |
50,0 (48,0–68,8) |
0,82 |
|
Мужчины, n (%) |
15 (62,5) |
14 (53,8) |
0,54 |
|
ИМТ, кг/м² |
29,9 (27,2–32,3) |
28,8 (25,7–32,9) |
0,85 |
|
Артериальная гипертензия, n (%) |
9 (37,5) |
7 (26,9) |
0,42 |
|
Дислипидемия, n (%) |
13 (54,2) |
19 (73,1) |
0,16 |
|
Уровень тромбоцитов, х10³/мкл |
19,6 (16,2–23,5) |
22,0 (18,6–27,1) |
0,29 |
|
АСТ, Ед/л |
43,5 (35,3–57,0) |
41,5 (33,0–75,5) |
0,17 |
|
АСТ, Ед/л |
57,0 (43,8–70,3) |
52,0 (38,3–99,0) |
0,60 |
|
ГГТ, Ед/л |
69,0 (39,5–112,5) |
55,5 (36,3–93,0) |
0,70 |
|
Глюкоза натощак, мг/дл |
115 (102–133) |
123 (113–142) |
0,10 |
|
HbA1c, % |
6,5 (6,1–7,1) |
6,8 (6,3–7,0) |
0,27 |
|
Ферритин, нг/мл |
256 (149–311) |
177 (100–346) |
0,57 |
|
Площадь висцерального жира, см² |
181 (162–234) |
176 (141,5–226) |
0,70 |
|
Площадь подкожного жира, см² |
238 (187–289) |
237 (169–311) |
0,78 |
Примечание: Непрерывные переменные представлены в виде медианы (нижний и верхний квартили). Полный перечень характеристик пациентов для оценки исследуемого показателя №2 представлен в доп. табл. S1. P-значения рассчитывали с использованием критерия хи-квадрат или t-критерия Крамера-Уэлча. ИПР — группа ипраглифлозина; КОНТР — группа контроля; ИМТ — индекс массы тела; АСТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ГГТ — гамма-глутамилтранспептидаза.
Влияние ипраглифлозина на жировую массу и гликемический контроль у пациентов с НАЖБП
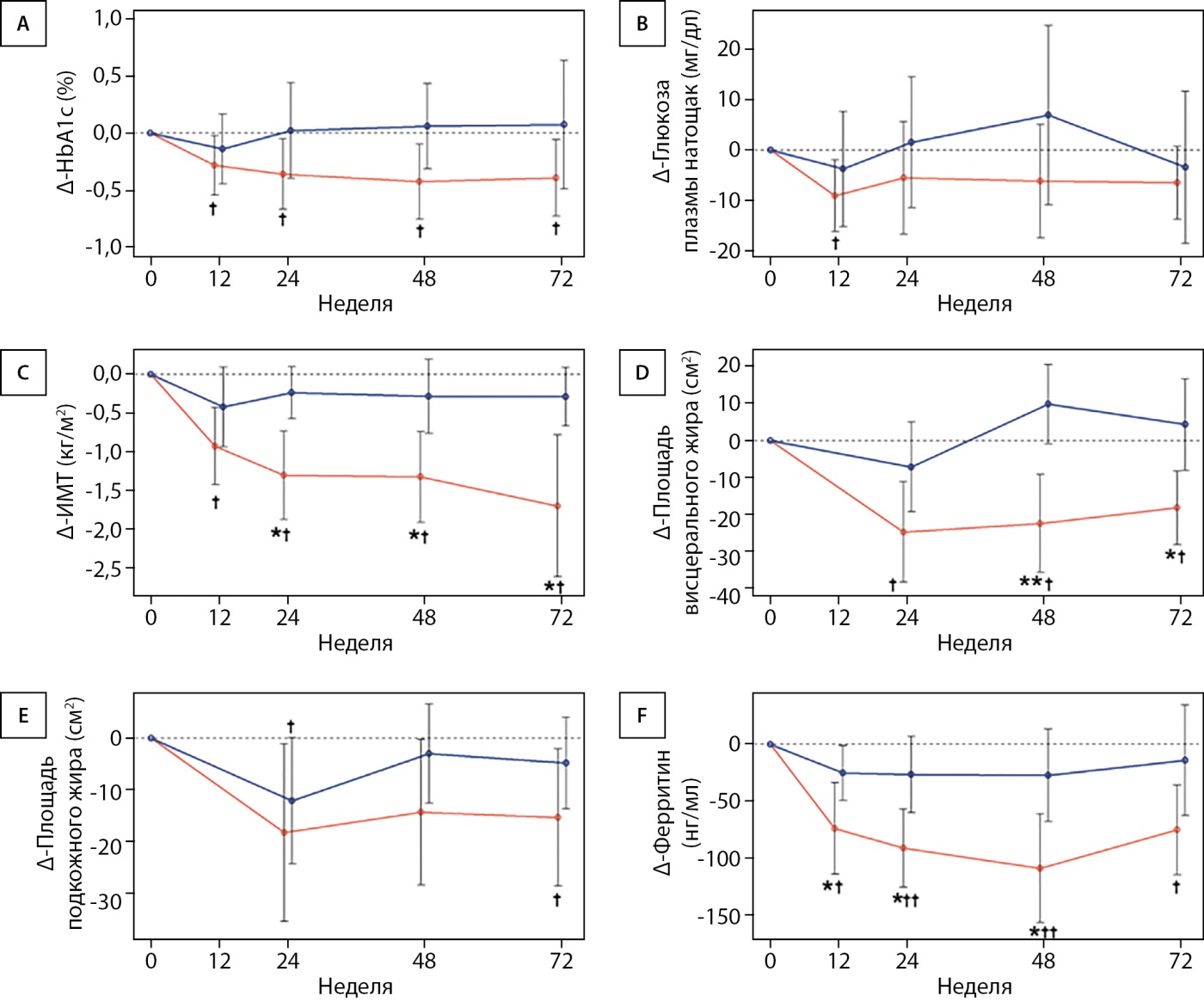
При анализе исследуемого показателя №1 группы сравнивали по изменению гликемического контроля, ИМП и площади жировой ткани относительно исходного уровня (рис. 2). В группе ИПР в ходе исследования отмечалось статистически значимое снижение HbA1c, тогда как в контрольной группе уровень HbA1c не изменился по сравнению с исходным состоянием (рис. 2А). Модель смешанных эффектов показала, что прием ипраглифлозина был статистически значимым фактором, ассоциированным со снижением концентрации HbA1c (логарифм отношения шансов = –0,311, Р=0,01), а единственным значимым корректирующим фактором был исходный уровень HbA1c (логарифм отношения шансов = 0,992, Р<0,01). В группе ИПР также установлено статистически значимое снижение концентрации глюкозы натощак спустя 12 нед., однако на этой временной точке статистически значимых различий между группами не было (рис. 2В). В группе ИПР наблюдалось статистически значимое снижение ИМТ, площади висцерального и подкожного жира (рис. 2С–E). Более того, в группе ИПР снижение ИМТ (через 24, 28 и 72 нед.) и площади висцерального жира (через 48 и 72 нед.) было статистически значимо больше, чем в контрольной группе. Следует отметить, что в группе ИПР также в большей степени снижалась концентрация ферритина в сыворотке в первые 12, 24 и 48 нед. исследования. Эти эффекты ипраглифлозина на гликемический контроль, жировой обмен и концентрацию ферритина также продемонстрированы в анализе исследуемого показателя №2 (доп. рис. S1).
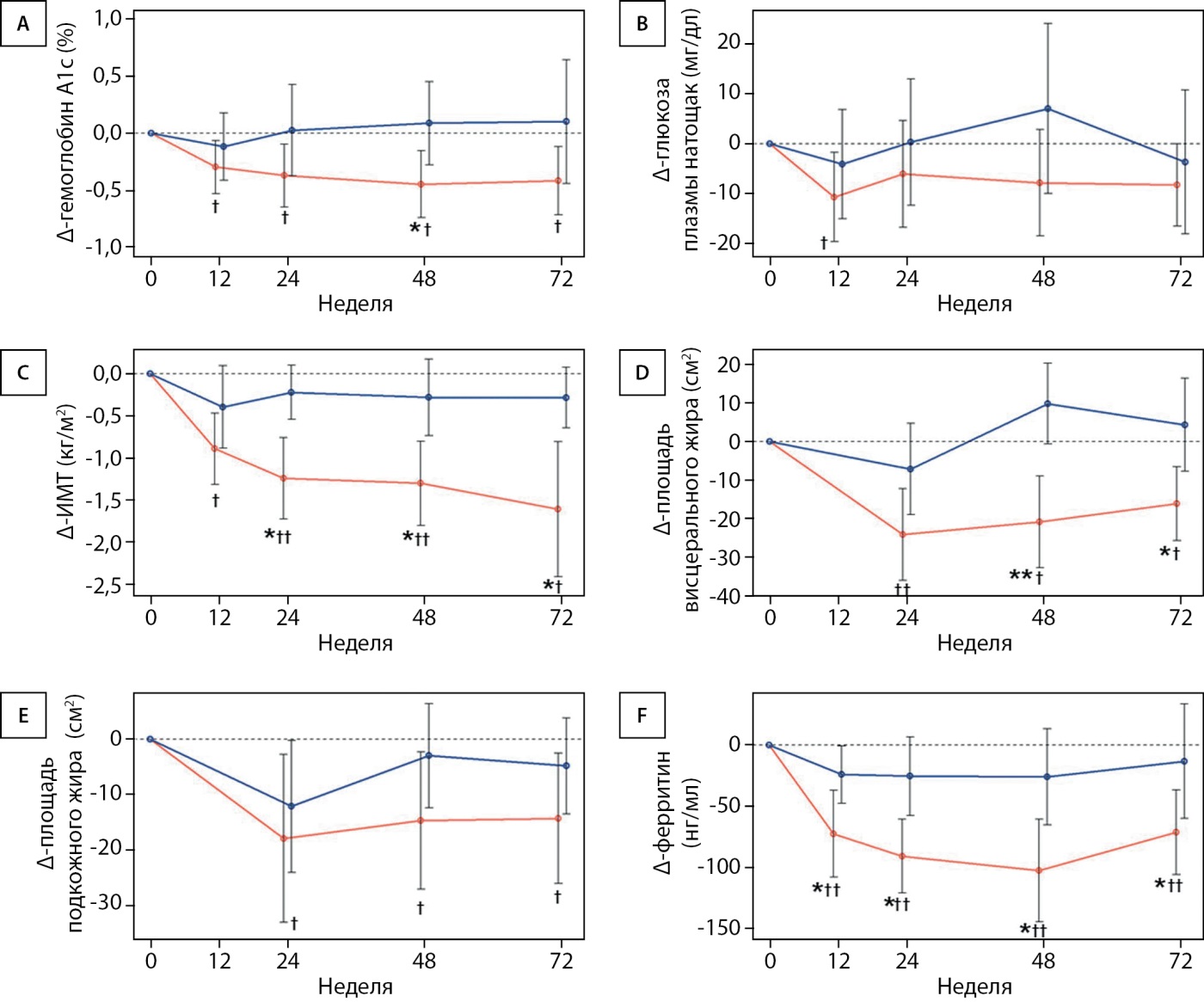
Рисунок 2. Изменения параметров, использованных для оценки показателя №1, относительно исходного состояния. Изображены средние изменения концентрации HbA1c (А), глюкозы плазмы натощак (В), ИМТ (С), площади висцерального жира (В), площади подкожного жира (Е) и концентрации ферритина в сыворотке (F) в группе ИПР (красная линия) и контрольной группе (синяя линия) относительно исходного уровня. Результаты представлены в виде среднего значения и стандартного отклонения.
*P<0,05 и **P<0,01 между группами по двухвыборочному t-критерию Крамера-Уэлча. †P<0,05 и ††P<0,01 относительно исходного уровня по одновыборочному t-критерию.
Влияние ипраглифлозина на патогенез НАЖБП
При анализе исследуемого показателя №2 оценивали изменения активности печеночных ферментов, сывороточных маркеров фиброза и патологических изменений печени. В группе ИПР активность аспартатаминотрансферазы (АСТ), АЛТ и гамма-глутамилтрансферазы (ГГТ) были статистически значимо ниже по сравнению с исходным уровнем, тогда как в контрольной группе изменения не были статистически значимыми (рис. 3А–С). Установлены статистически значимые различия между группами по изменению активности ГГТ через 24, 48 и 72 нед. исследования. Статистически значимой разницы в изменении концентрации общего билирубина между группами не установлено (рис. 3D). В отношении сывороточных маркеров фиброза статистически значимых различий изменений изомера Mac2-связывающего белка (M2BPGi) не обнаружено (рис. 3Е), но отмечено снижение содержания домена 7s коллагена IV типа — в группе ИПР через 24 и 72 нед. исследования, а также в контрольной группе через 48 нед., которое, однако, исчезло к 72 нед. (рис. 3F).
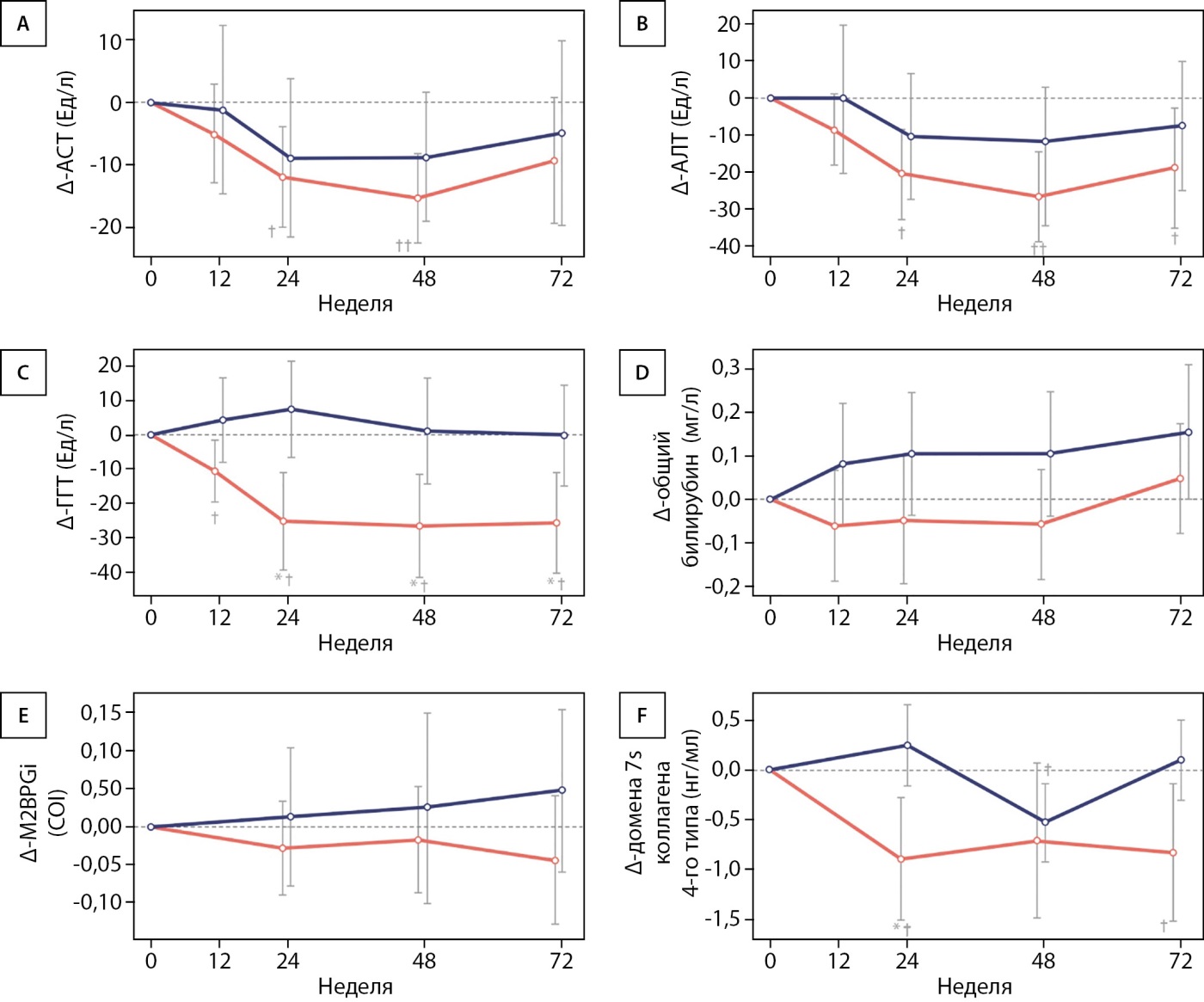
Рисунок 3. Изменения параметров, использованных для оценки показателя №2 относительно исходного уровня. Изображены средние изменения АСТ (А), АЛТ (В), ГГТ (С), общего билирубина (D), M2BPGi (Е) и домена 7s коллагена 4-го типа (F) в группе ИПР (красная линия) и контрольной группе (синяя линия) относительно исходного уровня. Результаты представлены в виде среднего значения и стандартного отклонения.
Примечание. АСТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; ГГТ — гамма-глутамилтранспептидаза; M2BPGi — изомер Mac2-связывающего белка.*P<0,05 и **P -<0,01 между группами по двухвыборочному t-критерию Крамера-Уэлча. †P<0,05 и ††P<0,01 относительно исходного уровня по одновыборочному t-критерию.
Изменения патоморфологических показателей
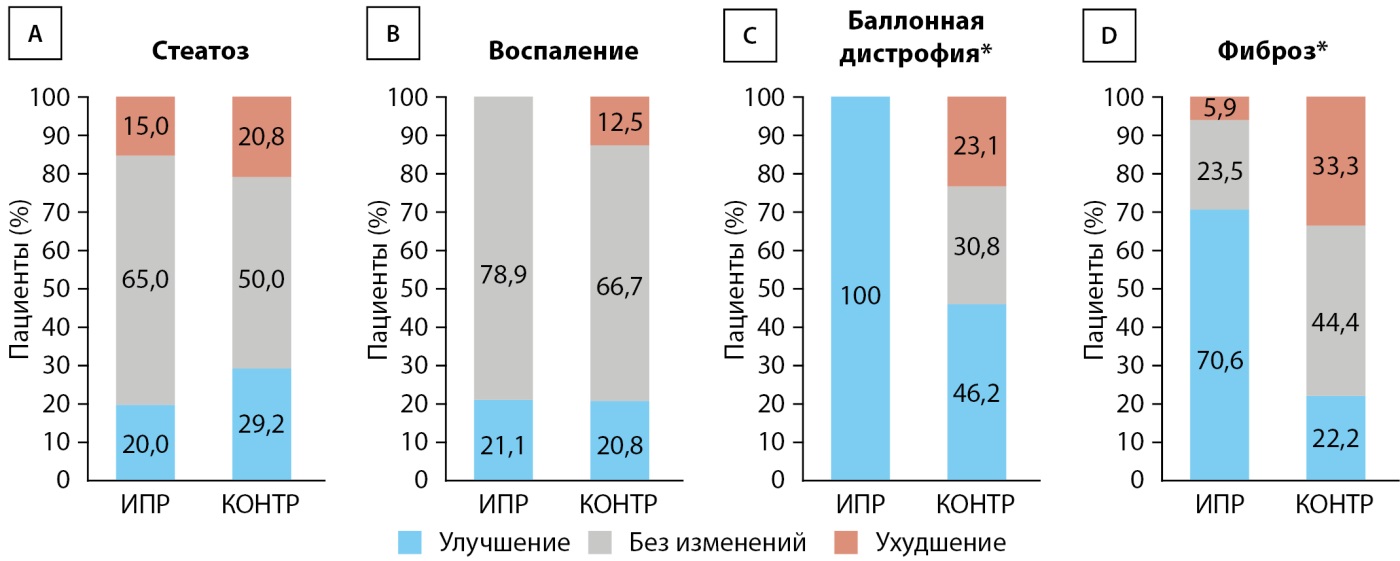
Изменения патоморфологических показателей отражены на рис. 4. В группе ИПР доля пациентов, у которых произошло уменьшение выраженности баллонной дистрофии хотя бы на один балл спустя 72 нед. лечения составила 52,4% (11 из 21), уменьшение хотя бы на одну стадию фиброза — 57,1% (12 из 21), что было статистически значимо больше, чем в контрольной группе (24% [ 6 из 25] для баллонной дистрофии, P=0,02; 16% [ 4 из 25] для фиброза, P=0,01) (рис. 4C, D). По степени стеатоза или воспаления статистически значимых различий между группами не установлено (рис. 4А, В). При анализе индивидуальных компонентов индекса NAS и стадии фиброза после исключения пациентов с баллом 0 или стадией 0 (доп. рис. S2) выраженность баллонной дистрофии у всех пациентов (11 из 11) в группе ИПР оказалась минимум на один балл ниже, в то время как в контрольной группе такое снижение установлено у 46,2% (6 из 13) участников (Р=0,02) (доп. рис. S2C). В группе ИПР у 70,6% (12 из 17) участников с фиброзом выше 1‑й стадии произошла регрессия фиброза минимум на одну стадию. В контрольной группе такое изменение установлено только у 22,2% (4 из 18) пациентов (Р=0,01) (доп. рис. S2D). Изменения каждого из компонентов шкалы оценки активности НАБЖП (NAS) и стадии фиброза представлены в доп. табл. S4. Соотношения между изменениями гликемического контроля или ИМТ и баллом баллонной дистрофии или стадией фиброза представлены на доп. рис. S3. Ни у одного из участников в группе ИПР с улучшением гликемического контроля или уменьшением ИМТ не наблюдалось ухудшения балла баллонной дистрофии или стадии фиброза, в то время как у нескольких участников контрольной группы эти морфологические изменения усугубились, несмотря на улучшение гликемического контроля и снижение ИМТ.
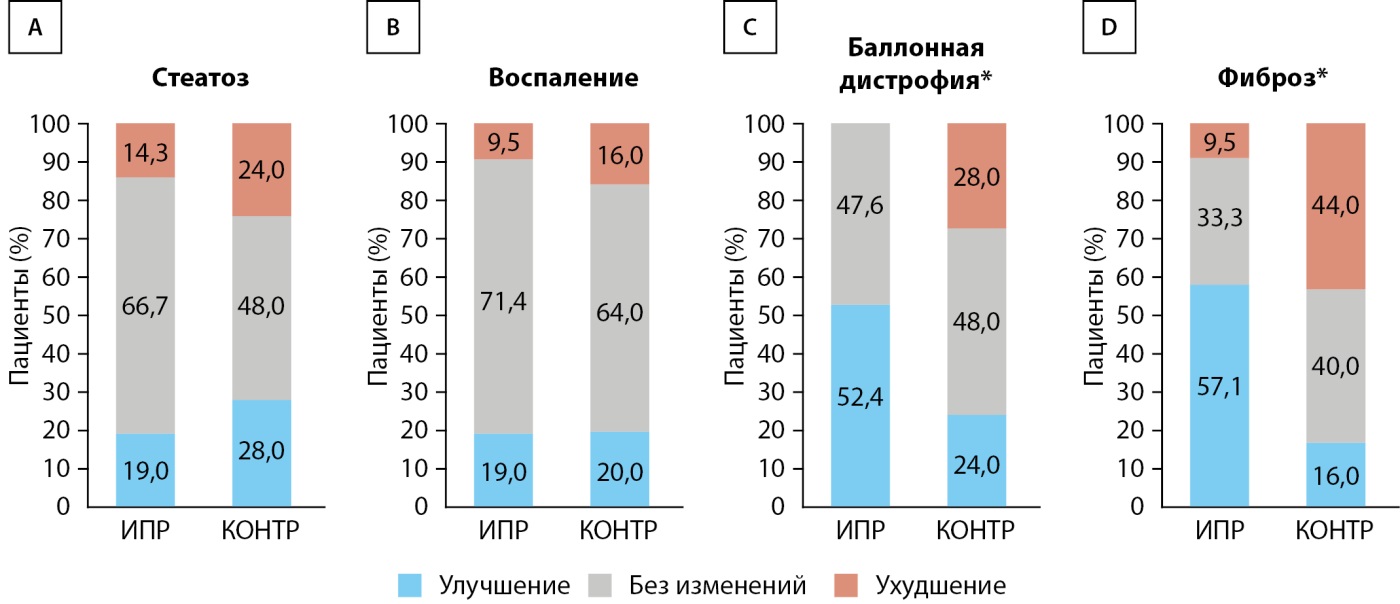
Рисунок 4. Результаты исследования биопсии печени. (А–D) Результаты патологоанатомического исследования биопсий всех участников для оценки показателя №2 (ИПР, n=21 vs. КОНТР, n=25).
Примечение. ИПР — группа ипраглифлозина; КОНТР — группа контроля.
*P<0,05 по двухвыборочному t-критерию Крамера-Уэлча.
Итоговые патоморфологические изменения, стратифицированные по наличию и отсутствию НАСГ на исходном уровне, представлены на рис. 5. В группе ИПР ни у одного из участников не развился НАСГ, тогда как в контрольной группе НАСГ развился у 33,3% пациентов.
Кроме того, в группе ИПР у 66,7% участников с НАСГ при исходном обследовании отмечена регрессия НАСГ без прогрессирования фиброза.
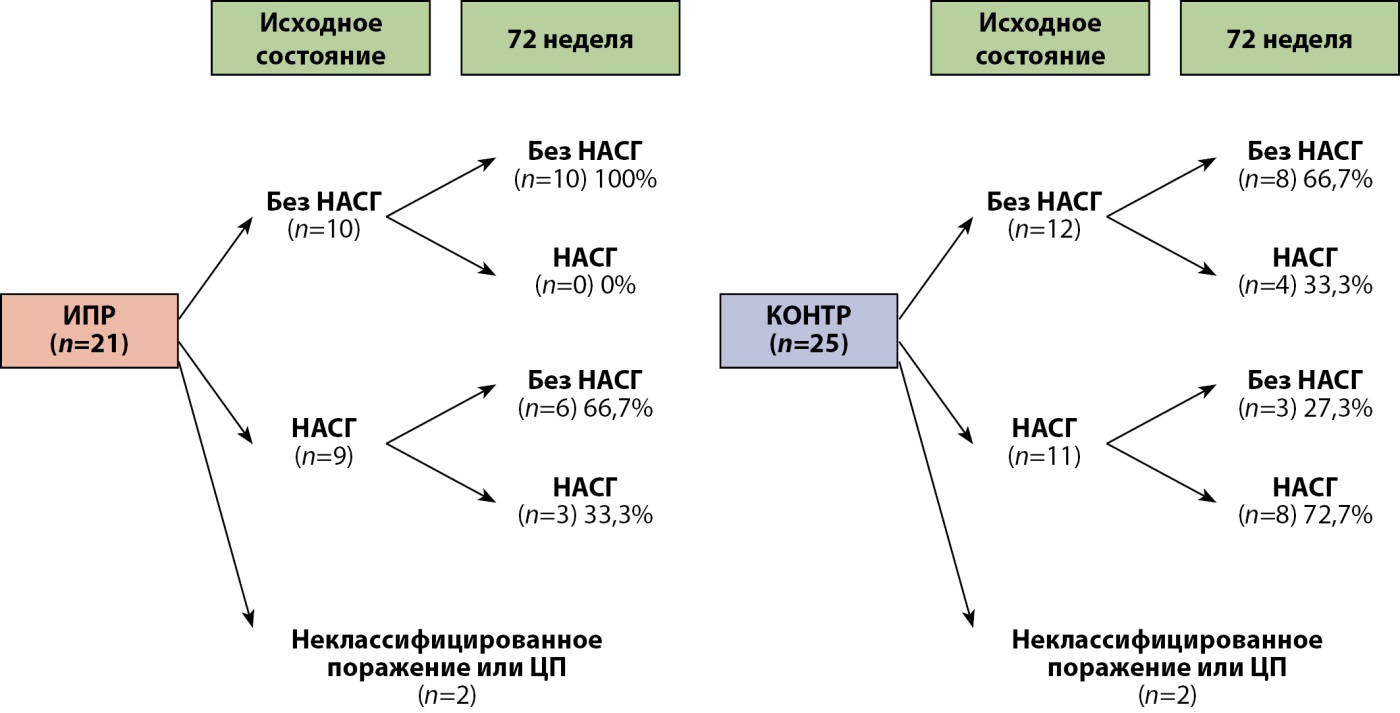
Рисунок 5. Итоговые патоморфологические изменения в группе ИПР и контрольной группе.
Примечание. ИПР — группа ипраглифлозина; КОНТР — группа контроля; ЦП — цирроз печени; НАСГ — неалкогольный стеатогепатит.
Безопасность
В табл. 2 представлена информация о безопасности проводимой терапии. НЯ зарегистрированы у 22,2% участников в группе ИПР и у 46,4% участников в контрольной группе. В большинстве случаев НЯ были легкой и умеренной степени. У одного пациента в группе ИПР в ходе эндоскопического исследования верхних отделов желудочно-кишечного тракта был диагностирован рак желудка, который зарегистрирован как серьезное НЯ. У одного участника в контрольной группе при проведении компьютерной томографии (КТ) коронарных артерий выявлен стеноз коронарной артерии, что потребовало проведения чрескожного коронарного стентирования. Ни у одного из участников не развились гипогликемия, лактатацидоз, застойная сердечная недостаточность или почечная недостаточность. У двух участников из группы ИПР отмечено учащенное мочеиспускание, хотя других признаков инфекции мочевыводящих путей, ни у кого из участников ни в одной группе не было выявлено. Изменения лабораторных показателей более 2‑й степени зарегистрированы только в контрольной группе: у трех участников наблюдалось повышение уровня HbA1c, двоим из них потребовалось назначение дополнительного противодиабетического препарата.
Таблица 2. Зарегистрированные нежелательные явления, n (%)
|
ИПР (n=27) |
КТР (n=28) |
|
|
n (%) |
n (%) |
|
|
Серьезные НЯ |
||
|
Рак желудка (3-я степень тяжести) |
1 (3,7) |
0 (0) |
|
Бессимптомный коронаростеноз (2-я степень тяжести) |
0 (0) |
1 (3,6) |
|
Частые НЯ |
||
|
Запор |
1 (3,7) |
1 (3,6) |
|
Вздутие живота |
0 (0) |
1 (3,6) |
|
Неприятные ощущения в животе |
0 (0) |
2 (7,1) |
|
Частое мочеиспускание |
2 (8) |
0 (0) |
|
Мышечные судороги |
0 (0) |
1 (3,6) |
|
Остеоартрит коленного сустава |
1 (3,7) |
0 (0) |
|
Сыпь в области промежности |
1 (3,7) |
0 (0) |
|
Зуд в области спины |
0 (0) |
1 (3,6) |
|
Пациенты с изменением лабораторных показателей выше 2‑й степени тяжести |
||
|
Повышение HbA1c |
0 (0) |
3 (10,7)* |
|
Повышение мочевой кислоты |
0 (0) |
1 (3,6) |
|
Всего |
||
|
Серьезные НЯ |
1 (3,7) |
1 (3,6) |
|
Общеизвестные НЯ |
5 (18,5) |
8 (30,8) |
|
Пациенты с изменением лабораторных показателей выше 2‑й степени тяжести |
0 (0) |
4 (14,3) |
|
Все НЯ |
6 (22,2) |
13 (46,4) |
*Зарегистрировано как обострение основного заболевания.
ОБСУЖДЕНИЕ
В этом многоцентровом открытом РКИ лечение пациентов с СД2 в сочетании с НАЖБП ипраглифлозином в течение 72 нед. сопровождалось улучшением гликемического контроля, снижением жировой массы и улучшением состояния печени, включая регрессию фиброза. Кроме того, ипраглифлозин уменьшал выраженность баллонной дистрофии и способствовал регрессии либо предотвращению развития НАСГ у значительной части пациентов. В период лечения ипраглифлозином зарегистрировано одно тяжелое НЯ (рак желудка), однако, судя по данным предыдущих исследований ипраглифлозина и других иНГЛТ-2 [10–12][24–26], это НЯ не связано с лечением, что подтверждает безопасность применения ипраглифлозина у пациентов с СД2 в сочетании с НАЖБП.
Несмотря на многочисленные данные о влиянии иНГЛТ-2 на печень при НАЖБП, контролируемых исследований, в которых оценивали бы морфологию и функцию печени, не проводилось. Следует отметить, что в ряде предыдущих исследований отсутствовала контрольная группа. В неконтролируемом открытом исследовании Akuta et al. с участием 9 пациентов с НАЖБП лечение канаглифлозином в течение 24 недель сопровождалось регрессией стеатоза печени (78%), воспаления (33%), баллонной дистрофии гепатоцитов (22%) и фиброза (33%), а также нормализацией функциональных проб печени и улучшением гликемического контроля [15]. Изменения активности печеночных ферментов служили основными исследуемыми показателями в большинстве клинических исследований с применением иНГЛТ-2 у пациентов с НАЖБП. В одном из недавних метаанализов показано снижение активности АСТ, АЛТ и ГГТ у 6475 пациентов с НАЖБП, получавших канаглифлозин в течение 26–52 нед. [27]. Кроме того, применение других иНГЛТ-2 (дапаглифлозина, эмпаглифлозина или ипраглифлозина) также ассоциировалось со снижением активности печеночных ферментов [28][29]. Применение методов визуализации, в частности КТ и протонной магнитно-резонансной спектроскопии, подтвердило влияние иНГЛТ-2 на выраженность стеатоза у пациентов с НАЖБП. Лечение дапаглифлозином [30] или лузеоглифлозином [31] в течение 24 нед. сопровождалось статистически значимым снижением выраженности стеатоза печени, оцениваемому по соотношению плотности печени к плотности селезенки на КТ. В ходе одного плацебо-контролируемого исследования с использованием для оценки стеатоза печени протонной магнитно-резонансной спектроскопии спустя 24 нед. лечения канаглифлозином отмечалось снижение внутрипеченочных запасов триглицеридов у пациентов с НАЖБП в сочетании с СД2 [32]. В настоящем исследовании также установлено статистически значимое снижение активности печеночных ферментов в группе ИПР, однако различий по степени изменений стеатоза между группами не выявлено. Это может быть связано с восстановлением запаса липидов в течение более длительного периода исследования, по сравнению с ранее проведенными исследованиями.
Также мы установили, что площадь висцерального жира, измеренная по КТ, была больше через 24 нед. лечения (рис. 2D и доп. рис. S1D). Имеются данные о том, что иНГЛТ-2 повышают аппетит у грызунов и изменяют их пищевые предпочтения, а также то, что пациенты, принимающие дапаглифлозин для лечения СД2, употребляют больше сахара [33][34]. Таким образом, не исключено, что участники в группе ИПР употребляли больше пищи, что привело к повторному набору висцерального жира к временной точке 24 нед. Это может означать, что мы пропустили лучшую временную точку для обнаружения регрессии стеатоза печени, которая могла находиться между 24 и 48 нед. Однако настоящее исследование продемонстрировало регрессию фиброза печени в результате лечения иНГЛТ-2, что является единственным морфологическим признаком, ассоциированным с прогнозом НАЖБП [8][9], однако мы не знаем, сохраняется ли это влияние дольше 72 недель и улучшает ли применение иНГЛТ-2 прогноз НАЖБП. Для ответа на эти вопросы требуются дальнейшие исследования.
Механизм улучшения показателей фиброза печени, индуцированного ипраглифлозином в этом исследовании, пока неясен. Тем не менее, улучшение гликемического контроля и снижение ИМТ, ассоциированные с приемом иНГЛТ-2 в настоящем и предыдущих исследованиях [14][15][32], могут способствовать регрессии стеатоза печени. Снижение концентрации HbA1c и ИМТ согласуется со снижением внутрипеченочного содержания триглицеридов на фоне приема лусеоглифлозина или канаглифлозина у пациентов с НАЖБП в сочетании с СД2 [32][35]. Вместе с тем, имеются данные, указывающие на то, что иНГЛТ-2 уменьшают фиброз печени у грызунов, а также стеатоз у грызунов и людей, независимо от снижения массы тела [36][37]. Это указывает на возможное существование механизма благоприятного влияния иНГЛТ-2 на состояние печени при НАЖБП, который не зависит от изменений жировой массы. В данном исследовании не было установлено, оказывал ли иНГЛТ-2 независимое влияние на патоморфологические изменения. Это связано с небольшим количеством участников, особенно в группе ИПР, у которых наблюдалось повышение уровня HbA1c и увеличение ИМТ (доп. рис. S3). Вместе с тем, следует отметить, что в группе ИПР уменьшение выраженности баллонной дистрофии гепатоцитов и фиброза печени отмечено у нескольких пациентов с ухудшением гликемического контроля и повышением ИМТ. Эти данные позволяют предположить, что влияние длительной терапии иНГЛТ-2 на баллонную дистрофию и фиброз более выражено, когда происходит снижение уровня HbA1c и массы тела, однако улучшение этих метаболических показателей не обязательно. иНГЛТ-2 повышают продукцию глюкозы в печени, стимулируя глюконеогенез и гликогенолиз [38] в ответ на увеличение выделения глюкозы почками и за счет прямого стимулирования выделения глюкагона альфа-клетками островков поджелудочной железы [39]. Кроме того, в одном из недавних исследований установлено, что глюкагон стимулирует липолиз в печени и активирует печеночные митохондрии через стимуляцию рецептора инозитолтрифосфата 1 — мембранного гликопротеинового комплекса, ответственного за кальциевый сигнальный путь в митохондриях гепатоцитов [40]. Также в экспериментах на грызунах продемонстрирована стимуляция β-окисления в печени под влиянием иНГЛТ-2 [41]. Это может оказаться ключевым глюкагон-опосредованным механизмом влияния иНГЛТ-2 на печень. В настоящее время продолжается несколько клинических исследований, направленных на оценку применения комбинации агонистов глюкагоновых рецепторов и агонистов рецепторов глюкагоноподобного пептида-1 или двойных агонистов этих рецепторов. Результаты доклинических исследований свидетельствуют о положительном влиянии этих препаратов на фиброз печени [42][43]. Таким образом, глюкагон-опосредованные эффекты иНГЛТ-2 могут способствовать их положительному влиянию на фиброз печени, а также на метаболические нарушения.
Регрессия баллонной дистрофии гепатоцитов под влиянием ипраглифлозина — еще один значимый результат данного исследования. Баллонная дистрофия представляет собой дегенеративные изменения в клетках печени, предшествующие их апоптозу. Она возникает на фоне метаболических нарушений, воспаления и расстройств кровообращения [44]. Баллонная дистрофия считается характерным признаком НАСГ, но в то же время она часто развивается и при других заболеваниях печени [22][45]. Установлено, что иНГЛТ-2 подавляют оксидативный стресс, стресс эндоплазматического ретикулума и сигнальные пути, ассоциированные с гипоксией. Это замедляет гибель и апоптоз клеток проксимальных канальцев почек in vitro и in vivo [46–48]. Однако, поскольку НГЛТ-2 не экспрессируются в гепатоцитах, регрессия баллонной дистрофии гепатоцитов, скорее всего, обусловлена непрямыми эффектами иНГЛТ-2. У пациентов с НАСГ часто имеет место перегрузка железом и гиперферритинемия [49]. У мышей с дефицитом рецепторов лептина перегрузка железом сопровождается оксидативным стрессом и активацией инфламмасом, что приводит к баллонной дистрофии гепатоцитов [50]. В нашем исследовании у пациентов из группы ИПР отмечено статистически значимое снижение концентрации ферритина в сыворотке (рис. 2F). Это позволяет предположить, что регрессия баллонной дистрофии гепатоцитов при НАЖБП на фоне лечения иНГЛТ-2 может быть обусловлена уменьшением перегрузки железом.
У нашего исследования есть несколько недостатков. Размер выборки, рассчитанный для оценки показателя №1, был слишком мал, чтобы подтвердить более выраженную эффективность ипраглифлозина в отношении регрессии НАСГ и фиброза по сравнению с контрольной группой. Таким образом, для подтверждения влияния ипраглифлозина или иНГЛТ-2 на состояние печени у пациентов с НАЖБП необходимы дополнительные исследования. Поскольку исследование не было плацебо-контролируемым и предусматривало использование активного контроля с различными вариантами лечения, в контрольной группе оцениваемые показатели могли оказаться достаточно вариабельными, что вполне могло повлиять на качество сравнения с группой ИПР. Несмотря на рандомизацию, группы на исходном уровне статистически значимо различались по концентрации общего холестерина в сыворотке для исследуемых показателей №1 и №2, а также по уровню глюкозы натощак для исследуемого показателя №2. Эти различия могли повлиять на оценку эффектов лечения в обеих группах. Поскольку критерии включения не ограничивали выбор участников только пациентами с тяжелой НАЖБП, в исследовании участвовали также пациенты с умеренной и легкой формой НАЖБП, в связи с чем эффективность ипраглифлозина следует интерпретировать осмотрительно. С другой стороны, участие пациентов с разной тяжестью НАЖБП позволило нам установить, что ипраглифлозин способен предотвращать развитие НАСГ, а также вызывать регрессию НАСГ и улучшать состояние печени при фиброзе. На основании этих данных мы полагаем, что ипраглифлозин может оказывать благоприятное действие у пациентов с разной степенью НАЖБП.
Таким образом, результаты данного РКИ подтверждают эффективность ипраглифлозина в уменьшении жировой массы и улучшении состояния печени, включая регрессию фиброза, у пациентов с СД2 в сочетании с НАЖБП. Препараты группы иНГЛТ-2 могут быть использованы для лечения пациентов с НАЖБП. Для подтверждения эффектов иНГЛТ-2 у пациентов с различными стадиями НАЖБП необходимы более крупные исследования III фазы.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Возможные конфликты интересов: Д‑р Anzai является членом спикер-бюро и получал гранты от компаний Daiichi Sankyo, Sumitomo Dainippon Pharma, Mitsubishi Tanabe Pharma, Novo Nordisk Pharma. Он является членом спикер-бюро компаний Kyowa Kirin, Sanofi K.K., Takeda Pharmaceutical. Также он получал гранты от компании Astellas Pharma, японской сети IDDM, компаний Taisho Pharma и Kracie Holdings. Д‑р Nakajima является членом спикер-бюро и получал гранты от компаний EA Pharma, Kowa, Mylan EPD. Также он является членом спикер-бюро компаний Astellas Pharma, MSD, Sumitomo Dainippon Pharma. Он получал гранты от компании Biofermin. Д‑р Yoneda получал гранты от компании Kowa.
Информация о спонсорстве: Исследование выполнено при поддержке Astellas Pharma Inc.
Регистрационные номера клинических исследований: UMIN000015727 и jRCTs071180069.
Благодарности. Авторы выражают благодарность г‑же Maki Miyahara, г‑же Kiyoka Yasunaga, г‑же Saori Fuchigami, г‑же Chieko Ogawa, а также медицинскому и техническому персоналу исследовательских центров за помощь в сборе клинических данных. Также авторы благодарят Mark Cleasby, Ph.D из Edanz Group (https://en-author-services. edanz.com/ac) за редактирование рукописи данной статьи.
ИНФОРМАЦИЯ О СТАТЬЕ
Эта статья доступна онлайн на веб-сайте wileyonlinelibrary.com.
DOI 10.1002/hep4.1696
Получена 8 октября 2020 г.; принята в печать 18 января 2021 г.
Дополнительные материалы к статье размещены онлайн по адресу onlinelibrary.wiley.com/doi/10.1002/hep4.1696/suppinfo.
© 2021 Авторы. Журнал «Hepatology Communications» издается компанией Wiley Periodicals LLC от имени Американской ассоциации по изучению болезней печени. Это статья открытого доступа, распространяемая под лицензией Creative Commons Attribution-NonCommercial-NoDerivs («С указанием авторства — Некоммерческая — Без производных». Лицензия позволяет использовать и распространять материал в любом формате при условии правильного цитирования оригинальной работы, только в некоммерческих целях, без изменений и адаптаций).
Перевод и печать на русском языке выполнены с официального разрешения правообладателя. Оригинальная статья: Ipragliflozin Improves the Hepatic Outcomes of Patients With Diabetes with NAFLD (Takahashi, H., Kessoku, T., Kawanaka, M., et al.) Hepatol Commun, 6: 120-132. https://doi.org/10.1002/hep4.1696.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Дополнительная таблица 1. Характеристики участников для исследуемого показателя 1
|
ИПР n=21 |
КОНТР n=25 |
Значение P |
Значение P |
|||
|
Исходно |
72 неделя |
Исходно |
72 неделя |
Исходно |
72 неделя |
|
|
Клинические характеристики |
||||||
|
Возраст, лет |
59.0 (46.8-64.3) |
- |
50.0 (48.0-68.8) |
- |
0.82 |
- |
|
Мужской пол, n (%) |
15 (62.5) |
- |
14 (53.8) |
- |
0.54 |
- |
|
Масса тела, кг |
81.8 (71.7-88.8) |
74.7 (69.1-84.6) |
75.8 (62.4-84.8) |
74.9 (63.5-83.3) |
0.53 |
0.93 |
|
ИМТ, кг/м² |
29.9 (27.2-32.3) |
28.7 (24.3-30.2) |
28.8 (25.7-32.9) |
29.8 (25.2-32.3) |
0.85 |
0.26 |
|
Гипертензия, n (%) |
9 (37.5) |
- |
7 (26.9) |
- |
0.42 |
- |
|
Дислипидемия, n (%) |
13 (54.2) |
- |
19 (73.1) |
- |
0.16 |
- |
|
Лабораторные анализы |
||||||
|
Тромбоциты, ×10³/мкл |
19.6 (16.2-23.5) |
19.8 (14.6-24.5) |
22.0 (18.6-27.1) |
21.2 (18.6-25.1) |
0.29 |
0.32 |
|
АСТ, Ед/л |
44 (35-57) |
34 (25-49) |
42 (33-76) |
47 (28-65) |
0.17 |
0.07 |
|
АЛТ, Ед/л |
57 (44-70) |
44.0 (29-53) |
52.0 (38-99) |
51.5 (37-80) |
0.60 |
0.12 |
|
ГГТ, Ед/л |
69 (40-113) |
52 (32-64) |
56 (36-93) |
53 (36-76) |
0.70 |
0.23 |
|
Общий билирубин, мг/дл |
0.9 (0.7-1.1) |
0.9 (0.9-1.30) |
0.8 (0.6-1.0) |
0.9 (0.6-1.1) |
0.07 |
0.42 |
|
Альбумин, г/дл |
4.4 (4.3-4.6) |
4.3 (4.0-4.6) |
4.3 (4.1-4.6) |
4.3 (3.9-4.6) |
0.29 |
0.99 |
|
Общий холестерин, мг/дл |
179 (164-199) |
187 (169-202) |
199 (184-220) |
191 (169-223) |
0.03 |
0.77 |
|
Х-ЛПВП, мг/дл |
55.0 (46.0-64.0) |
53 (48-57) |
50 (43.0-55.8) |
47 (43.5-55.8) |
0.05 |
0.05 |
|
Х-ЛПНП, мг/дл |
113 (88-128) |
117 (100-134) |
123 (100-143) |
114 (105-136) |
0.14 |
0.62 |
|
Триглицериды, мг/дл |
120 (97-158) |
118 (91-176) |
138 (110-171) |
157 (118-196) |
0.15 |
0.10 |
|
Глюкоза натощак, мг/дл |
115 (102-133) |
111 (103-120) |
123 (113-142) |
126 (112-140) |
0.10 |
0.04 |
|
HbA1c, % |
6.5 (6.1-7.1) |
6.0 (5.9-6.3) |
6.8 (6.3-7.0) |
6.6 (6.3-7.5) |
0.27 |
< 0.01 |
|
Инсулин натощак, мкЕд/мл |
15.8 (14.6-20.3) |
11.9 (8.2-18.4) |
22.7 (16.0-28.2) |
17.8 (14.2-28.8) |
0.86 |
0.02 |
|
HOMA-IR |
5.1 (3.7-6.1) |
2.8 (2.3-5.4) |
6.6 (4.5-9.6) |
6.3 (3.8-9.5) |
0.53 |
0.01 |
|
С-пептид, мг/дл |
3.3 (2.7-4.1) |
2.9 (2.5-3.6) |
3.8 (2.9-5.1) |
3.3 (2.7-5.0) |
0.48 |
0.04 |
|
Креатинин, мг/дл |
0.79 (0.64-0.93) |
0.74 (0.58-0.90) |
0.77 (0.67-0.92) |
0.74 (0.65-0.91) |
0.63 |
0.90 |
|
Ферритин, нг/мл |
256 (149-311) |
160 (102-246) |
177 (100-346) |
175 (105-268) |
0.57 |
0.39 |
|
Домен 7s коллагена IV типа, нг/мл |
4.5 (4.1-6.5) |
4.5 (3.7-5.9) |
5.1 (4.6-6.0) |
4.5 (3.4-5.1) |
0.88 |
0.10 |
|
M2BPGi, C.O.I |
0.70 (0.44-0.93) |
0.65 (0.50-1.03) |
0.90 (0.65-1.27) |
0.78 (0.64-1.30) |
0.09 |
0.04 |
|
Анализ визуальных методов исследования |
||||||
|
Площадь висцерального жира, см² |
181 (162-234) |
191 (133-224) |
176 (142-226) |
178 (128-235) |
0.70 |
0.58 |
|
Площадь подкожно-жировой клетчатки, см² |
238 (187-289) |
217 (163-278) |
237 (169-311) |
237 (153-307) |
0.78 |
0.46 |
|
Результаты гистологического исследования |
||||||
|
Оценка стеатоза (0/1/2/3), n |
1/15/4/4 |
- |
1/14/10/1 |
- |
0.23 |
- |
|
Оценка воспаления (0/1/2/3), n |
2/20/2/0 |
- |
1/21/4/0 |
- |
0.62 |
- |
|
Оценка баллонной дистрофии (0/1/2), n |
13/6/5 |
- |
13/7/6 |
- |
0.96 |
- |
|
НАС общая оценка |
3 (2-4) |
- |
3 (2-4) |
- |
0.70 |
- |
|
НАС (<4/≥4) |
15/9 |
- |
15/11 |
- |
0.73 |
- |
|
Стадия фиброза (0/1/2/3/4), n |
4/9/4/6/1 |
- |
7/12/4/2/1 |
- |
0.53 |
- |
Непрерывные переменные представлены в виде медианы (нижнего и верхнего квантилей). Значения P получены с помощью t-критерия Уэлча и критерия хи-квадрат при сравнении ИПР и КОНТР исходно и через 72 недели.
Сокращения: ИПР — группа ипраглифлозина; КОНТР — контрольная группа; ИМТ — индекс массы тела; АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; ГГТ — γ-глутамилтранспептидаза; Х-ЛПВП, холестерин липопротеинов высокой плотности; Х-ЛПНП — холестерин липопротеинов низкой плотности; HbA1c — гемоглобин A1c; M2BPGi — изомер гликозилирования Mac-2-связывающего белка; HOMA-IR — оценка инсулинорезистентности с помощью гомеостатической модели; НАС — оценка активности неалкогольной жировой болезни печени.
Дополнительная таблица 2. Характеристики участников для исследуемого показателя 2
|
ИПР n=21 |
КОНТР n=25 |
Значение P |
Значение P |
|||
|
Исходно |
72 неделя |
Исходно |
72 неделя |
Исходно |
72 неделя |
|
|
Клинические характеристики |
||||||
|
Возраст, лет |
55.0 (47.0-65.0) |
- |
50.0 (48.0-69.0) |
- |
0.87 |
- |
|
Мужской пол, n (%) |
14 (66.7) |
- |
13 (52.0) |
- |
0.31 |
- |
|
Масса тела, кг |
81.7 (71.7-87.6) |
74.7 (69.1- 83.0) |
76.0 (62.0-86.7) |
75.00 (62.4-83.8) |
0.63 |
0.99 |
|
ИМТ, кг/м² |
29.3 (27.1-31.4) |
28.4 (24.3-29.5) |
28.6 (25.6-33.1) |
29.5 (25.1-32.4) |
0.92 |
0.25 |
|
Гипертензия, n (%) |
8 (38.1) |
- |
6 (30.0) |
- |
0.30 |
- |
|
Дислипидемия, n (%) |
11 (52.4) |
- |
18 (72.0) |
- |
0.17 |
- |
|
Лабораторные анализы |
||||||
|
Тромбоциты, ×10³/мкл |
21.1 (16.8-24.8) |
19 (14.6-24.9) |
21.8 (18.5-26.9) |
21.3 (18.6-25.1) |
0.57 |
0.34 |
|
АСТ, Ед/л |
43 (33-57) |
33 (23-48) |
40 (33-74) |
47 (27-65) |
0.25 |
0.06 |
|
АЛТ, Ед/л |
57 (43-70) |
42 (29-53) |
51 (38-99) |
53 (36-81) |
0.53 |
0.06 |
|
ГГТ, Ед/л |
68 (38-114) |
50 (30-63) |
54 (36-87) |
52 (36-72) |
0.49 |
0.47 |
|
Общий билирубин, мг/дл |
1.0 (0.7-1.1) |
1.0 (0.88-1.33) |
0.8 (0.6-1.0) |
0.9 (0.6-1.1) |
0.08 |
0.50 |
|
Альбумин, г/дл |
4.4 (4.3-4.6) |
4.3 (3.9-4.5) |
4.3 (4.1-4.6) |
4.3 (4.0-4.6) |
0.38 |
0.58 |
|
Общий холестерин, мг/дл |
179 (165-194) |
185 (167-201) |
200 (183-220) |
191 (173-224) |
0.03 |
0.16 |
|
Х-ЛПВП, мг/дл |
54 (46-64) |
53 (47-60) |
50 (43-56) |
46 (43-56) |
0.06 |
0.07 |
|
Х-ЛПНП, мг/дл |
110 (89-121) |
113 (96-134) |
124 (98-146) |
115 (106-136) |
0.10 |
0.71 |
|
Триглицериды, мг/дл |
126.0 (100-156) |
115 (92-167) |
132 (109-163) |
161 (119-196) |
0.24 |
0.08 |
|
Глюкоза натощак, мг/дл |
114 (104-132) |
110 (102-120) |
120.0 (112-141) |
125 (111-140) |
0.04 |
0.03 |
|
HbA1c, % |
6.5 (6.1-7.0) |
6.0 (5.9-6.3) |
6.8 (6.3-7.1) |
6.6 (6.2-7.5) |
0.29 |
< 0.01 |
|
Инсулин натощак, мкЕд/мл |
16.2 (14.7-22.3) |
11.9 (8.0-17.8) |
21.4 (15.3-29.1) |
17.7 (14.0-29.1) |
0.97 |
0.02 |
|
HOMA-IR |
5.1 (3.7-6.0) |
2.8 (2.3-5.2) |
6.6 (4.3-9.8) |
6.0 (3.7-9.6) |
0.68 |
0.01 |
|
С-пептид, мг/дл |
3.3 (2.6-3.9) |
2.9 (2.4-3.6) |
3.6 (2.8-4.7) |
3.2 (2.7-5.1) |
0.20 |
0.10 |
|
Креатинин, мг/дл |
0.80 (0.64-0.97) |
0.74 (0.56-0.90) |
0.75 (0.67-0.92) |
0.75 (0.64-0.91) |
0.49 |
0.87 |
|
Ферритин, нг/мл |
250.5 (142-320) |
157 (99-242) |
179 (102-354) |
175.5 (106-279) |
0.72 |
0.27 |
|
Домен 7s коллагена IV типа |
4.5 (4.1-7.1) |
4.4 (3.7-4.9) |
5.0 (4.6-6.0) |
5.1 (4.5-6.2) |
0.81 |
0.04 |
|
M2BPGi, C.O.I |
0.70 (0.41-0.99) |
0.65 (0.49-0.98) |
0.90 (0.65-1.27) |
0.78 (0.68-1.32) |
0.09 |
0.03 |
|
Анализ визуальных методов исследования |
||||||
|
Площадь висцерального жира, см² |
180 (116-222) |
191 (131-215) |
176 (142-226) |
163 (126-226) |
0.82 |
0.57 |
|
Площадь подкожножировой клетчатки, см² |
220 (180-275) |
193 (158-244) |
237 (169-311) |
232 (152-309) |
0.36 |
0.22 |
|
Результаты гистологического исследования |
||||||
|
Оценка стеатоза (0/1/2/3), n |
1/13/4/3 |
2/13/6/0 |
1/13/10/1 |
3/13/4/5 |
0.36 |
0.15 |
|
Оценка воспаления (0/1/2/3), n |
2/18/1/0 |
3/18/0/0 |
1/20/4/0 |
3/18/4/0 |
0.39 |
0.16 |
|
Оценка баллонной дистрофии (0/1/2), n |
10/6/5 |
17/4/0 |
12/7/6 |
12/8/5 |
0.99 |
0.03 |
|
НАС общая оценка |
3 (2-4) |
2 (2-3) |
3 (2-4) |
3 (2-4) |
0.64 |
0.01 |
|
НАС (<4/≥4) |
13/8 |
19/2 |
14/11 |
14/11 |
0.69 |
0.01 |
|
Стадия фиброза (0/1/2/3/4), n |
4/8/3/5/1 |
10/3/4/4/0 |
7/11/4/2/1 |
3/13/4/4/1 |
0.66 |
0.03 |
Непрерывные переменные представлены в виде медианы (нижнего и верхнего квантилей). Значения P получены с помощью t-критерия Уэлча и критерия хи-квадрат при сравнении ИПР и КОНТР исходно и через 72 недели.
Сокращения: ИПР — группа ипраглифлозина; КОНТР — контрольная группа; ИМТ — индекс массы тела; АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; ГГТ — γ-глутамилтранспептидаза; Х-ЛПВП, холестерин липопротеинов высокой плотности; Х-ЛПНП — холестерин липопротеинов низкой плотности; HbA1c — гемоглобин A1c; M2BPGi — изомер гликозилирования Mac-2-связывающего белка; HOMA-IR — оценка инсулинорезистентности с помощью гомеостатической модели; НАС — оценка активности неалкогольной жировой болезни печени
Дополнительная таблица 3. Лекарственные препараты, используемые для лечения сопутствующих заболеваний, связанных с образом жизни
|
Сопутствующие препараты на исходном этапе |
Исследуемый показатель 1 |
Исследуемый показатель 2 |
||
|
ИПР (n=24) |
КОНТР (n=26) |
ИПР (n=21) |
КОНТР (n=25) |
|
|
Метформин |
2 |
3 |
2 |
2 |
|
Ингибитор альфа-глюкозидазы |
0 |
1 |
0 |
1 |
|
Ингибитор ДПП-4 |
3 |
3 |
2 |
2 |
|
Статин |
5 |
4 |
4 |
3 |
|
Эзетимиб |
0 |
1 |
0 |
1 |
|
Фенофибрат |
1 |
0 |
0 |
0 |
|
Этиловые эфиры омега-3 кислот |
1 |
0 |
0 |
0 |
|
Блокатор рецептора ангиотензина 2 |
7 |
5 |
4 |
3 |
|
Ингибитор АПФ |
1 |
1 |
1 |
1 |
|
Блокатор кальциевых каналов |
4 |
3 |
3 |
3 |
|
Бета-блокатор |
1 |
0 |
0 |
0 |
Сокращения: ДПП-4 – дипептидилпептидаза 4, АПФ – ангиотензинпревращающий фермент, ИПР – группа ипраглифлозина, КОНТР – контрольная группа
Дополнительная таблица 4. Изменения в отдельных компонентах НАС и стадии фиброза
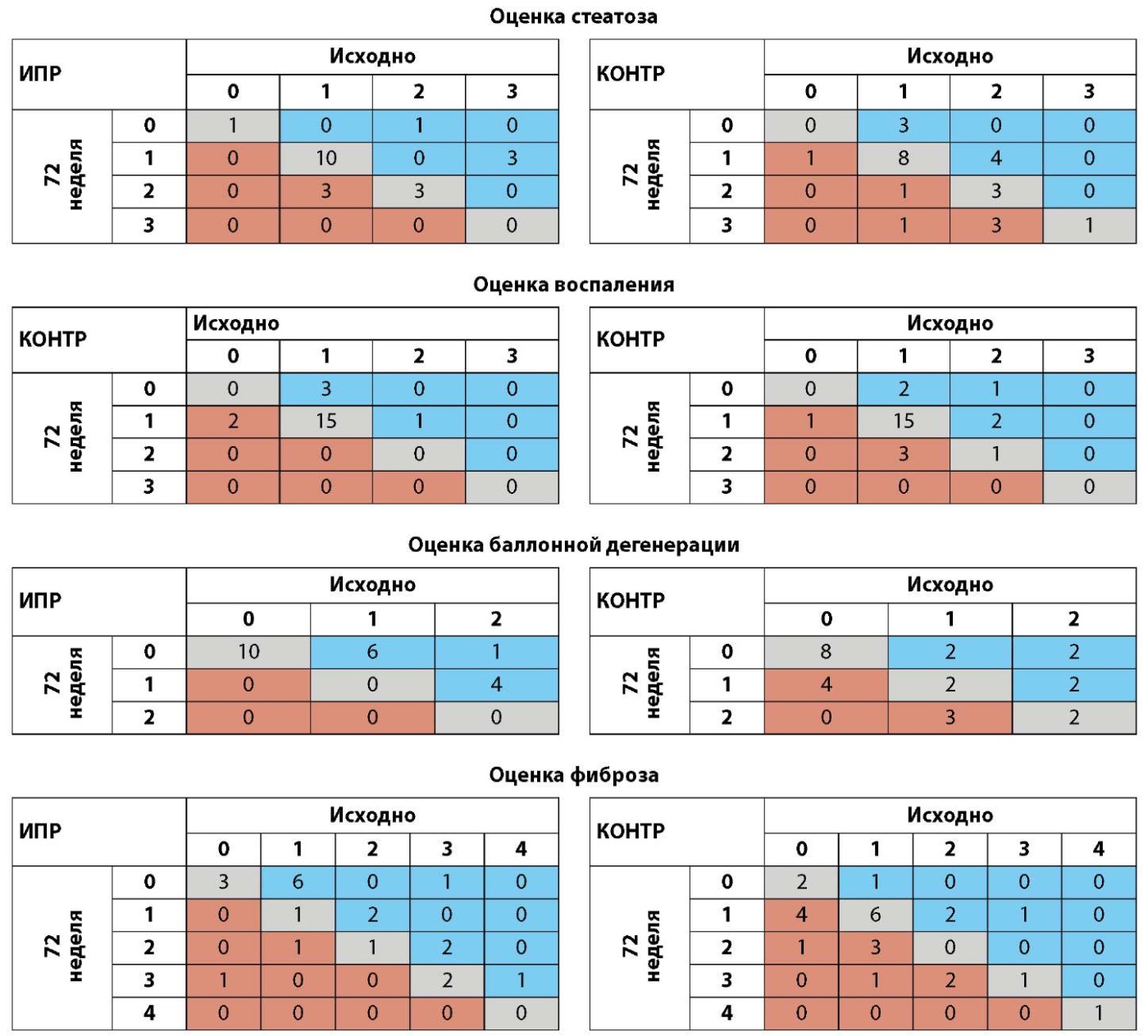
Патологоанатомическая оценка в группах ИПР и КОНТР исходно и через 72 недель лечения. Количество пациентов указано в цветных ячейках (синий — улучшение; серый — без изменений; красный — ухудшение между исходной оценкой и 72 неделей). НАСГ — показатель активности неалкогольной жировой болезни печени; ИПР — группа, принимающая ипраглифлозин; КОНТР — контрольная группа
Дополнительный рисунок 1. Изменение параметров исследуемого показателя 2 от исходного периода
Средние изменения (A) уровня гемоглобина A1c, (B) концентрации глюкозы в плазме крови натощак, (C) индекса массы тела, (D) площади висцерального жира, (E) площади подкожно-жировой клетчатки и (F) концентрации ферритина в сыворотке крови в группах ИПР (красная линия) и КОНТР (синяя линия) по сравнению с исходным уровнем. Данные представлены в виде средних значений и стандартных отклонений. ИМТ —индекс массы тела; ИПР — ипраглифлозин; КОНТ — контроль. *p<0,05 и **p<0,01, согласно t-критерию Уэлча для двух выборок, при сравнении между группами. †р<0,05 и ††р<0,01, согласно t-тесту с одной выборкой, по сравнению с исходным уровнем.
Дополнительный рисунок 2. Оценка биоптатов печени
(A)–(D) Участники с оценкой 0 баллов или стадией 0 по каждому компоненту были исключены. (A) стеатоз (ИПР, n=20 против КОНТР, n=24), (B) воспаление (ИПР, n=19 против КОНТР, n=24), (C) баллонная дистрофия (ИПР, n=11 против КОНТР, n=13) и (D) фиброз (ИПР, n=17 по сравнению с КОНТР, n=18). ИПР — группа ипраглифлозина; КОНТР — контрольная группа. *p<0,05, согласно t-критерию Уэлча для двух выборок.
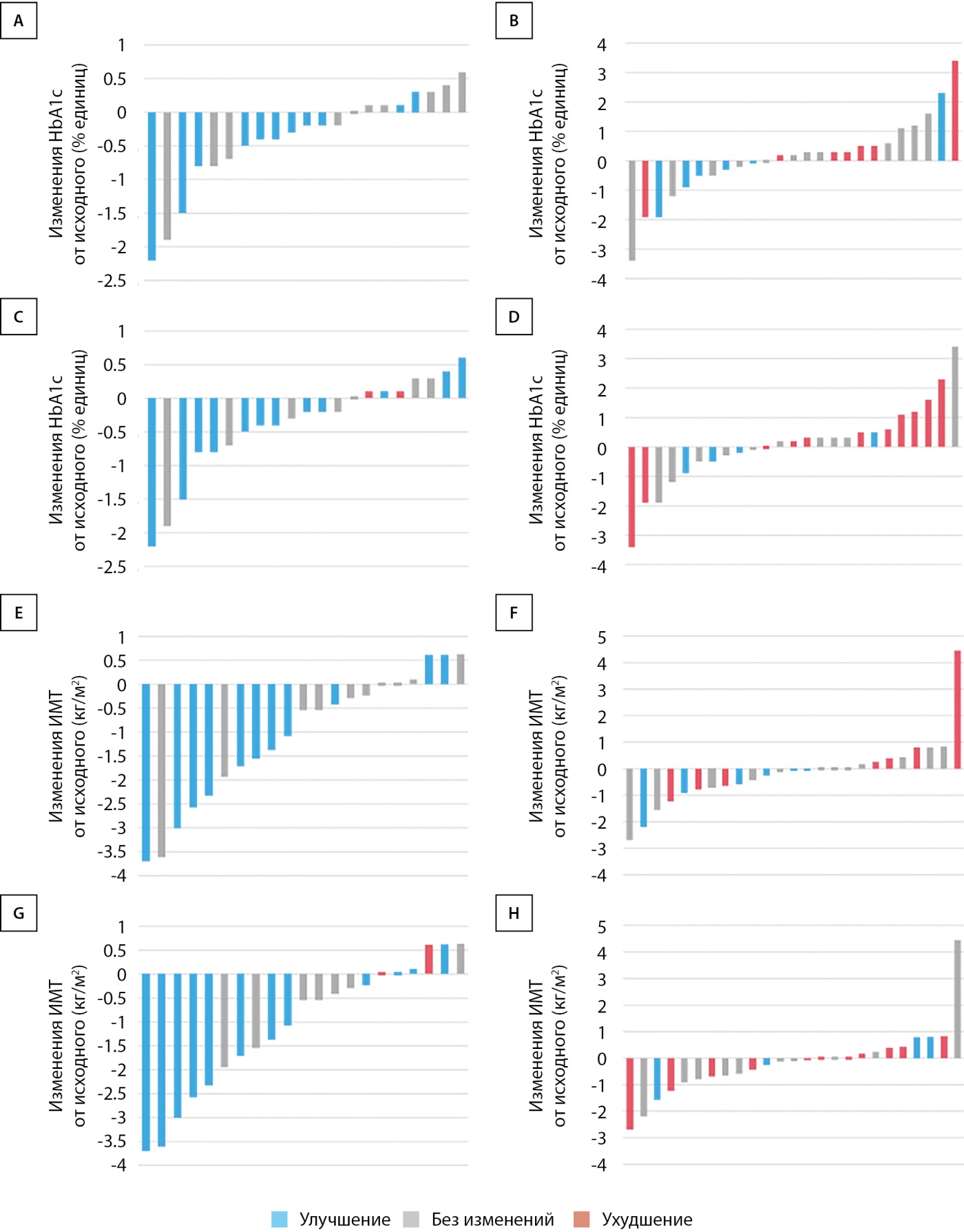
Дополнительный рисунок 3. Патанатомическая конечная точка (баллуннинг и фиброз) и изменения уровня гемоглобина A1c и ИМТ между исходным уровнем и 72 неделями у отдельных пациентов.
Пошаговая диаграмма изменений уровня гемоглобина A1c и ИМТ у отдельных пациентов. Результаты баллонной дегенерации гепатоцитов и изменения уровня гемоглобина A1c у пациентов в группах ИПР (A) и КОНТР (B). Исходы фиброза и изменения уровня гемоглобина A1c у пациентов группы ИПР (C) и группы КОНТР (D). Исходы баллонной дегенерации и изменения ИМТ у пациентов группы ИПР (E) и группы КОНТР (F). Исходы фиброза и изменения ИМТ у пациентов из групп ИПР (G) и КОНТР (H). Цвета каждой полоски на графиках-каскадах отражают исходы (синий — улучшение; серый — без изменений; красный — ухудшение между исходным уровнем и 72 неделей). HbA1c — гемоглобин A1c; ИМТ — индекс массы тела; ИПР — ипраглифлозин; КОНТР — контроль.
Список литературы
1. Younossi Z, Tacke F, Arrese M, et al. Global Perspectives on Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis. Hepatology. 2019;69(6):2672-2682. doi: https://doi.org/10.1002/hep.30251
2. Younossi ZM, Blissett D, Blissett R, et al. The economic and clinical burden of nonalcoholic fatty liver disease in the United States and Europe. Hepatology. 2016;64(5):1577-1586. doi: https://doi.org/10.1002/hep.28785
3. Estes C, Razavi H, Loomba R, Younossi Z, Sanyal AJ. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 2018;67(1):123-133. doi: https://doi.org/10.1002/hep.29466
4. Chalasani N, Wilson L, Kleiner DE, et al. Relationship of steatosis grade and zonal location to histological features of steatohepatitis in adult patients with nonalcoholic fatty liver disease. J Hepatol. 2008;48(5):829-834. doi: https://doi.org/10.1016/j.jhep.2008.01.016
5. Mantovani A, Byrne CD, Bonora E, Targher G. Nonalcoholic Fatty Liver Disease and Risk of Incident Type 2 Diabetes: A Meta-analysis. Diabetes Care. 2018;41(2):372-382. doi: https://doi.org/10.2337/dc17-1902
6. Dyson J, Jaques B, Chattopadyhay D, et al. Hepatocellular cancer: the impact of obesity, type 2 diabetes and a multidisciplinary team. J Hepatol. 2014;60(1):110-117. doi: https://doi.org/10.1016/j.jhep.2013.08.011
7. Lonardo A, Nascimbeni F, Mantovani A, Targher G. Hypertension, diabetes, atherosclerosis and NASH: Cause or consequence? J Hepatol. 2018;68(2):335-352. doi: https://doi.org/10.1016/j.jhep.2017.09.021
8. Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007;45(4):846-854. doi: https://doi.org/10.1002/hep.21496
9. Dulai PS, Singh S, Patel J, et al. Increased risk of mortality by fibrosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis. Hepatology. 2017;65(5):1557-1565. doi: https://doi.org/10.1002/hep.29085
10. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373(22):2117-2128. doi: https://doi.org/10.1056/NEJMoa1504720
11. Wanner C, Inzucchi SE, Lachin JM, et al. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016;375(4):323-334. doi: https://doi.org/10.1056/NEJMoa1515920
12. Mahaffey KW, Neal B, Perkovic V, et al. Canagliflozin for Primary and Secondary Prevention of Cardiovascular Events: Results From the CANVAS Program (Canagliflozin Cardiovascular Assessment Study). Circulation. 2018;137(4):323-334. doi: https://doi.org/10.1161/CIRCULATIONAHA.117.032038
13. Buse JB, Wexler DJ, Tsapas A, et al. 2019 update to: Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD) [published correction appears in Diabetologia. 2020 Aug;63(8):1667. doi: https://doi.org/10.1007/s00125-020-05151-2.]. Diabetologia. 2020;63(2):221-228. doi: https://doi.org/10.1007/s00125-019-05039-w
14. Lai LL, Vethakkan SR, Nik Mustapha NR, Mahadeva S, Chan WK. Empagliflozin for the Treatment of Nonalcoholic Steatohepatitis in Patients with Type 2 Diabetes Mellitus. Dig Dis Sci. 2020;65(2):623-631. doi: https://doi.org/10.1007/s10620-019-5477-1
15. Akuta N, Kawamura Y, Watanabe C, et al. Impact of sodium glucose cotransporter 2 inhibitor on histological features and glucose metabolism of non-alcoholic fatty liver disease complicated by diabetes mellitus. Hepatol Res. 2019;49(5):531-539. doi: https://doi.org/10.1111/hepr.13304
16. Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: a report from an ADA Consensus Conference. Diabetes Care. 2014;37(10):2864-2883. doi: https://doi.org/10.2337/dc14-1296
17. Haffner SM, Kennedy E, Gonzalez C, Stern MP, Miettinen H. A prospective analysis of the HOMA model. The Mexico City Diabetes Study. Diabetes Care. 1996;19(10):1138-1141. doi: https://doi.org/10.2337/diacare.19.10.1138
18. Murawaki Y, Ikuta Y, Koda M, Yamada S, Kawasaki H. Comparison of serum 7S fragment of type IV collagen and serum central triplehelix of type IV collagen for assessment of liver fibrosis in patients with chronic viral liver disease. J Hepatol. 1996;24(2):148-154. doi: https://doi.org/10.1016/s0168-8278(96)80023-7
19. Toshima T, Shirabe K, Ikegami T, et al. A novel serum marker, glycosylated Wisteria floribunda agglutinin-positive Mac-2 binding protein (WFA(+)-M2BP), for assessing liver fibrosis. J Gastroenterol. 2015;50(1):76-84. doi: https://doi.org/10.1007/s00535-014-0946-y
20. Yoshizumi T, Nakamura T, Yamane M, et al. Abdominal fat: standardized technique for measurement at CT. Radiology. 1999;211(1):283-286. doi: https://doi.org/10.1148/radiology.211.1.r99ap15283
21. Kleiner DE, Brunt EM, Van Natta M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology. 2005;41(6):1313-1321. doi: https://doi.org/10.1002/hep.20701
22. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol. 1999;94(9):2467-2474. doi: https://doi.org/10.1111/j.1572-0241.1999.01377.x
23. Matteoni CA, Younossi ZM, Gramlich T, Boparai N, Liu YC, McCullough AJ. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology. 1999;116(6):1413-1419. doi: https://doi.org/10.1016/s0016-5085(99)70506-8
24. Maegawa H, Tobe K, Tabuchi H, Nakamura I. Baseline characteristics and interim (3-month) efficacy and safety data from STELLA-LONG TERM, a long-term post-marketing surveillance study of ipragliflozin in Japanese patients with type 2 diabetes in real-world clinical practice [published correction appears in Expert Opin Pharmacother. 2016 Oct;17(15):iii-iv. doi: 10.1080/14656566.2016.1238677.]. Expert Opin Pharmacother. 2016;17(15):1985-1994. doi: https://doi.org/10.1080/14656566.2016.1217994
25. Schwartz SL, Akinlade B, Klasen S, Kowalski D, Zhang W, Wilpshaar W. Safety, pharmacokinetic, and pharmacodynamic profiles of ipragliflozin (ASP1941), a novel and selective inhibitor of sodiumdependent glucose co-transporter 2, in patients with type 2 diabetes mellitus. Diabetes Technol Ther. 2011;13(12):1219-1227. doi: https://doi.org/10.1089/dia.2011.0012
26. Kashiwagi A, Kazuta K, Goto K, Yoshida S, Ueyama E, Utsuno A. Ipragliflozin in combination with metformin for the treatment of Japanese patients with type 2 diabetes: ILLUMINATE, a randomized, double-blind, placebo-controlled study. Diabetes Obes Metab. 2015;17(3):304-308. doi: https://doi.org/10.1111/dom.12331
27. Li B, Wang Y, Ye Z, et al. Effects of Canagliflozin on Fatty Liver Indexes in Patients with Type 2 Diabetes: A Meta-analysis of Randomized Controlled Trials. J Pharm Pharm Sci. 2018;21(1):222-235. doi: https://doi.org/10.18433/jpps29831
28. Sattar N, Fitchett D, Hantel S, George JT, Zinman B. Empagliflozin is associated with improvements in liver enzymes potentially consistent with reductions in liver fat: results from randomised trials including the EMPA-REG OUTCOME® trial. Diabetologia. 2018;61(10):2155-2163. doi: https://doi.org/10.1007/s00125-018-4702-3
29. Lee PCH, Gu Y, Yeung MY, et al. Dapagliflozin and Empagliflozin Ameliorate Hepatic Dysfunction Among Chinese Subjects with Diabetes in Part Through Glycemic Improvement: A Single-Center, Retrospective, Observational Study. Diabetes Ther. 2018;9(1):285-295. doi: https://doi.org/10.1007/s13300-017-0355-3
30. Kurinami N, Sugiyama S, Yoshida A, et al. Dapagliflozin significantly reduced liver fat accumulation associated with a decrease in abdominal subcutaneous fat in patients with inadequately controlled type 2 diabetes mellitus. Diabetes Res Clin Pract. 2018;142:254-263. doi: https://doi.org/10.1016/j.diabres.2018.05.017
31. Shibuya T, Fushimi N, Kawai M, et al. Luseogliflozin improves liver fat deposition compared to metformin in type 2 diabetes patients with non-alcoholic fatty liver disease: A prospective randomized controlled pilot study. Diabetes Obes Metab. 2018;20(2):438-442. doi: https://doi.org/10.1111/dom.13061
32. Cusi K, Bril F, Barb D, et al. Effect of canagliflozin treatment on hepatic triglyceride content and glucose metabolism in patients with type 2 diabetes. Diabetes Obes Metab. 2019;21(4):812-821. doi: https://doi.org/10.1111/dom.13584
33. Tahara A, Kondo Y, Takasu T, Tomiyama H. Effects of the SGLT2 inhibitor ipragliflozin on food intake, appetite-regulating hormones, and arteriovenous differences in postprandial glucose levels in type 2 diabetic rats. Biomed Pharmacother. 2018;105:1033-1041. doi: https://doi.org/10.1016/j.biopha.2018.06.062
34. Horie I, Abiru N, Hongo R, et al. Increased sugar intake as a form of compensatory hyperphagia in patients with type 2 diabetes under dapagliflozin treatment. Diabetes Res Clin Pract. 2018;135:178-184. doi: https://doi.org/10.1016/j.diabres.2017.11.016
35. Sumida Y, Murotani K, Saito M, et al. Effect of luseogliflozin on hepatic fat content in type 2 diabetes patients with non-alcoholic fatty liver disease: A prospective, single-arm trial (LEAD trial) [published correction appears in Hepatol Res. 2019 Aug;49(8):957. doi: 10.1111/hepr.13406.]. Hepatol Res. 2019;49(1):64-71. doi: https://doi.org/10.1111/hepr.13236
36. Komiya C, Tsuchiya K, Shiba K, et al. Ipragliflozin Improves Hepatic Steatosis in Obese Mice and Liver Dysfunction in Type 2 Diabetic Patients Irrespective of Body Weight Reduction. PLoS One. 2016;11(3):e0151511. doi: https://doi.org/10.1371/journal.pone.0151511
37. Honda Y, Imajo K, Kato T, et al. The Selective SGLT2 Inhibitor Ipragliflozin Has a Therapeutic Effect on Nonalcoholic Steatohepatitis in Mice. PLoS One. 2016;11(1):e0146337. doi: https://doi.org/10.1371/journal.pone.0146337
38. Bonner C, Kerr-Conte J, Gmyr V, et al. Inhibition of the glucose transporter SGLT2 with dapagliflozin in pancreatic alpha cells triggers glucagon secretion. Nat Med. 2015;21(5):512-517. doi: https://doi.org/10.1038/nm.3828
39. Magnusson I, Rothman DL, Katz LD, Shulman RG, Shulman GI. Increased rate of gluconeogenesis in type II diabetes mellitus. A 13C nuclear magnetic resonance study. J Clin Invest. 1992;90(4):1323-1327. doi: https://doi.org/10.1172/JCI115997
40. Perry RJ, Zhang D, Guerra MT, et al. Glucagon stimulates gluconeogenesis by INSP3R1-mediated hepatic lipolysis. Nature. 2020;579(7798):279-283. doi: https://doi.org/10.1038/s41586-020-2074-6
41. Sawada Y, Izumida Y, Takeuchi Y, et al. Effect of sodiumglucose cotransporter 2 (SGLT2) inhibition on weight loss is partly mediated by liver-brain-adipose neurocircuitry. Biochem Biophys Res Commun. 2017;493(1):40-45. doi: https://doi.org/10.1016/j.bbrc.2017.09.081
42. Patel V, Joharapurkar A, Kshirsagar S, et al. Coagonist of glucagonlike peptide-1 and glucagon receptors ameliorates nonalcoholic fatty liver disease. Can J Physiol Pharmacol. 2018;96(6):587-596. doi: https://doi.org/10.1139/cjpp-2017-0683
43. Seghieri M, Christensen AS, Andersen A, Solini A, Knop FK, Vilsbøll T. Future Perspectives on GLP-1 Receptor Agonists and GLP-1/glucagon Receptor Co-agonists in the Treatment of NAFLD. Front Endocrinol (Lausanne). 2018;9:649. doi: https://doi.org/10.3389/fendo.2018.00649
44. Yip WW, Burt AD. Alcoholic liver disease. Semin Diagn Pathol. 2006;23(3-4):149-160. doi: https://doi.org/10.1053/j.semdp.2006.11.002
45. Lackner C, Gogg-Kamerer M, Zatloukal K, Stumptner C, Brunt EM, Denk H. Ballooned hepatocytes in steatohepatitis: the value of keratin immunohistochemistry for diagnosis. J Hepatol. 2008;48(5):821-828. doi: https://doi.org/10.1016/j.jhep.2008.01.026
46. Maeda S, Matsui T, Takeuchi M, Yamagishi S. Sodium-glucose cotransporter 2-mediated oxidative stress augments advanced glycation end products-induced tubular cell apoptosis. Diabetes Metab Res Rev. 2013;29(5):406-412. doi: https://doi.org/10.1002/dmrr.2407
47. Hosokawa K, Takata T, Sugihara T, et al. Ipragliflozin Ameliorates Endoplasmic Reticulum Stress and Apoptosis through Preventing Ectopic Lipid Deposition in Renal Tubules. Int J Mol Sci. 2019;21(1):190. doi: https://doi.org/10.3390/ijms21010190
48. Bessho R, Takiyama Y, Takiyama T, et al. Hypoxia-inducible factor-1α is the therapeutic target of the SGLT2 inhibitor for diabetic nephropathy. Sci Rep. 2019;9(1):14754. doi: https://doi.org/10.1038/s41598-019-51343-1
49. Nelson JE, Wilson L, Brunt EM, et al. Relationship between the pattern of hepatic iron deposition and histological severity in nonalcoholic fatty liver disease. Hepatology. 2011;53(2):448-457. doi: https://doi.org/10.1002/hep.24038
50. Handa P, Morgan-Stevenson V, Maliken BD, et al. Iron overload results in hepatic oxidative stress, immune cell activation, and hepatocellular ballooning injury, leading to nonalcoholic steatohepatitis in genetically obese mice. Am J Physiol Gastrointest Liver Physiol. 2016;310(2):G117-G127. doi: https://doi.org/10.1152/ajpgi.00246.2015
Об авторах
Hirokazu TakahashiЯпония
Hirokazu Takahashi, MD, PhD, Liver Center, Saga University Hospital, Faculty of Medicine, Saga University
5-1-1 Набешима, Сага-Сити, Сага
Takaomi Kessoku
Япония
Кафедра гастроэнтерологии и гепатологии, аспирантура медицинского факультета
Йокогама
Miwa Kawanaka
Япония
M.D., Ph.D.
Окаяма
Michihiro Nonaka
Япония
Отделение гастроэнтерологии и гепатологии
Хацукаичи
Hideyuki Hyogo
Япония
Отделение гастроэнтерологии и гепатологии
Хацукаичи
Hideki Fujii
Япония
Отделение гастроэнтерологии и гепатологии, больница района Джусо.
Кафедра первичной профилактической медицины, аспирантура медицинского факультета Университета г. Осака
Осака
Tomoaki Nakajima
Япония
Kento Imajo
Япония
Кафедра гастроэнтерологии и гепатологии, аспирантура медицинского факультета
Йокогама
Kenichi Tanaka
Япония
Отделение метаболизма и эндокринологии, медицинский факультет
Сага
Yoshihito Kubotsu
Япония
Отделение метаболизма и эндокринологии, медицинский факультет
Сага
Hiroshi Isoda
Япония
Центр гепатологии, клиника Университета Саги, медицинский факультет
Сага
Satoshi Oeda
Япония
Центр гепатологии, клиника Университета Саги, медицинский факультет
Сага
Osamu Kurai
Япония
Отделение гастроэнтерологии и гепатологии
Осака
Masato Yoneda
Япония
Кафедра гастроэнтерологии и гепатологии, аспирантура медицинского факультета
Йокогама
Masafumi Ono
Япония
Отделение внутренних болезней, медицинский центр
Токио
Yoichiro Kitajima
Япония
Отделение метаболизма и эндокринологии, медицинский факультет, Университет Саги
Отделение гастроэнтерологии, больница Эгучи
Сага, Оги
Ryo Tajiri
Япония
Клинический научный центр
Сага
Ayako Takamori
Клинический научный центр
Сага
Atsushi Kawaguchi
Япония
Научно-образовательный центр общественной медицины, медицинский факультет
Сага
Shinichi Aishima
Япония
Кафедра патологии и микробиологии, медицинский факультет
Сага
Masayoshi Kage
Япония
Научно-исследовательский центр инновационной терапии рака
Куруме
Atsushi Nakajima
Япония
Кафедра гастроэнтерологии и гепатологии, аспирантура медицинского факультета
Йокогама
Yuichiro Eguchi
Япония
Центр гепатологии, клиника Университета Саги, медицинский факультет
Сага
Keizo Anzai
Япония
Keizo Anzai, MD, PhD, Division of Metabolism and Endocrinology, Faculty of Medicine
5-1-1 Набешима, Сага-Сити, Сага
Дополнительные файлы
|
|
1. Рисунок 1. Блок-схема распределения участников исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(732KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Изменения параметров, использованных для оценки показателя №1, относительно исходного состояния. Изображены средние изменения концентрации HbA1c (А), глюкозы плазмы натощак (В), ИМТ (С), площади висцерального жира (В), площади подкожного жира (Е) и концентрации ферритина в сыворотке (F) в группе ИПР (красная линия) и контрольной группе (синяя линия) относительно исходного уровня. Результаты представлены в виде среднего значения и стандартного отклонения. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(733KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Изменения параметров, использованных для оценки показателя №2 относительно исходного уровня. Изображены средние изменения АСТ (А), АЛТ (В), ГГТ (С), общего билирубина (D), M2BPGi (Е) и домена 7s коллагена 4-го типа (F) в группе ИПР (красная линия) и контрольной группе (синяя линия) относительно исходного уровня. Результаты представлены в виде среднего значения и стандартного отклонения. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(366KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Результаты исследования биопсии печени. (А–D) Результаты патологоанатомического исследования биопсий всех участников для оценки показателя №2 (ИПР, n=21 vs. КОНТР, n=25). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(411KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Итоговые патоморфологические изменения в группе ИПР и контрольной группе. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(418KB)
|
Метаданные ▾ | |
|
|
6. Дополнительный рисунок 1. Изменение параметров исследуемого показателя 2 от исходного периода | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(672KB)
|
Метаданные ▾ | |
|
|
7. Дополнительный рисунок 2. Оценка биоптатов печени | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(396KB)
|
Метаданные ▾ | |
|
|
8. Дополнительный рисунок 3. Патанатомическая конечная точка (баллуннинг и фиброз) и изменения уровня гемоглобина A1c и ИМТ между исходным уровнем и 72 неделями у отдельных пациентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(946KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Takahashi H., Kessoku T., Kawanaka M., Nonaka M., Hyogo H., Fujii H., Nakajima T., Imajo K., Tanaka K., Kubotsu Y., Isoda H., Oeda S., Kurai O., Yoneda M., Ono M., Kitajima Y., Tajiri R., Takamori A., Kawaguchi A., Aishima Sh., Kage M., Nakajima A., Eguchi Yu., Anzai K. Ипраглифлозин улучшает состояние печени у пациентов с сахарным диабетом с неалкогольной жировой болезнью печени. Сахарный диабет. 2025;28(2):210-227. https://doi.org/10.14341/DM13340
For citation:
Takahashi H., Kessoku T., Kawanaka M., Nonaka M., Hyogo H., Fujii H., Nakajima T., Imajo K., Tanaka K., Kubotsu Y., Isoda H., Oeda S., Kurai O., Yoneda M., Ono M., Kitajima Y., Tajiri R., Takamori A., Kawaguchi A., Aishima Sh., Kage M., Nakajima A., Eguchi Yu., Anzai K. Ipragliflozin improves the hepatic outcomes of patients with diabetes with NAFLD. Diabetes mellitus. 2025;28(2):210-227. (In Russ.) https://doi.org/10.14341/DM13340
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































