Перейти к:
Иллюзия точности: критический анализ методов оценки качества систем непрерывного мониторирования глюкозы
https://doi.org/10.14341/DM13329
Аннотация
Непрерывное мониторирование глюкозы (НМГ) применяется более 15 лет в Российской Федерации как метод самоконтроля уровня глюкозы у пациентов с сахарным диабетом. Основной характеристикой устройств НМГ, обеспечивающей их эффективное и безопасное применение, является точность показаний. В настоящий момент отсутствуют единые регламентирующие документы, определяющие минимально приемлемые показатели точности для систем НМГ.
Целью настоящего обзора являлась систематизация существующих подходов к оценке точности систем НМГ в различных странах, а также предложения по разработке российского стандарта оценки точности устройств НМГ, включая требования к методологии дизайна клинических исследований оценки точности, а также к минимально приемлемым показателям точности устройств НМГ, необходимым для возможности их применения в клинической практике.
Ключевые слова
Для цитирования:
Шестакова М.В., Петеркова В.А., Галстян Г.Р., Ибрагимова Л.И., Климонтов В.В., Лаптев Д.Н., Малая И.П., Шестакова Е.А. Иллюзия точности: критический анализ методов оценки качества систем непрерывного мониторирования глюкозы. Сахарный диабет. 2025;28(3):231-239. https://doi.org/10.14341/DM13329
For citation:
Shestakova M.V., Peterkova V.A., Galstyan G.R., Ibragimova L.I., Klimontov V.V., Laptev D.N., Malaya I.P., Shestakova E.A. The illusion of accuracy: a critical analysis of continuous glucose monitoring systems quality assessment methods. Diabetes mellitus. 2025;28(3):231-239. (In Russ.) https://doi.org/10.14341/DM13329
ВВЕДЕНИЕ
За последние несколько лет непрерывное мониторирование глюкозы (НМГ) получило широкое распространение как метод контроля гликемии у пациентов с сахарным диабетом (СД) в Российской Федерации (РФ). Рандомизированные клинические исследования и наблюдения, проведенные в условиях повседневной клинической практики, продемонстрировали улучшение показателей гликемического контроля, таких как HbA1c, время в целевом диапазоне, время ниже диапазона, время выше диапазона, на фоне применения НМГ у лиц с СД 1 типа (СД1), СД 2 типа (СД2), а также при СД во время беременности [1–10].
В соответствии с положениями, закрепленными в Консенсусе по НМГ, опубликованном в 2017 г., в клинической практике следует использовать только те системы НМГ, которые обеспечивают достаточный уровень точности измерений [11], и за последние 20 лет, прошедшие с момента разработки первых систем НМГ и внедрения их в клиническую практику, отмечается рост их точности: у ранних систем НМГ среднее абсолютной величины относительной погрешности (Mean Absolute Relative Difference [MARD]) составляло порядка 20%, в то время как аналогичный показатель у самых современных систем НМГ, как правило, не превышает 10% [12]. Несмотря на то, что точность устройств НМГ является основной характеристикой, позволяющей обеспечить их эффективное и безопасное применение [13], к настоящему времени отсутствуют валидированные международные стандарты, а также российские ГОСТы, регламентирующие подходы к оценке, и минимальные критерии точности систем НМГ, что создает проблемы для регуляторных органов, врачей и пользователей [14][15].
ПОДХОДЫ К ОЦЕНКЕ ТОЧНОСТИ НМГ, РЕГЛАМЕНТИРУЮЩИЕ РУКОВОДСТВА И СТАНДАРТЫ
Руководство по оценке показателей точности систем НМГ POCT05, разработанное Институтом клинических и лабораторных стандартов, является единственным утвержденным документом, который описывает общие показатели, характеризующие точность систем НМГ и подходы к методологии оценки данных показателей в рамках клинических испытаний [16][17]. В данном документе представлены общие рекомендации о том, как должны оцениваться показатели точности систем НМГ, рассматриваются вопросы влияния различных факторов на результаты данной оценки. В Руководстве POCT05 указано, что точность системы НМГ следует оценивать путем прямых сравнений измерений глюкозы датчиком НМГ с показаниями референсного устройства. В качестве референсного устройства предпочтительным является лабораторный анализатор, как более точное устройство с прослеживаемыми показаниями [16].
Особое внимание в Руководстве POCT05 уделяется рекомендациям в отношении методологии проведения клинических исследований точности устройств НМГ, так как правильный выбор популяции пациентов для включения в исследование, методов для оценки показателей точности, числа парных измерений обеспечивает валидность полученных результатов. Авторы документа делают акцент на оценке основных клинико-демографических характеристик пациентов для включения в исследование точности: популяция в клинических исследованиях должна отражать популяцию предполагаемого использования устройства [16]. Основаниями для данной рекомендации служат особенности показателей вариабельности гликемии у пациентов в зависимости от типа СД, вида терапии, возраста и степени компенсации основных показателей гликемического контроля. В случае выраженной вариабельности гликемии следует ожидать более значимые различия между показаниями датчика и анализатора, измеряющего уровень глюкозы в венозной крови, по причине физиологического запаздывания показателей глюкозы в интерстициальной жидкости по отношению к глюкозе в крови, в особенности при быстрых изменениях концентрации глюкозы в крови [18]. Напротив, при снижении вариабельности уровня глюкозы показатели точности датчика НМГ будут иметь более благоприятные значения, таким образом, преобладание пациентов с СД2 в исследовании может исказить воспроизводимость его результатов при использовании на практике в случае, если устройство предполагается к применению у пациентов с СД1 [16]. Влияние одного дополнительного эпизода гипогликемии на значения показателя MARD проиллюстрировано в рамках модели, описанной в статье Vigersky RA с соавт.: при добавлении одного парного измерения с концентрацией глюкозы, соответствующей гипогликемическому диапазону, к шести парным измерениям «исследуемый датчик-референсный анализатор» значения показателя MARD возрастают с 8,79 до 10,26% [19].
Учитывая потенциальное влияние выраженных колебаний уровня глюкозы на результаты оценки точности, а также необходимость ее определения в клинически значимых диапазонах гликемии (гипогликемии, гипергликемии), рекомендуется изучение показателей точности во всем диапазоне значений глюкозы, а также проведение стимуляционных нагрузочных проб с глюкозой и инсулином для оценки точности при очень низких и очень высоких концентрациях глюкозы, при этом число парных измерений (точек сравнения) должно соответствовать статистически релевантному объему выборки в каждом из гликемических состояний [16]. Необходимо принимать во внимание, что вариабельность гликемии выше у пациентов с недостаточным гликемическим контролем, а также у детей и подростков с СД, в особенности у детей ранней возрастной группы, что диктует необходимость включения в исследование лиц с различными значениями HbA1c, а также необходимость оценки показателей точности в клинических исследованиях изолированно для взрослой и детской популяции пациентов в случае, если предполагается использование устройства у детей и подростков [16][20]. По данным ряда авторов, место установки датчика НМГ также может оказывать влияние на точность измерений, поэтому в Руководство POCT05 включена рекомендация о необходимости оценки точности датчика НМГ изолированно во всех допустимых анатомических областях установки [16]. Таким образом, критическая оценка дизайна исследования и его результатов имеет первостепенное значение для уполномоченных регулирующих органов при регистрации устройства НМГ, а также для практикующих специалистов при выборе системы НМГ. Результаты клинических исследований, разработанных с методологическими ошибками и способных повлиять на эффективность и безопасность применения устройства, следует рассматривать с крайней осторожностью или игнорировать [14].
В Руководстве POCT05 выделены особые подходы к организации клинических исследований для оценки точности систем НМГ у «уязвимых» групп пациентов: беременных женщин и детей. Так, при проведении исследований у беременных женщин, необходимых в случае, если предполагается применение устройства у данной категории лиц, рекомендовано ограничение объема образцов крови до минимально допустимых: общий объем крови, взятый в ходе клинического исследования, не должен превышать меньшего из значений: 50 мл или 3 мл/кг в течение любого 8-недельного периода. При проведении клинического исследования точности устройств НМГ у детей рекомендовано использование аналогичного подхода, а также рекомендуется использование глюкометра в качестве референсного метода (у детей в возрасте младше 6 лет) и отказ от проведения стимуляционных проб с нагрузкой глюкозой и инсулином [16].
С учетом наличия физиологической временной задержки между показателями глюкозы в крови и интерстициальной жидкости рекомендуется проводить не только оценку точности отдельных измерений, характеризующей близость показаний датчиков НМГ к показаниям референсного анализатора в данный момент, но и оценку точности тренда, которая отражает соответствие динамики уровня глюкозы по данным НМГ и референсного устройства [16].
Принимая во внимание возможное влияние исходных клинико-демографических характеристик включенных пациентов, а также методологических особенностей исследования, точность различных систем НМГ следует сопоставлять в прямых сравнительных исследованиях, чтобы избежать влияния особенностей дизайна клинического исследования на результаты [21].
НМГ ДЛЯ САМОСТОЯТЕЛЬНОГО И ВСПОМОГАТЕЛЬНОГО ПРИМЕНЕНИЯ
Ранее все системы НМГ были предназначены для использования только как дополнение к глюкометру. Для расчета дозы инсулина пользователям было рекомендовано подтверждать показания НМГ с помощью глюкометра и тест-полосок. Такое использование получило определение «адъювантного использования НМГ, то есть в дополнение к глюкометру» [22]. По мере повышения точности систем НМГ, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration [FDA]) одобрило возможность неадъювантного или самостоятельного использования, что означает, что подтверждения показаний НМГ глюкометром не требуются. В зависимости от данной характеристики все системы НМГ могут быть разделены на 2 группы [12][22][23]:
- Системы НМГ, которые можно использовать только в качестве вспомогательных (или адъювантных) к глюкометру устройств. При использовании таких систем пациент принимает клинические решения (расчет дозы инсулина или действия при гипогликемическом состоянии или подозрении на него) на основании показаний глюкометра, а НМГ использует только в качестве дополнения к рутинному измерению гликемии.
- Системы, которые можно использовать в качестве самостоятельного устройства для определения уровня глюкозы и принятия клинических решений, таких как дозирование инсулина, купирование гипогликемии. Такие системы, не требующие подтверждения глюкометром, получили название НМГ для самостоятельного применения, или неадъювантных. Вместе с тем, даже при использовании таких систем НМГ, оценка уровня глюкозы в капиллярной крови по-прежнему рекомендуется в случаях, если показания НМГ не соответствуют ожидаемым или использование НМГ не представляется возможным [23].
Полноценный самоконтроль уровня глюкозы, являющийся неотъемлемым компонентом терапии СД [24–26], можно осуществлять только при использовании систем НМГ, разрешенных к применению в качестве самостоятельного метода самоконтроля (неадъювантных НМГ), которые позволяют принимать и пациенту, и врачу клинические решения, например, рассчитывать дозу инсулина, основываясь на показаниях датчика без сопутствующего использования глюкометра. Применение систем НМГ, разрешенных для использования в качестве самостоятельного метода самоконтроля уровня глюкозы, также имеет ряд дополнительных преимуществ (в сравнении с устройствами, которые можно использовать только в качестве дополнительных к глюкометру): удобство и меньшая болезненность за счет сокращения частоты проколов пальца для взятия образца крови [22].
Характеристики систем НМГ, предназначенных для неадъювантного применения, были предложены FDA и представлены в табл. 1.
Таблица 1. Характеристики систем непрерывного мониторирования глюкозы, одобренных к применению в качестве самостоятельного метода самоконтроля глюкозы [22][27]
|
Устройство НМГ, предназначенное для использования в качестве самостоятельного (неадъювантного) метода самоконтроля |
• Предназначено для замещения определения уровня глюкозы глюкометром |
|
• Предназначено для определения уровня глюкозы, а также оценки направления и скорости изменения концентрации глюкозы |
|
|
• Используется для принятия терапевтических решений (например, расчет дозы инсулина) |
|
|
• Предоставляет ретроспективные данные об уровне глюкозы и его изменениях, облегчая долгосрочное управление СД |
Примечание. НМГ — непрерывное мониторирование глюкозы; СД — сахарный диабет.
ТРЕБОВАНИЯ FDA К МИНИМАЛЬНО ПРИЕМЛЕМЫМ ПОКАЗАТЕЛЯМ ТОЧНОСТИ ДЛЯ ИНТЕГРИРУЕМЫХ СИСТЕМ НМГ
Достаточная точность — основополагающее свойство для систем НМГ, предназначенных для применения в качестве самостоятельного средства самоконтроля, так как на основании информации, полученной от устройства, пациент осуществляет управление заболеванием. FDA выделило специальную категорию устройств НМГ, так называемых интегрируемых систем НМГ (иНМГ), которые разрешены для применения в качестве самостоятельного метода самоконтроля и предназначены для надежной и безопасной передачи данных об уровне глюкозы на цифровые подключенные устройства, включая автоматизированные системы доставки инсулина, и могут использоваться отдельно или в сочетании с этими цифровыми подключенными медицинскими устройствами для управления СД или состоянием, связанным с гликемическим контролем [27]. Критерии оценки точности устройств в категории иНМГ, разработанные и внедренные FDA, являются единственными и при этом достаточно строгими стандартами точности НМГ в мире [22].
Специальные требования, предъявляемые к показателям точности устройств данной категории, представлены в табл. 2 и включают не только критерии минимально приемлемой точности, но и методологические подходы к организации клинических исследований и предоставления их результатов, а также общую оценку устройств на предрегистрационном этапе [27]. Соответствие показателей точности иНМГ минимально приемлемым значениям должно быть оценено в каждом из диапазонов концентрации глюкозы: гипогликемическом (ниже 3,9 ммоль/л), гипергликемическом (выше 10,0 ммоль/л) и диапазоне, соответствующем целевым значениям глюкозы (3,9–10,0 ммоль/л); также должна проводиться оценка точности трендов на соответствие минимально приемлемым значениям.
Таблица 2. Требования FDA к минимально приемлемым показателям точности устройств категории интегрируемых систем непрерывного мониторирования глюкозы [27]
|
Специальные требования к точности иНМГ [ 95% нижний односторонний ДИ] |
|
|
Точность во всем диапазоне значений иНМГ |
|
|
Доля всех измерений в пределах ± 20% от значений референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 87% |
|
|
Уровень глюкозы датчика иНМГ <3,9 ммоль/л |
|
|
Доля всех измерений в пределах ±0,83 ммоль/л (15 мг/дл) от референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 85% |
Доля всех измерений в пределах ±2,22 ммоль/л (±40 мг/дл) от референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 98% |
|
При показателях глюкозы <3,9 ммоль/л системы иНМГ не должно быть ни одного парного значения на референсном анализаторе с показаниями >10,0 ммоль/л |
|
|
Уровень глюкозы датчика иНМГ 3,9–10,0 ммоль/л |
|
|
Доля всех измерений в пределах ±15% от значений референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 70% |
Доля всех измерений в пределах ±40% от значений референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 99% |
|
Уровень глюкозы датчика иНМГ >10 ммоль/л |
|
|
Доля всех измерений в пределах ±15% от значений референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 80% |
Доля всех измерений в пределах ±40% от значений референсного анализатора должна быть определена, и значения нижней границы одностороннего 95% ДИ должны быть более 99% |
|
При показателях глюкозы >10,0 ммоль/л системы иНМГ не должно быть ни одного парного значения на референсном анализаторе с показаниями <3,9 ммоль/л |
|
|
Специальные требования к точности трендов |
|
|
Доля измерений, соответствующих положительному тренду значений глюкозы иНМГ со скоростью повышения более 0,056 ммоль/л в мин [ +1 мг/дл в мин] при соответствующем отрицательном тренде референтного анализатора со скоростью снижения, превышающей 0,11 ммоль/л в мин [ -2 мг/дл в мин], не должна превышать 1%. Таким образом, доля измерений, когда динамика показаний иНМГ соответствует нарастанию концентрации глюкозы, а динамика показаний референсного устройства соответствует снижению концентрации глюкозы, не должна быть более 1% |
Доля измерений, соответствующих отрицательному тренду значений глюкозы иНМГ со скоростью снижения более 0,056 ммоль/л в мин [ -1 мг/дл в мин] при соответствующем положительном тренде референтного анализатора со скоростью повышения более 0,11 ммоль/л в мин [ 2 мг/дл в мин], не должна превышать 1%. Доля измерений, когда динамика показаний иНМГ соответствует снижению концентрации глюкозы, а динамика показаний референсного устройства соответствует нарастанию концентрации глюкозы, не должна быть более 1% |
Примечание. ДИ — доверительный интервал; иНМГ — интегрируемые системы непрерывного мониторирования глюкозы.
Специальные требования FDA к предрегистрационной оценке иНМГ включают [27]:
1) требования к оценке и валидации дизайна клинического исследования
a. Убедительные клинические данные, подтверждающие точность устройства у предполагаемой популяции пациентов.
b. Клинические данные должны включать сравнение показаний иНМГ и уровня глюкозы в крови в образцах, собранных параллельно с использованием одобренного FDA метода измерения глюкозы, который является точным и достоверным.
c. Клинические данные должны быть получены в ходе клинического исследования, дизайн которого должен в полной мере отражать точность устройства в популяции и условиях предполагаемого использования, в полном диапазоне измерений значений глюкозы.
d. Результаты оценки точности должны быть стабильны на протяжении всего периода использования датчика.
e. Результаты оценки точности должны соответствовать минимально приемлемым значениям, перечисленным в табл. 2.
f. Должна быть продемонстрирована сопоставимая точность в детской и взрослой популяции, в том числе при оценке точности тренда, либо предоставлено клиническое и/или техническое обоснование, почему предоставление таких данных не является обязательным, и данное обоснование должно быть утверждено FDA как приемлемое и надлежащее.
g. Должно быть продемонстрировано, что на протяжении заявленного срока службы датчика устройство не допускает клинически значимых пробелов в доступности данных, которые могли бы оказать негативное воздействие на работу любых подключенных цифровых устройств;
2) предоставление данных, подтверждающих надежность и безопасность передачи сведений об уровне глюкозы в реальном времени в клинически значимые интервалы времени с датчика иНМГ на устройства, предназначенные для интеграции с датчиком;
3) верификация наличия адекватного контроля при производстве устройств для обеспечения соответствия произведенного продукта его эксплуатационным характеристикам;
4) предоставление данных, подтверждающих приемлемую точность устройства в присутствии клинически значимых концентраций веществ, которые могут определяться в достаточных концентрациях у предполагаемой для применения иНМГ популяции пациентов, включая вещества эндогенной природы и метаболиты, пищевые добавки и лекарственные препараты, способные оказать влияние на работу датчика;
5) предоставление производителем подтверждения о принятии мер, гарантирующих, что датчики, предназначенные для однократного использования, не могут быть использованы повторно или по истечении заявленного срока их службы;
6) наличие данных, полученных в ходе кинического исследования с оценкой удобства применения устройства, продемонстрировавших, что предполагаемые пользователи могут безопасно использовать устройство и получать ожидаемую точность его показаний;
7) в инструкцию по медицинскому применению устройства должны быть включены показатели точности, полученные в клиническом исследовании, для каждой предполагаемой к использованию популяции пациентов в дополнение к показателям точности для каждой анатомической области установки датчика (рука, ягодица, живот): показатели точности для различных диапазонов уровня глюкозы, информация о точности тренда при его нисходящем и восходящем направлении, данные о частоте эпизодов потери связи с датчиком и их продолжительности, данные об истинных, ложных, пропущенных срабатываниях сигналов тревоги; рекомендации по настройке пороговых уровней, если это применимо.
Вместе с тем следует отметить, что многие рекомендации FDA в отношении требований к оценке и валидации дизайна клинического исследования носят общий характер без должной детализации, в отличие, например, от POCT5. Это создает предпосылки не только для расхождения в подходах при проведении клинических исследований, что затруднит сравнение и оценку результатов, но также определяет возможность выбора более благоприятных с точки зрения достижения более высокой точности условий.
ПОДХОДЫ К ОЦЕНКЕ ТОЧНОСТИ НМГ: ПРЕДЛОЖЕНИЯ ЭКСПЕРТНЫХ РАБОЧИХ ГРУПП ВЕЛИКОБРИТАНИИ И ЕВРОПЕЙСКОГО СОЮЗА
В 2023 г. в Великобритании Pemberton с соавт. проанализировали данные клинических исследований, изучавших точность одобренных к применению НМГ в Великобритании, с позиции соответствия методологии исследований, а также их результатов требованиям FDA, разработанных для иНМГ [14]. В результате проведенного анализа было показано, что многие производители систем НМГ не публикуют данные клинических исследований о точности производимых устройств, а доступные публикации указывают на наличие методологических ошибок в организации дизайна клинических исследований:
- несоответствие популяций пациентов в исследованиях и зарегистрированных показаний к применению по демографическим и клиническим параметрам, отсутствие данных о точности устройства у детей и подростков;
- преобладание пациентов с СД2 в некоторых исследованиях;
- отсутствие результатов по точности устройства в различных диапазонах концентрации глюкозы, в том числе при очень низких или очень высоких концентрациях;
- отсутствие данных о показателях точности в различные периоды работы датчика.
Применение в клинической практике устройств НМГ, декларируемые производителями свойства которых не соответствуют представленным данным клинических исследований, либо устройств НМГ, данные о клинически значимых результатах оценки точности у которых отсутствуют, способно привести к повышению рисков безопасности терапии СД, связанных с применением НМГ, даже несмотря на наличие одобрения к применению со стороны уполномоченных регулирующих органов [14]. Так, в 2022 г. в регионе Кампания в Италии в рамках льготного обеспечения пациентов с СД, получающих сахароснижающую терапию препаратами инсулина, было закуплено устройство НМГ, одобренное к применению в странах Европейского Союза. Несмотря на то, что данная система получила одобрение регулирующих органов для применения у лиц с СД, пациенты и врачи сообщали о неудовлетворительной точности системы при низких и высоких концентрациях глюкозы, что привело к отказу от назначения данного устройства врачами и рекомендации пациентам вернуться к использованию глюкометров для осуществления самоконтроля. Данная ситуация коснулась 20 000 пациентов, получавших инсулинотерапию в регионе Кампания [13].
В результате проведенного анализа рабочая группа предложила внедрение ступенчатого подхода к критической оценке дизайна, результатов и показателей точности систем НМГ в Великобритании, основываясь на принципах, представленных в Руководстве по оценке показателей точности систем НМГ POCT05 и критериев минимально приемлемой точности иНМГ, рекомендованных FDA [14][16][27].
- На первом шаге алгоритма, предложенного рабочей группой, следует оценивать дизайн исследования и методологические подходы к его проведению, заявленные производителем:
- опубликованы ли результаты исследования в рецензируемом научном журнале;
- репрезентативна ли выборка пациентов (Для систем НМГ, одобренных к применению при СД1, доля пациентов, включенных в исследование точности, с СД2 не должна превышать 2% для педиатрической популяции (<18 лет) и 30% для взрослой популяции пациентов 18 лет и старше);
- достаточно ли количество парных измерений для каждой анатомической области предполагаемой установки датчика (более 10 000 для популяции взрослых пациентов и более 2500 для детей и подростков младше 18 лет);
- проводилась ли оценка точности в различные периоды работы датчика (начальный, промежуточный и завершающий);
- проводились ли нагрузочные пробы с глюкозой или углеводами (прием пищи) и инсулином для стимуляции высокой скорости изменения концентрации глюкозы, а также изучения точности при очень низких и очень высоких значениях;
- соответствует ли доля парных измерений, полученных в гипогликемическом и гипергликемическом диапазонах показателям, рекомендованным Руководством POCT05 (более 8% измерений в диапазоне с концентрацией глюкозы ниже 4,4 ммоль/л; более 5% измерений в диапазоне с концентрацией глюкозы выше 16,7 ммоль/л).
- На втором шаге рабочая группа рекомендует оценивать, насколько корректно представлены результаты исследования: результаты оценки точности для разных типов пациентов (СД1 и СД2) и разных возрастных групп (дети и взрослые), представлены ли данные о точности в разные периоды работы датчика и в различных допустимых диапазонах отклонений при концентрациях глюкозы, соответствующих гипогликемическому, гипергликемическому и эугликемическому диапазону; представлены ли результаты оценки прецизионности датчиков; проводилась ли оценка времени между активацией датчика и получением первого значения глюкозы.
- В случае, если соблюдены требования, описанные в шагах 1 и 2, авторы считают возможным переход к шагу 3, в рамках которого проводится оценка результатов клинического исследования. На данном этапе проводится оценка соответствия полученных результатов критериям FDA, разработанных для категории иНМГ и представленных в таблице 2.
Внедрение данного ступенчатого подхода будет способствовать более взвешенному выбору устройств НМГ у пациентов с СД, основываясь на принципах доказательной медицины и позиции существующих руководств [14].
Схожий подход по формированию минимальных требований на предрегистрационном этапе к показателям точности систем НМГ для повышения безопасности управления СД был предложен Европейской экспертной рабочей группой, опубликован в 2025 г. и представлен на рисунке 1; при этом критерии минимально приемлемой точности для систем НМГ, одобренных к применению в качестве самостоятельного метода самоконтроля и/или предназначенных для передачи данных об уровне глюкозы на цифровые подключенные устройства, включая автоматизированные системы доставки инсулина, полностью соответствуют критериям FDA, разработанным для категории иНМГ [13][27].
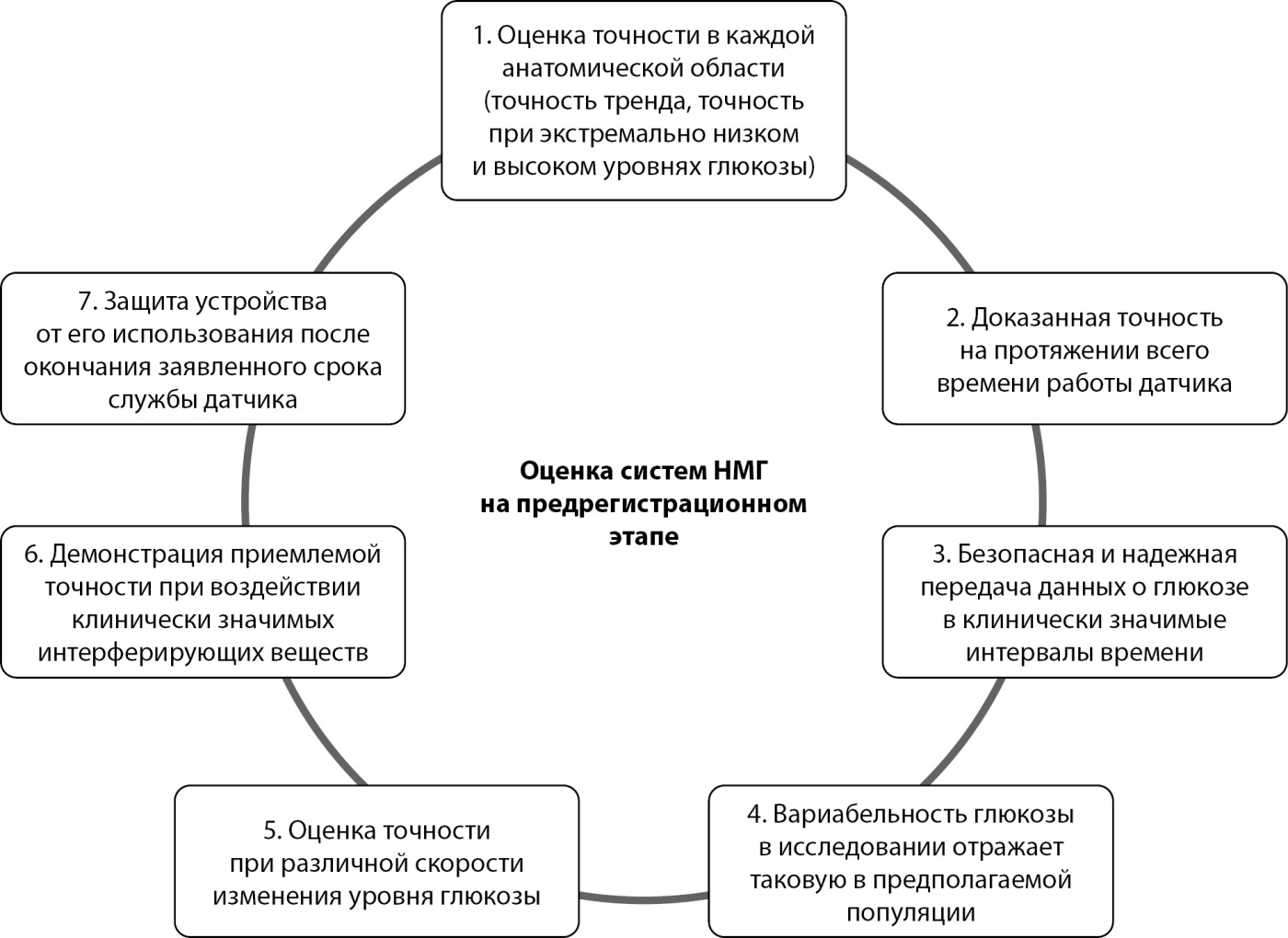
Рисунок 1. Минимальные требования к точности систем непрерывного мониторирования глюкозы, предложенные Европейской экспертной рабочей группой [13].
Примечание. НМГ — непрерывное мониторирование глюкозы.
ПОДХОДЫ К ОЦЕНКЕ МЕТОДОЛОГИИ И РЕЗУЛЬТАТОВ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ТОЧНОСТИ НМГ, ПРЕДЛОЖЕННЫЕ РОССИЙСКОЙ ГРУППОЙ ЭКСПЕРТОВ
На сегодняшний момент в Российской Федерации (РФ) отсутствует единый подход к оценке точности систем НМГ для одобрения их к клиническому применению [17]. Международный опыт свидетельствует о том, что расширение числа зарегистрированных устройств НМГ в отсутствие четких стандартов для их оценки на предрегистрационном и пострегистрационном этапах может привести к повышению рисков безопасности терапии СД, связанных с применением НМГ [13][14].
1 февраля 2025 г. в Москве состоялось обсуждение вопросов, связанных с точностью применяемых в клинической практике устройств НМГ, а также возможностей, связанных со стандартизацией подходов к оценке точности систем НМГ на предрегистрационном этапе в РФ. В результате обсуждения были предложены рекомендации к оценке дизайна, результатов клинических исследований точности устройств НМГ, а также предложение по минимально приемлемым показателям точности, необходимым для одобрения таких устройств для использования в клинической практике.
РЕКОМЕНДАЦИИ К ОЦЕНКЕ МЕТОДОЛОГИИ И РЕЗУЛЬТАТОВ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ ТОЧНОСТИ СИСТЕМ НМГ ДЛЯ УПОЛНОМОЧЕННЫХ РЕГУЛИРУЮЩИХ ОРГАНОВ (ПРЕДРЕГИСТРАЦИОННАЯ ОЦЕНКА) И ПРАКТИКУЮЩИХ СПЕЦИАЛИСТОВ (ПОСТРЕГИСТРАЦИОННАЯ ОЦЕНКА)
При оценке результатов исследований точности систем НМГ целесообразно учитывать следующее.
1. Были ли опубликованы методология и результаты клинического исследования оценки точности устройства НМГ в рецензируемом научном журнале?
2. Проводилось ли сравнение показаний устройства НМГ с использованием метода измерения глюкозы, который является более точным и достоверным (например, с лабораторным анализатором)?
3. Предоставлены ли производителем убедительные клинические данные, подтверждающие точность устройства в каждой из групп пациентов, в которых предполагается использование устройства (взрослые пациенты, дети, беременные женщины)? Сопоставимы ли результаты оценки точности во всех представленных группах пациентов?
4. Проводилась ли оценка точности устройства в каждой из предполагаемых анатомических областей установки датчика и предоставлена ли информация о результатах такой оценки?
5. Для систем, предназначенных для применения у лиц с СД1: не превышает ли доля включенных в исследование пациентов с СД2 2% в детской популяции и 30% во взрослой популяции?
6. Представлена и использована соответствующая клиническому применению устройства НМГ методология формирования парных измерений? Достаточно ли число парных измерений было включено в анализ в исследовании: более 10 000 для популяции взрослых пациентов и более 2500 для детей и подростков младше 18 лет?
7. Проводилась ли оценка точности в различные периоды работы датчика (начальный, срединный и конечный)? Сопоставимы ли результаты оценки точности датчика в данные периоды его работы?
8. Проводилась ли оценка точности устройства в полном диапазоне концентраций глюкозы?
9. Проводились ли нагрузочные пробы с глюкозой и инсулином для стимуляции высокой скорости изменения концентрации глюкозы, а также изучения точности устройства при очень низких и очень высоких значениях?
10. Достаточно ли число парных измерений, полученных в гипогликемическом и гипергликемическом диапазонах: более 8% измерений в диапазоне с концентрацией глюкозы ниже 4,4 ммоль/л; более 5% измерений в диапазоне с концентрацией глюкозы выше 16,7 ммоль/л?
11. Соответствует ли устройство минимальным приемлемым критериям точности, представленным в таблице 2, включая результаты оценки точности трендов?
12. Представлены ли данные, подтверждающие надежность и безопасность передачи данных об уровне глюкозы в реальном времени в клинически значимые интервалы времени с датчика НМГ на устройства, предназначенные для интеграции с датчиком?
13. Предоставлено ли производителем подтверждение о принятии мер, гарантирующих, что датчики, предназначенные для однократного использования, не могут быть использованы повторно или по истечении заявленного срока их службы?
14. Проводилась ли оценка точности срабатывания сигналов оповещения устройства НМГ? Предоставлены ли результаты данной оценки?
ЗАКЛЮЧЕНИЕ
Таким образом, единственно приемлемым подходом к повышению безопасности использования устройств НМГ является разработка и внедрение стандартов и руководств, на основании которых уполномоченные регулирующие органы будут принимать решение об одобрении устройства НМГ для применения на территории нашей страны, а практикующие специалисты будут осуществлять выбор системы НМГ для применения у пациентов. Данные руководства и стандарты целесообразно разрабатывать и внедрять, учитывая международный опыт.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Галстян Г.Р. — внесение в рукопись существенной правки, одобрение финальной версии рукописи; Ибрагимова Л.И. — написание статьи; Климонтов В.В. — внесение в рукопись существенной правки, одобрение финальной версии рукописи; Лаптев Д.Н. — написание статьи; Малая И.П. — написание статьи; Петеркова В.А. — внесение в рукопись существенной правки, одобрение финальной версии рукописи; Шестакова Е.А. — написание статьи; Шестакова М.В. — внесение в рукопись существенной правки, одобрение финальной версии рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Leelarathna L, Evans ML, Neupane S, et al. Intermittently Scanned Continuous Glucose Monitoring for Type 1 Diabetes. N Engl J Med. 2022;387(16):1477-1487 doi: https://doi.org/10.1056/NEJMoa2205650
2. Bolinder J, Antuna R, Geelhoed-Duijvestijn P, et al. Novel glucose-sensing technology and hypoglycaemia in type 1 diabetes: a multicentre, non-masked, randomized controlled trial. Lancet. 2016;388(10057):2254-2263 doi: https://doi.org/10.1016/S0140-6736(16)31535-5
3. Campbell FM, Murphy NP, Stewart C, et al. Outcomes of using flash glucose monitoring technology by children and young people with type 1 diabetes in a single arm study. Pediatr Diabetes. 2018;19(7):1294-1301 doi: https://doi.org/10.1111/pedi.12735
4. Evans M, Welsh Z, Ells S, Seibold A. The Impact of Flash Glucose Monitoring on Glycaemic Control as Measured by HbA1c: A Meta-analysis of Clinical Trials and Real-World Observational Studies. Diabetes Ther. 2020;11(1):83-95. doi: https://doi.org/10.1007/s13300-019-00720-0
5. Evans M, Welsh Z, Seibold A. Reductions in HbA1c with Flash Glucose Monitoring Are Sustained for up to 24 Months: A Meta-Analysis of 75 Real-World Observational Studies. Diabetes Ther. 2022;13(6):1175-1185. doi: https://doi.org/10.1007/s13300-022-01253-9
6. Fokkert M, van Dijk P, Edens M, et al. Improved well-being and decreased disease burden after 1-year use of flash glucose monitoring (FLARE-NL4). BMJ Open Diabetes Res Care. 2019;7(1):e000809 doi: https://doi.org/10.1136/bmjdrc-2019-000809
7. Wright EE, Jr., Kerr MSD, Reyes IJ, et al. Use of Flash Continuous Glucose Monitoring Is Associated With A1C Reduction in People With Type 2 Diabetes Treated With Basal Insulin or Noninsulin Therapy. Diabetes Spectr. 2021;34(2):184-189 doi: https://doi.org/10.2337/ds20-0069
8. Wright EE, Roberts GJ, Chuang JS, et al. Initiating GLP-1 Therapy in Combination with FreeStyle Libre Provides Greater Benefit Compared with GLP-1 Therapy Alone. Diabetes Technol Ther. 2024;26(10):754-762. doi: https://doi.org/10.1089/dia.2024.0015
9. Yaron M, Roitman E, Aharon-Hananel G, et al. Effect of Flash Glucose Monitoring Technology on Glycemic Control and Treatment Satisfaction in Patients With Type 2 Diabetes. Diabetes Care. 2019;42(7):1178-1184. doi: https://doi.org/10.2337/dc18-0166
10. Лаптев Д.Н., Безлепкина О.Б., Демина Е.С., и соавт. Результаты клинической апробации системы FreeStyle Libre у детей с сахарным диабетом 1 типа: улучшение гликемического контроля в сочетании со снижением риска тяжелой гипогликемии и диабетического кетоацидоза // Проблемы эндокринологии. — 2022. — Т. 68. — №3 — С. 86-92. doi: https://doi.org/10.14341/probl12877
11. Danne T, Nimri R, Battelino T, et al. International Consensus on Use of Continuous Glucose Monitoring. Diabetes Care. 2017;40(12):1631-1640. doi: https://doi.org/10.2337/dc17-1600
12. Bailey TS, Alva S. Landscape of Continuous Glucose Monitoring (CGM) and Integrated CGM: Accuracy Considerations. Diabetes Technol Ther. 2021;23(S3):S5-S11. doi: https://doi.org/10.1089/dia.2021.0236
13. Mathieu C, Irace C, Wilmot EG, et al. Minimum expectations for market authorization of continuous glucose monitoring devices in Europe-’eCGM’ compliance status. Diabetes Obes Metab. 2025;27(3):1025-1031. doi: https://doi.org/10.1111/dom.16153
14. Pemberton JS, Wilmot EG, Barnard-Kelly K, et al. CGM accuracy: Contrasting CE marking with the governmental controls of the USA (FDA) and Australia (TGA): A narrative review. Diabetes Obes Metab. 2023;25(4):916-939. doi: https://doi.org/10.1111/dom.14962
15. Петеркова В.А., Аметов А.С., Майоров А.Ю., и соавт. Резолюция научно-консультативного совета «Применение технологии непрерывного мониторинга глюкозы с периодическим сканированием в достижении гликемического контроля» // Сахарный диабет. — 2021. — Т. 24. — № 2. — С. 185-192. doi: https://doi.org/10.14341/DM12753
16. Clinical and Laboratory Standards Institute (CLSI). Performance Metrics for Continuous Interstitial Glucose Monitoring (CLSI Guideline POCT05). 2nd ed. Wayne, PA: CLSI; 2020
17. Момыналиев К.Т., Прокопьев М.В., Иванов И.В. О стандартизации и оценке систем непрерывного мониторинга уровня глюкозы. Эталоны // Стандартные образцы. — 2023. — Т. 19. — № 5. — С. 113-125. doi: https://doi.org/10.20915/2077-1177-2023-19-5-113-125
18. Ajjan RA, Cummings MH, Jennings P, et al. Accuracy of flash glucose monitoring and continuous glucose monitoring technologies: Implications for clinical practice. Diab Vasc Dis Res. 2018;15(3):175-184 doi: https://doi.org/10.1177/1479164118756240
19. Vigersky RA, Shin J. The Myth of MARD (Mean Absolute Relative Difference): Limitations of MARD in the Clinical Assessment of Continuous Glucose Monitoring Data. Diabetes Technol Ther. 2024;26(S3):38-44. doi: https://doi.org/10.1089/dia.2023.0435
20. Zhu J, Volkening LK, Laffel LM. Distinct Patterns of Daily Glucose Variability by Pubertal Status in Youth With Type 1 Diabetes. Diabetes Care. 2020;43(1):22-28 doi: https://doi.org/10.2337/dc19-0083
21. Heinemann L, Schoemaker M, Schmelzeisen-Redecker G, et al. Benefits and Limitations of MARD as a Performance Parameter for Continuous Glucose Monitoring in the Interstitial Space. J Diabetes Sci Technol. 2020;14(1):135-150 doi: https://doi.org/10.1177/1932296819855670
22. Klonoff DC, Gabbay M, Moon SJ, Wilmot EG. Importance of FDA-Integrated Continuous Glucose Monitors to Ensure Accuracy of Continuous Glucose Monitoring. J Diabetes Sci Technol. 2024:19322968241250357 doi: https://doi.org/10.1177/19322968241250357
23. Freckmann G, Eichenlaub M, Waldenmaier D, et al. Clinical Performance Evaluation of Continuous Glucose Monitoring Systems: A Scoping Review and Recommendations for Reporting. J Diabetes Sci Technol. 2023;17(6):1506-1526 doi: https://doi.org/10.1177/19322968231190941
24. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Клинические рекомендации. Сахарный диабет 1 типа у взрослых (2022 г). Доступно по ссылке: https://cr.minzdrav.gov.ru/preview-cr/286_2
25. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Клинические рекомендации. Сахарный диабет 2 типа у взрослых (2022 г). Доступно по ссылке: https://cr.minzdrav.gov.ru/preview-cr/290_2
26. Петеркова В.А., Шестакова М.В., Безлепкина О.Б., и др. Клинические рекомендации. Сахарный диабет 1 типа у детей (2022). Доступно по ссылке: https://cr.minzdrav.gov.ru/preview-cr/287_3
27. Food and Drug Administration (FDA) [Internet]. Classification of the integrated continuous glucose monitoring system. Federal register February 18. 2022 [accessed 28 Feb 2025]. Available from: https://www.federalregister.gov/documents/2022/02/18/2022-03504/medical-devices-clinicalchemistry-and-clinical-toxicology-devices-classification-ofthe-integrated
Об авторах
М. В. ШестаковаРоссия
Шестакова Марина Владимировна - д.м.н., профессор, академик РАН.
117292, Москва, ул. Дм. Ульянова, д. 11
Scopus Author ID 7004195530
Конфликт интересов:
Нет
В. А. Петеркова
Россия
Петеркова Валентина Александровна - д.м.н., профессор, академик РАН.
Москва
Конфликт интересов:
Нет
Г. Р. Галстян
Россия
Галстян Гагик Радикович - д.м.н., профессор.
Москва
Конфликт интересов:
Нет
Л. И. Ибрагимова
Россия
Ибрагимова Людмила Ибрагимовна - к.м.н.
Москва
Конфликт интересов:
Нет
В. В. Климонтов
Россия
Климонтов Вадим Валерьевич - д.м.н., профессор.
Новосибирск
Researcher ID R-7689-2017; Scopus Author ID 8295977000
Конфликт интересов:
Нет
Д. Н. Лаптев
Россия
Лаптев Дмитрий Никитич - д.м.н.
Москва
Researcher ID O-1826-2013; Scopus Author ID 24341083800
Конфликт интересов:
Нет
И. П. Малая
Россия
Малая Ирина Павловна - к.м.н.
Москва
Researcher ID AAO-8351-2021; Scopus Author ID 57218705086
Конфликт интересов:
Нет
Е. А. Шестакова
Россия
Шестакова Екатерина Алексеевна - д.м.н.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Минимальные требования к точности систем непрерывного мониторирования глюкозы, предложенные Европейской экспертной рабочей группой [13]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(569KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шестакова М.В., Петеркова В.А., Галстян Г.Р., Ибрагимова Л.И., Климонтов В.В., Лаптев Д.Н., Малая И.П., Шестакова Е.А. Иллюзия точности: критический анализ методов оценки качества систем непрерывного мониторирования глюкозы. Сахарный диабет. 2025;28(3):231-239. https://doi.org/10.14341/DM13329
For citation:
Shestakova M.V., Peterkova V.A., Galstyan G.R., Ibragimova L.I., Klimontov V.V., Laptev D.N., Malaya I.P., Shestakova E.A. The illusion of accuracy: a critical analysis of continuous glucose monitoring systems quality assessment methods. Diabetes mellitus. 2025;28(3):231-239. (In Russ.) https://doi.org/10.14341/DM13329
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































