Перейти к:
Гетерогенность аутоиммунного сахарного диабета у взрослых: данные реальной клинической практики
https://doi.org/10.14341/DM13319
Аннотация
ОБОСНОВАНИЕ. Аутоиммунный сахарный диабет (СД) у взрослых обладает значительной гетерогенностью. Особое внимание привлекают пациенты с медленным развитием аутоиммунного СД, отсутствием потребности в инсулине в дебюте заболевания. Исследования гетерогенности аутоиммунного СД имеют ключевое значение для разработки персонализированных подходов к лечению, направленных на сохранение функции β-клеток и увеличение длительности инсулиннезависимой фазы заболевания.
ЦЕЛЬ. Изучить гетерогенность аутоиммунного СД у взрослых и выявить факторы, ассоциированные с более поздним назначением инсулинотерапии в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен ретроспективный анализ клинических и лабораторных данных 717 пациентов с дебютом СД в возрасте старше 18 лет, которым в ФГБУ «НМИЦ эндокринологии» в период 2017–2022 гг. исследованы антитела к антигенам β-клетки (к GAD, IA-2, ICA, ZnT8, инсулину). Использованы данные электронных медицинских карт базы ФГБУ «НМИЦ эндокринологии» и анкет Базы данных клинико-эпидемиологического мониторинга СД на территории Российской Федерации. Проведено сравнение групп с повышенным и нормальным титром антител и сравнение пациентов с аутоиммунным СД с разным сроком назначения инсулинотерапии.
РЕЗУЛЬТАТЫ. У 370 пациентов (51,6%) выявлены повышенные антитела к антигенам β-клетки. Комбинация двух и более антител в дебюте СД встречалась у 63,7% пациентов. Чаще были повышены антитела к ZnT8, GAD, IA-2. Пациенты с положительными и отрицательными антителами не различались по возрасту дебюта СД, однако первые в дебюте характеризовались более низким индексом массы тела (ИМТ), большей частотой кетоацидоза, более низким уровнем С-пептида, мочевой кислоты, триглицеридов. У 36,8% пациентов с положительными антителами потребность в инсулине возникала не ранее, чем через 6 месяцев от дебюта заболевания (через 2 [1; 3] года). В дебюте и в первые 5 лет эти пациенты демонстрировали более высокий ИМТ и уровни триглицеридов, С-пептида; 8,9% пациентов с повышенными антителами получали только пероральные сахароснижающие препараты (ПССП) и/или агонисты рецептора глюкагоно-подобного полипептида 1 (арГПП-1) через 3 [2; 7,5] года от дебюта, при этом уровень гликированного гемоглобина составил 6,7 [6,2; 7,75]%.
ЗАКЛЮЧЕНИЕ. Аутоиммунный СД у взрослых характеризуется гетерогенностью по темпам снижения функции β-клеток и развития инсулинопотребности. Более позднее назначение инсулинотерапии при аутоиммунном СД ассоциировано со старшим возрастом дебюта заболевания, более высокими ИМТ, уровнем триглицеридов и С-пептида в дебюте заболевания и в динамике. Применение ПССП и/или арГПП1 у пациентов с сохранным уровнем С-пептида может быть рассмотрено при условии регулярного контроля показателей углеводного обмена и уровня С-пептида. Основным патогенетическим средством лечения при аутоиммунном СД остается заместительная инсулинотерапия.
Ключевые слова
Для цитирования:
Русяева Н.В., Кононенко И.В., Викулова О.К., Смирнова О.М., Шестакова М.В. Гетерогенность аутоиммунного сахарного диабета у взрослых: данные реальной клинической практики. Сахарный диабет. 2025;28(2):136-150. https://doi.org/10.14341/DM13319
For citation:
Rusyaeva N.V., Kononenko I.V., Vikulova O.K., Smirnova O.M., Shestakova M.V. Heterogeneity of autoimmune diabetes mellitus in adults: real-world clinical practice. Diabetes mellitus. 2025;28(2):136-150. (In Russ.) https://doi.org/10.14341/DM13319
ОБОСНОВАНИЕ
По данным Международной федерации сахарного диабета (СД) (IDF), в 2021 г. в мире насчитывалось 8,4 млн человек, больных СД 1 типа (СД1). Ежегодный прирост составляет более 500 000 новых случаев в год. Предполагается, что в 2040 г. число лиц с СД1 увеличится до 13,5–17,4 млн [1][2]. По данным IDF 2024 г., из общей численности пациентов с СД1 только 1,81 млн (19,8%) были моложе 20 лет, 6,28 млн (68,6%) были в возрасте от 20 до 59 лет, а 1,06 млн (11,8%) — 60 лет и старше [3].
Заболеваемость СД1 среди детского населения в 2–3 раза выше, чем у взрослых. Так, по данным Росстата, в 2023 г., заболеваемость СД1 (количество больных с диагнозом, установленным впервые в жизни) в возрастной группе от 0 до 14 лет составила 25,5 новых случая на 100 тыс. детского населения (6524 новых случая в год), в возрастной группе 15–17 лет — 32,1/100 тыс. населения (1485 новых случаев в год), у взрослых — 11,9/100 тыс. населения (13 844 новых случая в год) [4][5]. Таким образом, хотя заболеваемость СД1 у детей значительно выше, чем у взрослых, количество впервые выявленных случаев СД1 у взрослых значительно превышает данный показатель у детей.
Дифференциальная диагностика СД1 и СД 2 типа (СД2) у взрослых основывается на клинической картине в дебюте заболевания. Так, для СД1 характерно острое начало и выраженная декомпенсация углеводного обмена, развитие кетоза и кетоацидоза, отсутствие эффекта при назначении пероральных сахароснижающих препаратов (ПССП), значительное ухудшение состояния при отсутствии своевременного назначения инсулина. Однако в реальной клинической практике типичные проявления СД1 наблюдаются не всегда.
Улучшение методов диагностики и осведомленности врачей и населения о симптомах заболевания привело к тому, что диагностика СД1 все чаще происходит своевременно, до развития острой метаболической декомпенсации, а иногда даже на стадии начальных нарушений углеводного обмена [6]. В этом случае период времени до развития абсолютного дефицита инсулина и инсулинопотребности увеличивается, а вовремя начатая инсулинотерапия может приводить к более длительной ремиссии заболевания.
Латентный аутоиммунный диабет взрослых (LADA — Latent Autoimmune Diabetes in Adults) или СД типа 1,5) — особый вариант аутоиммунного СД — был описан еще в середине 80-х годов прошлого века. [7]. При этом подчеркивалось, что наличие аутоантител к антигенам β-клетки у взрослых пациентов с клинической картиной СД2 в дебюте заболевания свидетельствует о высоком риске развития инсулинопотребности. По разным данным, на долю LADA приходится 4–12% всех пациентов с диагнозом СД2 [8][9]. Однако многочисленные наблюдения указывают на значительные различия в сроках развития потребности в инсулине у пациентов с LADA. Так, несмотря на наличие антител, у одних пациентов необходимость назначения инсулина возникает уже в первые годы заболевания, тогда как у других компенсация углеводного обмена и через 10 лет достигается терапией ПССП [8].
В условиях стремительного роста заболеваемости СД исследования, направленные на выявление гетерогенности аутоиммунного СД, приобретают особую значимость. Понимание различных вариантов течения аутоиммунного СД способствует разработке более точных, персонализированных подходов к диагностике и лечению заболевания, направленных на оптимизацию сахароснижающей терапии (ССТ) и сохранение функции β-клеток.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить гетерогенность аутоиммунного СД у взрослых и выявить факторы, ассоциированные с более поздним назначением инсулинотерапии в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Изучаемая популяция
Пациенты с дебютом СД в возрасте 18 лет и старше, имеющие антитела к антигенам β-клеток поджелудочной железы.
Источник случаев: база электронных медицинских карт (ЭМК) ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России (далее — ФГБУ «НМИЦ эндокринологии»).
Критерии отбора пациентов:
- диагноз «СД» в ЭМК ФГБУ «НМИЦ эндокринологии» (коды МКБ-10: E10, E11, E13, E14);
- наличие в ЭМК ФГБУ «НМИЦ эндокринологии» результатов исследований антител к антигенам β-клеток поджелудочной железы, проведенных в период с 2017 по 2022 гг.;
- дебют СД в возрасте 18 лет и старше;
- наличие сведений о пациенте в Базе данных клинико-эпидемиологического мониторинга СД (БД СД) на территории Российской Федерации ФГБУ «НМИЦ эндокринологии» Минздрава России по состоянию на 01.08.2024 г.
Дизайн исследования
Когортное исследование с ретроспективным анализом базы данных.
- Одномоментный ретроспективный анализ клинических особенностей и иммунологического статуса (антитела к антигенам β-клетки) пациентов с аутоиммунным СД в дебюте заболевания.
- Ретроспективный анализ уровня С-пептида в дебюте заболевания, а также в динамике у пациентов с антителами к антигенам β-клетки (анализировались все доступные данные в ЭМК ФГБУ «НМИЦ эндокринологии»).
- Анализ ССТ на момент последнего визита (последнего обновления анкеты) в БД СД (на сроке 5 [ 3; 7] лет от дебюта СД). Необходимо подчеркнуть, что длительность наблюдения, которая учитывалась при анализе ССТ, была в среднем меньше, чем при анализе иммунологического статуса и С-пептида. Это связано с тем, что в некоторых случаях последняя запись в анкете пациента в БД СД была сделана существенно раньше до его обследования в НМИЦ эндокринологии.
- Анализ сроков назначения инсулинотерапии у пациентов, имеющих антитела к антигенам β-клетки. При этом пациенты были разделены на 2 группы: с началом постоянной инсулинотерапии в первые 6 мес и более, чем через 6 мес от начала заболевания.
- Анализ изменения диагноза: первый и последний доступный диагноз.
Дизайн исследования представлен на рис. 1.
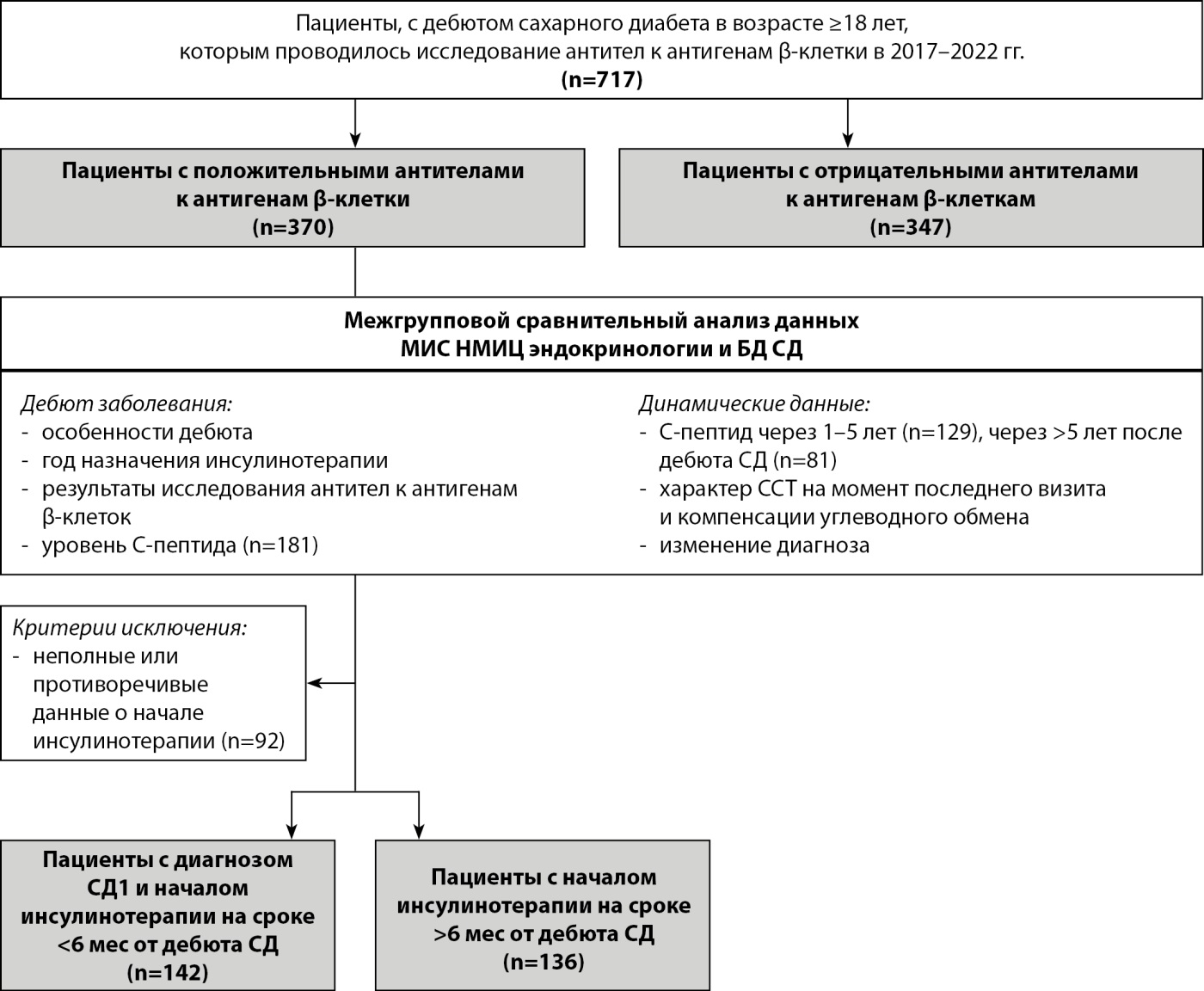
Рисунок 1. Дизайн исследования.
Примечание. МИС — медицинская информационная система; ССТ — сахароснижающая терапия; СД — сахарный диабет; СД1 — сахарный диабет 1 типа
Методы
Обезличенные данные анамнеза, лабораторных исследований, клинических характеристик пациентов были загружены из ЭМК ФГБУ «НМИЦ эндокринологии», а также из анкет пациентов в БД СД (визит в год дебюта СД и последний доступный визит).
Анализировались следующие параметры:
- Данные анамнеза:
- возраст дебюта СД;
- сведения о ССТ: проанализированы данные последнего визита БД СД (тип ССТ и уровень HbA1c). С целью достижения сопоставимости групп по длительности заболевания в анализ были включены только пациенты со сроком наблюдения до 15 лет включительно;
- сроки назначения постоянной инсулинотерапии: точные сведения для каждого пациента собраны из записей в ЭМК НМИЦ эндокринологии.
- Антропометрические характеристики: индекс массы тела (ИМТ) в дебюте заболевания.
- Результаты лабораторных исследований:
- биохимические показатели: общий холестерин, липопротеиды низкой плотности (ЛПНП), липопротеиды высокой плотности (ЛПВП), триглицериды, мочевая кислота в дебюте заболевания (первый год) и в динамике;
- уровень С-пептида в дебюте (первый год заболевания) и в динамике. Референсные значения (РИ) 1,1–4,4 нг/мл. Сохранным считался уровень С-пептида ≥1,1 нг/мл;
- результаты исследования антител к антигенам β-клетки: антител к глутаматдекарбоксилазе (GAD, референсный интервал (РИ) 0–10 Ед/мл), тирозинфосфатазе (IA-2, РИ 0–10 Ед/мл), островковым клеткам поджелудочной железы (ICA, РИ 0–1 Ед/мл); транспортеру цинка 8 (ZnT8, РИ 0–15 Ед/мл); инсулину (IAA, РИ 0–10 Ед/мл).
- Положительным результатом иммунологического анализа считалось наличие хотя бы одного вида антител выше РИ;
- уровень гликированного гемоглобина (HbA1c, %).
- Сведения о первом доступном и последнем (итоговом) диагнозах и датах их установления.
Статистический анализ
Статистическую обработку данных выполняли в программе Statistica 13.5.0.17 х86 (Tibco Software, 2018). Для оценки нормальности распределения признаков применялся критерий Колмогорова-Смирнова.
Распределение количественных признаков представлено в виде медиан и межквартильного интервала (25%- и 75%-квартили) — Me [ Q1; Q3]. Качественные данные представлены в виде абсолютных (n) и относительных величин (%).
Значимость различий между количественными признаками в независимых выборках оценивалась с помощью критерия Краскелла-Уоллиса для всей выборки в целом, попарные межгрупповые различия — с помощью U-критерия Манна-Уитни. Попарные межгрупповые различия — с помощью точного критерия Фишера (two-sided p), для множественных сравнений — критерий Фримена-Холтона. Корреляцию между переменными оценивали с помощью ранговой корреляции Спирмена. Статистически значимым считали уровень ошибки первого рода менее 5% (p<0,05), также учитывалась поправка Беньямини-Хохберга на множественные сравнения (с помощью сервиса https://tools.carbocation.com/FDR).
Этическая экспертиза
Проведение научно-исследовательской работы было одобрено локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России. Выписка из протокола №18 заседания локального этического комитета от 12 октября 2022 г.
РЕЗУЛЬТАТЫ
В выборку включено 717 пациентов с СД (412 женщин и 305 мужчин), которым в период с 2017 по 2022 гг. было проведено исследование антител к антигенам β-клетки. Средний возраст дебюта заболевания — 35 [ 27; 46] лет. Повышение антител было обнаружено у 370 пациентов (51,6%).
Результаты исследований антител к антигенам β-клетки
Длительность заболевания на момент исследования антител составила 1 [ 0; 5] год. У 378 пациентов анализ проведен в первый год заболевания, у 94 — через 2–3 года от дебюта заболевания, у 230 — более, чем через 3 года (на сроке 9 [ 6; 15] лет от дебюта). У 15 пациентов исследование проводилось еще до манифестации СД.
Исследование трех и более антител проводилось у 526 пациентов. Чаще всего исследовались 3 вида антител (n=224), реже — 5 (n=164) и 4 (n=138). Результаты исследования антител представлены в табл. 1.
Таблица 1. Результаты исследования антител (n=717)
|
Вид антитела (референсный интервал) |
Пациенты, которым проводилось исследование этого вида антител, n (%) |
Пациенты с наличием антитела к антигенам β-клетки, n (%) |
Титр антител, Ед/л |
|
Антитела к GAD (РИ 0–10 Ед/л) |
610 (85,1) |
195 (32,2) |
250 [ 97,6; 1634] |
|
Антитела к IA-2 (РИ 0–10 Ед/л) |
565 (78,8) |
175 (31,0) |
233,2 [ 65,1; 336,5] |
|
Антитела к ICA (РИ 0–1 Ед/л) |
411 (57,3) |
96 (23,4) |
12,55 [ 6,55; 15,8] |
|
Антитела к ZnT8 (РИ 0–15 Ед/л) |
423 (59,0) |
164 (38,8) |
228,65 [ 39,6; 486,6] |
|
Антитела к инсулину (РИ 0–10 Ед/л) |
333 (46,4) |
18 (5,41) |
13,595 [ 10,9; 20,7] |
Примечание. * — учитывались только значения выше референса лаборатории. GAD — глутаматдекарбоксилаза; IA-2 — тирозинфосфатаза; ICA — антигены островковых клеток: ZnT8 — транспортер цинка-8; РИ — референсный интервал.
Подробная характеристика комбинаций антител представлена на рисунке в приложении 1, рис. 1. Среди пациентов, которым иммунологическое исследование проводилось в течение первого года заболевания, исследование трех и более антител было проведено у 157 пациентов, при этом наличие комбинации ≥2-х положительных антител отмечалась у 63,7% (100 пациентов).
Клиническая характеристика пациентов с аутоиммунным сахарным диабетом в дебюте заболевания. Особенности иммунологического статуса
Антитела к антигенам β-клетки являются маркерами аутоиммунного СД, что позволяет рассматривать пациентов с положительными антителами как пациентов с аутоиммунным СД.
Средний возраст дебюта СД у пациентов с положительными антителами составил 34 [ 25; 47] года, ИМТ — 22,9 [ 20,7; 26,0] кг/м². Пациенты с положительными и отрицательными антителами не различались по полу и возрасту дебюта заболевания (табл. 2), однако в дебюте заболевания пациенты с положительными антителами имели значимо меньший ИМТ, более низкие уровни триглицеридов и мочевой кислоты, у них чаще отмечался кетоацидоз и кетонурия.
Таблица 2. Клиническая характеристика пациентов в дебюте заболевания
|
Пациенты с положительными антителами (n=370) |
Пациенты с отрицательными антителами (n=347) |
P-значение |
|||
|
n |
Me [ Q1; Q3] |
n |
Me [ Q1; Q3] |
||
|
Пол, муж/жен, n (%) |
147/223 (39,7/60,3) |
158/189 (45,5/54,5) |
0,131 |
||
|
Возраст дебюта, лет |
370 |
34 [ 25; 47] |
347 |
35 [ 28; 44] |
0,337 |
|
Наличие в анамнезе данных о кетоацидозе/кетонурии в дебюте, n (%) |
85 (23) |
52 (14,9) |
0,011 |
||
|
ИМТ в дебюте, кг/м² |
183 |
22,9 [ 20,7; 26,0] |
157 |
24,9 [ 22,0; 28,4] |
<0,001 |
|
Категории ИМТ в дебюте, n (%): - недостаточная (ИМТ<18,5 кг/м²) - нормальная (ИМТ 18,5–24,9 кг/м²) - избыточная (ИМТ 25,0–29,9 кг/м²) - ожирение (ИМТ≥30,0 кг/м²) |
183 |
- 17 (9,29) - 104 (56,8) - 48 (26,2) - 14 (7,65) |
157 |
- 10 (6,37) - 72 (45,9) - 46 (29,3) - 29 (18,5) |
0,012 |
|
Общий холестерин, ммоль/л |
189 |
4,8 [ 4,2; 6] |
154 |
5 [ 4,25; 5,9] |
0,603 |
|
Триглицериды, ммоль/л |
150 |
0,91 [ 0,7; 1,33] |
120 |
1,19 [ 0,82; 1,9] |
<0,001 |
|
ЛПНП, ммоль/л |
135 |
3 [ 2,4; 3,77] |
99 |
3,08 [ 2,36; 4,0] |
0,716 |
|
ЛПВП, ммоль/л |
76 |
1,38 [ 1,11; 1,59] |
68 |
1,13 [ 0,96; 1,5] |
0,023* |
|
Мочевая кислота, мкмоль/л |
67 |
243 [ 194; 300] |
65 |
282 [ 230; 338] |
0,004 |
|
HbA1c, % |
153 |
8,4 [ 6,8; 10,5] |
129 |
7,9 [ 6,7; 10] |
0,302 |
|
Уровень С-пептида, нг/мл |
102 |
1,07 [ 0,74; 1,61] |
79 |
1,63 [ 1,29; 2,55] |
<0,001 |
Примечание. * — статистическая тенденция (p<0,05, но не достигает порога значимости с поправкой Беньямини-Хохберга).
HbA1c — гликированный гемоглобин; ИМТ — индекс массы тела; ЛПВП — липопротеиды высокой плотности; ЛПНП — липопротеиды низкой плотности.
При корреляционном анализе данных пациентов с положительными антителами были выявлены следующие закономерности:
- снижение титра антител к ZnT8 по мере увеличения длительности заболевания (r=-0,314, p <0,001);
- связь между антителами к GAD и ICA: пациенты с антителами к GAD чаще имели также антитела к ICA, причем в более высоком титре (p<0,001); титры этих антител положительно коррелировали между собой (r=0,335; p=0,003);
- связь между антителами к IA-2 и ZnT8: пациенты с антителами к IA-2 чаще имели повышенные антитела к ZnT8 (p=0,008);
- у пациентов с бóльшим количеством видов антител в дебюте заболевания наблюдался более низкий уровень С-пептида в дебюте (r=-0,395, p<0,001) и более высокий титр антител к ICA (r=0,408, p=0,002).
Вместе с тем не было выявлено корреляционной связи между титром антител (всех видов) и возрастом дебюта СД, ИМТ, уровнем С-пептида, как в дебюте заболевания, так и в динамике, а также периодом до назначения инсулинотерапии (p>0,05).
К концу первого года заболевания инсулинотерапию получали 70,2% пациента с положительными антителами и 63,8% пациентов с отрицательными антителами. Однако динамические данные о наличии ремиссии СД и отмене инсулинотерапии, назначении ПССТ отсутствуют.
В группе с положительными антителами у пациентов с ожирением инсулинотерапия (n=14) была инициирована позже (1 [ 0; 2,5] год), чем у пациентов без ожирения (n=169), которым инсулинотерапия была назначена в первый год заболевания (p<0,001).
Среди пациентов с положительными антителами, получающих инсулинотерапию, у 36,4% инсулинотерапия была назначена в срок более, чем через 6 мес от дебюта заболевания (через 2 [ 1; 3] года).
Основные характеристики пациентов на момент последнего визита представлены в табл. 1 приложения 2.
Функция β-клеток у пациентов с аутоиммунным сахарным диабетом в дебюте заболевания и в динамике
Для оценки функции β-клеток проводилось исследование С-пептида натощак.
Средний уровень С-пептида в дебюте заболевания у пациентов с положительными антителами был значимо ниже, чем у пациентов с отрицательными антителами (табл. 3). Несмотря на это, у 50% пациентов с положительными антителами уровень С-пептида натощак в дебюте сохранялся на уровне более 1,1 нг/мл. При сравнении по критерию Манна-Уитни пациенты с положительными антителами с сохранным (>1,1 нг/мл) и со сниженным С-пептидом (<1,1 нг/мл) не различались по титру и комбинации антител (p>0,05), несмотря на ранее выявленную отрицательную корреляцию между этими параметрами.
Таблица 3. Динамика С-пептида у пациентов с положительными и отрицательными антителами в дебюте сахарного диабета через 1–5 лет и >5 лет от дебюта заболевания
|
Пациенты с положительными антителами (n=370) |
Пациенты с отрицательными антителами (n=347) |
P-значение |
|||
|
n |
Me [ Q1; Q3] |
n |
Me [ Q1; Q3] |
||
|
Уровень С-пептида в дебюте заболевания |
|||||
|
Пациенты с С-пептидом >1,1 нг/мл в дебюте, n (%) |
102 |
51 (50,0) |
79 |
67 (85,8) |
<0,001 |
|
C-пептид в первый год заболевания, нг/мл |
1,07 [ 0,74; 1,61] |
1,63 [ 1,29; 2,55] |
<0,001 |
||
|
Уровень С-пептида спустя 1–5 лет от начала заболевания |
|||||
|
Пациенты с С-пептидом >1,1 нг/мл, n (%) |
76 |
34 (44,7) |
53 |
31 (58,5) |
0,153 |
|
Уровень С-пептида, нг/мл |
1,07 [ 0,5; 1,5] |
1,5 [ 0,75; 2,2] |
0,007 |
||
|
Длительность заболевания на момент исследования, лет |
3 [ 2; 3] |
3 [ 2; 4] |
0,555 |
||
|
Уровень С-пептида спустя >5 лет от начала заболевания |
|||||
|
Пациенты с уровнем С-пептида >1,1 нг/мл, n (%) |
33 |
9 (27,3) |
48 |
27 (56,3) |
0,013* |
|
Уровень С-пептида, нг/мл |
0,49 [ 0,07; 1,1] |
1,58 [ 0,7; 2,3] |
<0,001 |
||
|
Длительность заболевания на момент исследования, лет |
8 [ 7; 11] |
11 [ 7; 16] |
0,046 |
||
Примечание. * — статистическая тенденция.
Сохранный уровень С-пептида спустя 1–5 лет от дебюта заболевания (через 3 [ 2; 3] года) регистрировался у 34 пациентов с положительными антителами (44,7% обследованных), а при длительности наблюдения более 5 лет — у 9 из 33 пациентов (27,3%) с положительными антителами (табл. 3).
У пациентов с положительными антителами средний уровень С-пептида в динамике был значимо ниже, чем у пациентов с отрицательными антителами, как спустя 1–5 лет, так и спустя >5 лет от дебюта (табл. 3, рис. 2).
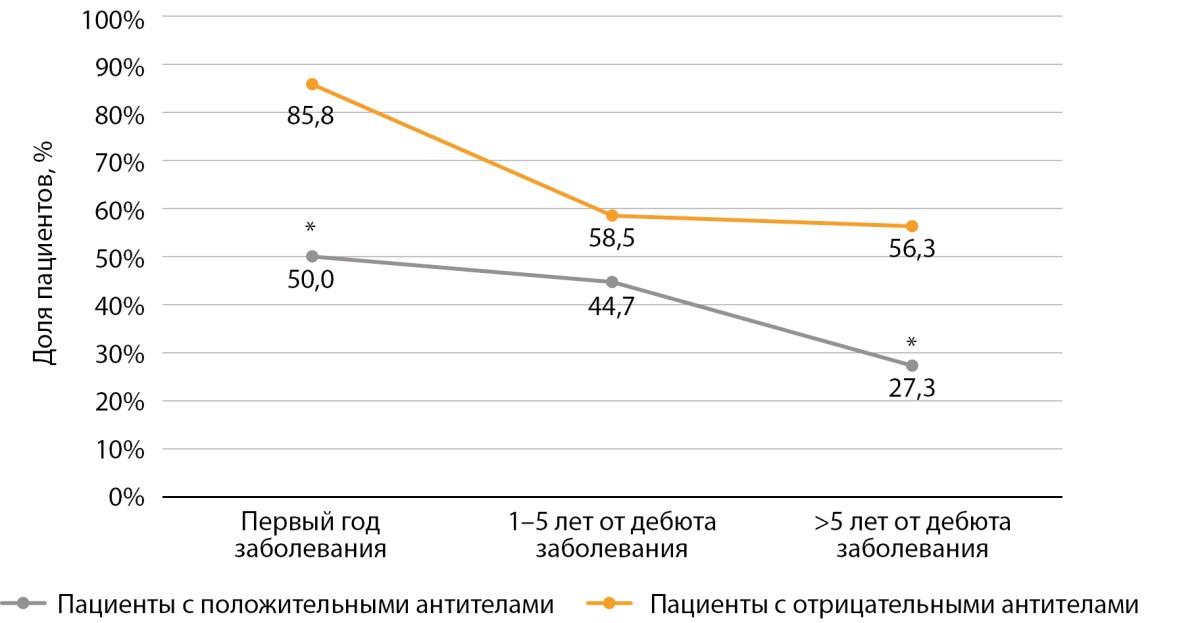
Рисунок 2. Доля пациентов с положительными и отрицательными антителами с сохранным уровнем базального С-пептида на разных сроках заболевания.
Примечание. * — статистически значимые различия.
Анализ сахароснижающей терапии
При анализе ССТ на момент последнего визита с целью достижения сопоставимости групп по длительности наблюдения в анализ были включены только пациенты с длительностью наблюдения до 15 лет включительно (n=592).
Данные о ССТ на момент последнего визита были доступны у 316 пациентов с положительными антителами. Медианный период наблюдения пациентов с положительными антителами составил 5 [ 3; 7] лет, возраст — 41 [ 32; 52] год. Инсулинотерапию получали 260 человек с положительными антителами (82,3%), ПССП и/или агонисты рецептора глюкагоноподобного пептида-1 (арГПП-1) — 28 человек (8,86%) и 27 человек (8,54%) — ПССП и/или арГПП-1 в комбинации с инсулином (рис. 3). Один пациент продолжал соблюдать только диету.
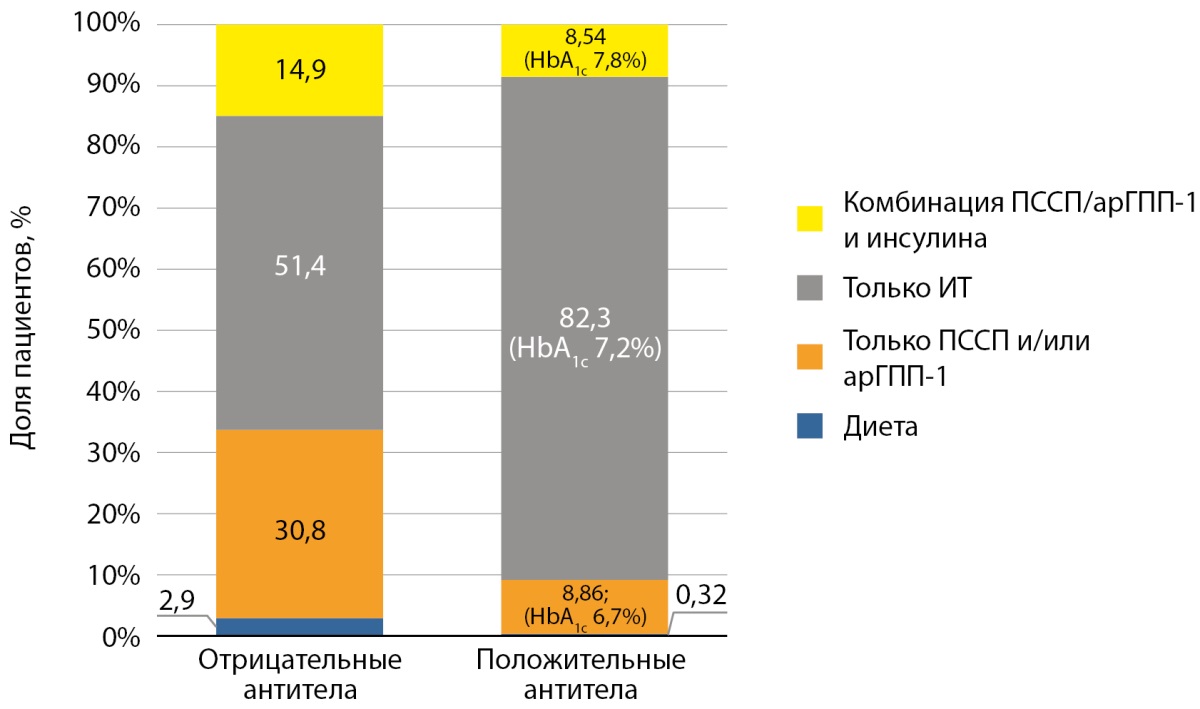
Рисунок 3. Структура сахароснижающей терапии на момент последнего визита в группах пациентов с отрицательными (n=276) и положительными (n=316) антителами.
Примечание. Различия между группами статистически значимы (p<0,001, критерий Фримена-Холтона). В анализ включены только пациенты с длительностью заболевания до 15 лет. Группы сопоставимы по длительности наблюдения (p=0,088).
HbA1c — гликированный гемоглобин; арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1; ПССП — пероральные сахароснижающие препараты.
У пациентов, получающих только ПССП и/или арГПП-1, уровень HbA1c на момент последнего визита составил 6,7 [ 6,2; 7,8]%, ПССП и/или арГПП-1 в комбинации с инсулинотерапией — 7,8 [ 6,5; 8,3]%.
Анализ сроков назначения инсулинотерапии
В ЭМК НМИЦ эндокринологии сведения о сроке назначения постоянной инсулинотерапии были доступны для 330 из 370 пациентов с положительными антителами. Однако у 44 пациентов сведения были неоднозначными и не позволяли точно установить срок назначения инсулинотерапии.
При анализе обнаружено, что 120 пациентам (36,4%) инсулинотерапия не назначалась в течение 6 мес от дебюта заболевания и впервые была начата спустя 2 [ 1; 3] года. Однако 8 из них были исключены из дальнейшего анализа в связи с тем, что сведения об инсулинотерапии в анкете БД СД противоречили данным ЭМК. Еще 24 пациентам (7,2%), по данным ЭМК, инсулинотерапия не назначалась вообще, что подкреплялось данными анкеты БД СД.
В зависимости от срока начала инсулинотерапии пациенты с положительными антителами были разделены на 3 группы.
1 группа: интенсифицированная инсулинотерапия была назначена в срок до 6 мес от дебюта заболевания и продолжалась на момент последнего визита (n=142). Диагноз «СД1» данным пациентам был установлен сразу в дебюте заболевания и не менялся в дальнейшем.
2 группа: инсулинотерапия была назначена через 6 и более месяцев от начала заболевания (спустя 2 [ 1; 3] года) или не назначена вообще (n=112). Из них 15 пациентов получали комбинацию инсулина и ПССП и/или арГПП-1 (период наблюдения 8 [ 4; 12] лет, HbA1c 7,8 [ 6,3; 8,4]%).
У 8 из 14 обследованных пациентов этой группы С-пептид в дебюте был в норме (≥1,1 нг/мл). Спустя 1–5 лет нормальный уровень С-пептида регистрировался у 14 из 38 обследованных пациентов, спустя >5 лет — у 4 из 15 обследованных.
Первоначально 49 пациентам этой группы (43,8%) был поставлен диагноз «СД2» (E11), у 18 пациентов (16,1%) тип СД не был определен (E13, E14), и только 45 пациентов (40,2%) имели диагноз «СД1» (E10) исходно.
3 группа: инсулинотерапия не назначена на сроке наблюдения 5 [ 3; 8] лет (n=24). При этом уровень HbA1c на момент последнего визита составил 6,9 [ 6,3; 7,9]%. Среди этих пациентов только один исходно имел диагноз «СД1». Данные об уровне С-пептида в этой группе ограниченны.
Пациенты 2‑й и 3‑й групп не различались по возрасту, ИМТ, уровню С-пептида в дебюте, титру антител, длительности наблюдения, HbA1c на момент последнего визита (p>0,05), поэтому при дальнейшем анализе были объединены в одну группу. В объединенной группе первоначальный диагноз «СД2» (E11) имели 69 пациентов (50,7%), неуточненный СД и «другие типы СД» — 21 пациент (15,4%). Только 46 пациентов (33,8%) имели диагноз «СД1» (E10) исходно.
Подробная сравнительная характеристика пациентов в зависимости от срока назначения инсулинотерапии представлена в табл. 4.
Таблица 4. Сравнительная характеристика пациентов с положительными антителами к антигенам β-клетки в зависимости от срока назначения инсулинотерапии
|
(1) Инсулин назначен в срок менее 6 мес от дебюта СД (n=142) |
(2) и (3) Инсулин назначен в срок позже 6 мес от дебюта СД или не назначен (n=136) |
Р-значение |
|||
|
n |
Me [ Q1; Q3] |
n |
Me [ Q1; Q3] |
||
|
Клинические характеристики в дебюте заболевания |
|||||
|
Возраст дебюта, лет |
142 |
28,5 [ 22,0; 37,0] |
136 |
39,5 [ 31; 50,5] |
<0,001 |
|
ИМТ в дебюте, кг/м² |
86 |
22,1 [ 19,1; 24,6] |
56 |
23,5 [ 21,9; 27,8] |
<0,001 |
|
Масса тела в дебюте: недостаток/нормальная/избыточная/ожирение, n (%) |
86 |
13/54/18/1 |
56 |
1/32/14/9 |
<0,001 |
|
Триглицериды в дебюте заболевания, ммоль/л |
65 |
0,78 [ 0,66; 1,13] |
41 |
1,07 [ 0,8; 1,5] |
0,007 |
|
С-пептид в динамике |
|||||
|
C-пептид в дебюте заболевания, нг/мл |
49 |
0,99 [ 0,57; 1,33] |
18 |
1,62 [ 0,83; 1,89] |
0,016# |
|
C-пептид через 1–5 лет заболевания, нг/мл |
8 |
0,37 [ 0,13; 0,72] |
43 |
1,07 [ 0,63; 1,46] |
0,006 |
|
C-пептид через >5 лет, нг/мл |
Мало данных (n=5; 0,03–0,98) |
18 |
0,42 [ 0,08; 1,37] |
0,550 |
|
|
Антитела к антигенам β-клетки |
|||||
|
Длительность наблюдения на момент исследования антител, лет |
142 |
0 [ 0; 3] |
136 |
2 [ 1; 3] |
<0,001 |
|
Число пациентов с наличием ≥2 повышенных антител*, n (%) |
114 |
60 (52,6) |
105 |
63 (60,0) |
0,280 |
|
Пациенты с повышенными антителами к GAD, n (%) |
127 |
67 (52,8) |
116 |
78 (67,2) |
0,026# |
|
Титр антител к GAD, Ед/мл |
67 |
225 [ 69,7; 780] |
78 |
320 [ 159; 2000] |
0,010# |
|
Титр антител к IA-2, Ед/мл |
75 |
151 [ 62,3; 305] |
59 |
245 [ 75,8; 358] |
0,148 |
|
Титр антител к ICA, Ед/мл |
33 |
12,1 [ 5,4; 15,7] |
37 |
12,8 [ 11,3; 15,7] |
0,521 |
|
Титр антител к ZnT8, Ед/мл |
66 |
260 [ 51,0; 500] |
56 |
277 [ 39,8; 476] |
0,742 |
|
Титр антител к инсулину, Ед/мл |
6 |
13,1 [ 10,9; 13,8] |
8 |
17,8 [ 12,5; 37,5] |
0,272 |
|
Данные последнего визита |
|||||
|
Длительность наблюдения на момент последнего визита, лет |
126 |
4 [ 3; 7] |
125 |
5 [ 3; 8] |
0,146 |
|
HbA1c на момент последнего визита, % |
107 |
7,2 [ 6,5; 7,9] |
107 |
7,2 [ 6,5; 8,0] |
0,889 |
Примечание. Показатели титров антител рассчитаны только для значений выше референсного интервала.
* — среди пациентов, которым исследовано 3 и более видов антител.
# — статистическая тенденция.
ИМТ — индекс массы тела; СД — сахарный диабет; GAD — глутаматдекарбоксилаза; IA-2 — тирозинфосфатаза; ICA — антигены островковых клеток: ZnT8 — транспортер цинка-8; HbA1c — гликированный гемоглобин
Пациенты с более поздним назначением инсулинотерапии имели больший возраст дебюта, ИМТ, уровень триглицеридов и демонстрировали более высокие показатели базального С-пептида в дебюте СД и на сроке 1–5 лет от дебюта. Количество повышенных видов антител не отличалось от группы 1, но выявлена статистическая тенденция к более частому выявлению антител к GAD и более высокому их титру.
При этом различий по уровню HbA1c на момент последнего визита при сопоставимой длительности заболевания между группами не выявлено (p=0,889). В группе пациентов, получающих только ПССП и/или арГПП-1, уровень HbA1c на сроке 5 [ 3; 8] лет от дебюта составил 6,9 [ 6,3; 7,9]%.
Изменение диагноза у пациентов
В группе пациентов с положительными антителами 58,5% имели первоначальный диагноз «СД1» (Е10), 119 пациентов (32,2%) — «СД2» (Е11), 0,8% были классифицированы, как «другие уточненные типы диабета», у 10,5% тип СД не был определен.
Обнаружение антител к антигенам β-клетки привело к тому, что 63 из 119 пациентов с исходным диагнозом «СД2», а также 29 пациентам с «неуточненным СД» был установлен диагноз «СД1».
Структура диагнозов отражена на рис. 4. В группе пациентов с положительными антителами диагноз менялся у 118 пациентов (31,9%) (рис. 4а), с отрицательными антителами — у 88 пациентов (25,4%) (рис. 4б).
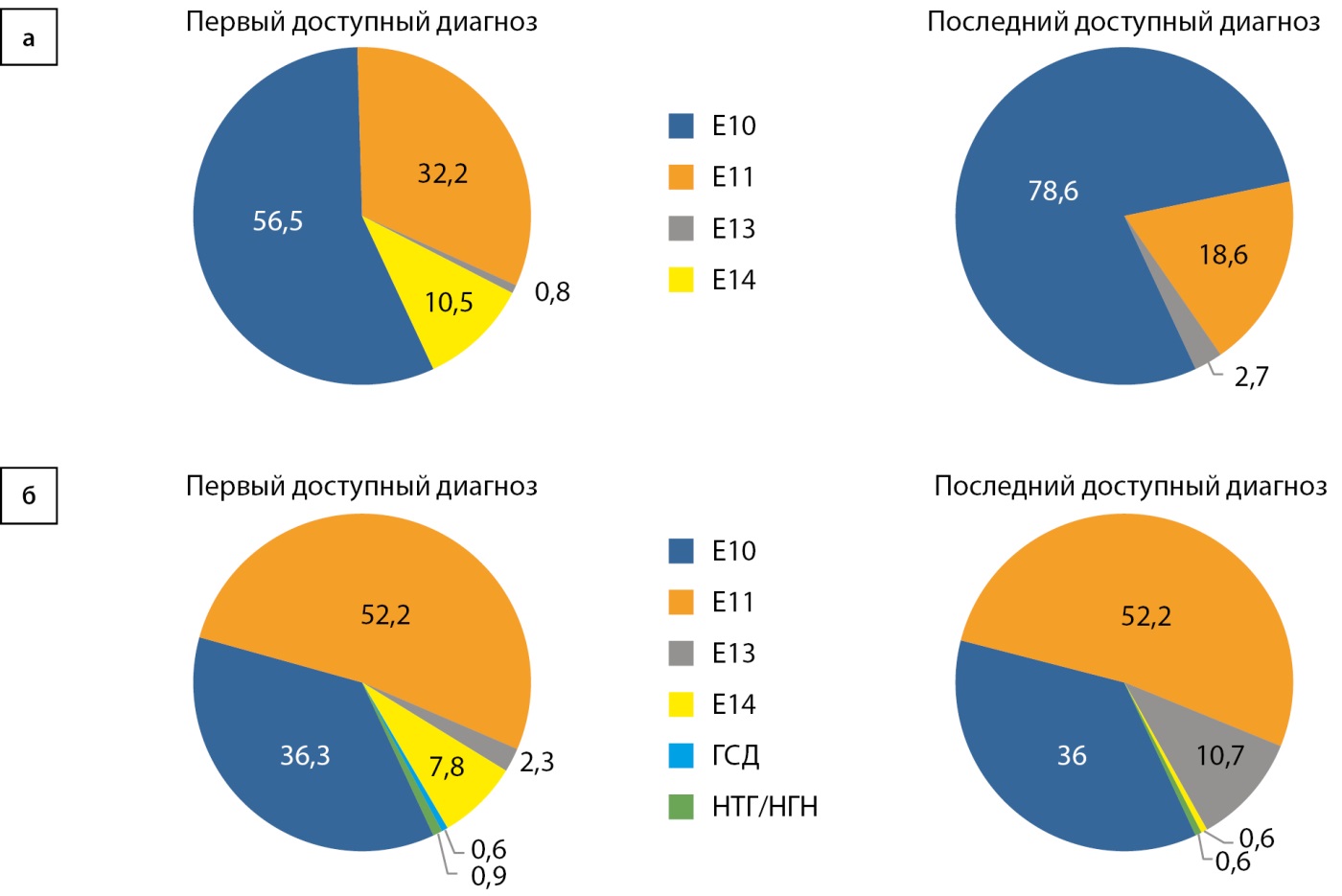
Рисунок 4. Изменение диагноза у пациентов с положительными (а) и отрицательными (б) антителами к β-клеткам.
Примечание. В группе пациентов с отрицательными антителами (б) у 24 пациентов (6,9%) диагноз «СД1» был реклассифицирован в иные категории (коды МКБ-10: E11, E13 или E14), еще у 24 пациентов (6,9%), напротив, из «иных типов» — в «СД1», в результате чего общее количество пациентов с СД1 и СД2 в этой группе не изменилось.
Е10 — инсулинозависимый сахарный диабет (сахарный диабет 1 типа); Е11 — инсулинонезависимый сахарный диабет (сахарный диабет 2 типа); Е13 — другие уточненные формы сахарного диабета; Е14 — сахарный диабет неуточненный (тип требует уточнения); ГСД — гестационный сахарный диабет; НТГ — нарушенная толерантность к глюкозе; НГН — нарушенная гликемия натощак.
У 34 пациентов с положительными антителами были дополнительно проведены молекулярно-генетические исследования с целью дифференциальной диагностики моногенных форм СД. У 5 из них были выявлены мутации в генах: GCK — у 2 пациентов, HNF1A — у 2 пациентов, Круппель-подобного фактора 11 (KLF11) — у 1 пациента.
Анализ группы пациентов с положительными антителами и диагнозом СД2
У 69 пациентов с положительными антителами был установлен итоговый диагноз «СД2». 42 из этих пациентов уже были рассмотрены в табл. 4 в группах (2) и (3).
В дебюте заболевания сохранный уровень С-пептида имели 13 из 14 обследованных пациентов данной группы (1,7 [ 1,26; 2,26] нг/мл), на сроке 1–5 лет (3 [ 1; 3] лет) — 8 из 13 пациентов (1,46 [ 0,79; 1,79] нг/мл), на сроке более 5 лет (11 [ 9; 19] лет) — 5 из 9 пациентов (1,40 [ 0,20; 1,92] нг/мл).
24 пациента получали ИТ на момент последнего визита, 16 — комбинированную терапию, 23 — только ПССП и/или арГПП-1, 1 пациент соблюдал диету. На момент последнего визита HbA1c у пациентов, получающих неинсулиновые препараты, в том числе в составе комбинированной ССТ, составил 7,2 [ 6,5; 7,9]% при сроке наблюдения 5 [ 2; 9] лет, у пациентов, получающих только инсулин, — 7,6 [ 7,1; 8,2]% при сроке наблюдения 5 [ 3; 7] лет.
ОБСУЖДЕНИЕ
Репрезентативность выборок
В наше исследование включены в основном те пациенты, которые были направлены на иммунологическое исследование крови в связи с трудностями при определении типа СД и выборе тактики лечения. В связи с этим выборка может не отражать естественное соотношение различных типов СД в популяции, но позволяет обратить внимание на клинические случаи, представляющие наибольшую сложность при определении типа СД у взрослых.
Кроме того, в выборку не вошли пациенты с СД, у которых исследование антител было выполнено в других ЛПУ, а также пациенты, не зарегистрированные в БД СД в РФ или снятые с учета.
Клиническая значимость результатов
Проведенное исследование основано на анализе данных реальной клинической практики и демонстрирует особенности дебюта аутоиммунного СД у взрослых и его гетерогенность.
Наличие антител к антигенам β-клеток указывает на наличие аутоиммунного СД. Возраст дебюта у пациентов, которым были исследованы антитела, составил 35 [ 27; 46] лет, что свидетельствует о том, что в этой возрастной категории определение типа СД вызывает наибольшие затруднения. Причем у 45% пациентов иммунологический анализ проведен спустя несколько лет от дебюта СД, что обусловлено, по всей видимости, сложностями не только при определении типа СД, но и при выборе тактики лечения. Это подчеркивает актуальность изучения гетерогенности СД у взрослых.
Общие характеристики пациентов с положительными антителами
У 73,4% обследованных пациентов проводилось исследование трех и более видов антител, что существенно повышает информативность проводимых иммунологических исследований. При этом комбинации 2 и более антител в первый год после дебюта СД встречались достаточно часто — у 63,7% пациентов. Антитела к ZnT8, к GAD и к IA-2 выявлялись практически с одинаковой частотой и в высоком титре. Существенно реже выявлялись антитела к инсулину и ICA.
Были обнаружены некоторые иммунологические особенности, а именно взаимосвязь между антителами к GAD и к ICA, а также между антителами к IA-2 и ZnT8. Так, у пациентов с антителами к GAD чаще выявлялись антитела к ICA, и их титр был выше; титры этих антител коррелировали между собой (r=0,335). У пациентов с повышенными антителами к IA-2 чаще были повышены и антитела к ZnT8.
Пациенты с положительными антителами характеризовались более низким ИМТ, уровнем триглицеридов и мочевой кислоты, более высоким уровнем ЛПВП в дебюте заболевания.
Известно, что наличие антител является важным предиктором развития потребности в инсулине. Результаты нашего исследования также подтверждают это: в группе пациентов с положительными антителами медианный уровень С-пептида, как в дебюте заболевания, так и через 1–5 лет и в период более 5 лет от начала заболевания, был значимо ниже, чем у пациентов с отрицательными антителами. В группе с аутоиммунным СД на момент последнего визита инсулинотерапию получали 82,3% пациента в сравнении с 51,4% из группы с отрицательными антителами. Причем у пациентов с положительными антителами инсулинотерапия назначалась раньше (p=0,019).
Гетерогенность аутоиммунного СД
При дальнейшем анализе группы пациентов, имеющих антитела к антигенам β-клетки, нам удалось продемонстрировать гетерогенность аутоиммунного СД у взрослых по темпам снижения секреции инсулина и развитию инсулинопотребности.
Показаны различные темпы снижения функции β-клеток у взрослых. Так, у 50% пациентов с положительными антителами уровень С-пептида натощак в течение первого года заболевания оставался в пределах референса (выше 1,1 нг/мл), а у ряда пациентов сохранный уровень С-пептида натощак отмечался и на сроке 1–5 лет от дебюта заболевания, и на сроке более 5 лет.
Отдельно проанализирована группа пациентов с положительными антителами, которым инсулинотерапия была назначена не ранее, чем через 6 мес от начала заболевания. Выбор данной отрезной точки был основан на критериях LADA, предложенных международным консенсусом экспертов в 2020 г. [9]. В эту же группу были включены 24 пациента, которым, несмотря на наличие антител, инсулин так и не был назначен на момент последнего визита (на сроке 5 [ 3; 8] лет от начала заболевания).
Выявлены некоторые особенности дебюта заболевания, ассоциированные с более поздним началом инсулинотерапии:
- более старший возраст дебюта заболевания;
- наличие избыточной массы тела или ожирения (более высокий ИМТ);
- более высокий уровень триглицеридов;
- более высокий С-пептид в дебюте заболевания и в течение первых 5 лет.
При этом пациенты с поздним началом инсулинотерапии имели такую же компенсацию углеводного обмена, что и пациенты, которым инсулинотерапия была назначена в первые 6 мес от дебюта, при той же длительности наблюдения.
Отчетливой взаимосвязи между сочетанием нескольких антител или их титром и сроком назначения инсулинотерапии не выявлено, хотя отмечена некоторая тенденция к более высокому титру GAD и более частому их выявлению у пациентов с медленным прогрессированием аутоиммунного СД. Это противоречит литературным данным [9] и может быть связано с различиями в длительности заболевания между группами, особенностями дизайна исследования и способом сбора данных.
Гетерогенность клинической картины аутоиммунного СД отражена в современной концепции выделения генетических и иммунологических эндотипов [10]. Исследования показывают, что для пациентов с дебютом СД в возрасте до 7 лет характерны более быстрая потеря функции β-клеток, ассоциация с HLA-гаплотипом DR4-DQ8 и высокий уровень аутоантител к инсулину (эндотип, ассоциированный с DR4-DQ8). У подростков и взрослых, напротив, проявления болезни менее интенсивны и часто сопровождаются признаками метаболических нарушений, что чаще связано с гаплотипом DR3-DQ2 и наличием антител к GAD (эндотип, ассоциированный с DR3-DQ2) [11–13]. Быстрое снижение секреции инсулина у детей связано с гипериммунным эндотипом (CD20hi), при котором инфильтрат поджелудочной железы изобилует В-клетками. Взрослые с медленным развитием заболевания демонстрируют иной иммунологический профиль, характеризующийся низким содержанием В-клеток в инфильтрате и близкий к CD20lo [14][15]. Важную роль в патогенезе аутоиммунного СД играют также снижение активности Tregs, повышенная активность CD8+ T-клеток и активация сигнального пути интерферона типа I, что также определяет течение заболевания [16–18].
Медленное течение аутоиммунного СД, ассоциированное с генетическим эндотипом DR3-DQ2 и иммунологическим эндотипом CD20lo, перекликается с медленным снижением инсулиновой секреции при LADA. Показано, что пациенты с высоким уровнем антител к GAD чаще требуют назначения инсулинотерапии на ранних этапах заболевания, тогда как пациенты с низким уровнем антител к GAD демонстрируют характеристики метаболического синдрома, характерные для СД2 [19].
Медленные темпы аутоиммунной деструкции β-клеток, отсутствие потребности в инсулинотерапии как минимум в первые 6 мес заболевания, клиническая картина, более характерная для СД2, в дебюте заболевания (отсутствие выраженной метаболической декомпенсации в дебюте) являются отличительными особенностями LADA.
Международной группой экспертов в 2020 г. были предложены следующие объективные критерии LADA: возраст дебюта старше 30 лет, наличие антител к антигенам β-клеток (наиболее часто антител к GAD), отсутствие потребности в инсулине в течение как минимум 6 мес после постановки диагноза [9]. В странах азиатского региона чаще используется термин «медленно прогрессирующий инсулинозависимый СД1» (slowly progressive type 1 insulin-dependent diabetes mellitus — SPIDDM), объединяющий пациентов с антителами к антигенам β-клетки, дебютом СД в любом возрасте, отсутствием потребности в инсулине в течение 3 мес после манифестации СД [20].
По данным UKPDS, потребность в инсулине возникала в первые 6 лет от дебюта заболевания у 58% пациентов с LADA, однако у некоторых пациентов она не развивалась и спустя >10 лет от дебюта [8]. По данным литературы, для более быстрого развития потребности в инсулине прогностическими факторами являются более низкий ИМТ в дебюте заболевания, количество повышенных видов антител, более высокий их титр, наличие предрасполагающих гаплотипов HLA, прием ПСМ в первый год заболевания [21–23].
Гетерогенность клинической картины LADA также подчеркивается результатами генетических исследований. Как и при СД1, у пациентов с LADA чаще встречаются предрасполагающие HLA-гаплотипы DR3-DQ2 и DR4-DQ8 [10][18][24]. Однако у этих пациентов также могут выявляться полиморфизмы, характерные для СД2, такие как вариации в гене TCF7L2, который играет важную роль в развитии инсулинорезистентности [25][26].
В нашем исследовании мы не ставили целью выделить группу пациентов с LADA, однако пациенты с антителами к антигенам β-клетки, которым инсулинотерапия была назначена позже, чем через 6 мес от начала заболевания или не назначена совсем, могут рассматриваться как пациенты с этим типом СД (n=136, 36,8%).
Современные подходы к выбору терапии при латентном аутоиммунном диабете взрослых (LADA)
Длительное время считалось, что единственным патогенетическим лечением LADA является инсулинотерапия [18]. Однако, учитывая медленные темпы деструкции β-клеток, часто возникают вопросы о времени назначения инсулинотерапии и, соответственно, об иной тактике ведения таких больных на этапе до развития потребности в инсулине.
Согласно международному консенсусу экспертов, для определения тактики лечения пациентов с LADA иммунологический анализ крови должен быть дополнен оценкой уровня С-пептида [9]. Предложен следующий алгоритм выбора терапии при LADA:
- при уровне С-пептида ниже 0,3 нмоль/л (0,9 нг/мл) показана интенсифицированная инсулинотерапия;
- при уровне С-пептида более 0,7 нмоль/л (2,1 нг/мл) — ведение по стандартам СД2;
- при уровне С-пептида в «серой зоне» (0,3–0,7 нмоль/л или 0,9–2,1 нг/мл) — в зависимости от клинической ситуации возможно применение ПССП, арГПП-1 и/или инсулинотерапии, при этом требуется мониторинг уровня С-пептида каждые 6 мес.
Хотя ПССП и/или арГПП-1 не являются традиционным выбором для лечения аутоиммунного СД, при LADA назначение такой терапии может быть рассмотрено на этапе до развития потребности в инсулине. Преимущества препаратов из группы иДПП-4, арГПП-1, тиазолидиндионов, метформина в отношении сохранения функции β-клеток при LADA были показаны в нескольких исследованиях [9][27–29]. Препараты ингибиторы натрий-глюкозного котранспортера 2 (ИНГЛТ2) менее изучены, и их применение несколько ограничено риском развития кетоацидоза, особенно у пациентов с ИМТ<27 кг/м² [9][30]. Так как пациенты с LADA имеют схожий риск развития неблагоприятных сердечно-сосудистых событий (особенно при наличии у них факторов сердечно-сосудистого риска — ожирения, дислипидемии), назначение ССТ препаратов с кардио- и нефропротективными свойствами может иметь дополнительные преимущества. Вместе с тем авторы алгоритма указывают на необходимость незамедлительного назначения инсулинотерапии при снижении уровня С-пептида.
Назначение препаратов сульфонилмочевины при LADA нежелательно, так как препараты этой группы могут способствовать более быстрой потере функции β-клеток [9][27][31].
Мы выявили группу пациентов с аутоиммунным СД (8,9% выборки), которые на момент последнего обновления анкеты в БД СД получали только ПССП и/или арГПП-1. На сроке 3 [ 2; 7,5] года от дебюта заболевания уровень HbA1c у них составил 6,7 [ 6,2; 7,75] %. Более того, 24 пациентам инсулин не назначался вообще, и на всем протяжении заболевания они получали только ПССП и/или арГПП-1, имея при этом удовлетворительную компенсацию углеводного обмена на сроке 5 [ 3; 8] лет от дебюта СД.
По всей видимости, в нетипичных клинических случаях, помимо исследования антител к антигенам β-клетки, определение уровня С-пептида может быть полезным для выбора тактики лечения, как в дебюте, так и в динамике.
Немаловажно, что назначение неинсулиновых препаратов у пациентов LADA может быть затруднено тем, что согласно действующей классификации LADA относится к СД1. Эти особенности находят отражение и в наших результатах: так, несмотря на наличие антител, у 18,6% пациентов в качестве итогового диагноза был указан СД2 (E11). По данным БД СД, на сроке 6 [ 3; 8] лет от дебюта заболевания 56,5% этих пациентов получали ПССП и/или арГПП-1 (в том числе в комбинации с инсулином) и имели при этом такую же компенсацию заболевания, как при назначении только инсулинотерапии. В дебюте заболевания у этих пациентов наблюдался сохранный уровень С-пептида (1,7 [ 1,26; 2,26] нг/мл). Понимая возможность различной тактики лечения пациентов с LADA, эксперты ВОЗ в 2019 г. предложили выделить медленно прогрессирующий СД взрослых в категорию гибридных форм СД [32], что предполагало бы возможность назначения как инсулина, так и неинсулиновых препаратов.
Дифференциальная диагностика аутоиммунного СД
В то время как диагностика классического СД1 обычно не вызывает затруднений и основывается на клинической картине заболевания, выявление случаев аутоиммунного СД среди пациентов с фенотипом СД2 остается актуальной проблемой [33]. Неоднократно предпринимались попытки разработки инструментов для выявления аутоиммунного СД на основании клинических параметров [34–36]. Однако основой диагностики аутоиммунного СД остается анализ крови на аутоантитела к β-клеткам поджелудочной железы. Так, по нашим данным, результат иммунологического анализа позволил диагностировать СД1 у 92 пациентов с первоначальным диагнозом СД2 или неуточненным СД.
Наконец, в нашем исследовании находит отражение необходимость дифференциальной диагностики моногенных форм СД у взрослых молодых пациентов. Так, в группе взрослых пациентов с окончательным диагнозом СД1 у 125 пациентов (98 из них — молодого возраста) антитела к антигенам β-клеток были отрицательными, при этом МГИ были проведены только у 11 из них. Остается открытым вопрос о необходимости проведения молекулярно-генетического исследования (МГИ) и возможном наличии моногенных форм СД у остальных пациентов. Отсутствие достаточного объема данных о наследственном анамнезе в МИС и БД СД указывает на то, что, к сожалению, в реальной клинической практике уделяется недостаточное внимание наличию отягощенного семейного анамнеза в отношении СД.
ВЫВОДЫ
- Дебют СД в возрасте 35 [ 27; 46] лет (т.е. у молодых взрослых пациентов) вызывает наибольшие трудности в дифференциальной диагностике различных типов СД. Наличие антитела к антигенам β-клетки остается основным маркером аутоиммунного СД и является предиктором снижения функции β-клеток и развития инсулинопотребности.
- Наличие антител ассоциировалось с более низким ИМТ, уровнем триглицеридов и мочевой кислоты.
- Комбинация 2-х и более антител в дебюте заболевания наблюдалась у 63,7% взрослых пациентов.
- У 50,0% пациентов с аутоиммунным СД с дебютом заболевания в возрасте 34 [ 25; 47] лет в течение первого года заболевания уровень С-пептида был выше 1,1 нг/мл.
- У 36,8% пациентов с дебютом аутоиммунного СД во взрослом возрасте потребность в назначении инсулинотерапии возникала позже 6 мес от дебюта заболевания. В 50,7% случаев данным пациентам исходно был поставлен диагноз СД2. Данные пациенты характеризовались более поздним возрастом дебюта, более высоким ИМТ и уровнем триглицеридов, более высоким уровнем С-пептида в дебюте и на сроке до 5 лет от начала заболевания.
- Несмотря на наличие антител к антигенам β-клеток, у некоторых больных отсутствует потребность в назначении инсулинотерапии даже спустя 5 [ 3; 8] лет от начала заболевания.
Ограничения исследования
В нашей выборке доля «неклассических» случаев СД1 может быть выше, чем в генеральной совокупности, так как выборку составили пациенты, которым проводилось исследование антител в реальной клинической практике, по всей видимости, для уточнения типа СД и тактики лечения. Исследование антител проводилось на разных сроках заболевания, что может влиять на уровень антител.
Оценка потребности в инсулине основывалась на сведениях о назначенной врачом терапии. Объективные данные об уровне С-пептида на разных этапах заболевания были ограниченны и не позволяли всесторонне оценить взаимосвязь между этим показателем и степенью компенсации углеводного обмена в группе пациентов с положительными антителами, получающих только неинсулиновую терапию.
ЗАКЛЮЧЕНИЕ
Аутоиммунный СД у взрослых характеризуется фенотипической гетерогенностью, которая проявляется различными темпами снижения функции β-клеток и развития инсулинопотребности. Базальный уровень С-пептида может находиться выше референсного значения у 50% пациентов в дебюте заболевания, а у некоторых пациентов и спустя 1–5 лет от начала заболевания. Для своевременной диагностики аутоиммунного СД в молодом взрослом возрасте необходимо исследование антитела к антигенам β-клетки.
Наличие антител является предиктором снижения функции β-клеток и развития потребности в инсулине. Назначение инсулинотерапии в срок более чем через 6 мес от постановки диагноза ассоциировано с более старшим возрастом дебюта заболевания, наличием избыточной массы тела или ожирения (более высоким ИМТ), с более высоким уровнем триглицеридов, а также С-пептида как в дебюте заболевания, так и в течение первых 5 лет.
Медленные темпы аутоиммунной деструкции β-клеток у взрослых требуют дальнейших исследований, поиска возможных мишеней для разработки новых лекарственных препаратов. Применение ПССП и/или арГПП1 у пациентов с сохранным уровнем С-пептида может быть рассмотрено при условии регулярного контроля показателей углеводного обмена и уровня С-пептида. Основным патогенетическим средством лечения при аутоиммунном СД остается заместительная инсулинотерапия.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование выполнено в рамках гранта КНП № 075-15-2024-645 от 12 июля 2024 г.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Русяева Н.В. — разработка дизайна исследования, сбор материала, статистическая обработка и интерпретация результатов, написание статьи; Кононенко И.В. — разработка концепции исследования, сбор материала, интерпретация результатов, написание статьи; Викулова О.К. — разработка дизайна исследования, интерпретация результатов, внесение существенных правок в текст статьи; Смирнова О.М. — интерпретация результатов, внесение существенных правок в текст статьи; Шестакова М.В. — существенный вклад в концепцию и дизайн исследования, внесение существенных правок в текст статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
ПРИЛОЖЕНИЕ | SUPPLEMENT
ПРИЛОЖЕНИЕ 1.
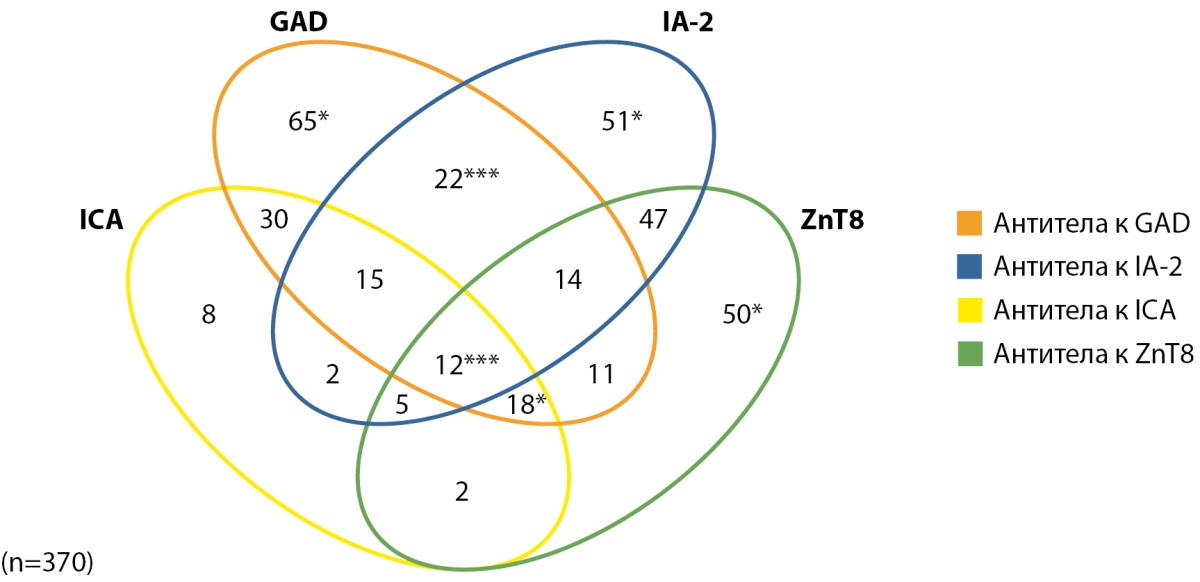
Рисунок 1. Количество пациентов с повышенными антителами и их комбинациями (n=370).
Примечание. На данной диаграмме отражены все обследованные пациенты, без ограничения по количеству исследованных антител.
* — +1 пациент c повышенными антителами к инсулину;
*** — +3 пациента с повышенными антителами к инсулину.
Изолированное повышение антител к инсулину до начала ИТ наблюдалось только у 8 пациентов (не отображены на рисунке).
ПРИЛОЖЕНИЕ 2.
Таблица 1. Характеристика пациентов с положительными и отрицательными антителами на момент последнего визита
|
Пациенты с положительными антителами (n=370) |
Пациенты с отрицательными антителами (n=347) |
P-значение |
|||
|
n |
Me [ Q1; Q3] |
n |
Me [ Q1; Q3] |
||
|
Возраст, лет |
333 |
41 [ 32; 54] |
331 |
44 [ 36; 54] |
0,007 |
|
Длительность наблюдения, лет |
333 |
5 [ 3; 7] |
331 |
6 [ 3; 12] |
<0,001 |
|
ИМТ, кг/м² |
254 |
24,0 [ 21,7;27,6] |
227 |
26,1 [ 22,5; 29,6] |
<0,001 |
|
HbA1c, % |
284 |
7,15 [ 6,5; 8] |
280 |
7,0 [ 6,5; 8] |
0,514 |
|
Пациенты, у которых достигнут индивидуальный целевой уровень HbA1c, n (%) |
115 (41,2) |
124 (47,3) |
0,497 |
||
Список литературы
1. Gregory GA, Robinson TIG, Linklater SE, et al. Global incidence, prevalence, and mortality of type 1 diabetes in 2021 with projection to 2040: a modelling study [published correction appears in Lancet Diabetes Endocrinol. 2022 Nov;10(11):e11. doi: https://doi.org/10.1016/S2213-8587(22)00280-7.]. Lancet Diabetes Endocrinol. 2022;10(10):741-760. doi: https://doi.org/10.1016/S2213-8587(22)00218-2
2. Ogrotis I, Koufakis T, Kotsa K. Changes in the Global Epidemiology of Type 1 Diabetes in an Evolving Landscape of Environmental Factors: Causes, Challenges, and Opportunities. Medicina (Kaunas). 2023;59(4):668. doi: https://doi.org/10.3390/medicina59040668
3. International Diabetes Federation. IDF Diabetes Atlas, 11th edn. Brussels, Belgium; 2025 [cited 10.02.2025]. Available from: https://diabetesatlas.org/resources/idf-diabetes-atlas-2025/
4. Котова Е.Г., Кобякова О.С., Стародубов В.И., и др. Заболеваемость взрослого населения России в 2022 году с диагнозом, установленным впервые в жизни: статистические материалы. — М.: ФГБУ «ЦНИИОИЗ» Минздрава России; 2023. doi: https://doi.org/10.21045/978-5-94116-113-3-2023
5. Котова Е.Г., Кобякова О.С., Стародубов В.И., и др. Заболеваемость детского населения России (0-14 лет) в 2022 году с диагнозом, установленным впервые в жизни: статистические материалы. — М.: ФГБУ «ЦНИИОИЗ» Минздрава России; 2023. doi: https://doi.org/10.21045/978-5-94116-115-7-2023
6. Insel RA, Dunne JL, Atkinson MA, et al. Staging presymptomatic type 1 diabetes: a scientific statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 2015;38(10):1964-1974. doi: https://doi.org/10.2337/dc15-1419
7. Kobayashi T, Sugimoto T, Itoh T, et al. The prevalence of islet cell antibodies in Japanese insulin-dependent and noninsulin-dependent diabetic patients studied by indirect immunofluorescence and by a new method. Diabetes. 1986;35(3):335-340. doi: https://doi.org/10.2337/diab.35.3.335
8. Turner R, Stratton I, Horton V, et al. UKPDS 25: autoantibodies to islet-cell cytoplasm and glutamic acid decarboxylase for prediction of insulin requirement in type 2 diabetes. UK Prospective Diabetes Study Group [published correction appears in Lancet 1998 Jan 31;351(9099):376]. Lancet. 1997;350(9087):1288-1293. doi: https://doi.org/10.1016/s0140-6736(97)03062-6
9. Buzzetti R, Tuomi T, Mauricio D, et al. Management of Latent Autoimmune Diabetes in Adults: A Consensus Statement From an International Expert Panel. Diabetes. 2020;69(10):2037-2047. doi: https://doi.org/10.2337/dbi20-0017
10. Battaglia M, Ahmed S, Anderson MS, et al. Introducing the Endotype Concept to Address the Challenge of Disease Heterogeneity in Type 1 Diabetes. Diabetes Care. 2020;43(1):5-12. doi: https://doi.org/10.2337/dc19-0880
11. Jiang Z, Ren W, Liang H, et al. HLA class I genes modulate disease risk and age at onset together with DR-DQ in Chinese patients with insulin-requiring type 1 diabetes. Diabetologia. 2021;64(9):2026-2036. doi: https://doi.org/10.1007/s00125-021-05476-6
12. Mikk ML, Pfeiffer S, Kiviniemi M, et al. HLA-DR-DQ haplotypes and specificity of the initial autoantibody in islet specific autoimmunity. Pediatr Diabetes. 2020;21(7):1218-1226. doi: https://doi.org/10.1111/pedi.13073
13. Ilonen J, Laine AP, Kiviniemi M, et al. Associations between deduced first islet specific autoantibody with sex, age at diagnosis and genetic risk factors in young children with type 1 diabetes. Pediatr Diabetes. 2022;23(6):693-702. doi: https://doi.org/10.1111/pedi.13340
14. Arif S, Leete P, Nguyen V, et al. Blood and islet phenotypes indicate immunological heterogeneity in type 1 diabetes [published correction appears in Diabetes. 2015 Sep;64(9):3334. doi: 10.2337/db15-er09a.]. Diabetes. 2014;63(11):3835-3845. doi: https://doi.org/10.2337/db14-0365
15. Leete P, Willcox A, Krogvold L, et al. Differential Insulitic Profiles Determine the Extent of β-Cell Destruction and the Age at Onset of Type 1 Diabetes. Diabetes. 2016;65(5):1362-1369. doi: https://doi.org/10.2337/db15-1615
16. Никонова Т.В., Апанович П.В., Пекарева Е.В., и др. Иммуногенетические аспекты медленно прогрессирующего аутоимунного диабета у взрослых (LADA). // Сахарный диабет. — 2011. — Т.14. — №1. — С.28-34. doi: https://doi.org/10.14341/2072-0351-6247
17. Никонова Т.В., Апанович П.В., Пекарева Е.В., и др. Роль регуляторных CD4+CD25+high Т-лимфоцитов и их функциональной активности в развитии и прогрессировании сахарного диабета 1 типа. // Сахарный диабет. — 2010. — Т.13. — №3. — С.25-31. doi: https://doi.org/10.14341/2072-0351-5483
18. Никонова Т.В. Сахарный диабет 1 типа и латентный аутоиммунный диабет взрослых (LADA): клинические, иммуногенетические и гормонально-метаболические аспекты. Дисс. ... докт. мед. наук. — Москва; 2011.
19. Lohmann T, Kellner K, Verlohren HJ, et al. Titre and combination of ICA and autoantibodies to glutamic acid decarboxylase discriminate two clinically distinct types of latent autoimmune diabetes in adults (LADA). Diabetologia. 2001;44(8):1005-1010. doi: https://doi.org/10.1007/s001250100602
20. Shimada A, Kawasaki E, Abiru N, et al. New diagnostic criteria (2023) for slowly progressive type 1 diabetes (SPIDDM): Report from Committee on Type 1 Diabetes of the Japan Diabetes Society (English version) [published correction appears in J Diabetes Investig. 2024 May;15(5):643. doi: 10.1111/jdi.14190.]. J Diabetes Investig. 2024;15(2):254-257. doi: https://doi.org/10.1111/jdi.14121
21. Zampetti S, Campagna G, Tiberti C, et al. High GADA titer increases the risk of insulin requirement in LADA patients: a 7-year follow-up (NIRAD study 7). Eur J Endocrinol. 2014;171(6):697-704. doi: https://doi.org/10.1530/EJE-14-0342
22. Rajkumar V, Levine SN. Latent Autoimmune Diabetes. In: StatPearls. Treasure Island (FL): StatPearls Publishing; March 1, 2024.
23. Maioli M, Pes GM, Delitala G, et al. Number of autoantibodies and HLA genotype, more than high titers of glutamic acid decarboxylase autoantibodies, predict insulin dependence in latent autoimmune diabetes of adults. Eur J Endocrinol. 2010;163(4):541-549. doi: https://doi.org/10.1530/EJE-10-0427
24. Голодников И.И., Русяева Н.В., Никонова Т.В., и др. Латентный аутоиммунный диабет взрослых — современное представление // Сахарный диабет. — 2023. — Т.26. — №3. — С.262-274. doi: https://doi.org/10.14341/DM12994
25. Cervin C, Lyssenko V, Bakhtadze E, et al. Genetic similarities between latent autoimmune diabetes in adults, type 1 diabetes, and type 2 diabetes. Diabetes. 2008;57(5):1433-1437. doi: https://doi.org/10.2337/db07-0299
26. Andersen MK, Sterner M, Forsén T, et al. Type 2 diabetes susceptibility gene variants predispose to adult-onset autoimmune diabetes. Diabetologia. 2014;57(9):1859-1868. doi: https://doi.org/10.1007/s00125-014-3287-8
27. Wang W, Huang F, Han C. Efficacy of regimens in the treatment of latent autoimmune diabetes in adults: a network meta-analysis. Diabetes Ther. 2023;14(10):1723-1752. doi: https://doi.org/10.1007/s13300-023-01459-5
28. Zhao Y, Yang L, Xiang Y, et al. Dipeptidyl peptidase 4 inhibitor sitagliptin maintains β-cell function in patients with recentonset latent autoimmune diabetes in adults: one year prospective study. J Clin Endocrinol Metab. 2014;99(5):E876-E880. doi: https://doi.org/10.1210/jc.2013-3633
Об авторах
Н. В. РусяеваРоссия
Русяева Надежда Владимировна, аспирант
117036 Москва, ул. Дм. Ульянова, д. 11
Researcher ID: AAY-6365-2021;
Scopus Author ID: 57220024968
И. В. Кононенко
Россия
Кононенко Ирина Владимировна, к.м.н., доцент
Москва
О. К. Викулова
Россия
Викулова Ольга Константиновна, д.м.н., доцент
Москва
Researcher ID: AAB-1682-2020;
Scopus Author ID: 8697054500
О. М. Смирнова
Россия
Смирнова Ольга Михайловна, д.м.н., профессор, гл.н.с.
Москва
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
Москва
Researcher ID: D-9123-2012;
Scopus Author ID: 7004195530
Дополнительные файлы
|
|
1. Рисунок 1. Дизайн исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(753KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Доля пациентов с положительными и отрицательными антителами с сохранным уровнем базального С-пептида на разных сроках заболевания. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(303KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Структура сахароснижающей терапии на момент последнего визита в группах пациентов с отрицательными (n=276) и положительными (n=316) антителами. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(290KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Изменение диагноза у пациентов с положительными (а) и отрицательными (б) антителами к β-клеткам. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(426KB)
|
Метаданные ▾ | |
|
|
5. ПРИЛОЖЕНИЕ 1. Рисунок 1. Количество пациентов с повышенными антителами и их комбинациями (n=370). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(308KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Русяева Н.В., Кононенко И.В., Викулова О.К., Смирнова О.М., Шестакова М.В. Гетерогенность аутоиммунного сахарного диабета у взрослых: данные реальной клинической практики. Сахарный диабет. 2025;28(2):136-150. https://doi.org/10.14341/DM13319
For citation:
Rusyaeva N.V., Kononenko I.V., Vikulova O.K., Smirnova O.M., Shestakova M.V. Heterogeneity of autoimmune diabetes mellitus in adults: real-world clinical practice. Diabetes mellitus. 2025;28(2):136-150. (In Russ.) https://doi.org/10.14341/DM13319
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































