Перейти к:
Факторы прогрессирования диабетической ретинопатии и развития макулярного отека после трансплантации поджелудочной железы
https://doi.org/10.14341/DM13306
Аннотация
Влияние трансплантации поджелудочной железы на состояние органов-мишеней при сахарном диабете (СД) является областью, которая требует дальнейшего изучения. В данном литературном обзоре проанализированы исследования, отражающие офтальмологический статус пациентов до и после трансплантации поджелудочной железы, а также произведена оценка потенциальных факторов риска, ассоциированных с прогрессированием диабетической ретинопатии и развитием диабетического макулярного отека в посттрансплантационном периоде. На основании результатов изученных исследований были выделены следующие предикторы прогрессирования диабетического поражения глазного дна после трансплантации поджелудочной железы: ранний возраст к моменту манифеста СД, непролиферативная стадия диабетической ретинопатии или отсутствие ретинопатии до хирургического лечения СД, проведение панретинальной лазерной коагуляции в течение 1 года до трансплантации, проведение изолированной трансплантации поджелудочной железы в качестве метода выбора пересадки, высокий исходный и послеоперационный уровни гликированного гемоглобина (до трансплантации — ≥9,0±2,3%, после операции — ≥6,0±0,6%), а также его выраженное снижение после хирургического лечения СД, артериальная гипотензия в первые 3 месяца после трансплантации, артериальная гипертензия в позднем посттрансплантационном периоде. Знание данных факторов риска может помочь врачу-офтальмологу в формировании прогноза течения диабетических изменений глазного дна, осуществлении профилактики, а также в оказании своевременной квалифицированной помощи при ухудшении офтальмологического статуса реципиентов трансплантата поджелудочной железы.
Ключевые слова
Для цитирования:
Аржиматова Г.Ш., Булава Е.В., Гусаков М.В., Дмитриев И.В. Факторы прогрессирования диабетической ретинопатии и развития макулярного отека после трансплантации поджелудочной железы. Сахарный диабет. 2025;28(3):249-258. https://doi.org/10.14341/DM13306
For citation:
Arzhimatova G.S., Bulava E.V., Gusakov M.V., Dmitriev I.V. Factors for diabetic retinopathy progression and macular edema development after pancreas transplantation. Diabetes mellitus. 2025;28(3):249-258. (In Russ.) https://doi.org/10.14341/DM13306
ВВЕДЕНИЕ
Рост заболеваемости сахарным диабетом (СД) является глобальной проблемой для медицинского сообщества. Согласно последнему докладу Международной федерации диабета от 2021 г., 537 млн человек страдали СД, и, по прогнозам, это число должно увеличиться до 643 млн к 2030 г. [1]. Результаты метаанализов отражают тенденцию роста заболеваемости СД 1 типа (СД1) среди детей с наступлением пандемии COVID-19 [2][3]. СД1 — тяжелое заболевание, при котором достижение адекватного уровня гликированного гемоглобина (HbA1с) с помощью традиционных методов консервативного лечения возможно только у 21% больных [4]. Хроническая гипергликемия на фоне абсолютной инсулиновой недостаточности — основная причина нейрососудистых осложнений СД1, приводящих к значительному снижению уровня жизни, инвалидизации и смерти пациентов [1][5][6].
Трансплантация поджелудочной железы (ТхПЖ) является способом хирургического лечения СД1, при котором удается достичь стойкой нормогликемии без экзогенной доставки инсулина. Сочетанную трансплантацию поджелудочной железы и почки (СТПЖиП) выполняют пациентам с СД1 и хронической болезнью почек (ХБП) 5 стадии, развившейся в исходе диабетической нефропатии. Такой подход хирургического лечения данного контингента больных значительно улучшает качество и продолжительность жизни, в сравнении с использованием инсулинотерапии и методов диализного лечения [7].
К 2020 г. во всем мире было выполнено 63 871 ТхПЖ [8]. Среди способов ТхПЖ выделяют: СТПЖиП — одномоментное оперативное вмешательство, при котором производится ТхПЖ совместно с пересадкой почки; поэтапная трансплантация почки и поджелудочной железы (ПТПиПЖ) — разновидность трансплантации, при которой проводят две отдельные операции: первый этап — пересадка почки (от посмертного или живого донора), второй — ТхПЖ; изолированная ТхПЖ (ИТПЖ) [9–11].
Вопрос влияния ТхПЖ на состояние органов — мишеней СД остается недостаточно изученным. Вопреки логическому суждению о том, что достижение эугликемии после хирургического лечения СД1 приводит к устранению рисков развития и прогрессирования осложнений заболевания [12][13], имеются сообщения, утверждающие об обратном [14].
Роль офтальмолога в поиске ответа на вопрос о влиянии ТхПЖ на периферическое кровообращение должна сводиться к оценке состояния органа зрения и его функций до и после операции, а также к анализу и предотвращению причин возможного прогрессирования диабетической ретинопатии (ДР) и развития диабетического макулярного отека (ДМО) в посттрансплантационном периоде [15][16].
В данном обзоре выделены основные факторы ухудшения клинических проявлений диабетического поражения глазного дна после ТхПЖ на основе анализа данных доступной медицинской литературы.
МАТЕРИАЛ И МЕТОДЫ
В соответствии с рекомендациями по составлению отчетов о систематических обзорах и матаанализах (Preferred Reporting Items for Systematic reviews and Meta-Analyses, PRISMA, 2020 г.) был произведен поиск исследований, опубликованных в электронных базах данных «PubMed», «Cochrane», «Embase». Настоящий обзор написан на основе анализа 117 исследований, найденных в ходе первоначального поиска, по ключевым словам: «трансплантация поджелудочной железы», «сочетанная трансплантация поджелудочной железы и почки», «диабетическая ретинопатия», «диабетический макулярный отек». В соответствии с критериями невключения (низкое качество исследования, недостаток данных или специфических результатов исследования) итоговый анализ был произведен на основе 35 источников, среди которых 7 являлись научными исследованиями, имеющими проспективный и ретроспективный дизайн, заключавшийся в оценке офтальмологического статуса пациентов до и после ТхПЖ (табл. 1). Статистический анализ результатов проводили с помощью программы Microsoft Excel 2019 (Microsoft, США).
Таблица 1. Сводная таблица проанализированных исследований
|
Авторы (год исследования) |
Дизайн исследования |
Количество пациентов (глаз) |
Проводимый метод трансплантации поджелудочной железы |
Объем офтальмологического осмотра до и после трансплантации |
Срок наблюдения офтальмолога за пациентами после трансплантации |
|
Voglova B. et al. (2020) |
Ретроспективно-проспективное, открытое, рандомизированное, контролируемое клиническое исследование |
43 (84) |
СТПЖиП |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна, оптическая когерентная томография |
12 месяцев |
|
Kim Y.J. et al. (2018) |
Ретроспективное сравнительное когортное исследование |
153 (303) |
ИТПЖ, ПТПиПЖ, СТПЖиП |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна, флюоресцентная ангиография глазного дна, оптическая когерентная томография |
5 лет |
|
Tsai F.Y. et al. (2017) |
Ретроспективное исследование серии клинических случаев |
6 (11) |
ИТПЖ |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна, флюоресцентная ангиография глазного дна, оптическая когерентная томография |
1–5 лет |
|
Giannarelli R. et al. (2005) |
Сравнительное обсервационное когортное исследование с элементами проспективного дизайна |
48 (96) |
СТПЖиП |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна, оптическая когерентная томография |
6–60 месяцев |
|
Chow C.W. et al. (1999) |
Проспективное сравнительное когортное исследование |
49 (98) |
СТПЖиП |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна, флюоресцентная ангиография глазного дна |
1–10 лет |
|
Wang Q. et al. (1994) |
Проспективное сравнительное когортное исследование |
50 (100) |
СТПЖиП |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна |
10–21 месяц |
|
Petersen M.R. et al. (1990) |
Проспективное сравнительное когортное исследование |
8 (16) |
СТПЖиП |
Визометрия, биомикроскопия, офтальмотонометрия, офтальмоскопия, фоторегистрация глазного дна |
12–49 месяцев |
Примечания: ИТПЖ — изолированная трансплантация поджелудочной железы, ПТПиПЖ – поэтапная трансплантация почки и поджелудочной железы, СТПЖиП — сочетанная трансплантация поджелудочной железы и почки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние трансплантации поджелудочной железы на прогрессирование стадии диабетической ретинопатии и развитие диабетического макулярного отека
В таблице 2 приведены данные осмотра глазного дна больных ДР до и после ТхПЖ. В представленных исследованиях изменения на глазном дне были классифицированы согласно Международной клинической шкале тяжести ДР (International Clinical Diabetic Retinopathy Disease Severity Scale, ICDRDSS, 2002 г.) (табл. 3) [17][18]. Пролиферативная стадия заболевания в приведенных работах была подразделена на две формы: неактивную и активную, отличающуюся присоединением свежих зон неоваскуляризации на глазном дне с развитием геморрагических осложнений в виде преретинальных и витреальных кровоизлияний [19][20].
Таблица 2. Стадия диабетической ретинопатии до и после трансплантации поджелудочной железы
|
Авторы (год исследования) |
Стадия диабетической ретинопатии |
До трансплантации, кол-во глаз (%) |
После трансплантации, кол-во глаз (%) |
р |
|
Voglova B. et al. (2020) |
отсутствие ДР |
– |
– |
0,028 |
|
легкая и умеренная НПДР |
9 (10,72) |
3 (3,57) |
||
|
тяжелая НПДР |
6 (7,14) |
10 (11,91) |
||
|
неактивная ПДР |
69 (82,14) |
52 (61,91) |
||
|
активная ПДР |
– |
19 (22,61) |
||
|
Kim Y.J. et al. (2018) |
отсутствие ДР |
37 (12,21) |
4 (1,32) |
<0,001* |
|
легкая и умеренная НПДР |
38 (12,54) |
14 (4,62) |
||
|
тяжелая НПДР |
7 (2,31) |
4 (1,32) |
||
|
неактивная ПДР |
221 (72,94) |
219 (72,28) |
||
|
активная ПДР |
– |
62 (20,46) |
||
|
Giannarelli R. et al. (2005) |
отсутствие ДР |
– |
– |
>0,050 |
|
легкая и умеренная НПДР |
14 (14,58) |
14 (14,58) |
||
|
тяжелая НПДР |
10 (10,42) |
6 (6,25) |
||
|
неактивная ПДР |
72 (75,00) |
70 (72,92) |
||
|
активная ПДР |
– |
6 (6,25) |
||
|
Chow C.W. et al. (1999) |
отсутствие ДР |
5 (6,10) |
3 (3,65) |
>0,050 |
|
легкая, умеренная или тяжелая НПДР |
12 (14,63) |
8 (9,76) |
||
|
неактивная ПДР |
52 (63,42) |
64 (78,05) |
||
|
активная ПДР |
13 (15,85) |
7 (8,54) |
||
|
Petersen M.R. et al. (1990) |
отсутствие ДР |
– |
– |
>0,050 |
|
легкая, умеренная или тяжелая НПДР |
3 (18,75) |
– |
||
|
неактивная ПДР |
13 (81,25) |
7 (43,75) |
||
|
активная ПДР |
– |
9 (56,25) |
Примечания: * — статистически значимые различия показателей степени тяжести диабетических изменений глазного дна по шкале ICDRDSS и активности пролиферативной стадии диабетической ретинопатии; НПДР — непролиферативная диабетическая ретинопатия; ПДР — пролиферативная диабетическая ретинопатия.
Таблица 3. Международная клиническая шкала тяжести диабетической ретинопатии (International Clinical Diabetic Retinopathy Disease Severity Scale, ICDRDSS, 2002 г.)
|
Стадия диабетической ретинопатии |
Офтальмоскопические признаки |
|
Отсутствие ДР |
Изменения отсутствуют |
|
Легкая НПДР |
Исключительно микроаневризмы |
|
Умеренная НПДР |
Микроаневризмы и другие симптомы НПДР (точечные геморрагии, твердые экссудаты и ватообразные очаги), но менее выраженные по сравнению с тяжелой НПДР |
|
Тяжелая НПДР |
Любое из нижеперечисленного: • более 20 интраретинальных кровоизлияний в каждом из 4 квадрантов; • выраженное сегментарное расширение вен сетчатки в 2 и более квадрантах; • ИРМА в 1 квадранте |
|
ПДР |
Одно из нижеперечисленного: • неоваскуляризация; • гемофтальм, преретинальное кровоизлияние |
Примечание: ДР — диабетическая ретинопатия; НПДР — непролиферативная диабетическая ретинопатия; ПДР — пролиферативная диабетическая ретинопатия; ИРМА — интраретинальные микрососудистые аномалии.
На основании приведенных данных можно отметить, что прогрессирование ДР после ТхПЖ отсутствовало в 72,3±7,8% случаев, а в 11,4±2,9% было зафиксировано улучшение офтальмоскопической картины в виде снижение уровня тяжести ДР по шкале ICDRDSS или перехода активного пролиферативного процесса в неактивную форму [21–24]. Таким образом, несмотря на хирургические риски и сложности, сопряженные с проведением ТхПЖ, в большинстве случаев можно отметить ее безопасное влияние на состояние органа зрения [21–27]. Однако в 16,3±7,7% случаев отмечалось прогрессирование стадии ДР в виде увеличения уровня тяжести по шкале ICDRDSS, а в 10,8±2,8% — развитие ДМО (табл. 4) [11][21–22][24].
Таблица 4. Частота присоединения диабетического макулярного отека после трансплантации поджелудочной железы
|
Авторы (год исследования) |
Количество глаз (%) с развившимся ДМО после трансплантации |
|
Voglova B. et al. (2020) |
12 (14,00) |
|
Kim Y.J. et al. (2018) |
32 (10,56) |
|
Chow C.W. et al. (1999) |
6 (7,32) |
|
Wang Q. et. al. (1994) |
5 (11,40) |
Примечание: ДМО — диабетический макулярный отек.
На данный момент отсутствует однозначное мнение о причинах присоединения свежих диабетических изменений сетчатки в посттрансплантационном периоде. В связи с этим в последующем изложении будут выделены основные факторы, способствующие ухудшению картины глазного дна у реципиентов трансплантата поджелудочной железы.
Влияние длительности и возраста дебюта СД на прогрессирование стадии диабетической ретинопатии и развитие диабетического макулярного отека после трансплантации поджелудочной железы
В представленных исследованиях длительность диабета к моменту ТхПЖ отличалась. Минимальная продолжительность СД составила 6 лет, максимальная — 47 лет. Средняя продолжительность СД на момент ТхПЖ отражена в таблице 5.
Таблица 5. Средняя продолжительность сахарного диабета до трансплантации поджелудочной железы
|
Авторы (год исследования) |
Кол-во пациентов (кол-во глаз) |
Вид операции |
Кол-во пациентов (%) |
Длительность СД, лет |
Прогрессирование ретинопатии, % |
|
Voglova B. et al. (2020) |
43 (84) |
ИТПЖ |
– |
26,2±7,4 |
25,0 |
|
ПТПиПЖ |
– |
||||
|
СТПЖиП |
43 (100) |
||||
|
Kim Y.J. et al. (2018) |
153 (303) |
ИТПЖ |
51(33,3) |
15,7±7,9 |
20,5 |
|
ПТПиПЖ |
25 (16,4) |
||||
|
СТПЖиП |
77 (50,3) |
||||
|
Giannarelli R. et al. (2005) |
48 (96) |
ИТПЖ |
– |
24,0±8,0 |
9,4 |
|
ПТПиПЖ |
– |
||||
|
СТПЖиП |
48 (100) |
||||
|
Chow C.W. et al. (1999) |
49 (98) |
ИТПЖ |
– |
25,0±7,0 |
10,2 |
|
ПТПиПЖ |
– |
||||
|
СТПЖиП |
49 (100) |
||||
|
Wang Q. et. al. (1994) |
50 (100) |
ИТПЖ |
– |
35,0±11,0 |
14,6 |
|
ПТПиПЖ |
– |
||||
|
СТПЖиП |
50 (100) |
||||
|
Petersen M.R. et al. (1990) |
8 (16) |
ИТПЖ |
– |
23,0±1,2 |
60,0 |
|
ПТПиПЖ |
– |
||||
|
СТПЖиП |
8 (100) |
Примечания: ИТПЖ — изолированная трансплантация поджелудочной железы; ПТПиПЖ — поэтапная трансплантация почки и поджелудочной железы; СД — сахарный диабет; СТПЖиП — сочетанная трансплантация поджелудочной железы и почки.
Длительность течения СД к моменту ТхПЖ статистически значимо не влияла на ухудшение картины глазного дна после этой операции (рис. 1).
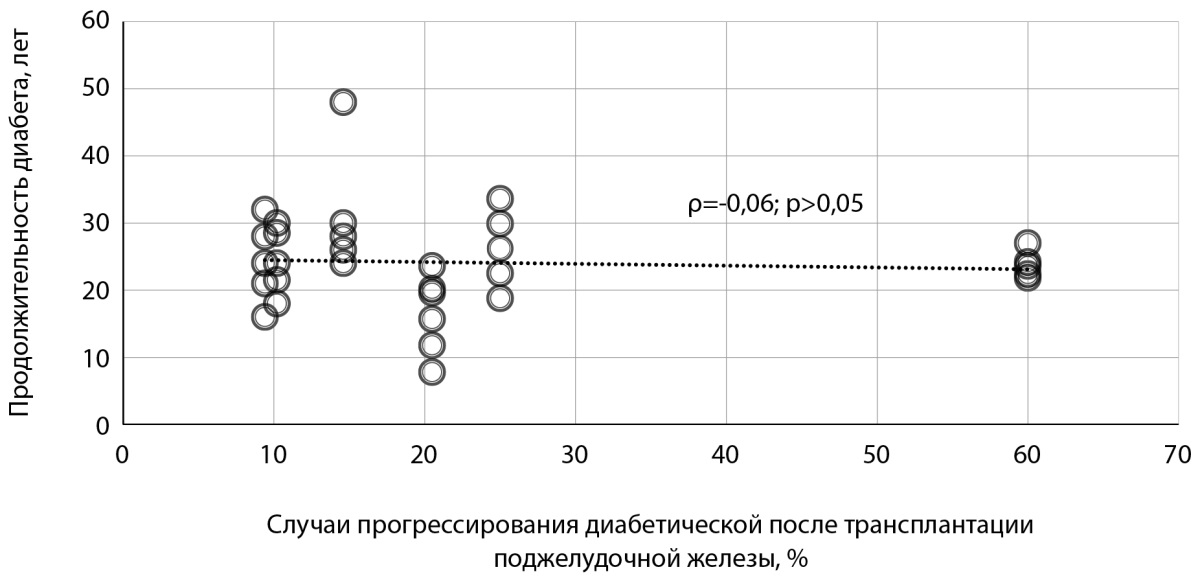
Рисунок 1. График зависимости прогрессирования диабетической ретинопатии после трансплантации поджелудочной железы от длительности течения сахарного диабета в предтрансплантационном периоде [11][21–25].
В нескольких работах прослеживается связь между возрастом дебюта СД и ухудшением офтальмоскопической картины. Так, в исследовании Kim Y.J. и соавт. было выявлено, что у пациентов с началом СД в более раннем возрасте после ТхПЖ чаще наблюдалось развитие ДМО (16,3±8,3 года) и прогрессирование ДР до пролиферативной стадии (18,1±8,4 года). В свою очередь, средний возраст на момент дебюта СД среди пациентов, у которых отсутствовало прогрессирование ДР после ТхПЖ, был 20,8±9,1 года (р<0,05) [21].
В исследовании Tsai F.Y. с соавт. было отмечено, что средний возраст манифестации СД у пациентов составил 15,2±3,6 года. Среди данной группы пациентов после ТхПЖ у 100,0% пациентов развился ДМО, у 81,8% через 1 месяц после ТхПЖ произошло присоединение зон интраретинальных микрососудистых аномалий с последующим развитием пролиферативных изменений глазного дна [28].
Влияние исходной стадии диабетической ретинопатии до трансплантации поджелудочной железы на прогрессирование диабетических изменений глазного дна в посттрансплантационном периоде
В группах пациентов с отсутствием ДР или наличием непролиферативных диабетических изменений глазного дна статистически чаще выявлялись случаи развития ДМО и прогрессирования стадии заболевания после ТхПЖ в сравнении с пациентами, которые имели пролиферативную стадию ретинопатии до трансплантации [21–23][28]. Так, в исследовании Giannarelli R. с соавт. в 6 глазах реципиентов наблюдалось развитие активной формы пролиферативной ДР после ТхПЖ, причем в 4 глазах (66,7%) присоединение участков неоваскуляризации на глазном дне произошло первично, и лишь в 2 глазах (33,3%) — с ранее диагностированной пролиферативной стадией заболевания [23].
В исследовании Kim Y.J. с соавт. появление зон неоваскуляризации после ТхПЖ наблюдали в 62 глазах, из них в 3 глазах (4,8 %) произошел переход из неактивной в активную форму пролиферативного процесса. В оставшихся случаях (95,2%) развитие неоваскуляризации происходило первично в глазах, имевших до трансплантации непролиферативную стадию или отсутствие ДР [21].
В исследовании Tsai F.Y. с соавт. выборку составили пациенты с отсутствием пролиферативных изменений на глазном дне. После проведения ТхПЖ в 81,8% глаз было зафиксировано присоединение неоваскуляризации сетчатки и диска зрительного нерва [28]. Возможно, такая закономерность была обусловлена повышенной чувствительностью менее измененных участков сетчатки к гипоксии, которая может возникать в раннем послеоперационном периоде из-за присоединения транзиторного снижения ретинальной гемоперфузии в ответ на резкое снижение гликемии [29]. Данная гипотеза требует изучения в дальнейших клинических испытаниях.
Влияние исходного уровня гликированного гемоглобина до трансплантации поджелудочной железы на прогрессирование стадии диабетической ретинопатии и развитие диабетического макулярного отека в посттрансплантационном периоде
Ухудшение офтальмоскопической картины после оперативного лечения СД было отмечено и у пациентов с исходно высоким значением HbA1с. Согласно данным Kim Y.J. с соавт., у пациентов с развившимся ДМО после ТхПЖ, уровень HbA1с до хирургического лечения составлял 9,3±2,4%, у больных пролиферативной ДР, потребовавшей витрэктомии и/или лазерной коагуляции сетчатки в посттрансплантационном периоде, показатель HbA1с до трансплантации был равен 8,9±2,2%. Среди пациентов, у которых отсутствовали признаки присоединения ДМО и прогрессирования ДР, уровень HbA1с до ТхПЖ составил 8,2±1,9% (р<0,05) [21].
В исследовании Tsai F.Y. с соавт. уровень HbA1с до ТхПЖ составлял 13,4±1,9%. У всех пациентов в данной работе, как было сказано ранее, в посттрансплантационном периоде присоединился ДМО и у большей части больных произошло прогрессирование ДР до пролиферативной стадии [28].
Таким образом, можно считать, что показатель HbA1с выше 9,0±2,3% перед ТхПЖ является плохим прогностическим фактором для послеоперационного течения ДР [21][28].
Влияние проводимой терапии диабетической ретинопатии до трансплантации поджелудочной железы на прогрессирование стадии диабетической ретинопатии и развитие диабетического макулярного отека в посттрансплантационном периоде
Независимым фактором риска ухудшения офтальмоскопической картины после ТхПЖ является предшествующая хирургическому лечению СД1 панретинальная лазерная коагуляция (ПРЛК). Данная процедура проводится с целью снижения рисков неоваскуляризации, кровоизлияний, развития тракционной отслойки сетчатки путем воздействия на ишемические участки глазного дна, которые выделяют сосудистый эндотелиальный фактор роста и другие факторы роста патологических сосудов [30][31]. Однако, по данным авторов, частота прогрессирования ДР, развитие ДМО, присоединение активной пролиферации на глазном дне была значительно выше в группе больных, кому в течение 1 года до ТхПЖ проводилась лазерная коагуляция сетчатки [21][22].
Основным механизмом устранения гипоксии при ПРЛК является выключение зон ишемии сетчатки с перераспределением ретинального и хориоидального кровотока [32][33]. Но этот процесс не наступает сразу после нанесения на сетчатку лазерных коагулятов. Значительный прирост сатурации ретинального кровотока наблюдается только через год после полученного лечения, более того, в течение первых трех месяцев возможно снижение показателя оксигенации от исходных значений (сатурация: до ПРЛК — 36,7%, через 12 недель — 36,1%, через 52 недели — 39,7%) [34][35]. Это объясняет тот факт, что сетчатка особенно чувствительна к гипоксии в течение первого года после лазерного воздействия, и изменение скорости кровотока на фоне резкого снижения гликемии после успешной ТхПЖ может усугубить ишемию сетчатки, способствуя развитию и прогрессированию пролиферативного процесса.
Влияние вида трансплантации поджелудочной железы на прогрессирование диабетических изменений глазного дна
При сравнительной оценке методов оперативного лечения СД отдельного внимания заслуживают более низкие риски присоединения свежих диабетических изменений после проведения СТПЖиП [8][21][26][27]. Согласно данным крупного проспективного исследования Kim Y.J. с соавт., включавшего 303 глаза, было отмечено, что при проведении ИТПЖ в 31,4% случаев наблюдалось прогрессирование ДР, а в 27,5% случаев — развитие ДМО в посттрансплантационном периоде. В свою очередь при проведении СТПЖиП процент развития диабетических поражений после операции был статистически значимо ниже (табл. 6) [21].
Таблица 6. Сравнительная оценка методов трансплантации поджелудочной железы
|
Оцениваемый показатель |
Значение показателя при проведении СТПЖиП |
Значение показателя при проведении ИТПЖ |
р |
|
Прогрессирование ДР после трансплантации |
9,1% |
31,4% |
0,001* |
|
Развитие ДМО после трансплантации |
3,9% |
27,5% |
0,001* |
Примечание: * — статистически значимые различия показателей; СТПЖиП — сочетанная трансплантация поджелудочной железы и почки; ИТПЖ — изолированная трансплантация поджелудочной железы; ДР — диабетическая ретинопатия; ДМО — диабетический макулярный отек.
Влияние степени выраженности снижения гликированного гемоглобина после трансплантации на прогрессирование стадии диабетической ретинопатии и развитие диабетического макулярного отека в посттрансплантационном периоде
Результаты проанализированных исследований демонстрируют значительное снижение уровня HbA1с у пациентов на фоне хирургического лечения СД (табл. 7).
Таблица 7. Динамика уровня HbA1с на фоне ТхПЖ
|
Авторы |
Количество пациентов (глаз) |
HbA1с до трансплантации, % |
HbA1спосле трансплантации, % |
р |
|
Voglova B. et al. (2020) |
43 (84) |
8,7±3,8 |
5,7±0,7 |
0,03* |
|
Kim Y.J. et al. (2018) |
153 (303) |
8,3±2,0 |
5,4±0,5 |
0,02* |
|
Tsai F.Y. et al. (2017) |
6 (11) |
13,4±1,9 |
6,5±0,4 |
<0,05* |
|
Giannarelli R. et al. (2005) |
48 (96) |
8,7±1,9 |
5,0±0,9 |
<0,01* |
Примечание: * — статистически значимые различия показателей.
При разрешении гипергликемии, достигнутой путем ТхПЖ, можно увидеть определенное влияние степени выраженности изменения уровня HbA1с на течение имеющейся ретинопатии. У пациентов, достигших уровня HbA1с менее 6,0±0,6%, после ТхПЖ отсутствуют сообщения о прогрессировании ДР и/или присоединении ДМО, в отличие от лиц с более высоким значением гликемии, у которых после хирургического лечения регистрировались случаи присоединения новых зон отека и ишемии сетчатки, интраретинальных микрососудистых аномалий, активной неоваскуляризации, интраретинальных и витреальных геморрагий [21–23][28].
Также неблагоприятным фактором для прогрессирования диабетического поражения глазного дна служит резкое снижение уровня HbA1с после ТхПЖ. В исследовании Kim Y.J. с соавт. среди пациентов с развившейся активной формой пролиферативной стадии ДР после ТхПЖ наблюдалось снижение уровня HbA1с на 3,7±2,2% в сравнении с группой пациентов, у которых офтальмоскопические показатели оставались стабильными после трансплантации, где уровень HbA1с снизился на 2,7±2,0% (р<0,05) [21]. Похожие результаты были представлены в работе Giannarelli R. с соавт. По данным авторов, у больных с изменением уровня HbA1с на 2,3±1,6% после ТхПЖ ДР оставалась стабильной, в отличие от группы реципиентов со снижением такого же показателя на 3,7±1,0%, в которой было зафиксировано ухудшение картины глазного дна (р<0,05) [23]. В серии клинических случаев Tsai F.Y. с соавт. уровень HbA1с в среднем снизился на 6,9±1,6%, у всех пациентов авторы отметили присоединение ДМО и прогрессирование стадии ДР [28].
Влияние изменения артериального давления после трансплантации на прогрессирование стадии диабетической ретинопатии и развитие диабетического макулярного отека в посттрансплантационном периоде
По данным Kim Y.J. с соавт., в течение первых 3 месяцев после ТхПЖ у части пациентов отмечалась артериальная гипотензия. Точная причина ее формирования не известна. Авторами было выдвинуто предположение об ортостатической природе гипотензии, возникшей на фоне продолжительной полостной операции. Среди пациентов, участвовавших в данном исследовании, у которых наблюдалось присоединение ДМО после трансплантации, в 82,4% случаях развитию отека сетчатки предшествовали эпизоды снижения уровня артериального давления [21]. Снижение значений артериального давления сопряжено с рисками формирования очагов гипоксии на глазном дне, в результате выработки проангиогенных факторов роста в ответ на изменение перфузии сетчатки, что в свою очередь может быть предрасполагающим фактором прогрессирования ДР и развития ДМО [32].
Chow V.C. с соавт. в своей работе отразили динамику изменения артериального давления в отдаленные сроки (1–10 лет) после СТПЖиП. Авторы отметили, что спустя год после операции у 77,6% пациентов наблюдалась артериальная гипертензия, требующая медикаментозной терапии. В течение 10 лет наблюдения за данной группой пациентов значения систолического артериального давления в среднем находились в диапазоне 140±20 мм рт.ст. В 10,2% глаз больных гипертонией произошло развитие неоваскуляризации на глазном дне [24].
ЗАКЛЮЧЕНИЕ
ТхПЖ имеет высокий потенциал как метод этиотропной терапии СД1 ввиду того, что данный способ лечения, в отличие от консервативной терапии, обеспечивает развитие стойкой физиологической эугликемии.
Основными недостатками данного метода лечения являются: критический дефицит донорских органов; наивысшая по сравнению с трансплантацией других солидных органов частота хирургических осложнений; отсутствие достаточного количества информации о влиянии данного вида лечения на течение нейрососудистых осложнений СД.
Результаты исследований, посвященные изучению течения ДР у реципиентов трансплантата поджелудочной железы, демонстрируют прогрессирующее течение заболевания в 16,3±7,7% случаев с присоединением ДМО у 10,8±2,8% больных после операции. На основании анализа литературных данных были выделены следующие предикторы прогрессирования диабетического поражения глазного дна после ТхПЖ:
- ранний возраст к моменту манифестации СД;
- отсутствие или наличие непролиферативных диабетических изменений сетчатки до хирургического лечения СД;
- проведение ПРЛК в течение 1 года до ТхПЖ;
- проведение ИТПЖ в качестве метода выбора пересадки;
- уровень HbA1с: до транспланации — ≥9,0±2,3%, после операции — ≥6,0±0,6%, или выраженное снижение HbA1с после хирургического лечения;
- артериальная гипотензия в первые 3 месяца после ТхПЖ, а также артериальная гипертензия в позднем посттрансплантационном периоде.
Знание данных факторов риска может помочь врачу-офтальмологу в формировании прогноза течения ДР, осуществлении профилактики, а также в оказании своевременной квалифицированной помощи при ухудшении офтальмологического статуса реципиентов трансплантата поджелудочной железы.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Аржиматова Г.Ш. — существенный вклад в получение и анализ данных, написание статьи; Булава Е.В. — существенный вклад в получение и анализ данных, написание статьи; Гусаков М.В. — существенный вклад в получение и анализ данных, написание статьи; Дмитриев И.В. — существенный вклад в концепцию, дизайн исследования и анализ данных, написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Magliano DJ, Boyko EJ. IDF Diabetes Atlas 10th edition scientific committee. IDF DIABETES ATLAS. Brussels: International Diabetes Federation; 2021. URL: https://www.ncbi.nlm.nih.gov/books/NBK581934/
2. D’Souza D, Empringham J, Pechlivanoglou P, Uleryk EM, Cohen E, Shulman R. Incidence of Diabetes in Children and Adolescents During the COVID-19 Pandemic: A Systematic Review and Meta-Analysis. JAMA Netw Open. 2023;6(6):e2321281. doi: https://doi.org/10.1001/jamanetworkopen.2023.21281
3. Rahmati M, Keshvari M, Mirnasuri S, et al. The global impact of COVID-19 pandemic on the incidence of pediatric new-onset type 1 diabetes and ketoacidosis: A systematic review and meta-analysis. J Med Virol. 2022;94(11):5112-5127. doi: https://doi.org/10.1002/jmv.27996
4. Foster NC, Beck RW, Miller KM, et al. State of Type 1 Diabetes Management and Outcomes from the T1D Exchange in 2016-2018 [published correction appears in Diabetes Technol Ther. 2019;21(4):230. doi: https://doi.org/10.1089/dia.2018.0384.correx.]. Diabetes Technol Ther. 2019;21(2):66-72. doi: https://doi.org/10.1089/dia.2018.0384
5. Akyirem S, Ekpor E, Namumbejja Abwoye D, Batten J, Nelson LE. Type 2 diabetes stigma and its association with clinical, psychological, and behavioral outcomes: A systematic review and meta-analysis. Diabetes Res Clin Pract. 2023;202:110774. doi: https://doi.org/10.1016/j.diabres.2023.110774
6. Heald A, Stedman M, Robinson A, et al. Mortality Rate Associated with Diabetes: Outcomes From a General Practice Level Analysis in England Using the Royal College of General Practitioners (RCGP) Database Indicate Stability Over a 15 Year Period. Diabetes Ther. 2022;13(3):505-516. doi: https://doi.org/10.1007/s13300-022-01215-1
7. Jiang AT, BHSc, Rowe N, Sener A, Luke P. Simultaneous pancreaskidney transplantation: The role in the treatment of type 1 diabetes and end-stage renal disease. Can Urol Assoc J. 2014;8(3-4):135-138. doi: https://doi.org/10.5489/cuaj.1597
8. Parajuli S, Arunachalam A, Swanson KJ, et al. Outcomes after simultaneous kidney-pancreas versus pancreas after kidney transplantation in the current era. Clin Transplant. 2019;33(12):e13732. doi: https://doi.org/10.1111/ctr.13732
9. Maupoey Ibáñez J, Boscà Robledo A, López-Andujar R. Late complications of pancreas transplant. World J Transplant. 2020;10(12):404-414. doi: https://doi.org/10.5500/wjt.v10.i12.404
10. Kervella D, Mesnard B, Prudhomme T, et al. Sterile Pancreas Inflammation during Preservation and after Transplantation. Int J Mol Sci. 2023;24(5):4636. doi: https://doi.org/10.3390/ijms24054636
11. Petersen MR, Vine AK. Progression of diabetic retinopathy after pancreas transplantation. The University of Michigan Pancreas Transplant Evaluation Committee. Ophthalmology. 1990;97(4):496-502. doi: https://doi.org/10.1016/s0161-6420(90)32556-3
12. Aref A, Zayan T, Pararajasingam R, Sharma A, Halawa A. Pancreatic transplantation: Brief review of the current evidence. World J Transplant. 2019;9(4):81-93. doi: https://doi.org/10.5500/wjt.v9.i4.81
13. Chan CM, Chim TM, Leung KC, Tong CH, Wong TF, Leung GK. Simultaneous pancreas and kidney transplantation as the standard surgical treatment for diabetes mellitus patients with end-stage renal disease. Hong Kong Med J. 2016;22(1):62-69. doi: https://doi.org/10.12809/hkmj154613
14. Lombardo C, Perrone VG, Amorese G, et al. Update on pancreatic transplantation on the management of diabetes. Minerva Med. 2017;108(5):405-418. doi: https://doi.org/10.23736/S0026-4806.17.05224-7
15. Nixon DR, Flinn N. Visual Function for Driving in Diabetic Macular Edema and Retinal Vein Occlusion Post-Stabilization with Anti-Vascular Endothelial Growth Factor. Clin Ophthalmol. 2021;15:1659-1666. doi: https://doi.org/10.2147/OPTH.S304229
16. Shrestha GS, Kaiti R. Visual functions and disability in diabetic retinopathy patients. J Optom. 2014;7(1):37-43. doi: https://doi.org/10.1016/j.optom.2013.03.003
17. Yang Z, Tan TE, Shao Y, Wong TY, Li X. Classification of diabetic retinopathy: Past, present and future. Front Endocrinol (Lausanne). 2022;13:1079217. doi: https://doi.org/10.3389/fendo.2022.1079217
18. Воробьева И.В., Мошетова Л.К., Пинчук А.В., и др. Диабетическая ретинопатия. Морфофункциональное состояние сетчатки у реципиентов поджелудочной железы // Офтальмология. — 2021. — Т. 18. — № 3. — С. 459-469. doi: https://doi.org/10.18008/1816-5095-2021-3-459-469
19. Lois N, Cook JA, Wang A, et al. Evaluation of a New Model of Care for People with Complications of Diabetic Retinopathy: The EMERALD Study. Ophthalmology. 2021;128(4):561-573. doi: https://doi.org/10.1016/j.ophtha.2020.10.030
20. Solomon SD, Goldberg MF. ETDRS Grading of Diabetic Retinopathy: Still the Gold Standard?. Ophthalmic Res. 2019;62(4):190-195. doi: https://doi.org/10.1159/000501372
21. Kim YJ, Shin S, Han DJ, et al. Long-term Effects of Pancreas Transplantation on Diabetic Retinopathy and Incidence and Predictive Risk Factors for Early Worsening. Transplantation. 2018;102(1):e30-e38. doi: https://doi.org/10.1097/TP.0000000000001958
22. Voglová B, Hladíková Z, Nemétová L, et al. Early worsening of diabetic retinopathy after simultaneous pancreas and kidney transplantation-Myth or reality?. Am J Transplant. 2020;20(10):2832-2841. doi: https://doi.org/10.1111/ajt.15924
23. Giannarelli R, Coppelli A, Sartini M, et al. Effects of pancreas-kidney transplantation on diabetic retinopathy. Transpl Int. 2005;18(5):619-622. doi: https://doi.org/10.1111/j.1432-2277.2005.00108.x
24. Chow VC, Pai RP, Chapman JR, et al. Diabetic retinopathy after combined kidney-pancreas transplantation. Clin Transplant. 1999;13(4):356-362. doi: https://doi.org/10.1034/j.1399-0012.1999.130413.x
25. Wang Q, Klein R, Moss SE, et al. The influence of combined kidney-pancreas transplantation on the progression of diabetic retinopathy. A case series. Ophthalmology. 1994;101(6):1071-1076. doi: https://doi.org/10.1016/s0161-6420(94)31216-4
26. Gruessner AC, Gruessner RWG. The 2022 International Pancreas Transplant Registry Report-A Review. Transplant Proc. 2022;54(7):1918-1943. doi: https://doi.org/10.1016/j.transproceed.2022.03.059
27. Stites E, Wiseman AC. Live donor kidney - PAK versus SPK: how to decide?. Curr Opin Organ Transplant. 2017;22(4):377-381. doi: https://doi.org/10.1097/MOT.0000000000000435
28. Tsai FY, Lau LI, Li AF, et al. Acute macular edema and peripapillary soft exudate after pancreas transplantation with accelerated progression of diabetic retinopathy. J Chin Med Assoc. 2017;80(5):319-325. doi: https://doi.org/10.1016/j.jcma.2017.01.004
29. Ramakrishnan S, Anand V, Roy S. Vascular endothelial growth factor signaling in hypoxia and inflammation. J Neuroimmune Pharmacol. 2014;9(2):142-160. doi: https://doi.org/10.1007/s11481-014-9531-7
30. Pandya M, Banait S, Daigavane S. Insights Into Visual Rehabilitation: Pan-Retinal Photocoagulation for Proliferative Diabetic Retinopathy. Cureus. 2024;16(2):e54273. doi: https://doi.org/10.7759/cureus.54273
31. Петрачков Д.В., Филиппов В.М. Влияние объема интраоперационной лазеркоагуляции сетчатки на частоту осложнений хирургического лечения диабетической ретинопатии // Офтальмология. — 2025. — Т. 22. — № 1. — С. 54-62. doi: https://doi.org/10.18008/1816-5095-2025-1-54-62
32. Auvazian SL, Cano J, Leahy S, et al. Relating Retinal Vascular Oxygen Saturation and Microvasculature Morphology at Progressive Stages of Diabetic Retinopathy. Transl Vis Sci Technol. 2021;10(6):4. doi: https://doi.org/10.1167/tvst.10.6.4
33. Sugano Y, Maeda S, Kato Y, et al. Morphometrics in three dimensional choroidal vessel models constructed from swept-source optical coherence tomography images. Sci Rep. 2022;12(1):15130. doi: https://doi.org/10.1038/s41598-022-17039-9
34. Sivaprasad S, Prevost AT, Vasconcelos JC, et al. Clinical efficacy of intravitreal aflibercept versus panretinal photocoagulation for best corrected visual acuity in patients with proliferative diabetic retinopathy at 52 weeks (CLARITY): a multicentre, single-blinded, randomised, controlled, phase 2b, non-inferiority trial. Lancet. 2017;389(10085):2193-2203. doi: https://doi.org/10.1016/S0140-6736(17)31193-5
35. Nicholson L, Crosby-Nwaobi R, Vasconcelos JC, et al. Mechanistic Evaluation of Panretinal Photocoagulation Versus Aflibercept in Proliferative Diabetic Retinopathy: CLARITY Substudy. Invest Ophthalmol Vis Sci. 2018;59(10):4277-4284. doi: https://doi.org/10.1167/iovs.17-23509
Об авторах
Г. Ш. АржиматоваРоссия
Аржиматова Гульжияна Шевкетовна - к.м.н., доцент.
Москва
Конфликт интересов:
Нет
Е. В. Булава
Россия
Булава Евгений Валерьевич - к.м.н., ассистент.
125993, Москва, Баррикадная ул., д. 2/1, стр. 1
Конфликт интересов:
Нет
М. В. Гусаков
Россия
Гусаков Михаил Владимирович - клинический ординатор.
Москва
Конфликт интересов:
Нет
И. В. Дмитриев
Россия
Дмитриев Илья Викторович - д.м.н., доцент.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. График зависимости прогрессирования диабетической ретинопатии после трансплантации поджелудочной железы от длительности течения сахарного диабета в предтрансплантационном периоде [11, 21–25]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(280KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Аржиматова Г.Ш., Булава Е.В., Гусаков М.В., Дмитриев И.В. Факторы прогрессирования диабетической ретинопатии и развития макулярного отека после трансплантации поджелудочной железы. Сахарный диабет. 2025;28(3):249-258. https://doi.org/10.14341/DM13306
For citation:
Arzhimatova G.S., Bulava E.V., Gusakov M.V., Dmitriev I.V. Factors for diabetic retinopathy progression and macular edema development after pancreas transplantation. Diabetes mellitus. 2025;28(3):249-258. (In Russ.) https://doi.org/10.14341/DM13306
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































