Перейти к:
Динамика секреции глюкагоноподобного пептида-1, глюкагона, а также коагониста ГПП-1/глюкагона оксинтомодулина у лиц с ожирением и сахарным диабетом 2 типа на фоне снижения массы тела после бариатрического вмешательства
https://doi.org/10.14341/DM13267
Аннотация
ОБОСНОВАНИЕ. Влияние глюкагона на метаболические процессы неоднозначно: с одной стороны, избыток данного гормона в постпрандиальном периоде увеличивает гликемию, с другой стороны, может способствовать снижению массы тела. Поэтому особый интерес представляет исследование секреции оксинтомодулина — природного коагониста глюкагона и глюкагоноподобного пептида-1 (ГПП-1) — у пациентов с ожирением, имеющих различный статус углеводного обмена.
ЦЕЛЬ. Оценить изменения в секреции ГПП-1, глюкагона и оксинтомодулина у пациентов с ожирением и сахарным диабетом 2 типа (СД2) в процессе снижения массы тела после бариатрического вмешательства.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование вошли пациенты с морбидным ожирением, как с СД2, так и без нарушений углеводного обмена. Всем участникам проводилось бариатрическое хирургическое вмешательство. Перед операцией, а также через 3 и 6 месяцев после нее проводился гиперинсулинемический эугликемический клэмп-тест. Кроме того, выполнялся глюкозотолерантный тест (ГТТ)/тест со смешанной пищей (ММТ — mixed-meal test) с определением концентрации глюкозы, глюкагона, ГПП-1 и оксинтомодулина в сыворотке крови в трех временных точках: на 0, 30 и 120 минутах теста.
РЕЗУЛЬТАТЫ. В исследовании приняли участие 86 пациентов: 44 с ожирением, но без нарушений углеводного обмена, и 42 пациента с ожирением и СД2. Основные характеристики, такие как возраст, рост, масса тела, индекс массы тела (ИМТ), окружность талии и бедер, в обеих группах были сопоставимы. У пациентов без нарушений углеводного обмена наблюдалась менее выраженная инсулинорезистентность, меньшая гиперглюкагонемия и сохранная секреция ГПП-1. Более того, изначально в этой группе фиксировались более высокие уровни оксинтомодулина по сравнению с пациентами с СД2 (площадь под кривой 2,08 [1,61; 2,50] нг/мл*ч против 1,64 [1,07; 1,78] нг/мл*ч, p<0,00005). В результате снижения массы тела после бариатрического вмешательства секреция оксинтомодулина возросла в обеих группах (площадь под кривой в группе без СД2: 2,35 [1,9; 3,28] нг/мл*ч через 3 месяца, 2,55 [2,02; 3,35] нг/мл*ч через 6 месяцев, p<0,00001; в группе с СД2: 2,27 [1,95; 2,61] нг/мл*ч через 3 месяца; 2,4 [1,99; 2,72] нг/мл*ч через 6 месяцев, p<0,00001) при отсутствии значимых межгрупповых различий через 3 и 6 месяцев после операции.
ЗАКЛЮЧЕНИЕ. Исходные уровни оксинтомодулина были значительно выше у пациентов с нормальным углеводным обменом, чем у пациентов с СД2, и сопоставимо возрастали в обеих группах через 3 и 6 месяцев после бариатрического вмешательства. Полученные результаты могут свидетельствовать о потенциальных защитных функциях оксинтомодулина, однако для окончательных выводов необходимы дальнейшие исследования.
Ключевые слова
Для цитирования:
Шестакова Е.А., Томилова А.О., Самсонова М.Д., Вознесенская А.А., Синеокая М.С., Стафеев Ю.С., Шестакова М.В. Динамика секреции глюкагоноподобного пептида-1, глюкагона, а также коагониста ГПП-1/глюкагона оксинтомодулина у лиц с ожирением и сахарным диабетом 2 типа на фоне снижения массы тела после бариатрического вмешательства. Сахарный диабет. 2025;28(4):313-322. https://doi.org/10.14341/DM13267
For citation:
Shestakova E.A., Tomilova A.O., Samsonova M.D., Voznesenskaya A.A., Sineokaya M.S., Stafeev I.S., Shestakova M.V. Impact of weight loss on GLP-1, glucagon and oxyntomodulin secretion in patients with obesity and type 2 diabetes. Diabetes mellitus. 2025;28(4):313-322. (In Russ.) https://doi.org/10.14341/DM13267
ОБОСНОВАНИЕ
Оксинтомодулин, выделенный и описанный Домиником Баталем и Йенсом Юль Хольстом в 1982 г., представляет собой 37-аминокислотный пептид, включающий 29 аминокислот глюкагона и C-концевой октопептид. Он преимущественно продуцируется и высвобождается L-клетками эндокринного аппарата кишечника путем обработки предшественника препроглюкагона с участием проконвертазы 1/3. Оксинтомодулин является природным коагонистом рецепторов как глюкагоноподобного пептида-1, так и глюкагона, в результате чего влияние его на контроль массы тела и гликемии может быть неоднозначным. В литературе описано множество эффектов оксинтомодулина на метаболический профиль, включая улучшение толерантности к глюкозе, увеличение энергетических затрат, ускорение липолиза в печени, подавление аппетита, замедление опорожнения желудка [1].
В то же время раздельное воздействие на рецепторы ГПП-1 и глюкагона у лиц с сахарным диабетом 2 типа (СД2) потенциально может приводить к разнонаправленным эффектам оксинтомодулина.
При СД2 отмечается отсутствие подавления постпрандиальной выработки глюкагона, что проводит к гиперглюкагонемии. Гиперглюкагонемия является одним из ранних патогенетических дефектов в развитии СД2 [2][3]. Повышенный уровень глюкагона натощак связан с резистентностью к инсулину на уровне альфа-клеток, что подтверждено исследованиями на мышах: удаление у них рецепторов инсулина приводило к гипергликемии и гиперглюкагонемии [2].
Воздействие на рецепторы ГПП-1 имитирует действие эндогенного ГПП-1, приводя к усилению секреции инсулина, подавлению выделения глюкагона, замедлению опорожнения желудка и снижению аппетита через центральные механизмы подавления чувства голода. По этой причине препараты группы агонистов рецепторов ГПП-1 (арГПП-1) представляют собой мощный инструмент для контроля уровня глюкозы в крови и улучшения компонентов метаболического синдрома [4].
Хорошо известно, что бариатрические вмешательства, направленные на снижение массы тела и нормализацию гликемического контроля, также способны положительно влиять на инкретиновую систему. Этот эффект наиболее характерен для шунтирующих типов операций. Так, ускоренное поступление пищи в дистальную часть тонкой кишки после шунтирующих вмешательств способствует быстрому высвобождению ГПП-1, а исключение двенадцатиперстной кишки из контакта с пищевой массой приводит к ингибированию диабетогенных субстанций, так называемых антиинкретинов (в том числе глюкагона и глюкозозависимого инсулинотропного полипептида (ГИП)) [5]. Таким образом, бариатрические вмешательства также обладают мощным влиянием на уровни инкретинов.
В свете вышесказанного особый интерес представляет влияние бариатрических операций и снижения массы тела на уровни и эффекты оксинтомодулина, являющегося коагонистом рецепторов ГПП-1 и глюкагона.
Ввиду различного влияния глюкагона и ГПП-1 на углеводный и жировой обмены, целью нашего исследования стало изучение динамики секреции оксинтомодулина у пациентов с ожирением с СД2 и без него на фоне проведения бариатрических вмешательств.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить изменения в секреции ГПП-1, глюкагона и коагониста ГПП-1/глюкагона оксинтомодулина у людей с ожирением с СД2 и без него в процессе снижения массы тела на фоне проведения бариатрических вмешательств.
МАТЕРИАЛЫ И МЕТОДЫ
Набор пациентов и проведение клинического обследования осуществлялись на базе ФГБУ «НМИЦ эндокринологии» Министерства здравоохранения Российской Федерации. Исследование было предварительно одобрено локальным этическим комитетом, протокол №16 от 12.10.2016. Все участники предоставили подписанное информированное согласие, подтверждающее их добровольное участие в исследовании.
Критерии включения
- Мужчины и женщины старше 30 лет.
- Наличие ожирения в течение 10 лет или более.
- индекс массы тела (ИМТ) равен или превышает 35 кг/м².
- Запланированное проведение одной из бариатрических операций: продольной резекции желудка, гастрошунтирования по Ру (ГШ) или билиопанкреатического шунтирования (БПШ) в модификации SADI.
Критерии исключения
- Диагноз «Сахарный диабет 1 типа».
- Предшествующий прием агонистов рецепторов ГПП-1.
- Оперативные вмешательства на тонкой кишке в анамнезе.
- Расчетная скорость клубочковой фильтрации (рСКФ) менее 60 мл/мин/1,73 м².
- Гемоглобин ниже 70 г/л.
- Острое нарушение мозгового кровообращения, инфаркт миокарда в течение последнего месяца.
- Текущая беременность.
- Онкологические заболевания на момент исследования.
- Неспособность регулярно посещать исследовательский центр для послеоперационного наблюдения.
Пациенты были разделены на две группы в зависимости от наличия СД2: одна группа состояла из пациентов с СД2, другая — из лиц без данного диагноза.
Обследования проводились до хирургического вмешательства, а также повторно через 3 и 6 месяцев после операции. Они включали оценку антропометрических показателей (рост, масса тела, ИМТ, объем талии (ОТ) и объем бедер (ОБ)), биохимические исследования крови и расширенный тест с углеводной нагрузкой. Уровни гликемии и гормональных параметров измерялись в трех временных точках: натощак, через 30 и 120 минут. Пациентам с нормальным углеводным обменом выполняли стандартный пероральный глюкозотолерантный тест (ГТТ), а у пациентов с СД2 использовали тест со смешанной пищей (МТТ) (по этическим соображениям), при этом сахароснижающие препараты отменялись не позднее чем за 12 часов до теста. Для оценки степени инсулинорезистентности (ИР) применялись гиперинсулинемический эугликемический клэмп-тест и расчет индекса HOMA-IR.
Для расчета индекса HOMA-IR применялась формула:
иммунореактивный инсулин(мЕд/л) * глюкоза сыворотки крови натощак (ммоль/л)/22,5
Определение в сыворотке крови уровня глюкозы (референсные значения натощак 3,1–6,1 ммоль/л) проводилось на биохимическом анализаторе Architect c4000 («Abbott Diagnostics», «Abbott Park», IL, США) стандартными наборами производителя. Гликированный гемоглобин (референсные значения 4−6%) определяли методом высокоэффективной жидкостной хроматографии на анализаторе D10 (Bio Rad); метод сертифицирован NGSP (The National Glycohemoglobin Standartization Program). Иммунореактивный инсулин (референсные значения натощак 2,3−26,4 мЕд/л) (в рамках расчета HOMA-IR) определяли в сыворотке крови на электрохемилюминесцентном анализаторе Cobas 6000 (Roche, Швейцария) стандартными наборами.
Уровень гормонов определялся методом иммуноферментного анализа (ИФА) с использованием наборов Mercodia (Швеция) для анализа глюкагона (диапазон анализатора 2,0–180 пмоль/л) и ГПП-1 (диапазон анализатора 0,9–940 пмоль/л), а также Cusabio (США) для исследования оксинтомодулина (диапазон анализатора 0,312–20 нг/мл).
Гиперинсулинемический эугликемический клэмп проводился в день, отличный от дня выполнения углеводной нагрузки, с использованием методики R. DeFronzo [6].
После бариатрических операций у пациентов с СД2 была достигнута стабилизация углеводного обмена. При достижении уровня гликемии натощак менее 6,5 ммоль/л и постпрандиальных значений глюкозы менее 8 ммоль/л проводилась постепенная корректировка сахароснижающей терапии вплоть до ее полной отмены.
Для обработки данных использовалась программа Statistica 13.3. Результаты количественных переменных представлены в виде медиан и межквартильного размаха (25-й и 75-й перцентиль) — Me [ Q1; Q3]. Для сравнения данных двух независимых групп применялся U-критерий Манна-Уитни. При анализе зависимых выборок использовался ранговый дисперсионный анализ Фридмана, а для анализа изменений внутри группы — критерий Вилкоксона. Поправка Бонферрони применялась для контроля множественных сравнений, при этом статистически значимыми считались различия при р<0,0005.
РЕЗУЛЬТАТЫ
В исследование вошли 44 пациента с ожирением без СД и 42 пациента с ожирением и СД2. Исходные характеристики (возраст, рост, масса тела, ИМТ, ОТ, ОБ) в обеих группах значимо не различались. В группе пациентов с ожирением и без нарушений углеводного обмена у 23 пациентов было выполнено гастрошунтирование по Ру (ГШ), а у 21 пациента — билиопанкреатическое шунтирование (БПШ) по модификации SADI. У пациентов с СД2 проводились три типа операций: 13 пациентам — ГШ, еще 13 — БПШ по модификации SADI и у 16 пациентов — продольная резекция желудка (ПРЖ).
Через 3 и 6 месяцев после бариатрических операций в обеих группах наблюдалось значимое снижение массы тела (табл. 1 и 2).
Таблица 1. Динамика антропометрических и клинических показателей (исходно, через 3 и 6 месяцев после бариатрической операции) у пациентов с ожирением без нарушений углеводного обмена
|
Показатель |
Исходно (n=44) |
3 месяца (n=44) |
6 месяцев (n=44) |
p (Friedman ANOVA) |
|
Масса тела, кг |
121 [ 112; 140] |
104 [ 95; 121] |
95 [ 87; 102] |
<0,00001 |
|
ИМТ, кг/м² |
43,2 [ 40,3; 46,5] |
37,0 [ 34,3; 40,2] |
33,6 [ 31,0; 37,3] |
<0,00001 |
|
Окружность талии, см |
133 [ 128; 140] |
122 [ 117,5; 130] |
115 [ 110; 120] |
<0,00001 |
|
Окружность бедер, см |
128,5 [ 118; 136] |
119,5 [ 109; 126] |
109 [ 100,5; 114] |
<0,00001 |
|
HbA1c, % |
5,5 [ 5,3; 5,8] |
5,35 [ 5,2; 5,5] |
5,2 [ 5,1; 5,4] |
<0,00001 |
|
Глюкоза натощак, ммоль/л |
5,2 [ 5,0; 5,7] |
5,2 [ 4,8; 5,7] |
4,9 [ 4,7; 5,1] |
0,00418 |
|
Глюкоза 30 мин в ходе ГТТ, ммоль/л |
8,4 [ 7,4; 9,6] |
7,7 [ 7,2; 9,1] |
8,1 [ 7,4; 9,2] |
0,02461 |
|
Глюкоза 120 мин в ходе ГТТ, ммоль/л |
6,0 [ 4,9; 7,1] |
6,6 [ 5,8; 7,3] |
6,2 [ 5,6; 6,8] |
0,05578 |
Примечание: HbA1c — гликированный гемоглобин; ГТТ — глюкозотолерантный тест; ИМТ — индекс массы тела.
Таблица 2. Динамика антропометрических и клинических показателей (исходно, через 3 и 6 месяцев после бариатрической операции) в группе пациентов с ожирением и сахарным диабетом 2 типа
|
Показатель |
Исходно (n=42) |
3 месяца (n=42) |
6 месяцев (n=42) |
p (Friedman ANOVA) |
|
Масса тела, кг |
124 [ 112; 138] |
99 [ 92; 112] |
93 [ 83; 104] |
<0,00001 |
|
ИМТ, кг/м² |
42,3 [ 39,1; 48,3] |
34,3 [ 32,3; 38,7] |
32,1 [ 29,5; 36,0] |
<0,00001 |
|
Окружность талии, см |
128 [ 121; 137] |
109,5 [ 105; 120] |
105 [ 101; 115] |
<0,00001 |
|
Окружность бедер, см |
127 [ 115; 132] |
116 [ 108; 128] |
113 [ 104; 123] |
<0,00001 |
|
HbA1c, % |
8,0 [ 7,2; 8,7] |
6,1 [ 5,7; 6,3] |
5,6 [ 5,3; 5,7] |
<0,00001 |
|
Глюкоза натощак, ммоль/л |
8,5 [ 7,2; 10,1] |
5,9 [ 5,3; 6,9] |
5,4 [ 5,1; 5,8] |
<0,00001 |
|
Глюкоза 30 мин в ходе ММТ, ммоль/л |
11,4 [ 9,2; 15,4] |
8,2 [ 7,5; 9,7] |
7,7 [ 7,2; 8,2] |
<0,00001 |
|
Глюкоза 120 мин в ходе ММТ, ммоль/л |
10,4 [ 9,1; 13,8] |
6,2 [ 5,9; 7,5] |
6,1 [ 5,5; 7,1] |
<0,00001 |
|
Длительность СД, лет |
9 [ 6; 12] |
Примечание: HbA1c — гликированный гемоглобин; ММТ — тест со смешанной пищей (mixed-meal test); ИМТ — индекс массы тела.
Также в группе пациентов с СД2 наблюдалось стремительное улучшение компенсации углеводного обмена, позволившее большинству пациентов отменить сахароснижающие препараты (рис. 1). Через 6 месяцев после оперативного вмешательства 73,8% пациентов из группы с исходным СД2 прекратили получать сахароснижающую терапию, 11 пациентов (26,2%) продолжили принимать метформин, 2 человека (4,8%) — препараты из класса ингибиторов дипептидилпептидазы 4 (иДПП-4) (табл. 3).
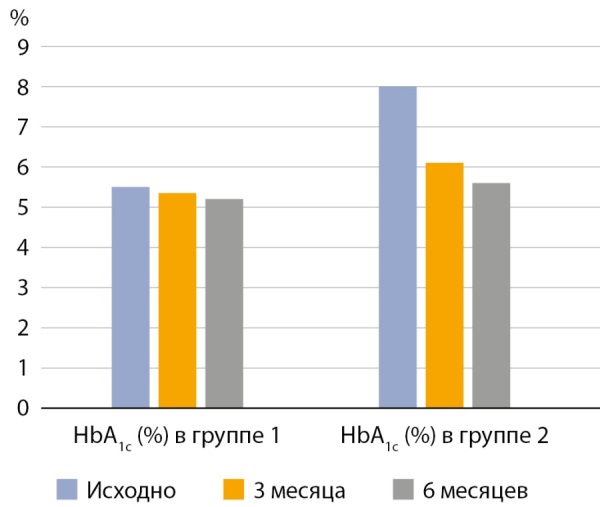
Рисунок 1. Динамика гликированного гемоглобина (исходно, через 3 и 6 месяцев после бариатрической операции) у пациентов с ожирением без нарушений углеводного обмена (группа 1) и у пациентов с ожирением и исходным сахарным диабетом 2 типа (группа 2).
Таблица 3. Исходная сахароснижающая терапия и динамика ее отмены в группе пациентов с ожирением и сахарным диабетом 2 типа
|
Исходно (n=42) |
3 месяца (n=42) |
6 месяцев (n=42) |
|
|
Количество сахароснижающих препаратов (n, %) |
|||
|
Монотерапия |
11 (26,2) |
17 (40,5) |
9 (21,4) |
|
Двойная терапия |
19 (45,2) |
4 (9,5) |
2 (4,8) |
|
в т.ч. на инсулинотерапии |
1 |
0 |
0 |
|
Тройная терапия |
12 (28,6) |
0 |
0 |
|
в т.ч. на инсулинотерапии |
5 |
0 |
0 |
|
Отмена терапии |
21 (50) |
31 (73,8) |
|
|
Классы сахароснижающих препаратов (n, %) |
|||
|
Бигуаниды |
33 (78,6) |
20 (47,6) |
11 (26,2) |
|
иДПП-4 |
17 (40,5) |
3 (7,1) |
2 (4,8) |
|
иНГЛТ-2 |
13 (31) |
2 (4,8) |
0 |
|
ПСМ |
16 (38,1) |
0 |
0 |
|
Базальный инсулин |
6 (14,3) |
0 |
0 |
Примечание: иДПП-4 — ингибиторы дипептидилпептидазы 4; иНГЛТ-2 — ингибиторы натрий-глюкозного контраспортера 2-го типа; ПСМ — препараты сульфонилмочевины.
Хирургическое лечение в обеих группах приводило к значимому снижению ИР как по результатам клэмп-теста, так и согласно значениям HOMA-IR (табл. 4).
Таблица 4. Динамика показателей инсулинорезистентности после бариатрических вмешательств
|
Показатель |
Исходно |
3 месяца |
6 месяцев |
p (Friedman ANOVA) |
|
Лица без нарушений углеводного обмена (n=44) |
||||
|
М-индекс (мг/кг*мин) |
4,1 [ 3,1; 5,0] |
4,9 [ 3,8; 5,6] |
5,1 [ 4,3; 6,2] |
<0,00001 |
|
HOMA-IR |
4,8 [ 3,2; 6,4] |
4,0 [ 3,3; 4,8] |
3,5 [ 2,8; 4,8] |
<0,0002 |
|
Лица с СД2 (n=42) |
||||
|
М-индекс (мг/кг*мин) |
1,5 [ 1,0; 2,2] |
3,4 [ 2,6; 4,3] |
5,0 [ 4,1; 5,2] |
<0,00001 |
|
HOMA-IR |
10,0 [ 6,9; 15,3] |
2,8 [ 2,3; 4,1] |
2,6 [ 2,2; 3,3] |
<0,00001 |
Примечание: HOMA-IR — индекс инсулинорезистентности (Homeostasis Model Assessment of Insulin Resistance); СД2 — сахарный диабет 2 типа.
Для оценки гормональной секреции (глюкагона, ГПП-1 и оксинтомодулина) всем пациентам трижды проведен тест с углеводной нагрузкой (ГТТ/МТТ). Модификация теста заключалась в определении показателей на 30-й минуте для оценки пиковых значений гормональной секреции. На рис. 2 и 3 представлена динамика секреции глюкагона и ГПП-1 в группах лиц без нарушений углеводного обмена и с СД2.
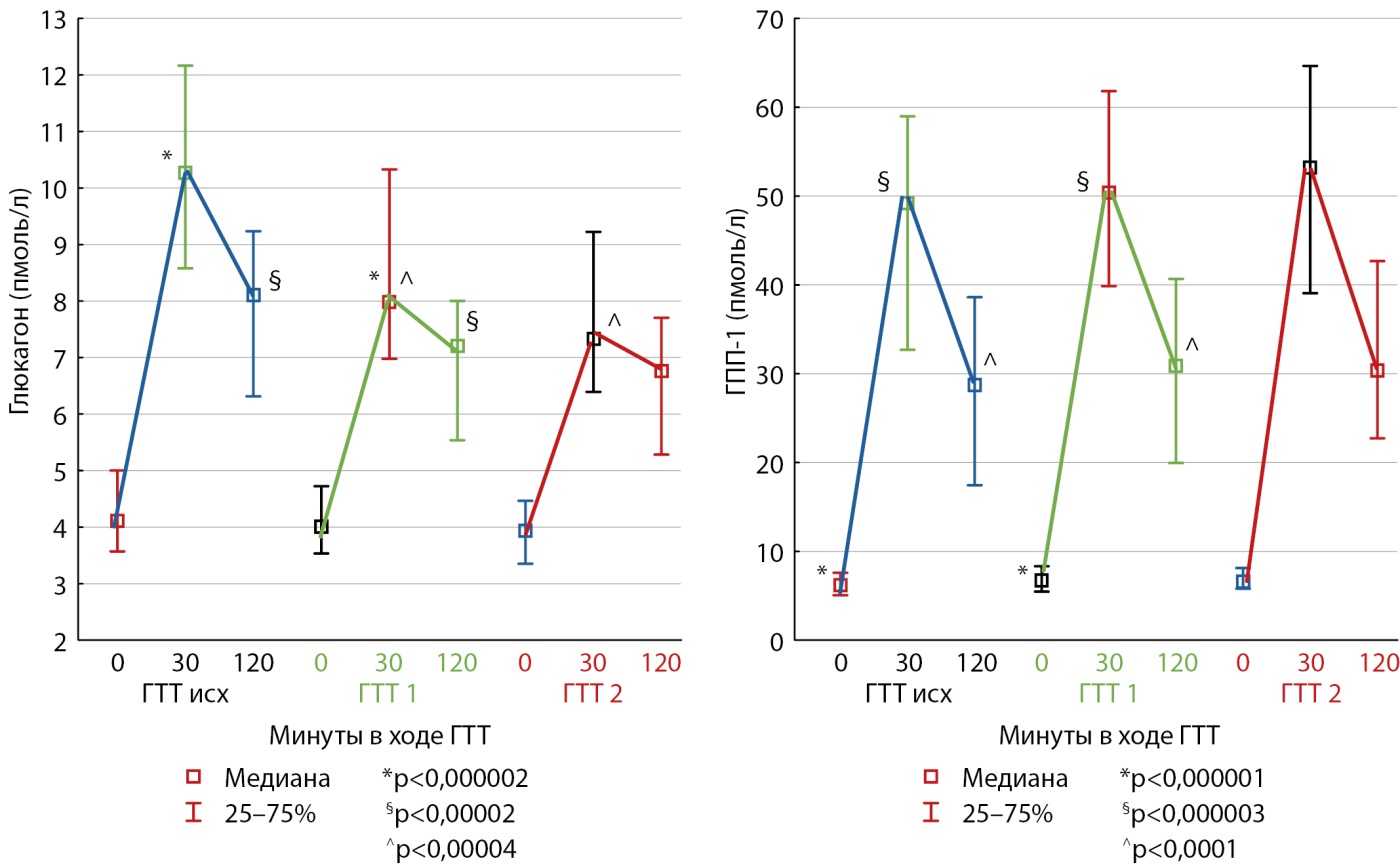
Рисунок 2. Динамика секреции глюкагона и глюкагоноподобного пептида-1 в ходе глюкозотолерантного теста у пациентов без нарушений углеводного обмена.
Примечание: необходимо обратить внимание на различия в осях ординат. Здесь и в рисунках 3–4: одинаковые символы указывают на межгрупповые различия в определенные временные моменты проведения ГТТ (по критерию Манна-Уитни); ГТТ исх. — ГТТ до операции, ГТТ1 — через 3 месяца после операции, ГТТ2 — через 6 месяцев после операции.
ГТТ — глюкозотолерантный тест.
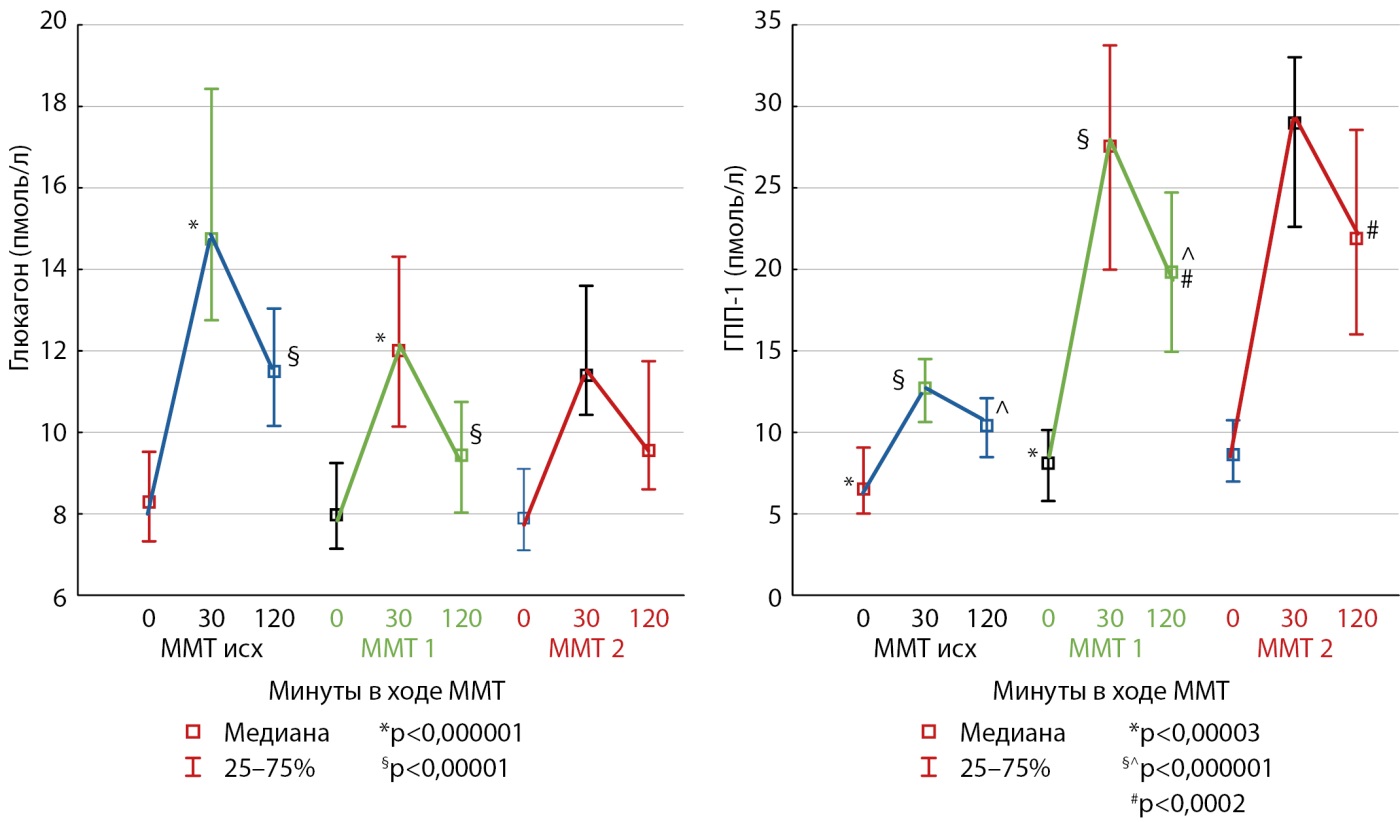
Рисунок 3. Динамика секреции глюкагона и глюкагоноподобного пептида-1 в ходе теста со смешанной пищей у лиц с сахарным диабетом 2 типа.
Примечание: необходимо обратить внимание на различия в осях ординат.
ММТ — тест со смешанной пищей (mixed-meal test); ГПП-1 — глюкагоноподобный пептид-1.
Обращает на себя внимание отсутствие подавления глюкагона в ответ на пищевую нагрузку, как у лиц с СД2, так и пациентов без нарушения углеводного обмена, что свидетельствует о раннем развитии гиперглюкагонемии у данных пациентов. Секреция ГПП-1 после оперативного вмешательства возросла у лиц с СД2 по сравнению с исходными значениями, однако не достигла пиковых значений группы с ожирением без нарушений углеводного обмена.
На рис. 4 представлена динамика ответа оксинтомодулина — природного коагониста глюкагона и ГПП-1 на углеводную нагрузку, на рис. 5 — сравнение площади под кривой для данного гормона.
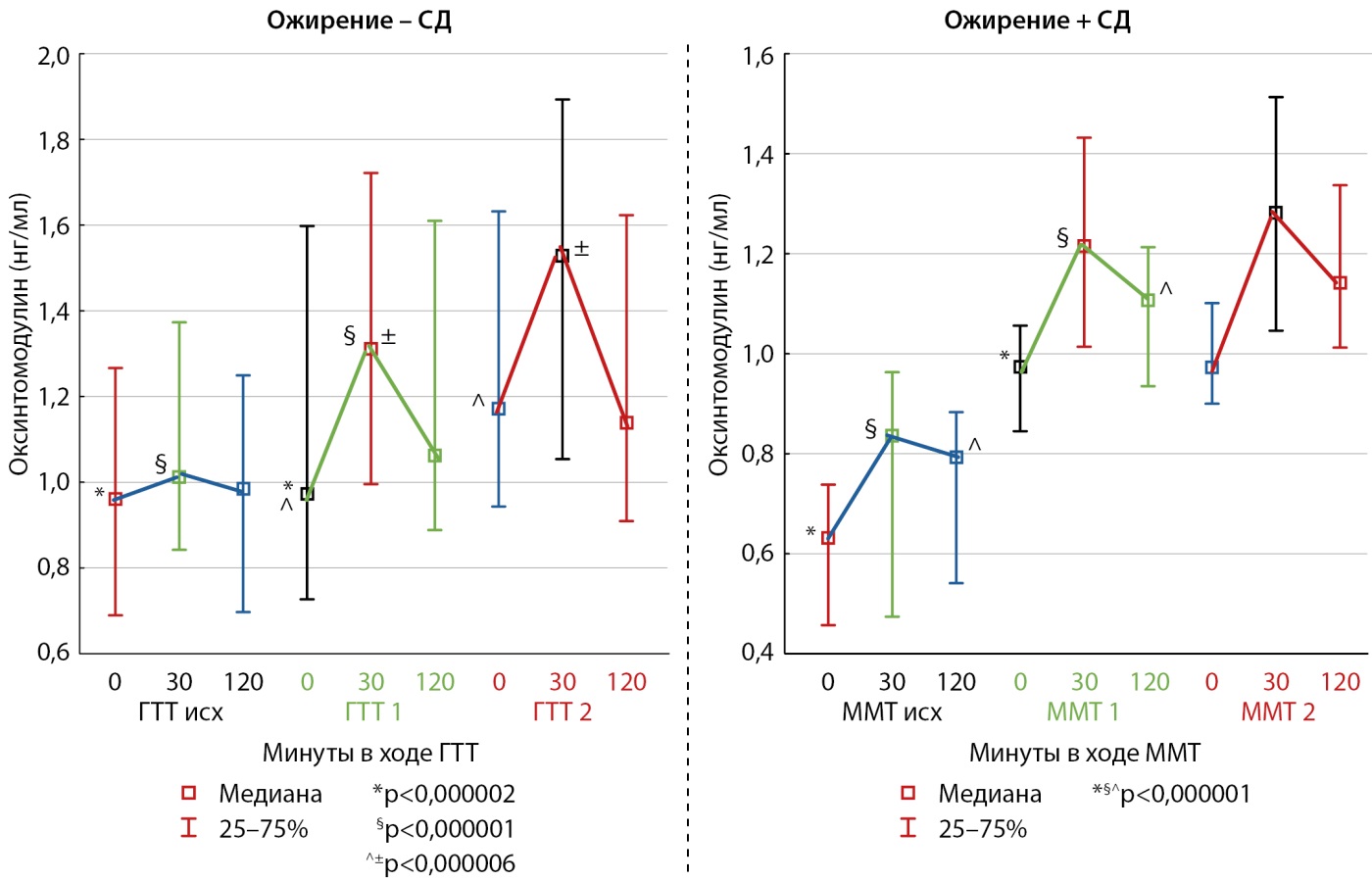
Рисунок 4. Динамика секреции оксинтомодулина в ходе теста с углеводной нагрузкой исходно, через 3 и 6 месяцев в группах пациентов с сахарным диабетом 2 типа и без него.
Примечание: необходимо обратить внимание на различия в осях ординат.
ММТ — тест со смешанной пищей (mixed-meal test); ГТТ — глюкозотолерантный тест; СД — сахарный диабет.
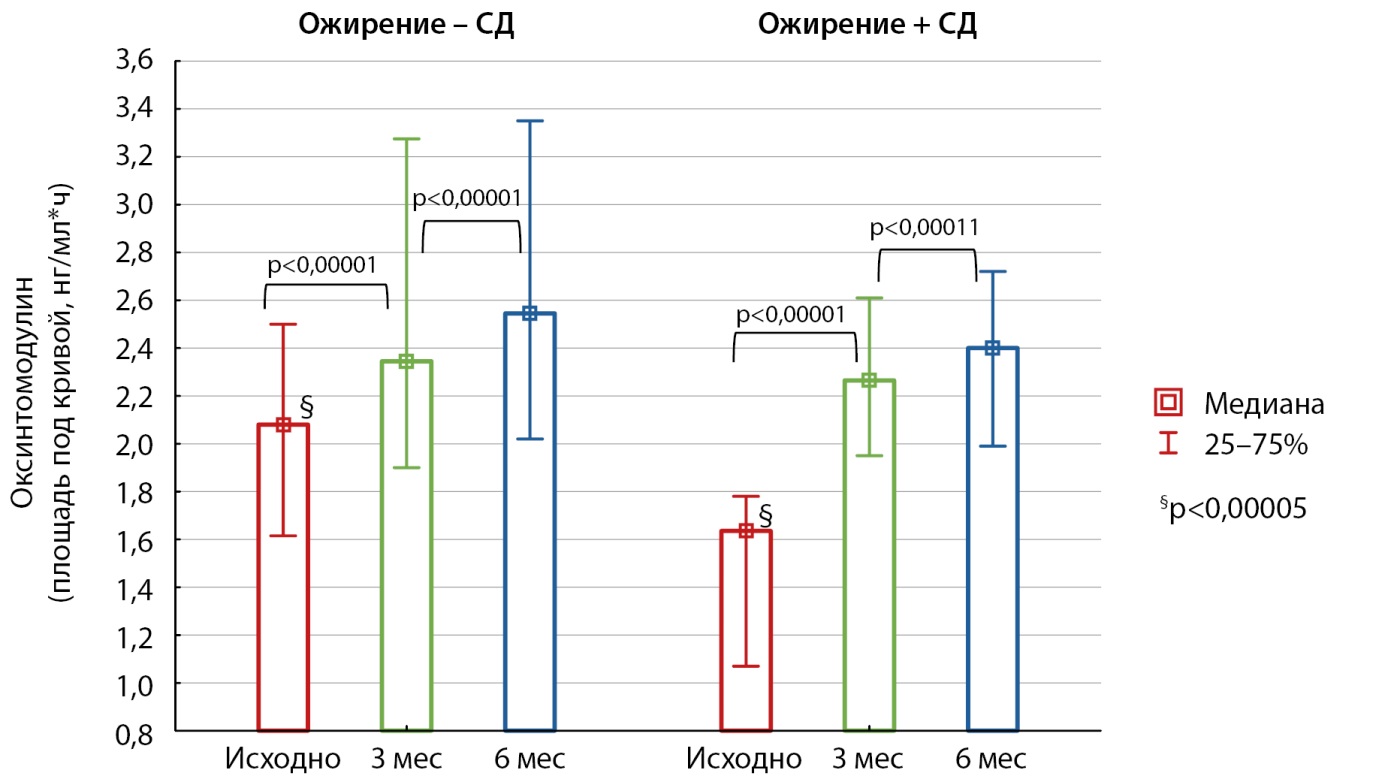
Рисунок 5. Динамика секреции оксинтомодулина (площадь под кривой) после бариатрической операции у пациентов с ожирением, как с сахарным диабетом 2 типа, так и без него.
Примечание: специальные символы указывают на межгрупповые различия (критерий Манна-Уитни); скобки с уровнем значимости обозначают различия динамических показателей внутри одной группы (критерий Вилкоксона).
СД — сахарный диабет.
Исходный уровень оксинтомодулина у пациентов с ожирением без нарушений углеводного обмена был значимо выше по сравнению с уровнем у пациентов с ожирением и СД2 (площадь под кривой 2,08 [ 1,61; 2,50] нг/мл*ч в группе без СД2 против 1,64 [ 1,07; 1,78] нг/мл*ч в группе с СД2, p<0,00005) (рис. 5), однако его ритм секреции в ответ на углеводную нагрузку оставался монотонным (рис. 4). Через 3 и 6 месяцев после начала исследования у обеих групп наблюдалось восстановление ритма секреции оксинтомодулина, с пиковым значением на 30-й минуте ГТТ, но значимых межгрупповых различий не выявлено. В обеих группах секреция оксинтомодулина увеличивалась к 3-му месяцу наблюдения и продолжала расти к 6-му месяцу (площадь по кривой в группе без СД2: 2,35 [ 1,9; 3,28] нг/мл*ч через 3 месяца, 2,55 [ 2,02; 3,35] нг/мл*ч через 6 месяцев, p<0,00001; в группе с СД2: 2,27 [ 1,95; 2,61] нг/мл*ч через 3 месяца; 2,4 [ 1,99; 2,72] нг/мл*ч через 6 месяцев, p<0,00001).
С учетом отличий в объеме оперативного вмешательства был проведен дополнительный анализ, в рамках которого не обнаружено значимых различий в секреции глюкагона, ГПП-1 и оксинтомодулина, как исходно, так и в ходе наблюдения вне зависимости от наличия у пациентов нарушений углеводного обмена. На рисунке 6 представлена зависимость секреции оксинтомодулина от типа оперативного вмешательства: после любых видов вмешательств отмечалась тенденция к увеличению секреции оксинтомодулина, при этом различий между группами хирургического лечения обнаружено не было.
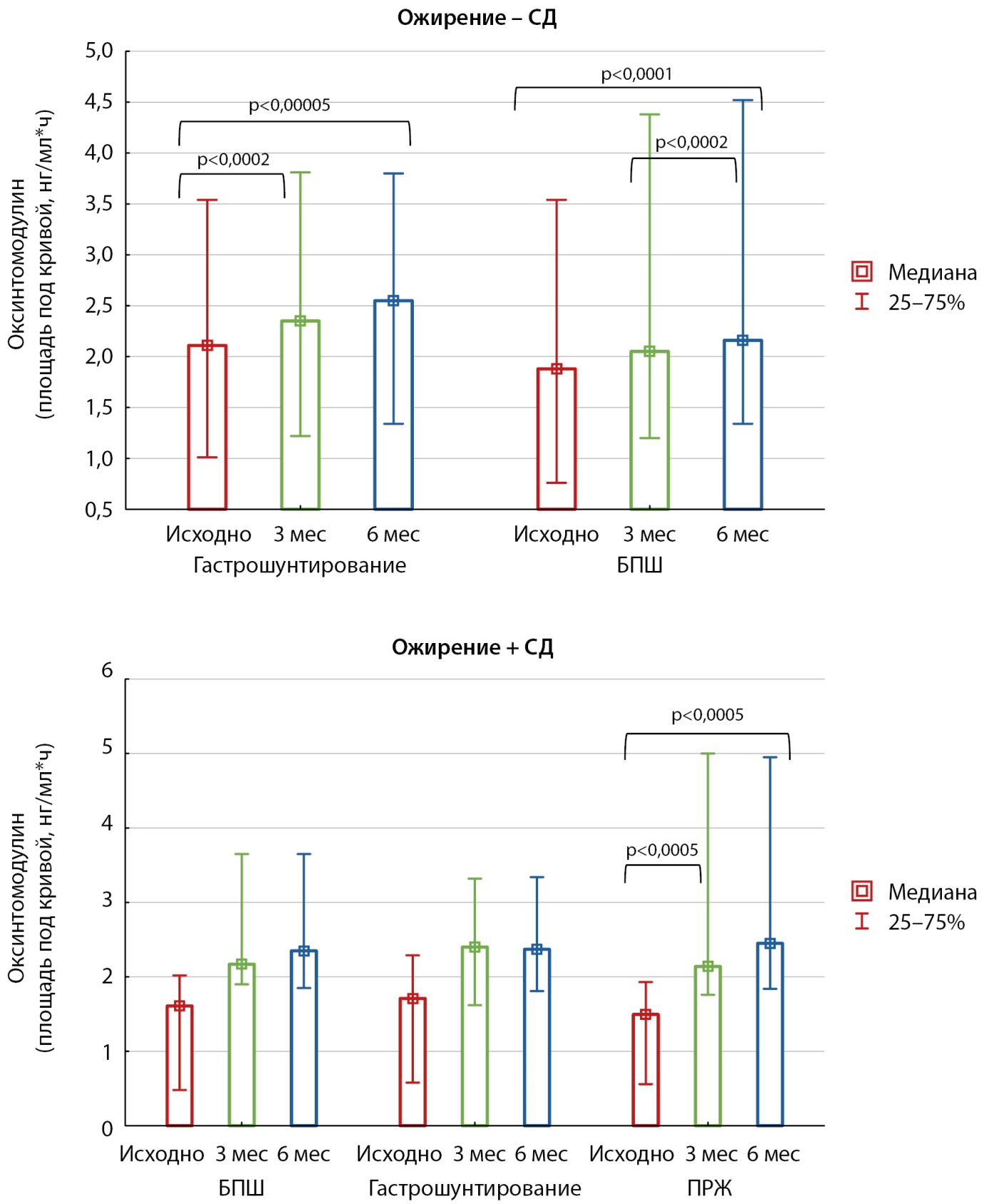
Рисунок 6. Сравнение секреции оксинтомодулина в группах пациентов с сахарным диабетом 2 типа и без него, в зависимости от типа оперативного вмешательства.
Примечание: скобки с уровнем значимости обозначают различия динамических показателей внутри одной группы (критерий Вилкоксона).
БПШ — билиопанкреатическое шунтирование; ПРЖ — продольная резекция желудка; СД — сахарный диабет.
ОБСУЖДЕНИЕ
Основной задачей данного исследования являлось изучение изменений в уровнях гормонов желудочно-кишечного тракта (ЖКТ), которые оказывают влияние на массу тела (ГПП-1, глюкагон, оксинтомодулин) у пациентов с ожирением и различным состоянием углеводного обмена в процессе снижения массы тела на фоне бариатрического лечения. Особое внимание уделялось секреции оксинтомодулина, который является природным коагонистом глюкагона и ГПП-1. Это особенно актуально, поскольку двойные и тройные агонисты гормонов ЖКТ сегодня рассматриваются как перспективные препараты для терапии ожирения и СД2 [7].
Бариатрическая хирургия в данном исследовании расценивалась как высокоэффективный метод долгосрочного снижения массы тела. Результаты контроля массы тела на фоне бариатрических вмешательств значительно превосходят результаты диетологических интервенций, на фоне которых большинству лиц не удается длительно поддерживать достигнутый результат [8]. Одной из причин различий эффективности двух методов лечения ожирения является разное их влияние на профиль секреции кишечных гормонов. Бариатрическая операция связана с модификацией анатомии желудочно-кишечного тракта и, соответственно, приводит к изменениям уровней кишечных гормонов, в отличие от низкокалорийной диеты, часто сопровождающейся усилением чувства голода [9][10].
В данном исследовании для анализа секреции гормонов ЖКТ после бариатрического вмешательства были сформированы две группы пациентов, схожих по степени ожирения, но различающихся по статусу углеводного обмена: одна группа с нормогликемией, другая — с СД2. У пациентов без нарушений углеводного обмена отмечался более «защитный» метаболический профиль: у них наблюдалась меньшая степень ИР. Это подтверждалось данными гиперинсулинемического эугликемического клэмп-теста (признанного золотым стандартом в оценке ИР) и расчетом индекса HOMA-IR. Кроме того, эти пациенты демонстрировали более благоприятные показатели гормональной регуляции углеводного обмена: менее выраженную гиперглюкагонемию и лучше сохраненную секрецию ГПП-1.
По результатам нашего исследования секреция оксинтомодулина до операции была более сохранна у лиц без нарушений углеводного обмена, что потенциально может говорить о положительном влиянии более высоких значений эндогенного оксинтомодулина на углеводный обмен.
Оксинтомодулин является не столь изученным гормоном, как другие представители семейства проглюкагона. Ранние исследования сосредоточивались на его влиянии на ЖКТ, включая снижение секреции желудочного сока, замедление опорожнения желудка и подавление моторики двенадцатиперстной кишки. В последние годы также был продемонстрирован выраженный гипогликемический эффект у мышей с СД, вызванным стрептозотоцином, и у мышей db/db. Было также выявлено, что естественный оксинтомодулин значительно увеличивает секрецию инсулина у лиц с ожирением [1].
В исследованиях на людях подкожное введение оксинтомодулина в течение 4 недель способствовало снижению массы тела что, по-видимому, было связано как с увеличением расхода энергии, так и с уменьшением потребления пищи [11][12]. Однако роль оксинтомодулина в этиологии потери массы тела неоднозначна. У мышей, лишенных рецепторов ГПП-1, инъекции оксинтомодулина не оказывали влияния на аппетит, что говорит о том, что подавление потребления пищи связано с активацией ГПП-1-рецепторов. У японских перепелов инъекции оксинтомодулина вызывали активацию нейронов в аркуатном ядре гипоталамуса, что стимулировало чувство насыщения. Введение оксинтомодулина непосредственно в мозг также вызывало анорексигенные эффекты, дозозависимо снижая потребление как пищи, так и воды. Также было показано влияние оксинтомодулина на энергетический обмен: он усиливал липолиз в печени и увеличивал расход энергии через активацию глюкагоновых рецепторов. Таким образом, оксинтомодулин способствует снижению массы тела за счет двух факторов: уменьшения потребления пищи и увеличения энергетических затрат [1].
Однако исследования, посвященные экзогенному введению коагониста глюкагона/ГПП-1, говорят о противоречивом влиянии совместной стимуляции рецепторов ГПП-1 и глюкагона на метаболизм. Несмотря на то, что коагонист глюкагона/ГПП-1 обладает положительным влиянием на массу тела у лиц с ожирением и приводит к снижению массы тела, превосходящему эффективность лираглутида 3,0 мг [13], среди пациентов с СД2 отмечается отсутствие его влияния на уровень HbA1c и даже некоторое повышение глюкозы плазмы и инсулина натощак [14]. Эти данные могут говорить не столько о диабетогенном эффекте комбинированного влияния на рецепторы к глюкагону и ГПП-1, сколько о необходимости очень точной регулировки степени воздействия на каждый из типов рецепторов под влиянием коагониста. По данным анализа 26 рандомизированных контролируемых исследований, различные коагонисты демонстрируют устойчивое снижение массы тела, уменьшение содержания внутрипеченочного жира, улучшение параметров липидного спектра, чувствительности к инсулину; результаты по контролю углеводного обмена остаются противоречивыми [15].
После оперативного вмешательства секреция оксинтомодулина в группе лиц с СД2 возросла и достигла значений, сопоставимых с пациентами без СД2. Такая динамика гормональных изменений может свидетельствовать о роли снижения массы тела в восстановлении продукции оксинтомодулина. В ходе наблюдения также отмечалось снижение уровня глюкагона и увеличение секреции ГПП-1, что наряду с увеличением выработки оксинтомодулина отмечалось и в других испытаниях [16].
Данное исследование имеет ряд ограничений. Сложность в интерпретации полученных данных заключается в том, что все три гормона — глюкагон, ГПП-1, оксинтомодулин — являются производными проглюкагона [17]. В связи с этим определение данных веществ наборами ИФА может приводить к перекрестной реакции. В нашем исследовании использованы наборы, для которых данная реакция сведена к минимуму.
Также необходимо отметить, что период наблюдения 6 месяцев, отраженный в данном исследовании, может быть недостаточным для оценки динамики секреции оксинтомодулина, глюкагона, ГПП-1 у пациентов без исходного СД2.
ЗАКЛЮЧЕНИЕ
Целью нашего исследования было изучение динамики секреции природного коагониста глюкагона/ГПП-1/оксинтомодулина у лиц с ожирением как с СД2, так и без нарушений углеводного обмена на фоне проведенного бариатрического лечения. Выработка оксинтомодулина исходно была более высокой в группе лиц без СД2, а после проведения бариатрических вмешательств на фоне снижения массы тела секреция оксинтомодулина сопоставимо возросла в обеих группах. Более высокие исходные значения уровня оксинтомодулина у лиц без нарушений углеводного обмена по сравнению с пациентами с СД2 могут свидетельствовать о его защитных эффектах, однако достоверность данного утверждения требует проверки в дополнительных исследованиях.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Грант РНФ 22-15-00365.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Шестакова Е.А. — концепция и дизайн исследования, проведение лечебно-диагностических мероприятий, сбор, обработка и интерпретация полученных данных, анализ литературы, написание статьи, утверждение итогового варианта текста рукописи; Томилова А.О., Самсонова М.Д., Вознесенская А.А., Синеокая М.С., Стафеев Ю.С. — анализ литературы, написание статьи; Шестакова М.В. — редактирование текста; утверждение итогового варианта текста рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Zhihong Y, Chen W, Qianqian Z, et al. Emerging roles of oxyntomodulin-based glucagon-like peptide-1/glucagon co-agonist analogs in diabetes and obesity. Peptides. 2023;162:170955. doi: https://doi.org/10.1016/j.peptides.2023.170955
2. Chen X, Maldonado E, DeFronzo RA, Tripathy D. Impaired Suppression of Glucagon in Obese Subjects Parallels Decline in Insulin Sensitivity and Beta-Cell Function. J Clin Endocrinol Metab. 2021;106(5):1398-1409. doi: https://doi.org/10.1210/clinem/dgab019
3. Шестакова Е.А., Ильин А.В., Шестакова М.В., Дедов И.И. Секреция гормонов инкретинового ряда у лиц с факторами риска развития сахарного диабета 2-го типа // Терапевтический архив. — 2014. — № 10. — С. 10-14.
4. Zheng Z, Zong Y, Ma Y, et al. Glucagon-like peptide-1 receptor: mechanisms and advances in therapy. Signal Transduct Target Ther. 2024;9(1):234. doi: https://doi.org/10.1038/s41392-024-01931-z
5. Ершова Е.В., Трошина Е.А. Применение бариатрических операций при сахарном диабете 2 типа: в помощь практическому врачу // Ожирение и метаболизм. — 2016. — Т. 13. — №1. С. 50-56. doi: https://doi.org/10.14341/omet2016150-56
6. DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 1979;237(3):E214-E223. doi: https://doi.org/10.1152/ajpendo.1979.237.3.E214
7. Pickford P, Lucey M, Rujan RM, et al. Partial agonism improves the anti-hyperglycaemic efficacy of an oxyntomodulin-derived GLP-1R/GCGR co-agonist. Mol Metab. 2021;51:101242. doi: https://doi.org/10.1016/j.molmet.2021.101242
8. Look AHEAD Research Group. Eight-year weight losses with an intensive lifestyle intervention: the look AHEAD study. Obesity (Silver Spring). 2014;22(1):5-13. doi: https://doi.org/10.1002/oby.20662
9. Anton SD, Han H, York E, Martin CK, Ravussin E, Williamson DA. Effect of calorie restriction on subjective ratings of appetite. J Hum Nutr Diet. 2009;22(2):141-147. doi: https://doi.org/10.1111/j.1365-277X.2008.00943.x
10. Sumithran P, Prendergast LA, Delbridge E, et al. Long-term persistence of hormonal adaptations to weight loss. N Engl J Med. 2011;365(17):1597-1604. doi: https://doi.org/10.1056/NEJMoa1105816
11. Wynne K, Park AJ, Small CJ, et al. Subcutaneous oxyntomodulin reduces body weight in overweight and obese subjects: a double-blind, randomized, controlled trial. Diabetes. 2005;54(8):2390-2395. doi: https://doi.org/10.2337/diabetes.54.8.2390
12. Wynne K, Park AJ, Small CJ, et al. Oxyntomodulin increases energy expenditure in addition to decreasing energy intake in overweight and obese humans: a randomised controlled trial. Int J Obes (Lond). 2006;30(12):1729-1736. doi: https://doi.org/10.1038/sj.ijo.0803344
13. Alba M, Yee J, Frustaci ME, Samtani MN, Fleck P. Efficacy and safety of glucagon-like peptide-1/glucagon receptor co-agonist JNJ-64565111 in individuals with obesity without type 2 diabetes mellitus: A randomized dose-ranging study. Clin Obes. 2021;11(2):e12432. doi: https://doi.org/10.1111/cob.12432
14. Alba M, Yee J, Frustaci ME, et al. Efficacy and safety of glucagon-like peptide-1/glucagon receptor co-agonist JNJ-64565111 in individuals with obesity without type 2 diabetes mellitus: A randomized dose-ranging study. Clin Obes. 2021;11(2):e12432. doi: https://doi.org/10.1111/cob.12432
15. Winther JB, Holst JJ. Glucagon agonism in the treatment of metabolic diseases including type 2 diabetes mellitus and obesity. Diabetes Obes Metab. 2024;26(9):3501-3512. doi: https://doi.org/10.1111/dom.15693
16. Alexiadou K, Cuenco J, Howard J, et al. Proglucagon peptide secretion profiles in type 2 diabetes before and after bariatric surgery: 1-year prospective study. BMJ Open Diabetes Res Care. 2020;8(1):e001076. doi: https://doi.org/10.1136/bmjdrc-2019-001076
17. Lafferty RA, O’Harte FPM, Irwin N, Gault VA, Flatt PR. Proglucagon-Derived Peptides as Therapeutics. Front Endocrinol (Lausanne). 2021;12:689678. Published 2021 May 18. doi: https://doi.org/10.3389/fendo.2021.689678
Об авторах
Е. А. ШестаковаРоссия
Шестакова Екатерина Алексеевна - д.м.н., профессор, г.н.с.
117036, Москва, улица Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. О. Томилова
Россия
Томилова (Гаврилова) Алина Олеговна – аспирант.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. Д. Самсонова
Россия
Cамсонова Маргарита Денисовна – аспирант.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. А. Вознесенская
Россия
Вознесенская Анастасия Александровна – аспирант.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. С. Синеокая
Россия
Синеокая Мария Сергеевна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ю. С. Стафеев
Россия
Стафеев Юрий Сергеевич - к.б.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. В. Шестакова
Россия
Шестакова Марина Владимировна - д.м.н., профессор, академик РАН.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Динамика гликированного гемоглобина (исходно, через 3 и 6 месяцев после бариатрической операции) у пациентов с ожирением без нарушений углеводного обмена (группа 1) и у пациентов с ожирением и исходным сахарным диабетом 2 типа (группа 2). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(147KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Динамика секреции глюкагона и глюкагоноподобного пептида-1 в ходе глюкозотолерантного теста у пациентов без нарушений углеводного обмена. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(531KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Динамика секреции глюкагона и глюкагоноподобного пептида-1 в ходе теста со смешанной пищей у лиц с сахарным диабетом 2 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(492KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Динамика секреции оксинтомодулина в ходе теста с углеводной нагрузкой исходно, через 3 и 6 месяцев в группах пациентов с сахарным диабетом 2 типа и без него. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(540KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Динамика секреции оксинтомодулина (площадь под кривой) после бариатрической операции у пациентов с ожирением, как с сахарным диабетом 2 типа, так и без него. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(369KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Сравнение секреции оксинтомодулина в группах пациентов с сахарным диабетом 2 типа и без него, в зависимости от типа оперативного вмешательства. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(668KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шестакова Е.А., Томилова А.О., Самсонова М.Д., Вознесенская А.А., Синеокая М.С., Стафеев Ю.С., Шестакова М.В. Динамика секреции глюкагоноподобного пептида-1, глюкагона, а также коагониста ГПП-1/глюкагона оксинтомодулина у лиц с ожирением и сахарным диабетом 2 типа на фоне снижения массы тела после бариатрического вмешательства. Сахарный диабет. 2025;28(4):313-322. https://doi.org/10.14341/DM13267
For citation:
Shestakova E.A., Tomilova A.O., Samsonova M.D., Voznesenskaya A.A., Sineokaya M.S., Stafeev I.S., Shestakova M.V. Impact of weight loss on GLP-1, glucagon and oxyntomodulin secretion in patients with obesity and type 2 diabetes. Diabetes mellitus. 2025;28(4):313-322. (In Russ.) https://doi.org/10.14341/DM13267

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































