Перейти к:
Хирургические технологии удержания синусового ритма у больных сахарным диабетом, страдающих длительно персистирующей формой фибрилляции предсердий
https://doi.org/10.14341/DM13242
Аннотация
ОБОСНОВАНИЕ. Лечение больных сахарным диабетом (СД), страдающих длительно персистирующей формой фибрилляции предсердий (ФП), является нерешенной проблемой современного здравоохранения в связи с высоким риском инвалидизации и смертности. Учитывая низкую эффективность медикаментозного лечения ФП, в клиническую практику большинства стран внедрены хирургические технологии, эффективность применения которых у больных СД окончательно не изучена. Изолированное применение интервенционных хирургических технологий удержания синусового ритма при наличии СД, по данным различных авторов, ассоциировано с высокой частотой рецидивирования по сравнению с пациентами, не страдающими нарушениями углеводного обмена. Целесообразность применения таких хирургических методов, как торакоскопическая эпикардиальная абляция (Т-РЧА), изолировано или в сочетании с внутрисердечным вмешательством, для удержания синусового ритма у больных СД, страдающих ФП, в настоящее время не определена.
ЦЕЛЬ. Оценить эффективность и безопасность этапного хирургического лечения, направленного на длительное удержание синусового ритма, у больных с СД, страдающих ФП.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включено 19 пациентов в возрасте 53–73 лет, страдающих СД и длительно персистирующей формой ФП. Лиц женского пола было 4 (21,1%) человека, мужского — 15 (78,9%). С целью удержания синусового ритма всем пациентам проведено этапное хирургическое лечение: Т-РЧА с последующей эндокардиальной катетерной радиочастотной абляцией (РЧА) в области зон реконнекции левого предсердия (ЛП), которая выполнялась через 3 месяца после Т-РЧА, по окончанию «слепого периода» в случае клинически значимого рецидива предсердной тахикардии.
РЕЗУЛЬТАТЫ. По окончанию «слепого периода» синусовый ритм удерживался у 17 (89,5%) больных в течение всего периода наблюдения. Двум (10,5%) больным проведен второй, эндокардиальный, этап хирургического лечения: РЧА зон реконнекции в ЛП. На фоне длительного удержания синусового ритма после Т-РЧА наблюдалось значительное уменьшение индекса объема ЛП (p=0,013) и снижение концентрации предшественника мозгового натрийуретического пептида (p=0,014). Неблагоприятные события в периоперационном и отдаленном периодах не зарегистрированы.
ЗАКЛЮЧЕНИЕ. Этапный подход к хирургическому удержанию синусового ритма у больных с СД, страдающих персистирующей формой ФП, по данным нашего пилотного исследования, может рассматриваться как рациональная стратегия. Выполнение второго, эндокардиального, этапа лечения у данной категории пациентов целесообразно в случае рецидива предсердных тахисистолических нарушений ритма сердца.
Ключевые слова
Для цитирования:
Хамнагадаев И.А., Зотов А.С., Шелест О.О., Булавина И.А., Глупак А.А., Зотова З.А., Сахаров Э.Р., Бондаренко И.З., Шацкая О.А., Хабазов Р.И., Троицкий А.В., Мокрышева Н.Г. Хирургические технологии удержания синусового ритма у больных сахарным диабетом, страдающих длительно персистирующей формой фибрилляции предсердий. Сахарный диабет. 2024;27(6):572-579. https://doi.org/10.14341/DM13242
For citation:
Khamnagadaev I.A., Zotov A.S., Shelest O.O., Bulavina I.A., Glupak A.A., Zotova Z.A., Sakharov E.R., Bondarenko I.Z., Shatskaya O.A., Habazov R.I., Troitsky A.V., Mokrysheva N.G. Surgical approaches to maintaining sinus rhythm in patients with type 2 diabetes and long-term persistent atrial fibrillation. Diabetes mellitus. 2024;27(6):572-579. (In Russ.) https://doi.org/10.14341/DM13242
ОБОСНОВАНИЕ
Фибрилляция предсердий (ФП) в настоящее время является одной из самых распространенных аритмий, которая диагностируется у 0,4% населения земного шара и ассоциирована с высоким риском инвалидизации и смертности [1]. В течение каждого года риск развития кардиогенных тромбоэмболий при ФП составляет 4,2%, а летальность, по расчетным данным, может достигать 12,3 человека на 100 000 населения. Ежегодные затраты, ассоциированные с ФП в Российской Федерации, достигают 135 миллиардов рублей [2]. Развитие данной аритмии у больных сахарным диабетом (СД) c тенденцией к длительно персистирующему течению утяжеляет состояние пациента, внося значительный вклад в коморбидность, а также повышает риск сердечно-сосудистой смертности на 25–66% [3]. К данной категории пациентов относятся больные, страдающие ФП более года при условии выбора стратегии «контроля ритма» [4]. Учитывая низкую эффективность медикаментозного лечения ФП, в клиническую практику большинства стран внедрены хирургические технологии, эффективность применения которых у больных СД не валидизирована [5].
Хирургическое лечение, направленное на контроль ритма при ФП, в настоящее время представлено технологиями, которые можно разделить на:
- интервенционные (катетерные) вмешательства;
- торакоскопические технологии;
- операции на открытом сердце.
Возможна комбинация данных технологий. Например, торакоскопическая процедура, которая дополняется катетерной эндокардиальной абляцией [6][7][8]. В последнем случае процедуру считают гибридной или этапной.
Гибридная — выполняется одномоментно с торакоскопическим вмешательством или спустя 3–6 месяцев после торакоскопической процедуры вне зависимости от наличия предсердных нарушений ритма сердца.
Этапная — выполняется спустя три месяца после торакоскопической процедуры в случае рецидива заболевания.
Изолированное интервенционное лечение больных ФП при наличии СД, по данным различных авторов, ассоциировано с высокой частотой рецидивирования по сравнению с пациентами, не страдающими нарушениями углеводного обмена. Целесообразность применения других хирургических подходов для лечения ФП у больных СД в настоящее время не определена [8].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить эффективность и безопасность этапного хирургического подхода к длительному удержанию синусового ритма у больных с СД, страдающих ФП.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения:
- ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава РФ,
- ФНКЦ специализированных видов медицинской помощи и медицинских технологий ФМБА России.
Время исследования: 2021–2024 гг.
Критерии включения
Критерии включения в исследование: СД 1 типа или СД 2 типа (СД1 или СД2) при наличии длительно персистирующей формы ФП, в случае выбора стратегии длительного удержания синусового ритма при помощи нефармакологических подходов.
Критерии исключения
Критерии исключения из исследования: выбор стратегии «контроль частоты» при постоянной форме ФП; тяжелая экстракардиальная патология; тромбоз полостей сердца; врожденные и приобретенные пороки сердца; миокардиты, дилятационная, гипертрофическая и рестриктивная кардиомиопатии; ранее перенесенные операции на открытом сердце, наличие противопоказаний к введению рентгенконтрастных средств, некомпенсированная патология щитовидных и околощитовидных желез.
Дизайн исследования
Двухцентровое пилотное исследование, выполненное на основании договора о научно-практическом сотрудничестве.
Условия проведения
Хирургическое лечение выполнялось по методике, опубликованной ранее Зотовым А.С. и соавт., и включало два этапа [7]:
- первый этап выполнялся в ФНКЦ ФМБА России — проводилась торакоскопическая биполярная орошаемая абляция (Т-РЧА) левого предсердия (ЛП);
- второй этап выполнялся в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава РФ и заключался в проведении внутрисердечного электрофизиологического исследования (ЭФИ) с эндокардиальной радиочастотной абляцией (РЧА) зон реконнекции.
В настоящее пилотное исследование включено 19 человек (чел.) с СД2 и СД1 в возрасте 53–73 лет. Медиана возраста составила 62 года, нижний квартиль — 57,5 года, верхний квартиль — 66 лиц: лица женского пола — 21,1% (4 из 19) пациентов; лица мужского пола — 78,9% (15 из 19) пациентов.
При оценке отдаленных результатов у 19 (100,0%) пациентов оценивалась:
- частота развития рецидива ФП по данным 24-часовой регистрации электрокардиограммы;
- изменение структурных характеристик миокарда: объем ЛП, в том числе индексированный к площади поверхности тела (ИОЛП);
- течение хронической сердечной недостаточности (ХСН): фракция выброса левого желудочка (ФВЛЖ); предшественник мозгового натрийуретического пептида (NT-proBNP);
- неблагоприятные события.
Клиническая характеристика больных с СД, страдающих ФП, представлена в табл. 1.
Таблица 1. Клиническая характеристика пациентов
Количество пациентов с АГ, n (%) | 15 (78,9) |
Количество пациентов с ХБП, n (%) | 3 (15,8) |
Количество пациентов с гемодинамически незначимым атеросклерозом КА, n (%) | 10 (52,6) |
Количество пациентов после стентирования КА, n (%) | 1 (5,3) |
Длительность ФП (мес), Min-Max: Me [ Q1; Q3] | 12–240: 48 [ 24; 72] |
Длительность СД (годы), Min-Max: Me [ Q1; Q3] | 1–24: 7 [ 4,5; 11,5] |
Количество пациентов с СД2 и СД1 (/) | 18/1 |
НbА1с (%), Min–Max: Me [ Q1; Q3] | 6,2–8,6: 7,3 [ 6,4–8,1] |
Структура сахароснижающей терапии | |
Инсулин, n (%) | 1 (5,3) |
Пероральная, n (%) | 14 (73,7) |
Комбинированная, n (%) | 0 (0,0) |
Диета, n (%) | 4 (21,0) |
Примечание. АГ — артериальная гипертензия; ХБП — хроническая болезнь почек; КА — коронарные артерии; ФП — фибрилляция предсердий; СД — сахарный диабет; Min-Max — минимальное-максимальное значение; Me — медиана; Q1 — первый (нижний) квартиль; Q3 — третий (верхний) квартиль; НbА1с — гликированный гемоглобин; n — количество пациентов.
Статистическая обработка
Статистическая обработка выполнялась при помощи программы SPSS Statistics 26.0.0.0 (IBM Inc., США). Количественные признаки представлены в виде Min–Max (Me, IQR), где Min — минимальное значение, Max — максимальное значение; Ме — медиана, IQR — межквартильный интервал (1-й и 3-й квартили). При описании возраста пациентов Me и IQR округлялись до целого значения. При описании других непрерывных признаков Me и IQR округлялись до одного знака после запятой включительно. При описании процентных величин значение округлялось до одного знака после запятой включительно. Расчет статистической значимости различий непрерывных признаков проводился по методу Уилкоксона. При проверке статистических гипотез принимался 5% уровень значимости.
Этическая экспертиза
Статья рассмотрена на заседании локально-этического комитета ФГБУ «НМИЦ эндокринологии» Минздрава России, была одобрена (Протокол №18 от 08.09.2021).
РЕЗУЛЬТАТЫ
Период наблюдения составил 4–52: 19 [ 8; 31] месяцев. Длительное удержание синусового ритма за период наблюдения было отмечено у 17 (89,5%) больных: 15 (78,9%) пациентов — на фоне отмены антиаритмической терапии (ААТ); 2 (10,5%) пациента — на фоне продолжения ААТ. В последних двух случаях ААТ была продолжена с учетом выбора пациента. В связи с развитием клинически значимых устойчивых пароксизмов предсердных постинцизионных тахиаритмий двум (10,5%) больным проведен второй, эндокардиальный, этап хирургического лечения с катетерной РЧА зон реконнекции в ЛП. При изучении динамики показателей, характеризующих недостаточность кровообращения, выявлены статистически значимые различия по уровню NT-proBNP (p=0,014). Медиана концентрации NT-proBNP до оперативного лечения составила 691,1 [ 177,2; 969,0] пг/мл, после операции на фоне удержания синусового ритма в течение 12 месяцев — 346,4 [ 205; 632,3] пг/мл. В отдаленном периоде отмечено обратное ремоделирование миокарда: значимое снижение ИОЛП (p=0,013). Статистически значимых различий по ФВЛЖ (p=0,07) до и после проведенного лечения не выявлено (табл. 2). В 89,5% (17 из 19 чел.) случаев хирургическое лечение ограничилось торакоскопической процедурой. У 10,5% (2 из 19 чел.) больных было выполнено гибридное лечение ФП: через три месяца после Т-РЧА проведено внутрисердечное ЭФИ с устранением зон реконнекции в ЛП при помощи эндокардиальной РЧА. На рис. 1 и 2 показаны этапы хирургического лечения, направленного на удержание синусового ритма у больных СД, страдающих ФП.
Таблица 2. Длительное удержание синусового ритма после хирургического лечения больных с сахарным диабетом, страдающих фибрилляцией предсердий: обратное ремоделирование миокарда и регресс хронической сердечной недостаточности
Характеристика | Предоперационные данные | Послеоперационные данные | p |
Индексированный объем ЛП (мл/м²), Min-Max: Me [ Q1; Q3] | 26,0–67,7: | 18,7–58,7: | 0,013 |
Давление в ЛА (мм рт.ст.), Min-Max: Me [ Q1; Q3] | 21,0–46,0: | 20,0–48,0: | 0,85 |
ФВЛЖ (%), | 50,0–69,0: | 55,0–64,0: | 0,07 |
NTproBNP (пг/мл), | 30,3–2400,0: | 59,8–790,0: | 0,014 |
Примечание. ЛА — легочная артерия; ЛП — левое предсердие; ФВЛЖ — фракция выброса левого желудочка, NTproBNP — предшественник мозгового натрийуретического пептида; p — вероятность ошибочно отвергнуть нулевую гипотезу об отсутствии различий.
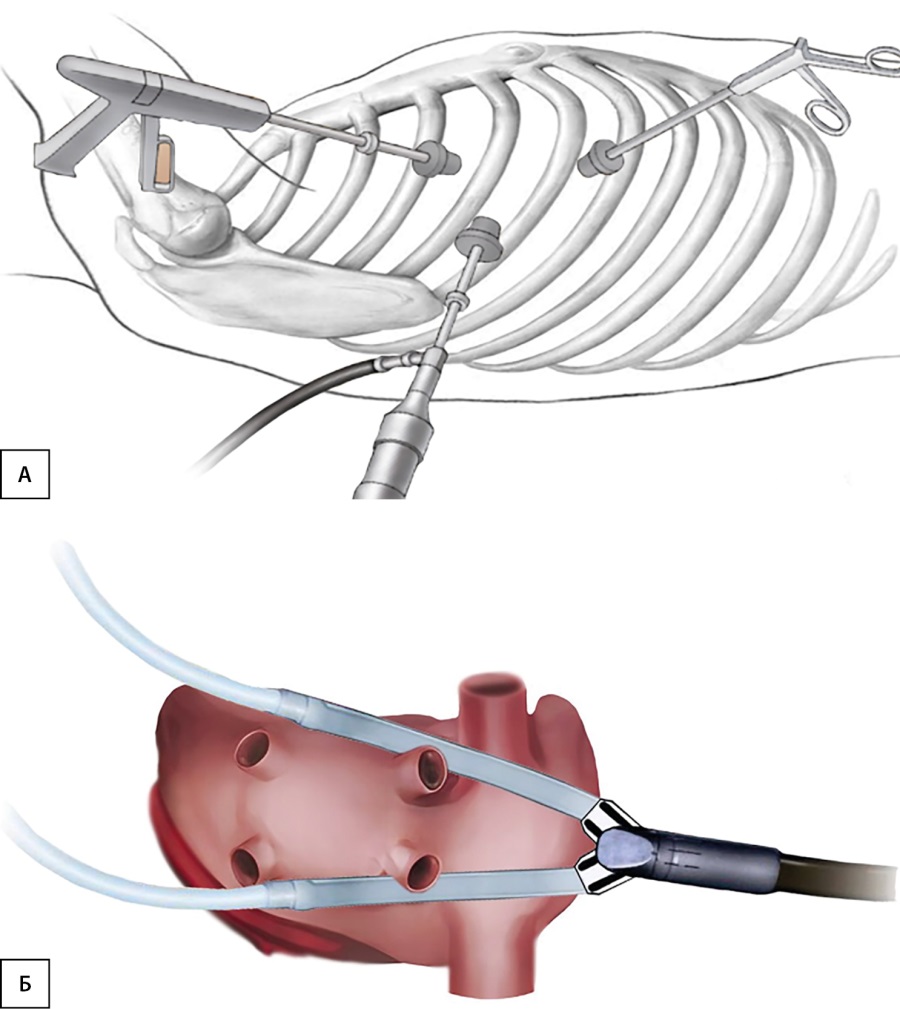
Рисунок 1. Торакоскопическая биполярная орошаемая абляция левого предсердия: А — позиция торакоскопических портов относительно межреберных промежутков; Б — абляционное устройство позиционировано в перикарде в области левого предсердия со стороны правой плевральной полости.
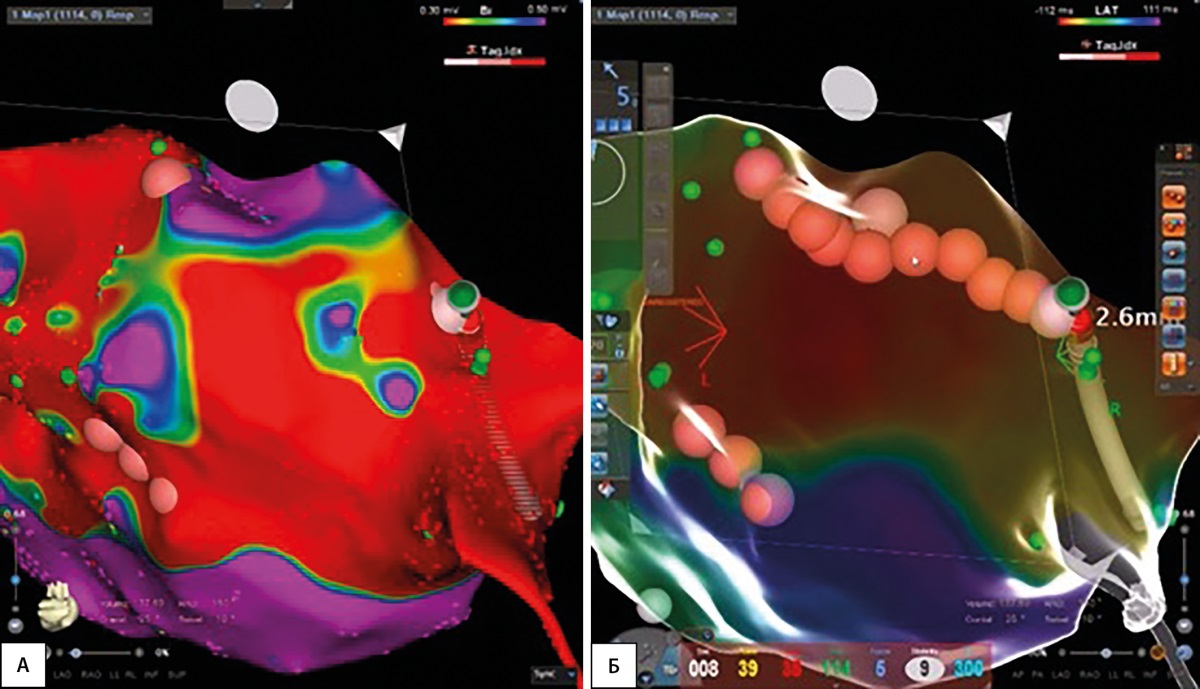
Рисунок 2. Внутрисердечное электрофизиологическое исследование и эндокардиальная радиочастотная абляция у больного после торакоскопической радиочастотной биполярной орошаемой радиочастотной абляции: левое предсердие, вид сзади.
А — биполярное картирование левого предсердия: красный цвет — амплитуда эндокардиального сигнала менее 0,3 мВ, фиолетовый цвет — более 0,5 мВ (зоны реконнекции левого предсердия);
Б — выявленные зоны реконнекции левого предсердия после торакоскопической биполярной орошаемой абляции устранены методом эндокардиальной радиочастотной абляции (область воздействия отмечена фиолетовыми шарами).
Неблагоприятные события, включающие нарушения мозгового кровообращения или транзиторные ишемические атаки, в отдаленном периоде не зарегистрированы. В двух случаях (10,5%) потребовалась повторная госпитализация в связи с декомпенсацией ХСН. Не было ни одного случая смерти, связанного с сердечно-сосудистыми событиями.
ОБСУЖДЕНИЕ
Несмотря на относительный успех и удовлетворительный профиль безопасности Т-РЧА, данная хирургическая процедура имеет ряд ограничений: отсутствие возможности абляции зоны митрального истмуса, необходимых участков циркуляции волн «macro re-entry» правого предсердия. У пациентов с развитой эпикардиальной клетчаткой зачастую невозможно добиться полноценной замкнутой абляционной линии, что приводит к формированию зон «реконнекции» [8]. В свою очередь данные участки с восстановленным электрическим проведением в ЛП могут быть не только причиной рецидива ФП, но и формирования атипичного трепетания предсердий, оказывающего более значимое влияние на центральную гемодинамику по сравнению с ФП. Кроме прочего, ни один протокол Т-РЧА не включает воздействий в области кавотрикуспидального истмуса [8]. В связи с этим в настоящее время в клинических рекомендациях, наряду с Т-РЧА, предусмотрена возможность проведения так называемого гибридного лечения ФП. В данном случае торакоскопическая процедура дополняется интервенционным, катетерным, вмешательством [1][4].
Вместе с тем остается неизученным вопрос о времени между Т-РЧА и эндокардиальной РЧА. Возможно выполнение данных процедур во время одного вмешательства. При этом для эпикардиального этапа существует возможность использовать инструмент Episense (процедура Convergent) или выполнить эпикардиальный протокол торакоскопическими инструментами, завершая процедуру катетерным вмешательством в зоне митрального истмуса, абляцией зоны кавотрикуспидального истмуса и дополнительной изоляцией легочных вен [9].
Такой подход приводит к снижению прямых затрат лечения. Однако во время выполнения одной процедуры могут возникнуть ложные результаты из-за отека тканей, что затрудняет поиск зон реконнекции после Т-РЧА [10][11].
Альтернативный подход заключается в выполнении эндокардиальной РЧА в интервале 3–6 месяцев после Т-РЧА [12].
Наконец возможен третий вариант: этапное лечение. Применение этапного подхода к лечению непароксизмальных форм ФП у больных СД, как показано в нашем исследовании, минимизирует травматичность вмешательства, поскольку эндокардиальный этап операции выполняется в случае рецидива заболевания. При этом показано, что такой подход, наряду с минимизацией уровня хирургической агрессии, обеспечивает эффективное длительное удержание синусового ритма.
Выбор той или иной стратегии в настоящее время не регламентирован клиническими рекомендациями и обусловлен сложившейся практикой в медицинской организации. Эффективность этапного лечения, направленного на длительное удержание синусового ритма у больных с СД, страдающих ФП, может быть обусловлена тем, что ключевым механизмом ФП у данной категории больных может являться роторная активность в области задней стенки ЛП [13].
Следует отметить, что взаимосвязь СД и ФП — многофакторная, включает такие механизмы, как окислительный стресс и системное воспаление, развитие дисфункции митохондрий, глюкозотоксичность и гипогликемические состояния, вариабельность гликемии в течение суток, которые ведут к структурному, механическому и электрическому ремоделированию ЛП с формированием субстрата аритмии (рис. 3) [9].
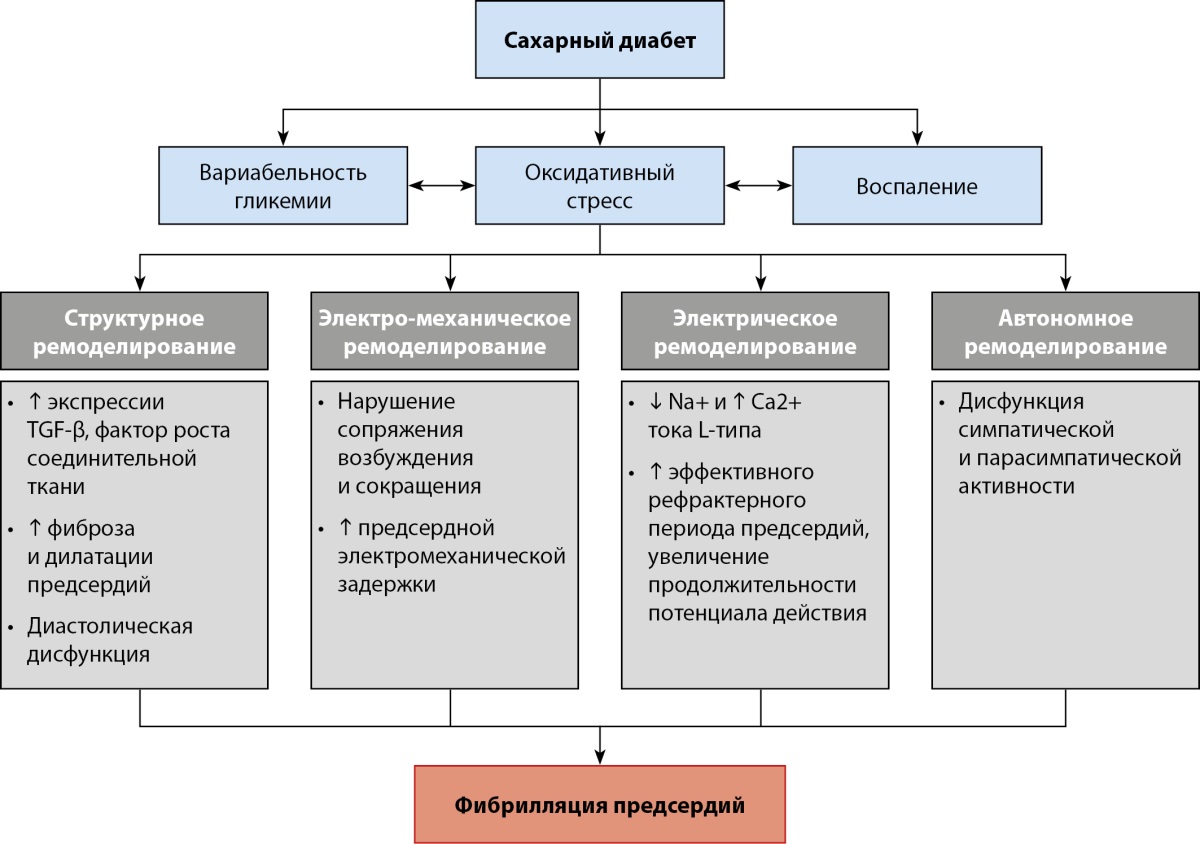
Рисунок 3. Патофизиологические механизмы развития фибрилляции предсердий при сахарном диабете.
Следует отметить, что для больных СД наиболее характерно персистирующее течение заболевания [14].
Повышение уровня HbA1c на 1% сопровождается повышением риска ФП на 13% [9][15]. Кроме того, более высокие уровни HbA1c связаны с более высокой частотой рецидивов ФП после эндокардиальной РЧА (табл. 1) [9].
Наличие ФП у больных СД существенно повышает риски летального исхода вследствие тромбоэмболических осложнений [9], но ведущей причиной смертности является ХСН. При этом существующие подходы к лечению больных с ФП не учитывают наличие нарушений углеводного обмена [3][16].
В ранее проведенных исследованиях показана высокая эффективность гибридного хирургического лечения по сравнению с этапным подходом [17][18]. Однако данная стратегия не была валидизирована для больных с СД. В нашем пилотном исследовании объектом исследования были пациенты, страдающие СД и ФП. Была показана высокая эффективность длительного удержания синусового ритма при выполнении изолированной Т-РЧА, что, по мнению авторов настоящей работы, обусловлено, высокой эффективностью изоляции задней стенки ЛП при выполнении Т-РЧА, что позволяет воздействовать на ключевой механизм патогенеза ФП у больных СД.
ЗАКЛЮЧЕНИЕ
Этапное хирургическое лечение, направленное на удержание синусового ритма у больных с СД, страдающих персистирующей формой ФП, по данным нашего пилотного исследования, может рассматриваться как рациональная стратегия. Выполнение второго, эндокардиального, этапа лечения у данной категории пациентов следует выполнять в случае рецидива тахисистолических нарушений ритма сердца.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Государственное задание НИР № 123021000043-0, 2023-2025 гг.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи.
Участие авторов. Хамнагадаев И.А., Зотов А.С. — руководство лечением пациентов, участие в операционном процессе, написание текста статьи; Бондаренко И.З., Глупак А.А., Сахаров Э.Р., Зотова З.А. — статистическая обработка и обсуждение результатов исследования, написание текста статьи; Булавина И.А., Шацкая О.А., Шелест О.О. — написание текста статьи, поисково-аналитическая работа; Хабазов Р.И., Троицкий А.В., Мокрышева Н.Г. — руководство лечением пациентов, обсуждение результатов исследования.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Van Gelder IC, Rienstra M, Bunting KV, et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2024;45(36):3314-3414. https://doi.org/10.1093/eurheartj/ehae176
2. Колбин А.С., Мосикян А.А., Татарский Б.А. Социально-экономическое бремя фибрилляции предсердий в России: динамика за 7 лет (2010-2017 годы) // Вестник аритмологии. — 2018. — № 92. — С. ٤٢–٤٨.
3. PhD LGMP. Association of Atrial Fibrillation with Diabetes Mellitus, High Risk Comorbidities. Maedica (Bucur). 2022;17(1):143–152. https://doi.org/10.26574/maedica.2022.17.1.143
4. Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю., и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020 // Российский кардиологический журнал. — 2021. — №7. — С.4594 [https://doi.org/10.15829/1560-4071-2021-4594
5. Голухова Е.З., Милиевская Е.Б., Филатов А.Г., и др. Аритмология — 2022. Нарушения ритма сердца и проводимости. — Москва: Национальный научно–практический центр сердечно-сосудистой хирургии им. А.Н. Бакулева, ٢٠٢٣. — 148 с.
6. Сапельников О.В., Николаева О.А., Ардус Д.Ф., и др. Одномоментное гибридное лечение персистирующей формы фибрилляции предсердий // Кардиология и сердечно-сосудистая хирургия. — 2018. — Т. 11. — №6. — С. 83–86 https://doi.org/10.17116/kardio20181106183
7. Зотов А.С., Хамнагадаев И.А., Сахаров Э.Р. и др. Первый опыт применения гибридного подхода при хирургическом лечении фибрилляции предсердий // Клиническая практика. — 2022. — Т. 13. — №4. — С. 38–50 https://doi.org/10.17816/clinpract116052
8. Ревишвили А.Ш., Артюхина Е.А., Стребкова Е.Д. и др. Эволюция торакоскопического лечения фибрилляции предсердий: от становления до современного этапа // Комплексные проблемы сердечно-сосудистых заболеваний. — 2023. — Т. 12. — №2. — С. 107–121 https://doi.org/10.17802/2306-1278-2023-12-2-107-121
9. Wats K, Kiser A, Makati K, et al. The Convergent Atrial Fibrillation Ablation Procedure: Evolution of a Multidisciplinary Approach to Atrial Fibrillation Management. Arrhythmia Electrophysiol Rev. 2020;9(2):88-96. https://doi.org/10.15420/aer.2019.20
10. Vroomen M, Maesen B, Luermans JL, et al. Epicardial and Endocardial Validation of Conduction Block After Thoracoscopic Epicardial Ablation of Atrial Fibrillation. Innovations (Phila). 2020;15(6):525-531. https://doi.org/10.1177/1556984520956314
11. Gottlieb LA, Dekker LRC, Coronel R. The Blinding Period Following Ablation Therapy for Atrial Fibrillation. JACC Clin Electrophysiol. 2021;7(3):416-430. https://doi.org/10.1016/j.jacep.2021.01.011
12. Harlaar N, Oudeman MA, Trines SA, et al. Long-term follow- up of thoracoscopic ablation in long-standing persistent atrial fibrillation. Interact Cardiovasc Thorac Surg. 2022;34(6):990–998. https://doi.org/10.1093/icvts/ivab355
13. Wang A, Green JB, Halperin JL, Piccini JP Sr. Atrial Fibrillation and Diabetes Mellitus: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;74(8):1107–1115. https://doi.org/10.1016/j.jacc.2019.07.020
14. Онучина Е.Л., Соловьев О.В., Чапурных А.В., Мочалова О.В., Онучин С.Г., Ефремов Д.Н. Нарушения ритма сердца у пациентов с сахарным диабетом 2 типа // Сахарный диабет. — 2008. — Т. 11. — №1. — С. 25-27. https://doi.org/10.14341/2072-0351-5940
15. Gherasim L. Association of Atrial Fibrillation with Diabetes Mellitus, High Risk Comorbidities. Maedica (Bucur). 2022;17(1):143-152. https://doi.org/10.26574/maedica.2022.17.1.143
16. Sun DK, Zhang N, Liu Y, et al. Dysglycemia and arrhythmias. World J Diabetes. 2023;14(8):1163–1177. https://doi.org/10.4239/wjd.v14.i8.1163
17. Артюхина Е.А., Таймасова И.А., Ревишвили А.Ш.. Катетерная аблация предсердных аритмий у пациентов после торакоскопической аблации персистирующих форм фибрилляции предсердий. Российский кардиологический журнал. — 2020. — Т. 25.— №7. — С. 28–33 [https://doi.org/10.15829/1560-4071-2020-3655
18. Хамнагадаев И.А., Токарев А.Р., Тюрин Н.И. Эндоваскулярное лечение нарушений ритма сердца // Эндоваскулярная хирургия — технологии и практика / ред. Л. С. Коков, Н. В. Боломатов. — Москва: РАН, 2021. — С. 290–311.
Об авторах
И. А. ХамнагадаевРоссия
Хамнагадаев Игорь Алексеевич - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
А. С. Зотов
Россия
Зотов Александр Сергеевич - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
О. О. Шелест
Россия
Шелест Олег Олегович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
И. А. Булавина
Россия
Булавина Ирина Андреевна
Москва, ул. Бакинская, д. 26
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
А. А. Глупак
Россия
Глупак Александр Александрович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
З. А. Зотова
Россия
Зотова Злата Александровна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
Э. Р. Сахаров
Россия
Сахаров Эмиль Романович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
И. З. Бондаренко
Россия
Бондаренко Ирина Зиятовна - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
О. А. Шацкая
Россия
Шацкая Ольга Александровна - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
Р. И. Хабазов
Россия
Хабазов Роберт Иосифович - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
А. В. Троицкий
Россия
Троицкий Александр Витальевич -д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна - д.м.н., профессор, чл.-корр. РАН.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией статьи
Дополнительные файлы
|
|
1. Рисунок 1. Торакоскопическая биполярная орошаемая абляция левого предсердия: А — позиция торакоскопических портов относительно межреберных промежутков; Б — абляционное устройство позиционировано в перикарде в области левого предсердия со стороны правой плевральной полости. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(525KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Внутрисердечное электрофизиологическое исследование и эндокардиальная радиочастотная абляция у больного после торакоскопической радиочастотной биполярной орошаемой радиочастотной абляции: левое предсердие, вид сзади. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(888KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Патофизиологические механизмы развития фибрилляции предсердий при сахарном диабете. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(601KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Хамнагадаев И.А., Зотов А.С., Шелест О.О., Булавина И.А., Глупак А.А., Зотова З.А., Сахаров Э.Р., Бондаренко И.З., Шацкая О.А., Хабазов Р.И., Троицкий А.В., Мокрышева Н.Г. Хирургические технологии удержания синусового ритма у больных сахарным диабетом, страдающих длительно персистирующей формой фибрилляции предсердий. Сахарный диабет. 2024;27(6):572-579. https://doi.org/10.14341/DM13242
For citation:
Khamnagadaev I.A., Zotov A.S., Shelest O.O., Bulavina I.A., Glupak A.A., Zotova Z.A., Sakharov E.R., Bondarenko I.Z., Shatskaya O.A., Habazov R.I., Troitsky A.V., Mokrysheva N.G. Surgical approaches to maintaining sinus rhythm in patients with type 2 diabetes and long-term persistent atrial fibrillation. Diabetes mellitus. 2024;27(6):572-579. (In Russ.) https://doi.org/10.14341/DM13242
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































