Перейти к:
Оценка эффективности и безопасности фиксированной комбинации алоглиптина и пиоглитазона в реальной клинической практике: результаты исследования PROsperity
https://doi.org/10.14341/DM13238
Аннотация
ЦЕЛЬ. Оценить терапевтическую эффективность и безопасность применения новой фиксированной комбинации алоглиптина с пиоглитазоном у пациентов с сахарным диабетом 2 типа (СД2) в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено многоцентровое наблюдательное неинтервенционное проспективное исследование единственного препарата — фиксированной комбинации алоглиптина и пиоглитазона на территории Российской Федерации (РФ) (коммерческое название «Инкресинк») в дозировках 25 мг+15 мг и 25 мг+30 мг соответственно (PROsperity). Включено 1999 пациентов с СД2 в возрасте 18 лет и старше, наблюдавшихся в течение 6 мес в 52 исследовательских центрах РФ с впервые диагностированным СД2 или не достигших целевых показателей гликемии на предшествующей терапии. Исходно, через 3 и 6 мес от начала терапии Инкресинком, регистрировались уровень гликированного гемоглобина (HbA1c), гликемия натощак и после приема пищи, а также широкая панель кардио-рено-метаболических показателей, сопутствующей терапии, индекса инсулинорезистентности (HOMA-IR) и антропометрических показателей (масса тела, окружность талии) на фоне терапии. В качестве первичной конечной точки выбраны изменение HbA1c через 3 и 6 мес терапии, доля пациентов, достигших индивидуальной цели по HbA1c через 6 мес терапии; вторичных конечных точек — динамика остальных показателей. Для сопутствующих гипогликемических препаратов фиксировались международные непатентованные наименования (МНН), торговое название, режим дозирования и длительность лечения.
РЕЗУЛЬТАТЫ. Длительность заболевания составила 68,4±62,0 мес. Среднее снижение уровня HbA1c через 6 мес составило –1,3% от исходного уровня 8,2% (p<0,001). В группе пациентов, стартовавших с дозы Инкресинка 25+30 мг, снижение HbA1c было более выраженным и составило –1,5% от исходного уровня 8,2% (p<0,001). Максимальное снижение HbA1c –2,8% зафиксировано в группе пациентов с исходным HbA1c >9,0% (n=300, 15% всей выборки). Целевых показателей HbA1c (<7,0%) достигли 70,2% всех пациентов и 80,1% пациентов, получавших Инкресинк 25мг+30 мг (n=915, 46% выборки). На фоне терапии Инкресинком в течение 6 мес зарегистрировано улучшение липидного спектра крови, снижение инсулинорезистентности, систолического артериального давления и массы тела. Применение Инкресинка характеризовалось благоприятным профилем безопасности: зарегистрировано 23 нежелательных явления (~1%), которые в основном относились к легким и неспецифическим и не потребовали прекращения терапии. После завершения исследования 94% пациентов остались на терапии Инкресинком, а 94% врачей оценили ее как «очень эффективную» или «эффективную».
ЗАКЛЮЧЕНИЕ. Результаты многоцентрового наблюдательного неинтервенционного исследования PROsperity подтверждают высокую эффективность и безопасность Инкресинка, позволяя рассматривать новую комбинацию как следующий шаг в лечении пациентов с СД2, не достигающих целевого уровня гликемического контроля на предшествующей терапии.
Ключевые слова
Для цитирования:
Шестакова М.В., Харахулах М.И., Белолипецкий Я.А. Оценка эффективности и безопасности фиксированной комбинации алоглиптина и пиоглитазона в реальной клинической практике: результаты исследования PROsperity. Сахарный диабет. 2025;28(2):198-209. https://doi.org/10.14341/DM13238
For citation:
Shestakova M.V., Kharakhulakh M.I., Belolipetsky Y.A. Assessment of the effectiveness and safety of fixed-dose combination of alogliptin and pioglitazone in real clinical practice: results of the PROsperity study. Diabetes mellitus. 2025;28(2):198-209. (In Russ.) https://doi.org/10.14341/DM13238
По данным за первую половину 2024 г., в Российской Федерации (РФ) заболеваемость сахарным диабетом 2 типа (СД2) превысила 3200 случаев на 100 тысяч населения, что составило примерно 4,8 млн человек [1]. Наибольшая распространенность заболевания наблюдается в возрасте 65–69 лет [2].
СД2 относится к неизлечимым прогрессирующим заболеваниям, поэтому выбор терапии определяет долгосрочный прогноз качества жизни пациентов. Согласно современным рекомендациям по терапии СД2, ориентиром правильно подобранной терапии служит достижение целевого уровня гликированного гемоглобина (НbA1c) [3].
Опасность СД2 связана с высоким риском развития микро- и макроваскулярных осложнений, что значимо ухудшает долгосрочные прогнозы пациентов [4–6]. Наиболее часто у пациентов с СД2 развиваются атеросклеротические изменения сосудов, приводящие к фатальным исходам [7]. Сопутствующие метаболические нарушения в виде ожирения, дислипидемии, инсулинорезистентности увеличивают риск сердечно-сосудистых событий [5][8].
Поэтому клинические рекомендации по лечению СД2 в качестве контрольных точек терапии включают целевые значения пре- и постпрандиального уровня глюкозы плазмы, показателей липидного обмена и артериального давления, достижение которых способствует снижению сердечно-сосудистого риска [9].
Тактика терапии СД2 предусматривает раннее назначение комбинации противодиабетических препаратов, если исходный показатель HbA1c превышает индивидуальный целевой уровень на 1,0–2,5% или отсутствует достижение целевого уровня НbA1c на монотерапии [9].
Несмотря на высокую эффективность сахароснижающих препаратов в клинических исследованиях, по данным реальной клинической практики, не более 50% пациентов достигают целевого уровня НbA1c менее 7,0% [2][9].
К рациональным относится комбинация ингибиторов дипептидилпептидазы-4 (иДПП-4) (алоглиптин) с представителями класса тиазолидиндионов (ТЗД), к которым относится пиоглитазон. Пиоглитазон, обладающий выраженным сахароснижающим действием, повышающий чувствительность к инсулину, и алоглиптин, повышающий постпрандиальную секрецию инсулина и ограничивающий секрецию глюкагона, взаимодополняют друг друга. Эта комбинация уже подтвердила свою эффективность в клинических исследованиях [10]. Такая комбинация обладает эффективным сахароснижающим действием, дополнительно снижая риск сердечно-сосудистых заболеваний [11]. Алоглиптин при совместном применении позволяет снизить дозу пиоглитазона до 30–15 мг, что обеспечивает безопасность терапии при сохранении высокой эффективности [12].
С учетом возможного расхождения показателей эффективности клинических исследований и реальной клинической практики оценка эффективности и переносимости новой фиксированной комбинации алоглиптина и пиоглитазона у пациентов с СД2 и нецелевым уровнем HbA1c в условиях российской практики представляет значительный интерес.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценка терапевтической эффективности и безопасности применения препарата Инкресинк (фиксированной комбинации алоглиптина с пиоглитазоном) у пациентов с СД2 в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
В 2022–2024 гг. на базе 52 российских медицинских центров проведено наблюдательное неинтервенционное проспективное исследование эффективности новой фиксированной комбинации ингибитора ДПП4 алоглиптина с единственным актуальным представителем класса тиазолидиндионов пиоглитазоном (препарат Инкресинк) у пациентов с СД2 в реальной клинической практике (PROsperity).
Изучаемая популяция
В исследовании приняли участие 1999 пациентов СД2, соответствующих критериям включения.
Основные критерии включения: возраст 18 лет и старше с впервые диагностированным СД2 или недостижение целевых показателей гликемии на предшествующей терапии.
Критерии невключения: при наличии в анамнезе СД 1 типа (СД1), хронической сердечной недостаточности (ХСН) I–IV как диагностированной, так и при наличии характерных клинических признаков и симптомов, тяжелой печеночной недостаточности (>9 баллов по шкале Чайлд-Пью), почечной недостаточности (расчетной скорости клубочковой фильтрации (рСКФ) <50 мл/мин/1,73 м²), кетоацидоза, макрогематурии, рака мочевого пузыря, индивидуальной непереносимости действующих компонентов препарата. Также в исследовании не могли принять участие пациенты, принимающие другие препараты инкретинового ряда (иДПП-4 или агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1)), женщины во время беременности или периода грудного вскармливания.
Описание медицинского вмешательства
Назначение препарата Инкресинк производилось врачом-исследователем в соответствии с инструкцией по применению и индивидуальными особенностями пациентов. Доза препарата Инкресинк 25+15 или 25+30 выбиралась на усмотрение лечащего врача.
Первичными конечными точками являлись следующие параметры:
- изменение уровня гликированного гемоглобина (HbA1c) у пациентов на фоне лечения препаратом Инкресинк через 3 и 6 мес терапии;
- оценка доли пациентов (%), достигших индивидуальной цели по HbA1c через 6 мес терапии, а также произведен анализ по подгруппам в зависимости от исходного уровня HbA1c: группа с исходным HbA1c<7,5%, группа с исходным HbA1c 7,5–9,0%, группа с исходным HbA1c>9,0%.
Вторичные конечные точки включали динамику показателей содержания глюкозы в плазме натощак (ГПН) и постпрандиальной гликемии (ППГ), определяемой двухчасовым глюкозотолерантным тестом с 75 г глюкозы (ПГТТ); долю пациентов, ответивших на терапию в виде снижения HbA1c≥0,3%; динамику показателей липидов в плазме крови; динамику индексов инсулинорезистентности HOMA-IR и функции β-клеток HOMA-β (формулы расчета: HOMA-IR = инсулин натощак (мкЕд/мл) * глюкоза натощак (ммоль/л) / 22,5. HOMA-B = (20 × инсулин натощак (мкЕд/мл)) / (глюкоза натощак (ммоль/л) — 3,5); динамику массы тела, индекса массы тела (ИМТ), окружности талии; уровня систолического (САД) и диастолического артериального давления (ДАД), частоты сердечных сокращений (ЧСС); динамику лабораторных показателей (рСКФ, величина альбуминурии) относительно исходных значений.
Наблюдение за пациентами продолжалось 6 мес, за это время проводилось три визита: включение (Визит 1), наблюдение через 3 мес от включения (Визит 2) и заключительный визит через 6 мес (Визит 3). Во время Визита 1 назначался препарат Инкресинк в рамках рутинной практики, в Визиты 2 и 3 проводилась оценка эффективности терапии, антропометрических показателей, уровня САД и ДАД, мониторинг нежелательных явлений (НЯ). Во время всех визитов собирались данные рутинного лабораторного обследования.
Проведена оценка безопасности препарата Инкресинк с учетом частоты и вида НЯ.
Оценка лечения препаратом Инкресинк исследователями
Во время последнего визита проводилась оценка удовлетворенности исследователей проводимой терапией (5-пунктная шкала Лайкерта). Предлагалось ответить на вопрос, как исследователь оценивает терапию Инкресинком: «очень хорошо», «хорошо», «нейтрально», «неудовлетворительно», «очень плохо».
В последний визит исследователи фиксировали, продолжает ли пациент прием препарата Инкресинк в текущей суточной дозе, планируется ли продолжение лечения препаратом после завершения исследования, занесены ли данные о проводимой терапии в «Базу данных клинико-эпидемиологического мониторинга СД на территории РФ».
Статистический анализ
Статистическая обработка непрерывных переменных включала показатели описательной статистики: средние значения (М) и средние квадратические отклонения (SD) для количественных признаков, имеющих нормальное распределение. В процессе статистической обработки данных применены методы описательной статистики, корреляционный анализ Спирмена, значимость изменений показателей оценивалась с помощью критерия Уилкоксона. Сравнение качественных показателей проводилось при помощи критерия Пирсона. Различия считались достоверными при р <0,05.
Категориальные переменные оценены с помощью частоты и процентов. Для переменных, обозначаемых как «бинарные», рассчитаны точные (Clopper-Pearson) 95% доверительные интервалы. Для категориальных переменных с более чем двумя категориями 95% доверительные интервалы рассчитаны с использованием метода Goodman.
При подготовке исследования планировалось рассчитывать результаты для популяции подлежащих включению пациентов, All Enrolled Set (AES), популяции всех включенных пациентов, Full Data Set (FAS) и популяция безопасности, Safety Population (SP). По окончании исследования популяции FAS и SP полностью совпали и составили 100% включенных участников.
Обработка данных проводилась с использованием программного обеспечения, предназначенного для статистического анализа данных: SAS 9.4 (SAS Institute Inc, Cary, NC) — финальный анализ и генерация таблиц и графиков и R 4.3.1 (R Core Team, R Foundation for Statistical Computing, Vienna, Austria) — подготовка данных, расчет дополнительных переменных, изменение формы наборов данных.
Специальных методов замещения пропущенных данных в процессе анализа не применялось.
Этическая экспертиза
Все пациенты подписали информированное согласие на участие в исследовании. Исследование одобрено на этических советах и в этических комитетах всех клинических центров, где проводилось исследование.
РЕЗУЛЬТАТЫ
Всего в исследовании приняли участие 1999 пациентов с СД2, из них 1084 человека принимали препарат Инкресинк в дозе 25+15 мг, 915 — в дозе 25+30 мг. В табл. 1 представлены основные исходные характеристики включенных пациентов.
Таблица 1. Исходные характеристики включенных пациентов
|
Показатели |
Инкресинк 25+15 мг (n=1084) |
Инкресинк 25+30 мг (n=915) |
Все пациенты (n=1999) |
|
Средний возраст, годы |
58,5±11,01 |
57,0±11,30 |
57,8±11,17 |
|
ИМТ, кг/м² |
32,2±5,39 |
32,6±5,27 |
32,4±5,34 |
|
Окружность талии, см |
99,5±15,1 |
101,7±15,08 |
100,5±15,08 |
|
Курильщики, n (%) |
109 (10,1) |
106 (11,6) |
215 (10,8) |
|
НbA1c, % |
8,1±0,97 |
8,2±1,33 |
8,2±1,15 |
|
ГПН, ммоль/л |
8,5±1,68 |
8,7±2,12 |
8,6±1,90 |
|
ППГ, ммоль/л |
10,4±1,84 |
10,4±2,41 |
10,4±2,13 |
|
HOMA-β |
88,5±95,24 |
94,7±47,12 |
91,5±75,80 |
|
HOMA-IR |
5,9±3,40 |
7,3±3,13 |
6,6±3,34 |
|
Длительность СД2, мес |
68,7±59,89 |
68,2±64,44 |
68,4±62,06 |
|
Ретинопатия, n (%) |
214 (19,7) |
113 (12,3) |
327 (16,4) |
|
Нейропатия, n (%) |
270 (24,9) |
235 (25,7) |
505 (25,3) |
|
Нефропатия, n (%) |
80 (7,4) |
54 (5,9) |
134 (6,7) |
Примечание: данные представлены в формате среднего и стандартного отклонения (M±SD). HbA1c — гликированный гемоглобин; HOMA-β — гомеостатическая модель оценки функции β-клеток (Homeostatic Model Assessment of β-cell function); HOMA-IR — гомеостатическая модель оценки инсулинорезистентности (Homeostatic Model Assessment for Insulin Resistance); ИМТ — индекс массы тела; ГПН — уровень глюкозы в плазме натощак; ППГ — постпрандиальная гликемия; СД2 — сахарный диабет 2 типа.
Сбор данных по сердечно-сосудистым заболеваниям (ССЗ) и факторам сердечно-сосудистого риска показал наличие артериальной гипертензии у 59,4% участников, дислипидемии — у 53%, ССЗ — у 5,7% (наиболее распространенные — ишемическая болезнь сердца и фибрилляция предсердий). Инфаркт миокарда и инсульт были в анамнезе у 1%. При оценке сердечно-сосудистого риска высокий риск отмечен у 56,7%, еще у 22,3% — очень высокий. Кроме того, у 16,8% пациентов имелись другие сопутствующие эндокринные заболевания, в основном патология щитовидной железы.
Анализ предшествующей терапии СД2
Большинство пациентов (89%) получали сахароснижающую терапию до начала исследования. Наиболее распространенным препаратом был метформин (89% пациентов). Другие часто используемые препараты включали иДПП-4 (18%), натрий-глюкозного котранспортера 2 (иНГЛТ-2) (21%) и производные сульфонилмочевины (ПСМ), 9%). Менее 1% пациентов применяли инсулин или арГПП-1. Комбинированная терапия была более распространена (85%), чем монотерапия (15%), и, в основном, была представлена комбинацией метформина с иДПП-4, иНГЛТ-2 или ПСМ.
Сопутствующая терапия
После начала исследования 71% пациентов продолжали получать сопутствующую терапию совместно с Инкресинком. Метформин оставался наиболее часто используемым препаратом (67%). ИНГЛТ-2 использовались у 16% пациентов. Терапия иДПП-4, ПСМ, инсулином и арГПП-1 была отменена (0% пациентов соответственно). Инкресинк использовался в комбинации с метформином или иНГЛТ-2 в составе тройной сахароснижающей терапии, а у части пациентов в составе квадротерапии метформин + иНГЛТ-2 + Инкресинк (порядка 6% пациентов).
Первичная конечная точка
При оценке первичной конечной точки выявлено снижение HbA1c через 3 мес наблюдения у 91,7% пациентов, получавших Инкресинк в дозе 25+15 мг, и у 96,5% — в дозе 25+30 мг. Через 6 мес терапии снижение HbA1c отмечено у 89,3% пациентов, принимавших дозу 25+15 мг, и у 94,4%, получавших дозу 25+30 мг. Различия между группами достигали статистической значимости (p<0,001 на каждом визите). Индивидуальные цели HbA1c на Инкресинке в дозе 25+15 мг были достигнуты к Визиту 2 у 308 пациентов (28,4%), к Визиту 3 — у 670 пациентов (61,8%); на Инкресинке в дозе 25+30 мг были достигнуты к Визиту 2 у 339 пациентов (37,0%), к Визиту 3 — у 733 пациентов (80,1%). Различие между группами и визитами статистически значимое p<0,001. В совокупности более 30% участников достигли целевого уровня HbA1c через 3 мес, 70,2% через 6 мес терапии препаратом Инкресинк (рис. 1).
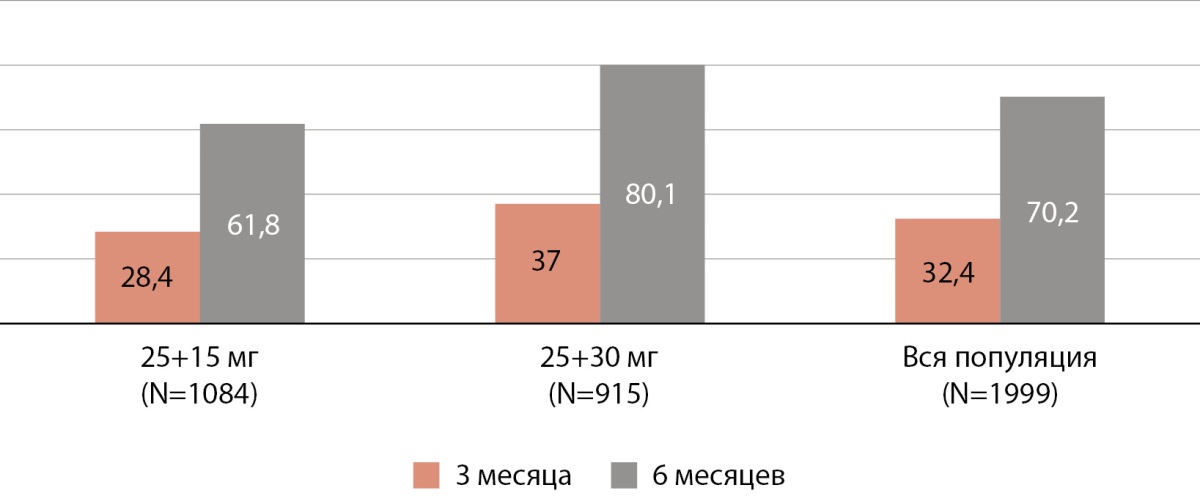
Рисунок 1. Доля участников, достигших целевого уровня гликированного гемоглобина, (%).
Анализ данных ответа на терапию показал, что через 3 мес наблюдения доля пациентов со снижением HbA1cна 0,3% и больше в группе принимавших Инкресинк в дозе 25+15 мг составила 67,7%, в дозе 25+30 мг — 75,2%; через 6 мес наблюдения — 82,4% и 90,7% соответственно. В общем доля ответчиков к Визиту 2 составила 71,1%, к Визиту 3 — 86,2%. Во всех группах достигнуто статистически значимое различие (р<0,001). Динамика уровня HbA1c по визитам представлена на рис. 2.
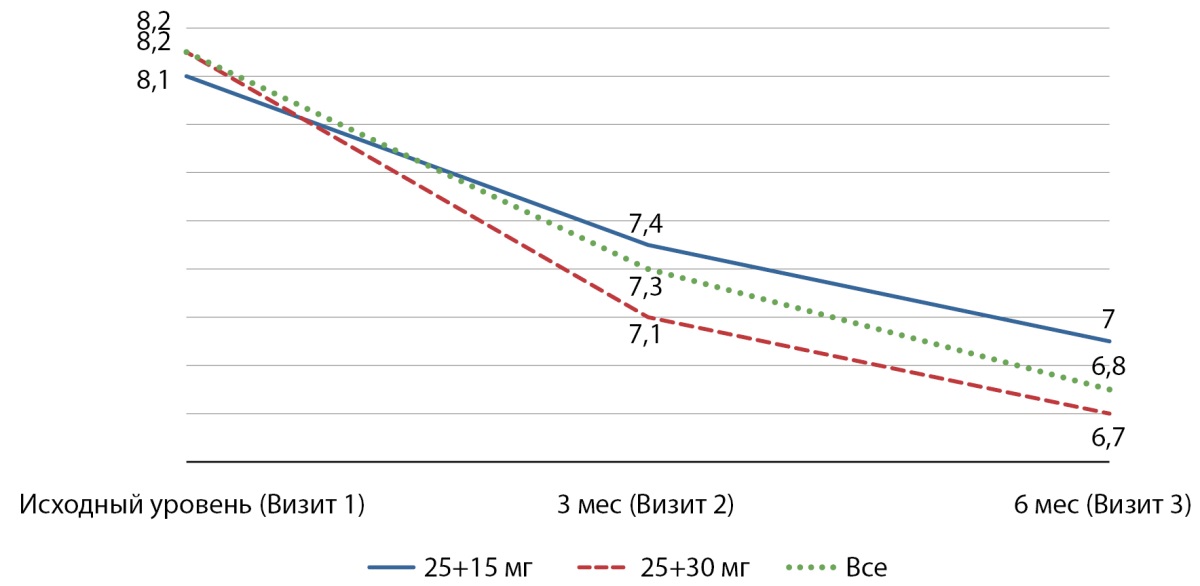
Рисунок 2. Средние значения гликированного гемоглобина (%) на визитах.
Субанализ изменения уровня HbA1c в группах с разным исходным HbA1c показал, что при начальном HbA1c<7,5% (N=516) через 6 мес наблюдения произошло снижение HbA1c на 0,7±0,48, при 7,5 — 9,0% (N=1181) — на 1,2±0,58, при >9,0 (N=300) — на 2,8±1,66. Различия между группами статистически значимы (p<0,0001).
Вторичные конечные точки
Результаты оценки вторичных конечных точек через 3 и 6 мес наблюдения представлены в табл. 2.
Таблица 2. Параметры антропометрии, витальных функций, уровня глюкозы, липидного обмена, функции почек и их динамика через 3 и 6 месяцев наблюдения (М±SD)
|
Показатель/визиты |
Инкресинк 25+15 мг |
Инкресинк 25+30 мг |
Все пациенты |
|
ГПН, ммоль/л |
|||
|
Визит 2 |
7,2±1,19 |
6,9±1,20 |
7,0±1,20 |
|
Динамика к Визиту 2* |
-1,2±1,45 |
-1,8±1,93 |
-1,5±1,73 |
|
Визит 3 |
6,7±1,03 |
6,3±0,90 |
6,5±0,98 |
|
Динамика к Визиту 3* |
-1,7±1,64 |
-2,3±2,05 |
-2,0±1,88 |
|
ППГ, ммоль/л |
|||
|
Визит 2 |
8,8±1,68 |
8,3±1,38 |
8,6±1,57 |
|
Динамика к Визиту 2* |
-1,5±1,51 |
-2,0±2,09 |
-1,8±1,83 |
|
Визит 3 |
8,3±1,46 |
7,7±1,05 |
8,0±1,31 |
|
Динамика к Визиту 3* |
-2,0±1,62 |
-2,7±2,31 |
-2,4±2,01 |
|
Масса тела, кг |
|||
|
Визит 2 |
88,8±16,30 |
90,6±16,27 |
89,7±16,30 |
|
Динамика к Визиту 2 |
-1,2±2,91 |
-1,5±4,65 |
-1,3±3,82 |
|
Визит 3 |
87,5±16,06 |
89,3±16,17 |
88,4±16,13 |
|
Динамика к Визиту 3 |
-2,5 |
-2,8 |
-2,7 |
|
ИМТ, кг/м² |
|||
|
Визит 2 |
31,6±5,17 |
32,1±5,16 |
31,8±5,17 |
|
Динамика к Визиту 2 |
-0,4±1,05 |
-0,5±1,60 |
-0,5±1,33 |
|
Визит 3 |
31,2±5,15 |
31,6±5,17 |
31,4±5,16 |
|
Динамика к Визиту 3 |
-0,9±4,92 |
-1,0±5,68 |
-0,9±5,29 |
|
Окружность талии, см |
|||
|
Визит 2 |
98,2±14,64 |
99,4±14,52 |
98,8±14,59 |
|
Динамика к Визиту 2** |
- 1,6±3,07 |
-2,0±3,66 |
-1,8±3,36 |
|
Визит 3 |
96,4±14,36 |
97,3±14,59 |
96,8±14,47 |
|
Динамика к Визиту 3** |
-3,5±4,93 |
-4,1±5,68 |
-3,8±5,29 |
|
ЧСС, уд/мин |
|||
|
Визит 2 |
72,4±6,86 |
72,1±6,33 |
72,2±6,61 |
|
Динамика к Визиту 2* |
- 1,1±6,96 |
- 2,3±6,95 |
- 1,7±6,98 |
|
Визит 3 |
71,8±6,42 |
72,0±6,55 |
71,9±6,48 |
|
Динамика к Визиту 3** |
-1,7±7,36 |
-2,4±7,92 |
-2,0±7,64 |
|
САД, мм рт.ст. |
|||
|
Визит 2 |
126,5±9,27 |
124,9±8,98 |
125,8±9,17 |
|
Динамика к Визиту 2** |
-2,3±9,96 |
-3,3±10,79 |
-2,8±10,36 |
|
Визит 3 |
125,8±8,92 |
124,1±8,62 |
125,0±8,82 |
|
Динамика к Визиту 3** |
-3,0±11,18 |
-4,1±11,38 |
-3,5±11,28 |
|
ДАД, мм рт.ст. |
|||
|
Визит 2 |
77,5±7,98 |
77,3±7,14 |
77,4±7,60 |
|
Динамика к Визиту 2 |
-1,9±8,41 |
-2,6±7,63 |
-2,2±8,06 |
|
Визит 3 |
77,4±7,98 |
77,6±6,59 |
77,5±7,37 |
|
Динамика к Визиту 3 |
-2,0±9,24 |
-2,3±8,24 |
-2,1±8,79 |
|
HOMA-IR |
|||
|
Визит 2 |
4,3±2,45 |
4,3±2,13 |
4,3±2,30 |
|
Динамика к Визиту 2* |
-1,6±2,46 |
-2,6±2,28 |
-2,1±2,43 |
|
Визит 3 |
4,0±3,02 |
4,0±1,82 |
4,0±2,55 |
|
Динамика к Визиту 3* |
-2,2±2,98 |
-3,6±2,35 |
-2,8±2,79 |
|
ОХС, ммоль/л |
|||
|
Визит 2 |
4,9±0,89 |
5,0±1,00 |
5,0±0,95 |
|
Динамика к Визиту 2** |
-0,3±0,85 |
-0,4±1,06 |
-0,4±0,97 |
|
Визит 3 |
4,8±0,79 |
4,9±0,93 |
4,9±0,87 |
|
Динамика к Визиту 3 |
-0,5±1,01 |
-0,6±1,20 |
-0,6±1,12 |
|
ТГ, ммоль/л |
|||
|
Визит 2 |
1,6±0,73 |
1,7±0,86 |
1,6±0,80 |
|
Динамика к Визиту 2 |
-0,3±1,23 |
-0,4±1,23 |
-0,4±1,22 |
|
Визит 3 |
1,±0,68 |
1,7±0,75 |
1,6±0,72 |
|
Динамика к Визиту 3 |
-0,6±-0,3 |
-0,5±-0,3 |
-0,6±-0,3 |
|
ЛПНП, ммоль/л |
|||
|
Визит 2 |
2,7±0,90 |
2,8±0,96 |
2,8±0,94 |
|
Динамика к Визиту 2 |
-0,3±0,78 |
-0,3±0,86 |
-0,3±0,82 |
|
Визит 3 |
2,5±0,91 |
2,8±0,96 |
2,6±0,95 |
|
Динамика к Визиту 3 |
-0,5±1,00 |
-0,5±1,05 |
-0,5±1,02 |
|
ЛПВП, ммоль/л |
|||
|
Визит 2 |
1,4±0,38 |
1,5±0,46 |
1,4±0,42 |
|
Динамика к Визиту 2** |
0,0±0,36 |
0,1±0,38 |
0,0±0,37 |
|
Визит 3 |
1,4±0,31 |
1,4±0,44 |
1,4±0,38 |
|
Динамика к Визиту 3 |
0,1±0,38 |
0,1±0,38 |
0,1±0,38 |
|
рСКФ, мл/мин/1,73 м² |
|||
|
Визит 2 |
90,1±18,86 |
90,8±19,67 |
90,5±19,30 |
|
Динамика к Визиту 2** |
-0,1±10,59 |
1,7±12,28 |
0,9±11,61 |
|
Визит 3 |
88,7±16,10 |
86,8±16,10 |
87,7±16,10 |
|
Динамика к Визиту 3 |
-0,9±12,54 |
0,2±14,86 |
-0,3±13,89 |
|
Альбумин/креатинин, мг/г |
|||
|
Визит 2 |
18,4±25,83 |
17,1±32,09 |
17,6±29,66 |
|
Динамика к Визиту 2 |
-2,2±27,21 |
-2,5±9,24 |
-2,3±19,40 |
|
Визит 3 |
9,7±17,22 |
8,0±29,32 |
8,7±24,99 |
|
Динамика к Визиту 3 |
-7,5±34,49 |
-8,3±22,92 |
-7,9±29,04 |
Примечание. HOMA-IR — гомеостатическая модель оценки инсулинорезистентности (Homeostatic Model Assessment for Insulin Resistance); ГПН — уровень глюкозы в плазме натощак; ДАД — диастолическое артериальное давление; ИМТ — индекс массы тела; ЛПВП — липопротеины высокой плотности; ЛПНП — липопротеины низкой плотности; ОХС — общий холестерин; ППГ — постпрандиальная гликемия; рСКФ — расчетная скорость клубочковой фильтрации; САД — систолическое артериальное давление; ТГ — триглицериды; ЧСС — частота сердечных сокращений.
P — значение при сравнении с исходными значениями: *p<0,001, **p<0,05.
На фоне терапии препаратом «Инкресинк» отмечена положительная динамика уровня глюкозы натощак и после еды, а также уменьшение инсулинорезистентности (рис. 3).
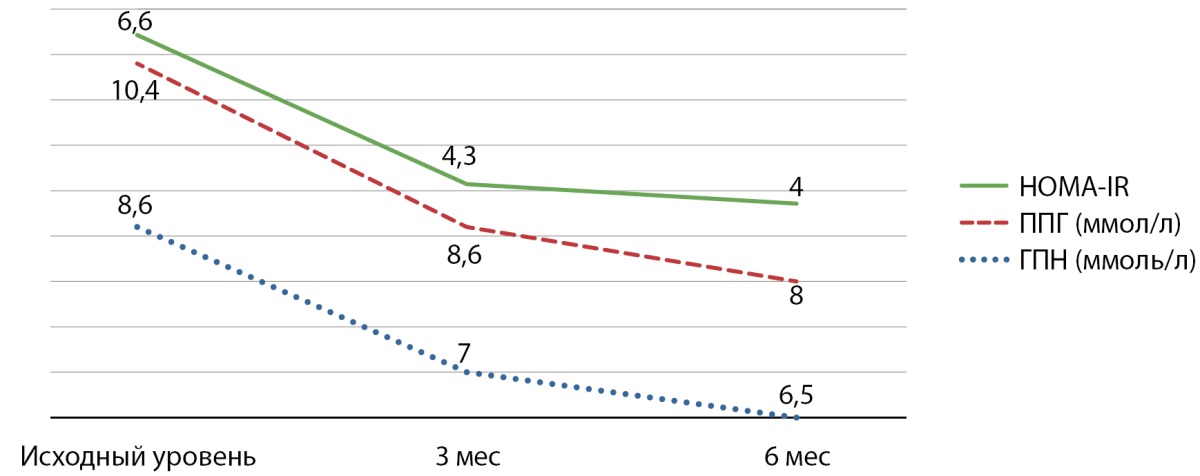
Рисунок 3. Динамика глюкозы плазмы натощак, постпрандиальной гликемии, HOMA-IR по визитам.
Примечание. HOMA-IR — гомеостатическая модель оценки инсулинорезистентности (Homeostatic Model Assessment for Insulin Resistance); ГПН — уровень глюкозы в плазме натощак (ммоль/л); ППГ — постпрандиальная гликемия (ммоль/л).
Положительное плейотропное действие комбинации алоглиптина и пиоглитазона проявлялось снижением уровня общего холестерина, триглицеридов и липопротеинов низкой плотности (ЛПНП) (рис. 4).
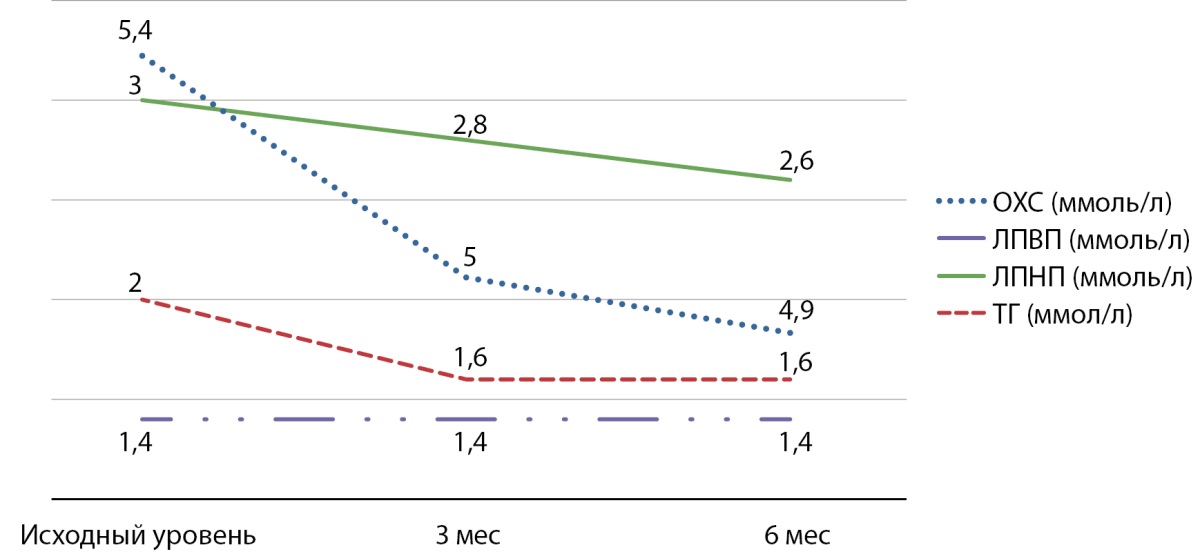
Рисунок 4. Динамика показателей липидного обмена.
Примечание. ЛПВП — липопротеины высокой плотности; ЛПНП — липопротеины низкой плотности; ОХС — общий холестерин; ТГ — триглицериды (ммоль/л).
При анализе функции почек в динамике за 6 мес наблюдения выявлено, что применение обеих доз обеспечило снижение альбуминурии, начиная с 3 мес терапии, и особо значимо — через полгода приема препарата (с 17,6 на исходном уровне до 8,7 мг/г к окончанию наблюдения). При этом отсутствовало снижение величины рСКФ.
За время исследования положительные сдвиги отмечены в отношении массы тела, окружности талии и, соответственно, ИМТ (рис. 5).
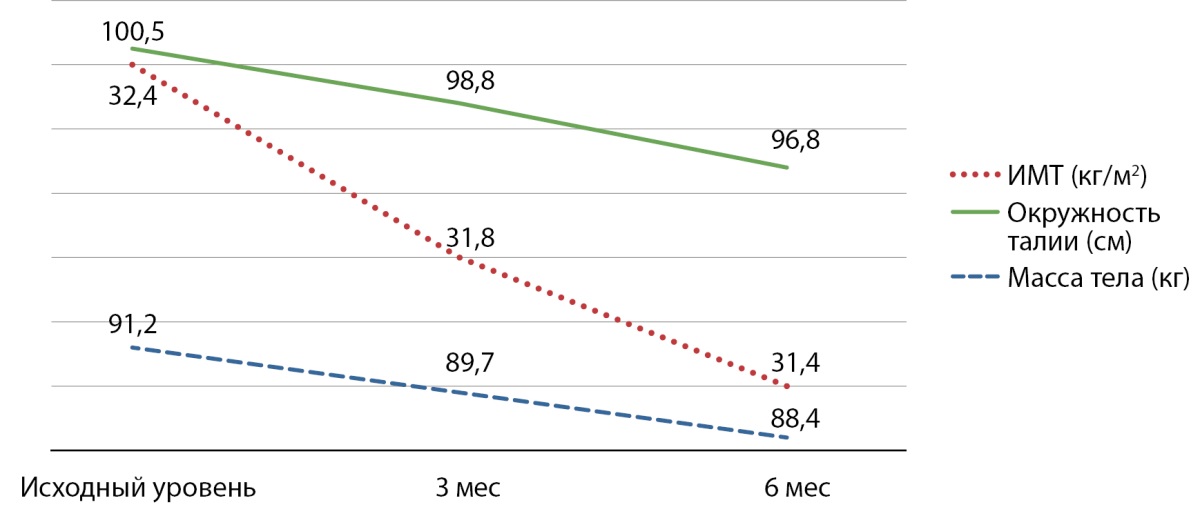
Рисунок 5. Динамика антропометрических данных ИМТ (кг/м²), масса тела (кг), окружность талии (см).
Примечание. ИМТ — индекс массы тела.
Повышение дозы препарата с 25+15 мг до 25+30 мг потребовалось 28,8% пациентов через 3 мес и 6,6% пациентов через 6 мес терапии. Среди пациентов, изначально принимавших 25+30 мг, снижение дозы препарата потребовалось только 1% через 3 мес и 0,5% через 6 мес, что свидетельствует о высокой безопасности и эффективности комбинации.
Оценка безопасности
За все время наблюдения зарегистрировано 23 НЯ у 20 пациентов, из них 5 — на Визите 2 и 15 — на Визите 3. Только одно НЯ, острый панкреатит, было оценено как серьезное, но не связанное с приемом препарата (табл. 3).
Таблица 3. Список нежелательных явлений
|
Нежелательные явления |
Тяжесть |
Связь с исследуемым препаратом |
Исход |
Предпринятые меры |
|
Лабораторные и инструментальные данные |
||||
|
Повышение уровня трансаминаз |
Легкая |
не связано |
разрешилось |
снижение дозы |
|
Повышение уровня трансаминаз |
Легкая |
не связано |
разрешилось |
не применялись |
|
Повышение артериального давления |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Повышение артериального давления |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Повышение артериального давления |
Легкая |
не связано |
разрешилось |
не применялись |
|
Желудочно-кишечные нарушения |
||||
|
Боль в верхних отделах живота |
Легкая |
связано |
разрешилось |
не применялись |
|
Вздутие живота |
Легкая |
связано |
разрешилось |
не применялись |
|
Диарея |
Легкая |
связано |
разрешилось |
не применялись |
|
Панкреатит острый |
Тяжелая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Инфекции и инвазии |
||||
|
Пневмония |
Умеренная |
не связано |
разрешилось |
не применялись |
|
Фарингит |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Инфекция дыхательных путей |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Ринит |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Инфекция дыхательных путей |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Нарушения со стороны нервной системы |
||||
|
Головная боль |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Головокружение |
Легкая |
не связано |
разрешилось |
не применялись |
|
Головная боль |
Легкая |
не связано |
разрешилось |
не применялись |
|
Нарушения со стороны крови и лимфатической системы |
||||
|
Нейтропения |
Легкая |
не связано |
неизвестен |
не применялись |
|
Нарушения со стороны сосудов |
||||
|
Гипертонический криз |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Гипертонический криз |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Гипертонический криз |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Гипертонический криз |
Легкая |
не связано |
разрешилось |
назначение сопутствующей терапии |
|
Общие нарушения |
||||
|
Отек |
Легкая |
связано |
разрешилось |
снижение дозы |
Четыре НЯ были связаны с применением препарата Инкресинк: по одному случаю — боли в верхних отделах живота, вздутия живота в группе дозы 25+15 мг, диареи и отека в группе 25+30 мг. Все НЯ разрешились самостоятельно и не потребовали назначения сопутствующей терапии. По поводу развития отека (группа 25+30 мг) было принято решение снизить дозу препарата на 25+15 мг.
Оценка приверженности и удовлетворенности проводимой терапии
После завершения исследования более 94% пациентов остались на терапии Инкресинком, при этом только менее 1% пациентов закончили участие в исследовании досрочно. 94% врачей оценили терапию Инкресинком как «очень эффективную» (74%) или «эффективную» (20%). При этом важно заметить, что на дозировке 25+30 мг исследователи гораздо чаще оценивали лечение как «очень эффективное»: в 82,2% случаев против 67,3% в группе 25+15 мг.
ОБСУЖДЕНИЕ
Лечение СД2 традиционно основывалось на ступенчатом подходе: начиналось с диеты, физических упражнений и пероральных сахароснижающих препаратов с последующей эскалацией сахароснижающей терапии при ухудшении контроля гликемии. Сегодня этот «инертный» подход признан устаревшим, так как ступенчатая эскалация отстает от темпов прогрессирования СД2 и не компенсирует постепенное снижение функции β-клеток, что лежит в основе ухудшения контроля уровня сахара в крови. Сегодня известно, что дисфункция β-клеток развивается раньше манифестации гипергликемии и является более выраженной, чем считалось ранее. К моменту постановки диагноза функция β -клеток может снижаться более чем на 50% от исходной [13]. Это указывает на необходимость широкого применения «проактивного» подхода и применения ранней комбинированной терапии СД2 в дебюте заболевания.
Ральф ДеФронзо в своей лекции Бантинга, 2009 г. [4], предложил изменить парадигму лечения СД2, основываясь на следующих принципах:
- эффективное лечение требует комбинации препаратов, воздействующих на различные патологические механизмы;
- терапия должна быть направлена на устранение патогенетических нарушений, а не только на снижение уровня HbA1c;
- лечение необходимо начинать как можно раньше, чтобы предотвратить прогрессирующую дисфункцию β-клеток.
Комбинация алоглиптина и пиоглитазона соответствует этим требованиям, так как оба препарата действуют через взаимодополняющие механизмы: алоглиптин стимулирует секрецию инсулина и снижает уровень глюкагона после еды, а пиоглитазон повышает чувствительность к инсулину в периферических тканях и печени. Объединение эффектов двух препаратов реализуется в улучшении функции β-клеток, что способствует более продолжительному гликемическому контролю и замедлению темпов прогрессирования СД2. Ранее проведенные клинические исследования подтвердили эффективность комбинации алоглиптина и пиоглитазона у пациентов с СД2. В исследованиях продолжительностью от 12 до 52 недель комбинация показала значительное снижение уровня HbA1c (на 0,6–1,0% больше, чем при монотерапии каждым из компонентов) и улучшение других показателей гликемического контроля. Эффективность не зависела от возраста, пола, индекса массы тела, длительности диабета или этнической принадлежности. При этом на комбинации показан благоприятный профиль переносимости, без повышения риска гипогликемии по сравнению с отдельными компонентами [14].
Проведенное исследование реальной клинической практики включило данные почти 2 тысяч пациентов из 52 российских исследовательских центров. Такой масштабный охват, как по числу пациентов, так и по вовлеченным территориям, позволяет достоверно оценить эффективность и безопасность препарата «Инкресинк» и перенести результаты на общую популяцию пациентов СД2.
По данным исследования, через 6 мес наблюдения 70,2% пациентов независимо от дозы достигали целевых уровней HbA1c; количество пациентов, принимавших Инкресинк в дозе 25 мг+30 мг 1 раз/сут и достигших целевых показателей HbA1c, составило 80,1%. При этом около трети пациентов достигли целевых значений уже через 3 мес терапии.
Данные, полученные в нашем исследовании реальной клинической практики, превосходят результаты ранее проведенных рандомизированных клинических исследований. В исследованиях Pratley R.E. (2009 г.) [15] и Kim H.J. (2022 г.) [16] уровня HbA1c≤7,0% на 24‑й и 26‑й неделе терапии 25 мг алоглиптина и 15 мг пиоглитазона достигли 49% и 55% пациентов соответственно. И выше, чем в исследовании Rosenstock J. (2010 г.), в котором 63% пациентов, принимавших 25 мг алоглиптина в сочетании с 30 мг пиоглитазона, достигли целевого уровня HbA1c [17].
Величина снижения HbA1c при применении препарата зависела от исходного уровня: чем выше было первоначальное значение, тем сильнее в последующем снижался HbA1c.
Немалая роль в патогенезе СД2 принадлежит феномену инсулинорезистентности. Применение препарата «Инкресинк» способствовало уменьшению массы тела и окружности талии, снижению ИМТ и HOMA-IR. Уменьшение массы тела достаточно неожиданно для препаратов из группы ТЗД. Известно, что на этой группе препаратов происходит перераспределение массы тела: уменьшение висцерального жира и увеличение подкожного, что имеет благоприятный метаболический эффект. В нашем исследовании уменьшение окружности талии свидетельствовало об уменьшении висцерального жира. Общее уменьшение массы тела в среднем на 3 кг может быть обусловлено наличием в фиксированной комбинации препарата из группы иДПП4 алоглиптина [10].
Известно, что опасность СД2 заключается в развитии сосудистых осложнений, ускорении атеросклеротических процессов. По данным анамнеза включенных пациентов, большая часть имела высокий и очень высокий риск сердечно-сосудистых осложнений. Результаты исследования продемонстрировали плейотропное действие комбинации алоглиптина и пиоглитазона, которое позволило улучшить показатели липидного обмена и снизить уровень общего холестерина, триглицеридов и ЛПНП. Исследование показало, что через 6 мес терапии у пациентов улучшился уровень артериального давления, в частности наблюдалась отчетливая динамика в снижении САД. Учитывая широкую распространенность артериальной гипертензии, а также вклад данного фактора риска в кардиоваскулярный прогноз, снижение артериального давления относится к дополнительным положительным эффектам терапии Инкресинком. Важно отметить, что пиоглитазон оказывает положительное влияние не только на факторы риска и суррогатные маркеры ССЗ, но также снижает частоту сердечных событий у пациентов с СД2, что было подтверждено результатами рандомизированных контролируемых исследований (РКИ) сердечно-сосудистых исходов [18].
Также в ходе нашего исследования подтверждена безопасность терапии препаратом «Инкресинк» со стороны функции почек: помимо устойчивой не изменившейся рСКФ, на фоне лечения зафиксировано снижение уровня альбуминурии уже после 3 мес, что говорит о благоприятном эффекте и, возможно, о наличии ренопротективных свойств у комбинации. Полученные результаты согласуются с предшествующим клиническим опытом. Так, в ряде РКИ и метаанализов показано снижение альбуминурии у пациентов с СД2, нормо- или микроальбуминурией на фоне терапии ТЗД, в т.ч. пиоглитазоном. Аналогичный эффект показан на иДПП-4 и алоглиптине. При этом важно заметить, что пока не проведено больших продолжительных РКИ иДПП-4 и ТЗД, оценивающих влияние этих классов сахароснижающих препаратов на «твердые» почечные конечные точки, возможные протективные эффекты комбинации требуют дальнейшего изучения [19][20].
ЗАКЛЮЧЕНИЕ
Проведенное исследование реальной клинической практики подтвердило высокую эффективность препарата «Инкресинк», фиксированной комбинации алоглиптина и пиоглитазона, в отношении достижения и поддержания компенсации углеводного обмена. Результаты исследования также показали дополнительные плейотропные эффекты терапии в виде улучшения модифицируемых факторов кардиоваскулярного риска, безопасность со стороны функции почек и высокую приверженность к терапии. Комбинация алоглиптина и пиоглитазона соответствует современным требованиям к лечению СД2, воздействуя на несколько патологических механизмов и сохраняя функцию β-клеток. Удобство применения фиксированной комбинации в одной таблетке может улучшить приверженность лечению и повысить его эффективность. Это позволяет рассматривать комбинацию алоглиптина и пиоглитазона как следующий шаг в лечении пациентов с СД2, не достигающих удовлетворительного гликемического контроля на предшествующей терапии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование проведено при поддержке компании АО «Нижфарм».
Конфликт интересов. Шестакова М.В. как национальный координатор исследования принимала участие в экспертных советах, связанных с проведением исследования, а также представлением промежуточных и финальных результатов исследования в рамках Национального эндокринологического конгресса в 2023 и 2024 гг.
Участие авторов. Шестакова М.В. — разработка концепции и дизайна исследования, внесение существенных правок в текст статьи; Харахулах М.И. — разработка дизайна исследования, сбор данных, внесение существенных правок в текст статьи; Белолипецкий Я.А. — сбор и статистический анализ данных, написание текста статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Авторы выражают глубокую благодарность всем исследователям, принявшим участие в этом проекте: Абакумовой А.А., Авалиани Д.А., Андреевой Н.В., Андреевой Т.З., Арутюнян А.В., Атанесян Р.А., Ахмеровой Е.В., Балковой С.Ф., Барановой Е.Н., Барыкиной И.Н., Белошапкиной Н.В., Бородкиной Д.А., Важуровой Н.Г., Вербовой М.В., Волковой Т.В., Воробьеву С.В., Голомидовой И.Л., Гюльмагомедовой А.Н., Денисовой К.И., Доценко Д.А., Елсуковой О.С., Золкиной И.А., Зубаткиной Т.Н., Игнариной О.С., Калининой И.А., Касумовой С.А., Каторжанской Т.Ю., Каторжанскому В.К., Коломойцевой И.И., Косимову Ж.У., Кудинову В.И., Кузьминой В.А., Курову С.В., Лазаренко Ф.Э., Малаховой М.С., Малых Н.Э., Махалиной Т.В., Мовсесян С.Д., Муратовой А.В., Нечунаевой Т.С., Омельчук Н.Н., Онопе В.В., Первушиной В.Ю., Пресняковой О.Ю., Рымар О.Д., Рябовой А.А., Согомонян К.В., Соколовой А.В., Соколовой Е.Н., Сунагатулиной Г.Р., Тананакиной Н.В., Ткач Е.В., Филатовой Т.Е., Фроловой Е.В., Хамражанову З.А., Харахулах М.И., Хмельницкому О.К., Шабановой Е.С., Шуваловой Е.В., Шуваловой И.Г., Эйхенбау И.Ю., Юневой Г.Л.
Статья подготовлена при поддержке AО «Нижфарм» (группа компаний STADA). Мнение автора может не совпадать с мнением компании.
Список литературы
1. База данных клинико-эпидемиологического мониторинга сахарного диабета на территории Российской Федерации [Интернет]. [доступ от 13.09.2024]. Available from: https://sd.diaregistry.ru/?ysclid=m10r5tepjz411837192
2. Дедов И.И., Шестакова М.В., Викулова О.К., и соавт. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021 // Сахарный диабет. — 2021. — Т. 24. — № 3. — С. 204-221. doi: https://doi.org/10.14341/DM12759
3. ElSayed NA, Aleppo G, Aroda VR, et al. 6. Glycemic Targets: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46(Suppl 1):S97-S110. doi: https://doi.org/10.2337/dc23-S006
4. Defronzo RA. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes. 2009;58(4):773-795. doi: https://doi.org/10.2337/db09-9028
5. Ma CX, Ma XN, Guan CH, Li YD, Mauricio D, Fu SB. Cardiovascular disease in type 2 diabetes mellitus: progress toward personalized management. Cardiovasc Diabetol. 2022;21(1):74. doi: https://doi.org/10.1186/s12933-022-01516-6
6. Trikkalinou A, Papazafiropoulou AK, Melidonis A. Type 2 diabetes and quality of life. World J Diabetes. 2017;8(4):120-129. doi: https://doi.org/10.4239/wjd.v8.i4.120
7. Rawshani A, Rawshani A, Franzén S, et al. Mortality and Cardiovascular Disease in Type 1 and Type 2 Diabetes. N Engl J Med. 2017;376(15):1407-1418. doi: https://doi.org/10.1056/NEJMoa1608664
8. James DE, Stöckli J, Birnbaum MJ. The aetiology and molecular landscape of insulin resistance. Nat Rev Mol Cell Biol. 2021;22(11):751-771. doi: https://doi.org/10.1038/s41580-021-00390-6
9. Рубрикатор КР [Интернет]. [доступ от 11.09.2024]. [Rubrikator KR [Internet]. [dostup ot 11..09.2024]. (In Russ.).] Available from: https://cr.minzdrav.gov.ru/schema/290_2?ysclid=m0xy7dnk7k947220878
10. Scheen AJ. Pharmacokinetics and clinical evaluation of the alogliptin plus pioglitazone combination for type 2 diabetes. Expert Opin Drug Metab Toxicol. 2015;11(6):1005-1020. doi: https://doi.org/10.1517/17425255.2015.1041499
11. Sheikh IM, Hassan OA, Adam SM, et al. Association of Pioglitazone With Major Adverse Cardiovascular Events, All-Cause Mortality, and Heart Failure Hospitalizations: A Systematic Review. Cureus. 2023;15(10):e46911. doi: https://doi.org/10.7759/cureus.46911
12. Vaccaro O, Masulli M, Nicolucci A, et al. Effects on the incidence of cardiovascular events of the addition of pioglitazone versus sulfonylureas in patients with type 2 diabetes inadequately controlled with metformin (TOSCA.IT): a randomised, multicentre trial [published correction appears in Lancet Diabetes Endocrinol. 2017 Nov;5(11):e7. doi: 10.1016/S2213-8587(17)30333-9.]. Lancet Diabetes Endocrinol. 2017;5(11):887-897. doi: https://doi.org/10.1016/S2213-8587(17)30317-0
13. Tan MH, Baksi A, Krahulec B, et al. Comparison of pioglitazone and gliclazide in sustaining glycemic control over 2 years in patients with type 2 diabetes. Diabetes Care. 2005;28(3):544-550. doi: https://doi.org/10.2337/diacare.28.3.544
14. Tomlinson B, Chan P, Lam CWK. An overview of alogliptin + pioglitazone for the treatment of type 2 diabetes. Expert Opin Pharmacother. 2022;23(1):29-42. doi: https://doi.org/10.1080/14656566.2021.1985465
15. Pratley RE, Reusch JE, Fleck PR, Wilson CA, Mekki Q; Alogliptin Study 009 Group. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin added to pioglitazone in patients with type 2 diabetes: a randomized, double-blind, placebocontrolled study. Curr Med Res Opin. 2009;25(10):2361-2371. doi: https://doi.org/10.1185/03007990903156111
16. Kim HJ, Jeong IK, Hur KY, et al. Comparison of Efficacy of Glimepiride, Alogliptin, and Alogliptin-Pioglitazone as the Initial Periods of Therapy in Patients with Poorly Controlled Type 2 Diabetes Mellitus: An Open-Label, Multicenter, Randomized, Controlled Study. Diabetes Metab J. 2022;46(5):689-700. doi: https://doi.org/10.4093/dmj.2021.0183
17. Rosenstock J, Inzucchi SE, Seufert J, Fleck PR, Wilson CA, Mekki Q. Initial combination therapy with alogliptin and pioglitazone in drug-naïve patients with type 2 diabetes. Diabetes Care. 2010;33(11):2406-2408. doi: https://doi.org/10.2337/dc10-0159
18. Bell DSH, Jerkins T. In praise of pioglitazone: An economically efficacious therapy for type 2 diabetes and other manifestations of the metabolic syndrome. Diabetes Obes Metab. 2023;25(11):3093-3102. doi: https://doi.org/10.1111/dom.15222
19. Sarafidis PA, Stafylas PC, Georgianos PI, Saratzis AN, Lasaridis AN. Effect of thiazolidinediones on albuminuria and proteinuria in diabetes: a meta-analysis. Am J Kidney Dis. 2010;55(5):835-847. doi: https://doi.org/10.1053/j.ajkd.2009.11.013
20. Penno G, Garofolo M, Del Prato S. Dipeptidyl peptidase-4 inhibition in chronic kidney disease and potential for protection against diabetesrelated renal injury. Nutr Metab Cardiovasc Dis. 2016;26(5):361-373. doi: https://doi.org/10.1016/j.numecd.2016.01.001
Об авторах
М. В. ШестаковаРоссия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
117036, Москва, ул. Дм. Ульянова, д. 11
М. И. Харахулах
Россия
Харахулах Марина Ивановна, к.м.н.
634063, Томск, ул. И. Черных, д. 96
Конфликт интересов:
Я. А. Белолипецкий
Россия
Белолипецкий Ярослав Александрович, старший медицинский советник
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Доля участников, достигших целевого уровня гликированного гемоглобина, (%). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(89KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Средние значения гликированного гемоглобина (%) на визитах. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(269KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Динамика глюкозы плазмы натощак, постпрандиальной гликемии, HOMA-IR по визитам. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(216KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Динамика показателей липидного обмена. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(229KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Динамика антропометрических данных ИМТ (кг/м2), масса тела (кг), окружность талии (см). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(229KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Шестакова М.В., Харахулах М.И., Белолипецкий Я.А. Оценка эффективности и безопасности фиксированной комбинации алоглиптина и пиоглитазона в реальной клинической практике: результаты исследования PROsperity. Сахарный диабет. 2025;28(2):198-209. https://doi.org/10.14341/DM13238
For citation:
Shestakova M.V., Kharakhulakh M.I., Belolipetsky Y.A. Assessment of the effectiveness and safety of fixed-dose combination of alogliptin and pioglitazone in real clinical practice: results of the PROsperity study. Diabetes mellitus. 2025;28(2):198-209. (In Russ.) https://doi.org/10.14341/DM13238

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































