Перейти к:
Применение индексов стеатоза и фиброза печени у пациентов с избыточной массой тела и ожирением в зависимости от наличия нарушений углеводного обмена
https://doi.org/10.14341/DM13229
Аннотация
ОБОСНОВАНИЕ. В настоящее время большое внимание уделяется поиску высокоинформативных и неинвазивных методов скрининга прогрессирования неалкогольной жировой болезни печени (НАЖБП) по стадиям «стеатогепатоз-стеатогепатит-фиброз». К таким неинвазивным методам относят тесты, основанные на сывороточных маркерах и/или биометрических показателях. Факт различия отрезных диагностических значений одних индексов фиброза и использование при расчете других индексов (NAFLD-LFS, BARD, NFS) балльной шкалы, включающей наличие/отсутствие сахарного диабета (СД) или других нарушений углеводного обмена (НУО), делает актуальным вопрос изучения применимости данных индексов в когорте пациентов с предиабетом и СД 2 типа (СД2).
ЦЕЛЬ. Изучить клинико-лабораторные ассоциации индексов печеночного стеатоза и фиброза у пациентов с избыточной массой тела и ожирением в зависимости от наличия и типа НУО, а также оценить диагностическую значимость отдельных индексов стеатоза и фиброза в данной когорте пациентов.
МАТЕРИАЛЫ И МЕТОДЫ. Всем пациентам выполнено комплексное клиническое и лабораторное обследование, проведен скрининг фиброза печени с помощью непрямой ультразвуковой фиброэластометрии печени, выполнено МРТ печени в режиме IDEAL-IQ с оценкой содержания внутрипеченочного жира. Рассчитаны индекс стеатоза FLI и индексы фиброза FIB-4, APRI, BARD и NFS. Статистическая обработка результатов включала сравнительный анализ, частотный анализ, корреляционный и ROC-анализ.
РЕЗУЛЬТАТЫ. В исследование включены 114 пациентов с избыточной массой тела или ожирением. Пациенты разделены на группы в зависимости от наличия и типа НУО: группа 1 — без НУО (n=52), группа 2 — предиабет (n=34), группа 3 — впервые диагностированный СД2 (n=28). Только для индекса NFS были получены значимые различия в зависимости от наличия и вида НУО: у лиц с СД2 индекс NFS был значимо выше, чем у лиц с нарушенной толерантностью к глюкозе (НТГ), и значимо выше, чем в группе без НУО. У пациентов с НТГ значения NFS достоверно превышали таковые в группе без НУО. По результатам оценки APRI и FIB4, в полученной выборке больных вообще не установлено случаев продвинутого (≥F2) фиброза. Индексы FIB-4 и NFS положительно коррелировали с параметрами углеводного обмена — гликированным гемоглобином (HbA1c) и гликемией натощак. Индекс APRI показал достаточную информативность в отношении F2 фиброза (площадь под кривой=0,687; р=0,008) в когорте больных ожирением и избыточной массой тела без учета НУО.
ЗАКЛЮЧЕНИЕ. Неинвазивные тесты потенциально перспективны в установлении фиброза печени, однако требуют дальнейшего изучения в отношении применимости для когорты больных с НУО.
Ключевые слова
Для цитирования:
Мусина Н.Н., Петрухина Д.А., Славкина Я.С., Родионова О.В., Алибиев Д.Е., Фомина С.В., Зима А.П., Саприна Т.В. Применение индексов стеатоза и фиброза печени у пациентов с избыточной массой тела и ожирением в зависимости от наличия нарушений углеводного обмена. Сахарный диабет. 2025;28(2):175-186. https://doi.org/10.14341/DM13229
For citation:
Musina N.N., Petrukhina D.A., Slavkina Y.S., Rodionova O.V., Alibiev D.E., Fomina S.V., Zima A.P., Saprina T.V. Use of liver steatosis and fibrosis indices in overweight and obese patients with or without carbohydrate metabolism disorders. Diabetes mellitus. 2025;28(2):175-186. (In Russ.) https://doi.org/10.14341/DM13229
Согласно данным отечественной и зарубежной литературы, от 25 до 30% взрослых жителей развитых стран, в том числе США и России, страдают неалкогольной жировой болезнью печени (НАЖБП), что позволяет считать данное заболевание самым частым хроническим заболеванием печени в современном мире [1]. НАЖБП проходит последовательно несколько стадий прогрессии, определяющих тяжесть заболевания, — от стеатоза до неалкогольного стеатогепатита (НАСГ) с исходом в цирроз печени. Как печеночные причины, включая цирроз и гепатоцеллюлярный рак, так и внепеченочные проявления, и осложнения — метаболический синдром, сердечно-сосудистые заболевания, сахарный диабет 2 типа (СД2) — определяют неблагоприятные исходы НАЖБП. Результаты современных исследований позволяют рассматривать НАЖБП в качестве печеночной манифестации метаболического синдрома, и более того, рядом исследователей предлагается использовать новый термин — метаболически-ассоциированная болезнь печени (МАЖБП). Все больше данных свидетельствует о том, что коморбидные состояния — НАЖБП, метаболический синдром, ожирение, СД2 и сердечно-сосудистые заболевания — оказывают взаимо-направленное влияние на свое естественное течение [1]. Было неоднократно показано, что частота выявления НАЖБП у лиц с СД значительно превышает таковую для общей популяции и составляет от 30 до 75% [2][3].
Высокая распространенность НАЖБП в общей популяции и особенно в популяции больных с нарушениями углеводного обмена (НУО) обуславливает необходимость поиска высокоинформативных и неинвазивных методов скрининга прогрессирования данной патологии по стадиям «стеатогепатоз-стеатогепатит-фиброз». Несмотря на тот факт, что золотым стандартом верификации НАЖБП, и особенно фиброза печени, остается биопсия, высокая стоимость и риски данной процедуры ограничивают ее применение [1][3]. В связи с этим биопсия печени для установления и стадирования НАЖБП в реальной клинической практике проводится далеко не всегда и, согласно данным Американской ассоциации изучения заболеваний печени (AASLD), должна быть «зарезервирована» для конкретных клинических сценариев [3]. В настоящее время на первый план выходят методы неинвазивной диагностики. Ведется активный поиск таковых для скрининга заболевания, его стадирования, и для формирования прогноза и оценки эффективности проводимой терапии [1][3]. Среди неинвазивных методов можно выделить визуальные методы: ультразвуковое исследование (УЗИ) с измерением затухания ультразвуковой эховолны и магнитно-резонансную томографию (МРТ) с расчетом количества жира (FF — fat fraction) в печени. Неинвазивные тесты также относятся к неинвазивным методам диагностики НАЖБП и основываются на сывороточных маркерах и/или биометрических показателях.
Для разных стадий НАЖБП валидизированы отдельные неинвазивные методы скрининга. Так, для быстрого и стандартизированного установления стеатоза предлагается опираться на результаты УЗИ-эластометрии с оценкой CAP (Controlled attenuation parameter), однако для количественной оценки стеатоза более информативен метод МРТ с вычислением протонной плотности фракции жира (Proton Density Fat Fraction — PDFF). В качестве расчетных тестов стеатоза авторами национальных консенсусов и рекомендаций [1][3][4] предлагаются следующие индексы: FLI (Fatty Liver Index); NAFLD-LFS (NAFLD — liver fat score), HSI (Hepatic Steatosis Index) и LAP (Lipid accumulation product). Первые два (FLI и NAFLD-LFS) признаны наиболее валидизированными.
Действующие клинические рекомендации не советуют ни одну из предложенных ранее неинвазивных методик диагностики НАСГ, включая биохимические маркеры, такие как CK-18 (цитокератин 18), и методы визуализации. На сегодняшний день в отношении неинвазивных методик при НАСГ существует дефицит валидационных исследований, либо они недоступны для широкого и простого воспроизведения [1], эталонным стандартом для данной стадии НАЖБП остается биопсия печени [1].
Поскольку основным фактором прогноза течения НАЖБП является фиброз печени, при этом тяжелый фиброз становится независимым фактором риска летальности, разработка и валидизация неинвазивных диагностических тестов ориентирована именно на определение тяжелого фиброза (F3–4 стадий по шкале METAVIR). В качестве расчетных тестов фиброза современными международными рекомендациями [1][3][4] предлагаются: NFS (NAFLD fibrosis score), FIB-4 (index for liver fibrosis), BARD (шкала для оценки фиброза), APRI (отношение АСТ к тромбоцитам), AAR (отношение АСТ к АЛТ). Наиболее валидизированным признан индекс FIB-4, а также, согласно Российскому национальному консенсусу [1], NFS, за счет его высокой специфичности. При этом отрезные значения для установления низкого и высокого рисков фиброза по результатам FIB-4 несколько расходятся по данным разных консенсусов [1][3]. Согласно документу AASLD [3], значения индекса <1,3 соответствуют низкой вероятности фиброза, диапазон значений 1,3–2,67 — среднему риску, а уровень >2,67 — высокому риску фиброза. Авторами Российских рекомендаций [1] верхний отрезной порог FIB-4, обеспечивающий высокую специфичность в установлении высокого риска фиброза, предлагается равным 3,25.
Не только факт различия отрезных диагностических значений одних индексов фиброза, но и использование при расчете других индексов (NAFLD-LFS, BARD, NFS) балльной шкалы, включающей наличие/отсутствие СД или других НУО, делает актуальным вопрос изучения применимости данных индексов в когорте пациентов с предиабетом и СД2.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить клинико-лабораторные ассоциации индексов печеночного стеатоза и фиброза у пациентов с избыточной массой тела и ожирением в зависимости от наличия и типа НУО, а также оценить диагностическую значимость отдельных индексов стеатоза и фиброза в данной когорте пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование проводилось в эндокринологической клинике Сибирского государственного медицинского университета, г. Томск, Россия.
Время исследования. За период с 01 марта 2023 г. до 30 января 2024 г. комплексное обследование прошли 114 пациентов с избыточной массой тела или ожирением.
Изучаемые популяции (одна или несколько)
Критерии включения: Общими критериями включения в исследование являлись мужской и женский пол; возраст — от 18 до 55 лет; избыточная масса тела или ожирение на момент включения в исследование (ИМТ≥25,0 кг/м² и <45,0 кг/м²). По результатам оценки углеводного обмена (пероральный глюкозотолерантный тест (ПГТТ) с 75 г глюкозы и исследования гликированного гемоглобина (HbA1c)) мы стратифицировали пациентов в группы соответственно лабораторным критериям:
1) без НУО: глюкоза венозной плазмы натощак <6,1 ммоль/л, глюкоза венозной плазмы через 2 часа после нагрузки глюкозой <7,8 ммоль/л, уровень HbA1c<6,0%;
2) предиабет (нарушение толерантности к глюкозе (НТГ)): глюкоза венозной плазмы натощак менее 7,0 ммоль/л, глюкоза венозной плазмы через 2 часа после нагрузки глюкозой ≥7,8 ммоль/л и <11,1 ммоль/л; уровень HbA1c — 6,0–6,4%;
3) СД2, диагностированный впервые на момент включения в исследование: глюкоза венозной плазмы натощак ≥7,0 ммоль/л, глюкоза венозной плазмы через 2 часа после нагрузки глюкозой ≥11,1 ммоль/л; уровень HbA1c ≥6,5% и <7,5%.
Критерии исключения: В исследование не включались пациенты, находящиеся в постоперационном периоде; перенесшие бариатрические оперативные вмешательства в анамнезе; имевшие гемотрансфузии в период 1 месяца до включения в исследование; имеющие положительные маркеры HBsAg и/или anti-HCV; злоупотреблявшие алкоголем в анамнезе; пациенты с диагностированным ранее циррозом печени; пациенты с острой печеночной недостаточностью, а также со снижением расчетной скорости клубочковой фильтрации (рСКФ) ниже 30 мл/мин/1,73 м² по формуле CKD-EPI; пациенты с хронической сердечной недостаточностью (ХСН) стадий II и выше (по NYHA) и/или стадий IIA и выше по классификации Стражеско-Василенко; не подписавшие информированное согласие на участие в исследовании. В исследование также не вошли пациенты, принимавшие когда-либо ранее любые сахароснижающие препараты.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Истинно-случайный.
Дизайн исследования
Одноцентровое, наблюдательное, одномоментное, одновыборочное, сравнительное (при сравнении подгрупп) исследование.
Методы
Всем пациентам выполнялись антропометрия: измерение роста (см), веса (кг), расчет ИМТ по формуле: ИМТ = вес в кг / рост в м², измерение окружности талии (ОТ, см), окружности бедер (ОБ, см) и расчет индекса ОТ/ОБ. Лабораторное обследование включало общий анализ крови (анализатор XN1000, «Sysmex», Япония), биохимический анализ крови с исследованием трансаминаз, гамма-глутамилтранспептидазы (анализатор ARCHITECT i2000SR, «Abbott», США), оценка липидного спектра, исследование гликемии в ходе ПГТТ с 75 г глюкозы и исследование гликированного гемоглобина (анализатор D10, «BIORAD», США).
Скрининг фиброза печени выполнялся для всех пациентов с помощью непрямой ультразвуковой фиброэластометрии печени на аппарате TOSHIBA Aplio 700 (сдвиговой волной). Стадирование по шкале METAVIR по результатам эластометрии проводилось с учетом показателя жесткости печени: F0/1<7,1 кПа, F2=7,1–9,5 кПа, F3=9,5–10,5 кПа, F4≥10,5 кПа. Всем пациентам также выполняли исследование сывороточных маркеров фиброза с расчетом индексов фиброза печени: FIB-4, APRI, АСТ/АЛТ, BARD и NFS.
Расчет индексов фиброза печени проводился c использованием онлайн-калькуляторов (https://fibrotests.narod.ru/ и https://medsoftpro.ru/kalkulyatory/nfs-score.html) c учетом соответствующих параметров клинических и лабораторных данных.
1. Для индекса APRI (aspartate aminotransferase to platelet ratio index): АСТ и количество тромбоцитов.
Значение APRI>1,0 расценивалось как соответствующее высокому риску выраженного фиброза; значение индекса <0,5 — низкому риску выраженного фиброза.
2. Индекс BARD рассчитывался как сумма трех показателей: соотношение АСТ/АЛТ ≥0,8 = 2 балла; ИМТ≥28 кг/м² = 1 балл; наличие СД2 = 1 балл.
Индекс BARD 0–1 расценивался как отсутствие высокого риска выраженного фиброза печени; 2–4 — как высокий риск выраженного фиброза.
3. Для расчета FIB-4 (Fibrosis-4) учитывали показатели: возраст (лет), АСТ, количество тромбоцитов.
Полученные значения FIB-4 <1,45 говорят об отсутствии высокого риска фиброза, результат >3,25 с высокой вероятностью свидетельствует о выраженном фиброзе.
4. Для расчета индекса NFS (NAFLD fibrosis score) учитывали показатели: возраст (лет), ИМТ (кг/м²), факт наличия или отсутствия СД (есть СД — 1, нет СД — 0), АСТ, АЛТ, количество тромбоцитов и альбумин (г/дл).
Индекс NFS>0,676 свидетельствует о высоком риске продвинутого F3–F4 фиброза печени; <-1,455 — соответствует F0–F2 фиброзу; диапазон значений -1,455–0,676 расценивается как сомнительный результат («серая зона»).
Для расчета индекса стеатоза печени FLI (fatty liver index) учитывали показатели: уровень ТГ, ИМТ, содержание ГГТП, ОТ, где ТГ — триглицериды, ИМТ — индекс массы тела, ГГТП — гамма-глутамилтранспептидаза, ОТ — окружность талии.
Значения индекса FLI находятся в интервале от 1 до 100. Показатель менее 30 говорит об отсутствии стеатоза печени; результат от 30 до 59 считается неопределенным; 60 и более — считается предиктором стеатоза (вероятность стеатоза>78%).
Некоторым включенным в исследование пациентам — в зависимости от технической возможности аппарата, — было проведено МРТ-исследование печени с использованием томографа GE 1.5T SIGNA CREATOR. Режим выполнения исследования — IDEAL-IQ, по результатам проводилась оценка последовательности FatFraction. Данная последовательность позволяет напрямую, без вторичного математического анализа оценивать в % значение доли жира на область печени [5].
Мы оценивали применимость и диагностическую эффективность индексов фиброза печени относительно фиброэластометрии, без использования золотого стандарта (биопсии печени). Диагностическая значимость индексов фиброза печени определялась путем построения характеристических кривых (ROC-анализ).
Статистический анализ
Для статистической обработки данных использовали пакет программ SPSS STATISTICS 23. Для проверки нормальности распределения признаков использовался критерий Колмогорова-Смирнова. Ряд показателей имел ненормальное распределение, в связи с чем мы приняли решение все количественные показатели представить медианой и интерквартильным диапазоном, Me [Q1; Q3]. Для оценки значимости различий показателей между независимыми группами сравнения использовали критерий Манна-Уитни, с пороговым уровнем значимости p<0,05. Корреляционные связи между признаками определяли с помощью коэффициента корреляции Спирмена. Сравнение частот бинарного признака в двух независимых группах осуществлялось с помощью двустороннего точного критерия Фишера или критерия χ² с поправкой Йейтса. Пороговый уровень статистической значимости составлял α=0,05.
Этическая экспертиза
Протокол исследования №9388 одобрен локальным этическим комитетом ФГБОУ ВО СибГМУ Минздрава России 27.02.2023 г. Все включенные пациенты дали добровольное информированное согласие на включение в исследование.
РЕЗУЛЬТАТЫ
В исследование включены 114 пациентов: 41 (36,0%) мужчина и 73 (64,0%) женщины. Пациенты были разделены на группы в зависимости от НУО: группа 1 — без НУО (n=52; 45,6% от общей выборки), группа 2 — НТГ (n=34; 29,8% от общей выборки), группа 3 — СД2 (n=28; 24,6% от общей выборки). Общая клиническая и лабораторная характеристика пациентов в зависимости от НУО представлена в табл. 1.
Таблица 1. Клиническая и лабораторная характеристика пациентов в зависимости от наличия и вида нарушений углеводного обмена
|
Параметры |
Группа 1 (без НУО) (n=52) |
Группа 2 (НТГ) (n=34) |
Группа 3 (СД2) (n=28) |
р между группами 1 и 2 |
р между группами 1 и 3 |
р между группами 2 и 3 |
|
Возраст, лет |
31,0 [ 22,0; 40,0] |
40,0 [ 35,5; 47,5] |
48,0 [ 41,5; 53,0] |
0,007 |
<0,0001 |
0,055 |
|
ИМТ, кг/м² |
33,7 [ 29,0; 37,0] |
34,0 [ 30,7; 38,1] |
38,00 [ 30,5; 46,3] |
0,268 |
0,151 |
0,450 |
|
ОТ, см |
102,0 [ 89,0; 111,0] |
104,5 [ 93,8; 112,0] |
102,0 [ 99,0; 128,0] |
0,482 |
0,143 |
0,245 |
|
ОБ, см |
115,0 [ 109,0; 124,0] |
114,0 [ 108,0; 124,3] |
125,0 [ 109,5; 131,0] |
0,893 |
0,315 |
0,610 |
|
ОТ/ОБ |
0,85 [ 0,78; 0,95] |
0,89 [ 0,83; 0,95] |
0,93 [ 0,89; 0,99] |
0,376 |
0,094 |
0,223 |
|
Инсулин крови натощак, мкМЕ/мл |
13,6 [ 8,90; 20,2] |
14,9 [ 12,0; 17,3] |
15,2 [ 10,7; 25,8] |
0,467 |
0,528 |
0,843 |
|
Индекс НОМА |
2,92 [ 2,03; 4,32] |
3,29 [ 2,89; 3,89] |
4,90 [ 2,94; 8,25] |
0,398 |
0,049 |
0,203 |
|
HbA1c, % |
5,40 [ 5,20; 5,60] |
5,60 [ 5,25; 6,10] |
6,60 [ 6,25; 7,35] |
0,084 |
<0,0001 |
0,001 |
|
Мочевая кислота, мкмоль/л |
0,34 [ 0,29; 0,41] |
0,37 [ 0,29; 0,48] |
0,43 [ 0,36; 0,53] |
0,402 |
0,042 |
0,247 |
|
ГГТП, Ед/л |
20,0 [ 13,0; 42,0] |
31,0 [ 26,0; 48,0] |
39,0 [ 27,0; 59,0] |
0,126 |
0,046 |
0,414 |
|
Аланинаминотрансфераза, Ед/л |
25,0 [ 16,0; 34,0] |
28,0 [ 19,5; 43,5] |
25,0 [ 16,0; 37,5] |
0,119 |
0,745 |
0,589 |
|
Аспартатаминотрансфераза, Ед/л |
20,0 [ 16,0; 26,8] |
22,0 [ 16,5; 33,0] |
21,0 [ 18,0; 27,0] |
0,395 |
0,596 |
0,850 |
|
Маркеры стеатоза и фиброза печени |
||||||
|
Индекс FLI |
76,0 [ 22,0; 91,0] |
92,0 [ 66,0; 94,0] |
97,0 [ 74,0; 99,0] |
0,086 |
0,032 |
0,340 |
|
АСТ/АЛТ |
0,91 [ 0,70; 1,18] |
0,68 [ 0,64; 1,03] |
0,76 [ 0,65; 1,26] |
0,082 |
0,569 |
0,434 |
|
Индекс FIB-4 |
0,50 [ 0,33; 0,71] |
0,59 [ 0,43; 0,83] |
0,73 [ 0,67; 0,91] |
0,137 |
0,004 |
0,063 |
|
Индекс APRI |
0,21 [ 0,15; 0,28] |
0,21 [ 0,15; 0,33] |
0,22 [ 0,17; 0,28] |
0,634 |
0,506 |
0,787 |
|
Индекс BARD |
2,0 [ 1,0; 3,0] |
1,0 [ 1,00; 3,00] |
2,00 [ 2,00; 4,00] |
0,552 |
0,069 |
0,055 |
|
Индекс NFS |
-2,94 [ -3,40; -2,19] |
-1,71 [ -2,13; -0,88] |
-0,77 [ -1,43; -0,34] |
<0,0001 |
<0,0001 |
0,038 |
Примечание. APRI — индекс отношения АСТ к тромбоцитам (AST to Platelet Ratio Index); BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes); FIB4 — индекс фиброза печени (index for liver fibrosis); FLI — индекс стеатоза печени (Fatty Liver Index); HbA1c — гликированный гемоглобин; НОМА — индекс инсулинорезистентности (Homeostasis Model Assessment); NFS — шкала оценки фиброза при НАЖБП (NAFLD Fibrosis Score); АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; ГГТП — гамма-глутамилтранспептидаза; НУО — нарушения углеводного обмена; НТГ — нарушенная толерантность к глюкозе; СД2 — сахарный диабет 2 типа; ОТ — окружность талии; ОБ — окружность бедер; ИМТ — индекс массы тела.
Пациенты, имевшие НУО — как НТГ, так и впервые выявленный СД2, — были значимо старше лиц без патологии углеводного обмена. Аналогичная тенденция имела место при сравнении больных СД2 и НТГ, однако статистическая достоверность для данных различий не была достигнута. Пациенты всех групп были сопоставимы и по ИМТ, и по соотношению ОТ/ОБ. Ожидаемо, самый высокий уровень HbA1c был получен в группе СД2, при этом различий между группами без НУО и с НТГ выявлено не было.
Индекс стеатоза печени FLI был значимо выше у лиц с СД2 в сравнении с пациентами без НУО, но не отличался от такового в группе предиабета, хотя очевидная тенденция нарастания индекса по мере прогрессирования патологии углеводного обмена имела место.
Хотя ни медиана, ни значения четвертого квартиля индекса фиброза FIB-4 не превышали 3,25 (референс, свидетельствующий о высоком риске фиброза) и даже не попадали в «серую зону» (1,45–3,25), показатель FIB-4 у пациентов с СД2 был значимо выше, чем в группе без НУО. Значения индекса APRI также находились в пределах, соответствующих низкому риску фиброза во всех группах и значимо не различались в зависимости от наличия и выраженности НУО. Поскольку расчет индекса BARD непосредственно основан на учете факта наличия СД, самые высокие средние значения и значения 75 перцентиля данного маркера были ожидаемо группе больных СД2, хотя и в группе лиц без НУО значения данного индекса фиброза превышали пороговые для установления высокого риска фиброза. В то же время значимых различий BARD между указанными группами мы не получили. Другой индекс фиброза, NFS, также включает в формулу расчета факт наличия у пациента СД или НТГ. Как и в случае BARD, ожидаемо наиболее высокие значения NFS отмечались в группе больных СД2. Кроме того, были получены значимые различия значений индекса в зависимости от состояния углеводного обмена: у лиц с СД2 индекс NFS был значимо выше, чем у лиц с НТГ, и значимо выше, чем в группе без НУО. У пациентов с НТГ значения NFS также достоверно превышали таковые в группе без НУО. При этом средние значения и значения 75 перцентиля данного индекса не достигали референса, свидетельствующего о высоком риске F3–4 фиброза (0,676) ни в одной из групп, хотя у лиц с СД находились в «серой зоне».
В табл. 2 приведена инструментальная характеристика пациентов в зависимости от состояния углеводного обмена — показатели жесткости печени по данным эластометрии, а также содержание жира в печени по данным МРТ.
Таблица 2. Инструментальная характеристика пациентов в зависимости от наличия и вида нарушений углеводного обмена
|
Параметры |
Группа 1 (без НУО) (n=52) |
Группа 2 (НТГ) (n=34) |
Группа 3 (СД2) (n=28) |
р между группами 1 и 2 |
р между группами 1 и 3 |
р между группами 2 и 3 |
|
Коэффициент жесткости печени, кПа |
6,90 [ 5,83; 7,70] |
7,50 [ 5,75; 8,00] |
6,10 [ 5,35; 6,60] |
0,569 |
0,071 |
0,079 |
|
FatFraction правой доли, % |
4,00 [ 3,00; 7,00] |
8,50 [ 3,75; 16,3] |
7,00 [ 3,00; 8,00] |
0,019 |
0,267 |
0,950 |
|
FatFraction левой доли, % |
3,00 [ 2,00; 5,25] |
8,00 [ 3,75; 16,0] |
6,00 [ 1,00; 7,25] |
0,016 |
0,577 |
0,659 |
Примечание. НУО — нарушения углеводного обмена; НТГ — нарушенная толерантность к глюкозе; СД2 — сахарный диабет 2 типа.
Показатели жесткости печени значимо не различались в зависимости от НУО. Без учета статистической достоверности максимальные значения жесткости печени были получены в группе НТГ.
Достоверные различия в содержании внутрипеченочного жира были получены для групп 1 и 2: показатель FatFraction был выше при НТГ. Интересно, что достоверных различий в указанных параметрах отложения жира в печени между группами без НУО и СД2 получено не было.
Среди всех включенных в исследование пациентов стеатогепатит встречался только в 15 (13,2%) случаев. В группе НТГ стеатогепатит встречался значимо чаще, чем в группах без НУО и СД2 (χ² Пирсона=11,278 р=0,024) (табл. 3).
Таблица 3. Частота случаев стеатогепатита в зависимости от наличия и вида нарушений углеводного обмена
|
Общая выборка (n=114) |
Группа 1 (без НУО) (n=52) |
Группа 2 (НТГ) (n=34) |
Группа 3 (СД2) (n=28) |
|
|
Нет стеатогепатита, n (%) |
99 (86,8) |
46 (88,5) |
27 (79,4) |
26 (92,8) |
|
Стеатогепатит минимальной активности, n (%) |
13 (11,4) |
6 (11,5) |
7 (20,6) |
0 (0) |
|
Стеатогепатит умеренной активности, n (%) |
2 (1,8) |
0 (0) |
0 (0) |
2 (7,2) |
Примечание. НУО — нарушения углеводного обмена; НТГ — нарушенная толерантность к глюкозе; СД2 — сахарный диабет 2 типа.
Несмотря на полученную статистическую значимость различий, результат проведенного частотного анализа представляется достаточно дискутабельным ввиду ограниченности выборки.
Интересно отметить, что индекс FLI менее 30, соответствующий низкому риску стеатоза печени, встречался только в группе лиц без НУО (n=16, 30,7% от общего количества пациентов в группе), тогда как в группах предиабета и СД2 все пациенты имели значения FLI в «серой зоне» (30–59) или зоне высокого риска стеатоза (≥60). Тем не менее значимых различий в структуре стеатоза в зависимости от наличия и типа НУО выявлено не было.
По данным расчета индекса фиброза BARD, высокий риск фиброза ожидаемо чаще выявлялся у пациентов с СД2 (χ² Пирсона=42,622 р<0,0001) (табл. 4).
Таблица 4. Частота выявления рисков фиброза печени по шкале BARD в зависимости от наличия и вида нарушений углеводного обмена
|
Общая выборка (n=114) |
Нет НУО (n=52) |
НТГ (n=34) |
СД2 (n=28) |
|
|
BARD 1, n (%) |
44 (38,6) |
21 (40,4) |
15 (44,1) |
8 (28,6) |
|
BARD 2, n (%) |
22 (19,3) |
8 (15,4) |
2 (5,9) |
12 (42,8) |
|
BARD 3, n (%) |
40 (35,1) |
23 (44,2) |
17 (50,0) |
0 (0) |
|
BARD 4, n (%) |
8 (7,0) |
0 (0) |
0 (0) |
8 (28,6) |
Примечание. BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes); НУО — нарушения углеводного обмена; НТГ — нарушенная толерантность к глюкозе; СД2 — сахарный диабет 2 типа.
Мы также установили, что высокий индекс BARD чаще встречался у пациентов женского пола (χ² Пирсона=8,021 р=0,005) (табл. 5).
Таблица 5. Частота выявления рисков фиброза по шкале BARD в зависимости от пола
|
Мужчины, n=41 |
Женщины, n=73 |
|
|
BARD 0–1 балла, n=44 (%) |
22 (50,0) |
22 (50,0) |
|
BARD 2–4 балла, n=70 (%) |
19 (27,1) |
51 (72,9) |
Примечание. BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes).
По структуре фиброза печени, согласно данным фиброэластометрии, группы пациентов без НУО и с НУО различной выраженности (предиабет и СД2) были сопоставимы (табл. 6).
Таблица 6. Частота выявления различных стадий фиброза печени по шкале METAVIR (УЗИ-эластометрия) в зависимости от наличия и вида нарушений углеводного обмена
|
УЗИ-эластометрия |
Общая выборка (n=114) |
Нет НУО (n=52) |
НТГ (n=34) |
СД2 (n=28) |
|
METAVIR 0, n (%) |
38 (33,3) |
16 (30,8) |
12 (35,3) |
10 (35,7) |
|
METAVIR 1, n (%) |
33 (28,9) |
14 (26,9) |
4 (11,8) |
15 (53,6) |
|
METAVIR 2, n (%) |
42 (36,8) |
21 (40,4) |
18 (52,9) |
3 (10,7) |
|
METAVIR 3, n (%) |
0 (0) |
0 (0) |
0 (0) |
0 (0) |
|
METAVIR 4, n (%) |
1 (1,0) |
1 (1,9) |
0 (0) |
0 (0) |
Примечание. METAVIR — система оценки фиброза и активности воспаления в печени (Meta-analysis of Histological Data in Viral Hepatitis); НУО — нарушения углеводного обмена; НТГ — нарушенная толерантность к глюкозе; СД2 — сахарный диабет 2 типа; УЗИ — ультразвуковое исследование.
С учетом того, что только по результатам расчета индекса BARD были получены значения, соответствующие высокому риску фиброза печени, мы повторно стратифицировали всех включенных пациентов в две группы: 1) с низким риском фиброза по шкале BARD (0–1 балла) и 2) с высоким риском фиброза по шкале BARD (2–4 балла). Во вновь сформированных группах мы провели сравнительный анализ отдельных параметров метаболического контроля и маркеров углеводного обмена (табл. 7).
Таблица 7. Параметры метаболического контроля и углеводного обмена в зависимости от риска фиброза печени по шкале BARD
|
Параметры |
Группа 1 BARD 0–1 балла, n=44 |
Группа 2 BARD 2–4 балла, n=70 |
р между группами 1 и 2 |
|
Возраст, лет |
23,0 [ 22,0; 40,0] |
40,0 [ 34,0; 45,0] |
0,005 |
|
ИМТ, кг/м² |
35,0 [ 31,0; 37,1] |
33,0 [ 29,0; 38,0] |
0,309 |
|
ОТ, см |
107,5 [ 99,3; 115,5] |
101,5 [ 89,3; 108,0] |
0,010 |
|
ОБ, см |
115,0 [ 112,0; 122,0] |
113,5 [ 109,0; 126,0] |
0,808 |
|
ОТ/ОБ |
0,94 [ 0,87; 0,98] |
0,85 [ 0,79; 0,91] |
0,001 |
|
Инсулин крови натощак, мкМЕ/мл |
16,1 [ 11,93; 27,88] |
12,6 [ 9,10; 17,08] |
0,015 |
|
Индекс HOMA |
3,65 [ 2,49; 5,82] |
2,95 [ 2,15; 3,86] |
0,079 |
|
HbA1c, % |
5,40 [ 5,20; 5,60] |
5,60 [ 5,30; 6,00] |
0,109 |
|
FatFraction правой доли, % |
7,00 [ 5,00; 14,00] |
4,00 [ 3,00; 7,75] |
0,012 |
|
FatFraction левой доли, % |
5,00 [ 4,00; 12,00] |
3,00 [ 2,00; 7,00] |
0,016 |
Примечание. BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes); HbA1c — гликированный гемоглобин; НОМА — индекс инсулинорезистентности (Homeostasis Model Assessment); ИМТ — индекс массы тела; ОТ — окружность талии; ОБ — окружность бедер.
Полученные результаты сравнительного анализа представляются не вполне ожидаемыми: пациенты с низким риском фиброза по шкале BARD имели более выраженный дисметаболический портрет: значимо большую ОТ и, соответственно, индекс ОТ/ОБ, более высокое содержание инсулина, более высокий индекс HOMA, хотя и без достижения статистической значимости, а также более высокое содержание жира в печени. Данные результаты не согласуются с имеющимися на текущий момент данными литературы и могут быть пересмотрены при расширении выборки исследования.
Пациенты с высоким риском фиброза, по результатам оценки BARD, были значимо старше лиц с низким риском. Согласно EASL, возраст >50 лет является одним из значимых факторов риска продвинутого (≥F2) фиброза печени наряду с фактом наличия у пациента СД2 [4]. Можно предположить, что для когорты больных НУО отрезное значение возраста как риск-фактора будет ниже, как и в представленных в табл. 7 результатах, а также предположить, что риск фиброза имеет сильную зависимость с длительностью диабета и возрастом дебюта СД.
Сравнение аналогичных показателей метаболического контроля и маркеров углеводного обмена в зависимости от индекса стеатоза печени FLI (группа 1 — низкий риск стеатоза печени, FLI <30, n=16; группа 2 — высокий риск стеатоза печени, FLI≥60, n=46) дало более предсказуемые результаты. Пациенты с высоким индексом FLI имели значимо большие ИМТ, ОТ, ОБ, соотношение ОТ/ОБ, содержание инсулина крови, индекс HOMA и содержание внутрипеченочного жира (табл. 8).
Таблица 8. Параметры метаболического контроля и углеводного обмена в зависимости от риска стеатоза печени по шкале FLI
|
Параметры |
Группа 1 FLI<30, n=16 |
Группа 2 FLI≥60, n=46 |
р между группами 1 и 2 |
|
ИМТ, кг/м² |
27,1 [ 26,0; 29,0] |
36,0 [ 33,2; 39,0] |
<0,0001 |
|
ОТ, см |
80,0 [ 78,5; 85,5] |
105,0 [ 101,5; 112,0] |
<0,0001 |
|
ОБ, см |
109,0 [ 107,0; 110,0] |
119,0 [ 112,00; 126,50] |
0,001 |
|
ОТ/ОБ |
0,75 [ 0,72; 0,79] |
0,91 [ 0,83; 0,97] |
<0,0001 |
|
Инсулин крови натощак, мкМЕ/мл |
8,50 [ 7,90; 14,80] |
14,9 [ 11,4; 20,2] |
0,028 |
|
Индекс HOMA |
2,00 [ 1,70; 3,26] |
3,37 [ 2,58; 5,21] |
0,015 |
|
HbA1c, % |
5,55 [ 5,30; 5,70] |
5,40 [ 5,20; 6,00] |
0,941 |
|
FatFraction правой доли, % |
2,00 [ 2,00; 3,00] |
6,00 [ 3,00; 15,00] |
0,002 |
|
FatFraction левой доли, % |
2,00 [ 2,00; 3,00] |
7,00 [ 2,00; 12,00] |
0,030 |
Примечание. FLI — индекс стеатоза печени (Fatty Liver Index); HbA1c — гликированный гемоглобин; НОМА — индекс инсулинорезистентности (Homeostasis Model Assessment); ИМТ — индекс массы тела; ОТ — окружность талии; ОБ — окружность бедер.
С целью установления возможных взаимосвязей между параметрами метаболического контроля, углеводного обмена и непрямыми индикаторами фиброза печени, мы провели корреляционный анализ (табл. 9).
Таблица 9. Корреляционные связи между индексами стеатоза, фиброза печени и параметрами метаболического контроля и углеводного обмена
|
Показатели |
Коэффициент Спирмена |
Индекс FLI |
Индекс FIB-4 |
Индекс APRI |
АСТ/АЛТ |
Индекс BARD |
Индекс NFS |
|
ИМТ |
r |
0,864 р<0,0001 |
ns |
0,306 р=0,007 |
-0,274 р=0,015 |
ns |
0,262 р=0,022 |
|
ОТ |
r |
0,860 р<0,0001 |
ns |
0,353 р=0,003 |
-0,446 р<0,0001 |
-0,244 р=0,039 |
ns |
|
ОБ |
r |
0,709 р<0,0001 |
ns |
0,323 р=0,006 |
ns |
ns |
ns |
|
ОТ/ОБ |
r |
0,598 р<0,0001 |
ns |
ns |
-0,494 р<0,0001 |
-0,325 р=0,005 |
ns |
|
Инсулин |
r |
0,468 р=0,001 |
ns |
ns |
ns |
ns |
ns |
|
Индекс НОМА |
r |
0,519 0,468 р=0,001 |
ns |
0,327 р=0,005 |
-0,307 р=0,007 |
ns |
ns |
|
HbA1c |
r |
0,302 р=0,037 |
0,400 р<0,0001 |
ns |
ns |
ns |
0,454 р<0,0001 |
|
Глюкоза натощак |
r |
ns |
0,276 р=0,021 |
ns |
ns |
0,277 р=0,019 |
0,266 р=0,020 |
|
Глюкоза ч/з 2 часа в ПГТТ |
r |
0,358 р=0,016 |
ns |
ns |
-0,246 р=0,038 |
ns |
0,298 р=0,013 |
|
FatFraction правой доли |
r |
0,627 р<0,0001 |
ns |
ns |
-0,404 р=0,002 |
ns |
ns |
|
FatFraction левой доли |
r |
0,431 р=0,022 |
ns |
ns |
-0,331 р=0,014 |
ns |
ns |
|
Индекс FLI |
r |
NA |
ns |
0,501 р<0,0001 |
-0,499 р<0,0001 |
ns |
ns |
Примечание. APRI — индекс отношения АСТ к тромбоцитам (AST to Platelet Ratio Index); BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes); FIB-4 — индекс фиброза печени (index for liver fibrosis); NFS — шкала оценки фиброза при НАЖБП (NAFLD Fibrosis Score); FLI — индекс стеатоза печени (Fatty Liver Index); HbA1c — гликированный гемоглобин; НОМА — индекс инсулинорезистентности (Homeostasis Model Assessment); АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза; ИМТ — индекс массы тела; ОТ — окружность талии; ОБ — окружность бедер; ПГТТ — пероральный глюкозотолерантный тест.
В отношении индекса стеатоза FLI были получены сильные положительные корреляционные связи с ИМТ, ОТ, ОБ, содержанием внутрипеченочного жира (по результатам МРТ), а также средней силы корреляции с соотношением ОТ/ОБ, содержанием инсулина крови и индексом HOMA. Индекс FLI также слабоположительно коррелировал с уровнем HbA1c, гликемией через 2 часа в ходе ПГТТ. Наличие взаимосвязей между расчетным индексом стеатоза печени и вышеупомянутыми параметрами метаболического и гликемического контроля в целом представляется ожидаемым и согласуется с данными мировой литературы.
С такими параметрами метаболического контроля, как ИМТ, ОБ, ОТ и индекс HOMA, слабоположительно коррелировал индекс APRI. С параметрами углеводного обмена, а именно HbA1c и гликемией натощак, слабоположительно коррелировал индекс FIB-4. Индекс NFS положительно коррелировал с ИМТ, HbA1c и гликемией, как натощак, так и постпрандиальной.
Интересно отметить, что коэффициент де Ритиса (соотношение АСТ/АЛТ) и основанный в том числе на его подсчете индекс BARD слабоотрицательно коррелировали с параметрами метаболического контроля. Этот результат корреляционного анализа перекликается с полученными нами результатами сравнительного анализа (табл. 7) и, несомненно, требует пересмотра на более широкой выборке пациентов.
Индекс стеатоза FLI положительно с умеренной силой коррелировал с единственным индексом фиброза — APRI, и отрицательно — с индексом BARD. В ходе работы нами также было отмечено наличие только очень слабых и слабых корреляционных связей между разными индексами фиброза.
Мы провели оценку диагностической значимости индексов фиброза относительно фиброэластометрии с применением построения характеристических кривых (ROC-анализ). С учетом того, что в нашей выборке пациентов, по результатам УЗИ-эластометрии, из клинически значимых стадий фиброза выявлялся только F2-фиброз (не считая единичного случая F4), оценивалась диагностическая значимость расчетных индексов FIB-4, APRI, BARD и NFS именно в выявлении F2-фиброза.
Результат ROC-анализа представлен на рис. 1 и 2.
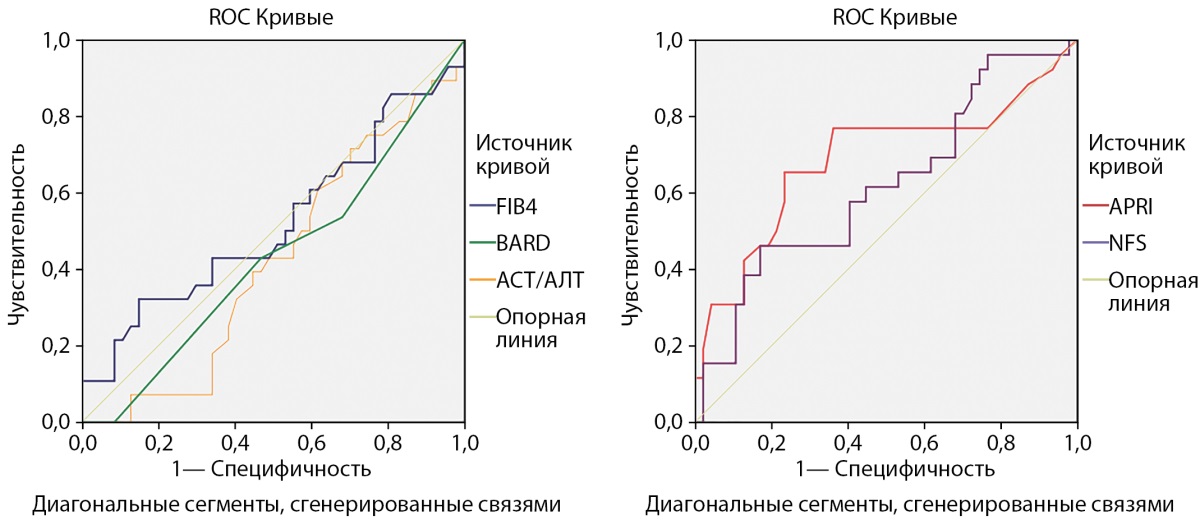
Рисунок 1. Информативность расчетных индексов фиброза печени относительно ультразвуковой эластометрии у пациентов с избыточной массой тела и ожирением независимо от состояния углеводного обмена.
Примечание. APRI — индекс отношения АСТ к тромбоцитам (AST to Platelet Ratio Index); BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes); FIB-4 — индекс фиброза печени (index for liver fibrosis); NFS — шкала оценки фиброза при НАЖБП (NAFLD Fibrosis Score); АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза.
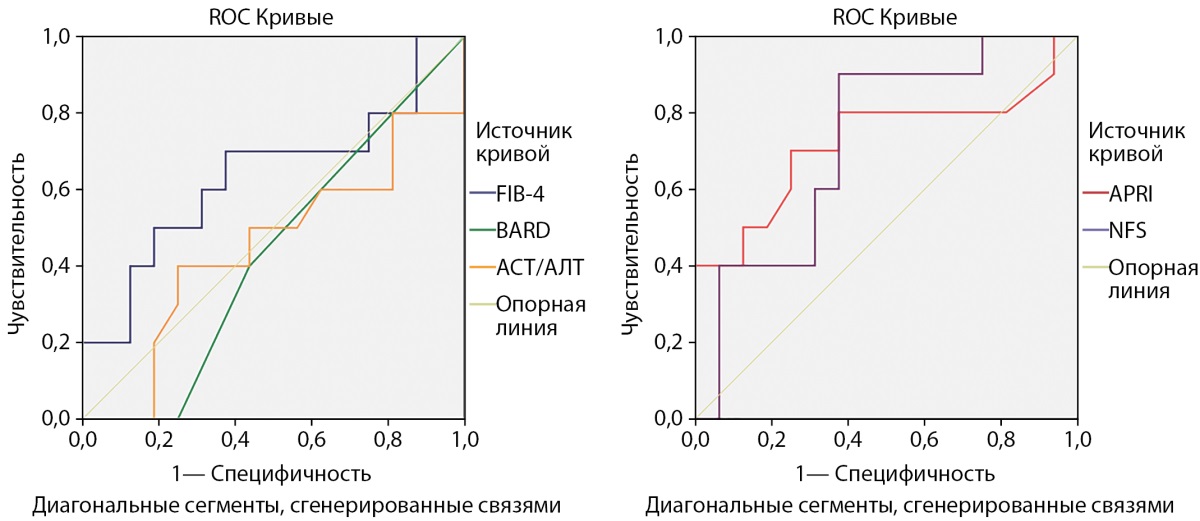
Рисунок 2. Информативность расчетных индексов фиброза печени относительно ультразвуковой эластометрии у пациентов с избыточной массой тела и ожирением и нарушениями углеводного обмена.
Примечание. APRI — индекс отношения АСТ к тромбоцитам (AST to Platelet Ratio Index); BARD — шкала оценки фиброза печени при НАЖБП (BARD Score: BMI, AST/ALT ratio, Diabetes); FIB-4 — индекс фиброза печени (index for liver fibrosis); NFS — шкала оценки фиброза при НАЖБП (NAFLD Fibrosis Score); АСТ — аспартатаминотрансфераза; АЛТ — аланинаминотрансфераза.
В общей выборке лиц (n=114) информативным оказался только индекс APRI: чувствительность — 76,9%, специфичность — 63,8% при диагностическом пороге 0,21 (площадь под кривой=0,687 р=0,008, рис. 1).
При оценке информативности тех же индексов фиброза в группе пациентов с НУО — и НТГ, и СД2 — (n=62), не было достигнуто уровней статистической достоверности. Так, для APRI чувствительность составила 80,0%, специфичность — 62,5% при аналогичном диагностическом пороге 0,21 (площадь под кривой=0,722 р=0,061), для NFS чувствительность составила 90,0%, специфичность — 62,5% при аналогичном диагностическом пороге -1,68 (площадь под кривой=0,725 р=0,058) (рис. 2).
Из представленных и обсуждаемых в данной статье расчетных индексов фиброза печени наиболее перспективным в применении у пациентов с НУО на данный момент представляется индекс APRI. Использование индекса BARD в неинвазивной диагностике фиброза печени в данной когорте пациентов видится пока сомнительным и однозначно требует изучения на больших выборках больных НТГ и СД2.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Для установления объема выборки мы использовали несколько стратегий:
1) табличный метод К.А. Отдельновой: необходимый объем выборки для проведения исследования средней точности с учетом уровня значимости p=0,05, составил 100 человек;
2) калькулятор расчета выборки: при выборе доверительной вероятности, равной 95%, а доверительного интервала, равному 5%, необходимый размер репрезентативной выборки составил от 383 человек;
3) дополнительно в ходе исследования использована последовательная стратегия расчета объема выборки с учетом коэффициента вариации (среднеквадратичное отклонение от среднеарифметического в процентах), которая показала, что необходимый объем выборки составляет от 71 человека. Выборка исследования представляется репрезентативной, однако для повышения точности результатов ведется работа над ее расширением.
Сопоставление с другими публикациями и клиническая значимость результатов
В обсуждении результатов данного исследования стоит отметить отсутствие традиционных различий между группами лиц без НУО, группой предиабета и СД2 — в соотношении ОТ/ОБ, ИМТ, уровне инсулинемии и инсулинорезистентности. Это обусловлено особенностями выборки и, в частности, «портретом» группы 3 — ранний диабет с умеренной гипергликемией, — по сути, сходным с «портретом» группы 2. Данные особенности выборки объясняют и отсутствие значимых различий индекса стеатоза FLI между лицами с предиабетом и СД2, а также отсутствие различий в частоте случаев низкого и высокого риска стеатоза по результатам расчета FLI. В то же время полученные нами результаты свидетельствуют о более высоком индексе стеатоза у пациентов с СД2 в сравнении с таковым в группе без НУО, а также о наличии прочной ассоциации данного индекса с ожирением, инсулинорезистентностью и гликемией. Эти результаты сопоставимы с данными мировой литературы, показавшими, что высокий индекс FLI является предиктором развития НАЖБП, предиабета, СД2, а также надежным предиктором конверсии предиабета в СД2 [6][7][8].
Результаты оценки индексов фиброза печени у лиц в зависимости от наличия и выраженности НУО представляется более дискутабельной. В нашем исследовании мы проводили оценку индексов фиброза печени, доступных для широкого использования в рутиной клинической практике и рекомендованных вышеупомянутыми клиническими рекомендациями и консенсусами Европы, США и Российской Федерации [1][3][4].
Согласно всем действующим рекомендациям и консенсусам, для диагностики фиброза печени в когорте больных предиабетом и СД2 применимы те же неинвазивные маркеры, что и в общей популяции. Однако, как уже упоминалось, в расчете некоторых из этих индексов заложен факт наличия НУО у пациента. В связи с этим актуально проведение исследований, направленных на установление диагностической значимости неинвазивных маркеров фиброза для популяции лиц с различными НУО. Подобные исследования на данный момент единичны.
В российской литературе I.G. Bakulin и соавт. опубликованы два последовательных исследования, целью которых стала скрининговая оценка стеатоза и фиброза печени у пациентов с СД2 с применением неинвазивных методов фиброэластометрии и коммерческих панелей — фибротестов [9][10]. Принципиальными отличиями выборки коллег являются старший возраст больных (до 82 лет) и большая вариабельность в отношении длительности СД, вероятно, обусловившие большую частоту значимого (F2–F4) фиброза, как по данным эластометрии, так и по результатам фибротестов [10]. В указанном исследовании не было выявлено корреляционных связей между ИМТ и показателями фибротестов, тогда как, согласно нашим результатам, ИМТ положительно коррелировал и с индексом стеатоза FLI, и с одним из индексов фиброза — APRI. Кроме того, в исследованиях российских коллег [9][10] не было выявлено корреляций между стеатозом и фиброзом, установленными на основании фибротестов, в то время как наши результаты свидетельствуют о наличии взаимосвязи между индексами FLI и APRI. I.G. Bakulin и соавт. также не использовали в качестве золотого стандарта биопсию печени. Авторы оценивали информативность двух неинвазивных методов — фиброэластометрии и фибротестов — друг относительно друга и показали, что точность этих методов сопоставима. Для фибротестов чувствительность составила 55%, а специфичность — 82%, при этом значения площади под кривой нарастали по мере прогрессирования фиброза от F0 до F4 и, в частности, для F2 составили 0,56 [9][10]. Это значение ниже полученного нами в ходе собственного исследования для индекса APRI. Авторами было сделано заключение, что достоверность фибротестов является очень хорошей для стадии F4, но неудовлетворительной для стадий F0–1 и F2–3 [9][10]. В отличие от исследования российских коллег мы оценивали диагностическую значимость не коммерческих панелей, а отдельных наиболее валидизированных тестов, и показали, что для когорты больных НУО наиболее перспективным в выявлении F2 фиброза представляется индекс APRI. Оценить информативность индексов в отношении более прогрессивных стадий фиброза нам не удалось ввиду ограниченности выборки и количества случаев ≥F3 внутри нее. Еще одним фактором, обуславливающим более высокую частоту выявления продвинутых стадий фиброза в выборке коллег в сравнении с нашей выборкой больных, может быть распространенность и тяжесть ХСН у пациентов. ХСН, как известно, является одним из факторов риска развития и прогрессирования НАЖБП по стадиям «печеночного континуума» «стеатоз – стеатогепатит – фиброз – цирроз – гепатоцеллюлярная карцинома», а также рассматривается в качестве одного из коморбидных НАЖБП-состояний [1][11]. I.G. Bakulin и соавт. в своей работе не приводят характеристики выборки больных относительно ХСН, однако, с учетом старшего возраста включения, можно предположить, что пациенты в большинстве своем страдали данной патологией. Мы стремились создать максимально «чистую» выборку с целью оценки взаимного влияния НУО и НАЖБП. Стоит также отметить, что других исследований, направленных на оценку диагностической значимости неинвазивных расчетных индексов фиброза у лиц с патологией углеводного обмена, в отечественной литературе не представлено.
Наиболее валидизированный и не включающий в формулу расчета наличие НУО индекс FIB-4 не только не показал высокой диагностической значимости в выявлении фиброза в нашем исследовании, но и находился в диапазоне низкого риска — как в общей выборке, так и в группах НТГ и СД2. Тот факт, что традиционно используемые расчетные тесты фиброза, включая валидизированные АСТ/АЛТ, FIB-4 и NFS, могут иметь низкую чувствительность и отрицательную прогностическую ценность для выявления фиброза печени у пациентов с диабетом, уже обсуждался ранее [12][13][14]. Amandeep Singh с соавт. была разработана новая прогностическая модель «Шкала фиброза печени при диабете» (DLFS) включающая такие параметры, как возраст, наличие артериальной гипертензии, хронической болезни почек, использование антилипидемических препаратов, количество тромбоцитов и АСТ [14]. Авторы апробировали собственную модель на 592 пациентах с сочетанием СД2 и НАЖБП, показав, что DLFS превосходит используемые в настоящее время шкалы фиброза и может помочь в выявлении пациентов с диабетом, имеющих значительный риск заболеваний, связанных с печенью.
Ограничения исследования
Основным ограничением исследования является численность выборки. Данное ограничение обусловлено не только фактом начала набора пациентов, но и стремлением создать максимально «чистую» выборку, которая позволит оценить клинико-лабораторные ассоциации индексов печеночного стеатоза и фиброза у пациентов с избыточной массой тела и ожирением в зависимости от наличия и типа НУО, установить диагностическую значимость отдельных индексов стеатоза и фиброза в данной когорте пациентов без влияния сторонних факторов, обладающих высокой значимостью в формировании фиброза, таких как возраст и ХСН. В настоящее время продолжается работа над расширением объема выборки исследования.
Направления дальнейших исследований
В продолжении работы на расширенном объеме выборки пациентов планируется изучение диагностической значимости неинвазивных фибротестов в выявлении более продвинутых стадий фиброза (F3–4) у пациентов с избыточной массой тела и ожирением в зависимости от наличия и вида НУО. В перспективе исследования мы также рассчитываем изучить вклад различных нарушений обмена железа (латентного дефицита железа, анемии, дисметаболической перегрузки железом и/или изолированной гиперферритинемии) в прогрессирование НАЖБП и формирование фиброза печени.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенное нами исследование является актуальным с позиции продолжающегося поиска доступных в широкой клинической практике неинвазивных и при этом обладающих высокой диагностической значимостью в специфичной когорте больных НУО маркеров фиброза печени при НАЖБП/МАЖБП. Полученные результаты не претендуют на масштабность, но обладают несомненной научной новизной ввиду уникальности выборки — больные с ранними НУО, и методологического подхода — установления информативности отдельных непатентованных индексов фиброза в зависимости от типа НУО, и, соответственно, могут внести вклад в мировой пул данных, полученных при изучении проблемы диагностики и стадирования НАЖБП у пациентов с СД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Мусина Н.Н. — участие в разработке концепции и дизайна исследования, сбор и анализ полученных данных, написание статьи; Петрухина Д.А. — сбор и анализ полученных данных, написание статьи; Славкина Я.С. — сбор и анализ полученных данных, написание статьи; Родионова О.В. — анализ полученных данных, обоснование рукописи и проверка критически важного интеллектуального содержания, внесение правок с целью повышения научной ценности текста; Алибиев Д.Е. — сбор и анализ полученных данных, написание статьи; Фомина С.В. — анализ полученных данных, обоснование рукописи и проверка критически важного интеллектуального содержания, внесение правок с целью повышения научной ценности текста; Зима А.П. — разработка концепции и дизайна исследования, анализ полученных данных; обоснование рукописи и проверка критически важного интеллектуального содержания; Саприна Т.В. — разработка концепции и дизайна исследования, анализ полученных данных, обоснование рукописи и проверка критически важного интеллектуального содержания, внесение правок с целью повышения научной ценности текста.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Маевская М.В., Котовская Ю.В., Ивашкин В.Т., и др. Национальный Консенсус для врачей по ведению взрослых пациентов с неалкогольной жировой болезнью печени и ее основными коморбидными состояниями. // Терапевтический архив. — 2022. — Т. 94. — № 2. — С. 216–253. doi: https://doi.org/10.26442/00403660.2022.02.201363
2. Ajmera V, Cepin S, Tesfai K, et al. A prospective study on the prevalence of NAFLD, advanced fibrosis, cirrhosis and hepatocellular carcinoma in people with type 2 diabetes. J Hepatol. 2023;78(3):471- 478. doi: https://doi.org/10.1016/j.jhep.2022.11.010
3. Rinella ME, Neuschwander-Tetri BA, Siddiqui MS, et al. AASLD Practice Guidance on the clinical assessment and management of nonalcoholic fatty liver disease. Hepatology. 2023;77(5):1797-1835. doi: https://doi.org/10.1097/HEP.0000000000000323
4. European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of nonalcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-1402. doi: https://doi.org/10.1016/j.jhep.2015.11.004
5. Szczepaniak LS, Nurenberg P, Leonard D, et al. Magnetic resonance spectroscopy to measure hepatic triglyceride content: prevalence of hepatic steatosis in the general population. Am J Physiol Endocrinol Metab. 2005;288(2):E462-E468. doi: https://doi.org/10.1152/ajpendo.00064.2004
6. Cuthbertson DJ, Koskinen J, Brown E, et al. Fatty liver index predicts incident risk of prediabetes, type 2 diabetes and non-alcoholic fatty liver disease (NAFLD). Ann Med. 2021;53(1):1256-1264. doi: https://doi.org/10.1080/07853890.2021.1956685
7. Kaneva AM, Bojko ER. Fatty liver index (FLI): more than a marker of hepatic steatosis. J Physiol Biochem. 2024;80(1):11-26. doi: https://doi.org/10.1007/s13105-023-00991-z
8. Busquets-Cortés C, Bennasar-Veny M, López-González AA, et al. Fatty liver index and progression to type 2 diabetes: a 5-year longitudinal study in Spanish workers with pre-diabetes. BMJ Open. 2021;11(8):e045498. doi: https://doi.org/10.1136/bmjopen-2020-045498
9. Бакулин И.Г., Винницкая Е.В., Сандлер Ю.Г., и др. Оценка фиброза печени у пациентов с сахарным диабетом // Фарматека. — 2016. — №2. — С.43-48.
10. Бакулин И. Г., Сандлер Ю. Г., Винницкая Е. В., и др. Сахарный диабет и новый взгляд на проблему: от стеатоза к фиброзу печени // Доктор.Ру. — 2016. — Т. 10. — № 127. — С.16–22.
11. Cтолбова С.К., Драгомирецкая Н.А., Беляев Ю.Г., Подзолков В.И. Клинико-лабораторные ассоциации индексов печеночного фиброза у больных с декомпенсацией хронической сердечной недостаточности II–IV функциональных классов // Кардиология. — 2020. — Т.60. — №5. — С.90–99. doi: https://doi.org/10.18087/cardio.2020.5.n920
12. Bertot LC, Jeffrey GP, de Boer B, et al. Diabetes impacts prediction of cirrhosis and prognosis by non-invasive fibrosis models in non-alcoholic fatty liver disease. Liver Int. 2018;38(10):1793-1802. doi: https://doi.org/10.1111/liv.13739
13. Singh A, Gosai F, Siddiqui MT, et al. Accuracy of noninvasive fibrosis scores to detect advanced fibrosis in patients with type-2 diabetes with biopsy-proven nonalcoholic fatty liver disease. J Clin Gastroenterol. 2020;54(10):891-897. doi: https://doi.org/10.1097/MCG.0000000000001339
14. Singh A, Garg R, Lopez R, Alkhouri N. Diabetes liver fibrosis score to detect advanced fibrosis in diabetics with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2022;20(3):e624-e626. doi: https://doi.org/10.1016/j.cgh.2021.01.010
Об авторах
Н. Н. МусинаРоссия
Мусина Надежда Нурлановна, к.м.н., кафедра факультетской терапии с курсами эндокринологии и клинической фармакологии, ассистент
634050, Томск, Московский тракт, д. 2
Д. А. Петрухина
Россия
Петрухина Дарья Андреевна, аспирант, кафедра факультетской терапии с курсами эндокринологии и клинической фармакологии
Томск
Я. С. Славкина
Россия
Славкина Яна Сергеевна, аспирант, кафедра факультетской терапии с курсами эндокринологии и клинической фармакологии
Томск
О. В. Родионова
Россия
Родионова Оксана Валерьевна, к.м.н., врач-рентгенолог, отделение томографических методов исследования
Томск
Д. Е. Алибиев
Россия
Алибиев Думан Ерланович
Кафедра лучевой диагностики и лучевой терапии
Томск
С. В. Фомина
Россия
Фомина Светлана Викторовна, к.м.н., заведующий отделением тделением ультразвуковой диагностики
Томск
А. П. Зима
Россия
Зима Анастасия Павловна, д.м.н., профессор, кафедра патофизиологии, централизованная клинико-диагностическая лаборатория, заведующий
Томск
Т. В. Саприна
Россия
Саприна Татьяна Владимировна, д.м.н., профессор, кафедра факультетской терапии с курсами эндокринологии и клинической фармакологии, эндокринологическая клиника, заведующий клиникой
Томск
Дополнительные файлы
|
|
1. Рисунок 1. Информативность расчетных индексов фиброза печени относительно ультразвуковой эластометрии у пациентов с избыточной массой тела и ожирением независимо от состояния углеводного обмена. | |
| Тема | ||
| Тип | Результаты исследования | |
Посмотреть
(497KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Информативность расчетных индексов фиброза печени относительно ультразвуковой эластометрии у пациентов с избыточной массой тела и ожирением и нарушениями углеводного обмена. | |
| Тема | ||
| Тип | Результаты исследования | |
Посмотреть
(492KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мусина Н.Н., Петрухина Д.А., Славкина Я.С., Родионова О.В., Алибиев Д.Е., Фомина С.В., Зима А.П., Саприна Т.В. Применение индексов стеатоза и фиброза печени у пациентов с избыточной массой тела и ожирением в зависимости от наличия нарушений углеводного обмена. Сахарный диабет. 2025;28(2):175-186. https://doi.org/10.14341/DM13229
For citation:
Musina N.N., Petrukhina D.A., Slavkina Y.S., Rodionova O.V., Alibiev D.E., Fomina S.V., Zima A.P., Saprina T.V. Use of liver steatosis and fibrosis indices in overweight and obese patients with or without carbohydrate metabolism disorders. Diabetes mellitus. 2025;28(2):175-186. (In Russ.) https://doi.org/10.14341/DM13229

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































