Перейти к:
Ингибиторы натрий-глюкозного котранспортера 2 типа как потенциальные противоонкогенные средства
https://doi.org/10.14341/DM13224
Аннотация
Онкологические заболевания являются одной из ведущих причин смертности в мире. Несмотря на интенсивный поиск новых методов по увеличению эффективности и безопасности противоопухолевой терапии и снижению резистентности к ней со стороны злокачественных опухолей, вопросы лечения по-прежнему остаются открытыми в клинической онкологии. В данном обзоре произведен анализ экспериментальных данных, свидетельствующих об антинеопластическом эффекте ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2): приведены основания, по которым иНГЛТ-2 возможно использовать для лечения злокачественных опухолей, определена класс-специфичность и дозозависимость антинеопластического эффекта лекарственных препаратов. В деталях описаны возможные механизмы противоопухолевого эффекта глифлозинов, среди которых, помимо снижения поступления глюкозы в опухолевые клетки, существенную роль играют ингибирование сигнального пути Wnt/β-катенин, усиление активности АМФ-активируемой протеинкиназы с последующим изменением липидного профиля опухолевых клеток и ингибированием протеинкиназы mTOR (mammalian target of rapamycin), нарушение синтеза ДНК и РНК в клетках злокачественных опухолей и др. Значительное место уделено проонкогенному эффекту иНГЛТ-2, неоспоримому ранее и опровергнутому сегодня, а также взаимодействию данного класса противодиабетических средств с другими методами противоопухолевого лечения в контексте эффективности, безопасности и терапевтической резистентности.
Ключевые слова
Для цитирования:
Радкевич Е.Р., Северина А.С., Шамхалова М.Ш., Шестакова М.В. Ингибиторы натрий-глюкозного котранспортера 2 типа как потенциальные противоонкогенные средства. Сахарный диабет. 2025;28(2):243-251. https://doi.org/10.14341/DM13224
For citation:
Radkevich E.R., Severina A.S., Shamkhalova M.S., Shestakova M.V. Sodium-glucose cotransporter 2 inhibitors as potential anticancer agents. Diabetes mellitus. 2025;28(2):243-251. (In Russ.) https://doi.org/10.14341/DM13224
Ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) достаточно недавно, но при этом прочно заняли свою нишу в мировой и отечественной диабетологии. Однако данный класс препаратов продолжает привлекать внимание ученых не только своим доказанным во многих исследованиях сахароснижающим действием, но и рядом негликемических (гемодинамических, метаболических, органопротективных) эффектов, которые способствуют снижению общей смертности, в частности от кардиоваскулярных заболеваний [1][2]. Основной группой пациентов, получающих иНГЛТ-2, являются лица с сахарным диабетом 2 типа (СД2), принимающие препарат данного класса как для снижения уровня глюкозы в крови, так и для кардио- и нефропротекции.
Стоит отметить, что СД увеличивает риск развития онкологических процессов посредством гипергликемии, гиперинсулинемии, оксидативного стресса, хронического воспаления, неблагоприятного влияния генетических факторов [3][4]. Изучение различных эффектов относительно новых противодиабетических препаратов, иНГЛТ-2, становится актуальным не только в эндокринологии, кардиологии и нефрологии, но и в онкологии. Так, например, на данный момент проводятся несколько исследований, направленных на изучение эффективности дапаглифлозина в комбинированной противоопухолевой терапии [5][6]. Но насколько оправдано использование иНГЛТ-2 в лечении злокачественных новообразований? Авторы обзора с разных сторон изучают вопрос потенциального применения глифлозинов в комбинированной противоопухолевой терапии.
ПРООНКОГЕННЫЙ ЭФФЕКТ ИНГИБИТОРОВ НГЛТ-2
На данный момент многими современными клиническими исследованиями подтверждено отсутствие повышения онкологической заболеваемости при применении иНГЛТ-2 [7][8]. Однако стоит отметить, что в недавнем прошлом ученые делали противоположные выводы. Так, в исследовании S. De Jonghe и соавт. описано увеличение частоты развития феохромоцитом, новообразований почек и тестикулярных опухолей из клеток Лейдига у крыс при использовании иНГЛТ-2 [9]. Существует также целый ряд других исследований, проводившихся на мышах и крысах с применением иНГЛТ-2, которые демонстрировали увеличение заболеваемости злокачественными новообразованиями в связи с использованием глифлозинов [10][11].
В своей работе M. Dutka и соавт., ссылаясь на исследование H.W. Lin и соавт., приводят данные, что первые исследования влияния дапаглифлозина на человеческий организм позволяли предполагать значительное увеличение риска развития рака молочной железы (РМЖ) у пациенток, получающих этот препарат [12][13]. Отечественные и зарубежные авторы также отмечали увеличение риска развития рака мочевого пузыря при использовании препаратов класса иНГЛТ-2, в связи с чем глифлозины не рекомендовались к приему пациентам с новообразованиями мочевого пузыря в анамнезе [7][8][14].
По данным более поздних исследований, увеличение количества случаев РМЖ было связано с его наличием в анамнезе, а не с влиянием дапаглифлозина на риск возникновения и прогрессирования данного заболевания [12][13]. Это было подтверждено и другими работами — например, исследованием, в котором изучалось применение всех иНГЛТ-2, включая дапаглифлозин, у женщин с СД2, применяющих ингибиторы дипептидилпептидазы-4 [15]. В развитии рака мочевого пузыря роль дапаглифлозина также была исключена, несмотря на предполагаемое влияние глюкозурии, часто встречающейся при приеме препарата, на возникновение онкологических заболеваний мочевого пузыря [13][16].
ПРОТИВООПУХОЛЕВЫЙ ЭФФЕКТ ИНГИБИТОРОВ НГЛТ-2: КЛАСС-ЭФФЕКТ ИЛИ СПЕЦИФИКА ОТДЕЛЬНЫХ ПРЕПАРАТОВ?
Механизм сахароснижающего эффекта одинаков для всех препаратов класса глифлозинов, однако целый ряд фармакодинамических и фармакокинетических параметров отличает отдельных представителей данного семейства. Среди отличительных свойств можно, например, выделить сродство препаратов к НГЛТ-2, значения биодоступности и периода полувыведения и др. [17]. Эти отличия следует учитывать не только при прогнозировании основного терапевтического эффекта иНГЛТ-2, но и при оценке плейотропных эффектов препаратов.
Помимо этого, различаются глифлозины по спектру оказываемых эффектов. Так, M. Dutka и соавт. сообщают, что канаглифлозин по сравнению с дапаглифлозином снижает клоногенную активность и выживаемость опухолевых клеток у мышей при раке печени, легкого, молочной и предстательной желез [12]. Опубликованы результаты исследований, подтверждающие успешность применения дапаглифлозина для лечения различных злокачественных новообразований у человека (например, почечно-клеточного рака [18] или метастатического рака поджелудочной железы [19]). Перспективным также кажется использование иНГЛТ-2 (например, тофоглифлозина) не только для лечения гепатоцеллюлярной карциномы (ГЦК), но и для предотвращения ее образования у людей, страдающих СД2 (участвующим в патогенезе ГЦК) и неалкогольным стеатогепатитом (способным прогрессировать в ГЦК). При этом механизмы подобной профилактики заключаются в гипогликемическом эффекте иНГЛТ-2, в вызываемом ими снижении веса пациентов, в ослаблении хронического воспалительного процесса и усилении антиоксидантных возможностей организма [20][21][22]. При уже развившейся ГЦК последние исследования доказали эффективность комбинации эмпаглифлозина с метформином, которые с помощью множества различных механизмов ингибируют сигнальный путь NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells), значимый для дальнейшего прогрессирования данного злокачественного образования [23].
ПРЕДПОСЫЛКИ ИЗУЧЕНИЯ ПОТЕНЦИАЛЬНОГО ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА ИНГИБИТОРОВ НГЛТ-2
1. Эффект Варбурга, заключающийся в преобладании анаэробного гликолиза над аэробным распадом глюкозы в злокачественных клетках. Эта особенность опухолевых клеток связана со значительной дисфункцией митохондрий в них, что не позволяет утилизировать глюкозу с помощью окисления [24]. Метаболически гиперактивные раковые клетки вынуждены в таком случае переходить на менее энергетически эффективный анаэробный гликолиз, компенсируя недостаточное образование молекул АТФ высокими темпами потребления и разложения глюкозы [25].
2. Чрезмерная экспрессия глюкозных транспортеров GLUT и НГЛТ-2 опухолевыми клетками при раке простаты, легкого, поджелудочной железы и др., что, вероятно, является необходимым условием для метаболического перепрограммирования подобных клеток [16][26–30].
3. Проонкогенное действие гипергликемии и развивающейся на ее фоне инсулинорезистентности. Подобные изменения, вызывая оксидативный стресс и хронический воспалительный процесс, меняют микроокружение клеток и приводят к появлению мутаций [3][4].
4. Снижение уровня глобулина, связывающего половые гормоны (Sex Hormone-Binding Globulin; SHBG), на фоне гипергликемии и гиперинсулинемии. Сопутствующее закономерное повышение концентрации половых гормонов увеличивает вероятность развития гормонально-чувствительных опухолей [31].
Механизмы противоопухолевого эффекта ингибиторов НГЛТ-2 представлены на рис. 1.
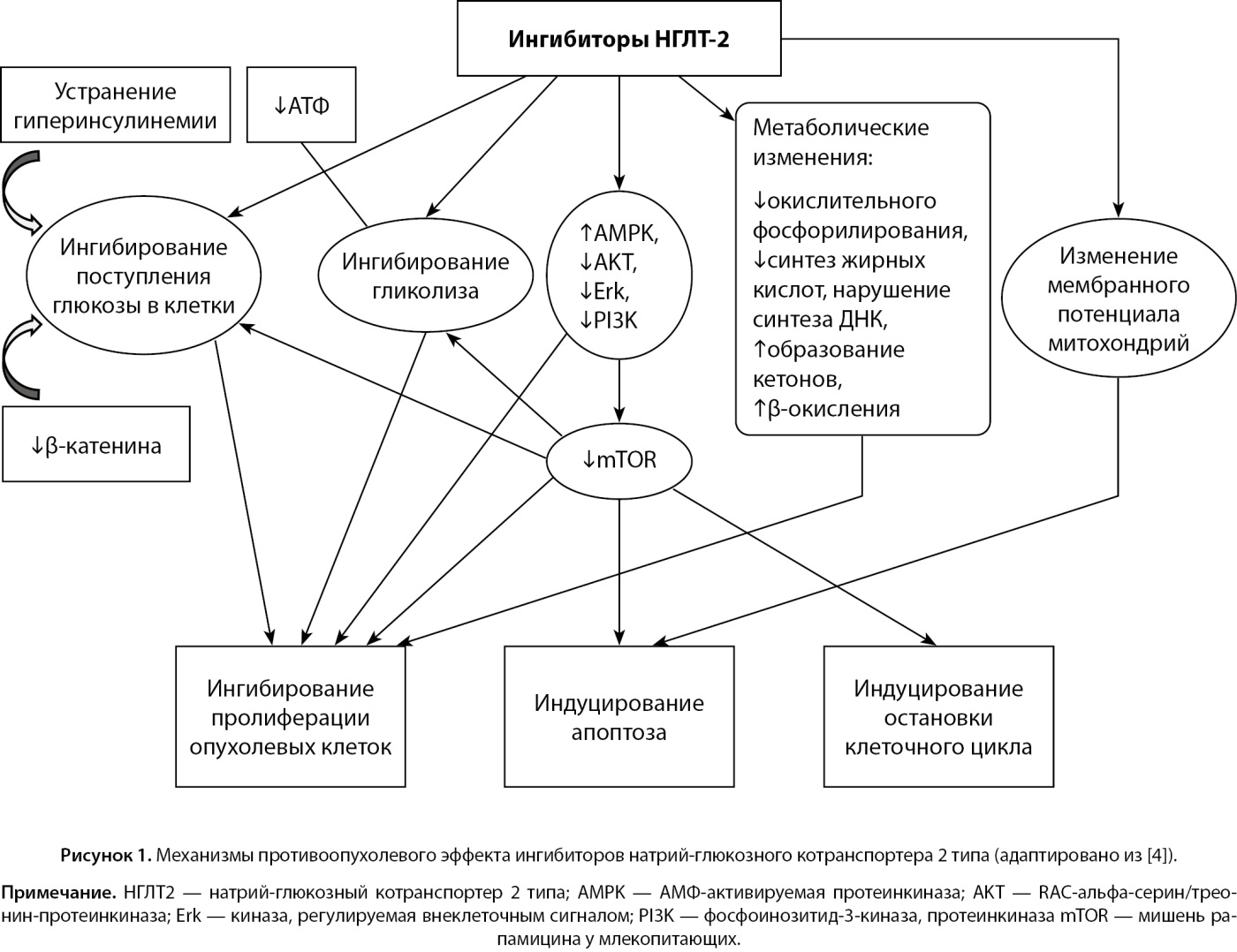
Рисунок 1. Механизмы противоопухолевого эффекта ингибиторов натрий-глюкозного котранспортера 2 типа (адаптировано из [4]).
Примечание. НГЛТ2 — натрий-глюкозный котранспортер 2 типа; AMPK — АМФ-активируемая протеинкиназа; AKT — RAC-альфа-серин/трео нин-протеинкиназа; Erk — киназа, регулируемая внеклеточным сигналом; PI3K — фосфоинозитид-3-киназа, протеинкиназа mTOR — мишень ра памицина у млекопитающих.
I. Ингибирование НГЛТ-2
При сверхэкспрессии НГЛТ-2 и различных транспортеров GLUT в злокачественных клетках оправданным кажется стремление заблокировать данные переносчики глюкозы и, таким образом, лишить опухоль метаболического субстрата. Однако проведенные ранее попытки ингибировать GLUT оказались непригодными для клинического применения, поскольку здоровые клетки тоже нуждаются в этих переносчиках для поддержания своей биологической активности [12]. В таком случае НГЛТ-2 представляется более подходящей мишенью для противоопухолевой терапии — данный транспортер в основном функционирует лишь в проксимальных канальцах почек, его ингибирование не только не приносит вред организму, но, наоборот, с успехом используется для лечения СД2. Однако на данный момент получены сведения, что наличие или отсутствие глюкозы в той среде, в которой находится опухолевая клетка, не влияет на выраженность антипролиферативного эффекта иНГЛТ-2 [32]. По-видимому, снижение поступления глюкозы в злокачественные клетки с помощью блокирования НГЛТ-2 является далеко не единственным механизмом антинеопластического эффекта глифлозинов. Так, например, эмпаглифлозин и дапаглифлозин, имеющие более высокое сродство к НГЛТ-2, чем канаглифлозин, оказывают, тем не менее, не столь выраженный антипролиферативный эффект [12].
II. Ингибирование сигнального пути Wnt/β-катенин (рис. 2)
В клетках ГЦК канаглифлозин демонстрирует ингибирующий эффект на сигнальный путь Wnt/β-катенин. Функционирование данного сигнального пути, необходимого опухолевым клеткам для более эффективного метаболизма и развития, зависит от количества глюкозы в клетке: чем больше глюкозы — тем активней сигнальный путь Wnt/β-катенин [12]. Канаглифлозин, снижая концентрацию глюкозы в клетках, а также напрямую блокируя взаимодействие гликопротеина Wnt с предшественником транскрипционного фактора β-катенина и ингибируя активность протеинфосфатазы 2A, опосредованно вызывает фосфорилирование β-катенина [12][30]. Фосфорилированный β-катенин, подвергаясь протеасомной деградации, не поступает из цитоплазмы в ядро клетки; его транскрипционная функция нарушается, что ведет к нивелированию действия сигнального пути Wnt/β-катенин в раковых клетках [30].
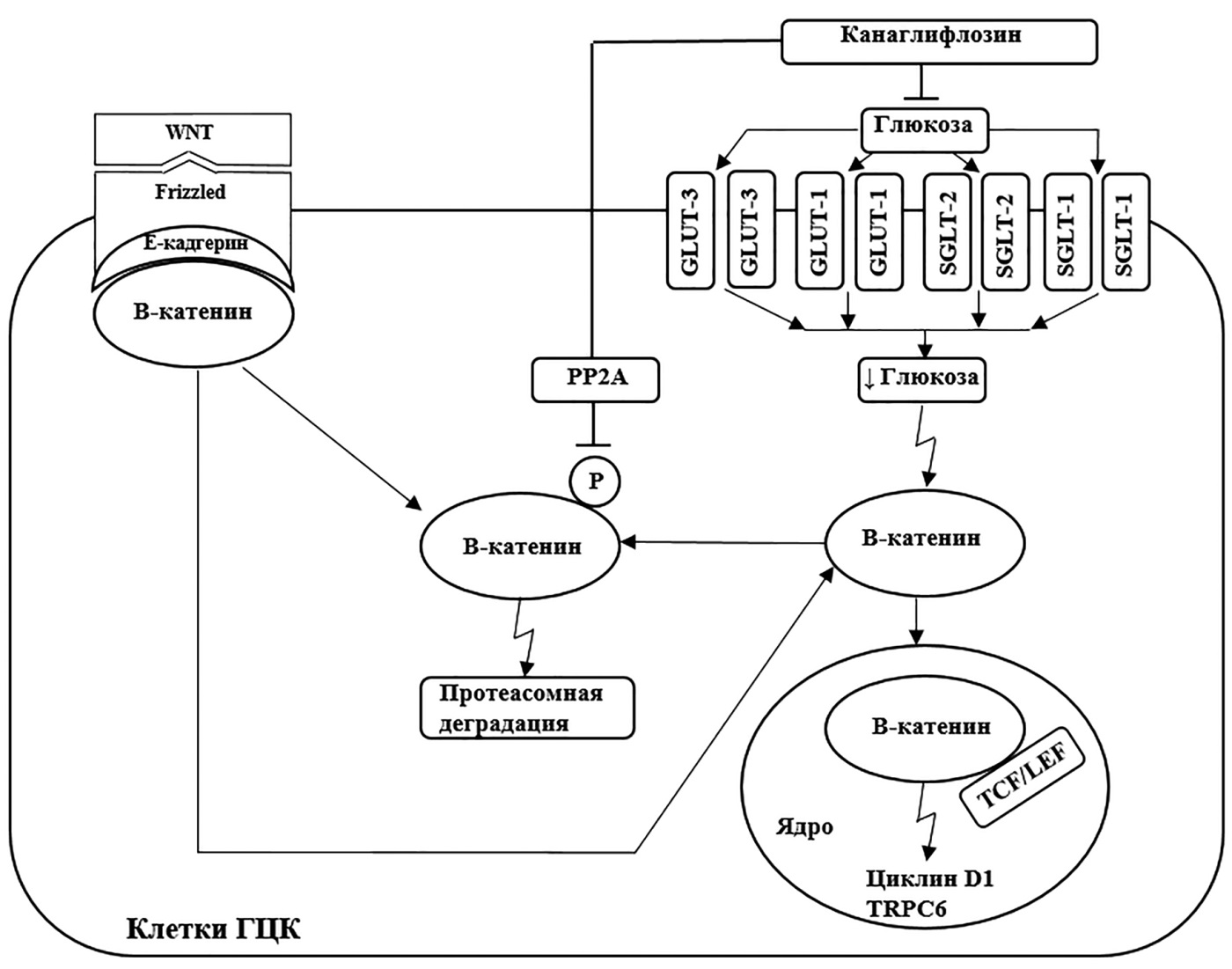
Рисунок 2. Механизм противоопухолевого эффекта канаглифлозина путем ингибирования β-катенина и усиления его протеасомной деградации в клетках ГЦК (адаптировано из [12]).
Примечание. SGLT-1 — натрий-глюкозный котранспортер-1; SGLT-2 — натрий-глюкозный котранспортер-2; GLUT1 — стереоспецифический транспортер глюкозы 1; GLUT3 — стереоспецифический транспортер глюкозы 3; WNT — Лиганд типа WNT (Wingless); Frizzled — трансмембранный рецептор сигнального пути Wnt/β-катенин; сопряженный с G-белком; PP2A — протеинфосфатаза 2А; TCF/LEF — Т-клеточный фактор/лимфоидный энхансерный фактор; TRPC6 — транзиторный рецепторный потенциальный катионный канал; E-cadherin — эпителиальный кадгерин; ГЦК — гепатоцеллюлярная карцинома.
III. Усиление активности АМФ-активируемой протеинкиназы (AMP activated protein kinase; AMPK) (рис. 3)
В клетках различных злокачественных опухолей (ГЦК, рак простаты, РМЖ и др.) канаглифлозин, ингибируя митохондриальный комплекс I и АТФ-синтазу, подавляет процесс окислительного фосфорилирования, что приводит к значительному снижению концентрации молекул АТФ в злокачественных клетках и, соответственно, к увеличению соотношения АМФ/АТФ [24][33]. К увеличению соотношения АМФ/АТФ приводит также ингибирование канаглифлозином глутаматдегидрогеназы: в данном случае уменьшение концентрации α-кетоглутарата в клетке нарушает функционирование цикла трикарбоновых кислот (цикла Кребса), что обуславливает снижение концентрации АТФ [32]. В подобных условиях количественного превалирования АМФ над АТФ, подвергаясь фосфорилированию, чрезмерно активируется AMPK, приводя к целому ряду механизмов противоопухолевого действия, что кажется, например, очень важным в перспективе использования глифлозинов для лечения рака щитовидной железы [34]. Среди механизмов можно выделить основные.
- Через фосфорилирование ацетил-КоА-карбоксилазы (Acetyl-CoA carboxylase; ACC) и ингибирование белка SREBP1 (Sterol regulatory element-binding protein-1) и фермента SCD1 (Stearoyl-CoA desaturase-1), необходимых для метаболизма стероидов, активированная AMPK подавляет синтез мононенасыщенных жирных кислот в опухолевых клетках и, таким образом, приводит к увеличению концентрации полиненасыщенных жирных кислот, индуцирующих перекисное окисление липидов и, как следствие, гибель раковой клетки по типу ферроптоза [24][35].
- Через блокирование протеинкиназы mTOR (mammalian target of rapamycin; мишень рапамицина у млекопитающих), необходимой для функционирования различных мультимолекулярных сигнальных комплексов, которые регулируют клеточный рост, активированная AMPK генетически опосредованно подавляет пролиферацию опухолевых клеток (клеточный цикл останавливается в пресинтетической фазе G1 интерфазы) и индуцирует их апоптоз [27][36–38]. Следует отметить, что наблюдающееся при этом генетическое перепрограммирование, определяющее снижение транскрипционной активности клеток, происходит очень быстро — в течение 24 часов после применения канаглифлозина и достижения его концентрации 10 мкМоль [36]. Лузеоглифлозин и тофоглифлозин, например, таким образом останавливают клеточный цикл в фазе G1 у лейкоцитов линий ATL и MT-2, что указывает на перспективность применения иНГЛТ-2 для лечения гемобластозов [39]. При чрезмерной активации AMPK возможна остановка клеточного цикла и в постсинтетической фазе G2 интерфазы посредством изменения функционирования транскрипционного фактора p53 и белка p21 [24][40].
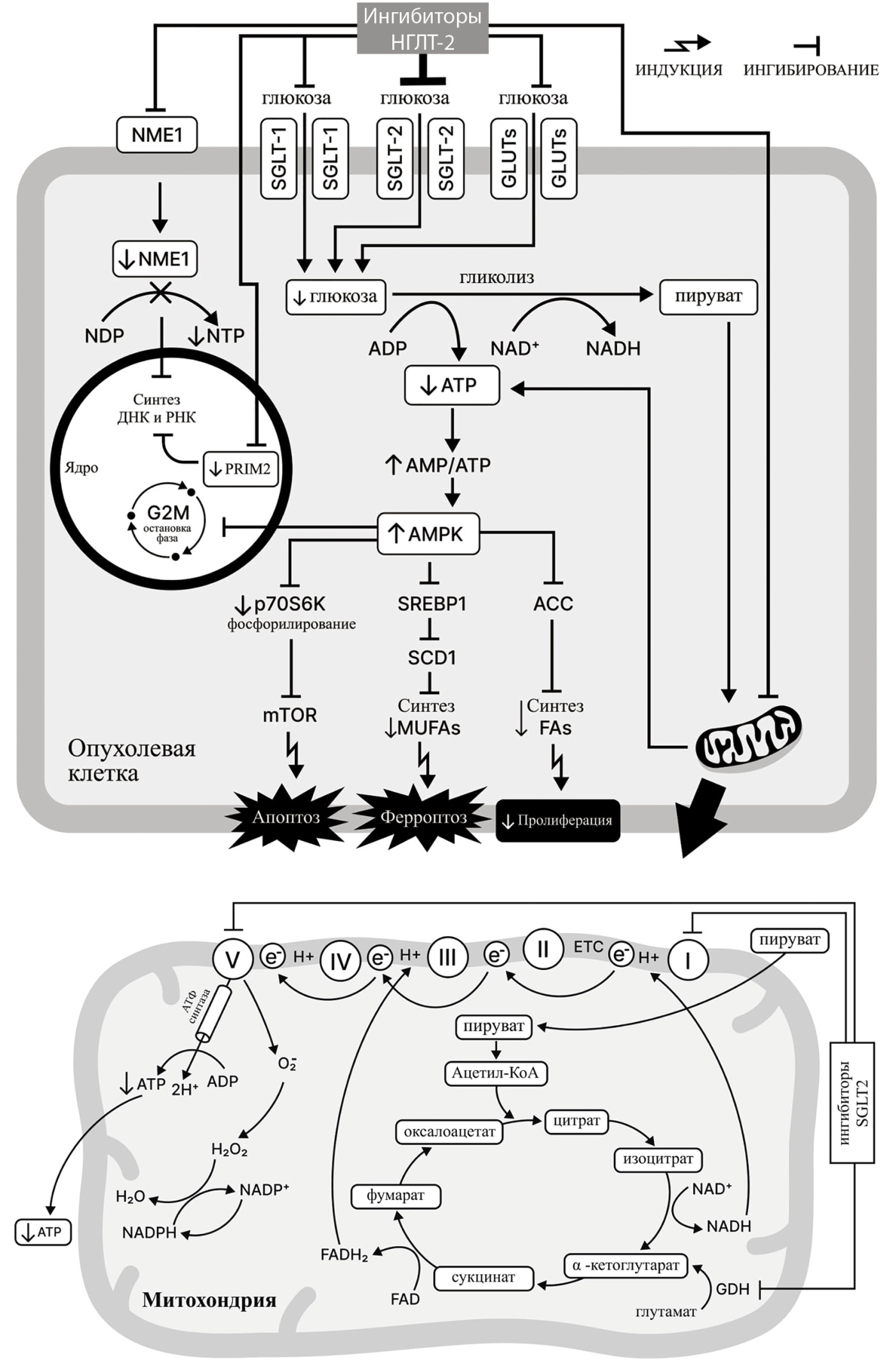
Рисунок 3. Механизмы противоопухолевого эффекта ингибиторов натрий-глюкозного котранспортера 2 типа, включая центральную роль активации AMPK (адаптировано из [12]).
Примечание. SGLT-1 — натрий-глюкозный котранспортер-1; SGLT-2 — натрий-глюкозный котранспортер-2; GLUTs — стереоспецифические транспортеры глюкозы; AMPK — АМФ-активируемая протеинкиназа; AMP — аденозинмонофосфат; ADP — аденозиндифосфат; ATP — аденозинтрифосфат; TCA — трикарбоновая кислота; GDH — глутаматдегидрогеназа; NAD+ — никотинамидадениндинуклеотид (окисленный); NADH — никотинамидадениндинуклеотид (восстановленный); NADP+ — никотинамидадениндинуклеотидфосфат (окисленный); NADPH — никотинамидадениндинуклеотидфосфат (восстановленный); FAD — флавинадениндинуклеотид (окисленный); FADH2 — флавинадениндинуклеотид (восстановленный); ACC: ацетил-КоА карбоксилаза, протеинкиназа mTOR — мишень рапамицина у млекопитающих; SREBP1 — стерол-регуляторный элемент-связывающий белок 1; SCD1 — стеароил-коэнзим А (КоА) десатураза-1; MUFAs — мононенасыщенные жирные кислоты; PUFAs — полиненасыщенные жирные кислоты; Fas — жирные кислоты; NME1 — нуклеозиддифосфаткиназа 1; NDP — нуклеотидифосфат; NTP — нуклеотидтрифосфат; PRIM2 — субъединица 2 ДНК-праймазы; ETC — электронно-транспортная цепь; e- — электрон.
IV. Нарушение синтеза ДНК и РНК
Канаглифлозин, ингибируя активность нуклеозиддифосфат-киназы, снижает концентрацию нуклеозидтрифосфата в опухолевых клетках, что значительно замедляет синтез в них ДНК и РНК [24]. Через угнетение экспрессии субъединицы PRIM2 канаглифлозин также нарушает функционирование в клетках злокачественных опухолей ДНК-праймазы — фермента, необходимого для репликации ДНК [24].
V. Увеличение инфильтрации злокачественной опухоли иммунными клетками
Вызывая подавление фосфорилирования протеинкиназы AKT (RAC-alpha serine/threonine-protein kinase) — фермента, играющего большую роль в развитии многих злокачественных образований, иНГЛТ-2 увеличивают экспрессию белка STING (Stimulator of interferon genes), который, в свою очередь, активирует интерфероновый сигнальный путь IRF3/IFN-β. В ответ на это происходит инфильтрация злокачественной опухоли иммунными клетками, что было продемонстрировано на примере с остеосаркомой [41].
VI. Ингибирование неоваскуляризации в опухолях
Канаглифлозин, ингибируя деятельность таких активаторов ангиогенеза, как тканевой ингибитор металлопротеиназ-1 (Tissue inhibitor of metalloproteinases 1; TIMP1), ангиогенин, интерлейкин 8, предотвращает ангиогенез в опухолях [42].
VII. Ингибирование притока натрия в опухолевые клетки
В клетках РМЖ иНГЛТ-2, одновременно с поступлением глюкозы блокируя поступление ионов натрия, вызывают гиперполяризацию клеточной мембраны и нестабильность мембранного потенциала митохондрий, что приводит к оксидативному стрессу и последующей гибели опухолевых клеток [43].
VIII. Нарушение адгезивных способностей раковых клеток
Увеличивая активность протеиназы ADAM 10 (A disintegrin and metalloproteinase domain-containing protein 10), дапаглифлозин индуцирует повышенное расщепление DDR1 (Discoidin domain receptor tyrosine kinase 1) — рецепторов, необходимых для связывания клеток с коллагеновыми волокнами I и IV типов, что нарушает адгезивные способности клеток толстокишечной карциномы [29].
ДОЗОЗАВИСИМОСТЬ ПРОТИВООПУХОЛЕВОГО ЭФФЕКТА ИНГИБИТОРОВ НГЛТ-2
При применении иНГЛТ-2 у пациентов с онкологическими заболеваниями одним из важнейших является вопрос дозирования отдельных препаратов этого класса. Так, для достижения противоопухолевого эффекта иНГЛТ-2, продемонстрированного в исследованиях in vitro, ученые часто добивались более высоких концентраций глифлозинов, нежели наблюдаются в сыворотке крови у пациентов, использующих иНГЛТ-2 для лечения сердечной недостаточности или СД2 [12]. Безопасность доз иНГЛТ-2, превышающих терапевтические, остается неизвестной.
В своем исследовании S. Komatsu и соавт. продемонстрировали дозозависимый антипролиферативный эффект ипраглифлозина в клетках РМЖ MCF-7 [26]. J. Zhou и соавт. приводят данные о дозозависимом усилении дапаглифлозином и канаглифлозином фосфорилирования AMPK, приводящем к остановке клеточного цикла и апоптозу в клетках РМЖ MCF-7 посредством блокады mTOR [27]. По данным ряда исследований, подтверждается дозозависимое подавление пролиферации клеток при применении канаглифлозина при раках легкого, поджелудочной железы и печени [28][38].
Вопрос дозирования важен еще и потому, что имеются сведения о возможной корреляции между применением высоких доз иНГЛТ-2 и их потенциальным проонкогенным эффектом. В исследовании S. De Jonghe и соавт. продемонстрировано возникновение различных опухолей (тестикулярные опухоли из клеток Лейдига, новообразования почек, феохромоцитомы) у крыс при использовании высоких доз иНГЛТ-2 (100 мг/сут) [9]. Однако полученные результаты авторы объясняли видовыми особенностями крыс [9].
ИНГИБИТОРЫ НГЛТ-2 В СОСТАВЕ КОМБИНИРОВАННОЙ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ — НА ПУТИ К МИНИМИЗАЦИИ ТОКСИЧНОСТИ, УВЕЛИЧЕНИЮ ЭФФЕКТИВНОСТИ И УСТРАНЕНИЮ ЛЕКАРСТВЕННОЙ РЕЗИСТЕНТНОСТИ
Потенциальный антинеопластический эффект иНГЛТ-2 открывает перед исследователями новое поле для научной деятельности — возможность комбинированной терапии злокачественных опухолей с помощью добавления глифлозинов к традиционно применяемым противоопухолевым препаратам. Но каков в таком случае терапевтический эффект, изменяются ли частота и выраженность нежелательных лекарственных реакций? Например, в ряде исследований рассматривался вопрос влияния иНГЛТ-2 на кардиотоксичность, вызываемую препаратами противоопухолевой терапии [44]. Были получены интересные данные, касающиеся улучшения жизненного прогноза пациентов с сердечной недостаточностью, связанной с приемом антинеопластических препаратов, на фоне кардиопротективного действия иНГЛТ-2 [45]. При этом, по данным исследований, кардиопротективный эффект глифлозинов заключался в снижении пред- и постнагрузки на сердце, улучшении метаболизма миокарда с помощью более эффективной регуляции кровоснабжения и увеличения поглощения кардиомиоцитами кислорода, нивелировании риска развития аритмий и др. [46]. Особенно важным подобное действие иНГЛТ-2 оказалось для пациентов с сопутствующей почечной патологией [45].
Необходимо также упомянуть об эффекте потенцирования в противоопухолевом действии, который достигается в рамках описанной выше комбинированной терапии и который позволяет минимизировать токсические эффекты традиционно применяемых антинеопластических препаратов благодаря снижению их дозы [12]. Одним из возможных механизмов усиления противоопухолевого эффекта может являться тот факт, что глифлозины (в частности канаглифлозин), снижая внутриклеточную концентрацию молекул АТФ, угнетают деятельность P-гликопротеина, чем нарушают эффлюкс противоопухолевых средств (например, доксорубицина) из злокачественных клеток и способствуют их цитотоксическому эффекту [17][47]. Подобное действие оказывает и эмпаглифлозин [44]. Следует сказать, что иНГЛТ-2 потенцируют противоопухолевый эффект не только фармакологических средств, но и лучевой терапии [48]. При этом особый интерес представляют специальные магнитоуправляемые наночастицы из оксида железа, которые используются в качестве своеобразного транспорта для более точной доставки иНГЛТ-2 в опухолевые клетки [49]. Например, применение современного поколения таких наночастиц — IO/PMAA-g-PEGMA (Iron oxide/Poly(methacrylic acid)-graft-poly(ethyleneglycol methacrylate), несущих канаглифлозин и зарекомендовавших себя в качестве успешных индукторов апоптоза в злокачественных клетках, считается наиболее эффективным именно во внешнем магнитном поле, активирующем эти наночастицы, с одновременным использованием лучевого воздействия [48].
Комбинированная противоопухолевая терапия в таком ключе может рассматриваться как возможное решение проблемы множественной лекарственной резистентности рака [4][12]. Однако стоит учитывать, что онкологические заболевания в анамнезе, как правило, являются критерием исключения пациентов из клинических исследований, ввиду чего приведенные результаты основаны прежде всего на анализе данных электронных медицинских карт [45]. Это не дает с полной уверенностью сделать выводы об эффективности комбинированной противоопухолевой терапии, в состав которой входят иНГЛТ-2.
БЕЗОПАСНОСТЬ ПРИЕМА ИНГИБИТОРОВ НГЛТ-2 КАК КОМПОНЕНТА КОМБИНИРОВАННОЙ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
Процессу широкой интеграции иНГЛТ-2 в традиционно применяемую противоопухолевую терапию, безусловно, могут препятствовать потенциальные нежелательные лекарственные реакции, вызываемые глифлозинами. Перечень основных нежелательных лекарственных реакций иНГЛТ-2 следующий: урогенитальные инфекции, гипогликемия, дегидратация с риском развития кетоацидоза, гипотония, увеличение риска возникновения саркопении у пожилых пациентов, желудочно-кишечные расстройства [50].
Нельзя не отметить риск развития такой серьезной нежелательной реакции, как некротизирующий фасциит промежности (гангрена Фурнье). S. Bersoff-Matcha и соавт. приводят данные о развитии 55 случаев гангрены Фурнье у пациентов, в течение шести лет принимавших иНГЛТ-2 [51]. Риск присоединения инфекции мочевыводящих путей и половых органов, в частности грибковой инфекции, выше у пациентов, получающих противоопухолевую терапию, оказывающую общее иммуносупрессивное влияние на организм пациента. Более уязвимыми в данном случае оказались пациенты женского пола, что отчасти может быть связано с анатомическими особенностями — широкой короткой уретрой и близостью анального отверстия к уретре [52]. Кроме того, стоит отметить, что, по данным современных исследований, при применении некоторых препаратов класса иНГЛТ-2 (эмпаглифлозин и дапаглифлозин) у пациентов, получавших противоопухолевую терапию, оказался выше риск развития эугликемического кетоацидоза [53].
Однако, несмотря на вышесказанное, иНГЛТ-2, по результатам многочисленных клинических исследований, доказали свою хорошую переносимость, относительную безопасность у онкологических больных, а также возможность использования у пациентов, даже не страдающих СД [54][55].
ЗАКЛЮЧЕНИЕ
Несомненно, потенциал иНГЛТ-2 в качестве одного из компонентов комбинированной противоопухолевой терапии крайне велик. Однако стоит учитывать, что противоопухолевый эффект этого класса препаратов преимущественно был доказан в исследованиях, проводимых на животных моделях, или в рамках ретроспективных исследований, что затрудняет диагностику дальнейшей динамики состояния пациентов, входящих в выборку. Несмотря на повышенный интерес в медицинском сообществе к антинеопластической активности глифлозинов и интенсивно ведущуюся в этом направлении научную работу, многое остается еще неизвестным. В связи с наличием различных, иногда полностью противоположных, результатов исследований (например, проонкогенный эффект иНГЛТ-2) необходимо дальнейшее проведение длительных клинических рандомизированных проспективных исследований с учетом сопутствующих заболеваний, возраста, пола пациентов, приема ими иных лекарственных препаратов и других факторов, способных влиять на достоверность результатов. Вероятно, будущие клинические исследования, направленные на изучение механизма антинеопластического эффекта иНГЛТ-2, смогут вывести современную противоопухолевую терапию на принципиально новую ступень развития.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Работа была выполнена без спонсорской поддержки.
Вклад авторов. Радкевич Е.Р. — поиск и анализ научной литературы, написание текста обзора; Северина А.С., Шамхалова М.Ш. — написание текста обзора, редактирование текста; Шестакова М.В. — окончательное редактирование текста и утверждение для публикации рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373(22):2117-2128. doi: https://doi.org/10.1056/NEJMoa1504720
2. Maejima Y. SGLT2 Inhibitors Play a Salutary Role in Heart Failure via Modulation of the Mitochondrial Function. Front Cardiovasc Med. 2020;6:186. doi: https://doi.org/10.3389/fcvm.2019.00186
3. Zhu B, Qu S. The Relationship Between Diabetes Mellitus and Cancers and Its Underlying Mechanisms. Front Endocrinol (Lausanne). 2022;13:800995. doi: https://doi.org/10.3389/fendo.2022.800995
4. Basak D, Gamez D, Deb S. SGLT2 Inhibitors as Potential Anticancer Agents. Biomedicines. 2023;11(7):1867. doi: https://doi.org/10.3390/biomedicines11071867
5. Memorial Sloan Kettering Cancer Center. Preventing High Blood Sugar in People Being Treated for Metastatic Breast Cancer. Available online: https://ClinicalTrials.gov/show/NCT05090358
6. Washington University School of Medicine Children’s Discovery Institute. Targeting Pediatric Brain Tumors with Sodium Glucose Cotransporter 2 Inhibitors (SGLT2i). Available online: https://ClinicalTrials.gov/show/NCT05521984
7. Filippas-Ntekouan S, Filippatos TD, Elisaf MS. SGLT2 inhibitors: are they safe? Postgrad Med. 2018;130(1):72-82. doi: https://doi.org/10.1080/00325481.2018.1394152
8. Tang H, Dai Q, Shi W, et al. SGLT2 inhibitors and risk of cancer in type 2 diabetes: a systematic review and meta-analysis of randomised controlled trials. Diabetologia. 2017;60(10):1862-1872. doi: https://doi.org/10.1007/s00125-017-4370-8
9. De Jonghe S, Proctor J, Vinken P, et al. Carcinogenicity in rats of the SGLT2 inhibitor canagliflozin. Chem Biol Interact. 2014;224:1-12. doi: https://doi.org/10.1016/j.cbi.2014.09.018
10. Taub ME, Ludwig-Schwellinger E, Ishiguro N, et al. Sex-, Species-, and Tissue-Specific Metabolism of Empagliflozin in Male Mouse Kidney Forms an Unstable Hemiacetal Metabolite (M466/2) That Degrades to 4-Hydroxycrotonaldehyde, a Reactive and Cytotoxic Species. Chem Res Toxicol. 2015;28(1):103-115. doi: https://doi.org/10.1021/tx500380t
11. Prentice DE, Meikle AW. A review of drug-induced Leydig cell hyperplasia and neoplasia in the rat and some comparisons with man. Hum Exp Toxicol. 1995;14(7):562-572. doi: https://doi.org/10.1177/096032719501400703
12. Dutka M, Bobiński R, Francuz T, et al. SGLT-2 Inhibitors in Cancer Treatment-Mechanisms of Action and Emerging New Perspectives. Cancers (Basel). 2022;14(23):5811. doi: https://doi.org/10.3390/cancers14235811
13. Lin HW, Tseng CH. A Review on the Relationship between SGLT2 Inhibitors and Cancer. Int J Endocrinol. 2014;2014:719578. doi: https://doi.org/10.1155/2014/719578
14. Шестакова М.В., Сухарева О.Ю. Глифлозины: особенности сахароснижающего действия и негликемические эффекты нового класса препаратов // Клиническая фармакология и терапия. — 2016. — Т. 25. — №2. — С. 65-71.
15. Suissa M, Yin H, Yu OHY, Wong SM, Azoulay L. Sodium-Glucose Cotransporter 2 Inhibitors and the Short-term Risk of Breast Cancer Among Women With Type 2 Diabetes. Diabetes Care. 2021;44(1):e9-e11. doi: https://doi.org/10.2337/dc20-1073
16. Billger M, Kirk J, Chang J, et al. A study in a rat initiation-promotion bladder tumour model demonstrated no promoter/progressor potential of dapagliflozin. Regul Toxicol Pharmacol. 2019;103:166-173. doi: https://doi.org/10.1016/j.yrtph.2019.01.031
17. Bardaweel S, Issa A. Exploring the Role of Sodium-Glucose Cotransporter as a New Target for Cancer Therapy. J Pharm Pharm Sci. 2022;25:253-265. doi: https://doi.org/10.18433/jpps32879
18. Kuang H, Liao L, Chen H, Kang Q, Shu X, Wang Y. Therapeutic Effect of Sodium Glucose Co-Transporter 2 Inhibitor Dapagliflozin on Renal Cell Carcinoma. Med Sci Monit. 2017;23:3737-3745. doi: https://doi.org/10.12659/msm.902530
19. Park LK, Lim KH, Volkman J, et al. Safety, tolerability, and effectiveness of the sodium-glucose cotransporter 2 inhibitor (SGLT2i) dapagliflozin in combination with standard chemotherapy for patients with advanced, inoperable pancreatic adenocarcinoma: a phase 1b observational study. Cancer Metab. 2023;11(1):6. doi: https://doi.org/10.1186/s40170-023-00306-2
20. Hendryx M, Dong Y, Ndeke JM, Luo J. Sodium-glucose cotransporter 2 (SGLT2) inhibitor initiation and hepatocellular carcinoma prognosis. PLoS One. 2022;17(9):e0274519. doi: https://doi.org/10.1371/journal.pone.0274519
21. Jojima T, Wakamatsu S, Kase M, et al. The SGLT2 Inhibitor Canagliflozin Prevents Carcinogenesis in a Mouse Model of Diabetes and Non-Alcoholic Steatohepatitis-Related Hepatocarcinogenesis: Association with SGLT2 Expression in Hepatocellular Carcinoma. Int J Mol Sci. 2019;20(20):5237. doi: https://doi.org/10.3390/ijms20205237
22. Yoshioka N, Tanaka M, Ochi K, et al. The sodium-glucose cotransporter-2 inhibitor Tofogliflozin prevents the progression of nonalcoholic steatohepatitis-associated liver tumors in a novel murine model. Biomed Pharmacother. 2021;140:111738. doi: https://doi.org/10.1016/j.biopha.2021.111738
23. Abdelhamid AM, Saber S, Youssef ME, et al. Empagliflozin adjunct with metformin for the inhibition of hepatocellular carcinoma progression: Emerging approach for new application. Biomed Pharmacother. 2022;145:112455. doi: https://doi.org/10.1016/j.biopha.2021.112455
24. Nakano D, Kawaguchi T, Iwamoto H, Hayakawa M, Koga H, Torimura T. Effects of canagliflozin on growth and metabolic reprograming in hepatocellular carcinoma cells: Multiomics analysis of metabolomics and absolute quantification proteomics (iMPAQT). PLoS One. 2020;15(4):e0232283. doi: https://doi.org/10.1371/journal.pone.0232283
25. Bose S, Zhang C, Le A. Glucose Metabolism in Cancer: The Warburg Effect and Beyond. Adv Exp Med Biol. 2021;1311:3-15. doi: https://doi.org/10.1007/978-3-030-65768-0_1
26. Komatsu S, Nomiyama T, Numata T, et al. SGLT2 inhibitor ipragliflozin attenuates breast cancer cell proliferation. Endocr J. 2020;67(1):99-106. doi: https://doi.org/10.1507/endocrj.EJ19-0428
27. Zhou J, Zhu J, Yu SJ, et al. Sodium-glucose co-transporter-2 (SGLT-2) inhibition reduces glucose uptake to induce breast cancer cell growth arrest through AMPK/mTOR pathway. Biomed Pharmacother. 2020;132:110821. doi: https://doi.org/10.1016/j.biopha.2020.110821
28. Yamamoto L, Yamashita S, Nomiyama T, et al. Sodium-glucose cotransporter 2 inhibitor canagliflozin attenuates lung cancer cell proliferation in vitro. Diabetol Int. 2021;12(4):389-398. doi: https://doi.org/10.1007/s13340-021-00494-6
29. Okada J, Yamada E, Saito T, et al. Dapagliflozin Inhibits Cell Adhesion to Collagen I and IV and Increases Ectodomain Proteolytic Cleavage of DDR1 by Increasing ADAM10 Activity. Molecules. 2020;25(3):495. doi: https://doi.org/10.3390/molecules25030495
30. Hung MH, Chen YL, Chen LJ, et al. Canagliflozin inhibits growth of hepatocellular carcinoma via blocking glucose-influxinduced β-catenin activation. Cell Death Dis. 2019;10(6):420. doi: https://doi.org/10.1038/s41419-019-1646-6
31. Park SJ, Kim TS, Park KH, Kwon WS, Kim JJ. Serum concentration of sex hormone-binding globulin in healthy volunteers and patients with breast cancer stratified by sex and age. Oncol Lett. 2020;20(1):364-372. doi: https://doi.org/10.3892/ol.2020.11549
32. Papadopoli D, Uchenunu O, Palia R, et al. Perturbations of cancer cell metabolism by the antidiabetic drug canagliflozin. Neoplasia. 2021;23(4):391-399. doi: https://doi.org/10.1016/j.neo.2021.02.003
33. Leprivier G, Rotblat B. How does mTOR sense glucose starvation? AMPK is the usual suspect. Cell Death Discov. 2020;6:27. doi: https://doi.org/10.1038/s41420-020-0260-9
34. Coperchini F, Greco A, Croce L, et al. Canagliflozin reduces thyroid cancer cells migration in vitro by inhibiting CXCL8 and CCL2: An additional anti-tumor effect of the drug. Biomed Pharmacother. 2024;170:115974. doi: https://doi.org/10.1016/j.biopha.2023.115974
35. Luis G, Godfroid A, Nishiumi S, et al. Tumor resistance to ferroptosis driven by Stearoyl-CoA Desaturase-1 (SCD1) in cancer cells and Fatty Acid Biding Protein-4 (FABP4) in tumor microenvironment promote tumor recurrence. Redox Biol. 2021;43:102006. doi: https://doi.org/10.1016/j.redox.2021.102006
36. Biziotis OD, Tsakiridis EE, Ali A, et al. Canagliflozin mediates tumor suppression alone and in combination with radiotherapy in non-small cell lung cancer (NSCLC) through inhibition of HIF-1α. Mol Oncol. 2023;17(11):2235-2256. doi: https://doi.org/10.1002/1878-0261.13508
37. Rao H, Cheng W, Yu J, et al. 恩格列净通过雷帕霉素靶点蛋白抑制 胃癌的分子机制初探 [Preliminary Investigation of the Molecular Mechanism of Empagliflozin Suppressing Gastric Cancer Through Mammalian Target of Rapamycin]. Sichuan Da Xue Xue Bao Yi Xue Ban. 2023;54(6):1146-1153. doi: https://doi.org/10.12182/20231160204
38. Xu D, Zhou Y, Xie X, et al. Inhibitory effects of canagliflozin on pancreatic cancer are mediated via the downregulation of glucose transporter-1 and lactate dehydrogenase A. Int J Oncol. 2020;57(5):1223-1233. doi: https://doi.org/10.3892/ijo.2020.5120
39. Nakachi S, Okamoto S, Tamaki K, et al. Impact of antidiabetic sodium-glucose cotransporter 2 inhibitors on tumor growth of intractable hematological malignancy in humans. Biomed Pharmacother. 2022;149:112864. doi: https://doi.org/10.1016/j.biopha.2022.112864
40. Chen XY, Li DF, Han JC, et al. Reprogramming induced by isoliquiritigenin diminishes melanoma cachexia through mTORC2- AKT-GSK3β signaling. Oncotarget. 2017;8(21):34565-34575. doi: https://doi.org/10.18632/oncotarget.16655
41. Wu W, Zhang Z, Jing D, et al. SGLT2 inhibitor activates the STING/IRF3/IFN-β pathway and induces immune infiltration in osteosarcoma. Cell Death Dis. 2022;13(6):523. doi: https://doi.org/10.1038/s41419-022-04980-w
42. Cruys B, Wong BW, Kuchnio A, et al. Glycolytic regulation of cell rearrangement in angiogenesis. Nat Commun. 2016;7:12240. doi: https://doi.org/10.1038/ncomms12240
43. Mao W, Zhang J, Körner H, Jiang Y, Ying S. The Emerging Role of Voltage-Gated Sodium Channels in Tumor Biology. Front Oncol. 2019;9:124. doi: https://doi.org/10.3389/fonc.2019.00124
44. Quagliariello V, De Laurentiis M, Rea D, et al. The SGLT-2 inhibitor empagliflozin improves myocardial strain, reduces cardiac fibrosis and pro-inflammatory cytokines in non-diabetic mice treated with doxorubicin. Cardiovasc Diabetol. 2021;20(1):150. doi: https://doi.org/10.1186/s12933-021-01346-y
45. Avula V, Sharma G, Kosiborod MN, et al. SGLT2 Inhibitor Use and Risk of Clinical Events in Patients With Cancer TherapyRelated Cardiac Dysfunction. JACC Heart Fail. 2024;12(1):67-78. doi: https://doi.org/10.1016/j.jchf.2023.08.026
46. Chang A, Botteri E, Gillis RD, et al. Beta-blockade enhances anthracycline control of metastasis in triple-negative breast cancer. Sci Transl Med. 2023;15(693):eadf1147. doi: https://doi.org/10.1126/scitranslmed.adf1147
47. Zhong J, Sun P, Xu N, et al. Canagliflozin inhibits p-gp function and early autophagy and improves the sensitivity to the antitumor effect of doxorubicin. Biochem Pharmacol. 2020;175:113856. doi: https://doi.org/10.1016/j.bcp.2020.113856
48. Angelopoulou A, Kolokithas-Ntoukas A, Papaioannou L, et al. Canagliflozin-loaded magnetic nanoparticles as potential treatment of hypoxic tumors in combination with radiotherapy. Nanomedicine (Lond). 2018;13(19):2435-2454. doi: https://doi.org/10.2217/nnm-2018-0145
49. Jump DB. Fatty acid regulation of hepatic lipid metabolism. Curr Opin Clin Nutr Metab Care. 2011;14(2):115-120. doi: https://doi.org/10.1097/MCO.0b013e328342991c
50. Scheen AJ. An update on the safety of SGLT2 inhibitors. Expert Opin Drug Saf. 2019;18(4):295-311. doi: https://doi.org/10.1080/14740338.2019.1602116
51. Bersoff-Matcha SJ, Chamberlain C, Cao C, Kortepeter C, Chong WH. Fournier Gangrene Associated With Sodium-Glucose Cotransporter-2 Inhibitors: A Review of Spontaneous Postmarketing Cases. Ann Intern Med. 2019;170(11):764-769. doi: https://doi.org/10.7326/M19-0085
52. Saisho Y. SGLT2 Inhibitors: the Star in the Treatment of Type 2 Diabetes? Diseases. 2020;8(2):14. doi: https://doi.org/10.3390/diseases8020014
53. Posado-Domínguez L, Figuero-Pérez L, Aránzazu Amores-Martín M, et al. Complications Secondary to the Use Of Sglt2 Inhibitors in Oncological Patients: A Series of 5 Cases. Eur J Case Rep Intern Med. 2023;11(1):004216. doi: https://doi.org/10.12890/2023_004216
54. Packer M. Lessons learned from the DAPA-HF trial concerning the mechanisms of benefit of SGLT2 inhibitors on heart failure events in the context of other large-scale trials nearing completion. Cardiovasc Diabetol. 2019;18(1):129. doi: https://doi.org/10.1186/s12933-019-0938-6
55. Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021;385(16):1451-1461. doi: https://doi.org/10.1056/NEJMoa2107038
Об авторах
Е. Р. РадкевичРоссия
Радкевич Елизавета Романовна, клинический ординатор
117292, г. Москва, ул. Дм. Ульянова, д. 11
А. С. Северина
Россия
Северина Анастасия Сергеевна, к.м.н., в.н.с.
Москва
М. Ш. Шамхалова
Россия
Шамхалова Минара Шамхаловна, д.м.н.
Москва
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
Москва
Scopus Author ID: 7004195530
Дополнительные файлы
|
|
1. Рисунок 1. Механизмы противоопухолевого эффекта ингибиторов натрий-глюкозного котранспортера 2 типа (адаптировано из [4]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(762KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Механизм противоопухолевого эффекта канаглифлозина путем ингибирования β-катенина и усиления его протеасомной деградации в клетках ГЦК (адаптировано из [12]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(464KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Механизмы противоопухолевого эффекта ингибиторов натрий-глюкозного котранспортера 2 типа, включая центральную роль активации AMPK (адаптировано из [12]). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(959KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Радкевич Е.Р., Северина А.С., Шамхалова М.Ш., Шестакова М.В. Ингибиторы натрий-глюкозного котранспортера 2 типа как потенциальные противоонкогенные средства. Сахарный диабет. 2025;28(2):243-251. https://doi.org/10.14341/DM13224
For citation:
Radkevich E.R., Severina A.S., Shamkhalova M.S., Shestakova M.V. Sodium-glucose cotransporter 2 inhibitors as potential anticancer agents. Diabetes mellitus. 2025;28(2):243-251. (In Russ.) https://doi.org/10.14341/DM13224

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































