Перейти к:
Сахарный диабет и гемостаз. Интрига отношений. Часть 1. Дисфункция эндотелия
https://doi.org/10.14341/DM13217
Аннотация
Данный обзор литературы является первым в серии статей, посвященных взаимному влиянию сахарного диабета (СД) и нарушений в системе гемостаза, связанных с дисфункцией эндотелия (ДЭ), изменениями активности тромбоцитов, плазменно-коагуляционного звена гемостаза, активности естественных антикоагулянтов и фибринолиза. Проанализированы основные механизмы развития ДЭ, возможности ее выявления не только в научных исследованиях, но и в рутинной клинической практике. Также приведены основные принципы как немедикаментозной, так и медикаментозной коррекции ДЭ. Сделан акцент на возможности использования с этой целью препаратов, обладающих сахароснижающим эффектом и не имеющих его. Высказано мнение о наличии обратного влияния ДЭ на дисбаланс углеводного обмена, которое, по мнению авторов, сможет значительно расширить представление о роли этих нарушений не только в развитии осложнений, но и в патогенезе самого СД.
Ключевые слова
Для цитирования:
Березовская Г.А., Петрищев Н.Н., Халимов Ю.Ш. Сахарный диабет и гемостаз. Интрига отношений. Часть 1. Дисфункция эндотелия. Сахарный диабет. 2025;28(4):376-383. https://doi.org/10.14341/DM13217
For citation:
Berezovskaya G.A., Petrishchev N.N., Khalimov Yu.Sh. Diabetes mellitus and hemostasis. Intrigue of relationships. Part 1. Endothelial dysfunction. Diabetes mellitus. 2025;28(4):376-383. (In Russ.) https://doi.org/10.14341/DM13217
ВВЕДЕНИЕ В ПРОБЛЕМУ
Сахарный диабет (СД) в течение многих лет занимает одну из лидирующих позиций среди причин смерти населения земли, занимая 6-е место среди неинфекционных болезней. Кроме этого, около 5,2% случаев смерти от сердечно-сосудистых заболеваний (ССЗ) также ассоциированы с диабетом [1]. По прогнозам, без принятия адекватных мер в 2030 г. диабетом будут страдать около 600 миллионов человек, а в 2045 г. их число возрастет до 700 миллионов [2].
Стремительный рост заболеваемости СД и многообразие осложнений, возникающих при этом, требуют незамедлительного поиска новых подходов к профилактике и лечению данного заболевания. Результаты исследований последних лет дают все основания утверждать, что нарушения углеводного обмена, лежащие в основе этой патологии, являются лишь частью патогенеза его осложнений. А тот факт, что длительное время СД имеет полное право называться «тихим убийцей», свидетельствует о том, что в этом процессе весомую роль играют структуры, представляющие материальный субстрат и потенциал функции, стоящие до поры вдалеке от прямой связи. Одним из таких «серых кардиналов», реагирующих на изменение уровня гликемии, является гемостаз, многообразие функций которого позволяет предположить, что его влияние не ограничивается участием в развитии гипер- и гипокоагуляционных состояний при СД, а спектр нарушений, обусловленных его дисбалансом, значительно шире.
Говоря об осложнениях СД, прежде всего, разумеется, речь идет о ССЗ, частота которых среди пациентов с СД2 варьирует от 21 до 32%, что существенно выше таковой в общей популяции (10,6%). Известно, что СД2 приводит к двухкратному увеличению риска ишемического инсульта [3] и трех-пятикратному увеличению риска инфаркта миокарда (ИМ) [4], особенно при условии недостаточного контроля факторов риска сердечно-сосудистых осложнений (ССО) [5]. Кроме того, пациенты с СД 2 типа (СД2) имеют худшие исходы после острого коронарного синдрома и более высокую частоту развития сердечной недостаточности [6].
В отличие от убедительной ассоциации СД2 с артериальной тромбоэмболией (АТЭ), его связь с венозной тромбоэмболией (ВТЭ) ставится под сомнение. При этом частота заболеваемости ВТЭ в сопоставимых по возрасту категориях существенно выше при СД, чем в общей популяции, и составляет 2,12 против 1,83 на 1000 человеко-лет соответственно [7]. Наиболее частым проявлением ВТЭ у пациентов с СД является тромбоз глубоких вен (ТГВ, 72%) [8]; частота его развития, по некоторым данным, возрастает при СД на 60%, но только до коррекции факторов риска, прежде всего индекса массы тела (ИМТ) [7], а также при декомпенсации хронических заболеваний и оперативных вмешательствах [8]. Тем не менее принято считать, что СД2 не является независимым фактором риска ВТЭ [9], но их можно рассматривать лишь как распространенное сопутствующее заболевание, встречающееся у 19,1% пациентов с СД2. Однако очевидно и то, что наличие СД связано с повышением риска рецидива ТГВ на 74%, увеличением частоты крупных кровотечений на 40% у пациентов, получающих антикоагулянтные препараты [10], и посттромботических язв в 2,3 раза [11]. Таким образом, очевидным на данный момент является то, что СД2 существенно повышает риск АТЭ, в частности ИМ и инсульта, в то время как его влияние на риск ВТЭ в значительной степени связано с увеличением ИМТ, нередко сопутствующим нарушениям углеводного обмена.
Хорошо известно, что основной причиной развития осложнений при СД являются повреждения микро- и макрососудов, приводящие не только к снижению тромборезистентности сосудистой стенки в результате дисфункции эндотелия (ДЭ), но и нарушениям регионарного кровообращения.
ЭНДОТЕЛИЙ И ЕГО ДИСФУНКЦИЯ
Функции эндотелия
Несмотря на то, что внутренняя оболочка сосудов представлена тонким моноклеточным слоем эндотелиальных клеток (ЭК), в физиологических условиях он реагирует на воздействия всех без исключения химических и физических сигналов путем выработки большого количества биологически активных веществ, участвующих в регуляции клеточной адгезии, пролиферации гладкомышечных клеток (ГМК), сосудистого тонуса, тромборезистентности и развития воспаления. Эндотелий сосудов по существу является активным эндокринным, паракринным и аутокринным органом, основные функции которого заключаются в регуляции и поддержании сосудистого тонуса и гомеостаза [12].
Дисфункция эндотелия
ДЭ — это изменение нормальной функции эндотелия, которое подразумевает потерю некоторых структурных и/или функциональных особенностей и представляет собой одну из наиболее важных составляющих ССЗ. ДЭ характеризуется снижением биодоступности вазодилататоров, в частности оксида азота (NO•), и/или увеличением биодоступности эндотелиальных вазопрессоров, таких как ангиотензин II (Ang II) [13]. Подобные изменения приводят к нарушению баланса между возможностями снабжения тканей кислородом и метаболическими потребностями в нем в результате патологического ремоделирования сосудистой стенки и нарушений регионарного кровообращения [14].
Известно, что ДЭ является общим звеном патогенеза осложнений диабета и ССЗ [14]. Однако ДЭ при этом, как было установлено, может выступать в качестве промежуточного звена патологического процесса, так и первопричины возникновения не только ССЗ, но и нарушений углеводного обмена, в частности инсулинорезистентности [15] (рис. 1).
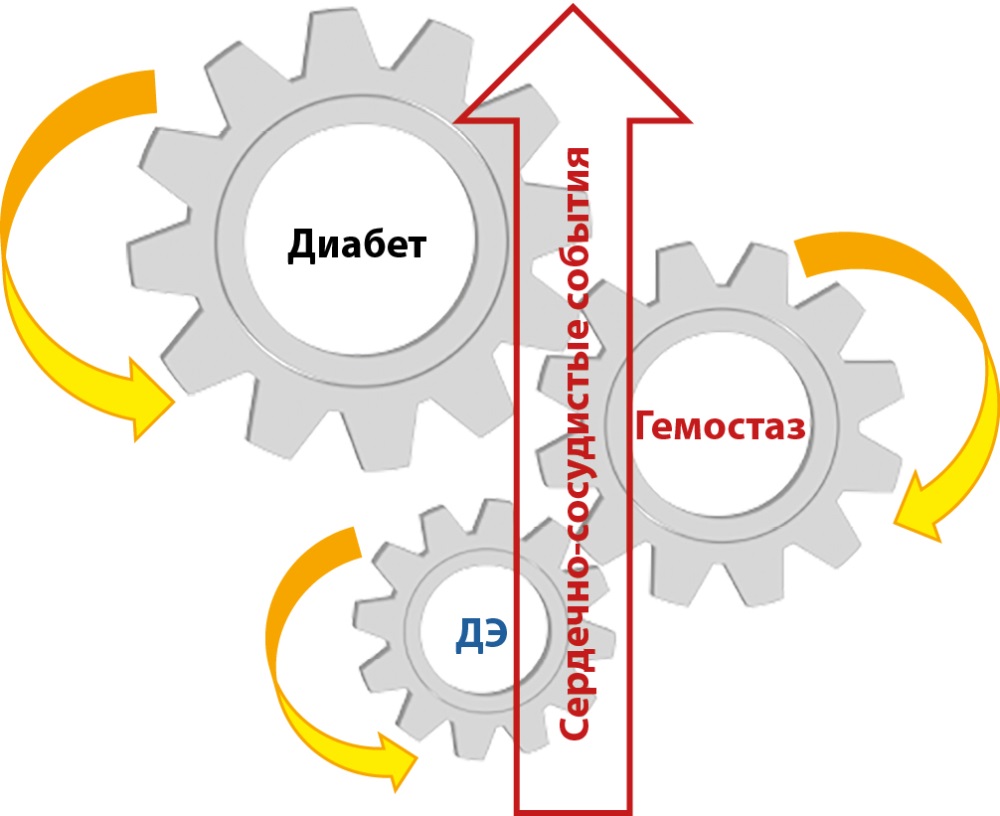
Рисунок 1. Роль взаимного влияния сахарного диабета, дисбаланса гемостаза и дисфункции эндотелия в увеличении риска развития сердечно-сосудистых заболеваний.
Примечание: ДЭ — дисфункция эндотелия.
Роль инсулина в регуляции функции эндотелия
Инсулин играет важную роль в поддержании сосудистого гомеостаза. С одной стороны, он стимулирует выработку эндотелием NO•, важнейшего сосудорасширяющего вещества, обладающего антиагрегантным действием и способного ограничивать пролиферацию и миграцию ГМК, а также опосредует высвобождение эндотелина-1 (англ. Endothelin-1, ET-1), который, как известно, действует как сильный вазоконстриктор. Это двойное действие инсулина опосредуется двумя основными сигнальными путями. В физиологических условиях преобладает вазопротекторный путь фосфоинозитид-3-киназы (PI3-K)/Akt, который отвечает за экспрессию и активацию эндотелиальной синтазы оксида азота (eNOS) [16].
При возникновении резистентности к инсулину баланс смещается в сторону митоген-активируемой протеинкиназы/внеклеточной регулируемой сигналом киназы (MAPK/ERK), которая участвует в развитии воспаления, вазоспазма и пролиферации ГМК. Таким образом, имеющиеся данные свидетельствуют о наличии взаимных влияний между механизмами действия инсулина и эндотелием как в норме, так и при патологии. Именно поэтому инсулинорезистентность как правило сосуществует с ДЭ при ССЗ [16].
Взаимное влияние окислительного стресса, гипергликемии и дисфункции эндотелия при сахарном диабете
Эндотелий сосудов также является основной мишенью окислительного стресса, представляющего собой дисбаланс между выработкой и разрушением активных форм кислорода (АФК), приводящего в итоге к развитию как самого диабета, так и осложнений, связанных с ним [17]. В частности, усиленное образование свободных радикалов и снижение активности антиоксидантных систем в клетке приводит к нарушению чувствительности к инсулину, которое проявляется в изменении толерантности к глюкозе и/или повышению резистентности к инсулину [17]. Следствием подобных нарушений, как известно, является гипергликемия, которая наряду с гиперпродукцией фактора некроза опухоли-альфа (ФНО-α) и высокими концентрациями окисленных липопротеинов низкой плотности (ЛПНП), составляющих метаболическую среду больного СД2, приводит к снижению экспрессии NO-синтазы (англ. Nitric oxide synthase, NOs) — фермента, участвующего в образовании NO• из L-аргинина. Результатом данных воздействий является усиление вазоспазма, проницаемости сосудистой стенки и синтеза молекул клеточной адгезии, воспаления, агрегации тромбоцитов и активации тромбогенных факторов, приводящих к нарушению макро- и микроциркуляции при СД [18].
Изменение целостности эндотелия при сахарном диабете
Наряду с ДЭ при СД возникают условия для нарушения целостности эндотелия, приводящего к снижению тромборезистентности сосудистой стенки. Одной из причин данной патологии являются качественные и количественные изменения эндотелиальных клеток-предшественниц (англ. Endothelial progenitor cells, EPC) [19]. Механизмы развитии подобных нарушений при СД в настоящее время до конца не изучены. Достоверно известно, что гипергликемия индуцирует окислительный стресс и выработку АФК in vivo, способных ингибировать пролиферацию и активность EPC, снижать образование NO• и матриксной металлопротеиназы-9 (MMP-9), необходимых для мобилизации этих клеток из костного мозга [20].
Гипергликемия и эндотелиальный гликокаликс
В эксперименте на животных было показано, что при СД поверхность эндотелия становится неровной, эндотелиоциты располагаются нерегулярно, обнаруживаются фрагменты субэндотелия, свободные от ЭК, а оставшиеся содержат большое количество цитоплазматических сегментов и вакуолей. Наряду с другими структурными изменениями сосудистой стенки это указывает на то, что СД значительно изменяет структуру эндотелиального слоя [21]. Кроме того, под воздействием АФК происходит изменение ультраструктур митохондрий, их деления и слияния, что является важной особенностью повреждения эндотелия при СД [22]. Более того, стало известно, что гипергликемия способствует уменьшению толщины или исчезновению эндотелиального гликокаликса (ЭГ), действующего как естественный динамический барьер, расположенный на поверхности ЭК. Потеря ЭГ облегчает адгезию липидов, моноцитов и тромбоцитов к эндотелию сосудов, что способствует повреждению эндотелиального барьера и увеличению проницаемости эндотелия [23]. Изучение изменений, происходящих в структуре ЭГ при СД, позволило установить, что восстановление этой структуры сосудистой стенки может позволить не только повысить тромборезистентность эндотелия, посредством устранения его дисфункции, но и добиться уменьшения диастолической дисфункции миокарда при диабетической кардиомиопатии [24], альбуминурии при диабетической нефропатии [25] и прогрессирования диабетической ретинопатии [26], приводящей к потере зрения. По мнению ряда исследователей, восстановление ЭГ может быть первым шагом в лечении диабетического повреждения эндотелия сосудов. Результаты экспериментальных исследований на модели мышей свидетельствуют о том, что с этой целью могут быть использованы такие вещества, как ангиопоэтин-1 (Angiopoietin-1, Ang-1) [27], хотя механизмы изменений ультраструктуры ЭГ при диабете до сих пор достоверно не известны. При этом влияние Ang-1 на состояние сосудистой стенки не вызывает сомнения благодаря наличию у него способности повышать выживаемость ЭК, усиливать их миграцию и пролиферацию, снижать проницаемость сосудистой стенки и периваскулярный отек, а также влиять на активность периэндотелиальных клеток.
ГИПЕРАКТИВАЦИЯ АПОПТОЗА ПРИ САХАРНОМ ДИАБЕТЕ
Механизмы развития апоптоза
Повреждение эндотелия при СД связано также с гиперактивацией апоптоза. Об этом свидетельствует тот факт, что у пациентов с СД2 уровень циркулирующих ЭК выше, чем у здоровых людей. Причина этого заключается в том, что под воздействием высоких концентраций в крови глюкозы происходит ингибирование фосфорилирования АМФ-активируемой протеинкиназы (англ. 5’ adenosine monophosphate-activated protein kinase, AMPK), приводящее к постепенной фрагментации митохондрий, активации апоптоза и образованию апоптотических телец. Таким образом, апоптоз признан важным проявлением структурных и морфологических изменений эндотелия сосудов при СД и одной из причин эндотелиальной дисфункции [28].
Вклад микрочастиц эндотелиального происхождения в протромбогенный потенциал крови при сахарном диабете
Кроме того, в результате апоптоза, как и активации ЭК, в периферический кровоток выделяются микрочастицы эндотелиального происхождения (МЭП), представляющие собой везикулы, образованные клеточной оболочкой ЭК. МЭП содержат фрагменты цитоплазмы, а также находящиеся на поверхности мембран отрицательно заряженные фосфолипиды и антигенные детерминанты, аналогичные материнской клетке. Они имеют меньшие размеры, чем апоптотические тельца, и не содержат ядерных кислот. В отличие от апоптотических телец, образующихся в заключительной стадии апоптоза, выброс МЭП эндотелиальными клетками происходит в период обратимой фазы апоптоза, до начала фрагментации ДНК. Известно, что МЭП содержат на своей поверхности молекулы адгезии (Е-селектин, ICAM-1, РЕСАМ-1) и обладают высокой прокоагулянтной активностью, а их количество напрямую коррелирует с тяжестью ЭД [29]. Кроме того, установлено, что на внешней поверхности апоптотических телец и МЭП возникают условия для образования тромбина — главного энзима гемостаза, одной из основных функций которого является активация плазменно-коагуляционного звена гемостаза и агрегация тромбоцитов, приводящие к тромбообразованию [30][31].
Роль аннексина А5 в защите от гиперактивации апоптоза при сахарном диабете
Связь между апоптозом и протромбогенным потенциалом ЭК принято также ассоциировать с аннексином А5, относящимся к семейству аннексинов, источником появления в крови которых являются исключительно апоптотические и разрушенные клетки, в том числе эндотелиальные [29]. Все представители данного класса белков способны связываться с отрицательно заряженными фосфолипидами, в частности с фосфатидилсерином (ФС), экспонирование которого на внешней поверхности клеточной мембраны является одним из ранних признаков активации и апоптоза любых клеток. При этом аннексин А5 непосредственно образует щит вокруг отрицательно заряженных молекул фосфолипидов, блокируя тем самым процесс коагуляции благодаря конкуренции за сайты связывания ФС с протромбином, а также ингибируя активность фосфолипазы A1. Именно это свойство рекомбинантного аннексина А5 используют для выявления и подсчета апоптотических клеток в периферической крови [32].
РОЛЬ АУТОФАГИИ В РАЗВИТИИ ДИСФУНКЦИИ ЭНДОТЕЛИЯ ПРИ САХАРНОМ ДИАБЕТЕ
Механизмы развития аутофагии
Аутофагия — еще один физиологический процесс, изменение которого при СД определяет как прогрессирование самого заболевания, так и развитие микро- и макрососудистых осложнений. На данный момент известно о наличии трех типов аутофагии: микроаутофагия, макроаутофагия и шапероновая аутофагия. Микроаутофагия заключается в поглощении лизосомами макромолекул и обломков клеточных мембран. При макроаутофагии участок цитоплазмы, содержащий как правило какие-либо органеллы, окружается мембранным компартментом, напоминающим цистерну эндоплазматической сети. Шапероновая аутофагия, описанная только у млекопитающих, индуцируется стрессом (например, при голодании или физических нагрузках), осуществляется при участии цитоплазматических белков-шаперонов семейства hsp-70 (англ. heat shock proteins, HSP), вспомогательных белков и LAMP-2 (англ. lysosomal associated membrane protein 2). Известно также, что аутофагия способна воздействовать на отдельные органеллы или внутриклеточные молекулы, обеспечивая избирательность этому процессу, приводящему к развитию митофагии, пексофагии, ER-фагии (аутофагии эндоплазматического ретикулума), липофагии, гранулофагии, рибофагии и т.п. [33].
Особенности аутофагии при сахарном диабете
Установлено, что аутофагия влияет на состояние эндотелия при СД, оказывая диаметрально противоположные эффекты. Причем это зависит не только от механизмов ее развития посредством активации таких сигнальных путей, как PI3K/AKT/mTOR, AMPK, PINK1/Parkin и Hedgehog, но и разнообразия стимулов, индуцирующих их активацию: miR-126, miR-199a-3p и miR-21, липопротеиды низкой плотности (ЛПНП) и многие другие [6]. Также имеются данные о снижении интенсивности аутофагии с возрастом. В эксперименте на мышах было показано, что экспрессия нескольких генов аутофагии, включая Beclin 1 или Atg5-Atg12, снижается в некоторых тканях старых особей и сопровождается повышением активности mTOR (англ. mammalian target of rapamycin) — серин-треониновой киназы, принимающей участие во многих процессах в клетке, включая клеточный рост и пролиферацию [34].
Ряд исследований показали, что при СД нарушение аутофагии сопровождается морфологическими нарушениями и дисфункцией сосудистого эндотелия, активацией апоптоза и отшелушиванием ЭК, уменьшением толщины ЭГ, нарушением миграции и пролиферации ПЭК, усилением окислительного стресса и блокирование активации eNOS. Сложность регуляции аутофагии и противоречивые данные исследований в этой области не позволяют однозначно судить о роли аутофагии в регуляции повреждения эндотелия при диабете. Однако большинство исследователей уверенны, что коррекция аутофагии при СД может стать одним из путей к профилактике и лечению не только диабетической ангиопатии, но и других осложнений [6]. Основанием для этого служат результаты исследований, свидетельствующих о том, что эндотелиоциты являются далеко не единственными клетками, страдающими от нарушения аутофагии при СД. В частности известно, что аутофагия участвует в метаболизме глюкозы, модулируя функцию β-клеток поджелудочной железы, а также регулирует липидный обмен в организме путем контроля дифференцировки адипоцитов и поддержания баланса между белым и бурым жиром [35]. Известно также, что некоторые антигипергликемические препараты, такие как метформин, росиглитазон и агонисты рецепторов глюкагоноподобного пептида-1, вызывают улучшение метаболизма частично за счет усиления аутофагической активности [36].
ВЛИЯНИЕ ГИПЕРГЛИКЕМИИ НА ИЗМЕНЕНИЕ ФЕНОТИПА ЭНДОТЕЛИАЛЬНЫХ КЛЕТОК: МЕХАНИЗМЫ РАЗВИТИЯ И КЛИНИЧЕСКАЯ ЗНАЧИМОСТЬ
Среди причин развития ДЭ при СД также рассматривается формирование сенесцентного или стареющего фенотипа ЭК [37]. Известно, что наиболее значимым индуктором старения эндотелия является гипергликемия, повышающая активность фермента аргиназы-1, принадлежащего к суперсемейству уреогидролазы. Так, в исследовании Shosha E. и соавт. (2018 г.) было показано, что повышение активности данного фермента под воздействием гипергликемии играет основную роль в старении ЭК сетчатки при СД [38].
Влияние стареющего эндотелия на гемостатический потенциал крови, происходящее как при естественном процессе старения организма, так и при патологических процессах, активно изучается на протяжении последних десятилетий [37]. Очевидным на данный момент является то, что повышение риска тромбообразования при формировании сенесцентного фенотипа эндотелия связано с увеличением тромбогенного потенциала в результате увеличения прокоагулянтной активности ЭК, изменения антикоагулянтных свойств и угнетения системы фибринолиза [39]. Среди причин снижения тромборезистентности стареющих ЭК ряд исследователей называют появление провоспалительного фенотипа [40], а также секреторного фенотипа эндотелиоцитов, связанного со старением (англ. Senescence-associated secretory phenotype, SASP), приводящих к изменению секреции молекул, регулирующих процесс гемостаза: увеличение фактора Виллебранда (англ. von Willebrand factor, vWF), ингибитора активатора плазминогена-1 и -2 (англ. Plasminogen activator inhibitor, PAI), уменьшение тканевого активатора плазминогена (англ. Tissue-type plasminogen activator, tPA), тромбомодулина (англ. Thrombomodulin, TM), ADAMTS-13 (англ. ADisintegrin And Metalloproteinase) и др. [41]. Активно обсуждаются и другие механизмы изменения прокоагулянтной активности ЭК при старении, среди которых — нарушение регуляции циркадных ритмов в стареющих клетках [42], а также изменение электролитного баланса, при котором, в частности, интенсивность экспрессии и синтеза vWF эндотелиоцитами напрямую зависит от концентрации ионов натрия в их цитоплазме [43].
ВЛИЯНИЕ ГИПОГЛИКЕМИИ НА РАЗВИТИЕ ДИСФУНКЦИИ ЭНДОТЕЛИЯ ПРИ САХАРНОМ ДИАБЕТЕ
Роль гипогликемии в развитии ДЭ менее изучена, однако интерес к данной проблеме в последние годы стремительно растет. Результаты метаанализа, опубликованные в 2013 г., свидетельствуют о том, что тяжелые эпизоды гипогликемии связаны с повышенным риском ССЗ у пациентов с СД2 [44], обусловленным, наряду с другими факторами, развитием ДЭ [45].
Изучение эффектов гипогликемии у здоровых добровольцев с использованием плечевой проточно-опосредованной дилатации показало, что гипогликемическая стимуляция увеличивает количество ингибитора активации плазминогена-1 (англ. Plasminogen activator inhibitor-1PAI-1), молекул клеточной адгезии сосудов-1 (англ. Vascular cell adhesion molecule-1, VCAM-1 или CD106), молекул внутриклеточной адгезии-1 (англ. Inter-Cellular Adhesion Molecule-1, ICAM-1 или CD54), Е-селектина, Р-селектина, комплекса тромбин/антитромбин (ТАТ), ФНО-α, а также реакции на интерлейкин-6 и снижение эндогенной вазодилатации, опосредованной NO [46].
О влиянии гипогликемии на развитие ДЭ пациентов с СД убедительно свидетельствуют результаты целого ряда клинических и экспериментальных исследований. Так, на модели СД2 на крысах вида Goto-Kakizaki было установлено, что гипогликемия сопровождается повышением уровня адреналина, увеличением адгезии моноцитов к эндотелию и ДЭ [45]. В ряде других исследований также было показано, что повышение уровня адреналина, индуцированное гипогликемией, стимулирует гиперплазию неоинтимы и ГМК через α1-адренергические рецепторы после повреждения сосудов [47], а также способствует повышению уровня провоспалительных цитокинов, вызывающих ДЭ [48].
Также стало известно, что гипогликемия вызывает развитие не только ДЭ, но и гиперкоагуляции, активации симпатической нервной системы, изменения морфологии зубца Т на ЭКГ, а также индукции воспаления [49]. Wang J. и соавт. [50] установили, что воздействие гипогликемии на эндотелиальные клетки сосудов при концентрации глюкозы в крови менее 3,33 ммоль/л (60 мг/дл) приводит к значительному снижению выработки NO• наряду с гиперкатехоламинемией и увеличением выработки АФК митохондриями даже у здоровых людей.
ОСНОВНЫЕ МЕТОДЫ ВЫЯВЛЕНИЯ ДИСФУНКЦИИ ЭНДОТЕЛИЯ
Лабораторные маркеры дисфункции эндотелия
В клинической практике для выявления ДЭ могут быть использованы как инвазивные (лабораторные тесты), так и неинвазивные (функциональные методы исследования) маркеры. К числу биохимических маркеров ДЭ относятся фактор Виллебранда, Е-селектин, ангиопоэтин-1 (Ang-1), эндотелиальные прогениторные клетки, микрочастицы эндотелиального происхождения, асимметричный диметиларгинин (ADMA), аннексин 5а (или аннексин V), модифицированный ишемией альбумин, пентраксин-3, эндокан (специфичная для эндотелиальных клеток молекула-1) [51, 52]. В качестве специфичных для СД маркеров ДЭ предлагается также оценивать содержание в крови эндотелиальной синтазы оксида азота 3 типа (eNOS3), молекул адгезии ICAM-1 и VCAM-1, Р-селектина, резистина и остеопротегерина [53].
Выявление дисфункции эндотелия с помощью функциональных методов исследования
Функциональные методы исследования позволяют нам оценить либо сосудистые проявления ДЭ, либо выявить в тканях изменения, имеющие корреляционную связь с ней. К числу неинвазивных тестов относятся оценка лодыжечно-плечевого индекса, комплекса интима-медиа, артериальной ригидности, толщины эпикардиального жира и поток-опосредованной дилатации [51].
УСТРАНЕНИЕ ДИСФУНКЦИИ ЭНДОТЕЛИЯ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ
Коррекция факторов риска дисфункции эндотелия
Методы нормализации функций эндотелия, доступные в современной клинической практике, касаются прежде всего устранения таких факторов риска, как избыточная масса тела, стрессы и курение. Особое значение имеет борьба с гиподинамией, поскольку повышение физической активности приводит к увеличению синтеза ЛПВП и количества циркулирующих ЭПК, усилению ангиогенеза и артериогенеза, а также улучшению микроциркуляции и нормализации сосудистого тонуса [54].
Медикаментозное воздействие на функцию эндотелия
Возможности медикаментозной коррекции ДЭ представлены гораздо шире, чем принято считать. Перечень препаратов, обладающих способностью предотвратить развитие и снизить прогрессирование этого процесса, включает хорошо известные статины, ингибиторы ангиотензинпревращающего фермента, блокаторы кальциевых каналов, бета-адреноблокаторы (Небивалол, Карведилол), ингибиторы фосфодиэстеразы 5-го типа (Силденафил, Тадалафил, Варденафил), омега-3 жирные кислоты, блокаторы рецепторов к эндотелину (Бозентан), а также некоторые нестероидные противовоспалительные средства (ацетилсалициловая кислота, Целекоксиб).
Наряду с этим в последние годы активно обсуждается наличие у сахароснижающих препаратов эффектов, сдерживающих не только развитие и прогрессирование ДЭ, но и сосудистое старение в целом [55]. О наличии способности устранять ДЭ известно у инкретинов (агонистов рецепторов глюкагоноподобного пептида-1(арГПП-1) и ингибиторов дипептидилпептидазы-4 (ДПП-4)), метформина, инсулина, препаратов сульфонилмочевины (гликлазида, глимепирида), а также тиазолидиндионов [56]. В настоящий момент обсуждается наличие общего пути устранения ДЭ для противодиабетических препаратов. Предполагается, что одним из ключевых ферментов, который активируется данными препаратами, является фосфатидилинозитол-3-киназа (PI3K). Несмотря на индивидуальные особенности воздействия на эндотелий для каждого из препаратов, общим является усиление продукции NO• и уменьшение образования эндотелина-1, обладающего мощным сосудосуживающим эффектом [56].
ЗАКЛЮЧЕНИЕ
В завершение следует отметить, что уникальность эндотелия придает особую важность проблемам, связанным с его дисфункцией. Возникающие при СД структурные и функциональные изменения эндотелия создают условия для тромбообразования в результате повышения активности протромбогенных факторов и изменения регионарного кровообращения. Однако факт обратного влияния ДЭ на дисбаланс углеводного обмена позволяет значительно расширить представление о роли этих нарушений не только в развитии осложнений, но и в патогенезе самого СД. А в качестве результатов подобных суждений открываются новые возможности как для профилактики, так и лечения одного из самых грозных заболеваний современности — СД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Березовская Гелена Анатольевна — существенный вклад в получение, анализ данных и интерпретацию результатов, написание статьи; Петрищев Николай Николаевич — существенный вклад в концепцию исследования, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Халимов Юрий Шавкатович — существенный вклад в концепцию исследования, внесение в рукопись существенной правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Carrizzo A, Izzo C, Oliveti M, et al. The Main Determinants of Diabetes Mellitus Vascular Complications: Endothelial Dysfunction and Platelet Hyperaggregation. International Journal of Molecular Sciences. 2018;19(10):2968. doi: https://doi.org/10.3390/ijms19102968
2. Saeedi P, Petersohn I, Salpea P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res Clin Pract. 2019;157:107843. doi: https://doi.org/10.1016/j.diabres.2019.107843
3. Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet. 2017;389(10085):2239-2251. doi: https://doi.org/10.1016/S0140-6736(17)30058-2
4. Yuen L, Saeedi P, Riaz M, et al. Projections of the prevalence of hyperglycaemia in pregnancy in 2019 and beyond: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res Clin Pract. 2019;157:107841. doi: https://doi.org/10.1016/j.diabres.2019.107841
5. Ge Y, He D, Shao Y, Wang L, Yan W. Percutaneous coronary intervention in insulin-treated diabetic patients: A meta-analysis. Ann Noninvasive Electrocardiol. 2022;27(5):e12953. doi: https://doi.org/10.1111/anec.12953
6. Liu H, Wang X, Gao H, et al. Physiological and pathological characteristics of vascular endothelial injury in diabetes and the regulatory mechanism of autophagy. Front Endocrinol (Lausanne). 2023;14:1191426. doi: https://doi.org/10.3389/fendo.2023.1191426
7. Lin S, Rocha VM, Taylor R. Artefactual inflation of type 2 diabetes prevalence in WHO STEP surveys. Trop Med Int Health. 2019;24(4):477-483. doi: https://doi.org/10.1111/tmi.13213
8. Sun H, Saeedi P, Karuranga S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res Clin Pract. 2022;183:109119. doi: https://doi.org/10.1016/j.diabres.2021.109119
9. Nations U. World population prospects: the 2017 revision, key findings and advance tables. Department of Economics and Social Affairs PD, editor. New York: United Nations. 2017;46
10. Jovanovic L, Rajkovic M, Subota V, et al. Predictive value of admission glycemia in diabetics with pulmonary embolism compared to non-diabetic patients. Acta Diabetol. 2022;59(5):653-659. doi: https://doi.org/10.1007/s00592-021-01843-2
11. Bryk-Wiązania AH, Undas A. Hypofibrinolysis in type 2 diabetes and its clinical implications: from mechanisms to pharmacological modulation. Cardiovasc Diabetol. 2021;20(1):191. doi: https://doi.org/10.1186/s12933-021-01372-w
12. Elrakaybi A, Laubner K, Zhou Q, et al. Cardiovascular protection by SGLT2 inhibitors - Do anti-inflammatory mechanisms play a role? Mol Metab. 2022;64:101549. doi: https://doi.org/10.1016/j.molmet.2022.101549
13. Dang Z, Avolio E, Thomas AC, et al. Transfer of a human gene variant associated with exceptional longevity improves cardiac function in obese type 2 diabetic mice through induction of the SDF-1/CXCR4 signalling pathway. Eur J Heart Fail. 2020;22(9):1568-1581. doi: https://doi.org/10.1002/ejhf.1840
14. Izoe Y, Nagao M, Sato K, et al. Dynamic coronary CT Angiography-Estimated coronary flow in Non-Obstructive, Plaque-free coronary Arteries: Association with dyslipidemia and diabetes. Int J Cardiol Heart Vasc. 2022;42:101098. doi: https://doi.org/10.1016/j.ijcha.2022.101098
15. Garcia-Sayan E, Lee M, Stone JR, et al. Endothelial Dysfunction and Cardiometabolic Risk Factors in Mexican American Adults: The Cameron County Hispanic Cohort. Am J Cardiol. 2023;205:75-83. doi: https://doi.org/10.1016/j.amjcard.2023.07.165
16. Hung MJ, Chang NC, Hu P, et al. Association between Coronary Artery Spasm and the risk of incident Diabetes: A Nationwide population-based Cohort Study. Int J Med Sci. 2021;18(12):2630-2640. doi: https://doi.org/10.7150/ijms.57987
17. Bhatti JS, Sehrawat A, Mishra J, et al. Oxidative stress in the pathophysiology of type 2 diabetes and related complications: Current therapeutics strategies and future perspectives. Free Radic Biol Med. 2022;184:114-134. doi: https://doi.org/10.1016/j.freeradbiomed.2022.03.019
18. Huang Y, Yue L, Qiu J, et al. Endothelial Dysfunction and Platelet Hyperactivation in Diabetic Complications Induced by Glycemic Variability. Horm Metab Res. 2022;54(7):419-428. doi: https://doi.org/10.1055/a-1880-0978
19. Jalilian E, Elkin K, Shin SR. Novel Cell-Based and Tissue Engineering Approaches for Induction of Angiogenesis as an Alternative Therapy for Diabetic Retinopathy. Int J Mol Sci. 2020;21(10):3496. doi: https://doi.org/10.3390/ijms21103496
20. Benítez-Camacho J, Ballesteros A, Beltrán-Camacho L, et al. Endothelial progenitor cells as biomarkers of diabetes-related cardiovascular complications. Stem Cell Res Ther. 2023;14(1):324. doi: https://doi.org/10.1186/s13287-023-03537-8
21. Zhao N, Yu X, Zhu X, et al. Diabetes Mellitus to Accelerated Atherosclerosis: Shared Cellular and Molecular Mechanisms in Glucose and Lipid Metabolism. J Cardiovasc Transl Res. 2024;17(1):133-152. doi: https://doi.org/10.1007/s12265-023-10470-x
22. Li S, Deng J, Sun D, et al. FBXW7 alleviates hyperglycemia-induced endothelial oxidative stress injury via ROS and PARP inhibition. Redox Biol. 2022;58:102530. doi: https://doi.org/10.1016/j.redox.2022.102530
23. Masola V, Zaza G, Arduini A, et al. Endothelial Glycocalyx as a Regulator of Fibrotic Processes. Int J Mol Sci. 2021;22(6):2996. doi: https://doi.org/10.3390/ijms22062996
24. Qiu Y, Buffonge S, Ramnath R, et al. Endothelial glycocalyx is damaged in diabetic cardiomyopathy: angiopoietin 1 restores glycocalyx and improves diastolic function in mice. Diabetologia. 2022;65(5):879-894. doi: https://doi.org/10.1007/s00125-022-05650-4
25. Ramnath RD, Butler MJ, Newman G, et al. Blocking matrix metalloproteinase-mediated syndecan-4 shedding restores the endothelial glycocalyx and glomerular filtration barrier function in early diabetic kidney disease. Kidney Int. 2020;97(5):951-965. doi: https://doi.org/10.1016/j.kint.2019.09.035
26. Kaur G, Harris NR. Endothelial glycocalyx in retina, hyperglycemia, and diabetic retinopathy. Am J Physiol Cell Physiol. 2023;324(5):C1061-C1077. doi: https://doi.org/10.1152/ajpcell.00188.2022
27. Ćurko-Cofek B, Jenko M, Taleska Stupica G, et al. The Crucial Triad: Endothelial Glycocalyx, Oxidative Stress, and Inflammation in Cardiac Surgery—Exploring the Molecular Connections. Int. J. Mol. Sci. 2024;25:10891. doi: https://doi.org/10.3390/ijms252010891
28. Zheng Y, Luo A, Liu X. The imbalance of mitochondrial Fusion/Fission drives high-Glucose-Induced vascular injury. Biomolecules. 2021;11:1779. doi: https://doi.org/10.3390/biom11121779
29. Васина Л.В., Петрищев Н.Н., Власов Т.Д. Эндотелиальная дисфункция и ее основные маркеры. // Регионарное кровообращение и микроциркуляция. — 2017. — Т.16. — №1. — С.4-15. doi: https://doi.org/10.24884/1682-6655-2017-16-1-4-15
30. Матвиенко О.Ю., Наместников Ю.А., Головина О.Г., и др. Вклад микрочастиц в развитие гиперкоагуляционного синдрома у пациентов с посттромботической болезнью // Вестник гематологии. — 2011. — Т.7. — №1 — С.112-113.
31. Матвиенко О.Ю., Наместников Ю.А., Головина О.Г., и др. Гиперкоагуляционный синдром при ишемическом инсульте // Клиническая геронтология. — 2011. — №9-10. — С.34-38.
32. Петрищев Н.Н., Васина Л.В., Луговая А.В. Содержание растворимых маркеров апоптоза и циркулирующих аннексин V-связанных апоптотических клеток в крови больных острым коронарным синдромом // Вестник Санкт-Петербургского университета. — 2008. — Т.11. — №1. — С.14–23.
33. Li FX, Xu F, Li CC, et al. Cold Exposure Alleviates T2DM Through Plasma-Derived Extracellular Vesicles. Int J Nanomedicine. 2024;19:10077-10095. doi: https://doi.org/10.2147/IJN.S441847
34. Lee JH, Lee J. Endoplasmic Reticulum (ER) Stress and Its Role in Pancreatic β-Cell Dysfunction and Senescence in Type 2 Diabetes. Int J Mol Sci. 2022;23(9):4843. doi: https://doi.org/10.3390/ijms23094843
35. Kudo T, Zhao ML, Jeknić S, et al. Context-dependent regulation of lipid accumulation in adipocytes by a HIF1α-PPARγ feedback network. Cell Syst. 2023;14(12):1074-1086.e7. doi: https://doi.org/10.1016/j.cels.2023.10.010
36. Rodriguez-Rodriguez AE, Porrini E, Torres A. Beta-Cell Dysfunction Induced by Tacrolimus: A Way to Explain Type 2 Diabetes? Int J Mol Sci. 2021;22(19):10311. doi: https://doi.org/10.3390/ijms221910311
37. Власова Т.И., Петрищев Н.Н., Власов Т.Д. Эндотелий и старение: механизмы формирования сенесцентного фенотипа эндотелиальных клеток//Регионарное кровообращение и микроциркуляция. — 2023. — Т.22. — №3. — С.19–33. doi: https://doi.org/10.24884/1682-6655-2023-22-3-19-33
38. Liao YL, Fang YF, Sun JX, Dou GR. Senescent endothelial cells: a potential target for diabetic retinopathy. Angiogenesis. 2024;27(4):663-679. doi: https://doi.org/10.1007/s10456-024-09943-7
39. Donato AJ, Machin DR, Lesniewski LA. Mechanisms of Dysfunction in the Aging Vasculature and Role in Age-Related Disease. Circ Res. 2018;123(7):825-848. doi: https://doi.org/10.1161/CIRCRESAHA.118.312563
40. Akrivou D, Perlepe G, Kirgou P, et al. Pathophysiological Aspects of Aging in Venous Thromboembolism: An Update. Medicina (Kaunas). 2022;58(8):1078. doi: https://doi.org/10.3390/medicina58081078
41. McCafferty C, Busuttil-Crellin X, Cai T, et al. Plasma Proteomic Analysis Reveals Age-Specific Changes in Platelet- and Endothelial Cell-Derived Proteins and Regulators of Plasma Coagula tion and Fibrinolysis. J Pediatr. 2020;221S:S29-S36. doi: https://doi.org/10.1016/j.jpeds.2020.01.051
42. Yu Y, Li W, Xu L, Wang Y. Circadian rhythm of plasminogen activator inhibitor-1 and cardiovascular complications in type 2 diabetes. Front Endocrinol (Lausanne). 2023;14:1124353. doi: https://doi.org/10.3389/fendo.2023.1124353
43. Dmitrieva NI, Boehm M, Yancey PH, Enhörning S. Long-term health outcomes associated with hydration status. Nat Rev Nephrol. 2024;20(5):275-294. doi: https://doi.org/10.1038/s41581-024-00817-1
44. Alwafi H, Alsharif AA, Wei L, et al. Incidence and prevalence of hypoglycaemia in type 1 and type 2 diabetes individuals: A systematic review and meta-analysis. Diabetes Res Clin Pract. 2020;170:108522. doi: https://doi.org/10.1016/j.diabres.2020.108522
45. Manosroi W, Phimphilai M, Waisayanand N, et al. CORE-Thailand investigators. Glycated hemoglobin variability and the risk of cardiovascular events in patients with prediabetes and type 2 diabetes mellitus: A post-hoc analysis of a prospective and multicenter study. J Diabetes Investig. 2023;14(12):1391-1400. doi: https://doi.org/10.1111/jdi.14073
46. Kolb H, Kempf K, Röhling M, Martin S. Insulin: too much of a good thing is bad. BMC Med. 2020;18(1):224. doi: https://doi.org/10.1186/s12916-020-01688-6
47. Foreman YD, van Doorn WPTM, Schaper NC, et al. Greater daily glucose variability and lower time in range assessed with continuous glucose monitoring are associated with greater aortic stiffness: The Maastricht Study. Diabetologia. 2021;64(8):1880-1892. doi: https://doi.org/10.1007/s00125-021-05474-8
48. Hu Y, Li Z, Li H, et al. Severe hypoglycaemia-induced microglial inflammation damages microvascular endothelial cells, leading to retinal destruction. Diab Vasc Dis Res. 2024;21(4):1-11. doi: https://doi.org/10.1177/14791641241278506
49. Choi SY, Ko SH. Severe hypoglycemia as a preventable risk factor for cardiovascular disease in patients with type 2 diabetes mellitus. Korean J Intern Med. 2021;36(2):263-270. doi: https://doi.org/10.3904/kjim.2020.327
50. Kusunoki Y, Konishi K, Tsunoda T, Koyama H. Significance of Glycemic Variability in Diabetes Mellitus. Intern Med. 2022;61(3):281-290. doi: https://doi.org/10.2169/internalmedicine.8424-21
51. Balta S. Endothelial Dysfunction and Inflammatory Markers of Vascular Disease. Curr Vasc Pharmacol. 2021;19(3):243-249. doi: https://doi.org/10.2174/1570161118666200421142542
52. Наумов А.В., Прокофьева Т.В., Полунина О.С., и др. Анализ уровней аннексина V и цитокинового статуса у больных с острым инфарктом миокарда // Медицинский алфавит. — 2022. — №19. — С.33-38. doi: https://doi.org/10.33667/2078-5631-2022-19-33-38
53. Хрипун И.А., Моргунов М.Н., Воробьев С.В., и др. Эндотелиальная дисфункция и сахарный диабет 2 типа: новые маркеры ранней диагностики. // Кардиоваскулярная терапия и профилактика. — 2016. — Т.15. — №5 — С.59–63. doi: http://dx.doi.org/10.15829/1728-8800-2016-5-59-63
54. Gao J, Pan X, Li G, et al. Physical Exercise Protects Against Endothelial Dysfunction in Cardiovascular and Metabolic Diseases. J Cardiovasc Transl Res. 2022;15(3):604-620. doi: https://doi.org/10.1007/s12265-021-10171-3
55. Халимов Ю.Ш., Рубцов Ю.Е., Салухов В.В., Агафонов П.В. Ингибиторы натрий-глюкозного транспортера 2-го типа и новые возможности управления сосудистым возрастом у больных сахарным диабетом 2-го типа // Медицинский совет. — 2021. — №12. — С.228–236. doi: https://doi.org/10.21518/2079-701X-2021-12-228-236
56. Nedosugova LV, Markina YV, Bochkareva LA, et al. Inflammatory Mechanisms of Diabetes and Its Vascular Complications. Biomedicines. 2022;10(5):1168. doi: https://doi.org/10.3390/biomedicines10051168
Об авторах
Г. А. БерезовскаяРоссия
Березовская Гелена Анатольевна - д.м.н., доцент; ResearcherID: KYR-9204-2024; Scopus Author ID: 56700397600; eLibrary SPIN: 3931-3943.
197022, Санкт-Петербург, ул. Льва Толстого, д. 6-8
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. Н. Петрищев
Россия
Петрищев Николай Николаевич - д.м.н., профессор; ResearcherID: H-9236-2019; Scopus Author ID: 7005080867; eLibrary SPIN: 7377-2565.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ю. Ш. Халимов
Россия
Халимов Юрий Шавкатович - д.м.н, профессор; ResearcherID: AFG-7640-2022; Scopus Author ID: 55531165300; eLibrary SPIN: 7315-6746; РИНЦ ID: 464335.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Роль взаимного влияния сахарного диабета, дисбаланса гемостаза и дисфункции эндотелия в увеличении риска развития сердечно-сосудистых заболеваний. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(243KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Березовская Г.А., Петрищев Н.Н., Халимов Ю.Ш. Сахарный диабет и гемостаз. Интрига отношений. Часть 1. Дисфункция эндотелия. Сахарный диабет. 2025;28(4):376-383. https://doi.org/10.14341/DM13217
For citation:
Berezovskaya G.A., Petrishchev N.N., Khalimov Yu.Sh. Diabetes mellitus and hemostasis. Intrigue of relationships. Part 1. Endothelial dysfunction. Diabetes mellitus. 2025;28(4):376-383. (In Russ.) https://doi.org/10.14341/DM13217

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































