Перейти к:
Риски смертельных исходов при различных клинических фенотипах у больных сахарным диабетом 2 типа в Новосибирской области
https://doi.org/10.14341/DM13195
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет 2 типа (СД2) — заболевание с высокой распространенностью и ранней смертностью, а выделение групп риска неблагоприятных исходов имеет важное значение во вторичной профилактике.
ЦЕЛЬ. Изучить клинические, метаболические и генетические факторы риска отдаленных смертельных исходов при различных клинических фенотипах у больных СД2 в Новосибирской области.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено проспективное когортное исследование в Новосибирской области 2507 больных СД2. Длительность наблюдения составила 6,3±2,5 года. В зависимости от уровня С-пептида и индекса НОМА-IR пациенты были распределены на 3 фенотипа: инсулинопенический (n=288), классический (n=1921), инсулинорезистентный (n=298). Летальный исход за период с 2014 по 31.12.2022 зарегистрирован у 592 пациентов (23,6%). Выделение ДНК, генотипирование структурных вариантов генов TCF7L2 (rs7903146), ATM (rs11212617) проводили с помощью ПЦР.
РЕЗУЛЬТАТЫ. Ведущей причиной смерти больных СД2, независимо от клинического фенотипа были сердечно-сосудитсые заболевания (ССЗ) (63,8%). Пациенты с инсулинорезистентным фенотипом имели значимо меньшую длительность диабета на момент смерти 12,3±5,5 года по сравнению с классическим и инсулинопеническим фенотипом (р<0,001). Факторами риска общей смертности, по данным многофакторного регрессионного анализа Кокса (ОР), были длительность СД2 (1,043, р<0,001), уровень HbA1c (1,131, р<0,001), креатинина (1,013, р=0,002), наличие аллеля Т гена TCF7L2 (rs7903146) (ОР=1,431, р=0,017) и аллеля С гена ATM (rs11212517) (ОР=1,509, р=0,007). Предикторами сердечно-сосудистой смерти были HbA1c (ОР=1,129, р=0,001), длительность диабета (ОР=1,041, р=0,002), уровень креатинина (ОР=1,015, р=0,004), наличие аллеля Т гена TCF7L2 (rs7903146) (ОР=1,719, р=0,005) и аллеля С гена ATM (ОР=1,539, р=0,024).
ЗАКЛЮЧЕНИЕ. Исследование выявило, что пациенты с инсулинорезистеным фенотипом имели неблагоприятный прогноз. Основным предиктором общей и сердечно-сосудистой смерти являлся HbA1c. Наличие аллеля Т гена TCF7L2 (rs7903146) увеличивало риск общей смертности на 43,1%, аллеля С гена ATM (rs11212617) на 50,9%.
Для цитирования:
Бондарь И.А., Шабельникова О.Ю. Риски смертельных исходов при различных клинических фенотипах у больных сахарным диабетом 2 типа в Новосибирской области. Сахарный диабет. 2024;27(6):580-588. https://doi.org/10.14341/DM13195
For citation:
Bondar I.A., Shabelnikova O.Y. Risks of mortality for various phenotypes in patients with type 2 diabetes mellitus in the Novosibirsk region. Diabetes mellitus. 2024;27(6):580-588. (In Russ.) https://doi.org/10.14341/DM13195
ОБОСНОВАНИЕ
Сахарный диабет 2 типа (СД2) является одним из заболеваний с самыми быстрыми темпами увеличения распространенности в мире и представляет собой угрозу за счет ранней инвалидизации и высокой смертности. По оценкам Международной федерации диабета, в 2021 г. 6,7 млн смертей были связаны с диабетом и его осложнениями (IDF atlas 2021) [1]. В Российской Федерации так же, как и в других странах мира, растет смертность, Согласно базе данных клинико-эпидемиологического мониторинга СД на территории Российской Федерации, за период с 2010 по 2022 гг. смертность от СД2 увеличилась в 3 раза и в 2021 г. достигла 142,2 на 1000 населения [2]. Более половины смертей больных СД связана с сердечно-сосудистыми заболеваниями (ССЗ) [1][2]. К основным факторам риска высокой смертности при СД2 относят гипергликемию, гиперлипидемию, артериальную гипертензию (АГ), ожирение [3]. В недавно опубликованном обзоре факторов риска сердечно-сосудистой смерти (ССС) отмечалось влияние не только традиционных кардиометаболических факторов риска, но и генетической предрасположенности, вариабельности гликемии и инсулинорезистентности [3]. Однако исследований, направленных на изучение взаимосвязи развития фатальных событий и структурных вариантов генов TCF7L2 (rs7903146) и ATM (rs11212617), ассоциированных как с развитием СД2, так и с его осложнениями, в настоящее время представлено немного. В литературе имеются данные о взаимосвязи структурного варианта гена TCF7L2 (rs7903146) с развитием СД2 и с более выраженными нарушениями липидного обмена и почечными осложнениями [4]. Ген АТМ кодирует киназу атаксии телеангиоэктазии (ATM) и участвует в регуляции клеточного цикла, механизмах транспорта белков, метаболизме глюкозы, окислительном стрессе и функции митохондрий [5]. Приблизительно 2% населения имеют гетерозиготную мутацию в гене ATM [6]. Лица с гетерозиготной мутацией подвержены более высокому риску развития СД, сердечной недостаточности и рака [5]. В последнее время были опубликованы крупные эпидемиологические исследования по анализу основных причин смерти людей с диабетом и без него, в которых отмечено значительное снижение смертности от сердечно-сосудистых причин и увеличение или стабильный уровень смертности от инфекционных причин, таких как пневмония [7]. В обзоре, посвященном анализу динамики осложнений и смерти от диабета за период с 2015 по 2021 гг., показано, что за последние 30 лет уменьшилась частота макрососудистых осложнений и ССС, но произошло увеличение числа рака, деменции, инфекции, туберкулеза и тропических болезней [8]. Авторы отметили, что наибольшее снижение частоты сосудистых осложнений наблюдалось у пожилых людей, а для более молодых групп профили кардиометаболического риска не улучшились [8]. Таким образом, исследования, направленные на изучение факторов риска смерти у пациентов с СД2 с целью снижения неблагоприятных исходов, являются актуальными. Научных работ, посвященных анализу основных причин смерти и факторов риска развития неблагоприятных исходов у пациентов с различными клиническими фенотипами СД2 с преобладанием инсулинорезистентности или дефицита инсулина, нет.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить клинические, метаболические и генетические факторы риска смертельных исходов у больных с различными клиническими фенотипами СД2 в Новосибирской области.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование выполнено на базе Диамобиля ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» (главный врач — Юданов А.В.).
Время исследования. Исследование выполнено в период с апреля 2013 по ноябрь 2017 гг. Изучение основных причин смерти проводилось по данным свидетельств о смерти медицинского информационно-аналитического центра (МИАЦ) в период с 2014 по 31.12.2022 г.
Изучаемые популяции
В исследование было включено 2507 больных СД2, проживающих в Новосибирской области.
Критерии включения: на момент первичного обследования включались больные СД2 в возрасте от 18 до 70 лет. Верификацию диагноза СД2 проводили в соответствии с критериями Комитета экспертов Всемирной организации здравоохранения по СД (1999).
Критерии исключения на момент первичного обследования: СД1, наличие антител к β-клеткам и/или антител к декарбоксилазе глютаминовой кислоты (GADА), беременность, другие типы диабета, наличие у пациента онкологических заболеваний, сердечной недостаточности функциональных классов 3–4 в соответствии с классификацией Нью-Йоркской кардиологической ассоциации, хронической болезни почек 4–5 стадии, лечение кортикостероидами или эстрогенами, алкоголизм, наркомания, деменция или серьезные психические расстройства, острые воспалительные заболевания.
Способ формирования выборки из изучаемой популяции
Всего было обследовано 2805 больных СД2, проживающих в Новосибирской области в период с 2013 по 2017 гг. Для анализа на 31.12.2022 (через 6,3±2,5 года) были доступны данные по 2507 пациентам (89,4%), которые и были включены в последующий анализ, из них 1915 пациентов были живы, и летальный исход на 31.12.2022 зарегистрирован у 592 пациентов (23,6%).
Для изучения фатальных исходов в зависимости от клинических фенотипов СД2 пациенты были распределены на 3 группы по результатам первичного обследования на основании данных уровня С-пептида и индекса НОМА-IR: при уровне С-пептида ниже нижней границы референтных значений и индексе НОМА-IR менее 2,77 пациенты были отнесены в группу с инсулиновой недостаточностью — инсулинопенический фенотип n=288 (группа 1); при уровне С-пептида в пределах референтных значений и индексе НОМА-IR более 2,77 в группу с умеренной инсулинорезистентностью — классический фенотип n=1921 (группа 2); при уровне С-пептида выше референтных значений и индексе НОМА-IR более 2,77 в группу с выраженной инсулинорезистентностью — инсулинорезистентный фенотип n=298 (группа 3).
Дизайн исследования
Проведено проспективное когортное исследование. Первичное обследование проводилось во время выездов Диамобиля в районы Новосибирской области в период с 2013 по 2017 гг. Анализ свидетельств о смерти, по данным МИАЦ, проводился в период с 2014 по 31.12.2022 г. По 298 пациентам информация отсутствовала в связи со сменой места жительства.
Описание медицинского вмешательства
Лечебные и диагностические вмешательства являлись частью рутинной врачебной практики. Выделение ДНК и генотипирование структурных вариантов генов TCF7L2 (rs7903146) и ATM (rs11212617) проводили после подписания информированного согласия пациента из биообразцов крови.
Методы
Клиническое обследование больных включало осмотр эндокринолога, офтальмолога, кардиолога, невролога. Во время выезда Диамобиля у пациентов осуществлялся забор биоматериала: крови на исследование уровня гликированного гемоглобина (НbA1c) и биохимических параметров (глюкоза, креатинин, холестерин общий, триглицериды, липопротеиды высокой и низкой плотности (ЛПВП и ЛПНП), аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), инсулин, С-пептид) и мочи на микроальбуминурию. Все биообразцы доставлялись в сертифицированную лабораторию ГБУЗ НСО «Государственная Новосибирская областная клиническая больница». Биохимические исследования, уровни инсулина, С-пептида выполняли на автоматическом анализаторе Immulite 2000. Исследование НbA1c проводили на автоматическом анализаторе D-10 фирмы BIO-RAD методом высокоэффективной жидкостной хроматографии с помощью наборов D-10 Reorder Pack, 400 Test (производства BIO-RAD LABORATORIES).
Выделение ДНК и генотипирование структурных вариантов генов TCF7L2 (rs7903146) и ATM (rs11212617) проводили в лаборатории фармакогеномики Института химической биологии и фундаментальной медицины СО РАН с помощью ПЦР в режиме реального времени с использованием конкурирующих TaqMan-зондов (заведующий лабораторией фармакогеномики д.б.н. Филипенко М.Л.).
Статистический анализ
Для описательной статистики между группами для категорийных переменных использовали χ². Для количественных переменных при нормальном распределении данные представлены в виде среднего значения (М) и стандартного отклонения (SD). Для оценки межгрупповых различий использовался непараметрический метод Краскела–Уоллиса. Кластерный анализ К-средних был проведен на основе 5 переменных: HbA1c, возраст на момент постановки диагноза, индекс массы тела (ИМТ), С-пептид, пол. Все данные были масштабированы до среднего значения нулевой и единичной дисперсии перед кластеризацией. Для оценки связи между фатальными событиями и клиническими, лабораторными и генетическими параметрами использовали регрессию Кокса (относительный риск (ОР) (95% доверительный интервал (ДИ)). Критический уровень значимости принимали равным 0,05. Для статистической обработки использован пакет статистики SPSS13.0.
Этическая экспертиза
Исследование выполнено в соответствии с положениями Конституции Российской Федерации и Хельсинской декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей». Протокол исследования одобрен комитетом по этике Новосибирского государственного медицинского университета (протокол №52 от 19.03.2013). Перед включением в исследование все пациенты подписывали информированное согласие.
РЕЗУЛЬТАТЫ
Длительность наблюдения составила 6,3±2,5 года. Летальный исход зарегистрирован у 592 пациентов (23,6%). Средняя продолжительность жизни была 66,3±6,5 года. Длительность СД2 от момента установления диагноза 16,0±7,5 года. Достоверных отличий по частоте случаев смерти при различных клинических фенотипах не выявлено. Было установлено, что пациенты с инсулинорезистентным фенотипом имели значимо меньшую длительность диабета на момент смерти 12,3±5,5 года, по сравнению с группой умерших с классическим (16,4±7,7 года) и инсулинопеническим фенотипом (16,5±6,8 года, р<0,001), однако продолжительность жизни и длительность наблюдения значимо не различались, что, вероятно, обусловлено более поздним развитием СД2 при инсулинорезистентном фенотипе (табл. 1).
Таблица 1. Частота случаев смерти, продолжительности жизни и длительности наблюдения пациентов с сахарным диабетом 2 типа при различных клинических фенотипах
Параметр | Инсулинопенический, n=293 | Классический, n=1915 | Инсулинорезистентный, n=298 | Р |
Продолжительность жизни, лет | 66,3±6,5 65 [ 62; 70,8] | 66,6±6,4 67 [ 63; 71] | 66,1±5,8 66 [ 62; 71] | 0,316 |
Длительность СД2, лет | 16,5±6,8 15,5 [ 12; 20] | 16,4±7,7 16 [ 11; 21] | 12,3±5,5 12 [ 9; 15] | <0,001* |
Длительность наблюдения, лет | 6,6±2,5 7 [ 5; 9] | 6,2±2,5 6 [ 4; 8] | 6,7±2,8 7 [ 4,5; 9] | 0,094 |
Частота случаев смерти, n (%) | 72 (24,6) | 455 (23,8) | 65 (21,8) | 0,702 |
Примечание. * — критерий Kruskal Wallis Test, уровень статистической значимости р<0,05.
Анализ основных причин смерти установил, что ведущей причиной смерти больных СД2, независимо от клинического фенотипа были ССЗ (n=378, 63,8%), что согласуется с данными литературы (табл. 2) [2]. Достоверных различий развития фатального события в зависимости от фенотипа СД2 не выявлено, что может быть обусловлено небольшим количеством наблюдений при распределении на фенотипы, в связи с чем дальнейший анализ факторов риска развития фатальных событий проведен в общей группе больных СД2.
Таблица 2. Частота основных причин смерти в зависимости фенотипа сахарного диабета 2 типа
Параметр | Инсулинопенический, n=72 (1) | Классический, n=455 (2) | Инсулинорезистентный, n=65 (3) | Р | P1 | P2 | P3 |
ССЗ, n (%) | 51 (70,8) | 289 (63,5) | 38 (58,5) | 0,307 | 0,399 | 0,692 | 0,999 |
Онкологические заболевания, n (%) | 4 (5,6) | 46 (10,1) | 7 (10,8) | 0,451 | 0,908 | 0,674 | 0,999 |
COVID, n (%) | 2 (2,8) | 31 (6,8) | 7 (10,8) | 0,176 | 0,189 | 0,616 | 0,705 |
тХПН, n (%) | 4 (5,6) | 26 (5,7) | 0 | 0,142 | 0,957 | - | - |
Гангрена, n (%) | 3 (4,2) | 8 (1,8) | 3 (4,6) | 0,206 | 0,636 | 0,999 | 0,470 |
Заболевания печени, n (%) | 0 | 4 (0,9) | 2 (3,1) | 0,167 | 0,121 | - | - |
Кома, n (%) | 0 | 3 (0,7) | 0 | - | - | - | - |
Отек мозга, n (%) | 0 | 8 (1,8) | 1 (1,5) | 0,526 | - | - | 0,899 |
Примечание. Р — Метод множественного сравнения с поправкой Бонферрони; Р1 — инсулинопенический и инсулинорезистеный; Р2 — инсулинопенический и классический; Р3 — инсулинорезистентный и классический; ССЗ — сердечно-сосудистые заболевания, COVID — новая коронавирусная инфекция, тХПН — терминальная почечная недостаточность.
При анализе исходных клинических, лабораторных параметров и взаимосвязи структурных вариантов генов TCF7L2 (rs7903146): C/C vs C/Т, T/T и ATM (rs11212517): A/A vs A/C, C/C с наступлением фатального события было установлено, что в группе с фатальным событием от всех причин по сравнению с группой без фатального события пациенты были старше, имели большую длительность СД2, более высокий уровень глюкозы натощак и HbA1c, САД, более низкий уровень С-пептида и креатинина (табл. 3, 4) и чаще были носителями аллеля С и генотипов А/С и С/С структурного варианта гена ATM (rs11212517) 40,2% против 31,1% (р=0,021) (рис. 1). Более высокая частота инсулинотерапии и комбинированной терапии — метформин в сочетании с препаратами сульфонилмочевины у больных СД2 — в группе с фатальными исходами вероятно большей длительностью диабета.
Таблица 3. Исходные клинические показатели у пациентов с сахарным диабетом 2 типа в зависимости от фатального события в отдаленном периоде
Параметр | Без фатальных событий n=1914 | Фатальные события (все причины) n=592 | Р |
Мужчины, n (%) Женщины, n (%) | 395 (20,6) 1519 (79,4) | 172 (29,1) 420 (70,9) | <0,001 |
Возраст, лет | 58,37±6,90 | 59,94±6,13 | <0,001 |
Длительность СД, лет | 7,44±6,33 | 9,69±6,94 | <0,001 |
Возраст дебюта СД2, лет | 50,96±8,28 | 50,34±8,19 | 0,116 |
ИМТ, кг/м² | 33,73±6,21 | 33,85±6,76 | 0,686 |
САД, мм рт.ст. | 148,41±21,14 | 151,54±22,32 | 0,002 |
ДАД, мм рт.ст. | 89,89±12,11 | 90,90±12,00 | 0,076 |
Сахароснижающая терапия: инсулинотерапия, n (%) метформин, n (%) сульфонилмочевина, n (%) метформин+сульфонилмочевина, n (%) иДПП-4, n (%) иДПП-4+метформин, n (%) | 518 (27,1) 466 (24,3) 198 (10,3) 715 (37,3) 7 (0,4) 10 (0,5) | 229 (38,7) 128 (21,6) 65 (11,0) 151 (25,5) 7 (1,2) 12 (2,0) | <0,001 0,535 0,157 <0,001 0,065 0,095 |
Прием статинов, n (%) | 289 (15,1) | 74 (12,5) | 0,173 |
Примечание. * — сравнивали группы без фатального события и с фатальным событием, р<0,05. Для категориальных параметров применялся критерий хи-квадрат Пирсона; для непрерывных показателей, распределенных нормально (данные представлены в виде m±σ), критерий Стьюдента для сравнения двух групп); ИМТ — индекс массы тела, САД — систолическое артериальное давление, ДАД — диастолическое артериальное давление, иДПП-4 — ингибиторы дипептидилпептидазы 4 типа.
Таблица 4. Исходные лабораторные показатели у пациентов с сахарным диабетом 2 типа в зависимости от фатального события в отдаленном периоде
Параметр | Без фатальных событий n=1914 | Фатальные события (все причины) n=592 | COVID n=40 | ССЗ n=378 |
Глюкоза крови натощак, ммоль/л | 8,53±2,82 | 9,57±3,46 Р<0,001* | 9,47±3,45 Р=0,141 | 9,69±3,55 Р<0,001* |
HbA1c, % | 8,5 [ 7,1; 10,2] | 9,8 [ 7,9; 11,3] Р<0,001* | 9,85 [ 8,03; 11,78] Р<0,006* | 9,9 [ 8,0; 11,4] Р<0,001* |
HOMA-IR | 3,02 [ 2,07; 4,85] | 3,08 [ 2,20; 5,34] Р=0,233 | 2,99 [ 2,25; 5,11] Р=0,562 | 3,08 [ 2,16; 5,07] Р=0,453 |
HOMA-FB | 24,0 [ 14,3; 46,6] | 25,0 [ 13,6; 52,0] Р=0,834 | 25,02 [ 17,4; 63,8] Р=0,287 | 25,0 [ 13,6; 50,6] Р=0,989 |
С-пептид, нмоль/л | 552,5 [ 337,8; 869,0] | 480,0 [ 285,0; 818,5] Р<0,001* | 582,0 [ 322,0; 1003,7] Р=0,590 | 480,0 [ 285,8; 798,5] Р=0,001* |
Общий холестерин, ммоль/л | 5,60 [ 5,0; 6,66] | 5,65 [ 5,0; 6,57] Р=0,876 | 5,90 [ 4,88; 6,71] Р=0,871 | 5,6 [ 5,0; 6,4] Р=0,465 |
Триглицериды, ммоль/л | 1,70 [ 1,36; 2,55] | 1,70 [ 1,42; 2,59] Р=0,688 | 1,70 [ 1,15; 2,68] Р=0,402 | 1,70 [ 1,38; 2,39] Р=0,350 |
ЛПВП, ммоль/л | 1,06 [ 0,99; 1,31] | 1,06 [ 0,98; 1,30] Р=0,104 | 1,06 [ 1,01; 1,27] Р=0,757 | 1,06 [ 0,98; 1,33] Р=0,434 |
ЛПНП, ммоль/л | 3,01 [ 2,72; 3,44] | 3,0 [ 2,73; 3,43] Р=0,981 | 2,98 [ 2,80; 3,43] Р=0,699 | 3,0 [ 2,75; 3,41] Р=0,693 |
АЛТ, ЕД/л | 20,0 [ 17,0; 25,0] | 20,8 [ 17,0; 27,0] Р=0,382 | 19,85 [ 17,3; 26,1] Р=0,900 | 21,0 [ 17,0; 28,2] Р=0,100 |
АСТ, ЕД/л | 19,0 [ 16,7; 24,4] | 19,6 [ 16,9; 26,0] Р=0,145 | 19,0 [ 17,2; 23,7] Р=0,877 | 19,9 [ 17,0; 26,0] Р=0,046* |
Креатинин, мкмоль/л | 80,0 [ 70,5; 91,7] | 78,5 [ 69,8; 89,1] Р<0,001* | 82,5 [ 76,3; 100,0] Р=0,020* | 82,1 [ 71,0; 97,8] Р<0,001* |
Примечание. * — Сравнивали группы без фатального события и с фатальным событием, р<0,05. Для категориальных параметров применялся критерий хи-квадрат Пирсона; для непрерывных показателей, распределенных нормально (данные представлены в виде m±σ), — критерий Стьюдента для сравнения двух групп; для непрерывных показателей, распределенных ненормально (данные представлены в виде Me [ 25%; 75%]), — критерий Mann-Whitney.
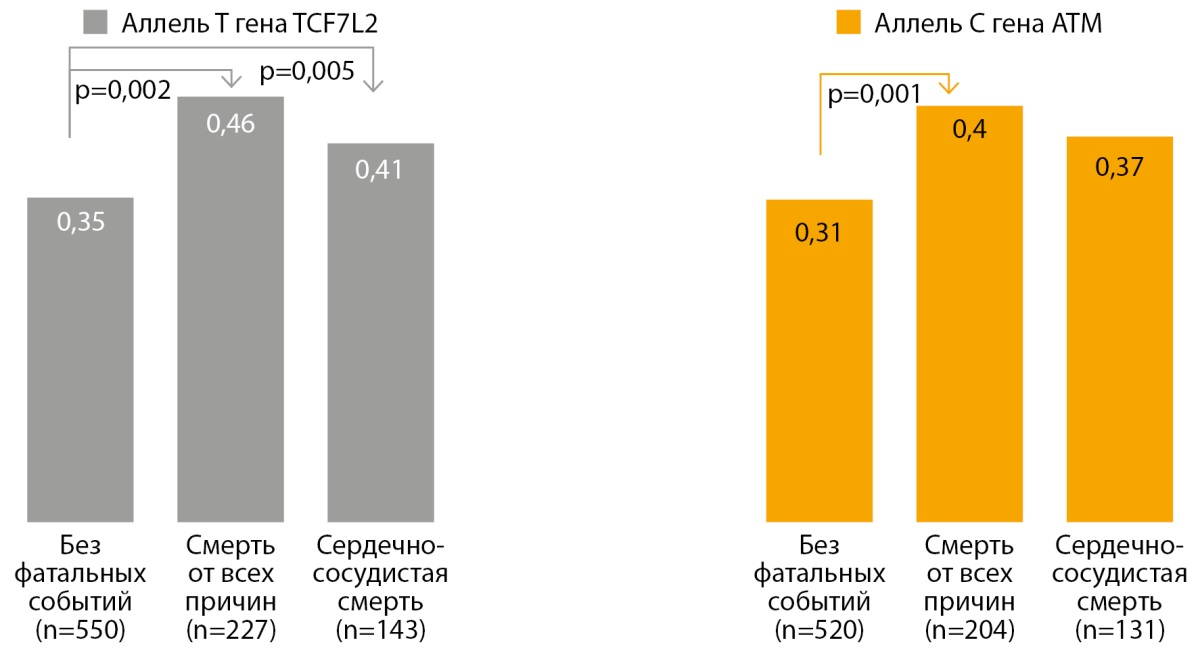
Рисунок 1. Частота аллеля Т структурного варианта гена TCF7L2 (rs7903146) и аллеля С структурного варианта гена ATM (rs11212617) в зависимости от фатального исхода.
При проведении многофакторного регрессионного анализа Кокса выявлены традиционные факторы риска смерти от всех причин у больных СД2: длительность СД2, уровень HbA1c, уровень креатинина. А также установлена ассоциация развития фатального события с наличием аллеля Т и генотипов С/Т и Т/Т гена TCF7L2 (rs7903146): C/C vs C/Т, T/T (ОР 1,431, р=0,017) и аллеля С и генотипов А/С и С/С гена ATM (rs11212517): A/A vs A/C, C/C (ОР 1,509, р=0,007).
В проведенном нами исследовании выявлено, что группа пациентов, где причиной смерти были ССЗ, отличалась от пациентов без фатального события старшим возрастом (60,02±6,17 года против 58,74±6,76 года, Р<0,001), большей длительностью СД2 (10,11±7,08 года против 7,97±6,55 года, Р<0,001) и высокими показателями глюкозы натощак (9,69±3,55 ммоль/л против 8,53±2,82 ммоль/л, р<0,001), более высокими значениями HbA1c, САД, креатинина, АСТ, низким уровнем С-пептида (табл. 4) и высокой частотой аллеля Т и генотипов С/Т и Т/Т гена TCF7L2 (rs7903146) (рис. 1). Не было установлено взаимосвязи ССС с уровнем холестерина, ЛПНП, ЛПВП и триглицеридов (табл. 3). Выявленные различия факторов риска наступления смерти у больных СД2 были подтверждены многофакторным регрессионным анализом Кокса. Так, при развитии смерти от ССЗ наиболее значимыми предикторами были HbA1c: риск фатального исхода увеличивался на 12,9% при повышении HbA1c на 1%, риск смерти увеличивался на 1,4%, (р=0,002) на каждый год заболевания. Повышение уровня креатинина на каждый 1 мкмоль/л повышало риск смерти на 1,5%, наличие аллеля Т и генотипов С/Т и Т/Т гена TCF7L2 (rs7903146) увеличивало риск смерти на 71,9%, а наличие аллеля С и генотипов А/С и С/С гена ATM (rs11212517) — на 53,9%.
За анализируемый период у 40 пациентов причиной смерти была коронавирусная инфекция (COVID). В этой группе пациенты отличались исходным более высоким уровнем креатинина и HbA1c. Следует отметить, что, несмотря на отсутствие статистической значимости, в группе инсулинорезистентного фенотипа смерть от коронавирусной инфекции была самой высокой и составила 10,8% по сравнению с классическим фенотипом 6,8% и инсулинопеническим фенотипом 2,8%. Риск развития фатального события от COVID увеличивался на 18,7% при повышении уровня HbA1c на 1% и на каждый 1 мкмоль/л креатинина на 3% (табл. 5).
Таблица 5. Отношение шансов развития фатального события в зависимости от клинических, лабораторных и генетических факторов
Фатальное событие | ОР | 95% ДИ | Р |
Смерть от всех причин | |||
Генотип С/С vs С/Т и Т/Т гена TCF7L2 (rs7903146) | 1,431 | 1,066–1,921 | 0,017* |
Генотип А/А vs А/С и С/С гена ATM (rs11212517) | 1,509 | 1,121–2,032 | 0,007* |
Длительность СД2, на каждый 1 год | 1,043 | 1,023–1,064 | <0,001* |
HbA1c, на каждый 1% | 1,131 | 1,067–1,198 | <0,001* |
Креатинин, на каждый 1 мкмоль/л | 1,013 | 1,005–1,021 | 0,002* |
Сердечно-сосудистая смерть | |||
Генотип C/C vs С/Т и Т/Т гена TCF7L2 (rs7903146) | 1,719 | 1,179–2,506 | 0,005* |
Генотип А/А vs А/С и С/С гена ATM (rs11212517) | 1,539 | 1,058–2,240 | 0,024* |
Длительность СД2, на каждый 1 год | 1,041 | 1,014–1,068 | 0,002* |
HbA1c, на каждый 1% | 1,129 | 1,050–1,213 | 0,001* |
Креатинин, на каждый 1 мкмоль/л | 1,015 | 1,005–1,025 | 0,001* |
Коронавирусная инфекция | |||
HbA1c, на каждый 1% | 1,187 | 1,061–1,328 | 0,003* |
Креатинин, на каждый 1 мкмоль/л | 1,030 | 1,011–1,049 | 0,002* |
Онкологические заболевания | |||
Креатинин, на каждый 1 мкмоль/л | 1,023 | 1,005–1,041 | 0,011* |
Примечание. * — логистический регрессионный анализ Кокса, отношение шансов (ОР) (95% доверительный интервал (ДИ)). Критический уровень значимости, р<0,05.
Злокачественные заболевания как причина смерти зарегистрированы у 57 человек, только более высокий исходный уровень креатинина был ассоциирован со смертью от онкологических заболеваний, по другим параметрам, включая гликемию и показатели инсулинорезистентности, различий не было. При анализе частоты данной причины смерти в зависимости от фенотипа мы обратили внимание, что смерть от онкологических заболеваний при инсулинопеническом фенотипе встречалась в 2 раза реже (5,6% по сравнению с классическим 10,1% и инсулинорезистентным 10,8%), но также не достигала уровня статистической значимости. Отсутствие статистической разницы, вероятно, обусловлено малым количеством наблюдений. Риск наступления смерти от онкологии увеличивался с каждым 1 мкмоль/л креатинина на 2,3% (табл. 5).
ОБСУЖДЕНИЕ
Репрезентативность выборок
Клиническая характеристика обследованных нами больных согласуется с данными других обсервационных исследований [9][10] и отражает в целом популяцию больных СД2, что в определенной степени позволяет экстраполировать полученные нами результаты на целевую популяцию.
Сопоставление с другими публикациями
Наш анализ данных за период с 2013 по 2022 гг. показал, что у пациентов с СД2 самыми сильными предикторами как неблагоприятных сердечно-сосудистых исходов, так и смерти от всех причин, являлись более старший возраст, большая длительность СД2, высокий уровень глюкозы натощак, HbA1c, САД, креатинина и более низкий уровень С-пептида. При этом высокий уровень HbA1c был наиболее значимым предиктором как общей, так и ССС независимо от фенотипа СД2. Подобное негативное влияние высокого уровня HbA1c было продемонстрировано при анализе данных Шведского национального регистра диабета, в котором изучали риски инсульта и смертности в зависимости от уровня HbA1c. Было отмечено ступенчатое повышение риска смерти после инсульта при увеличении уровня HbA1c: при показателях 54–64 ммоль/моль: ОР=1,27 (95% ДИ 1,22–1,32) и при уровне HbA1c более 87 ммоль/моль: ОР=2,14 (95% ДИ 1,90–2,42) по сравнению с группой с HbA1c менее 53 ммоль/моль [10].
В отличие от нашего исследования, где не было обнаружено статистически значимой взаимосвязи неблагоприятных исходов с индексами инсулинорезистентности (HOMA-IR) и уровнем инсулина, в исследовании ACCELERATE, в котором приняли участие 12 092 пациентов (у 2042 был СД2), уровень инсулина в плазме натощак оказался независимым предиктором основных неблагоприятных сердечно-сосудистых исходов (ОР=1,36, p=0,007) и необходимости реваскуляризации (ОР=1,56, p=0,001) [11]. В проведенном нами исследовании отмечена взаимосвязь более низкого уровня С-пептида с общей смертностью, в то время как в ретроспективном когортном исследовании, включившем 864 человека с СД2, у которых при диагностике диабета измеряли уровень С-пептида натощак и уровень HbA1c, было установлено, что увеличение уровня С-пептида натощак на одно стандартное отклонение было связано со смертностью от всех причин (ОР=1,33, p=0,001) и смертностью от рака (ОР=1,51, р=0,005), а увеличение HbA1c на одно стандартное отклонение ассоциировалось со смертностью от всех причин (ОР=1,24; р=0,005), серьезными сердечно-сосудистыми событиями (ОР=1,20, р=0,015), инсультом (ОР=1,36, p=0,006) и ретинопатией (ОР=1,54, p<0,0001) [12].
Проведенное исследование не выявило взаимосвязи постпрандиальной гипергликемии и гиперлипидемии с фатальными событиями, в то время как в других исследованиях отмечено влияние именно гипертриглицеридемии на развитие неблагоприятных сердечно-сосудистых исходов. В обсервационном проспективном исследовании в Италии риск смертности был значительно выше при высоком уровне триглицеридов (ОР=1,167, p=0,003) и низком уровне холестерина ЛПВП (1,232, p<0,0001) [13], а группой японских авторов была установлена не только взаимосвязь постпрандиальной гипергликемии и гипертриглицеридемии со смертностью от всех причин у пациентов с СД2, но и предложены пороговые значения постпрандиальной гликемии (13,8 ммоль/л) и гипертриглицеридемиии, ассоциированные с повышенным риском смертности [14]. Отсутствие взаимосвязи гиперлипидемии с развитием фатальных событий, вероятно, связано с небольшой длительностью наблюдения (6,3±2,5 года).
Новая коронавирусная инфекция как причина смерти была зарегистрирована только у 40 пациентов в проведенном исследовании, а наиболее значимым предиктором неблагоприятного исхода являлся высокий уровень HbA1c. Эти данные согласуются с результатами других исследований. Высокая смертность при худшем гликемическом контроле (стратифицированном по HbA1c) была продемонстрирована при анализе базы данных 10 926 смертей от COVID, у пациентов с уровнем HbA1c <7,5% скорректированный показатель HR для смерти составил 1,31, тогда как при уровне HbA1c≥7,5% показатель HR составил 1,95 [15]. В Британском исследовании у пациентов с СД2 также было подтверждено, что более высокий уровень HbA1c и вероятность острого повреждения почек при коронавирусной инфекции взаимосвязана с более высокой смертностью [16]. При анализе факторов риска неблагоприятных исходов от коронавирусной инфекции базы данных клинико-эпидемиологического мониторинга СД на территории Российской Федерации, кроме взаимосвязи с HbA1c ≥7% (ОР=1,35), была показана взаимосвязь с мужским полом (ОР=1,18), возрастом старше 65 лет (ОР=3,18) и длительностью СД более 10 лет (ОР=2,11) [17].
Известно, что протеинкиназа АТМ является ядерным белком, участвующем в клеточном цикле, активация которого происходит при повреждении ДНК, а аллель С структурного варианта гена ATM (rs11212517) ассоциирована с метаболическими и сердечно-сосудистыми осложнениями [6]. Выявленная нами взаимосвязь наличия аллеля С структурного варианта гена ATM (rs11212517) с повышенной общей и ССС согласуется с результатами ранее проведенных исследований. Так, еще в 2000 г. было отмечено, что наличие аллеля С структурного варианта гена ATM (rs11212517) у 405 обследованных сопровождалось повышенным риском смерти ОР=1,9. Среди основных причин смерти была онкология ОР=2,6; умершие от рака были в среднем на 4 года моложе. На втором месте была ишемическая болезнь сердца (ИБС) ОР=2,0, умершие носители аллеля С в среднем на 11 лет были моложе по сравнению с неносителями аллеля С (P = 0,006) [6].
В настоящее время ген TCF7L2 рассматривается как центральный транскрипционный регулятор, влияющий на экспрессию генов, участвующих в метаболизме липидов и глюкозы [18], и участвует не только в формировании дисфункции β-клеток, но и в процессах адипогенеза и нарушении метаболизма жировой ткани, способствуя гипертрофии адипоцитов и периферической и печеночной резистентности к инсулину [19].
В исследовании ARIC, включившем 13 000 больных, не выявлено ассоциации структурных вариантов гена TCF7L2 (rs7903146, rs12255372, rs7901695, rs11196205, rs7895340) с ИБС, ишемическим инсультом, ССЗ, атеросклерозом периферических артерий или смертностью от всех причин [20]. В ранее опубликованных работах было установлено, что только в группе больных без СД наличие аллеля Т гена TCF7L2 (rs7903146) взаимосвязано с более высоким шансом иметь какое-либо поражение коронарных артерий (ОР=1,51, р=0,01), высокой распространенностью трехсосудистого поражения коронарных артерий (ОР=1,76, p=0,01) и со значительно более высокой частотой сердечно-сосудистых событий, в то время как на популяции больных с СД2 данные взаимосвязи не выявлены [21]. Однако нами получены результаты, что наличие аллеля Т и генотипа С/Т и Т/Т гена TCF7L2 (rs7903146) увеличивало риск смерти от ССЗ на 71,9% (1,719 (1,179–2,506, р=0,005),
Клиническая значимость результатов
В настоящее время нет клинических рекомендаций, основанных на фенотипах диабета, но наши результаты в сочетании с данными других авторов позволяют предположить, что фенотип СД2 с выраженной инсулинорезистентностью и повышением функции β-клеток имеет худший прогноз и раннюю смертность. Выявленная взаимосвязь наступления фатального события с наличием аллеля Т гена TCF7L2 (rs7903146) и аллеля С гена ATM (rs11212517) требует дальнейших исследований. Таким образом, подход, сочетающий фенотипические особенности СД2 и генетические исследования, для прогнозирования фатальных событий имеет большую клиническую ценность.
Ограничения исследования
Наше когортное обсервационное исследование имеет несколько сильных сторон, но также и некоторые заметные ограничения. Мы не учитывали изменения переменных факторов риска во время наблюдения, и хотя это имело бы преимущества, использованный нами подход сводит к минимуму риск обратной причинно-следственной связи при интерпретации результатов. Кроме того, мы не проводили различий между пациентами, у которых переменные находились в пределах целевого диапазона без какого-либо специального вмешательства, и пациентами, которые получали медикаментозное лечение.
Направления дальнейших исследований
В настоящее время продолжается наблюдение за включенными в исследование пациентами для анализа риска развития осложнений и исходов в зависимости от клинического фенотипа СД2 с целью увеличения мощности выборки.
ЗАКЛЮЧЕНИЕ
Проведенное исследование выявило, что пациенты с инсулинорезистеным фенотипом и кластер со сниженной функцией β-клеток имели более неблагоприятный прогноз. Наиболее значимым предиктором общей и ССС являлся HbA1c. Наличие аллеля Т гена TCF7L2 (rs7903146) увеличивало риск общей смертности на 43,1%, аллеля С гена ATM (rs11212617) — на 50,9%. Наиболее значимый вклад генетические факторы вносили в наступление ССС.
Установлен более неблагоприятный прогноз развития смерти при инсулинорезистентном фенотипе, продолжительность жизни от момента установления диагноза была меньше при инсулинорезистентном фенотипе по сравнению с инсулинопеническим и классическим фенотипами. Определены клинические, метаболические и генетические факторы риска фатального события от всех причин в общей группе больных СД2: длительность СД2, HbA1c, уровень креатинина, наличие аллеля Т и генотипов С/Т и Т/Т гена TCF7L2 (rs7903146) увеличивало риск смерти на 43,1% и наличие аллеля С и генотипов А/С и С/С гена ATM (rs11212517) — на 50,9%. Выявлено, что наиболее частой причиной смерти у больных СД2 были ССЗ — 63,8%, а риск фатального исхода от ССЗ был ассоциирован с высоким уровнем HbA1c, креатинина, длительностью диабета.
Установлено, что наличие аллеля Т и генотипов С/Т и Т/Т гена TCF7L2 (rs7903146) увеличивало риск смерти от ССЗ на 71,9% и аллеля С и генотипов А/С и С/С гена ATM (rs11212517) — на 53,9%.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при поддержке гранта РФФИ 13-04-00520.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Бондарь И.А. — существенный вклад в концепцию исследования, в интерпретацию результатов исследования; внесение в рукопись существенной правки с целью повышения научной ценности статьи; Шабельникова О.Ю. — существенный вклад в концепцию исследования, в получение, анализ данных и интерпретацию результатов исследования, написание статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы выражают благодарность профессиональному математику Научно-исследовательского института терапии и профилактической медицины — филиала Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр Институт цитологии и генетики СО РАН» Лилии Валерьевне Щербаковой за помощь в проведении кластерного анализа.
Список литературы
1. International Diabetes Federation. IDF Diabetes Atlas, 10th edn. Brussels, Belgium; 2021. Available from: https://www.diabetesatlas.org
2. Дедов И.И., Шестакова М.В., Викулова О.К. с соавт. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. https://doi.org/10.14341/DM13035
3. Yun JS, Ko SH. Current trends in epidemiology of cardiovascular disease and cardiovascular risk management in type 2 diabetes. Metabolism. 2021;123:154838. https://doi.org/10.1016/j.metabol.2021.154838
4. Engelbrechtsen L, Hansen TH, Mahendran Y, et al. Homozygous carriers of the TCF7L2 rs7903146 T-allele show altered postprandial response in triglycerides and triglyceride-rich lipoproteins. Sci Rep. 2017;7:1–8. https://doi.org/10.1038/srep43128
5. Wingard MC, Frasier CR, Singh M, et al. Heart failure and diabetes: role of ATM. Curr Opin Pharmacol. 2020;54:27-35. https://doi.org/10.1016/j.coph.2020.06.007
6. Su Y, Swift M. Mortality rates among carriers of ataxia-telangiectasia mutant alleles. Ann Intern Med. 2000;133(10):770-8. https://doi.org/10.7326/0003-4819-133-10-200011210-00009
7. Pearson-Stuttard J, Bennett J, Cheng YJ, еt al. Trends in predominant causes of death in individuals with and without diabetes in England from 2001 to 2018: an epidemiological analysis of linked primary care records. Lancet Diabetes Endocrinol. 2021;9(3):165-173. https://doi.org/10.1016/S2213-8587(20)30431-9
8. Ali MK, Pearson-Stuttard J, Selvin E, еt al. Interpreting global trends in type 2 diabetes complications and mortality. Diabetologia. 2022;65(1):3-13. https://doi.org/10.1007/s00125-021-05585-2
9. Rawshani A, Rawshani A, Franzén S, et al. Risk Factors, Mortality, and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 2018;379(7):633-644. https://doi.org/10.1056/NEJMoa1800256
10. Zabala A, Darsalia V, Holzmann MJ, et al. Risk of first stroke in people with type 2 diabetes and its relation to glycaemic control: A nationwide observational study. Diabetes Obes Metab. 2020;22(2):182-190. https://doi.org/10.1111/dom.13885
11. Kumar A, Patel DR, Wolski KE, et al. Baseline fasting plasma insulin levels predict risk for major adverse cardiovascular events among patients with diabetes and high-risk vascular disease: Insights from the ACCELERATE trial. Diab Vasc Dis Res. 2019;16(2):171-177. https://doi.org/10.1177/1479164119827604
12. Otten J, Tavelin B, Söderberg S, et al. Fasting C-peptide at type 2 diabetes diagnosis is an independent risk factor for total and cancer mortality. Diabetes Metab Res Rev. 2022;38(3):e3512. https://doi.org/10.1002/dmrr.3512
13. Orsi E, Penno G, Solini A, et al. Renal Insufficiency And Cardiovascular Events (RIACE) Study Group. Independent association of atherogenic dyslipidaemia with all-cause mortality in individuals with type 2 diabetes and modifying effect of gender: a prospective cohort study. Cardiovasc Diabetol. 2021;20(1):28. https://doi.org/10.1186/s12933-021-01224-7
14. Takao T, Suka M, Yanagisawa H, et al. Thresholds for postprandial hyperglycemia and hypertriglyceridemia associated with increased mortality risk in type 2 diabetes patients: A real-world longitudinal study. J Diabetes Investig. 2021;12(5):886-893. https://doi.org/10.1111/jdi.13403
15. Feldman EL, Savelieff MG, Hayek SS, et al. COVID-19 and Diabetes: A Collision and Collusion of Two Diseases. Diabetes. 2020;69(12):2549-2565. https://doi.org/10.2337/dbi20-0032
16. Holman N, Knighton P, Kar P, et al. Risk factors for COVID-19-related mortality in people with type 1 and type 2 diabetes in England: a population-based cohort study. Lancet Diabetes Endocrinol. 2020;8(10):823-833. https://doi.org/10.1016/S2213-8587(20)30271-0
17. Shestakova MV, Vikulova OK, Elfimova AR, et al. Risk factors for COVID-19 case fatality rate in people with type 1 and type 2 diabetes mellitus: A nationwide retrospective cohort study of 235,248 patients in the Russian Federation. Front Endocrinol (Lausanne). 2022;13:909874. https://doi.org/10.3389/fendo.2022.909874
18. Geoghegan G, Simcox J, Seldin MM, et al. Targeted deletion of Tcf7l2 in adipocytes promotes adipocyte hypertrophy and impaired glucose metabolism. Mol Metab. 2019;24:44-63. https://doi.org/10.1016/j.molmet.2019.03.003
19. Chen X, Ayala I, Shannon C, et al. The Diabetes Gene and Wnt Pathway Effector TCF7L2 Regulates Adipocyte Development and Function. Diabetes. 2018;67(4):554-568. https://doi.org/10.2337/db17-0318
20. Bielinski SJ, Pankow JS, Folsom AR, et al. TCF7L2 single nucleotide polymorphisms, cardiovascular disease and all-cause mortality: the Atherosclerosis Risk in Communities (ARIC) study. Diabetologia. 2008;51(6):968-70. https://doi.org/10.1007/s00125-008-1004-1
21. Sousa AG, Marquezine GF, Lemos PA, et al. TCF7L2 polymorphism rs7903146 is associated with coronary artery disease severity and mortality. PLoS One. 2009;4(11):e7697. https://doi.org/10.1371/journal.pone.0007697
Об авторах
И. А. БондарьРоссия
Бондарь Ирина Аркадьевна - д.м.н., профессор.
Новосибирск
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
О. Ю. Шабельникова
Россия
Шабельникова Олеся Юрьевна - к.м.н.
630087, Новосибирск, ул. Немировича-Данченко, д. 130
Конфликт интересов:
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Частота аллеля Т структурного варианта гена TCF7L2 (rs7903146) и аллеля С структурного варианта гена ATM (rs11212617) в зависимости от фатального исхода. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(285KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Бондарь И.А., Шабельникова О.Ю. Риски смертельных исходов при различных клинических фенотипах у больных сахарным диабетом 2 типа в Новосибирской области. Сахарный диабет. 2024;27(6):580-588. https://doi.org/10.14341/DM13195
For citation:
Bondar I.A., Shabelnikova O.Y. Risks of mortality for various phenotypes in patients with type 2 diabetes mellitus in the Novosibirsk region. Diabetes mellitus. 2024;27(6):580-588. (In Russ.) https://doi.org/10.14341/DM13195

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































