Перейти к:
Рандомизированное контролируемое испытание эффективности и безопасности системы поддержки принятия врачебных решений на основе искусственного интеллекта для коррекции параметров инсулиновой помпы у детей с сахарным диабетом 1 типа
https://doi.org/10.14341/DM13171
Аннотация
ОБОСНОВАНИЕ. Ранее нами был представлен процесс разработки системы поддержки принятия врачебных решений (СППВР) по коррекции параметров инсулиновой помпы (ИП) у детей с сахарным диабетом 1 типа (СД1) и оценка согласованности генерируемых ею рекомендаций с экспертным мнением врачей. Полученные результаты показали удовлетворительные параметры точности прогнозирования профиля глюкозы и частоту согласованности рекомендаций между СППВР и врачами-экспертами.
ЦЕЛЬ. Оценить эффективность и безопасность применения СППВР на основе искусственного интеллекта у детей с СД1, проверив гипотезу не меньшей (с пределом -5%) эффективности по критерию относительного прироста времени глюкозы в целевом диапазоне (ВЦД) за 6 месяцев.
МАТЕРИАЛЫ И МЕТОДЫ. В испытание было включено 80 детей с СД1, разделенных на две сопоставимые группы по 40 детей методом минимизации. Пациенты основной группы получали рекомендации по коррекции настроек ИП от врача, который использует СППВР, пациенты контрольной группы получали рекомендации от врача (группа контроля). Пациенты наблюдались в течение 6 месяцев с проведением дистанционных консультаций 1 раз в месяц (всего 7 консультаций) и контролем гликированного гемоглобина (HbA1c) на 1, 4 и 7 консультациях. Первичный исход — разность групповых средних относительного изменения ВЦД (%), дополнительные исходы, — ВЦД (%), концентрация HbA1c.
РЕЗУЛЬТАТЫ. Испытание окончили 63 пациента: 32 в основной группе, 31 в группе контроля. Разность средних относительного прироста ВЦД на 7 консультации в группах составила 3,02%, односторонний 95% ДИ (-4,55%; inf ). Таким образом, нижняя граница этого ДИ больше предела неменьшей эффективности -5%, и гипотеза неменьшей эффективности может быть принята. Статистически значимых различий между группами ни по одному изучаемому исходу не было установлено. Динамика показателей была положительной в основной группе, имела статистическую тенденцию к положительным изменениям в группе контроля.
ЗАКЛЮЧЕНИЕ. Применение СППВР имело неменьшую эффективность в отношении показателя ВЦД, чем ведение пациента врачом. Применение в клинической практике СППВР может оказать помощь в регулярном и частом наблюдении детей с СД1, стандартизировать на высоком уровне подход к коррекции параметров ИП, дополненной системами мониторинга глюкозы.
Ключевые слова
Для цитирования:
Лаптев Д.Н., Сорокин Д.Ю., Труфанова Е.С., Реброва О.Ю., Безлепкина О.Б. Рандомизированное контролируемое испытание эффективности и безопасности системы поддержки принятия врачебных решений на основе искусственного интеллекта для коррекции параметров инсулиновой помпы у детей с сахарным диабетом 1 типа. Сахарный диабет. 2024;27(3):254-264. https://doi.org/10.14341/DM13171
For citation:
Laptev D.N., Sorokin D.Yu., Trufanova E.S., Rebrova O.Yu., Bezlepkina O.B. Effectiveness and safety of an artificial intelligence-based medical decision support system for adjusting insulin pump settings in children with type 1 diabetes mellitus: randomized controlled trial. Diabetes mellitus. 2024;27(3):254-264. (In Russ.) https://doi.org/10.14341/DM13171
ОБОСНОВАНИЕ
Распространенность сахарного диабета (СД) в мире продолжает расти, и прогнозируется, что к 2030 г. он займет 7 место по значимости летальных исходов [1]. Опасность представляют не только острые осложнения СД (диабетический кетоацидоз, тяжелая гипогликемия), но и хронические — воздействие стабильной гипергликемии на органы и системы с нарушением их функционирования. Ежегодно на его лечение в мире тратится более 600 миллиардов долларов США [2].
Терапия сахарного диабета 1 типа (СД1) включает в себя современные достижения медицины: инсулиновые помпы (ИП), системы мониторинга глюкозы (непрерывный мониторинг глюкозы (НМГ), флеш-мониторинг глюкозы (ФМГ)), аналоги человеческого инсулина и др. Но несмотря на это, процесс достижения компенсации обменных процессов у детей остается затруднительным [3]. За более чем 30-летний опыт использования интенсифицированной схемы инсулинотерапии у пациентов с СД1 существует ограниченное количество данных и нет единых рекомендаций для врачей и пациентов по способам оптимизации параметров инсулинотерапии [4, 5]. Отсутствие конкретных рекомендаций приводит к субъективной коррекции доз инсулинотерапии медицинскими работниками, которые основываются на их индивидуальном опыте и, следовательно, сильно различаются.
Искусственный интеллект (ИИ) широко внедряется в медицинскую практику. Его потенциальными преимуществами являются: широкий охват пациентов, высокая эффективность и низкая стоимость. ИИ может расширить возможности полноценного, индивидуализированного и интеллектуального ведения СД [6-8].
Ранее нами был представлен процесс разработки системы поддержки принятия врачебных решений (СППВР) — математической модели по коррекции параметров помповой инсулинотерапии (ПИ) у детей с СД1, использующих ИП и НМГ/ФМГ, и оценка согласованности рекомендаций СППВР с экспертным мнением врачей [9]. В своей основе математическая модель имеет рекуррентную нейронную сеть, которая предсказывает концентрацию глюкозы на горизонте 30-60-90-120 минут. Сравнение точности предсказаний концентрации глюкозы разработанной модели с аналогичными моделями показало уменьшение риска развития системной ошибки и более точные показатели прогнозирования профиля глюкозы нашей модели на всех четырех точках. На базе модели по прогнозированию концентрации глюкозы был разработан оптимизатор настроек ИП. Коррекция проводится по трем параметрам: базальный профиль (БП), углеводный коэффициент (УК), чувствительность к инсулину (ЧИ). Модель по прогнозированию профиля глюкозы и оптимизатор параметров ПИ реализованы в виде СППВР по коррекции ПИ у детей с СД1. Для оценки возможности клинического использования модели была проведена оценка сопоставимости рекомендаций СППВР с рекомендациями врачей при коррекции ПИ, дополненной НМГ/ФМГ, у детей с СД1. Согласно индексу Каппа, (взвешенная) согласованность рекомендаций СППВ и врачебных рекомендаций по всем трем параметрам ПИ находилась в диапазоне 0,063–0,149, что соответствует незначительной согласованности. Однако частота встречаемости полной согласованности по всем трем параметрам ПИ (БП, УК, ЧИ) находилась в диапазоне 37,5–53,8%, а частичной согласованности — 38,9–50,7%, что клинически является удовлетворительным и соответствует ранее проведенным исследованиям [10]. Различий среднечасовых настроек параметров ИП между СППВР и врачами-экспертами не обнаружено.
Таким образом, получив приемлемую точность прогнозирования концентрации глюкозы и сопоставимые рекомендации СППВР и врачей относительно параметров ИП, актуальным является провести клиническое исследование с оценкой эффективности и безопасности СППВР у детей с СД1.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить эффективность и безопасность применения СППВР на основе ИИ у детей с СД1, проверив гипотезу неменьшей (с пределом 5%) эффективности по критерию относительного прироста времени глюкозы в целевом диапазоне (ВЦД) за 6 месяцев.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования — детское отделение сахарного диабета ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России, исследование проводилось с февраля по декабрь 2023 г.
Изучаемая популяция — дети с СД1.
Критерии включения
1.Дети обоих полов.
2.Возраст от 1 до 18 лет.
3.СД1 (Е10 по МКБ-10).
4.Длительность заболевания 1 год и более.
5.Инсулинотерапия посредством непрерывной подкожной инфузии инсулина длительностью от трех месяцев.
6.Контроль уровня глюкозы путем НМГ/ФМГ длительностью от трех месяцев.
7.Недостижение целевого гликемического контроля, оцениваемое по одному из следующих показателей: HbA1c≥7%, ВЦД (3,9–10,0) ммоль/л менее 70% или время ниже целевого диапазона (ВНД) (<3,9 ммоль/л) более 4%.
Критерии исключения
1.Клинически значимые, острые заболевания сердечно-сосудистой, нервной, мочеполовой систем, желудочного-кишечного тракта и заболевания крови.
2.Инсулинотерапия путем множественных инъекций инсулина в течение более 14 дней за последний месяц.
3.Системная терапия препаратами глюкокортикоидов.
4.Клинически нестабильная или требующая лечения препролиферативная, пролиферативная ретинопатия или макулопатия.
5.Наличие в анамнезе эмоциональных, поведенческих или других расстройств, которые могут помешать контролю СД и участию в исследовании.
Критерии выбывания
1.Нежелание пациента продолжать участвовать и проводить дистанционные консультации.
2.Технические проблемы в работе ИП, в результате которых пациент вынужден вернуться к использованию множественных инъекций инсулина.
Способ формирования выборки из изучаемой популяции — сплошной.
Дизайн исследования: рандомизированное контролируемое испытание с одиночным ослеплением. Пациенты были разделены на 2 группы — основную и контрольную; до окончания исследования пациенты не знали, в какой группе находились. Способ формирования групп: минимизация (адаптивная рандомизация) с использованием программного инструмента MinimPy v.2.0 (https://minimpy.sourceforge.net/). Применялись следующие критерии для достижения сопоставимости групп: возраст до 12 и старше, уровень HbA1c — до 7%, 7–9% и более 9%, длительность СД1 — до двух и более лет.
Ведение пациентов осуществлялось в течение 6 месяцев с проведением дистанционных телемедицинских консультаций исходно и 1 раз в месяц (всего 7 консультаций).
Описание медицинского вмешательства
Вмешательства:
1)основная группа: пациенты получали рекомендации по коррекции настроек ИП от врача, который использует СППВР по коррекции параметров ИП. Сначала проводилась загрузка электронных данных пациента в СППВР (данные с ИП (вводимый базальный и болюсный инсулин, употребляемые углеводы), НМГ/ФМГ (профиль глюкозы), персонализированные метаданные пациента (пол, возраст, рост, вес, длительность СД1, HbA1c) с генерацией рекомендаций по коррекции параметров ИП). Затем рекомендации СППВР отправлялись врачу на экспертную оценку. Врач был вправе полностью или частично согласиться с рекомендациями СППВР, полностью не согласиться ними, после чего формировался окончательный вариант рекомендаций, который передавался пациенту. Врачам было рекомендовано следовать указаниям системы, однако в случае необходимости (значительное несоответствие этих указаний, по мнению врача) они могли их скорректировать;
2)контрольная группа: пациенты получали рекомендации по коррекции настроек ИП от врача, который не использует СППВР, по коррекции параметров ИП.
Материалы
Дистанционное предоставление данных осуществлялось с помощью официальных облачных хранилищ компаний Medtronic (Medtronic CareLink Personal) и Abbott (Libre View). Анализировались данные с используемых пациентами ИП Medtronic 640G, дополненных НМГ Guardian 2 Link или ФМГ FreeStyle Libre. Осуществлялся контроль HbA1c в начале (1 консультация), в середине (4 консультация) и в конце (7 консультация) исследования, всего 3 измерения. Между консультациями пациентам не запрещалось вносить самостоятельные корректировки в параметры ИП.
В исследовании приняли участие 6 высококвалифицированных врачей детского отделения сахарного диабета ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России, каждый из которых имеет большой опыт работы и коррекции параметров ПИ:
- стаж работы более 10 лет,
- соавторство в написании учебной литературы для детей, родителей и специалистов по СД и ПИ,
- обучение детей, родителей и специалистов первичным основам работы с ИП (при первичной установке ИП) и более углубленное обучение опытных пользователей,
- все 6 специалистов наблюдали как пациентов основной группы, так и пациентов контрольной группы (распределение пациентов между врачами было произвольным).
Методы
Основной исход для оценки эффективности: разность групповых средних относительного прироста ВЦД (между 7 и 1 консультациями) (%).
Относительный прирост ВЦД оценивался по формуле:
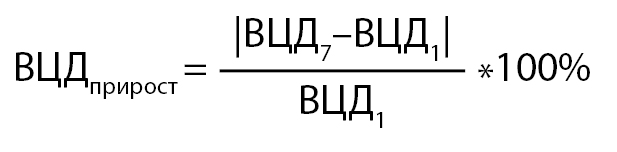
где ВЦД7 — ВЦД на 7 консультации (отчет с системы мониторинга глюкозы создается за 3 месяца),
ВЦД1 — ВЦД на 1 консультации (отчет с системы мониторинга глюкозы создается за 3 месяца).
Разность групповых средних вычисляется как ВЦДприрост в осн. гр. — ВЦДприрост в контр. гр.
Гипотеза исследования: ведение пациента с СД1 врачом с использованием СППВР не хуже ведения пациента врачом по критерию относительного прироста ВЦД за 6 месяцев (предел неменьшей эффективности 5%).
Дополнительные критерии эффективности:
1)% ВЦД (глюкоза в диапазоне 3,9–10,0 ммоль/л) в конце исследования (отчет с системы мониторинга глюкозы создается за 3 месяца);
2)уровень HbA1c в конце исследования (%);
3)изменение параметра — оценивалась как разность между значениями показателя в начале, середине и конце клинического исследования за 3 или 6 месяцев. Оценивалась по формуле:
Изменение = Знач. – Знач. пред.,
где Знач. — значение параметра,
Знач. пред. — предыдущее значение соответствующего параметра (3 или 6 месяцев назад).
Положительные значения изменения свидетельствовали об увеличении значения параметра за сравниваемый период, отрицательные — об уменьшении.
Показатели:
a)время нахождения глюкозы в целевом и смежных диапазонах (%),
b)HbA1c (%).
Критерии безопасности:
1)% ВВД (глюкоза >10,0 ммоль/л) в конце исследования (отчет с системы мониторинга глюкозы создается за 3 месяца);
2)% ВНД (глюкоза <3,9 ммоль/л) в конце исследования (отчет с системы мониторинга глюкозы создается за 3 месяца);
3)количество случаев острых осложнений СД (тяжелая гипогликемия, диабетический кетоацидоз).
Статистический анализ
Расчет объема выборки выполнялся с использованием онлайн-инструмента https://sealedenvelope.com/power/continuous-noninferior/. Для расчета объема выборки использовались следующие параметры: стандартное отклонение относительного прироста ВЦД 8,5, мощность (1-бета) 80%, уровень значимости (альфа) 5%, предел неменьшей эффективности (non-inferiority limit) — 5%. Расчет необходимого объема выборки дал минимальный размер каждой группы в 36 пациентов (всего 72 пациента в обеих группах). С учетом возможного выбывания пациентов нами было решено увеличить объем каждой группы на 10% — итоговый размер составил по 40 пациентов в каждой.
Анализ данных проводился в программах Statistica v. 13 (TIBCO Inc., США), MS Excel 2019 (Microsoft, США). Распределения количественных показателей описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей [Q1; Q3]. Различие между количественными признаками в зависимых выборках оценивалось с помощью критерия Вилкоксона (W-тест), в независимых выборках — с помощью критерия Манна-Уитни (U-тест). Описательная статистика качественных данных представлена в виде абсолютных (n) и относительных (%) частот. Доверительный интервал (ДИ) для медиан рассчитывался методом бутстрэп (bootstrap) в Python 3.10.2 с использованием открытых библиотек: statsmodels 0.13.2 (Seabold, Skipper, and Josef Perktold. “statsmodels: Econometric and statistical modeling with python.” Proceedings of the 9th Python in Science Conference. 2010), SciPy 1.9.1 (https://scipy.org/).
Пороговым уровнем значимости (P0) считался 0,05. В случае множественной проверки гипотез применялась поправка Бонферрони.
Этическая экспертиза
Локальным этическим комитетом ГНЦ ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, согласно протоколу №17 заседания Комитета от 28.10.2020, постановлено, что планируемая научная работа соответствует этическим стандартам добросовестной клинической практики и может быть проведена на базе Института детской эндокринологии ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России. Законные представители пациентов дали информированное согласие на участие в рандомизированном контролируемом исследовании (РКИ).
РЕЗУЛЬТАТЫ
В РКИ включено 80 человек, набор пациентов проводился с февраля по май 2023 г., клиническое исследование — с февраля по декабрь 2023 г. Исходная клинико-лабораторная характеристика и сравнение групп представлены в табл. 1. Сформированные группы статистически не различаются по всем проанализированным показателям. Окончили клиническое исследование 63 пациента из 80 — 32 в основной группе и 31 в группе контроля. Таким образом, выбывание было равномерным и составило 20% в основной группе и 22,5% в группе контроля.
Основными причинами выбывания пациентов из клинического исследования были:
1.Нежелание пациента продолжать участвовать и проводить дистанционные консультации (10 из 17 пациентов, 4 в основной группе, 6 в группе контроля), особенно во вторую половину клинического исследования; в первую половину по собственному желанию прервали участие 4 пациента, во вторую — 6 пациентов.
2.Технические проблемы в работе ИП (7 из 17 пациентов, 4 в основной группе, 3 в группе контроля), в результате которых пациент был вынужден вернуться к использованию множественных инъекций инсулина.
Клинико-лабораторная характеристика и сравнение групп пациентов, окончивших исследование, в начале исследования представлены в табл. 2. После выбывания пациентов группы остались исходно сопоставимыми. В дальнейший анализ включены только пациенты, закончившие исследование (набор данных Per Protocol).
Группы пациентов репрезентативны: Ме возраста и HbA1с других исследований (табл. 3) входят в 95% ДИ медиан тех же показателей групп пациентов.
Группы пациентов, закончивших исследование, также репрезентативны — Ме возраста и HbA1с других исследований (табл. 3) входят в 95% ДИ медиан тех же показателей изучаемых групп.
В табл. 4 приведены значения по основному исходу РКИ — относительному приросту ВЦД (%). Нижняя граница одностороннего 95% ДИ разности средних относительного прироста ВЦД на 7 консультации больше предустановленного предела неменьшей эффективности -5%, следовательно, проверяемая гипотеза неменьшей эффективности ведения пациентов с использованием СППВР может быть принята.
По данным систем мониторирования глюкозы (отчеты созданы за последние 3 месяца использования системы мониторинга глюкозы), видно, что к четвертой консультации в основной группе отмечается статистически значимое увеличение ВЦД и снижение ВВД (табл. 5 и рис. 1). С 3 по 6 месяцы (с 4 по 7 консультации) в основной группе дальнейшего улучшения не происходит, в то время как в группе контроля статистически значимых изменений между началом и окончанием исследования не установлено. Между группами за время клинического исследования статистически значимых различий по диапазонам не установлено.
В обеих группах отмечалось статистически значимое более выраженное изменение дельты ВВД в первую половину исследования, чем во вторую; для ВЦД аналогичные результаты наблюдались в основной группе, и статистическая тенденция к ним в группе контроля (табл. 6). Статистически значимых различий между группами нет.
В результате шестимесячного наблюдения отмечалось статистически значимое снижение уровня HbA1c в основной группе (табл. 7, рис. 2), при этом статистически значимых различий между основной группой и группой контроля на протяжении всего клинического исследования нет. Наиболее выраженное улучшение уровня HbA1c отмечалось в основной группе за первые три месяца наблюдения, при этом статистически значимой динамики за вторые три месяца наблюдения нет. В группе контроля наблюдалась статистическая тенденция к снижению показателя в первые три месяца исследования.
Согласно табл. 8, изменение HbA1c имело статистически значимое выраженное снижение в основной группе в первую половину исследования, чем во вторую. Статистически значимых различий между группами нет.
Пациенты основной группы и группы контроля не сообщали об острых осложнениях СД (тяжелая гипогликемия, диабетический кетоацидоз) за время проведения клинического исследования.
Процент отказа врача от рекомендаций СППВР за время клинического исследования составил 6,4% (2 пациента из 32). Причиной отказа врачом от рекомендаций СППВР стало грубое нарушение пациентом рекомендаций по самоконтролю и режиму инсулинотерапии — пропуски болюсного введения инсулина, неправильный подсчет ХЕ. Данным пациентам не проводилась коррекция параметров ИП, а проводились образовательные беседы, даны рекомендации по соблюдению самоконтроля, диеты и режиму инсулинотерапии. К концу исследования у обоих пациентов были те же параметры состояния углеводного обмена, что и в начале исследования: у первого пациента ВЦД 27,0–31,0% и HbA1c 13,7–13,0%, у второго — 43,0–40,0% и 9,6–9,7% соответственно. Поэтому мы считаем, что данные пациенты не оказали существенного влияния на итоговые результаты основной группы.
Таблица 1. Исходная клинико-лабораторная характеристика пациентов, включенных в рандомизированное контролируемое исследование (80 пациентов)
Основная группа (n=40) | Группа контроля (n=40) | Р, U-тест | |
Возраст, лет | 12,6 [ 10,5; 14,8], | 12,6 [ 9,6; 14,9], | 0,569 |
Рост, см | 158,5 [ 144,5; 167,0] | 158,0 [ 135,0; 165,0] | 0,355 |
Вес, кг | 50,0 [ 37,0; 61,5] | 44,5 [ 30,0; 60,5] | 0,244 |
Длительность СД1, лет | 4,2 [ 2,2; 7,7] | 3,1 [ 2,2; 6,9] | 0,518 |
СДИ, Ед/кг/сут | 0,9 [ 0,8; 1,1] | 0,9 [ 0,7; 1,1] | 0,418 |
СДИ, Ед/сут | 43,0 [ 30,0; 59,0] | 38,0 [ 23,0; 64,0] | 0,232 |
HbA1c, % | 7,6 [ 6,9; 8,2], | 7,4 [ 6,7; 7,9], | 0,407 |
ВЦД (3,9–10,0 ммоль/л), % | 62,7±14,5 (Psw=0,771) | 63,6±15,5 (Psw=0,229) | 0,677 |
ВНД (3,9 ммоль/л), % | 3,2±3,0 (Psw=0,111) | 2,7±2,4 (Psw=0,110) | 0,636 |
ВВД (10,0 ммоль/л), % | 34,3±16,8 (Psw=0,255) | 34,0±17,1 (Psw=0,143) | 0,699 |
Коэффициент вариации, % | 35,3 [ 33,5; 39,2] | 37,0 [ 33,3; 40,1] | 0,506 |
Примечание. Данные представлены в виде медианы и интерквартильного интервала, среднего значения и СКО: Me [Q1; Q3], M±SD; данные с систем мониторинга глюкозы получены за последние 3 месяца использования. Psw — результат применения теста Шапиро-Уилка. СД1 — сахарный диабет 1 типа; СДИ — суточная доза инсулина; HbA1c — гликированный гемоглобин; ВЦД — время в целевом диапазоне; ВНД — время ниже целевого диапазона; ВВД — время выше целевого диапазона.
Таблица 2. Исходная клинико-лабораторная характеристика пациентов, окончивших 6-месячное исследование (63 пациента)
Основная группа (n=32) | Группа контроля (n=31) | Р, U-тест | |
Возраст, лет | 13,5 [ 11,0; 15,2], | 12,7 [ 10,0; 15,2], | 0,660 |
Рост, см | 159,5 [ 151,0; 169,0] | 160,0 [ 138,0; 167,0] | 0,578 |
Вес, кг | 50,0 [ 41,5; 64,0] | 49,0 [ 32,0; 64,0] | 0,406 |
Длительность СД1, лет | 4,3 [ 2,2; 7,9] | 3,7 [ 2,1; 7,8] | 0,695 |
СДИ, Ед/кг/сут | 0,9 [ 0,8; 1,1] | 0,9 [ 0,8; 1,1] | 0,820 |
СДИ, Ед/сут | 46,5 [ 32,5; 62,5] | 48,0 [ 23,0; 68,0] | 0,518 |
HbA1c, % | 7,7 [ 7,2; 8,2], | 7,3 [ 6,5; 7,9], | 0,114 |
ВЦД (3,9–10,0 ммоль/л), % | 61,1±14,8 (Psw=0,931) | 64,8±17,2 (Psw=0,106) | 0,236 |
ВНД (3,9 ммоль/л), % | 2,8±2,5 (Psw =0,084) | 2,9±2,5 (Psw=0,101) | 0,667 |
ВВД (10,0 ммоль/л), % | 36,2±16,6 (Psw=0,707) | 32,5±18,9 (Psw=0,088) | 0,247 |
Коэффициент вариации, % | 35,1 [ 32,5; 39,2] | 37,2 [ 33,4; 39,9] | 0,393 |
Примечание. Данные представлены в виде медианы и интерквартильного интервала, среднего значения и СКО: Me [Q1; Q3], M±SD; данные с систем мониторинга глюкозы получены за последние 3 месяца использования; Psw — результат применения теста Шапиро-Уилка; СД1 — сахарный диабет 1 типа; СДИ — суточная доза инсулина; HbA1c — гликированный гемоглобин; ВЦД — время в целевом диапазоне; ВНД — время ниже целевого диапазона; ВВД — время выше целевого диапазона.
Таблица 3. Клинико-лабораторная характеристика пациентов целевой популяции по результатам ранее проведенных исследований
Клиническое исследование | Возраст, лет | HbA1c, % |
Романенкова Е.М. и соавт., n=703 [11] | 11,3 [ 7,3; 14,6] | 7,4% [ 6,5; 8,6] |
Лаптев Д.Н. и соавт., n=469 [12] | 11,3 [ 8,4; 14,6] | 7,4% [ 6,6; 8,4] |
Лаптев Д.Н. и соавт., n=228 [13] | 11,2 [ 8,6; 14,7] | 7,6% [ 6,8; 8,9] |
Примечание. Данные представлены в виде медианы и интерквартильного интервала: Me [Q1; Q3]. HbA1c — гликированный гемоглобин.
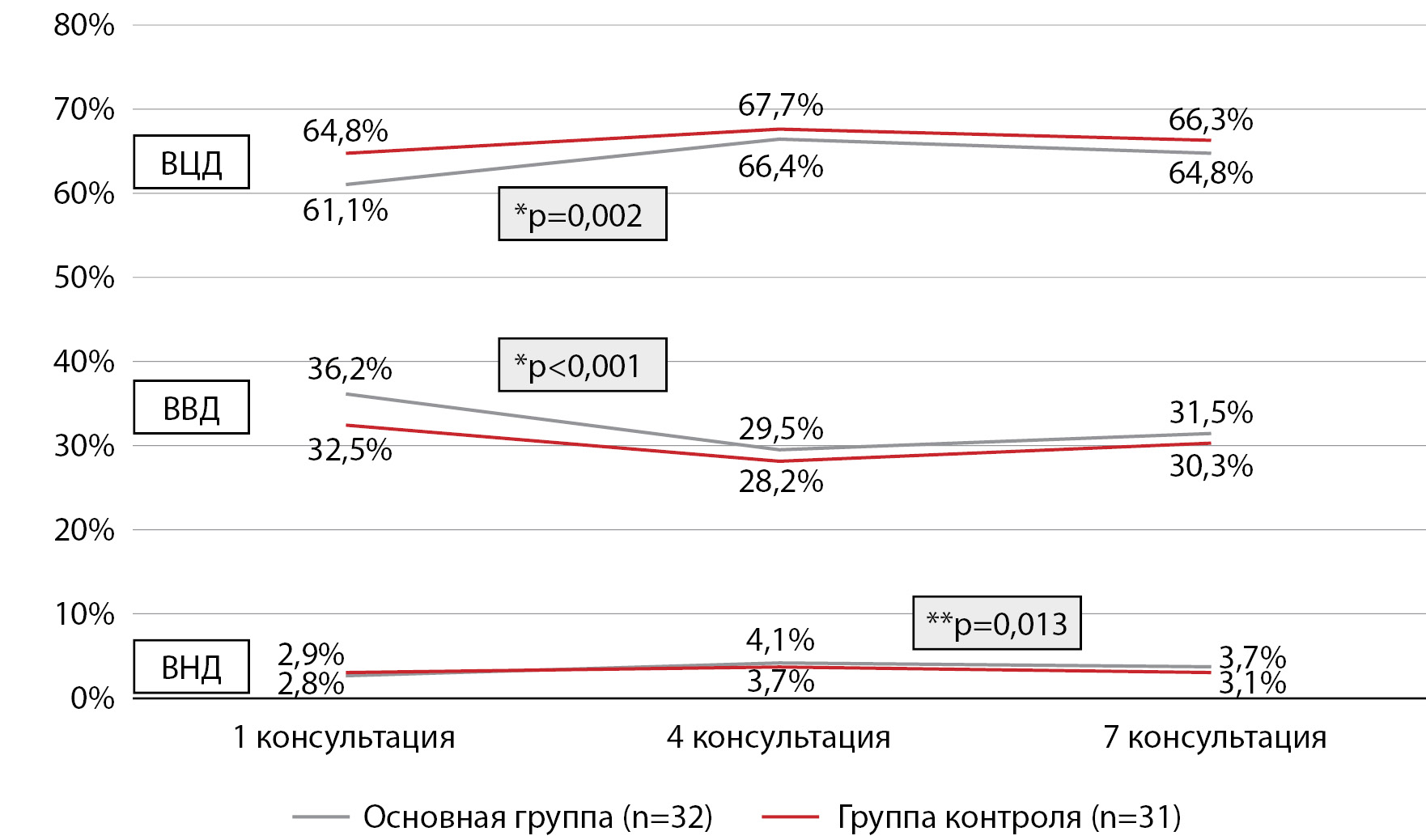
Рисунок 1. Время в целевом и смежных диапазонах по данным систем мониторинга глюкозы пациентов, окончивших клиническое исследование (6 мес.), в основной группе (n=32) и группе контроля (n=31) (средние значения показателя); данные с систем мониторинга глюкозы получены за последние 3 месяца использования.
ВЦД — время в целевом диапазоне; ВНД — время ниже целевого диапазона; ВВД — время выше целевого диапазона. * сравнение 1 и 4 консультаций (W-тест). ** сравнение 1 и 7 консультаций (W-тест).
Таблица 4. Прирост времени в целевом диапазоне, по данным систем мониторинга глюкозы, пациентов, окончивших клиническое исследование (6 мес.), в основной группе и группе контроля (%)
Основная группа (n=32) | Группа контроля (n=31) | |
Относительный прирост ВЦД (%) | 8,82±17,70 (Psw=0,199) | 5,80±18,29 (Psw=0,082) |
Разность средних относительного прироста ВЦД (%) | 3,02, односторонний 95% ДИ (-4,55; inf) | |
Примечание. Данные представлены в виде среднего значения и СКО: M±SD; данные с систем мониторинга глюкозы получены за последние 3 месяца использования. ВЦД — время в целевом диапазоне.
Таблица 5. Время в целевом и смежных диапазонах, по данным систем мониторинга глюкозы пациентов, окончивших клиническое исследование (6 мес., 63 пациента)
Основная группа (n=32) | Группа контроля (n=31) | Р, U-тест | |
ВЦД (3,9–10,0 ммоль/л), % | |||
1 консультация | 61,1±14,8 (Psw=0,931) | 64,8±17,2 (Psw=0,106) | 0,236 |
4 консультация | 66,4±10,3 (Psw=0,872) | 67,7±12,5 (Psw=0,104) | 0,490 |
7 консультация | 64,8±11,8 (Psw=0,259) | 66,3±13,3 (Psw=0,344) | 0,628 |
Р, W-тест 1–4 консультации | 0,002 | 0,045 | |
Р, W-тест 4–7 консультации | 0,202 | 0,265 | |
Р, W-тест 1–7 консультации | 0,045 | 0,381 | |
ВНД (<3,9 ммоль/л), % | |||
1 консультация | 2,8±2,5 (Psw=0,084) | 2,9±2,5 (Psw=0,101) | 0,667 |
4 консультация | 4,1±3,9 (Psw=0,093) | 3,7±2,9 (Psw=0,112) | 0,886 |
7 консультация | 3,7±3,2 (Psw=0,090) | 3,1±2,4 (Psw=0,081) | 0,534 |
Р, W-тест 1–4 консультации | 0,018 | 0,112 | |
Р, W-тест 4–7 консультации | 0,443 | 0,050 | |
Р, W-тест 1–7 консультации | 0,013 | 0,690 | |
ВВД (>10,0 ммоль/л), % | |||
1 консультация | 36,2±16,6 (Psw=0,707) | 32,5±18,9 (Psw=0,088) | 0,247 |
4 консультация | 29,5±11,8 (Psw=0,914) | 28,2±13,8 (Psw=0,134) | 0,393 |
7 консультация | 31,5±13,3 (Psw=0,405) | 30,3±15,1 (Psw=0,401) | 0,628 |
Р, W-тест 1–4 консультации | <0,001 | 0,021 | |
Р, W-тест 4–7 консультации | 0,081 | 0,168 | |
Р, W-тест 1–7 консультации | 0,027 | 0,165 | |
Примечание. Данные представлены в виде среднего значения и СКО: M±SD; данные с систем мониторинга глюкозы получены за последние 3 месяца использования. Psw — результат применения теста Шапиро-Уилка. Поправка Бонферрони: Р0=0,05/3=0,017. ВЦД — время в целевом диапазоне; ВНД — время ниже целевого диапазона; ВВД — время выше целевого диапазона.
Таблица 6. Изменения времени нахождения значений глюкозы в целевом и смежных диапазонах, по данным систем мониторинга глюкозы, между началом, серединой и окончанием клинического исследования
Основная группа (n=32) | Группа контроля (n=31) | Р, U-тест | |
Изменение ВЦД (3,9–10,0 ммоль/л), % | |||
4–1 консультация | 6,5 [ 0,0; 10,0] | 2,0 [ -2,0; 7,0] | 0,152 |
7–4 консультация | -2,0 [ -4,0; 2,5] | 0 [ -4,0; 3,0] | 0,811 |
7–1 консультация | 3,5 [ -5; 11,5] | 2,0 [ -4,0; 8,0] | 0,378 |
Р, W-тест 4–1 и 7–4 консультации | 0,002 | 0,024 | |
Изменение ВНД (<3,9 ммоль/л), % | |||
4–1 консультация | 0 [ -1,0; 3,0] | 0 [ -1,0; 3,0] | 0,543 |
7–4 консультация | 0 [ -1,5; 1,0] | 0 [ -2,0; 1,0] | 0,456 |
7–1 консультация | 1,0 [ 0; 2,0] | 0 [ -1,0; 2,0] | 0,152 |
Р, W-тест 4–1 и 7–4 консультации | 0,080 | 0,077 | |
Изменение ВВД (>10,0 ммоль/л), % | |||
4–1 консультация | -7,5 [ -11,5; -1,0] | -4,0 [ -9,0; 3,0] | 0,231 |
7–4 консультация | 2,0 [ -2,5; 4,5] | 1,0 [ -3,0; 5,0] | 0,991 |
7–1 консультация | -3,5 [ -12,5; 3,0] | -1,0 [ -9,0; 3,0] | 0,432 |
Р, W-тест 4–1 и 7–4 консультации | <0,001 | 0,007 | |
Примечание. Результаты представлены в виде медианы и интерквартильного интервала: Me [Q1; Q3]. Поправка Бонферрони: Р0=0,05/3=0,017. ВЦД — время в целевом диапазоне; ВНД — время ниже целевого диапазона; ВВД — время выше целевого диапазона.
Таблица 7. Гликированный гемоглобин HbA1c на протяжении 6 месяцев клинического исследования
HbA1c, % | Р, U-тест | ||
Основная группа (n=32) | Группа контроля (n=31) | ||
1 консультация | 7,7 [ 7,3; 8,2] | 7,3 [ 6,5; 7,9] | 0,114 |
4 консультация | 7,3 [ 6,8; 7,7] | 7,1 [ 6,7; 7,6] | 0,611 |
7 консультация | 7,2 [ 6,8; 7,9] | 7,1 [ 6,7; 7,9] | 0,880 |
Р, W-тест 1–4 консультации | <0,001 | 0,047 | |
Р, W-тест 4–7 консультации | 0,552 | 0,147 | |
Р, W-тест 1–7 консультации | 0,003 | 0,411 | |
Примечание. Результаты представлены в виде медианы и интерквартильного интервала: Me [Q1; Q3]. Поправка Бонферрони: Р0=0,05/3=0,017.
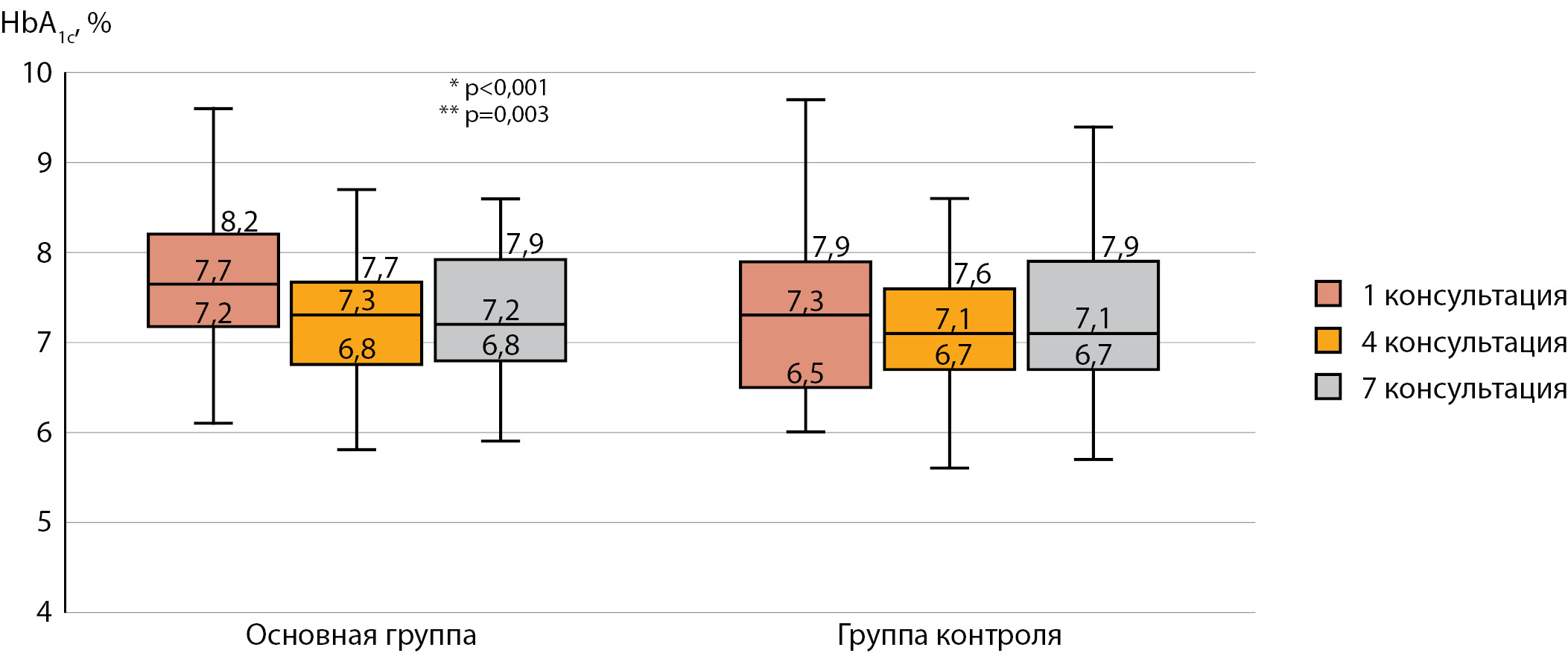
Рисунок 2. Уровни гликированного гемоглобина HbA1c за время клинического исследования в основной группе и группе контроля (Me, Q1-Q3, min, max).
HbA1c — гликированный гемоглобин. * сравнение 1 и 4 консультаций (W-тест). ** сравнение 1 и 7 консультаций (W-тест).
Таблица 8. Изменения гликированного гемоглобина HbA1c между началом, серединой и окончанием клинического исследования
Изменение HbA1c, % | Р, U-тест | ||
Основная группа (n=32) | группа контроля (n=31) | ||
4–1 консультация | -0,4 [ -0,8; -0,2] | -0,2 [ -0,6; 0,1] | 0,077 |
7–4 консультация | 0,1 [ -0,2; 0,3] | 0,1 [ -0,2; 0,3] | 0,977 |
7–1 консультация | -0,3 [ -0,9; 0,1] | 0 [ -0,5; 0,3] | 0,126 |
Р, W-тест 4–1 и 7–4 консультации | <0,001 | 0,017 | |
Примечание. Результаты представлены в виде медианы и интерквартильного интервала: Me [Q1; Q3]. Поправка Бонферрони: Р0=0,05/3=0,017. HbA1c — гликированный гемоглобин.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Изучаемые группы пациентов являются репрезентативными по отношению к целевой популяции детей с СД1 (табл. 1–3).
Сопоставление с другими публикациями
В основной группе к концу исследования отмечалось статистически значимое увеличение показателей ВНД относительно исходного уровня при отсутствии статистически значимых различий между группами. Данная тенденция может быть связана с улучшением гликемического контроля в основной группе, так как улучшение гликемического контроля сопряжено с увеличением частоты эпизодов гипогликемий.
Полученные статистически значимые различия по уровню HbA1c между 1 и 7 консультациями в основной группе и их отсутствие в группе контроля могут быть связаны с особенностями выборки: первоначально в обе группы были рандомизированы путем минимизации по 40 пациентов. За время клинического исследования из группы исследования выбыло 8 человек (их медиана HbA1c составила 7,0% [ 6,2; 7,6]), из группы контроля — 9 (их медиана HbA1c составила 7,7% [ 7,3; 7,9]). Таким образом, из основной группы выбыло больше пациентов с компенсированным СД1, а из группы контроля — с некомпенсированным СД1.
Учитывая отсутствие статистически значимых различий между группами по данным HbA1c и временным диапазонам систем мониторинга глюкозы, положительную и статистически значимую динамику в снижении HbA1c и увеличении ВЦД в основной группе можно сделать вывод о сопоставимой с врачами-экспертами клинической эффективности и безопасности разработанной СППВР. Учитывая отсутствие острых осложнений в обеих группах на протяжении 6 месяцев исследования, а также положительные изменения ВЦД и ВНД, можно сделать вывод о безопасности разработанной математической модели [14].
Имеется ограниченное количество исследований в мировой практике по клинической оценке алгоритмов, корректирующих параметры ИП. В исследовании Nimri R. и соавт. [15] оценивалась клиническая эффективность автоматизированного алгоритма Advisor Pro (DreaMed Diabetes Ltd, Петах-Тиква, Израиль) в многоцентровом рандомизированном исследовании с гипотезой неменьшей эффективности, с одиночным ослеплением в течение 6 месяцев. Пациенты были разделены на 2 группы — основная группа (AI-DSS) и группа контроля (врача), по 54 в каждой группе (всего 108 участников). Группы были сопоставимы между собой; возраст составил 15,6±3,0, HbA1c 8,4±0,8. Через 3 месяца отмечалось статистически значимое снижение уровня HbA1c в обеих группах без статистически значимых различий между группами. К концу исследования (6 месяцев) среднее изменение HbA1c в группе AI-DSS составило 0,32%, в группе врача — 0,19%. Процент ВЦД в группе AI-DSS был статистически не ниже, чем в группе врача (50,2±11,1% против 51,6±11,3% соответственно). Процент ВНЦ был статистически неменьшим для AI-DSS и группы врача (1,3±1,4% и 1,0±0,9% соответственно). Таким образом, была показана эффективность и безопасность автоматизированного алгоритма Advisor Pro в коррекции параметров ИП, дополненной НМГ/ФМГ.
Отличием нашего исследования от клинической оценки Advisor Pro является возрастной диапазон и степень компенсации основного заболевания. В зарубежном исследовании основной объем составляли пациенты более взрослой возрастной группы и менее компенсированные, чем у нас. Как было уже упомянуто при оценке степени согласованности врачебных рекомендаций и рекомендаций СППВР [9], после окончания полового развития течение СД1 становится более стабильным. Наше исследование включает в себя пациентов всех возрастных групп, со всеми особенностями течения СД1 в каждый период формирования организма. Учитывая данное обстоятельство, мы считаем, что результаты нашего исследования не отличаются от результатов зарубежного.
Таким образом, сравнение результатов нашего исследования с зарубежными исследованиями позволяет сделать вывод об эффективности и безопасности разработанной СППВР.
Клиническая значимость результатов
Применение в клинической практике СППВР может оказать помощь в регулярном и частом наблюдении детей с СД1, стандартизировать на высоком уровне подход к коррекции параметров ИП, дополненной НМГ/ФМГ. Это позволит эффективно распределить ресурсы здравоохранения, осуществлять персонализированное лечение и наблюдение пациента.
Ограничения исследования
Ограничениями проведенного нами РКИ, согласно адаптированному Кокрановскому опроснику [16], являются отсутствие ослепления со стороны врача, высокий процент выбывания пациентов (20% в основной группе и 22,5% в группе контроля). Одной из причин выбывания пациентов, помимо личного нежелания, стали технические проблемы ИП, потребовавшие возвращения пациента к использованию множественных инъекций инсулина. Проспективная регистрация протокола исследования не была проведена. Имеется конфликт интересов — клиническое испытание проводилось группой лиц, принимавших участие в разработке СППВР.
Направления дальнейших исследований
Представляется перспективным продолжение сбора данных и использование их для разработки новых версий модели, обладающих большей точностью прогнозирования профиля глюкозы. С этой целью было бы целесообразно использовать дополнительные данные с электронных устройств, например, пульсоксиметра, трекера физической активности и т.п.
ЗАКЛЮЧЕНИЕ
Применение СППВР имело неменьшую эффективность в отношении показателя ВЦД, чем ведение пациента врачом. Статистически значимых различий между основной группой и группой контроля нет ни по одному из изученных исходов.
Применение в клинической практике СППВР может оказать помощь в регулярном и частом наблюдении детей с СД1, стандартизировать на высоком уровне подход к коррекции параметров ИП, дополненной НМГ/ФМГ. Это позволит эффективно распределить ресурсы здравоохранения, осуществлять персонализированное лечение и наблюдение пациента.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при финансовой поддержке «Альфа-Групп» и благотворительного фонда «Культура благотворительности» в рамках национальной благотворительной программы помощи детям с эндокринными заболеваниями «Альф-Эндо».
Участие авторов. Сорокин Д.Ю. — концепция и дизайн исследования, набор пациентов, проведение клинического исследования, написание текста публикации, получение, анализ, статистическая обработка и интерпретация полученных данных; Труфанова Е.С. — концепция и дизайн исследования, редактирование текста; Реброва О.Ю. — концепция и дизайн исследования, редактирование текста, анализ, статистическая обработка и интерпретация полученных данных; Безлепкина О.Б. — концепция и дизайн исследования, редактирование текста; Лаптев Д.Н. — концепция и дизайн исследования, редактирование текста, анализ, статистическая обработка и интерпретация полученных данных.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы выражают благодарность сотрудникам детского отделения сахарного диабета ГНЦ ФГБУ «НМИЦ эндокринологии» МЗ РФ: Андриановой Екатерине Андреевне, Емельянову Андрею Олеговичу, Ереминой Ирине Александровне, Кураевой Тамаре Леонидовне, Светловой Галине Николаевне, Сечко Елене Александровне, Титович Елене Витальевне — в оценке согласованности рекомендации между СППВР и экспертным мнением врача в коррекции параметров инсулиновой помпы.
Список литературы
1. Mansourypoor F, Asadi S. Development of a reinforcement learningbased evolutionary fuzzy rule-based system for diabetes diagnosis. Comput. Biol. Med. 2017;91:337-352. doi: https://doi.org/10.1016/j.compbiomed.2017.10.024
2. Zarkogianni К, Litsa Е, Mitsis К, et al. A review of emerging technologies for the management of diabetes mellitus. IEEE Trans. Biomed. Eng. 2015;62(12):2735-2749. doi: https://doi.org/10.1109/TBME.2015.2470521
3. Дедов И.И., Шестакова М.В., Петеркова В.А. и др. Сахарный диабет у детей и подростков по данным Федерального регистра Российской Федерации: динамика основных эпидемиологических характеристик за 2013-2016 гг. // Сахарный диабет. — 2017. — Т. 20. — №6. — C. 392-402. doi: https://doi.org/10.14341/DM9460
4. Aleppo G, Laffel LM, Ahmann AJ, et al. A practical approach to using trend arrows on the dexcom G5 CGM system for the management of adults with diabetes. J Endocr Soc. 2017;1(12):1445-1460. doi: https://doi.org/10.1210/js.2017-00388
5. Pettus J, Edelman SV. Recommendations for using real-time continuous glucose monitoring (rtCGM) data for insulin adjustments in type 1 diabetes. J Diabetes Sci Technol. 2017;11(1):138 -147. doi: https://doi.org/10.1177/1932296816663747
6. Prahalad P, Tanenbaum M, Hood K, Maahs DM. Diabetes technology: improving care, improving patient-reported outcomes and preventing complications in young people with Type 1 diabetes. Diabet Med. 2018;35(4):419-429. doi: https://doi.org/10.1111/dme.13588
7. Greenwood DA, Gee PM, Fatkin KJ, Peeples M. A systematic review of reviews evaluating technology-enabled diabetes self-management education and support. J Diabetes Sci Technol. 2017;11(5):1015-1027. doi: https://doi.org/10.1177/1932296817713506
8. Hou C, Carter B, Hewitt J, et al. Do mobile phone applications improve glycemic control (HbA1c) in the self-management of diabetes? A systematic review, meta-analysis, and GRADE of 14 randomized trials. Diabetes Care. 2016;39(11):2089-2095. doi: https://doi.org/10.2337/dc16-0346
9. Trufanova E.S., Sorokin D.Yu., Rebrova O.Yu., Laptev D.N., Peterkova V.A. Clinical decision support system for personalized therapy children with type 1 diabetes mellitus. ATTD 2021 ABSTRACTS. Diabetes Technology & Therapeutics. 2021;23:A-104. doi: https://doi.org/10.1089/dia.2021.2525.abstracts
10. Nimri R, Dassau E, Segall T, et al. Adjusting insulin doses in patients with type 1 diabetes who use insulin pump and continuous glucose monitoring: Variations among countries and physicians. Diabetes Obes Metab. 2018;20(10):2458-2466. doi: https://doi.org/10.1111/dom.13408
11. Романенкова Е.М., Еремина И.А., Титович Е.В. и др. Уровень С-пептида и распространенность панкреатических аутоантител у детей с сахарным диабетом 1 типа при разной длительности заболевания // Сахарный диабет. — 2022. — Т. 25. — №2. — С. 155-165. doi: https://doi.org/10.14341/DM12843
12. Лаптев Д.Н., Безлепкина О.Б., Демина Е.С. и др. Результаты клинической апробации системы freestyle libre у детей с сахарным диабетом 1 типа: улучшение гликемического контроля в сочетании со снижением риска тяжелой гипогликемии и диабетического кетоацидоза // Проблемы эндокринологии. — 2022. — Т. 68. — №3. — С. 86-92. doi: https://doi.org/10.14341/probl12877
13. Лаптев Д.Н., Емельянов А.О., Андрианова Е.А. и др. Применение Flash —мониторинга глюкозы у детей с сахарным диабетом 1 типа в реальной клинической практике // Сахарный диабет. — 2021. — Т. 24. — №6. — С. 504-510. doi: https://doi.org/10.14341/DM12817
14. Дедов И.И., Шестакова М.В., Майоров А.Ю. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск. Сахарный диабет. — 2023. — Т. 26. — №2. — С. 1-157. doi: https://doi.org/10.14341/DM13042
15. Nimri R, Battelino T, Laffel LM, et al. Insulin dose optimization using an automated artificial intelligence-based decision support system in youths with type 1 diabetes. Nature Medicine. 2020;26:1380-1384. doi: https://doi.org/10.1038/s41591-020-1045-7
16. Реброва О.Ю., Федяева В.К., Хачатрян Г.Р. Адаптация и валидизация вопросника для оценки риска систематических ошибок в рандомизированных контролируемых испытаниях // Медицинские технологии. Оценка и выбор. — 2015. — 19. — №1. — С. 9-17.
Об авторах
Д. Н. ЛаптевРоссия
Лаптев Дмитрий Никитич, д.м.н., профессор
Researcher ID: O-1826-2013;
Scopus Author ID: 2434108380
Москва
Д. Ю. Сорокин
Россия
Сорокин Даниил Юрьевич, врач-детский эндокринолог
Researcher ID: HJY-5714-2023
117036, Москва, ул. Дм. Ульянова, д. 11
Е. С. Труфанова
Россия
Труфанова Евгения Станиславовна
Москва
О. Ю. Реброва
Россия
Реброва Ольга Юрьевна, д.м.н.
ResearcherID: A-9071-2010;
Scopus Author ID: 6601986825
Москва
О. Б. Безлепкина
Россия
Безлепкина Ольга Борисовна, д.м.н., профессор
ResearcherID: B-6627-2017;
Scopus Author ID: 650763284
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Время в целевом и смежных диапазонах по данным систем мониторинга глюкозы пациентов, окончивших клиническое исследование (6 мес.), в основной группе (n=32) и группе контроля (n=31) (средние значения показателя); данные с систем мониторинга глюкозы получены за последние 3 месяца использования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(209KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Уровни гликированного гемоглобина HbA1c за время клинического исследования в основной группе и группе контроля (Me, Q1-Q3, min, max). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(160KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Лаптев Д.Н., Сорокин Д.Ю., Труфанова Е.С., Реброва О.Ю., Безлепкина О.Б. Рандомизированное контролируемое испытание эффективности и безопасности системы поддержки принятия врачебных решений на основе искусственного интеллекта для коррекции параметров инсулиновой помпы у детей с сахарным диабетом 1 типа. Сахарный диабет. 2024;27(3):254-264. https://doi.org/10.14341/DM13171
For citation:
Laptev D.N., Sorokin D.Yu., Trufanova E.S., Rebrova O.Yu., Bezlepkina O.B. Effectiveness and safety of an artificial intelligence-based medical decision support system for adjusting insulin pump settings in children with type 1 diabetes mellitus: randomized controlled trial. Diabetes mellitus. 2024;27(3):254-264. (In Russ.) https://doi.org/10.14341/DM13171

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































