Перейти к:
Модель формирования стрептозотоцин-индуцированного диабета на крупных животных с оценкой ее эффективности и стабильности
https://doi.org/10.14341/DM13168
Аннотация
ОБОСНОВАНИЕ. Исследования, направленные на создание и верификацию моделей диабета первого типа (СД1), играют важную роль в разработке новых методов лечения этого заболевания. Модели крупных животных могут сократить разрыв между фундаментальными исследованиями и клиническими испытаниями новых технологий для лечения дефицита инсулина. На данный момент наиболее востребованной моделью является стрептозотоцин-индуцированный диабет. Однако разные виды и породы животных по-разному реагируют на стрептозотоцин (СТЗ). Таким образом, несмотря на то, что уже существуют модели на разных породах свиней, верификация модели стрептозотоцин-индуцированного диабета на свиньях Wiesenau является важной задачей, так как эта порода еще не была использована, а также она является одной из наиболее доступных пород лабораторных свиней в России.
ЦЕЛЬ. Воспроизведение модели стрептозотоцин-индуцированного диабета на свиньях Wiesenau с коррекцией гипергликемии инсулинотерапией и оценка ее стабильности и соответствия экспериментальной модели СД1.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование было выполнено на 6 свиньях Wiesenau. Диабет индуцировался внутривенным введением СТЗ (150 мг/кг). Концентрацию глюкозы в крови определяли глюкометром, а также использовали систему непрерывного мониторинга глюкозы. Содержание инсулина в крови определяли иммуноферментным анализом (Cloud-clone corp). Успешность индукции диабета была подтверждена тестом толерантности к глюкозе. Через 7 дней после введения СТЗ начинали инсулинотерапию, которая продолжалась в течение трех месяцев. Через 3 месяца после индукции проводилось гистологическое и иммуногистохимическое исследование состояния островков поджелудочной железы.
РЕЗУЛЬТАТЫ. Исследования на свиньях породы Wiesenau показали, что доза 150 мг/кг СТЗ достаточно безопасна и эффективно вызывает СД в 67% случаев. Был подобран оптимальный индивидуальный протокол инсулинотерапии, который успешно снижает уровень глюкозы в крови до нормальных значений. Эта модель стрептозотоцин-индуцированного диабета у свиней породы Wiesenau стабильна в течение 90 дней и может быть использована для исследования новых антидиабетических средств.
ЗАКЛЮЧЕНИЕ. Сформирована модель стрептозотоцин-индуцированного диабета у свиней Wiesenau. Подтверждена стабильность модели в условиях снятия глюкозотоксичности инсулинотерапией.
Для цитирования:
Ермакова П.С., Луговая Л.А., Васильчикова Е.А., Богомолова А.Ю., Целоусова Ю.М., Наралиев Н.У., Кучин Д.М., Загайнова Е.В., Загайнов В.Е., Кашина А.В. Модель формирования стрептозотоцин-индуцированного диабета на крупных животных с оценкой ее эффективности и стабильности. Сахарный диабет. 2025;28(2):111-123. https://doi.org/10.14341/DM13168
For citation:
Ermakova P.S., Lugovaya L.A., Vasilchikova E.A., Bogomolova A.Y., Tselousova Y.M., Naraliev N.U., Kuchin D.M., Zagainova E.V., Zagainov V.E., Kashina A.V. Model of the formation of streptozotocin-induced diabetes in Wiesenau pigs with assessment of its effectiveness and stability. Diabetes mellitus. 2025;28(2):111-123. (In Russ.) https://doi.org/10.14341/DM13168
ОБОСНОВАНИЕ
Моделирование заболеваний на животных является важным инструментом в исследовании патофизиологических процессов и оценке эффективности новых терапевтических подходов. Для лечения сахарного диабета 1 типа (СД1) и инсулинодефицитных состояний разрабатываются новые подходы, включая химические препараты и трансплантационные технологии с использованием инсулин-продуцирующих клеток. На многие открытые вопросы, связанные с экспериментальными методами лечения СД, уже получены ответы в исследованиях с использованием моделей диабета на мелких животных. Однако на вопросы, касающиеся осуществимости таких концепций в доклинических условиях, можно ответить только на моделях диабета на крупных животных, так как метаболические механизмы у грызунов и человека существенно различаются, что ограничивает клиническую значимость результатов этих исследований. Модели крупных животных могут сократить разрыв между фундаментальными исследованиями и клиническими испытаниями на людях [1]. Приматы идеально подходят для таких исследований из-за их генетической и физиологической близости к человеку. Однако этические соображения, необходимость в квалифицированном персонале и высокие финансовые затраты свели исследования на приматах к минимуму. Мини-свиньи являются серьезной альтернативой из-за их размера, простоты обращения, что влечет за собой гораздо более низкие затраты по отношению к приматам. Свиньи обладают анатомическими и физиологическими характеристиками, которые близки человеческим в отношении сердечно-сосудистой системы, анатомии кожи, почек и строения глаз. Эти сходства делают свиней особенно привлекательными моделями. Кроме того, свиней уже используют в исследованиях, посвященных репродуктивной физиологии, терапии кожных дефектов и нейротрансплантации с участием свиных нейральных стволовых клеток [2]. Свиньи представляют перспективную модель для исследований диабета и инсулиновой недостаточности, так как и свиньи, и человек всеядны, их желудочно-кишечный тракт имеет схожее строение. Более того, свиной инсулин отличается от человеческого лишь одной аминокислотой, а β-клетки, ответственные за его выработку, и общая структура поджелудочной железы (включая островки и сосудистую сеть) во многом аналогичны человеческим [3].
В течение последних нескольких десятилетий для изучения СД и тестирования антидиабетических средств были созданы многочисленные модели животных, которые включают химические, хирургические, гормональные, вирус-индуцированные и генетические вмешательства. И хотя они не совсем эквивалентны по этиопатогенетическим механизмам данной патологии человека, каждая из них выступает в качестве неотъемлемого инструмента для исследования генетических, эндокринных, метаболических, морфологических изменений, лежащих в основе данного заболевания.
Аллоксановая и стрептозотоцитовая модели являются наиболее надежными, изученными, дешевыми и безопасными для экспериментатора. В качестве диабетогенного агента 57,9% исследователей использовали стрептозотоцин (СТЗ), 30,3% — аллоксан, а применение других методов составило оставшиеся 11,8% [4]. Оба химиката используются как цитотоксические аналоги глюкозы, которые имеют тенденцию проникать в β-клетки поджелудочной железы через переносчик глюкозы 2 (GLUT2). Но механизмы действия аллоксана и СТЗ в β-клетках различны. Более высокая химическая стабильность и меньшая токсичность СТЗ позволяет легче манипулировать и более гибко дозировать по сравнению с аллоксаном. Несмотря на дешевизну аллоксановой модели, предпочтительнее использовать СТЗ в качестве диабетогенного агента из-за более высокого процента успешной индукции диабета и низкого процента смертности экспериментальных животных.
На протяжении последних десятилетий было проведено и опубликовано множество протоколов и их модификаций индукции СТЗ-диабета у лабораторных животных, однако модели индукции диабета на свиньях описаны мало. В поисковой системе PubMed было обнаружено только 28 исследовательских работ, где используется моделирование СТЗ-индуцированного диабета на свиньях. Эти работы различаются дозой применения или графиком применения диабетогенного препарата [5], выбором породы свиней, различными протоколами инсулинотерапии. Тем не менее, несмотря на наличие литературы о моделировании диабета на свиньях, она часто является разнонаправленной и неполной. Более того, исследования показали, что чувствительность к СТЗ у свиней сильно различается. Предполагается, что это различие связано с генетическими факторами. Например, доза 150 мг/кг успешно вызывает диабет у свиней Yorkshire Landrace, но для индукции диабета у свиней Goettingen требовалась доза 200 мг/кг [6]. Таким образом, чувствительность пород свиней к СТЗ различна. На данный момент существуют модели СТЗ-индуцированного диабета, поставленные на свиньях Wuzhisha [7], Yorkshire Landrace [8][9], Goettingen [10], Yucatan [11]. Однако свиньи породы Wiesenau не были использованы для моделирования диабета. На данный момент это одна из наиболее доступных пород лабораторных свиней в России. В связи с этим крайне актуально верифицировать модель формирования СТЗ-индуцированного диабета для дальнейшей разработки противодиабетической терапии. В данной статье мы показываем модель формирования СТЗ-индуцированного диабета на свиньях Wiesenau с коррекцией гипергликемии посредством назначения инсулина и доказательством стабильности модели на протяжении 90 дней.
Целью данной статьи является воспроизведение модели СТЗ-индуцированного диабета на свиньях Wiesenau с коррекцией гипергликемии инсулинотерапией и оценка ее стабильности и соответствия экспериментальной модели СД1.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились на 6 минипигах породы Wiesenau возрастом 7–9 месяцев и весом 19,3±5 кг.
Животных содержали в условиях вивария с регулируемым световым режимом (12 часов день, 12 часов ночь). Кормление выполнялось (Kormlina (Россия)) два раза в день (в 09:00 и 17:00). К основному рациону добавлялись овощи в 12:00. После индукции диабета рацион не менялся. Манипуляции, включая внутривенное введение препаратов, забор крови для биохимических исследований или глюкозотолерантного теста (ГТТ), а также установка датчика непрерывного мониторинга глюкозы, выполнялись с применением седации путем внутримышечного введения смеси Золетила (Virbac SA, Карро, Франция) (2 мг/кг/час) и 2% Ксилазина (Интерхеми веркер «Де Аделар», Эстония) (0,1 мг/кг/час). Для вывода из эксперимента животные были подвергнуты эвтаназии с использованием высоких доз анестетика Пропофол-Липуро (Braun, Германия).
Исследование эффективности и особенностей развития СТЗ-индуцированного диабета у свиней проводилось по схеме, описанной ниже. Перед индукцией диабета у экспериментальных животных проводили оценку биохимических анализов крови и мочи, а также — углеводного обмена для будущего сравнения с этими показателями после индукции диабета. С момента введения СТЗ мониторинг уровня глюкозы в крови выполнялся каждые 2 часа в течение 24 часов для обнаружения характерных паттернов колебаний уровня глюкозы при разрушении β-клеток и предотвращения гипогликемии, вызванной высвобождением инсулина разрушенными β-клетками. Далее, со 2-го по 7‑й дни эксперимента уровень глюкозы в крови измерялся 2 раза в день, а также оценивалось общее состояние животных, включая слабость, рвоту, аппетит, чувство жажды и др. На 7‑й день после введения СТЗ проводились лабораторные исследования, определяющие успешное развитие диабета, а также гепато-, нефротоксичность СТЗ, включая биохимический анализ крови, общий анализ мочи и ГТТ. Факт наличия диабета считался подтвержденным при гликемии выше 11 ммоль/л, снижении уровня инсулина и появлении кетоновых тел в моче. Все биохимические исследования крови и мочи, включая общий анализ крови (ОАК), общий анализ мочи (ОАМ), креатинин, аланинаминотрансферазу (АЛАТ) и аспартатаминотрансферазу (АСАТ), проводились в специализированной ветеринарной лаборатории. Уровень инсулина анализировался с использованием иммуноферментного анализа (ИФА) (ELISA Kit for Insulin (Pig), Cloud-clone corp., США, CEA448Po) согласно инструкции производителя.
Начиная с 7-го и до 90-го дня проводилась инсулинотерапия. Измерения уровня глюкозы в крови выполнялись 2 раза в день перед приемом пищи. Использовались продленный инсулин (Хумулин НПХ) утром и вечером, а также — короткий инсулин (Хумулин Р) перед основными приемами пищи. Инсулин вводился подкожно в область холки свиньи. Дозы инсулина корректировались в зависимости от уровня гликемии. Суточная потребность колебалась в диапазоне от 0,55 до 1,8 МЕ/кг в сутки.
Для исследования стабильности модели диабета по истечении трех месяцев оценивались уровень глюкозы и инсулина в крови животных, а также морфологические изменения и количество инсулин-продуцирующих клеток в островках Лангерганса (ОЛ) поджелудочной железы с использованием гистологического и иммуногистохимического окрашивания.
Индукция диабета
Индукцию диабета проводили с использованием СТЗ (Sigma-Aldrich). Перед введением СТЗ животное оставалось голодным на протяжении 12 часов. СТЗ вводился внутривенно в дозе 150 мг/кг, разведенный в концентрации 80 мг/мл в ацетатном буфере [10]. Важно отметить, что СТЗ стабилен в растворе в течение 15 минут, поэтому препарат растворяли непосредственно перед введением [12].
Мониторинг глюкозы в крови
Оценку уровня глюкозы в крови на протяжении всего эксперимента проводили с использованием глюкометра Аccu-chek active (Roche, Германия) (кровь брали из уха животного) и прибора непрерывного мониторинга глюкозы (НМГ) Freestyle Libre (Abbott Diabetes Care Ltd., США). Крепление прибора НМГ выполнялось после седации животного. Край клейкой основы датчика Freestyle Libre пришивался к коже животного с использованием шовного материала, как показано на рис. 1. Далее датчик накрывался ограничивающей крышкой, крышка закреплялась послеоперационным пластырем, последний пришивался. Система Freestyle Libre переустанавливалась каждые 2 недели или при необходимости чаще.
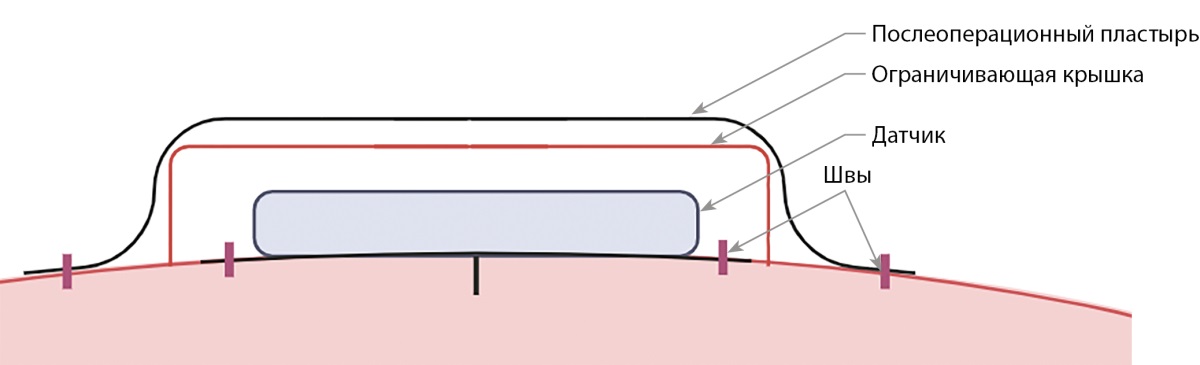
Рисунок 1. Схема крепления датчика Freestyle Libre для мониторинга глюкозы в крови свиней породы Wiesenau.
Глюкозотолерантный тест (ГТТ)
За 3 дня перед ГТТ отменялся продленный инсулин, животных переводили на инсулинотерапию коротким инсулином (Хумулин Р) перед каждым приемом пищи. Доза инсулина рассчитывалась исходя из уровня гликемии до приема пищи и количества хлебных единиц (ХЕ) в порции. За 12–16 часов до проведения ГТТ прекращалось введение любого инсулина и прием пищи. Для выполнения ГТТ вводили глюкозу (Гротекс ООО, Россия) внутривенно в дозе 0,5 г/кг. Образцы крови на исследование уровня глюкозы крови и инсулина забирали до и через 1 и 2 часа после внутривенного введения глюкозы.
Гистологический и иммуногистохимический анализы
После вывода животных из эксперимента забирали поджелудочные железы минипигов со СТЗ-индуцированным диабетом для гистологического и иммуногистохимического анализов. В качестве контроля использовали поджелудочные железы здоровых свиней породы Wiesenau. Гистологический анализ проводился с использованием стандартного окрашивания гематоксилином-эозином для визуализации структуры поджелудочной железы и ОЛ. Иммуногистохимический анализ проводился с использованием двойного иммуногистохимического окрашивания с первичными моноклональными антителами против глюкагона (1:10; Invitrogen, Carlsbad, California, USA) и инсулина (1:100; Invitrogen, Carlsbad, California, USA) на протяжении ночи при 4 °C. Образцы были докрашены с помощью DAPI (1:1000; BioLegend, San Diego, California, USA) в соответствии с протоколом производителя. Процент β-клеток был рассчитан с помощью программного обеспечения ImageJ как отношение площади инсулин-позитивных клеток к площади всей островковой ткани (инсулин- и глюкагон-позитивных клеток).
Условия проведения
Эксперимент проводился на базе вивария крупных животных ФГБОУ «ПИМУ» МЗ РФ и НИИ ЭО и БМТ ПИМУ МЗ РФ.
Этическая экспертиза
Все эксперименты с животными выполнялись в соответствии с принципами 3R (Replacement, Reduction, Refinement), которые были закреплены директивой Европейского парламента и совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. Все исследования с экспериментальными животными были одобрены локальным этическим комитетом ПИМУ (протокол №10 от 26.06.2020).
Статистический анализ
Статистический анализ и построение графиков выполнялись в программе GraphPad Prism 9.6.0 (GraphPad Software, LLC). Распределение всех данных предварительно проверялось на нормальность с помощью критериев Шапиро-Уилка. Данные представлены в виде медианы и интерквартильного размаха (Me [ Q1; Q3]) для непараметрических выборок или среднего ± стандартного отклонения для параметрических выборок. Для статистического анализа использовался тест Манна-Уитни. Различия считались статистически значимыми при p<0,005.
РЕЗУЛЬТАТЫ
Особенности развития стрептозотоцин-индуцированного диабета у свиней Wiesenau
Успешность проведения доклинических исследований на крупных животных в области испытания потенциальных противодиабетических препаратов зависит от корректно сформированной экспериментальной модели СД. Поэтому, учитывая множество открытых вопросов при формировании СТЗ-индуцированного диабета у свиней, такие исследования остаются крайне актуальными.
В данном исследовании при введении СТЗ в дозе 150 мг/кг диабет успешно индуцировался у четырех из шести свиней породы Wiesenau (табл. 1).
Таблица 1. Оценка успешности моделирования диабета
|
Успех индукции диабета |
|
|
Животное 1 |
+ |
|
Животное 2 |
+ |
|
Животное 3 |
Летальный исход |
|
Животное 4 |
+ |
|
Животное 5 |
Уровни глюкозы в крови остались в пределах нормы после введения СТЗ |
|
Животное 6 |
+ |
Примечание. СТЗ — стрептозотоцин.
После инъекции СТЗ у свиней наблюдался характерный паттерн колебания уровня глюкозы в крови первые 24 часа. Отмечалось повышение гликемии в крови первые 7 часов с последующим спадом уровня глюкозы до критических значений (рис. 2). При снижении гликемии ниже 2,5 ммоль/л животному внутривенно вводилась глюкоза в дозе 0,5 г/кг. Через 20 часов уровень глюкозы в крови снова повышался до 13,3±4,4 ммоль/л. Такая картина колебаний уровня глюкозы в крови являлась типичной при введении СТЗ [7][13].
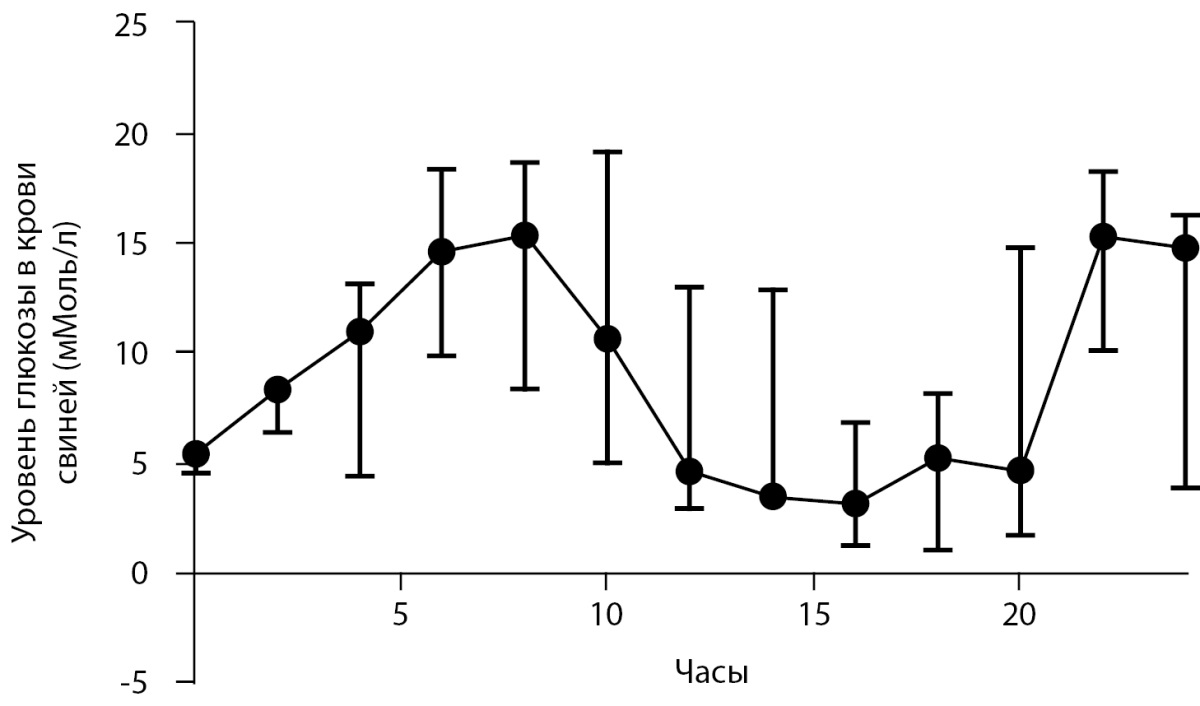
Рисунок 2. Динамика уровня глюкозы в крови в первые 24 часа после введения стрептозотоцина свиньям (медиана и интерквартильный размах).
Средний уровень глюкозы в крови животных со второго дня после введения СТЗ и до начала инсулинотерапии составил 17,3±2,5 ммоль/л, что сопоставимо с результатами зарубежных исследований [9]. Также в первые дни после индукции диабета у всех свиней наблюдалась вялость, потеря аппетита, полидипсия. У одной из свиней была замечена рвота. Снижение массы тела за первые 7 дней после инъекции СТЗ составило 7,8±2,6%, в других работах также отмечается потеря веса, например, продемонстрировано, что свиньи теряли 13,1% веса за 24 дня [10]. Кроме того, у трех свиней определялась кетонурия. Глюкозурия выявлялась во всех случаях.
ГТТ показал, что уровень глюкозы в крови свиней с индуцированным диабетом остается высоким как до (18,8±2 мМоль/л), так и после (19,2±2 мМоль/л) введения глюкозы. Уровень инсулина при этом не превышал значения 6,5 мкЕд/мл до и после нагрузки глюкозой. Стимуляция глюкозой не оказывала влияние на выработку инсулина (рис. 3).
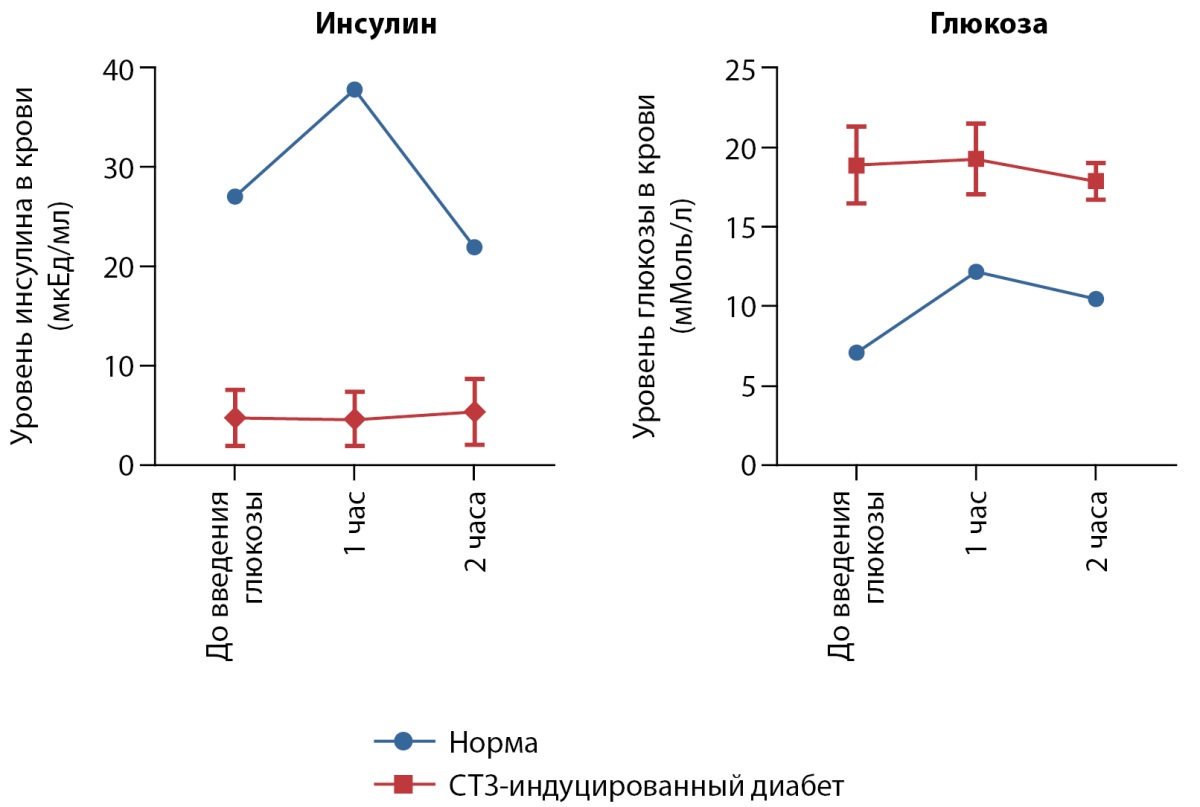
Рисунок 3. Изменение уровней глюкозы и инсулина в крови у свиней со стрептозотоцин-индуцированным диабетом в ответ на введение глюкозы по сравнению со здоровым животным (норма) (медиана и интерквартильный размах). Все данные статистически значимо отличаются по отношению в контролю (норма) (p<0,005).
У здоровых свиней уровень гликемии повышается после введения глюкозы с 7,0±0,3 ммоль/л до 12,1±0,35 ммоль/л, но затем быстро снижается до нормального уровня благодаря стимуляции выработки инсулина. В отличие от больных диабетом свиней, у здоровых особей уровень инсулина натощак был значимо выше, составил 27,0 мкЕд/мл и повышался в ответ на введение глюкозы до 37,8 мкЕд/мл (рис. 3). Данные результаты соответствуют исследованию [13], в котором у свиней с диабетом значения гликемии не снижаются после введения глюкозы, а уровень инсулина не увеличивается.
Оценивая ряд биохимических показателей крови, было выявлено, что через 7 дней введения СТЗ отмечалось повышение печеночных ферментов (АЛАТ, АСАТ), что указывает на гепатотоксичность СТЗ. При этом через 3 месяца уровень АЛАТ снизился до нормальных значений, а АСАТ не претерпел значительных изменений (табл. 2). Колебания креатинина крови были незначительными, что не подтверждает наличие нефротоксического действия СТЗ при использовании данной дозы.
Таблица 2. Изменение биохимических показателей крови свиней на разных сроках развития стрептозотоцин-индуцированного диабета
|
Креатинин, мкмоль/л |
АЛТ, Ед/л |
АСТ, Ед/л |
|
|
Норма |
69,6–207,7 |
21,7–46,5 |
15,3–55,3 |
|
7 дней |
96,7 [ 77,2; 134,6] |
54,3 [ 37,0; 72,6] |
120,7 [ 53,3; 294,6] |
|
1 месяц |
91,3 [ 78,4; 120,3] |
58,9 [ 46,1; 62,3] |
35,0 [ 26,1; 84,3] |
|
2 месяца |
112,6 [ 45,5; 104,1] |
83,3 [ 60,7; 79,6] |
48,1 [ 27,0; 44,5] |
|
3 месяца |
98,1 [ 85,8; 124,4] |
63,5 [ 55,5; 69,7] |
25,7 [ 19,6; 28,6] |
Примечание. АСТ — аланинаминотрансфераза; АСТ – аспартатаминотрансфераза. Жирным шрифтом выделены результаты, отклоняющиеся от нормы.
Таким образом, результаты исследования показывают, что введение СТЗ в дозе 150 мг/кг минипигам породы Wiesenau индуцирует диабет у 67% свиней. При этом наблюдаются характерные особенности успешного формирования диабета: развитие гипергликемии, кетонурии, глюкозурии, снижение уровня инсулина в крови, снижение массы тела.
Полученные нами результаты подтвердили относительную безопасность выбранной дозы СТЗ в отношении гепато- и нефротоксичности и в то же время эффективность в отношении индукции СД.
Подбор индивидуальной инсулинотерапии для свиней со стрептозотоцин-индуцированным диабетом
Для успешного использования модели СД на крупных животных в ходе тестирования различных антидиабетических препаратов важно не только обеспечить ее соответствие клиническим проявлениям заболевания, но и подтвердить долгосрочную стабильность. Кроме того, разработанный и оптимизированный протокол инсулинотерапии может служить важным инструментом для сравнения с другими потенциальными методами лечения диабета, что делает его ценным элементом в проведении доклинических исследований.
В данном исследовании для коррекции гипергликемии через 7 дней после введения СТЗ использовалась инсулинотерапия. Дозы инсулинотерапии рассчитывались исходя из массы тела животного. Потребность в инсулине составляла 0,70±0,34 МЕ/кг. Первоначально вводился базальный инсулин (Хумулин НПХ) и короткий инсулин (Хулулин Р). Доза продленного инсулина составляла 50–70% от общей и делилась на два приема (2⁄3–½ дозы утром, 1⁄3–½ дозы вечером). Доза короткого инсулина составляла 30–50% от общей и вводилась перед завтраком, ужином и при необходимости — перед обедом. Корректировка доз проводилась в зависимости от гликемии.
При инициации инсулинотерапии у свиней исчезали симптомы полидипсии и рвоты, они набирали в весе. Так, через неделю от начала инсулинотерапии масса свиней увеличилась на 7,6±5%. За 3 месяца инсулинотерапии вес свиней увеличился на 44,8±23%, что в том числе связано с их ростом. Средний уровень глюкозы крови за 3 месяца составил 10,9+2,4 ммоль/л, что представлено на рис. 4. В табл. 3 представлены медианы и интерквартильный размах у каждой свиньи в отдельности. При проведении контрольного анализа мочи кетоны не определялись.
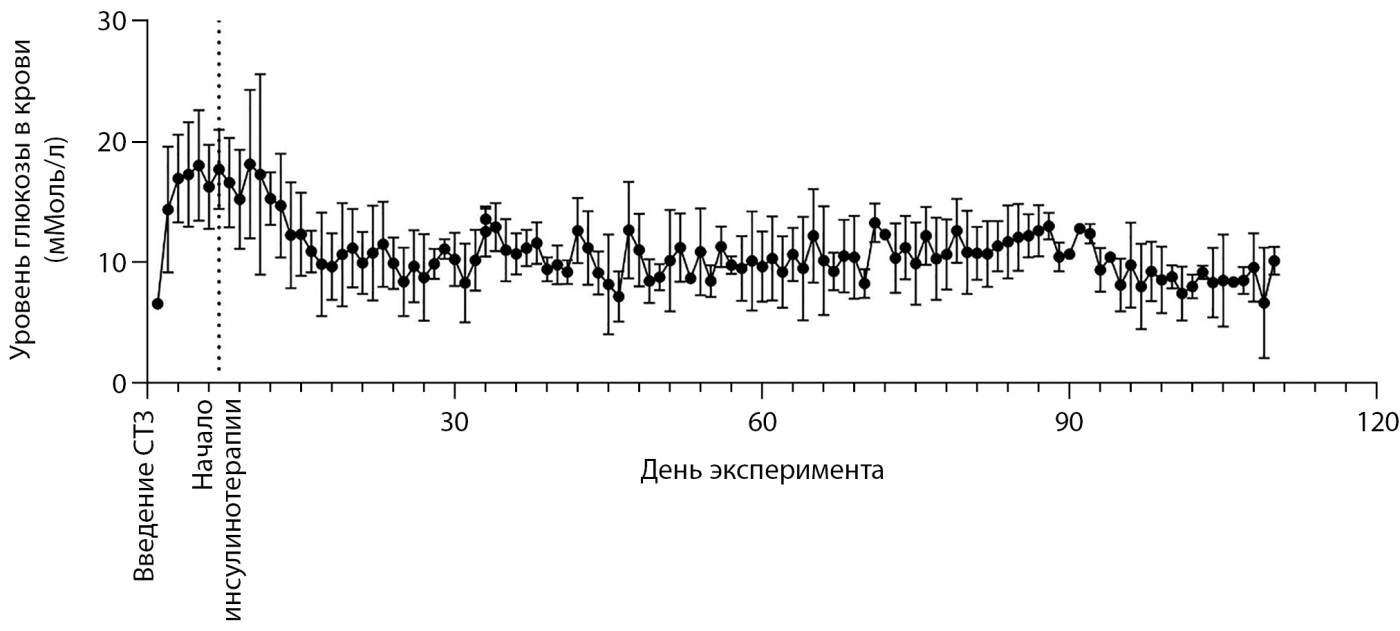
Рисунок 4. Динамика уровня глюкозы в крови свиней в ходе эксперимента (медиана и интерквартильный размах).
Таблица 3. Медианные значения уровня глюкозы в крови каждой свиньи в ходе эксперимента
|
Животное 1 |
Животное 2 |
Животное 4 |
Животное 6 |
|||||
|
утро |
вечер |
утро |
вечер |
утро |
вечер |
утро |
вечер |
|
|
Глюкоза крови, ммоль/л |
9,6 [ 8,6; 11,7] |
9,9 [ 8,6; 14,6] |
7,6 [ 6,3; 14,3] |
11,5 [ 9,1; 13,2] |
11,9 [ 9,4; 13,7] |
11,3 [ 9,4; 12,8] |
11,2 [ 9,5; 12,4] |
10,9 [ 9,1; 13,5] |
Необходимо отметить, что сложность достижения нормогликемии в данном случае была связана, во-первых, с наличием инсулинорезистентности у свиней, во-вторых, с тем, что через 1, 2 и 3 месяца исследования проводился ГТТ, который требовал отмены инсулина, что в условиях вызванного СТЗ дефицита инсулина вело к гипергликемии, которая требовала длительного времени для коррекции в условиях развивающейся глюкозотоксичности. Примечательно, что свинья 2, у которой отмечался наименьший вес, имела лучший гликемический профиль в отличие от остальных.
Экспериментально свиньям был проведен непрерывный мониторинг глюкозы (НМГ), который уже давно используется для контроля гликемии в интерстициальной жидкости у людей. Полученные результаты представлены на рис. 5. По данным кривых гликемий видно, что дневные колебания здоровой свиньи находятся в пределах физиологической нормы, после введения СТЗ гипергликемия достигает значений выше 17 ммоль/л, тогда как при инициации терапии инсулином уровень глюкозы крови снижается до нормальных значений с характерным подъемом после кормления. Данные результаты соответствуют исследованию [10], где выполнялся непрерывный мониторинг уровня глюкозы у свиней.
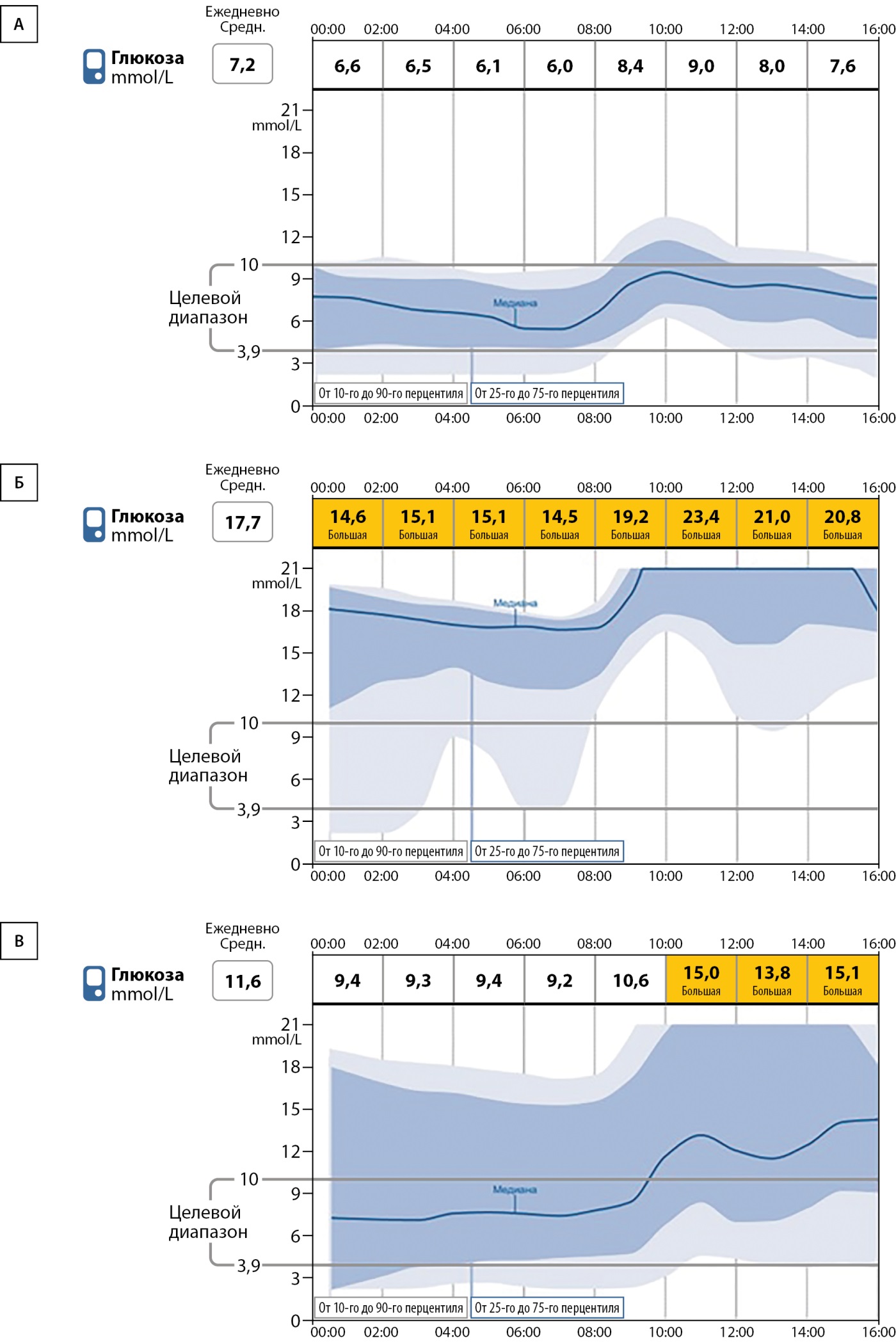
Рисунок 5. Динамика уровня глюкозы в крови свиней, полученная с использованием системы непрерывного мониторинга глюкозы Freestyle Libre.
Примечание. А — здоровая свинья; Б — свинья со стрептозотоцин-индуцированным диабетом в первые 7 дней после индукции диабета (без инсулинотерапии); В — свинья со стрептозотоцин-индуцированным диабетом на фоне лечения инсулином.
Таким образом, в проведенном нами исследовании демонстрируется подбор протокола инсулинотерапии для свиней породы Wiesenau с СТЗ-индуцированным диабетом для снижения уровня глюкозы крови в течение трех месяцев. Кроме того, для контроля гликемии была определена успешность применения непрерывного мониторинга глюкозы с использованием прибора Freestyle Libre, что позволит использовать его в дальнейших исследованиях для более удобной и стандартизированной оценки эффективности терапии СД на свиньях.
Исследование стабильности модели диабета на протяжении трех месяцев
Стабильность экспериментальной модели СД является важным параметром, особенно при проведении длительных исследований различных антидиабетических препаратов. В данной работе мы также продемонстрировали, что СТЗ-индуцированный диабет у свиней породы Wiesenau оставался стабильным на протяжении трех месяцев в условиях пониженной глюкозотоксичности. Это подтверждается тем, что при проведении ГТТ уровень глюкозы крови оставался на высоком уровне как натощак, так и после нагрузки. Кроме того, в течение исследования потребность в инсулине оставалась прежней. Также через 3 месяца после введения СТЗ уровень инсулина в крови свиней оставался на уровне 2,5±0,8 мкЕд/мл, в то время как у нормальных животных он был на высоком уровне. Данные результаты соотносятся с мировыми данными: так, в работе [13] инсулин в крови свиней с СТЗ-индуцированным диабетом составлял 2,8 мкЕд/мл.
Гистологическая картина при СТЗ-индуцированном диабете и инсулинотерапии подтвердила нарушения в структуре ОЛ (рис. 6). При исследовании поджелудочной железы свиней с СТЗ-индуцированным диабетом сложно было отличить эндокринную и экзокринную часть. Структура ОЛ была нарушена, наблюдался отек клеток (гиперхромные ядра, цитоплазма грубозернистая), присутствовали дистрофические изменения (синусоиды пустые, открытые), имелись уплотнения цитоплазмы в части клеток.
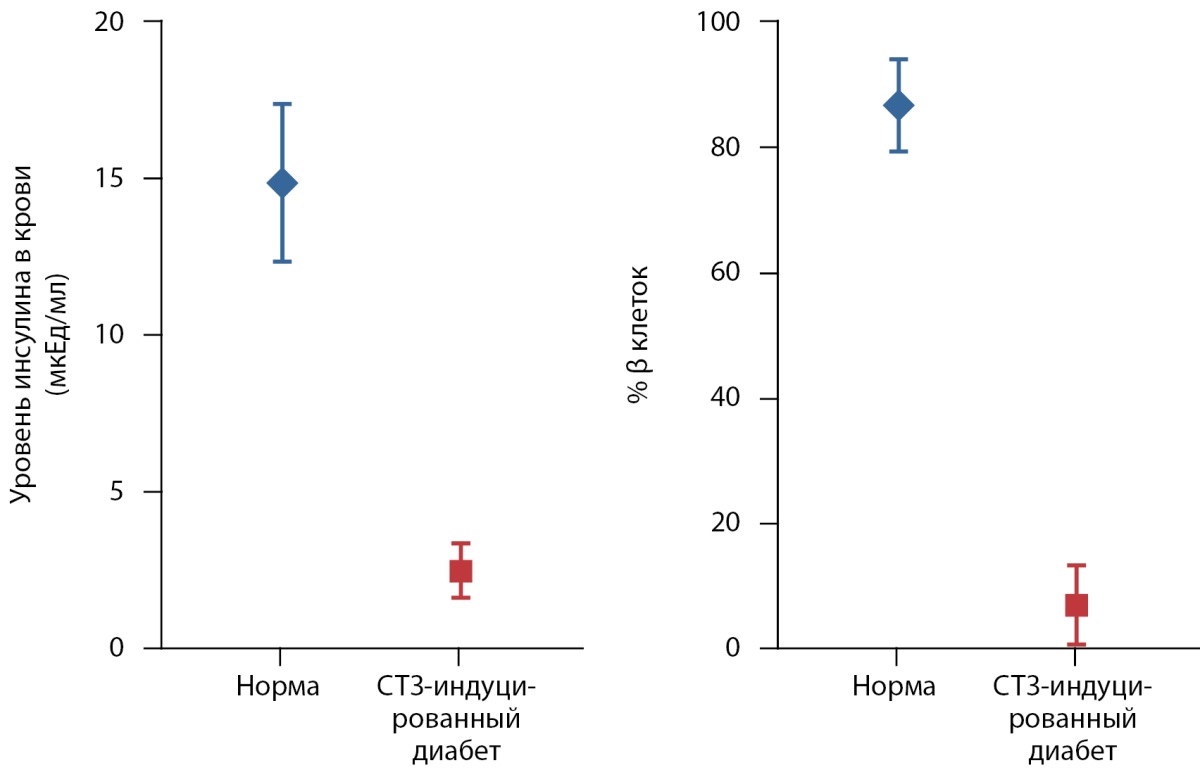
Рисунок 6. Уровень глюкозы в крови и количество β-клеток в островках Лангерганса свиней через три месяца после введения стрептозотоцина по сравнению со здоровым животным (норма) (медиана и интерквартильный размах). Все данные статистически значимо отличаются по отношению к контролю (норма) (p<0,005).
В здоровой поджелудочной железе границы между экзокринной и эндокринной частью были четкие, цитоплазма — слабо-базофильная и мелкозернистая, клетки — крупные. По периферии ОЛ клетки имели ядра округлой формы с высоким мелкодисперсным содержанием хроматина. В центре ОЛ ядра были более крупные, светлые, с мелкодисперсным содержанием хроматина. Синусоидные капилляры были расширены, отека не наблюдалось, что соответствует нормальной гистологической картине.
С помощью ИГХ-анализа было показано уменьшение размеров ОЛ у свиней с СТЗ-индуцированным диабетом за счет гибели инсулин-продуцирующих β-клеток. В ОЛ поджелудочных желез нормальных свиней содержалось 86±7% β-клеток, в то время как у свиней с СТЗ-индуцированным диабетом — только 7±6%. При этом глюкагон-продуцирующие α-клетки не страдали (рис. 7, 8).
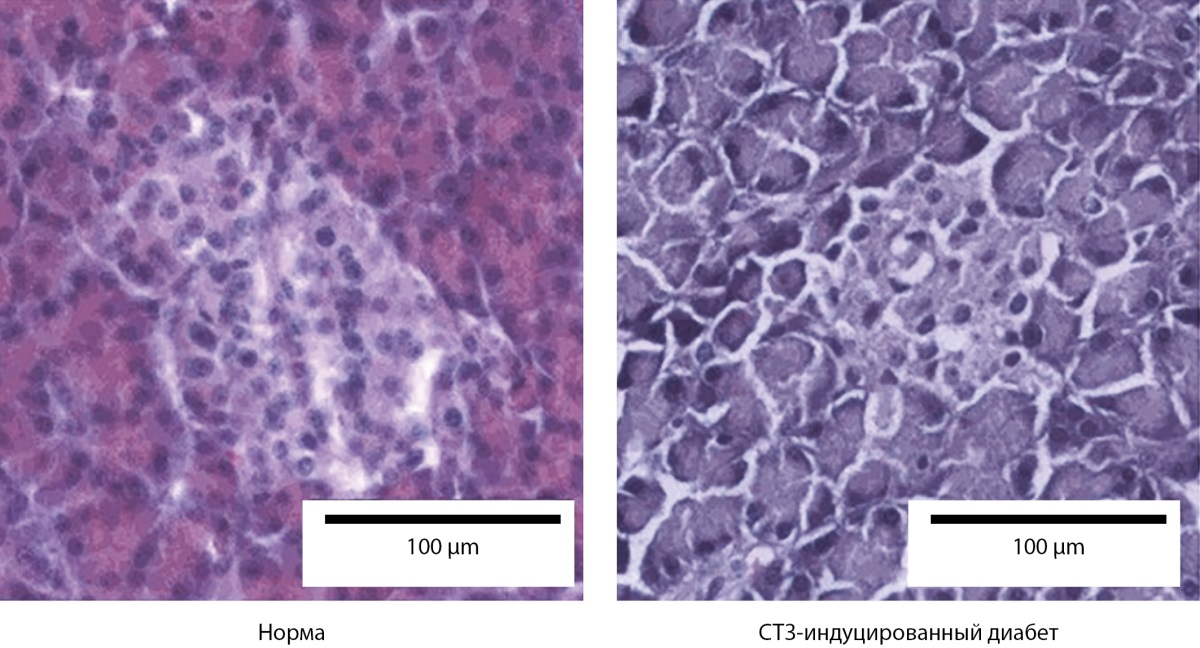
Рисунок 7. Гистологические изображения ткани поджелудочной железы свиньи (окрашивание гематоксилином и эозином. Об. х40).
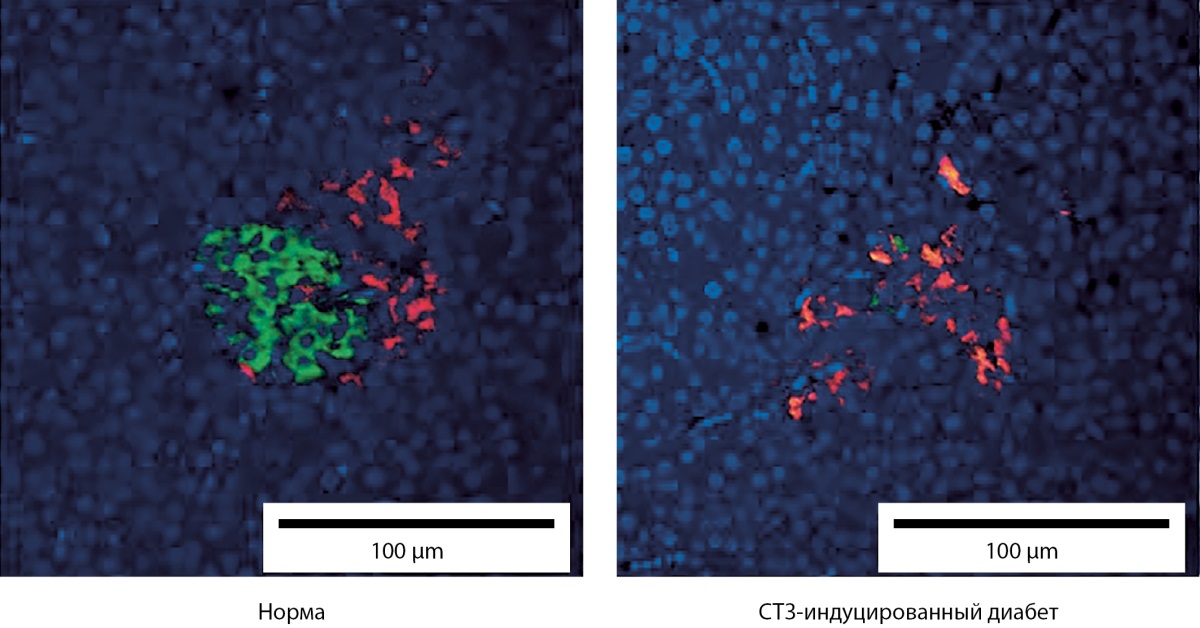
Рисунок 8. Изображения ткани поджелудочной железы свиньи (иммуногистохимическое окрашивание. Об. х40).
Примечание. Красным цветом окрашены глюкагон-продуцирующие клетки, зеленым — инсулин-продуцирующие клетки, синим — ядра клеток.
Наши данные показывают, что через три месяца модель СТЗ-индуцированного диабета у свиней Wiesenau остается стабильной: гистологическая картина тканей поджелудочной железы, ОЛ и процент β-клеток соответствуют модели СД1, уровень глюкозы в крови не снижался, а потребность в инсулине оставалась прежней, уровень инсулина в крови оставался на низком уровне.
ОБСУЖДЕНИЕ
Моделирование заболеваний на животных представляет собой важный инструмент для изучения патофизиологических процессов и оценки новых методов терапии. Хотя исследования на мелких животных позволили ответить на многие вопросы, для оценки применимости терапий в клинической практике необходимы модели крупных животных, поскольку метаболические механизмы у грызунов и человека существенно различаются. Приматы идеально подходят для таких исследований, однако их использование ограничено этическими и финансовыми соображениями. Свиньи обладают анатомическими и физиологическими характеристиками, близкими к человеческим, что делает их перспективными моделями для доклинических исследований. Метаболизм свиней схож с человеческим, включая усвоение питательных веществ, гомеостаз глюкозы и сходство молекул инсулина. Это обеспечивает адекватную модель для оценки эффективности и безопасности антидиабетических препаратов. Кроме того, размеры свиней позволяют проводить хирургические вмешательства, которые являются сложными или невозможными на мелких животных. Поскольку порода свиней Wiesenau ранее не использовалась для моделирования СД1, ее изучение представляется актуальным и значимым для расширения спектра доступных моделей, особенно в условиях России, где данная порода широко распространена.
В данной работе показано, что успешность моделирования СТЗ-индуцированного диабета у свиней породы Wiesenau при использовании дозы 150 мг/кг достигает 67%. Данные об эффективности моделей диабета в других исследованиях варьируются в зависимости от вида и породы животных. Например, показано, что у миниатюрных свиней и свиней породы Yorkshire Landrace доза СТЗ 150 мг/кг приводит к развитию диабета в 100% случаев [8][9][10], тогда как у свиней породы Goettingen и крупных беспородных свиней та же доза не вызывала гипергликемии [6]. С другой стороны, как доза, так и время введения препарата могут влиять на индукцию диабета. Например, было отмечено, что при медленной инфузии (30 минут) СТЗ в дозе 130 мг/кг развивается инсулинорезистентность [14].
Также варьируется эффективность моделирования СТЗ-индуцированного диабета у грызунов. Некоторые исследователи указывают на высокую степень успешности, достигающую 80–90% [15][16], в то время как другие работы сообщают о более низких показателях — 71% [17] и даже 50% [12]. Существуют и признанные модели диабета с низкой эффективностью. Например, аллоксановая модель используется в 30,3% исследований для моделирования диабета у крыс [18], однако она связана с летальными исходами в 30–60% случаев [4]. Тотальная панкреатэктомия свиней также может использоваться для моделирования диабета. Этот метод применяется, поскольку надежно вызывает диабет, однако он более травматичен и финансово затратен по сравнению с моделями, использующими химические агенты [10]. В другом исследовании, посвященном индукции диабета у свиней с помощью тотальной панкреатэктомии, только 60% животных успешно перенесли операцию, а выживаемость полностью панкреатэктомированных свиней составила 7,6±2,7 дня [19].
Следует отметить, что для животных среднего и крупного размера довольно сложно установить оптимальную дозу СТЗ из-за индивидуальных различий в реакции на препарат. В исследовании Ludwig B. с соавт. [20] показано, что использование СТЗ должно вызывать значительное повышение уровня глюкозы в крови в течение 1 недели, однако, особенно у свиней, этот эффект может быть частично обратимым. У некоторых животных может восстановиться контроль уровня глюкозы в крови и секреция эндогенного инсулина через неделю. Авторы отмечают, что увеличение дозировки СТЗ (например, до 200 мг/кг) не является решением, поскольку почечная и печеночная токсичность значительно возрастают. Таким образом, можно сделать вывод, что увеличение дозировки, вероятно, не приведет к повышению эффективности из-за токсичности препарата и увеличения числа летальных исходов. В то же время снижение дозы может привести к потенциальной резистентности у животных. Следовательно, выбранная доза 150 мг/кг обеспечивает оптимальный результат для свиней породы Wiesenau.
Кроме того, в данной работе мы продемонстрировали возможность использования современных технологий, рекомендованных для пациентов с СД, при формировании экспериментальной модели СД1 у свиней и для контроля гликемии в ходе инсулинотерапии. Система Freestyle Libre является одной из наиболее современных и широко распространенных в России. Информация о применении подобных систем в современной литературе ограничена. Была обнаружена только одна работа, в которой использовалось аналогичное устройство мониторинга (Medtronic MiniMed; Northridge, USA) [10]. В этом исследовании подчеркивается значимость системы непрерывного мониторинга уровня глюкозы для оценки состояния животного после введения инсулина и кормления. Кроме того, такая система позволяет отслеживать долгосрочные тенденции изменения уровня глюкозы в крови. Мы также отметили ценность этой системы: она не только предоставляет более полную информацию о колебаниях уровня глюкозы, но и снижает травматизацию капилляров ушей при ежедневном измерении уровня глюкозы глюкометром. Это значительно облегчает процедуру измерения и способствует более точному контролю уровня глюкозы у животных.
Стабильность экспериментальной модели СД является важным параметром, особенно при проведении длительных исследований различных антидиабетических препаратов. В литературе приводятся данные, полученные на мелких животных [21][22], которые свидетельствуют о том, что β-клетки могут начать восстанавливаться при отсутствии глюкозотоксичности через 120 дней и более. При использовании моделей свиней также отмечена возможность восстановления β-клеток через 24 месяца после введения СТЗ без устранения глюкозотоксичности [7]. В связи с этим мы посчитали важным протестировать стабильность данной модели на свиньях на протяжении 90 дней в условиях устранения глюкозотоксичности с помощью инсулинотерапии. На данный момент не существует стандартного протокола для коррекции дефицита инсулина у свиней. Одни исследователи используют инсулин короткого действия в дозе 0,4–0,8 МЕ/кг, разделяя ее на два приема [9], другие — пролонгированный инсулин с начальной дозой 0,8 МЕ/кг, корректируя ее в зависимости от уровня гликемии [23], а третьи сначала применяют инсулин короткого и среднего действия, а после стабилизации уровня глюкозы переходят на пролонгированный инсулин для поддержания гликемии [13]. В нашем исследовании использовалась инсулинотерапия с дозой 0,70±0,34 МЕ/кг. Применяли базальный инсулин (Хумулин НПХ) дважды в день (50–70% от дозы) и инсулин короткого действия (Хумулин Р) перед едой (30–50% от дозы) с учетом уровня гликемии. Такая терапия стабильно снижала уровень глюкозы в крови.
Таким образом, результаты нашего исследования демонстрируют, что через три месяца после индукции диабета с помощью СТЗ у свиней породы Wiesenau наблюдается стабильное течение заболевания. Гистологические изменения в поджелудочной железе, а также уровень остаточных β-клеток соответствуют характеристикам диабета. Уровень глюкозы в крови оставался повышенным, потребность в инсулине не снижалась, а концентрация инсулина в плазме крови сохранялась на низком уровне. Таким образом, данная модель может быть эффективно использована как для научных исследований, так и для доклинических испытаний новых препаратов, направленных на лечение состояний, связанных с дефицитом инсулина.
ЗАКЛЮЧЕНИЕ
Подтверждена относительная безопасность выбранной дозы СТЗ в отношении гепато- и нефротоксичности и эффективность в отношении индукции экспериментального СД1. При введении СТЗ в дозе 150 мг/кг у свиней успешно формируется диабет в 67% случаев. Подобран протокол инсулинотерапии и продемонстрирована его успешность для снижения уровня глюкозы крови в течение трех месяцев. Данная модель показала стабильность течения заболевания на протяжении 90 дней при сниженной глюкозотоксичности. Полученная модель может быть использована в экспериментальных и доклинических исследованиях при поиске и экспериментальном тестировании новых антидиабетических средств для лечения инсулинодефицитных состояний.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена при поддержке Министерства здравоохранения РФ (государственное задание № 720000Ф.99.1.БН62АБ30000 по теме «Технология компенсации инсулинодефицита аутологичными островками Лангерганса у больных с новообразованиями поджелудочной железы после радикального хирургического лечения»).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Ермакова П.С. — сбор и обработка полученных данных, статистическая обработка, анализ полученных результатов, написание основного текста; Луговая Л.А. — подбор инсулинотерапии, написание основного текста, редактирование текста; Васильчикова Е.А., Богомолова А.Ю., Целоусова Ю.М. — сбор и обработка полученных данных, редактирование текста; Наралиев Н.У., Кучин Д.М. — проведение хирургических процедур, одобрение финальной версии рукописи; Загайнова Е.В., Загайнов В.Е. — разработка концепции и дизайна исследования, написание и редактирование текста статьи, утверждение окончательного варианта статьи; Кашина А.В. — научное руководство проводимым исследованием, координация и контроль экспериментов, редактирование текста, одобрение финальной версии рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Renner S, Blutke A, Clauss S, et al. Porcine models for studying complications and organ crosstalk in diabetes mellitus. Cell Tissue Res. 2020;380(2):341-378. doi: https://doi.org/10.1007/s00441-019-03158-9
2. Joshi K, Katam T, Hegde A, et al. Pigs: Large Animal Preclinical Cancer Models. World J Oncol. 2024;15(2):149-168. doi: https://doi.org/10.14740/wjon1763
3. Zettler S, Renner S, Kemter E, et al. A decade of experience with genetically tailored pig models for diabetes and metabolic research. Anim Reprod. 2020;17(3):e20200064. doi: https://doi.org/10.1590/1984-3143-AR2020-0064
4. Ighodaro OM, Adeosun AM, Akinloye OA. Alloxan-induced diabetes, a common model for evaluating the glycemic-control potential of therapeutic compounds and plants extracts in experimental studies. Medicina (Kaunas). 2017;53(6):365-374. doi: https://doi.org/10.1016/j.medici.2018.02.001
5. Pandey S, Chmelir T, Chottova Dvorakova M. Animal Models in Diabetic Research-History, Presence, and Future Perspectives. Biomedicines. 2023;11(10):2852. Published 2023 Oct 20. doi: https://doi.org/10.3390/biomedicines11102852
6. Larsen MO, Rolin B. Use of the Göttingen Minipig as a Model of Diabetes, with Special Focus on Type 1 Diabetes Research. ILAR Journal / National Research Council, Institute of Laboratory Animal Resources. 2004;45(3):303-313. doi: https://doi.org/10.1093/ilar.45.3.303
7. Niu M, Liu Y, Xiang L, et al. Long-term case study of a Wuzhishan miniature pig with diabetes. Animal Model Exp Med. 2020;3(1):22-31. doi: https://doi.org/10.1002/ame2.12098
8. Jensen-Waern M, Andersson M, Kruse R, et al. Effects of streptozotocin-induced diabetes in domestic pigs with focus on the amino acid metabolism. Lab Anim. 2009;43(3):249-254. doi: https://doi.org/10.1258/la.2008.008069
9. Manell EA, Rydén A, Hedenqvist P, Jacobson M, Jensen-Waern M. Insulin treatment of streptozotocin-induced diabetes reestablishes the patterns in carbohydrate, fat and amino acid metabolisms in growing pigs. Lab Anim. 2014;48(3):261-269. doi: https://doi.org/10.1177/0023677213517683
10. Strauss A, Moskalenko V, Tiurbe C, et al. Goettingen Minipigs (GMP): Comparison of Two Different Models for Inducing Diabetes. Diabetol Metab Syndr. 2012;4:7. doi: https://doi.org/10.1186/1758-5996-4-7
11. Mésangeau D, Laude D, Elghozi JL. Early detection of cardiovascular autonomic neuropathy in diabetic pigs using blood pressure and heart rate variability. Cardiovasc Res. 2000;45(4):889-899. doi: https://doi.org/10.1016/s0008-6363(99)00406-x
12. Furman BL. Streptozotocin‐induced diabetic models in mice and rats. Curr Protoc Pharmacol. 2015:70(1):5.47.1-5.47.20. doi: https://doi.org/10.1002/0471141755.ph0547s70
13. Hara H, Lin YJ, Zhu X, et al. Safe induction of diabetes by high-dose streptozotocin in pigs [published correction appears in Pancreas. 2008 Apr;36(3):328. Balamarugan, A N [corrected to Balamurugan, A N]]. Pancreas. 2008;36(1):31-38. doi: https://doi.org/10.1097/mpa.0b013e3181452886
14. Koopmans SJ, Mroz Z, Dekker R, Corbijn H, Ackermans M, Sauerwein H. Association of insulin resistance with hyperglycemia in streptozotocin-diabetic pigs: effects of metformin at isoenergetic feeding in a type 2-like diabetic pig model. Metabolism. 2006;55(7):960-971. doi: https://doi.org/10.1016/j.metabol.2006.03.004
15. Deeds MC, Anderson JM, Armstrong AS, et al. Single dose streptozotocin-induced diabetes: considerations for study design in islet transplantation models. Lab Anim. 2011;45(3):131-140. doi: https://doi.org/10.1258/la.2010.010090
16. Wei M, Ong L, Smith MT, et al. The streptozotocindiabetic rat as a model of the chronic complications of human diabetes. Heart Lung Circ. 2023;12(1):44-50. doi: https://doi.org/10.1046/j.1444-2892.2003.00160.x
17. Gvazava IG, Kosykh AV, Rogovaya OS, et al. A Simplified Streptozotocin-Induced Diabetes Model in Nude Mice. Acta Naturae. 2020;12(4):98-104. doi: https://doi.org/10.32607/actanaturae.11202
18. Lee DY, Yang K, Lee S, et al. Optimization of monomethoxypolyethylene glycol grafting on the pancreatic islet capsules. J Biomed Mater Res. 2002;62(3):372-377. doi: https://doi.org/10.1002/jbm.10246
19. Kobayashi K, Kobayashi N, Okitsu T, et al. Development of a porcine model of type 1 diabetes by total pancreatectomy and establishment of a glucose tolerance evaluation method. Artif Organs. 2004;28(11):1035-1042. doi: https://doi.org/10.1111/j.1525-1594.2004.00002.x
20. Ludwig B, Wolf E, Schönmann U, Ludwig S. Large Animal Models of Diabetes. Methods Mol Biol. 2020;2128:115-134. doi: https://doi.org/10.1007/978-1-0716-0385-7_9
21. Grossman EJ, Lee DD, Tao J, et al. Glycemic control promotes pancreatic beta-cell regeneration in streptozotocin-induced diabetic mice. PLoS One. 2010;5(1):e8749. Published 2010 Jan 18. doi: https://doi.org/10.1371/journal.pone.0008749
22. Yin D, Tao J, Lee DD, et al. Recovery of islet beta-cell function in streptozotocin- induced diabetic mice: an indirect role for the spleen. Diabetes. 2006;55(12):3256-3263. doi: https://doi.org/10.2337/db05-1275
23. Nalin L, Selvaraju RK, Velikyan I, et al. Positron emission tomography imaging of the glucagon-like peptide-1 receptor in healthy and streptozotocin-induced diabetic pigs. Eur J Nucl Med Mol Imaging. 2014;41(9):1800-1810. doi: https://doi.org/10.1007/s00259-014-2745-3
Об авторах
П. С. ЕрмаковаРоссия
Ермакова Полина Сергеевна
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
Л. А. Луговая
Россия
Луговая Лия Александровна, к.м.н.
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
Е. А. Васильчикова
Россия
Васильчикова Екатерина Андреевна
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1 ,
А. Ю. Богомолова
Россия
Богомолова Александра Юрьевна
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
Ю. М. Целоусова
Россия
Целоусова Юлия Максимовна
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
Н. У. Наралиев
Россия
Наралиев Насиб Уланбекович
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
Д. М. Кучин
Россия
Кучин Денис Михайлович, к.м.н.
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1 ,
Е. В. Загайнова
Россия
Загайнова Елена Вадимовна, д.м.н., профессор
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1 ,
В. Е. Загайнов
Россия
Загайнов Владимир Евгеньевич, д.м.н., профессор
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1 ,
А. В. Кашина
Россия
Кашина Александра Викторовна, к.м.н.
603005, Нижний Новгород, пл. Минина и Пожарского, д. 10/1
Дополнительные файлы
|
|
1. Рисунок 1. Схема крепления датчика Freestyle Libre для мониторинга глюкозы в крови свиней породы Wiesenau. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(227KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Динамика уровня глюкозы в крови в первые 24 часа после введения стрептозотоцина свиньям (медиана и интерквартильный размах). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(170KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Изменение уровней глюкозы и инсулина в крови у свиней со стрептозотоцин-индуцированным диабетом в ответ на введение глюкозы по сравнению со здоровым животным (норма) (медиана и интерквартильный размах). Все данные статистически значимо отличаются по отношению в контролю (норма) (p<0,005). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(268KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Динамика уровня глюкозы в крови свиней в ходе эксперимента (медиана и интерквартильный размах). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(315KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Динамика уровня глюкозы в крови свиней, полученная с использованием системы непрерывного мониторинга глюкозы Freestyle Libre. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Уровень глюкозы в крови и количество β-клеток в островках Лангерганса свиней через три месяца после введения стрептозотоцина по сравнению со здоровым животным (норма) (медиана и интерквартильный размах). Все данные статистически значимо отличаются по отношению к контролю (норма) (p<0,005). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(220KB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. Гистологические изображения ткани поджелудочной железы свиньи (окрашивание гематоксилином и эозином. Об. х40). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(874KB)
|
Метаданные ▾ | |
|
|
8. Рисунок 8. Изображения ткани поджелудочной железы свиньи (иммуногистохимическое окрашивание. Об. х40). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(822KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Ермакова П.С., Луговая Л.А., Васильчикова Е.А., Богомолова А.Ю., Целоусова Ю.М., Наралиев Н.У., Кучин Д.М., Загайнова Е.В., Загайнов В.Е., Кашина А.В. Модель формирования стрептозотоцин-индуцированного диабета на крупных животных с оценкой ее эффективности и стабильности. Сахарный диабет. 2025;28(2):111-123. https://doi.org/10.14341/DM13168
For citation:
Ermakova P.S., Lugovaya L.A., Vasilchikova E.A., Bogomolova A.Y., Tselousova Y.M., Naraliev N.U., Kuchin D.M., Zagainova E.V., Zagainov V.E., Kashina A.V. Model of the formation of streptozotocin-induced diabetes in Wiesenau pigs with assessment of its effectiveness and stability. Diabetes mellitus. 2025;28(2):111-123. (In Russ.) https://doi.org/10.14341/DM13168

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































