Перейти к:
Аутологичная трансплантация гемопоэтических стволовых клеток как метод иммунной профилактики сахарного диабета 1 типа: возможности и перспективы
https://doi.org/10.14341/DM13089
Аннотация
Сахарный диабет 1 типа (СД1) — одно из наиболее распространенных аутоиммунных заболеваний, для лечения которого используется пожизненная инсулинотерапия. Нецелевые показатели гликемического контроля, которые отмечаются у 71% пациентов, приводят к формированию и прогрессированию осложнений СД, ранней инвалидизации и смертности. В связи с этим представляется актуальным поиск новых подходов к лечению и профилактике СД1. Проводятся исследования эффективности различных методов иммунопрофилактики развития СД1, в частности применения моноклональных антител. Так, для замедления развития клинической стадии СД1 в ноябре 2022 г. был одобрен теплизумаб. Изучаются перспективы применения новых вариантов трансплантации островковых клеток — в июне 2023 г. был одобрен препарат аллогенного донорского трансплантата β-клеток, полученного из поджелудочной железы доноров после смерти. Еще одним патогенетически обоснованным методом профилактики и лечения аутоиммунных заболеваний является высокодозная иммуносупрессивная терапия с аутологичной трансплантацией гемопоэтических стволовых клеток (ВИСТ-АТГСК). ВИСТ-АТГСК продемонстрировала свою эффективность и экономическую целесообразность в различных клинических испытаниях. В данном обзоре представлена актуальная информация по современным методам иммунопрофилактики СД1.
Ключевые слова
Для цитирования:
Черная М.Е., Халимов Ю.Ш., Волкова А.Р., Лискер А.В., Нерсесян А.А., Орловская А.Д., Полушин А.Ю., Залялов Ю.Р., Кулагин А.Д. Аутологичная трансплантация гемопоэтических стволовых клеток как метод иммунной профилактики сахарного диабета 1 типа: возможности и перспективы. Сахарный диабет. 2024;27(3):277-286. https://doi.org/10.14341/DM13089
For citation:
Chernaya M.E., Khalimov Y.Sh., Volkova A.R., Lisker A.V., Nersesyan A.A., Orlovskaya A.D., Polushin A.Y., Zalyalov Y.R., Kulagin A.D. Autologous hematopoietic stem cell transplantation as a method of immune prevention of type 1 diabetes mellitus: possibilities and prospects. Diabetes mellitus. 2024;27(3):277-286. (In Russ.) https://doi.org/10.14341/DM13089
ВВЕДЕНИЕ
Сахарный диабет 1 типа (СД1) стал наиболее распространенной аутоиммунной патологией среди детей, что связано со значительным ростом заболеваемости во всем мире за последнее десятилетие [1]. По данным Международной федерации диабета (IDF) на 2021 г., во всем мире более чем у 1,2 млн лиц в возрасте до 20 лет был диагностирован СД1 [1]. Увеличение числа пациентов обусловлено ростом продолжительности их жизни и снижением смертности [2]. Бремя этого заболевания связано с трудностями в поддержании целевых показателей гликемии и ранней инвалидизацией пациентов из-за осложнений СД. При недостаточном контроле гликемии происходит поражение сосудов мелкого и крупного калибра жизненно важных органов, в том числе сердца и почек [3]. Также возможно развитие ургентных осложнений — диабетического кетоацидоза и гипогликемических состояний. Течение СД1 связано с ранней потерей трудоспособности и снижением качества жизни [4–5]. Средний возраст смерти пациентов с СД1 в Российской Федерации (РФ) составляет 53 года [4].
Манифестация СД1 является результатом хронического аутоиммунного повреждения β-клеток поджелудочной железы (ПЖ), которое приводит к абсолютной инсулиновой недостаточности [6]. Важно отметить, что на момент клинической манифестации заболевания не функционирует от 60 до 80% β-клеток, однако часть β-клеток жизнеспособна [7].
Стандартные методы лечения СД1 основаны на применении пожизненной заместительной инсулинотерапии [8]. Несмотря на наличие современных препаратов инсулина и увеличение доли пациентов, применяющих помповую инсулинотерапию, по данным Федерального регистра СД в 2017–2022 гг. в РФ оптимальных показателей гликемического контроля достигают лишь 29% пациентов с СД1 [4]. Низкая эффективность инсулинотерапии обусловлена высокой лабильностью гликемии в условиях дисрегуляции углеводного обмена и отсутствия эндогенной секреции инсулина. Так, для оптимального гликемического контроля необходим высокий уровень вовлеченности и приверженности пациента к терапии [9].
В связи с недостаточной эффективностью инсулинотерапии у многих пациентов, актуальным является поиск принципиально иных подходов к лечению и профилактике СД1. Могут быть перспективны методики, направленные на профилактику аутоиммунного повреждения β-клеток, сохранение их жизнеспособности и секреторной активности.
ТРАНСПЛАНТАЦИЯ ОСТРОВКОВЫХ КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ В ЛЕЧЕНИИ СД1
В последние годы в клинических условиях у больных СД1 все чаще стали использоваться подходы, альтернативные «классической» заместительной инсулинотерапии: трансплантация β-клеток и различные стратегии сохранения резидуального пула β-клеток. Трансплантация островковых клеток ПЖ может привести к временному улучшению гликемического контроля, уменьшить риск макро- и микрососудистых осложнений СД1 и улучшить качество жизни пациента [10]. Тем не менее пациенты, получающие эту органозаместительную терапию, нуждаются в пожизненной иммуносупрессии для предотвращения рецидива иммуноопосредованной деструкции β-клеток и отторжения трансплантата [10]. Учитывая побочные эффекты постоянной иммуносупрессии, трансплантацию островковых клеток ПЖ рекомендовано выполнять пациентам, у которых уже есть показания к пересадке почки, и, следовательно, им в любом случае потребуется иммуносупрессивная терапия. Также трансплантация островковых клеток ПЖ показана в ситуациях, когда ожидаемая польза от строгого гликемического контроля превышает риски пожизненной иммуносупрессии, то есть при «лабильном» течении СД1 с частыми эпизодами диабетического кетоацидоза или тяжелых гипогликемий [10–11].
Для лечения взрослых с СД1 с частыми эпизодами тяжелых гипогликемических состояний в анамнезе в июне 2023 г. FDA был одобрен препарат аллогенного донорского трансплантата β-клеток, полученного из ПЖ доноров после смерти [12]. Это первый препарат для клеточной терапии СД1. По результатам исследований, в ходе которых была оценена эффективность и безопасность данного препарата, из 30 пациентов с СД1 у 10 была достигнута инсулинонезависимость более чем на 5 лет, у 11 — от 1 до 5 лет, у 4 — менее 1 года и у 5 пациентов инсулинонезависимость не была достигнута [13]. Главным недостатком данного вида терапии является обязательное применение иммуносупрессивных препаратов.
С момента определения гиперактивации аутоиммунитета как ключевого звена развития СД1 были исследованы различные стратегии задержки и/или прекращения разрушения β-клеток и сохранения оставшегося пула для увеличения продолжительности периода сохранной инсулиносекреторной функции ПЖ [14].
ПРИМЕНЕНИЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ В ПРОФИЛАКТИКЕ СД1
В последние 20 лет активно исследуется возможность применения моноклональных антител для профилактики или замедления развития СД1. Эффективность препаратов данной группы варьирует, что не позволяет однозначно оценить возможность их применения в клинической практике. Так, исследования по профилактике прогрессирования СД1 с использованием теплизумаба и отелизумаба (моноклональные антитела к T-клеточному рецептору-CD3) у пациентов с недавно манифестировавшим СД1 (менее 4 месяцев) продемонстрировали незначительное замедление снижения уровня С-пептида и некоторое снижение суточной потребности в инсулине. У 5% пациентов отмечены периоды инсулинонезависимости [15–16].
В последующем были осуществлены и другие воздействия на механизмы развития СД1 с применением иммуномодулирующих подходов: использование алефацепта (белок слияния LFA3-IgG1, который связывает CD2-рецепторы Т-клеток памяти) и абатацепта (белок слияния CTLA-4-IgG1, который связывает молекулы CD80 и CD86 на поверхности антигенпрезентирующих клеток) способствовало замедлению скорости снижения уровня С-пептида и снижению потребности в экзогенном инсулине по сравнению с плацебо, но ни один из пациентов не достиг полной инсулинонезависимости [17–18].
Также были попытки применения ритуксимаба (моноклональные антитела к трансмембранному антигену CD20 B-лимфоцитов) с целью лечения пациентов с недавно диагностированным СД1: несмотря на безопасность и способность замедлять снижение уровня С-пептида, существенной разницы в потребности в экзогенном инсулине по сравнению с плацебо обнаружено не было [19].
Таким образом, предупреждение разрушения β-клеток у пациентов с недавно манифестировавшим СД1 за счет воздействия на определенные регуляторные молекулы клеток иммунной системы пока не обладает достаточной эффективностью. В результате удается достичь лишь более медленного снижения уровня С-пептида и небольшого снижения суточных доз экзогенного инсулина. Фармакологическая иммуномодуляция моноклональными антителами не оказала существенного и длительного влияния на течение развившегося СД1.
В ноябре 2022 г. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для клинического применения у взрослых и детей старше 8 лет с целью замедления развития клинической стадии СД1 был одобрен препарат Tzield (теплизумаб) [20]. Эффективность данного препарата была подтверждена для ближайших родственников пациентов с СД1, у которых обнаруживалось не менее двух типов специфичных аутоантител (АТ-GAD — аутоантитела к декарбоксилазе глутаминовой кислоты, ICA — аутоантитела к островковым клеткам, IAA — аутоантитела к инсулину, IA-2 — аутоантитела к тирозинфосфатазе 2, ZnT8 — аутоантитела к транспортеру цинка 8) и имелись ранние нарушения углеводного обмена: нарушенная гликемия натощак и/или нарушенная толерантность к глюкозе [21]. Важно отметить, что у пациентов на момент включения в исследование отсутствовали признаки абсолютной инсулиновой недостаточности и, следовательно, манифестация СД1. Такие пациенты представляли собой группу риска развития СД1. За 8 лет наблюдения у 50% пациентов, получавших теплизумаб, и у 22% пациентов, получавших плацебо, не произошло манифестации СД1. Среднее время до манифестации СД1 было на 32,5 месяца больше в группе пациентов, получивших курс терапии теплизумабом, в сравнении с получавшими плацебо [22]. Наиболее частыми осложнениями терапии были кожный зуд и транзиторная лимфопения [21][23].
АУТОЛОГИЧНАЯ ТРАНСПЛАНТАЦИЯ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
В связи с наличием ряда преимуществ, таких как доступность доноров, минимальная потребность в иммуносупрессии, трансплантация стволовых клеток (СК) является перспективным методом терапии СД1 [24]. С одной стороны, СК могут индуцировать аутоиммунный процесс и иммунологическую реконституцию организма, с другой — могут быть источником для восстановления пула β-клеток ПЖ [25]. С этой целью на сегодняшний день чаще всего используются гемопоэтические стволовые клетки (ГСК), индуцированные плюрипотентные стволовые клетки (ИПСК) и мезенхимальные стволовые клетки (МСК) [26].
Среди различных методик предпочтение отдается аутологичной трансплантации, где донор является одновременно и реципиентом, нежели аллогенной, где донор и реципиент различны. Это связано риском развития реакции отторжения аллогенного трансплантата и необходимостью пожизненной иммуносупрессивной терапии. Несмотря на наличие различных источников СК и развитие клеточных технологий, клиническое использование данного метода терапии все еще ограничено. Так, проблемы терапии СД1 на основе ЭСК и ИПСК связаны с неполным созреванием и функциональной недостаточностью in vitro β-клеток, их подверженностью иммунным реакциям и риском образования тератом [27]. Данные об эффективности терапии на основе МСК неоднозначны. В исследовании Carlsson PO и соавт. (2014 г.) использование МСК продемонстрировало свою безопасность и сопоставимую с плацебо эффективность в достижении гликемического контроля [28]. В исследовании Izadi M и соавт. (2022 г.) было доказано, что аутологичная трансплантация МСК безопасна и эффективна, особенно у пациентов с недавно диагностированным СД1 и частыми эпизодами гипогликемии [26]. Тем не менее, потенциальная канцерогенность МСК в долгосрочной перспективе не исключена полностью, с чем связаны опасения по поводу их клинического использования [27]. Некоторые авторы отмечают, что на сегодняшний день наиболее обнадеживающие результаты были получены при аутологичной трансплантации ГСК [27][29].
Результаты ряда исследований показали, что высокодозная иммуносупрессивная терапия с аутологичной трансплантацией ГСК (ВИСТ-АТГСК) является достаточно эффективным методом лечения тяжелых аутоиммунных заболеваний (АИЗ). Чаще всего процедура ВИСТ-АТГСК используется у пациентов с рассеянным склерозом, системной склеродермией, болезнью Крона, системной красной волчанкой, СД1 [30]. В результате проведения ВИСТ-АТГСК снижается активность иммунной системы против собственных β-клеток ПЖ [31]. Своевременное прекращение деструкции β-клеток обеспечивает сохранение эндокринной функции ПЖ, что позволяет достичь полной независимости от введения экзогенного инсулина на неопределенный период, таким образом развивается ремиссия СД1 [32].
По данным исследования The Diabetes Control and Complications Trial (DCCT), выявлено снижение риска микрососудистых осложнений у пациентов с СД1 с более высокими уровнями С-пептида и пережившим фазу «медового месяца» [33]. Можно предположить аналогичный эффект от длительного периода независимости от инсулина после ВИСТ-АТГСК, что может способствовать достижению удовлетворительного гликемического контроля и замедлению развития отдаленных осложнений. Применение ВИСТ-АТГСК может быть экономически выгоднее, чем длительное применение инсулинотерапии, использование средств контроля гликемии и дальнейшее лечение осложнений СД1 [34].
Процедура ВИСТ-АТГСК включает в себя 8 основных этапов [35].
1.Мобилизация ГСК — стимуляция выхода CD34+ (стволовых клеток) из костного мозга в периферический кровоток с целью последующего афереза. Производится с использованием гранулоцитарного колониестимулирующего фактора (Г-КСФ) в сочетании с циклофосфамидом (ЦФ). Эффективность мобилизации ГСК зависит от возраста пациентов и индивидуальных особенностей, включая функционирование костного мозга.
2.Лейкаферез/аферез — забор из периферической крови CD34+ клеток, осуществляемый аппаратным способом с использованием сепаратора клеток крови.
3.Криоконсервация трансплантата — хранение ГСК в жидком азоте с добавлением диметилсульфоксида (криопротектора) на время проведения кондиционирования или перерыва в лечении.
4.Режим кондиционирования (РК) — проведение высокодозной иммуносупрессивной терапии с целью деплеции (удаления) аутореактивных Т- и В-лимфоцитов. РК продолжается от 4 до 7 дней и отличается по интенсивности, что определяет эффективность и безопасность лечения. Наиболее часто при АИЗ используется РК, включающий Циклофосфамид+Антитимоцитарный глобулин (ЦФ+АТГ). Однако вопрос выбора РК при СД1 остается открытым.
5.АТГСК — размораживание и инфузия аутотрансплантата (через центральный венозный катетер). В среднем процедура занимает до 30 минут. Целью переливания аутологичных ГСК является быстрое восстановление пула наивных иммунокомпетентных клеток и сокращение периода цитопении.
6.Иммунотерапия — дополнительное удаление Т-лимфоцитов, содержащихся в трансплантате. С этой целью используется АТГ, который также обладает иммуномодулирующим действием за счет увеличения экспансии Т-регуляторных лимфоцитов (T-reg), что положительно влияет на процессы иммунологической толерантности [36]. Важно отметить, что использование глюкокортикостероидов для профилактики нежелательных реакций иммунотерапии недопустимо при СД1, так как они обладают цитотоксичностью в отношении островковых клеток ПЖ [37].
7.Период цитопении — период, который характеризуется низким уровнем клеток крови, в связи с чем пациенты изолируются в палаты, оснащенные воздушными фильтрами, и получают антибактериальную, противовирусную и антимикотическую профилактику, а при необходимости — гемотрансфузионную поддержку.
8.Восстановление гемопоэза — этап достижения устойчивого гемопоэза и референтных значений содержания клеток в периферической крови, возможно дополнительное введение Г-КСФ для сокращения периода цитопении.
ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ МЕТОДА ВИСТ-АТГСК ПРИ СД1
СД1 является органоспецифическим АИЗ с преимущественным вкладом в его развитие нарушений клеточного иммунитета. Роль аутоантител в патогенезе СД1 вторична, но важна для клинической диагностики. Все АИЗ имеют общие иммунопатологические механизмы: под воздействием триггерных факторов окружающей среды (инфекции, курение, стресс и пр.) происходит дисрегуляция иммунной системы, и реализуется генетическая предрасположенность к АИЗ [38]. При СД1 развивается селективная аутоиммунная деструкция β-клеток ПЖ цитотоксическими Т-лимфоцитами, в результате чего возникает прогрессирующая потеря β-клеток и недостаточность секреции инсулина (инсулинопения) [39].
ВИСТ-АТГСК опосредует иммунную реконституцию («перезагрузку» иммунной системы), что ведет к предотвращению прогрессирования АИЗ. Метод рассчитан на снижение или полное подавление аутоагрессии при элиминации большей части аутореактивных клонов Т- и В-лимфоцитов за счет ВИСТ. Восстановление иммунной толерантности происходит популяцией «наивных» лимфоцитов при трансфузии аутотрансплантата (АТГСК) [40].
Таким образом, применение ВИСТ-АТГСК обосновано и потенциально эффективно в лечении СД1. Наилучший клинический прогноз наблюдается при проведении процедуры в период с достаточным количеством сохранных β-клеток ПЖ [41–42].
Возможные инфекционные, аллергические и токсические осложнения раннего периода ВИСТ-АТГСК известны, подвержены активному скринингу и лечению. Инфекционные осложнения развиваются практически во всех случаях, часто обусловлены реактивацией персистирующих в организме возбудителей и подвержены профилактике: санация очагов хронической инфекции до проведения процедуры и пребывание в условиях асептической палаты во время проведения ВИСТ-АТГСК. Инфекционные осложнения купируются с помощью антибактериальной, антимикотической и противовирусной терапии [43–44].
При иммунотерапии могут возникать аллергические реакции вплоть до сывороточной болезни, риск которых уменьшается при низкой скорости инфузии АТГ, предварительном приеме антигистаминных препаратов, парацетамола. В результате ВИСТ-АТГСК можно ожидать органные поражения: кардиотоксичность, гепатотоксичность, нефротоксичность, поражение желудочно-кишечного тракта, кожи и ее придатков (алопеция) [45].
Отдаленные осложнения ВИСТ-АТГСК при АИЗ изучены недостаточно, в связи с чем важна динамическая оценка состояния здоровья пациента после трансплантации. В результате ВИСТ-АТГСК существует риск развития вторичных АИЗ. Наиболее часто (в 3–4% случаев выполнения ВИСТ-АТГСК) описывают поражение щитовидной железы (аутоиммунный тиреоидит, болезнь Грейвса). Продемонстрировано отрицательное влияние данного метода лечения на репродуктивную систему мужчин и женщин, однако снижение фертильности ассоциировано со старшим возрастом. По литературным данным, для женщин старше 45 лет риск наступления аменореи с переходом в постменопаузу составляет 65%. Для профилактики бесплодия возможно рассмотрение процедуры криоконсервации половых клеток или эмбрионов перед ВИСТ-АТГСК.
Вместе с тем безопасность ВИСТ-АТГСК продемонстрирована во многих клинических испытаниях, а летальность, ассоциированная с терапией, составляет менее 1% [46].
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ВИСТ-АТГСК ДЛЯ ЛЕЧЕНИЯ СД1
Европейской группой трансплантации крови и костного мозга (European Group for Blood and Marrow Transplantation — EBMT) была создана единая база данных, включающая информацию о пациентах, перенесших аутологичную и аллогенную трансплантацию ГСК. По данным Группы по лечению АИЗ в регистре Европейского общества по трансплантации крови и костного мозга (Autoimmune Diseases Working Party (ADWP), частота АТГСК при АИЗ с каждым годом увеличивается, в настоящее время насчитывается более 3000 аутологичных трансплантаций при различных аутоиммунных патологиях. Так как аллогенная ТГСК ассоциирована с большим числом осложнений в сравнении с аутологичной ТГСК, ее применение оправдано только когда потенциальная польза значимо превышает риск [44].
Значимые этапы разработки метода ТГСК представлены на рис. 1.
В РФ метод ВИСТ-АТГСК используется при тяжелых АИЗ с середины 90-х [47–48]. Впервые метод ВИСТ-АТГСК для лечения СД1 был применен в Бразилии в 2007 г. Voltarelli и соавт. продемонстрировали обнадеживающие результаты в ходе проспективного исследования, которые были позднее подтверждены во всем мире [49–53]. В течение последних 15 лет исследования подтверждают, что ВИСТ-АТГСК является перспективным, эффективным терапевтическим подходом в отношении достижения временной инсулинонезависимости и улучшения гликемического контроля пациента с СД1 [54–55].
В табл. 1 приведены основные результаты исследований ВИСТ-АТГСК при СД1 с различными периодами наблюдения и критериями включения пациентов. Во всех приведенных исследованиях использовался одинаковый РК: ЦФ в суммарной дозе 200 мг/кг + AТГ (кроличий) в суммарной дозе 4,5 мг/кг. Во всех исследованиях зафиксирован период ремиссии СД1, определяемый как полная инсулинонезависимость на определенный срок. Отмечено значимое снижение необходимых доз экзогенного инсулина у пациентов, не достигших полной инсулинонезависимости, и у пациентов, вернувшихся к инъекциям после прекращения ремиссии. В результате ВИСТ-АТГСК зафиксировано снижение уровня HbA1c<7% минимум на 6 месяцев, нарастание уровня С-пептида и снижение уровня антител к GAD.
В завершенных исследованиях эффективности и безопасности ВИСТ-АТГСК у больных СД1 отмечается неоднородность полученных результатов, что может быть обусловлено влиянием различных факторов: разными критериями включения пациентов и сроками наблюдения.
В исследовании 3 (E. Snarski, 2016) отмечен один летальный исход, связанный с сепсисом от синегнойной палочки [57]. Из осложнений ВИСТ-АТГСК в указанных исследованиях наиболее часто встречались бактериальные и грибковые инфекции. Так, из всех 283 пациентов, включенных в указанные исследования, пневмонии зафиксированы у 5 человек (1,8%), другие инфекционные осложнения — у 7 человек (2,5%).
В исследованиях 4 и 6–9 среднее время инсулинонезависимости было больше, чем в других исследованиях, что может быть связано с более низким средним возрастом включенных пациентов. В исследовании 5 при молодом среднем возрасте пациентов (17,5 лет) отмечен небольшой период независимости от инсулина (12 мес), что может быть обусловлено включением пациентов с большой длительностью СД1 — до 6 мес [59].
Следует отметить, что в большинстве исследований в качестве первичной конечной точки и критерия эффективности ВИСТ-АТГСК выбран период инсулинонезависимости. Но снижение дозы инсулина, снижение уровня HbA1c, лучший гликемический контроль наблюдались и после окончания периода инсулинонезависимости. Оценка вариабельности гликемии до и после ВИСТ-АТГСК в ранее выполненных исследованиях не проводилась.
Наиболее важным предиктором успешной трансплантации является высокий уровень С-пептида в крови. Диабетический кетоацидоз в анамнезе, как маркер выраженного секреторного дефицита, относится к предиктору неудачи. Высокая аутореактивность цитотоксических Т-лимфоцитов и высокий уровень фактора некроза опухоли-α (ФНО-α) до проведения ВИСТ-АТГСК ассоциированы с меньшей продолжительностью ремиссии. Выявление более чем одного вида аутоантител к клеткам ПЖ в разных исследованиях оказывало разнонаправленное влияние на эффективность процедуры. Модель пациента с потенциально наибольшей пользой от ВИСТ-АТГСК: пациент с СД1, диагностированным не более чем за 6 недель до выполнения процедуры, без диабетического кетоацидоза в анамнезе, с высоким уровнем С-пептида [32].
Выявлена отрицательная корреляция возраста на момент ТГСК, а также уровня ФНО-α и периода инсулинонезависимости. Наибольший период инсулинонезависимости наблюдался у пациентов моложе 16 лет, при уровне С-пептида >1,5 нг/мл, уровне ФНО-α <3,5 пг/мл. Достоверно неизвестно влияние НLA-генотипа пациента на эффект ВИСТ-АТГСК [52]. В ряде исследований рассматривают возникновение респираторного заболевания как фактор завершения периода инсулинонезависимости. Неизученными остаются вопросы продления ремиссии, например, с помощью применения инкретинов в посттрансплантационном периоде для предотвращения рецидива СД1 [50].
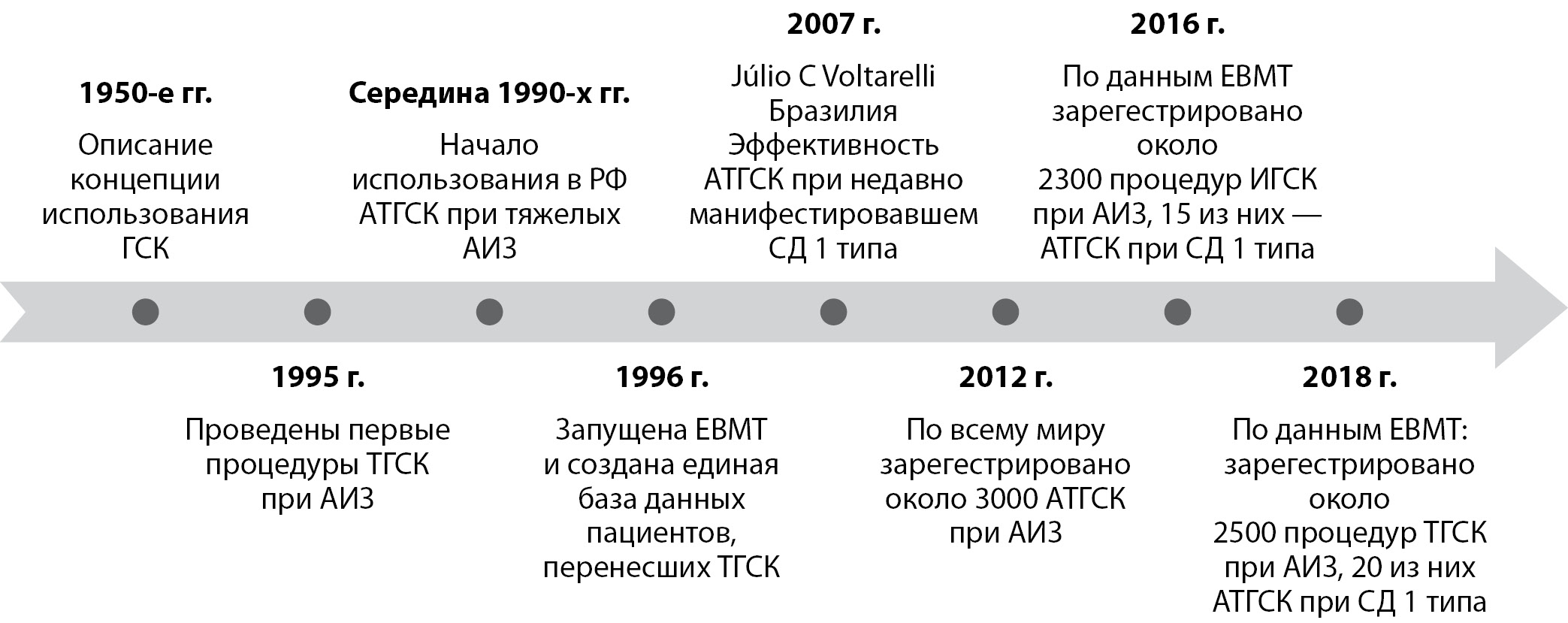
Рисунок 1. Развитие метода трансплантации гемопоэтических стволовых клеток при аутоиммунных заболеваниях.
Примечание: ГСК — гемопоэтические стволовые клетки; ТГСК — трансплантация гемопоэтических стволовых клеток (аутологичная, аллогенная, сингенная); АТГСК — аутологичная трансплантация гемопоэтических стволовых клеток; АИЗ — аутоиммунные заболевания.
Таблица 1. Основные исследования эффективности и безопасности аутологичной трансплантации гемопоэтических стволовых клеток при сахарном диабете 1 типа
№ | Средний возраст. Особенности выборки | Время от дебюта СД1 | Исходные показатели | Количество пациентов | Пациенты с ДКА | % пациентов, достигших инсулинонезависимости | Максимальный период инсулинонезависимости | Среднее время инсулинонезависимости | Среднее время от ТГСК до прекращения введения инсулина | Показатели после ТГСК | Тяжелые осложнения | Источник |
1 | 19,2 года | до 6 нед | HbA1c — 7,86±1,38%. С-пептид — 0,4±0,3 нг/мл, С-пептид стим. — 1,3±1,0 нг/мл | 15 | 0 | 93% | 35 мес | 16,2 мес | 1,7 дней (-3–610) | HbA1c <7%; С-пептид — 1,9±1,1 нг/мл; С-пептид стим. — 4,5±3,7 нг/мл через 24 мес | Двусторонняя пневмония — 1 | Voltarelli, 2007 [49] |
2 | 25,8 года До — получали плазмаферез. После — получали Акарбозу | До 6 нед | HbA1c — 12,33±2,87%; С-пептид — 0,71±0,63 нг/мл, С-пептид стим. — 1,55±1,26 нг/мл | 8 | 0 | 100% | 15 мес | 6 мес | 24 дня (6–60) | HbA1c через 6 мес. — 6,23±0,74%; С-пептид через 6 мес. — 1,35±0,53 нг/мл, С-пептид стим. через 6 мес. — 2,55±0,54 нг/мл | 0 | Snarski E, 2011 [56] |
3 | 26,5 года До — получали плазмаферез | До 6 нед | HbA1c — до 10,9%; С-пептид — 0,6 нг/мл, С-пептид стим. — 1,4 нг/мл | 23 | 0 | 87% | 80 мес | 31 мес | До 9 мес | HbA1c — 5,9% через 1 год; 7,1% через 4 года; С-пептид — 1,2 нг/мл, 0,98 нг/мл через 1 и 4 года; С-пептид стим. — 2,8 нг/мл, 2,3 нг/мл через 1 и 4 года | 2 случая сепсиса (1 с летальным исходом) | E Snarski, 2016 [57] |
4 | 18,4 года 2 получали ГКС | До 6 нед | HbA1c — 8,4±1,5%; AUC С-пептида стим. 225,0±75,2 нг/мл | 23 | 2 | 87% | 100 мес | 43 мес | 2 дня | HbA1c — 5,5%; AUC С-пептида стим. 728,1±144,4 нг/мл через 36 мес. | Двусторонняя внутрибольничная пневмония — 2 | Carlos EB Couri, |
5 | 17,5 года | До 6 мес | HbA1c — 9,8%; С-пептид — 0,42 нг/мл | 9 | 0 | 66% | 12 мес | 12 мес | - | HbA1c <7,0%; с-пептид 0,61 нг/мл через 12 мес | 4 случая бакт. инфекция, 1 — кандидоз вульвовагинальный | Zhang X, |
6 | 17,6 года | До 26 нед | HbA1c — 10,1±3,1%; С-пептид стим. 2,1±0,9 нг/мл | 28 | 11 | 53,6% | 42 мес | 24 мес | Снижение дозы в течение 1 мес | 0 | Weiqiong Gu, | |
7 | 18,3 года | До 26 мес | HbA1c — 10,6±2,5%, C-пептид стим. 2,07±0,85 нг/мл | 20 | 6 | 70% | 48 мес | 20 мес | - | HbA1c — 6,1±0,7%, C-пептид стим. 4,36±2,25 нг/мл через 3 мес | 0 | B Gu, |
8 | 13,7 года | До 12 мес | HbA1c — 9,1±3,6%, С-пептид стим. 494±338 пмоль/л | 13 | 10 | 23% | 48 мес | 30 мес | Снижение дозы в течение 3 мес | 0 | Lirong Li, 2012 [51] | |
9 | 19,3 года (12—35) | До 6 нед | HbA1c — 7,9±1,4%, С-пептид стим. 0,441±0,346 нг/мл | 14 | 0 | 71% | 48 мес | 48 мес | - | HbA1c — 6,3±1,6%, С-пептид стим. 2,43±1,5 нг/мл | Двусторонняя внутрибольничная пневмония — 2 | De Oliveira, 2012 [62] |
10 | 19,3 года | До 6 нед | HbA1c — 7,2±2,6%, C-петид стим. 3,46±1,44 нг/мл | 128 | 0 | 55% | 32 мес | 14 мес | - | ДКА — 1; Неуточненное поражение почек — 1 | Hang Xiang, | |
11 | 21 год ДКА с комой | До 1 нед | HbA1c >12,0% | 1 | 1 | 100% | 70 мес | 70 мес | 1 мес | HbA1c <6,0% через 60 мес | 0 | S Shen, |
12 | 28 лет До — получал плазмаферез | До 4 нед | HbA1c —13,8%; С-пептид стим. — 0,6 нг/мл | 1 | 0 | 100% | 5 мес | 5 мес | 1 мес | HbA1c — 5,2%; С-пептид стим. — 4,14 нг/мл через 3 мес. | 0 | E Snarski, 2009 [64] |
СД — сахарный диабет; ДКА — диабетический кетоацидоз; ГКС — глюкокортикостероиды ; HbA1c — гликированный гемоглобин; AUC — площадь под кривой (area under curve); ТГКС — трансплантация гемопоэтических стволовых клеток
ЗАКЛЮЧЕНИЕ
В настоящее время активно изучаются принципиально новые подходы к профилактике и лечению СД1. Методика ВИСТ-АТГСК является одним из методов лечения, приводящих к временной, иногда очень длительной, ремиссии СД1. По эффективности предупреждения сосудистых осложнений у лиц с СД1 ВИСТ-АТГСК сравнима со строгим контролем гликемии, достигнутым многократными инъекциями или непрерывной подкожной инфузией инсулина, которые также имеют определенные риски и являются серьезным бременем для пациентов.
В настоящее время актуальным является определение критериев отбора пациентов для более высокой эффективности терапии и предупреждения возможных осложнений. ВИСТ-АТГСК может стать многообещающей терапевтической стратегией, позволяющей в комбинации с другими видами лечения сделать важный шаг к персонализированной терапии СД1.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансовых средств.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Черная М.Е. — концепция и дизайн обзора, написание и редактирование текста; Халимов Ю.Ш. — концепция и дизайн обзора, написание и редактирование текста; Нерсесян А.А. — сбор и обработка литературного материала, написание текста; Орловская А.Д. — обработка литературного материала, написание текста; Лискер А.В. — концепция и дизайн обзора; Полушин А.Ю. — концепция и дизайн обзора, редактирование текста; Залялов Ю.Р. — концепция и дизайн обзора; Волкова А.Р. — концепция и дизайн обзора, редактирование текста; Кулагин А.Д. — концепция и дизайн обзора.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Magliano DJ, Boyko EJ; IDF Diabetes Atlas 10th edition scientific committee. IDF DIABETES ATLAS [Internet]. 10th edition. Brussels: International Diabetes Federation; 2021 [cited 2023 May 5]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK581934/
2. Tuomilehto J, Ogle GD, Lund-Blix NA, Stene LC. Update on Worldwide Trends in Occurrence of Childhood Type 1 Diabetes in 2020. Pediatr Endocrinol Rev. 2020;17(Suppl 1):198-209. doi: https://doi.org/10.17458/per.vol17.2020.tol.epidemiologychildtype1diabetes
3. Pang H, Luo S, Xiao Y, et al. Emerging Roles of Exosomes in T1DM. Front Immunol. 2020;11:593348. doi: https://doi.org/10.3389/fimmu.2020.593348
4. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С.104-123. doi: https://doi.org/10.14341/DM13035
5. Kulzer B. Körperliche und psychische Folgeerkrankungen bei Diabetes mellitus [Physical and psychological long-term consequences of diabetes mellitus]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2022;65(4):503-510. doi: https://doi.org/10.1007/s00103-022-03517-y
6. Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet. 2014;383(9911):69-82. doi: https://doi.org/10.1016/S0140-6736(13)60591-7
7. Willcox A, Gillespie KM. Histology of Type 1 Diabetes Pancreas. Methods Mol Biol. 2016; 1433:105-117. doi: https://doi.org/10.1007/7651_2015_287
8. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Клинические рекомендации «Алгоритмы специализированной медицинской помощи больным сахарным диабетом» (10-й выпуск). Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова // Cахарный диабет. — 2021. — №1S — C. 1-221. doi: https://doi.org/10.14341/DM1280
9. Wu FL, Wu EC, Chang YC, et al. Factors Affecting the Ability of People With Diabetes to Avoid Hypoglycemia. J Nurs Res. 2018;26(1):44-51. doi: https://doi.org/10.1097/JNR.0000000000000198
10. Lombardo C, Perrone VG, Amorese G, et al. Update on pancreatic transplantation on the management of diabetes. Minerva Med. 2017;108(5):405-418. doi: https://doi.org/10.23736/S0026-4806.17.05224-7
11. Chiang JL, Kirkman MS, Laffel LM, Peters AL. Type 1 Diabetes Sourcebook Authors. Type 1 diabetes through the life span: a position statement of the American Diabetes Association. Diabetes Care. 2014;37(7):2034-2054. doi: https://doi.org/10.2337/dc14-1140
12. fda.gov [Internet]. Lantidra [updated 2023 July 08; cited 2023 July 08]. Available from: https://www.fda.gov/vaccines-blood-biologics/lantidra
13. Yeh CC, Wang LJ, Mcgarrigle JJ, et al. Effect of Manufacturing Procedures on Human Islet Isolation from Donor Pancreata Standardized by the North American Islet Donor Score. Cell Transplantation. 2017;26(1):33-44. doi: https://doi.org/10.3727/096368916X692834
14. Couri CEB, Malmegrim KCR, Oliveira MC. New Horizons in the Treatment of Type 1 Diabetes: More Intense Immunosuppression and Beta Cell Replacement. Front Immunol. 2018;9:1086. doi: https://doi.org/10.3389/fimmu.2018.01086
15. Perdigoto AL, Preston-Hurlburt P, Clark P, et al. Treatment of type 1 diabetes with teplizumab: clinical and immunological follow-up after 7 years from diagnosis. Diabetologia. 2019;62(4):655-664. doi: https://doi.org/10.1007/s00125-018-4786-9
16. Guglielmi C, Williams SR, Del Toro R, Pozzilli P. Efficacy and safety of otelixizumab use in new-onset type 1 diabetes mellitus. Expert Opin Biol Ther. 2016;16(6):841-846. doi: https://doi.org/10.1080/14712598.2016.1180363
17. Rigby MR, Harris KM, Pinckney A, et al. Alefacept provides sustained clinical and immunological effects in new-onset type 1 diabetes patients. J Clin Invest. 2015;125(8):3285-3296. doi: https://doi.org/10.1172/JCI81722
18. Orban T, Bundy B, Becker DJ, et al. Costimulation modulation with abatacept in patients with recent-onset type 1 diabetes: follow-up 1 year after cessation of treatment. Diabetes Care. 2014;37(4):1069-1075. doi: https://doi.org/10.2337/dc13-0604
19. Pescovitz MD, Greenbaum CJ, Bundy B, et al. B-lymphocyte depletion with rituximab and β-cell function: two-year results. Diabetes Care. 2014;37(2):453-459. doi: https://doi.org/10.2337/dc13-0626
20. fda.gov [Internet]. FDA Approves First Drug That Can Delay Onset of Type 1 Diabetes [updated 2022 November 17; cited 2022 November 18]. Available from: https://www.fda.gov/news-events/pressannouncements/fda-approves-first-drug-can-delay-onset-type-1-diabetes
21. Herold KC, Bundy BN, Long SA, et al. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes [published correction appears in N Engl J Med. 2020 Feb 6;382(6):586]. N Engl J Med. 2019;381(7):603-613. doi: https://doi.org/10.1056/NEJMoa1902226
22. Sims EK, Bundy BN, Stier K, et al. Teplizumab improves and stabilizes beta cell function in antibody-positive highrisk individuals. Sci Transl Med. 2021;13(583):eabc8980. doi: https://doi.org/10.1126/scitranslmed.abc8980
23. Тucker ME. With Type 1 Diabetes Delay Possible, Focus Now on Screening [Internet]. Medscape [updated 2022 November 30; cited 2022 December 1] Available from: https://www.medscape.com/viewarticle/984748
24. Zhao Y, Jiang Z, Zhao T, et al. Reversal of type 1 diabetes via islet β cell regeneration following immune modulation by cord blood-derived multipotent stem cells. BMC Med. 2012;10:3. doi: https://doi.org/10.1186/1741–7015-10-3
25. Loretelli C, Assi E, Seelam AJ, et al. Cell therapy for type 1 diabetes. Expert Opin Biol Ther. 2020;20(8):887-897. doi: https://doi.org/10.1080/14712598.2020.1748596
26. Izadi M, Sadr Hashemi Nejad A, Moazenchi M, et al. Mesenchymal stem cell transplantation in newly diagnosed type-1 diabetes patients: a phase I/II randomized placebocontrolled clinical trial. Stem Cell Res Ther. 2022;13(1):264. doi: https://doi.org/10.1186/s13287-022-02941-w
27. Loretelli C, Assi E, Seelam AJ, et al. Cell therapy for type 1 diabetes. Expert Opin Biol Ther. 2020;20(8):887-897. doi: https://doi.org/10.1080/14712598.2020.1748596
28. Carlsson PO, Schwarcz E, Korsgren O, Le Blanc K. Preserved β-cell function in type 1 diabetes by mesenchymal stromal cells. Diabetes. 2015;64(2):587-92. doi: https://doi.org/10.2337/db14-0656
29. Carroll KR, Katz JD. Restoring tolerance to β-cells in Type 1 diabetes: Current and emerging strategies. Cell Immunol. 2022;380:104593. doi: https://doi.org/10.1016/j.cellimm.2022.104593
30. Alexander T, Greco R. Hematopoietic stem cell transplantation and cellular therapies for autoimmune diseases: overview and future considerations from the Autoimmune Diseases Working Party (ADWP) of the European Society for Blood and Marrow Transplantation (EBMT). Bone Marrow Transplant. 2022;57(7):1055-1062. doi: https://doi.org/10.1038/s41409-022-01702-w
31. Fiorina P, Voltarelli J, Zavazava N. Immunological applications of stem cells in type 1 diabetes. Endocr Rev. 2011;32(6):725-754. doi: https://doi.org/10.1210/er.2011-0008
32. Van Megen KM, van ‘t Wout ET, Forman SJ, Roep BO. A Future for Autologous Hematopoietic Stem Cell Transplantation in Type 1 Diabetes. Front Immunol. 2018;9:690. doi: https://doi.org/10.3389/fimmu.2018.00690
33. Effect of intensive therapy on residual beta-cell function in patients with type 1 diabetes in the diabetes control and complications trial. A randomized, controlled trial. The Diabetes Control and Complications Trial Research Group. Ann Intern Med. 1998;128(7):517-523. doi: https://doi.org/10.7326/0003-4819-128-7-199804010-00001
34. Snarski E, Szmurło D, Hałaburda K, et al. An economic analysis of autologous hematopoietic stem cell transplantation (AHSCT) in the treatment of new onset type 1 diabetes. Acta Diabetol. 2015;52(5):881-888. doi: https://doi.org/10.1007/s00592-015-0724-1
35. Полушин А.Ю., Залялов Ю.Р., Тотолян Н.А., и др. Высокодозная иммуносупрессивная терапия с аутологичной трансплантацией гемопоэтических стволовых клеток при рассеянном склерозе: современный взгляд на метод (обзор литературы). // Ученые записки СПбГМУ им. акад. И.П. Павлова. — 2021. — Т.28. — №4 — С. 9–21. doi: https://doi.org/10.24884/1607-4181-2021-28-4-9-21
36. Kitagawa Y, Sakaguchi S. Molecular control of regulatory T cell development and function. Curr Opin Immunol. 2017;49:64-70. doi: https://doi.org/10.1016/j.coi.2017.10.002
37. Weinhaus AJ, Bhagroo NV, Brelje TC, Sorenson RL. Dexamethasone counteracts the effect of prolactin on islet function: implications for islet regulation in late pregnancy. Endocrinology. 2000;141(4):1384-1393. doi: https://doi.org/10.1210/endo.141.4.7409
38. Нуралиева Н.Ф., Юкина М.Ю., Трошина Е.А. Основы иммунопатогенеза аутоиммунных тиреопатий и сахарного диабета 1 типа // Доктор.Ру. — 2019. — Т. 159. — №4 — С. 49–53. doi: https://doi.org/10.31550/1727-2378-2019-159-4-49-53
39. Ilonen J, Lempainen J, Veijola R. The heterogeneous pathogenesis of type 1 diabetes mellitus. Nat Rev Endocrinol. 2019;15(11):635-650. doi: https://doi.org/10.1038/s41574-019-0254-y
40. Malmegrim KCR, Lima-Júnior JR, Arruda LCM, et al. Autologous Hematopoietic Stem Cell Transplantation for Autoimmune Diseases: From Mechanistic Insights to Biomarkers. Front Immunol. 2018;9:2602. doi: https://doi.org/10.3389/fimmu.2018.02602
41. Karnell FG, Lin D, Motley S, et al. Reconstitution of immune cell populations in multiple sclerosis patients after autologous stem cell transplantation. Clin Exp Immunol. 2017;189(3):268-278. doi: https://doi.org/10.1111/cei.12985
42. Massey JC, Sutton IJ, Ma DDF, Moore JJ. Regenerating Immunotolerance in Multiple Sclerosis with Autologous Hematopoietic Stem Cell Transplant. Front Immunol. 2018;9:410. doi: https://doi.org/10.3389/fimmu.2018.00410
43. Полушин А.Ю., Залялов Ю.Р., Тотолян Н.А., и др. Высокодозная иммуносупрессивная терапия с аутологичной трансплантацией гемопоэтических стволовых клеток при рассеянном склерозе: перспективы снижения рисков // Анналы клинической и экспериментальной неврологии. — 2022. — T. 16. — № 3. — С. 53–64. doi: https://doi.org/10.54101/ACEN.2022.3.7
44. Sharrack B, Saccardi R, Alexander T, et al. Autologous haematopoietic stem cell transplantation and other cellular therapy in multiple sclerosis and immune-mediated neurological diseases: updated guidelines and recommendations from the EBMT Autoimmune Diseases Working Party (ADWP) and the Joint Accreditation Committee of EBMT and ISCT (JACIE). Bone Marrow Transplant. 2020;55(2):283-306. doi: https://doi.org/10.1038/s41409-019-0684-0
45. Давыдова И.Ю., Валиев Р.К., Карселадзе А.И., и др. Практические рекомендации по лечению пограничных опухолей яичников // Злокачественные опухоли: Практические рекомендации RUSSCO. — 2022. – T.12. — №3s2. — C.229–239. doi: https://doi.org/10.18027/2224-5057-2022-12-3s2-229-239
46. Burt RK, Loh Y, Pearce W, et al. Clinical applications of blood-derived and marrow-derived stem cells for nonmalignant diseases. JAMA. 2008;299(8):925-936. doi: https://doi.org/10.1001/jama.299.8.925
47. Сизикова С.А., Лисуков И.А., Кулагин А.Д., и др. Высокодозная иммуносупрессивная терапия с аутологичной трансплантацией стволовых кроветворных клеток при аутоиммунных заболеваниях // Терапевтический архив. — 2002. — Т. 74. — №7. — С. 22-26.
48. Шевченко Ю.Л., Новик А.А., Кузнецов А.Н., и др. Аутологичная трансплантация кроветворных стволовых клеток при рассеянном склерозе: результаты исследования российской кооперативной группы клеточной терапии // Неврологический журнал. — 2008. — Т. 13. — №2. — С. 11-18.
49. Voltarelli JC, Couri CE, Stracieri AB, et al. Autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus. JAMA. 2007;297(14):1568-1576. doi: https://doi.org/10.1001/jama.297.14.1568
50. Couri CE, Oliveira MC, Stracieri AB, et al. C-peptide levels and insulin independence following autologous nonmyeloablative hematopoietic stem cell transplantation in newly diagnosed type 1 diabetes mellitus. JAMA. 2009;301(15):1573-1579. doi: https://doi.org/10.1001/jama.2009.470
51. Li L, Shen S, Ouyang J, et al. Autologous hematopoietic stem cell transplantation modulates immunocompetent cells and improves β-cell function in Chinese patients with new onset of type 1 diabetes. J Clin Endocrinol Metab. 2012;97(5):1729-1736. doi: https://doi.org/10.1210/jc.2011-2188
52. Xiang H, Chen H, Li F, et al. Predictive factors for prolonged remission after autologous hematopoietic stem cell transplantation in young patients with type 1 diabetes mellitus. Cytotherapy. 2015;17(11):1638-1645. doi: https://doi.org/10.1016/j.jcyt.2015.07.006
53. Cantú-Rodríguez OG, Lavalle-González F, Herrera-Rojas MÁ, et al. Long-Term Insulin Independence in Type 1 Diabetes Mellitus Using a Simplified Autologous Stem Cell Transplant. J Clin Endocrinol Metab. 2016;101(5):2141-2148. doi: https://doi.org/10.1210/jc.2015-2776
54. Ye L, Li L, Wan B, et al. Immune response after autologous hematopoietic stem cell transplantation in type 1 diabetes mellitus. Stem Cell Res Ther. 2017;8(1):90. doi: https://doi.org/10.1186/s13287-017-0542-1
55. Zhang J, Hu M, Wang B, et al. Comprehensive assessment of T-cell repertoire following autologous hematopoietic stem cell transplantation for treatment of type 1 diabetes using highthroughput sequencing. Pediatr Diabetes. 2018;19(7):1229-1237. doi: https://doi.org/10.1111/pedi.12728
56. Snarski E, Milczarczyk A, Torosian T, et al. Independence of exogenous insulin following immunoablation and stem cell reconstitution in newly diagnosed diabetes type I. Bone Marrow Transplant. 2011;46(4):562-566. doi: https://doi.org/10.1038/bmt.2010.147
57. Snarski E, Milczarczyk A, Hałaburda K, et al. Immunoablation and autologous hematopoietic stem cell transplantation in the treatment of new-onset type 1 diabetes mellitus: longterm observations. Bone Marrow Transplant. 2016;51(3):398-402. doi: https://doi.org/10.1038/bmt.2015.294
58. Malmegrim KC, de Azevedo JT, Arruda LC, et al. Immunological Balance Is Associated with Clinical Outcome after Autologous Hematopoietic Stem Cell Transplantation in Type 1 Diabetes. Front Immunol. 2017; 8:167. doi: https://doi.org/10.3389/fimmu.2017.00167
59. Zhang X, Ye L, Hu J, et al. Acute response of peripheral blood cell to autologous hematopoietic stem cell transplantation in type 1 diabetic patient. PLoS One. 2012;7(2): e31887. doi: https://doi.org/10.1371/journal.pone.0031887
60. Gu W, Hu J, Wang W, et al. Diabetic ketoacidosis at diagnosis influences complete remission after treatment with hematopoietic stem cell transplantation in adolescents with type 1 diabetes. Diabetes Care. 2012;35(7):1413-1419. doi: https://doi.org/10.2337/dc11-2161
61. Gu B, Miao H, Zhang J, et al. Clinical benefits of autologous haematopoietic stem cell transplantation in type 1 diabetes patients. Diabetes Metab. 2018;44(4):341-345. doi: https://doi.org/10.1016/j.diabet.2017.12.006
62. de Oliveira GL, Malmegrim KC, Ferreira AF, et al. Up-regulation of fas and fasL pro-apoptotic genes expression in type 1 diabetes patients after autologous haematopoietic stem cell transplantation. Clin Exp Immunol. 2012;168(3):291-302. doi: https://doi.org/10.1111/j.1365-2249.2012.04583.x
63. Shen S, Li L, Ouyang J, et al. Remission induced by autologous hematopoietic stem cell transplantation in one newly diagnosed type 1 diabetes patient with diabetic ketoacidosis: a case report. J Diabetes. 2012;4(4):359-361. doi: https://doi.org/10.1111/j.1753-0407.2012.00214.x
64. Snarski E, Torosian T, Paluszewska M, et al. Alleviation of exogenous insulin requirement in type 1 diabetes mellitus after immunoablation and transplantation of autologous hematopoietic stem cells. Pol Arch Med Wewn. 2009;119(6):422-426
Об авторах
М. Е. ЧернаяРоссия
Черная Мария Евгеньевна, ассистент
197022, Санкт-Петербург, ул. Льва Толстого, д. 6–8
Ю. Ш. Халимов
Россия
Халимов Юрий Шавкатович, д.м.н., профессор
Scopus Author ID: 55531165300
Санкт-Петербург
А. Р. Волкова
Россия
Волкова Анна Ральфовна, д.м.н., профессор
Scopus Author ID: 57200116986
Санкт-Петербург
А. В. Лискер
Россия
Лискер Анна Владимировна
Санкт-Петербург
А. А. Нерсесян
Россия
Нерсесян Артем Артурович, студент
Санкт-Петербург
А. Д. Орловская
Россия
Орловская Анастасия Дмитриевна, клинический ординатор
Санкт-Петербург
А. Ю. Полушин
Россия
Полушин Алексей Юрьевич, к.м.н., доцент
Scopus Author ID: 57195962540
Санкт-Петербург
Ю. Р. Залялов
Россия
Залялов Юрий Ринатович, к.м.н.
Scopus Author ID: 36497755400
Санкт-Петербург
А. Д. Кулагин
Россия
Кулагин Александр Дмитриевич, д.м.н., доцент
ResearcherID: L-9795-2014;
Scopus Author ID: 7003340367
Санкт-Петербург
Дополнительные файлы
|
|
1. Рисунок 1. Развитие метода трансплантации гемопоэтических стволовых клеток при аутоиммунных заболеваниях. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(248KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Черная М.Е., Халимов Ю.Ш., Волкова А.Р., Лискер А.В., Нерсесян А.А., Орловская А.Д., Полушин А.Ю., Залялов Ю.Р., Кулагин А.Д. Аутологичная трансплантация гемопоэтических стволовых клеток как метод иммунной профилактики сахарного диабета 1 типа: возможности и перспективы. Сахарный диабет. 2024;27(3):277-286. https://doi.org/10.14341/DM13089
For citation:
Chernaya M.E., Khalimov Y.Sh., Volkova A.R., Lisker A.V., Nersesyan A.A., Orlovskaya A.D., Polushin A.Y., Zalyalov Y.R., Kulagin A.D. Autologous hematopoietic stem cell transplantation as a method of immune prevention of type 1 diabetes mellitus: possibilities and prospects. Diabetes mellitus. 2024;27(3):277-286. (In Russ.) https://doi.org/10.14341/DM13089

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































