Перейти к:
Характеристика пациентов с муковисцидоззависимым сахарным диабетом в детском возрасте по данным регистра пациентов с муковисцидозом Российской Федерации 2021 года
https://doi.org/10.14341/DM13064
Аннотация
ОБОСНОВАНИЕ. В последние десятилетия продолжительность жизни пациентов с муковисцидозом (МВ) увеличилась, что приводит к увеличению частоты состояний, связанных с нарушением углеводного обмена.
ЦЕЛЬ. Провести анализ влияния муковисцидоззависимого сахарного диабета (МЗСД) у детей и подростков на течение МВ по данным регистра пациентов с МВ Российской Федерации (РФ) 2021 г.
МАТЕРИАЛЫ И МЕТОДЫ. Проанализированы данные регистра пациентов с МВ РФ за 2021 г. В регистр были включены 122 пациента с МЗСД и потребностью в применении инсулина — 33 ребенка (27%) и 89 взрослых (73%), средний возраст детей составил 13,5±4,1 года, средний возраст взрослых пациентов от 18 лет — 27,4±6,6 года. Для сравнения течения МВ у детей и подростков с сахарным диабетом (СД) и без него были сформированы группы, сопоставимые по возрасту, полу, генотипу, — в группу пациентов без диабета вошли 827 пациентов, 33 пациента составили группу больных с МЗСД с применением инсулина. Сравнивались диагностические критерии МВ, показатели функции внешнего дыхания, микробиологический статус, характер осложнений, объем проводимой терапии.
РЕЗУЛЬТАТЫ. Частота МЗСД с потребностью в инсулинотерапии составляет 4,2% случаев в РФ в 2021 г. с преобладанием у взрослых по сравнению с детьми (10,5% vs 1,3%). Пациенты с МЗСД имеют более низкий показатель объема форсированного выдоха за первую секунду (ОФВ1) по сравнению с лицами без СД — M±SD ОФВ1 (%) 85,2±27,5 в группе пациентов без СД и M±SD ОФВ1 (%) 72,4±26,0 у пациентов с СД (p<0,016). Сравнение в группах микробиологического высева показало тенденцию к более частому хроническому росту синегнойной палочки (Р. aeruginosa) — 54,50% против 39,4% в группе без МЗСД. Также чаще выявлялся рост метициллинрезистентного стафилококка — 9,1% по сравнению с группой детей без СД — 3,1%. Чаще используется антибактериальная терапия — ингаляционная у 54,6% пациентов без СД против 75,8% случаев (р=0,017) среди детей с МЗСД. Значимо отличалась частота применяемой таблетированной антибактериальной терапии (р=0,013). Число пациентов на кислородотерапии в группе с МЗСД составило 12,1%, без МЗСД — 3,4% (р=0,01), что подтверждает более тяжелое течение МВ у пациентов с МЗСД.
ЗАКЛЮЧЕНИЕ. Распространенность МЗСД с потребностью в инсулинотерапии среди детей РФ составляет 1,3%. МЗСД значимо ухудшает течение МВ в отношении функции легких, роста грамотрицательной и резистентной флоры, частоты тяжелых осложнений и применения антибактериальной терапии, что, очевидно, связано с частыми обострениями бронхолегочного процесса при МВ у пациентов с развившимся МЗСД.
Ключевые слова
Для цитирования:
Кондратьева Е.И., Тлиф А.И., Воронкова А.Ю., Амелина Е.Л., Каширская Н.Ю., Красовский С.А., Старинова М.А., Кураева Т.Л. Характеристика пациентов с муковисцидоззависимым сахарным диабетом в детском возрасте по данным регистра пациентов с муковисцидозом Российской Федерации 2021 года. Сахарный диабет. 2023;26(5):418-426. https://doi.org/10.14341/DM13064
For citation:
Kondratyeva E.I., Tlif A.I., Voronkova A.Yu., Amelina E.L., Kashirskaya N.Yu., Krasovsky S.A., Starinova M.A., Kuraeva T.L. Characteristics of patients with cystic fibrosis-dependent diabetes mellitus in childhood according to the register of patients with cystic fibrosis of the Russian Federation in 2021. Diabetes mellitus. 2023;26(5):418-426. (In Russ.) https://doi.org/10.14341/DM13064
ОБОСНОВАНИЕ
Муковисцидоз (МВ) — наследственное мультисистемное заболевание, частота которого в мире составляет 1:2500 новорожденных. В последние десятилетия продолжительность жизни пациентов с МВ увеличилась, что связано с современными подходами к лечению пациентов [1][2], это приводит к увеличению частоты новых состояний, связанных с МВ, таких как нарушение толерантности к глюкозе и муковисцидоз-ассоциированный сахарный диабет (МЗСД) [3–7].
МЗСД имеет общие черты с сахарным диабетом 1 типа (СД1) и 2 типа (СД2), но не похож ни на один из основных типов диабета, что требует уникального подхода к его диагностике и лечению. Нарушения углеводного обмена стартуют с периодически возникающей постпрандиальной гипергликемии, затем происходит нарушение толерантности к глюкозе, прогрессирующее до проявления диабета. Согласно международным исследованиям, продолжительность жизни пациентов с МЗСД в два раза короче, чем без данного осложнения (данные Североамериканского регистра 2021) [8]. Нарушение синтеза, структуры и функции белка трансмембранного регулятора проводимости МВ (CFTR) приводит к дисфункции хлорных каналов, что вызывает дегидратацию апикальной поверхности секреторного эпителия и увеличение вязкости слизи. Образование густого вязкого секрета вызывает обструктивное повреждение экзокринной части поджелудочной железы с прогрессирующим фиброзом и жировой инфильтрацией, что приводит к деструкции эндокринных β-, α- и полипептидных клеток [7][9].
В то же время корреляция между степенью деструкции β-клеток и развитием диабета слабая, патологоанатомическое исследование не показало большей потери островков поджелудочной железы у пациентов с МЗСД в сравнении с пациентами, имеющими нормальную толерантность к глюкозе [9]. Первые сообщения о диабете при МВ относятся к 1955 г. [10]. Международные рекомендации по МВ рекомендуют с 10 лет начинать скрининг на МЗСД, используя пероральный тест на толерантность к глюкозе [11].
Недавние исследования показали, что ранние нарушения уровня глюкозы могут быть связаны с ухудшением клинического статуса у детей с МВ [12]. Прогрессирование МВ может фактически начаться за несколько лет до того, как пациент будет соответствовать диагностическим критериям МЗСД [13]. Распространенность МЗСД отличается, по разным данным, в зависимости от возраста начала мониторинга, критериев диагностики нарушений углеводного обмена и может быть недооценена в центрах, которые не проводят универсальный скрининг всех пациентов.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Провести анализ распространенности СД у больных МВ и анализ влияния МЗСД у детей и подростков на течение МВ по данным регистра пациентов с МВ Российской Федерации (РФ) 2021 г.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Проанализированы данные регистра пациентов с МВ Российской Федерации за 2021 г. из 82 регионов РФ [14]. Формат регистра соответствует Европейскому регистру [15].
Изучаемые популяции
Всего в регистр 2021 г. были внесены данные о течении МВ у 3969 больных, наблюдающихся в текущем году в РФ. Из них 3563 живы и 46 умерли, данные о динамическом контроле 360 пациентов не были представлены в текущем году. Больные включались в регистр с установленным диагнозом МВ при наличии клинических проявлений и положительной потовой пробы и/или генетического исследования.
В регистр вносились данные о наличии у пациента МЗСД с вариантами терапии — без применения инсулина, с применением инсулина, с применением таблетированных гипогликемизирующих препаратов, а также с неизвестной терапией.
Критерии исключения — в основную группу не включались больные, не удовлетворяющие критериям диагностики СД.
Способ формирования выборки
Детерминированная квотируемая выборка.
Дизайн исследования
- Одновыборочное неконтролируемое сравнительное исследование в группе пациентов с МВ и СД для анализа распространенности СД среди пациентов с МВ в РФ.
- Неконтролируемое сравнительное исследование с двумя выборками пациентов с МВ — с СД и без него для анализа влияния МЗСД у детей и подростков на течение МВ.
Методы
Диагноз СД устанавливался на основании общепринятых критериев: при наличии симптомов СД (полиурия, полидипсия) и повышения уровня глюкозы в плазме крови в случайно взятой пробе ≥11,1 ммоль/л (случайной считается проба, взятая в любое время суток независимо от приема пищи), а также при концентрации глюкозы в плазме крови натощак ≥7,0 ммоль/л. В сомнительных случаях проводился пероральный глюкозотолерантный тест. Тест проводился утром на фоне не менее чем 3-дневного неограниченного питания (более 150 г углеводов в сутки) и обычной физической активности. Тесту должно предшествовать ночное голодание в течение 8–14 ч (можно пить воду). Последний вечерний прием пищи содержал 30–50 г углеводов. После забора крови натощак испытуемый должен не более чем за 5 мин выпить 75 г безводной глюкозы или 82,5 г моногидрата глюкозы, растворенных в 250–300 мл воды. Для детей нагрузка составляет 1,75 г безводной глюкозы (или 1,925 г моногидрата глюкозы) на 1 кг массы тела, но не более 75 г (82,5 г). В процессе теста не разрешается курение. Через 2 ч осуществляется повторный забор крови. Для предотвращения гликолиза и ошибочных результатов концентрация глюкозы определяется сразу после взятия крови, или кровь должна быть центрифугирована сразу после взятия, или храниться при температуре 0–4°С, или взята в пробирку с консервантом (флуорид натрия) [16].
Анализировались диагностические критерии (потовый тест, ДНК-диагностика), критерии тяжести течения МВ: показатели функции внешнего дыхания, микробиологический статус, частота осложнений, объем проводимой терапии.
Потовый тест проводился всем пациентам для диагностики МВ. Положительным потовым тестом считались показатели: для метода титрования 60 и более ммоль/л, для проводимости — 80 и более ммоль/л, пограничные значения: 30–59 и 50–79 ммоль/л для титрования и проводимости соответственно.
Спирометрия проводилась всем пациентам в возрасте 6 лет и старше, оценивались в процентах от должного показатели функции внешнего дыхания по данным форсированной жизненной емкости легких (ФЖЕЛ) и объема форсированного выдоха за первую секунду (ОФВ1). Исследование проводили в соответствии с критериями Европейского респираторного общества и Американского торакального общества (ERS/ATS) [17].
ДНК-диагностику проводили согласно алгоритму консенсуса «Муковисцидоз: определение, диагностические критерии, терапия», раздел «Генетика муковисцидоза. Молекулярно-генетическая диагностика при муковисцидозе» [18]. На первом этапе исследования мутаций гена CFTR использовалась методика мультиплексной амплификации для выявления инсерционно/делеционных мутаций, для регистрации точковых нуклеотидных замен — метод аллель-специфичного лигирования с последующей амплификацией. На втором этапе ряду больных проведено определение нуклеотидной последовательности методом прямого автоматического секвенирования по Сэнгеру на приборе фирмы Applied Biosystems согласно протоколу фирмы-производителя. На третьем этапе проводился анализ протяженных перестроек гена CFTR методом количественной MLPA (мультиплексной лигазо-зависимой амплификации проб).
«Тяжелый» генотип определялся наличием в нем двух патогенных вариантов I–III классов, при «мягком» в генотипе имелась хотя бы одна мутация гена CFTR IV–VI классов.
Микробиологические исследования проводили всем пациентам в соответствии с Руководством по микробиологической диагностике инфекций дыхательных путей у пациентов с МВ [19], а также методическими рекомендациями «Методы бактериологического исследования условно-патогенных микроорганизмов в клинической микробиологии» (утверждены Министерством здравоохранения РСФСР 19 декабря 1991 г.) [20].
Диагностические критерии аллергического бронхолегочного аспергиллеза, по которым диагноз вносился в регистр, соответствовали критериям Консенсуса фонда кистозного фиброза 2003 г. [21].
Диагностические критерии остеопороза, по которым диагноз вносился в регистр, соответствовали снижению минеральной плотности костной ткани Z-score ниже 2 сигмальных отклонений и наличию низкоэнергетического перелома в анамнезе.
Статистический анализ
Статистическая обработка данных проводилась с помощью пакета прикладных программ IBM SPSS Statistics 26. В зависимости от вида распределения мерами центральной тенденции и рассеяния служили среднее значение (М)±стандартное отклонение (SD) или медиана и межквартильный размах (Me [ Q1; Q3]). Статистическая обработка проводилась с использованием критерия Манна–Уитни, критерия Хи-квадрат, точного критерия Фишера. Различия считались статистически значимыми при p<0,05.
Этическая экспертиза
Проект Регистр больных МВ Российской Федерации и информированное согласие одобрены Комитетом по этике ФГБНУ МГНЦ 20 декабря 2012 г. Пациенты с МВ и/или их представители подписывали информированное согласие. Новая форма информированного согласия была одобрена этическим комитетом ФГБНУ МГНЦ 21.02.2021 г., протокол № 1/2, после перехода на использование программы сбора информации и защиты персональных данных, разработанной АО «Астон Консалтинг».
АО «Астон «Консалтинг» является сертифицированным оператором персональных данных (номер записи 77-14-002874 в реестре «Роскомнадзора»), имеет аттестат соответствия обеспечения информационной безопасности объекта информатизации подсистемы «Универсальный программный комплекс для сбора, обработки и управления территориально распределенными и клинико-эпидемиологическими данными в режиме удаленного доступа Quinta®» требованиям безопасности №11/20-021АТТ. Шифрование данных проводится в соответствии с ГОСТ Р 34.10-2021 256 бит, установлен TLS-шлюз.
РЕЗУЛЬТАТЫ
По данным регистра больных МВ Российской Федерации 2021 г., частота МЗСД с инсулинотерапией составляет 4,2% случаев: 1,3% среди детей и подростков и 10,5% среди взрослых.
В анализ распространенности МЗСД были включены 122 пациента с СД, требующим применения инсулина, — 33 ребенка (27%) и 89 взрослых (73%), средний возраст детей составил 13,5±4,1, средний возраст взрослых пациентов от 18 лет и старше — 27,4±6,6 года.
При анализе показателей не было выявлено половых различий, пациенты мужского и женского пола одинаково часто страдали МЗСД. Среди детей преобладали подростки старше 11 лет (IQR 15,2 [ Q1; Q3: 11,9; 16,5]), с возрастом количество пациентов, страдающих СД, достоверно увеличивается. ДНК-диагностика проведена была 111 пациентам с СД из 122. Преобладали пациенты с «тяжелым» генотипом (наличие в генотипе двух патогенных вариантов 1,2 классов) — 93,7%. Пациенты с наличием «мягкого» патогенного варианта гена CFTR в генотипе составили 6,3% (табл. 1).
Таблица 1. Характеристика пациентов с сахарным диабетом и муковисцидозом
по данным регистра пациентов с муковисцидозом Российской Федерации за 2021 г.
|
Показатель |
Всего |
P |
Дети |
P |
Взрослые |
P |
|||
|
Возраст, годы |
|||||||||
|
M±SD |
122 |
23,7±8,7 |
- |
33 |
13,5±4,1 |
- |
89 |
27,4±6,6 |
- |
|
Me (IQR) |
122 |
22,5 (12,8) |
- |
33 |
15,2 (5,0) |
- |
89 |
27,3 (10,9) |
- |
|
Me [ Q1; Q3] |
122 |
22,5 [ 17,7; 30,4] |
- |
33 |
15,2 [ 11,9; 16,5] |
- |
89 |
27,3 [ 21,2; 32,1] |
- |
|
Пол |
|||||||||
|
Мужчины |
55 |
45,1% |
13 |
39,4% |
0,197 |
42 |
47,2% |
0,44 |
|
|
Женщины |
67 |
54,9% |
20 |
60,6% |
47 |
52,8% |
|||
|
Генотип |
|||||||||
|
Тяжелый |
104 |
93,7% |
<0,001 |
27 |
90% |
0,205 |
77 |
95,1% |
0,33 |
|
Мягкий |
7 |
6,3% |
3 |
10% |
4 |
4,9% |
|||
Примечание: IQR — интерквартильный размах.
Нарастание распространенности МЗСД наблюдается с 10–11 лет с пиком в 18–21 год и постепенным снижением до 37 лет, что соответствует современным данным о продолжительности жизни пациентов с МВ и СД (рис. 1).
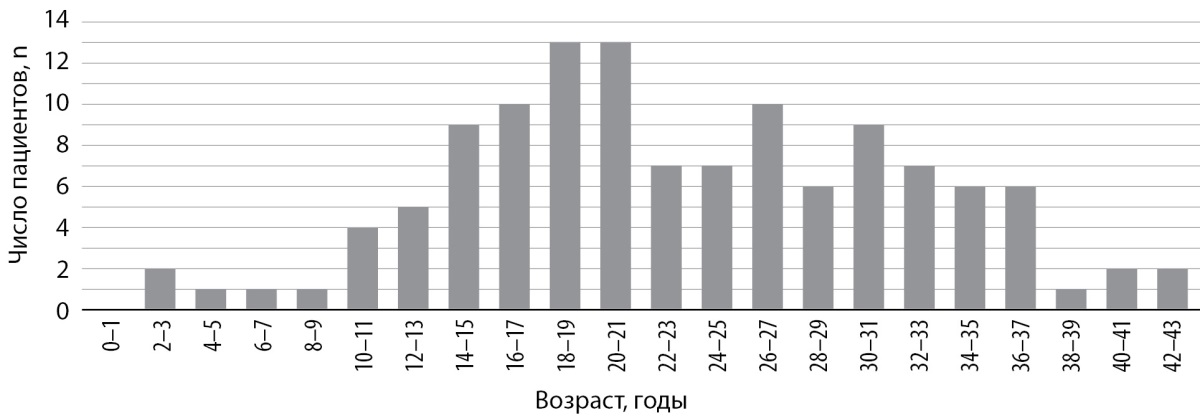
Рисунок 1. Гистограмма распространенности инсулинозависимого сахарного диабета
по возрасту пациентов с муковисцидозом по данным регистра 2021 г.
В дальнейшем сравнивали клинические особенности течения МВ у пациентов в возрасте до 18 лет с СД.
Для сравнения течения МВ у пациентов с СД и без него в детском возрасте были сформированы группы, сопоставимые по возрасту, полу, генотипу (тяжелый, мягкий), — в группу пациентов без диабета вошли 827 пациентов, 33 пациента составили группу больных с МЗСД с применением инсулина в возрасте до 18 лет. Сравнивались диагностические критерии, критерии тяжести течения МВ: показатели функции внешнего дыхания, микробиологический статус, частота осложнений, объем проводимой терапии.
В группу сравнения пациентов без СД вошли 827 детей в возрасте 13,4 [ 11,6; 15,6] года, мальчики составили 49,30%/408, девочки — 50,7%/419. Группу с МЗСД составили 33 ребенка в возрасте 15,2 [ 11,9; 16,5] года, мальчики — 39,4%/13, девочки — 60,6%/20 человек.
При сравнении пациентов с МЗСД и без него в группах, сопоставимых по возрасту, полу, генотипу, выявлено значимое различие по основному показателю состояния функции легких: M±SD ОФВ1 (% долж.) — 85,2±27,5 в группе пациентов без СД и M±SD ОФВ1 (% долж.) — 72,4±26,0 у пациентов с СД (p<0,016) (табл. 2).
Таблица 2. Характеристика пациентов детей и подростков
с муковисцидоззависимым сахарным диабетом и без него
по данным регистра 2021 г.
|
Показатель |
Дети без инсулинозависимого СД |
Дети с инсулинозависимым СД |
P |
||
|
n |
Возраст, годы |
n |
Возраст, годы |
||
|
M±SD |
827 |
13,6±2,3 |
33 |
13,5±4,1 |
|
|
Me (IQR) |
827 |
13,4 (4,0) |
33 |
15,2 (5,0) |
0,223 |
|
Me [ Q1; Q3] |
827 |
13,4 [ 11,6; 15,6] |
33 |
15,2 [ 11,9; 16,5] |
|
|
Пол |
|||||
|
Мужчины |
408 |
49,30% |
13 |
39,40% |
0,263 |
|
Женщины |
419 |
50,70% |
20 |
60,60% |
|
|
Возраст установления диагноза, годы |
|||||
|
M±SD |
814 |
2,0±3,3 |
33 |
1,8±3,1 |
0,797 |
|
Me (IQR) |
814 |
0,4 (1,83) |
33 |
0,5 (1,85) |
|
|
Me [ Q1; Q3] |
814 |
0,4 [ 0,2; 2,0] |
33 |
0,5 [ 0,2; 1,9] |
|
|
Потовый тест |
|||||
|
Титрование |
266 |
98,1±26,4 |
14 |
108,1±27,9 |
0,193 |
|
Проводимость |
517 |
106,9±22,1 |
18 |
109,8±12,5 |
0,637 |
|
Генотип |
|||||
|
Тяжелый |
549 |
81,0% |
27 |
90,0% |
0,214 |
|
Мягкий |
129 |
19,0% |
3 |
10,0% |
|
|
Респираторная функция |
|||||
|
M±SD ОФВ1, % долж. |
714 |
85,2±27,5 |
27 |
72,4±26,0 |
0,016 |
|
M±SD ФЖЕЛ, % долж. |
714 |
87,8±23,1 |
27 |
82,7±20,0 |
0,17 |
Примечание: IQR — интерквартильный размах;
ОФВ1 — объем формированного выдоха за первую секунду;
ФЖЕЛ — форсированная жизненная емкость легких.
По другим показателям диагностических критериев и течения МВ (возраст установления диагноза, результаты потовой пробы, генотип) достоверной разницы не получено.
При оценке микробиологического статуса значимой разницы между показателями в изучаемых группах не было выявлено, но тенденция к большему числу пациентов с хронической синегнойной инфекцией, MRSA отмечена в группе с МЗСД (табл. 3).
Таблица 3. Характеристика микробного пейзажа респираторного тракта
у пациентов с муковисцидозависимым сахарным диабетом
с применением инсулина и без диабета по данным регистра 2021 г.
|
Группы |
Дети без инсулинозависимого СД |
Дети с инсулинозависимым СД |
P |
||
|
n |
% |
n |
% |
||
|
Pseudomonas aeruginosa хронический высев |
326 |
39,4 |
18 |
54,5 |
0,082 |
|
Pseudomonas aeruginosa интермиттирующий высев |
137 |
16,6 |
5 |
15,2 |
0,830 |
|
MSSA хронический высев |
452 |
54,7 |
19 |
57,6 |
0,741 |
|
Burkholderia cepacia хронический высев |
30 |
3,6 |
2 |
6,3 |
0,447 |
|
Achromobacter spp. хронический высев |
45 |
5,5 |
2 |
6,1 |
0,888 |
|
MRSA хронический высев |
27 |
3,3 |
3 |
9,1 |
0,074 |
Примечание: MSSA — methicillin-sensitive Staphylococcus aureus;
MRSA — methicillin-resistant Staphylococcus aureus.
При анализе осложнений, характерных для МВ, различий между группами с МЗСД и без него выявлено не было. Однако была отмечена тенденция к большему числу пациентов с остеопорозом в группе МЗСД (табл. 4).
Таблица 4. Осложнения муковисцидоза в отчетном году в изучаемых группах
|
Показатель |
Дети без инсулинозависимого СД |
Дети с инсулинозависимым СД |
P |
||
|
n |
% |
n |
% |
||
|
Аллергический бронхопульмональный аспергиллез |
23 |
2,8 |
1 |
3,0 |
0,939 |
|
Синдром дистальной интестинальной обструкции, потребовавший госпитализации |
8 |
1,0 |
0 |
0,0 |
0,586 |
|
Синдром потери солей |
12 |
1,5 |
0 |
0,0 |
0,492 |
|
Пневмоторакс, потребовавший дренажа |
4 |
0,5 |
0 |
0,0 |
0,688 |
|
Кровотечение легочное |
4 |
0,5 |
0 |
0,0 |
0,689 |
|
Остеопороз |
15 |
2,3 |
2 |
7,7 |
0,085 |
|
Амилоидоз |
3 |
0,4 |
0 |
0,0 |
0,740 |
|
Риносинусит с полипозом носа |
410 |
50,0 |
20 |
60,6 |
0,489 |
|
Риносинусит без полипоза носа |
256 |
31,2 |
8 |
24,2 |
|
|
Онкологические заболевания |
0 |
0,0 |
0 |
0,0 |
- |
Анализ терапии, получаемой пациентами с МЗСД и без него, выявил значимую разницу в применяемой ингаляционной антибактериальной терапии — 54,6% пациентов без СД получали ингаляционные антибиотики, в то время как частота детей с МЗСД, получающих ингаляционную антибактериальную терапию, составила 75,8% (р=0,017). Значимо было различие применяемой таблетированной антибактериальной терапии (р=0,013). Отмечается тенденция к большему количеству пациентов на внутривенной антибактериальной терапии в группе детей с МЗСД — 53,1% против 38,3% в группе без СД (р=0,091). Значимо отличалось количество пациентов на кислородотерапии — в группе с МЗСД кислородотерапия применялась в 12,1% случаев, в группе без МЗСД — лишь в 3,4% (р= 0,01) (табл. 5).
Таблица 5. Анализ применяемой терапии у пациентов в изучаемых группах
по данным регистра пациентов с муковисцидозом 2021 г.
|
Показатель |
Дети без инсулинозависимого СД |
Дети с инсулинозависимым СД |
P |
||
|
n |
% |
n |
% |
||
|
Натрия хлорид гипертонический раствор в ингаляциях |
636 |
77,2 |
25 |
78,1 |
0,901 |
|
Маннитол ингаляционный |
76 |
9,2 |
6 |
18,2 |
0,086 |
|
Антибактериальная терапия ингаляционная |
448 |
54,6 |
25 |
75,8 |
0,017 |
|
Антибактериальная терапия внутривенная |
313 |
38,3 |
17 |
53,1 |
0,091 |
|
Антибактериальная терапия таблетированная |
485 |
59,2 |
26 |
81,3 |
0,013 |
|
Бронходилататоры |
396 |
48,1 |
19 |
59,4 |
0,211 |
|
Кислородотерапия |
28 |
3,4 |
4 |
12,1 |
0,01 |
|
Дорназа альфа |
813 |
98,7 |
32 |
97,0 |
0,416 |
|
Кортикостероиды ингаляционное применение |
81 |
9,8 |
5 |
15,2 |
0,316 |
|
Кортикостероиды оральное применение |
20 |
2,4 |
1 |
3,0 |
0,824 |
|
Азитромицин |
273 |
33,8 |
15 |
46,9 |
0,126 |
|
Урсодезоксихолевая кислота |
788 |
95,5 |
32 |
97,0 |
0,69 |
|
Панкреатин |
772 |
93,5 |
32 |
97,0 |
0,42 |
|
Ингибиторы протонной помпы |
194 |
24,2 |
10 |
31,3 |
0,36 |
|
Витамины жирорастворимые |
771 |
94,7 |
30 |
93,8 |
0,811 |
|
Кинезитерапия |
702 |
87,0 |
26 |
81,3 |
0,347 |
ОБСУЖДЕНИЕ
Частота МЗСД с потребностью в инсулинотерапии составляет 4,2% случаев в РФ в 2021 г. с преобладанием у взрослых по сравнению с детьми (10,5% vs 1,3%) согласно данным регистра больных МВ. Медиана возраста детей с СД составляет 15,2 [ 11,9; 16,5] года. В США МЗСД диагностируется у 9% пациентов с МВ в возрасте от 5 до 9 лет и у 26% пациентов в возрасте от 10 до 20 лет [22], что значительно превышает показатели РФ и, возможно, связано с особенностями диагностики СД в РФ и продолжительностью жизни пациентов. При организации ежегодного мониторинга нарушений углеводного обмена у всех пациентов с МВ распространенность МЗСД достигает 50–70% у пациентов в возрасте до 30 лет [23][24].
Сочетание МВ и СД оказывает негативное влияние на продолжительность жизни [22][25]. Средняя продолжительность жизни пациентов с МЗСД ниже по сравнению с пациентами без СД, медиана выживаемости у них составляет 24 года против 32 лет у пациентов с МВ без СД. МЗСД, как правило, протекает бессимптомно и может долгое время оставаться недиагностированным.
В настоящее время общепринято, что группами для обследования и исключения МЗСД являются подростки с 10-летнего возраста, пациенты с нутритивным дефицитом и с низкими темпами роста, задержкой полового созревания, снижением легочной функции, а также пациенты, у которых уровень глюкозы натощак превышает 7,0 ммоль/л, все беременные пациентки и планирующие беременность. Также контролю гликемии подлежат пациенты на внутривенной терапии антибактериальными средствами, пациенты на энтеральном питании. Обязательно обследование пациентов перед оперативным вмешательством, трансплантацией [26].
Данные настоящего исследования подтверждают более неблагоприятное течение МВ при присоединении МЗСД в детском возрасте. По данным исследования, пациенты с МЗСД имели более низкий показатель ОФВ1 по сравнению с детьми без СД (85,2±27,5% против 72,4±26,0% у пациентов с СД, p<0,016), что говорит о более тяжелом поражении бронхолегочной системы. Это подтверждается сравнением в группах микробиологической характеристики микрофлоры респираторного тракта. Отмечена тенденция к более частому хроническому высеву синегнойной палочки у пациентов с МЗСД — 54,50% против 39,4% в группе без МЗСД. Также чаще выявлялся рост MRSA — 9,1% по сравнению с группой детей без СД — 3,1%. Была отмечена тенденция к большему числу пациентов с остеопорозом в группе МЗСД, что свидетельствует о тяжести течения МВ у пациентов с СД. Более тяжелое состояние пациентов по данным ОФВ1 и росту грамотрицательной и антибиотикорезистентной флоры ведет к частому использованию ингаляционной антибактериальной терапии — 54,6% пациентов без СД получали ингаляционные антибиотики, дети с МЗСД получали ингаляционную антибактериальную терапию в 75,8% случаев (р=0,017). Достоверно было различие применяемой таблетированной антибактериальной терапии (р=0,013). Чаще пациенты с СД получали внутривенную антибактериальную терапию — 53,1% против 38,3% в группе без СД (р=0,091). Важно отметить достоверное отличие количества пациентов на кислородотерапии в группе с МЗСД — 12,1% против 3,4% без МЗСД (р=0,01). Приведенные отличия подтверждают более тяжелое течение МВ у пациентов с МЗСД в детском возрасте, что согласуется с данными литературы. Исследования, проведенные в РФ среди взрослых пациентов с МВ, показали, что пациенты с МЗСД характеризовались снижением показателей нутритивного статуса, функции легких, высокой колонизацией дыхательного тракта агрессивной микробной флорой, высокой частотой «тяжелых» генетических вариантов гена CFTR; «мягкие» варианты отсутствовали [27].
ЗАКЛЮЧЕНИЕ
Распространенность МЗСД с потребностью в инсулинотерапии у детей и подростков в РФ составляет 1,3%, чаще страдают подростки. Течение МЗСД значимо ухудшает течение МВ в отношении функции легких, роста грамотрицательной и резистентной флоры, развития тяжелых осложнений, что ведет к частому применению антибактериальной терапии. Задача специалистов, занимающихся лечением пациентов с МВ, — исследовать состояние углеводного обмена начиная с 10 лет у всех пациентов с МВ, а по показаниям и ранее, вовремя диагностировать МЗСД и предупреждать развитие осложнений СД и МВ. Возможно, раннее назначение таргетной терапии будет препятствовать развитию СД у пациентов с МВ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена в рамках гранта РНФ «Клинико-эпидемиологическая характеристика нарушений углеводного обмена при муковисцидозе и разработка новых подходов к их диагностике и терапии CFTR-модуляторами» № 23-25-00452 Государственного бюджетного учреждения здравоохранения Московской области «Научно-исследовательский клинический институт детства Министерства здравоохранения Московской области».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Кондратьева Е.И. — существенный вклад в концепцию и дизайн исследования, идея статьи, формализация задачи, отбор материала, работа с базами данных, внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи, одобрение финальной версии рукописи; Тлиф А.И. — существенный вклад в написание статьи, получение, анализ данных или интерпретацию результатов, внесение правок, одобрение финальной версии рукописи; Воронкова А.Ю. — существенный вклад в получение, анализ данных или интерпретацию результатов, сбор материала, написание статьи, коррекция текста, внесение правок, одобрение финальной версии рукописи; Каширская Н.Ю. — существенный вклад к концепции исследования, внесение существенных правок; Красовский С.А. — существенный вклад в получение, анализ данных, внесение существенных правок; Кураева Т.Л. — существенный вклад в коррекция данных, внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи, одобрение финальной версии рукописи; Амелина Е.Л. — существенный вклад в получение, анализ данных или интерпретацию результатов, внесение в рукопись существенной (важной) правки с целью повышения научной ценности статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Rana M, Munns CF, Selvadurai HC, et al. Increased detection of cystic-fibrosis-related diabetes in Australia. Arch Dis Child. 2011;96(9):823-826. doi: https://doi.org/10.1136/adc.2010.208652
2. Kern AS, Prestridge AL. Improving screening for cystic fibrosis-related diabetes at a pediatric cystic fibrosis program. Pediatrics. 2013;132(2):512-518. doi: https://doi.org/10.1542/peds.2012-4029
3. Scheuing N, Holl RW, Dockter G, et al. Diabetes in cystic fibrosis: multicenter screening results based on current guidelines. PLoS One. 2013;8(12):e81545. doi: https://doi.org/10.1371/journal.pone.0081545
4. Moran A, Becker D, Casella SJ, et al. Epidemiology, pathophysiology, and prognostic implications of cystic fibrosis-related diabetes: a technical review. Diabetes Care. 2010;33(12):2677-2683. doi: https://doi.org/10.2337/dc10-1279
5. Chan CL, Vigers T, Pyle L. Continuous glucose monitoring abnormalities in cystic fibrosis youth correlate with pulmonary function decline. J. Cyst. Fibros. 2018;17(6):783-790. doi: https://doi.org/10.1016/j.jcf.2018.03.008
6. Ode KL, Frohnert B, Laguna T. Oral glucose tolerance testing in children with cystic fibrosis. Pediatr Diabetes. 2010;11(7):487-492. doi: https://doi.org/10.1111/j.1399-5448.2009.00632.x
7. Hart NJ, Aramandla R, Poffenberger G. Cystic fibrosis-related diabetes is caused by islet loss and inflammation. JCI Insight. 2018;3(8):e98240. doi: https://doi.org/10.1172/jci.insight.98240
8. Patient-Registry-Annual-Data-Report [cited 10.10.2023]. Available from: https://www.cff.org/sites/default/files/2021-11/Patient-Registry-Annual-Data-Report.pdf
9. Sheikh S, Gudipaty L, De Leon DD. Reduced p-Cell Secretory Capacity in Pancreatic-Insufficient, but Not Pancreatic-Sufficient, Cystic Fibrosis Despite Normal Glucose Tolerance. Diabetes. 2017;66(1):134-144. doi: https://doi.org/10.2337/db16-0394
10. Shwachman H, Leubner H. Mucoviscidosis. Advan Pediat. 1955;(7):249-323.
11. Middleton PG, Wagenaar M, Matson AG, et al. Australian standards of care for cystic fibrosis-related diabetes. Respirology. 2014;19(2):185-192. doi: https://doi.org/10.1111/resp.12227
12. Prentice BJ, Chelliah A, Ooi CY, et al. Peak OGTT glucose is associated with lower lung function in young children with cystic fibrosis. J Cyst Fibros. 2020;19(2):305-309. doi: https://doi.org/10.1016/j.jcf.2019.05.005
13. Lanng S, Thorsteinsson B, Nerup J, Koch C. Influence of the development of diabetes mellitus on clinical status in patients with cystic fibrosis. Eur J Pediatr. 1992;151(9):684-687. doi: https://doi.org/10.1007/BF01957574
14. Доступно по: http://audit-orfan.clin-reg.ru/nozologii/mukoviscidoz.html.European Ссылка активна на 03.10.2023.
15. Cystic Fibrosis Society [Internet] Available from: https://www.ecfs.eu/ecfspr
16. Дедов И.И., Шестакова М.В., Майоров А.Ю. Алгоритмы специализированной медицинской помощи больным сахарным диабетом 11-й выпуск. — М.: Министерство здравоохранения РФ; 2023. doi: https://doi.org/10.14341/DM13042
17. Neder JA. The new ERS/ATS standards on lung function test interpretation: some extant limitations. Eur Respir J. 2022;60(2):2200252. doi: https://doi.org/10.1183/13993003.00252-2022
18. Кондратьева Е.И., Каширская Н.Ю., Капранов Н.И. Национальный консенсус. Муковисцидоз: определение, диагностические критерии, терапия. М.: Российское общество медицинских генетиков; 2016. 205 с.
19. Поликарпова С.В., Жилина С.В., Кондратенко О.В. Руководство по микробиологической диагностике инфекций дыхательных путей у пациентов с муковисцидозом. — М.: Триада; 2019.
20. Methods of bacteriological research of conditionally pathogenic microorganisms in clinical microbiology. Guidelines [cited 17.07.2022]. Available from: https://files.stroyinf.ru/Index2/1/4293727/4293727337.htm
21. Stevens DA, Moss RB, Kurup VP, et al. Allergic bronchopulmonary aspergillosis in cystic fibrosis—state of the art: Cystic fibrosis foundation consensus conference. Clin Infect Dis. 2003;37(S3):S225-S264. doi: https://doi.org/10.1086/376525
22. Moran A, Dunitz J, Nathan B. Cystic fibrosis-related diabetes: current trends in prevalence, incidence, and mortality. Diabetes Care. 2009;32(9):1626-1631. doi: https://doi.org/10.2337/dc09-0586
23. Zorron Mei Hsia Pu M, Goncalves AC, et al. Continuous glucose monitoring to evaluate glycaemic abnormalities in cystic fibrosis. Arch Dis Child. 2018;103(6):592-596. doi: https://doi.org/10.1136/archdischild-2017-314250
24. Clemente Leon M, Bilbao Gasso L, Moreno-Galdo A. Oral glucose tolerance test and continuous glucose monitoring to assess diabetes development in cystic fibrosis patients. Endocrinol Diabetes Nutr. 2018;65(1):45-51. doi: https://doi.org/10.1016/j.endinu.2017.08.008
25. Leclercq A., Gauthier B., Rosner V. Early assessment of glucose abnormalities during continuous glucose monitoring associated with lung function impairment in cystic fibrosis patients. J Cyst Fibros. 2014;13(4):478-84. doi: https://doi.org/10.1016/j.jcf.2013.11.005
26. Каширская Н.Ю., Капранова Н.И., Кондратьева Е.И. Муковисцидоз. Издание 2-е., переработанное и дополненное. — М.: Медпрактика; 2021.
27. Самойленко В.А., Красовский С.А., Марченков Я.В., и др. Клинические особенности течения муковисцидоза у взрослых больных с нарушением углеводного обмена // Терапевтический архив. — 2013. — Т. 85. — №3. — С. 32-37.
Об авторах
Е. И. КондратьеваРоссия
Кондратьева Елена Ивановна – доктор медицинских наук, профессор, заведующая научно-клиническим отделом муковисцидоза, заведующая кафедрой Генетики болезней дыхательной системы Института высшего и дополнительного профессионального образования, МГНЦ им. ак. Н.П. Бочкова; заместитель директора по научной работе, НИКИ детства МЗ МО.
115522, Москва, ул. Москворечье д.1; 115093, Москва, ул. Б. Серпуховская, 62
Researcher ID: A-6128-2014; Scopus Author ID 36737150600
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
А. И. Тлиф
Россия
Тлиф Асиет Исмаиловна - заведующая отделением эндокринологии.
115093, Москва, ул. Б. Серпуховская, 62
Scopus Author ID: 57193901713
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
А. Ю. Воронкова
Россия
Воронкова Анна Юрьевна – кандидат медицинских наук, ведущий научный сотрудник научно-клинического отдела муковисцидоза МГНЦ им. ак. Н.П. Бочкова; ведущий научный сотрудник, НИКИ детства МЗ МО.
115522, Москва, ул. Москворечье д.1; 115093, Москва, ул. Б. Серпуховская, 62
Researcher ID: M-7191-2014; Scopus Author ID: 57189352251
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
Е. Л. Амелина
Россия
Амелина Елена Львовна – кандидат медицинских наук, заведующая лабораторией муковисцидоза.
115682, Москва, Ореховый бульвар, 28
Scopus Author ID: 7003985681
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
Н. Ю. Каширская
Россия
Каширская Наталия Юрьевна – доктор медицинских наук, профессор, главный научный сотрудник лаборатории генетической эпидемиологии
115522, Москва, ул. Москворечье д.1
Researcher ID: C-6404-2012
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
С. А. Красовский
Россия
Красовский Станислав Александрович - кандидат медицинских наук, ведущий научный сотрудник научно-клинического отдела муковисцидоза, МГНЦ им. ак. Н.П. Бочкова; старший научный сотрудник лаборатории муковисцидоза, НИИ пульмонологии ФМБА России.
115522, Москва, ул. Москворечье, д.1; 115682, Москва, Ореховый бульвар, д.28
Scopus Author ID: 57193905152
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
М. А. Старинова
Россия
Старинова Марина Александровна - научный сотрудник научно-клинического отдела муковисцидоза.
115522, Москва, ул. Москворечье д.1
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
Т. Л. Кураева
Россия
Кураева Тамара Леонидовна - доктор медицинских наук, профессор, врач высшей квалификационной категории, главный научный сотрудник отдела наследственных и метаболических болезней НИКИ детства МЗ МО; главный научный сотрудник отделения сахарного диабета института детской эндокринологии НМИЦ эндокринологии Минздрава России.
115093, Москва, ул. Б.Серпуховская, 62
Author ID: 137339
Конфликт интересов:
Автор заявляет об отсутствии конфликта интересов
Дополнительные файлы
|
|
1. Рисунок 1. Гистограмма распространенности инсулинозависимого сахарного диабета по возрасту пациентов с муковисцидозом по данным регистра 2021 г. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(141KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кондратьева Е.И., Тлиф А.И., Воронкова А.Ю., Амелина Е.Л., Каширская Н.Ю., Красовский С.А., Старинова М.А., Кураева Т.Л. Характеристика пациентов с муковисцидоззависимым сахарным диабетом в детском возрасте по данным регистра пациентов с муковисцидозом Российской Федерации 2021 года. Сахарный диабет. 2023;26(5):418-426. https://doi.org/10.14341/DM13064
For citation:
Kondratyeva E.I., Tlif A.I., Voronkova A.Yu., Amelina E.L., Kashirskaya N.Yu., Krasovsky S.A., Starinova M.A., Kuraeva T.L. Characteristics of patients with cystic fibrosis-dependent diabetes mellitus in childhood according to the register of patients with cystic fibrosis of the Russian Federation in 2021. Diabetes mellitus. 2023;26(5):418-426. (In Russ.) https://doi.org/10.14341/DM13064
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































