Перейти к:
Нарушения углеводного обмена, ассоциированные с COVID-19: клинико-морфологическое исследование
https://doi.org/10.14341/DM13041
Аннотация
ОБОСНОВАНИЕ. Накапливается все больше данных о декомпенсации ранее известных нарушений углеводного обмена (НУО), а также впервые выявленной гипергликемии в остром периоде COVID-19, однако механизмы развития НУО в постковидном периоде до конца не ясны.
ЦЕЛЬ. Уточнить встречаемость НУО в постковидном периоде у больных, перенесших COVID-19 средней и тяжелой степени, без ранее известных НУО, а также оценить экспрессию белков SARS-CoV-2 и его трансмембранных переносчиков ангиотензин-превращающего фермента 2 (ACE2) и дипептидилпептидазы-4 (DPP4) в эндокринной части поджелудочной железы у больных COVID-19 в острый период заболевания.
МАТЕРИАЛЫ И МЕТОДЫ. Проанализированы клинико-анамнестические данные 187 больных в острый период COVID-19, из них в постковидном периоде обследован 141 пациент без ранее установленного диагноза сахарного диабета (СД). В постковидном периоде у всех участников оценены антропометрические данные, определены уровни гликированного гемоглобина (HbA1c), глюкозы плазмы крови натощак, у 106 больных определен уровень инсулина и рассчитан индекс инсулинорезистентности HOMA-IR. Для гистологического исследования отобраны фрагменты поджелудочной железы 20 пациентов с летальным исходом. Иммуногистохимическое исследование выполнено с антителами к SARS-CoV-2, ACE2, DPP4, а также проведена иммунофлюоресцентная микроскопия с двойной меткой (инсулин-SARS-CoV-2, инсулин-ACE2, инсулин-DPP4).
РЕЗУЛЬТАТЫ. У 9 (6,3%) из 141 больного в постковидном периоде показатели HbA1c или уровня глюкозы плазмы натощак соответствовали критериям СД, у 38 (26,9%) — были выше нормальных значений (ВОЗ), а при использовании критериев ADA (Американской диабетической ассоциации) количество больных с НУО составило 84 (59,6%). Больные с НУО в постковидном периоде, по сравнению с больными с нормальным уровнем гликемии, имели больший индекс массы тела (ИМТ), индекс НОМА-IR (р=0,001), который превышал значение 2,7 только у 40,4% человек. Больные с НУО имели более высокий уровень С-реактивного белка (р=0,007), максимальный уровень глюкозы (р=0,019) в остром периоде заболевания. Выявлена положительная корреляционная связь ИМТ с индексом HOMA-IR (р<0,001; r=0,389) в остром и постковидном (р<0,001; r=0,412) периодах, а также с уровнем HbA1с (р=0,004, r=0,242). Гистологическое и иммуногистохимическое исследования показали экспрессию белков SARS-CoV-2 в 1,85% [0–15,4] и 11,1% [5,3–14,8] клеток островков Лангерганса у больных, умерших во вторую и третью волны соответственно. Экспрессия ACE2, DPP4 в островках Лангерганса не превышала 0,4 % [0–1,7] и 0,5% [0–0,8] клеток соответственно. Выявлена ко-локализация SARS-CoV-2, ACE2, DPP4 c инсулином.
ЗАКЛЮЧЕНИЕ. НУО в постковидом периоде может быть обусловлено прямым цитотоксическим действием SARS-COV-2, глюкозотоксичностью и повышением инсулинорезистентности на фоне острого инфекционного процесса и его комплексной терапии.
Ключевые слова
Для цитирования:
Каронова Т.Л., Михайлова А.А., Лагутина Д.И., Воробьева О.М., Григорьева Д.О., Стерхова К.А., Малько В.А., Михеева А.Г., Черникова А.Т., Митрофанова Л.Б., Шляхто Е.В. Нарушения углеводного обмена, ассоциированные с COVID-19: клинико-морфологическое исследование. Сахарный диабет. 2023;26(6):515-525. https://doi.org/10.14341/DM13041
For citation:
Karonova T.L., Mikhailova A.A., Lagutina D.I., Vorobeva O.M., Grigoreva D.O., Sterkhova K.A., Malko V.A., Mikheeva A.G., Chernikova A.T., Mitrofanova L.B., Shlyakhto E.V. Glucose metabolism disorders associated with COVID-19: clinical and morphological study. Diabetes mellitus. 2023;26(6):515-525. (In Russ.) https://doi.org/10.14341/DM13041
ВВЕДЕНИЕ
COVID-19 представляет собой высококонтагиозное вирусное заболевание, возбудителем которого является РНК-вирус SARS-CoV-2 [1]. В дополнение к известной роли данного вируса в поражении дыхательной системы, известно и о COVID-19-ассоциированном повреждении эндокринных органов, включая островки Лангерганса поджелудочной железы (ПЖ) [2]. Однако патогенетические аспекты повреждения эндокринной части ПЖ в остром периоде COVID-19 остаются до конца неясными. Помимо описанного в литературе опосредованного цитокинового повреждения, а также нарушений, связанных с применением стероидов, рассматривается и возможное прямое цитотоксическое действие SARS-CoV-2 на эндокринный аппарат ПЖ [3][4].
В то же время, говоря о потенциальной интернализации вирусом эндокринной части ПЖ, описана идентификация SARS-CoV-2 методами иммуногистохимии, электронной микроскопии, а также гибридизации in situ [4][5]. Дополнительно была показана способность SARS-CoV-2 к инфицированию α- и β-клеток ПЖ, полученных из плюрипотентных стволовых клеток в ходе экспериментальных исследований [6].
Еще в 2003 г., в период вспышки тяжелого острого респираторного синдрома, вызванного SARS-CoV, была обнаружена тропность вирусов Coronaviridae к островкам Лангерганса [7]. В качестве основных входных ворот вируса рассматриваются различные мембранные белки-переносчики, среди которых ключевая роль в литературе отводится ангиотензин-превращающему ферменту 2 (ACE2). На сегодняшний день в научном сообществе нет окончательной позиции относительно экспрессии ACE2 в эндокринной части ПЖ. Так, по данным некоторых авторов, данный белок представлен как в экзокринной, так и в эндокринной части ПЖ [8], а D. Fignani и соавт. показали, что экспрессия АСЕ2 в большей степени характерна для β-клеток ПЖ, чем для остальных клеток островков Лангерганса [9]. Несмотря на отсутствие экспрессии ACE2 в эндокринной части ПЖ по данным других исследователей [10], было выдвинуто предположение, что низкая экспрессия ACE2 в β-клетках ПЖ не исключает их потенциального инфицирования SARS-CoV-2, так как может объясняться высокой синтетической функцией β-клеток [11]. Дополнительно, ACE2 также был выделен в перицитах сосудов ПЖ, что позволяет предположить локальное воспаление и ишемическое повреждение островков Лангерганса вследствие поражения микроциркуляторного русла [9]. Еще одним механизмом повреждения эндокринной части ПЖ, ассоциированным с АСЕ2, может быть снижение преобразования ангиотензина 2 в ангиотензин 1, что ведет к повышению внутриклеточной концентрации ионов кальция и, как следствие, апоптозу клетки [12].
Интерес представляет и другой мембранный рецептор, известный в качестве входных ворот для вируса, а именно дипептидилпептидаза-4 (DPP4) [13]. Учитывая роль данного рецептора в метаболических путях, регулирующих как воспаление, так и гомеостаз глюкозы, D.J. Drucker рассматривает DPP4 в качестве связующего патофизиологического звена между COVID-19 и сахарным диабетом (СД) 2 типа [14]. Дополнительно, по данным С. Steenblock и соавт., данный рецептор обнаружен как в эндокринной, так и в экзокринной части ПЖ, в том числе в ACE2-негативных клетках с идентифицированным SARS-CoV-2 [11].
С точки зрения клинических проявлений накапливается все больше данных о декомпенсации ранее известных нарушений углеводного обмена (НУО), а также впервые выявленной гипергликемии в остром периоде заболевания, вызванного как SARS-CoV, так и SARS-CoV-2 [15][16]. Несмотря на факт, что у большинства больных нарушение метаболизма глюкозы после атипичной пневмонии, вызванной SARS-CoV, носило обратимый характер, у части пациентов, включенных в проспективное исследование с периодом наблюдения в 12 лет, было отмечено 4-кратное повышение риска СД [16]. Пандемия COVID-19, по данным метаанализа, а также когортных исследований, также характеризуется повышенным риском развития СД в отдаленном периоде, что может рассматриваться как проявление постковидного синдрома [17–19].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Уточнить встречаемость НУО в постковидном периоде у больных, перенесших COVID-19 средней и тяжелой степени, без ранее диагностированных НУО, а также оценить экспрессию белков SARS-CoV-2 и его трансмембранных переносчиков ACE2 и DPP4 в эндокринной части ПЖ у больных COVID-19 в острый период заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
В исследование включены больные, соответствующие критериям включения, госпитализированные для стационарного лечения в инфекционный стационар ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России (г. Санкт-Петербург) по поводу COVID-19 средней и тяжелой степени тяжести в период с ноября 2020 г. по август 2021 г.
Дизайн исследования
Проведенное исследование состоит из двух частей (клинической и морфологической). Первая часть исследования представляет собой одноцентровое продольное проспективное исследование с включением больных в острый период COVID-19 средней и тяжелой степени с целью уточнения развития НУО в постковидном периоде у лиц, ранее не имевших СД и предиабета. Конечной точкой исследования являлось развитие НУО через 6–18 мес от момента перенесенного COVID-19.
Вторая часть является морфологическим исследованием с оценкой характера повреждения эндокринной части ПЖ в острый период COVID-19 у умерших больных.
Критерии соответствия в клинической части исследования
Пациенты с диагнозом COVID-19, подтвержденным по данным мультиспиральной компьютерной томографии и методом полимеразной цепной реакции в реальном времени. Критерии исключения: указания в анамнезе на наличие НУО до госпитализации в инфекционный стационар с COVID-19, тяжелые соматические заболевания, а также беременность и лактация.
Клиническая часть исследования
Из 187 больных COVID-19, госпитализированных в инфекционный стационар с известными анамнестическими, клиническими и лабораторными данными, в проспективное наблюдение были включен 141 пациент без указаний на наличие НУО в анамнезе на момент госпитализации. Повторное обследование больных проведено через 6–18 мес от момента госпитализации больных в инфекционный стационар.
Исходное обследование являлось стандартным для госпитализированного больного. Дополнительно после подписания информированного согласия были собраны образцы сыворотки и плазмы крови.
Обследование в динамике включало антропометрическое исследование: измерение роста, веса, расчет индекса массы тела (ИМТ) по формуле Кетле (кг/м²) = вес (кг) / рост² (м²). За прибавку массы тела в постковидном периоде принято увеличение показателя, более или равное 5% от исходного. Для оценки состояния углеводного обмена у всех участников был определен уровень гликированного гемоглобина (HbA1c), уровень глюкозы плазмы крови натощак. Для оценки функции бета-клеток и инсулинорезистентности у 106 больных был определен уровень инсулина плазмы крови, произведен перевод единиц измерения инсулина из пмоль/л в мкЕд/мл (1 пмоль/л×0,138 = 1 мкЕд/л) и рассчитан индекс инсулинорезистентности HOMA-IR (Homeostasis model assessment of insulin resistance) по формуле:
HOMA-IR = [уровень базального инсулина(мкЕд/мл) × глюкоза плазмы натощак (ммоль/л)]/22,5.
Наличие отклонений показателей углеводного обмена от нормальных значений оценивалось в соответствии с критериями Всемирной организации здравоохранения (ВОЗ) (1999–2013 гг.), а также с критериями Американской диабетической ассоциации (АДА, 2020).
Уровни С-реактивного белка (СРБ), лактатдегидрогеназы (ЛДГ), ферритина, базального инсулина измерялись на автоматическом биохимическом анализаторе Cobas e411 Roche (Швейцария), референсные диапазоны: 0–5 мг/л, 133–225 Ед/л, 15–150 нг/мл, 17,8–173,0 ммоль/л соответственно.
Уровень HbA1c измерялся на анализаторе для определения HbA1c D-10 (BIO-RAD, Франция), референсные диапазоны (<6,0%).
Для всех пациентов была рассчитана суммарная доза глюкокортикостероидов (ГКС) за время госпитализации. Расчет эквивалентной дексаметазону дозы ГКС выполнен с помощью программного обеспечения Steroid Conversation Calculator [https://www.mdcalc.com/calc/2040/steroid-conversion-calculator].
Морфологическая часть исследования
Был исследован секционный материал 197 пациентов, умерших во время госпитализации в инфекционном стационаре, с подтвержденным диагнозом COVID-19 по данным мультиспиральной компьютерной томографии органов грудной клетки и методом полимеразной цепной реакции в реальном времени. Разделение на волны заболеваемости проводилось в соответствии с датами госпитализации.
Секвенирование образцов для определения штамма вируса было проведено в ФГБУ «НИИ гриппа им. А.А. Смородинцева»: 2-я волна — B.1.397 B.1.317; Alpha VOC (B.1.1.7) и AT.1 lineage; 3-я волна — B.1.617.2 lineage (Delta VOC).
При гистологическом исследовании ткани ПЖ были оценены следующие показатели: степень аутолиза, липоматоза и фиброза, наличие воспалительного инфильтрата, некроза, отложений в островках, расширенных протоков, белковых масс в протоках, размер островков и степень ядерного полиморфизма.
Для иммуногистохимического (ИГХ) исследования были отобраны 20 пациентов (10 пациентов, проходивших лечение во 2-ю волну и 10 — в 3-ю). Антитела к SARS-Cov-2 spike protein (GeneTex, USA, кроличьи), DPP4 (Affinity Biosciences, Australia, кроличьи), ACE2 (Affinity Biosciences, Australia, кроличьи) и инсулину (Abcam, United Kingdom, мышиные) были использованы для проведения ИГХ. Для оцифровки изображения и морфометрии использовалась программа Aperio ImageScope 12.3.3. Для иммунофлуоресцентной микроскопии с двойной меткой использовались сочетания антител инсулин-SARS-Cov-2 spike protein, инсулин-DPP4 и инсулин-ACE2. Для флуоресцентной микроскопии и получения микрофотографий использовался микроскоп Leica DM4000B.
Статистический анализ
Для статистического анализа данных морфологического исследования использовалась программа Statistica v10. Статистическая обработка результатов клинической части исследования осуществлялась с использованием программы Jamovi, version 2.3.2 (Jamovi project, 2022, Сидней, Австралия). Данные представлены медианой и интерквартильным размахом (Me [Q1; Q3]). Для определения значимости различий между двумя независимыми группами использовался U-критерий Манна–Уитни для количественных признаков и χ² для качественных признаков. При проведении корреляционного анализа применялся коэффициент корреляции Спирмена. Уровень значимости был установлен на уровне р²<0,05.
Этическая экспертиза
На момент госпитализации пациенты подписывали информированное согласие для проведения дополнительного обследования, которое было одобрено локальным этическим комитетом (Выписка № 1011-20-02C из протокола заседания ЛЭК N° 0212-22 от 30.11.2020 г.).
Дополнительное соглашение для проведения проспективной части исследования одобрено этическим комитетом НМИЦ им. В.А. Алмазова (Выписка № 200212-22 из протокола заседания ЛЭК N° 0212-22 от 26.12. 2022 г.).
Морфологическая часть исследования выполнялась из материала больных, находившихся на стационарном лечении с диагнозом COVID-19, чья госпитализация закончилась летальным исходом. На момент госпитализации все пациенты подписывали стандартное информированное согласие на обследование и лечение в стационаре.
РЕЗУЛЬТАТЫ
У 187 больных, проходивших лечение в инфекционном стационаре по поводу COVID-19 средней и тяжелой степени тяжести, оценены клинические, лабораторные и инструментальные данные. Из 187 пациентов у 141 человека не было НУО в анамнезе. Исходная характеристика больных, включенных в дальнейшее проспективное исследование, представлена в табл. 1.
Таблица 1. Характеристика больных в остром периоде COVID-19 (n=141)
|
Параметры |
Значения |
|
Пол ж., n (%) |
77 (54,6) |
|
Возраст, лет |
57 [ 49; 67] |
|
ГБ, n (%) |
83 (61,9) |
|
ИБС, n (%) |
17 (12,6) |
|
ИМТ, кг/м² |
28,2 [ 25,4; 31,1] |
|
Норма, n (%) Избыточная масса тела, n (%) Ожирение, n (%): 1-й степени 2-й степени 3-й степени |
34 (24,1) 57 (40,4) 50 (35,5) 37 (74,0) 12 (24,0) 1 (2,0) |
|
Максимальный уровень глюкозы при cлучайном определении во время госпитализации, ммоль/л |
8,9 [ 6,89; 11,2] |
|
Уровень гликемии выше 11,1 ммоль/л при cлучайном определении во время госпитализации, n (%) |
38 (27,0) |
|
Максимальный уровень СРБ во время госпитализации, мг/л |
54,3 [ 25,3; 113] |
|
Максимальный уровень ферритина во время госпитализации, нг/мл |
645 [ 281; 1123] |
|
Максимальный уровень ЛДГ во время госпитализации, Ед/л |
317 [ 258; 451] |
|
Терапия ГКС, n (%) |
133 (94,3) |
|
Суммарная доза ГКС за время госпитализации*, мг |
197 [ 121; 325] |
|
Терапия МАБ, n (%) |
35 (27,6) |
|
Процент поражения по КТ, % |
30 [ 20; 45] |
|
Степень по КТ, n (%) 0 1 2 3 4 |
2 (1,4) 49 (34,8) 68 (48,2) 17 (12,1) 5 (3,5) |
|
Койко-дни, дни |
14 [ 12; 17] |
|
Лечение в ОА и Р, n (%) |
5 (3,7) |
Примечание: ГБ — гипертоническая болезнь;
ИБС — ишемическая болезнь сердца;
ИМТ–индекс массы тела;
СРБ — С-реактивный белок;
ЛДГ — лактатдегидрогеназа;
ГКС — глюкокортикостероиды;
* — доза ГКС представлена в перерасчете на дексаметазон;
КТ — компьютерная томография;
ОА и Р — отделение анестезиологии и реанимации;
МАБ —препараты моноклональных антител.
В постковидном периоде в интервале от 6 до 18 мес после перенесенного COVID-19 (медиана визита составила 7 [ 6; 10] мес) был обследован 141 больной без указаний в анамнезе на НУО при поступлении в инфекционный стационар. По результатам обследования в постковидном периоде повышение уровня HbA1с более 6,5% было выявлено у 7 больных (4,9%), уровень глюкозы плазмы крови натощак, равный и превышающий 7,0 ммоль/л, был обнаружен еще у 2 обследованных (1,4%). У 38 (29,6%) больных уровень гликемии и/или HbA1с отклонялся от нормальных значений согласно критериям ВОЗ. Вместе с тем при использовании критериев АДА количество больных с НУО в виде предиабета было значимо больше и составило 84 (59,6%) человека. Данные о НУО в постковидном периоде представлены на рис. 1.

Рисунок 1. Характеристика нарушений углеводного обмена,
выявленных в постковидном периоде у пациентов,
перенесших COVID-19 средней и тяжелой степени тяжести.
Примечание: ВОЗ — Всемирная организация здравоохранения;
АДА — Американская диабетическая ассоциация;
НУО — нарушения углеводного обмена;
СД — сахарный диабет;
розовый цвет на графике — пациенты без НУО;
голубой цвет на графике — уровень глюкозы плазмы крови
или уровень гликированного гемоглобина соответствуют критериям СД;
фиолетовый цвет на графике — отклонение от нормальных показателей
углеводного обмена.
Результаты обследования больных в постковидном периоде представлены в табл. 2. Для сравнительного анализа в соответствии с критериями ВОЗ пациенты разделены на группы «Больные с НУО» и «Больные без НУО».
Таблица 2. Характеристика пациентов
с нарушениями углеводного обмена и пациентов без них
в постковидном периоде
|
Параметры |
Пациенты с НУО (n=47) |
Пациенты без НУО (n=94) |
Р |
|
Пол ж, n (%) |
27 (57,4) |
50 (53,1) |
0,215 |
|
Возраст, лет |
60 [ 52; 65] |
56 [ 47; 65] |
0,024 |
|
ГБ, n (%) |
37 (78,7) |
46 (48,9) |
<0,001 |
|
ИБС, n (%) |
8 (17,0) |
9 (9,6) |
0,173 |
|
ИМТ, кг/м² |
29,8 [ 26,3; 33,4] |
27,9 [ 25,7; 31,0] |
0,048 |
|
Норма, n (%) Избыточная масса тела, n (%) Ожирение, n (%): 1-й степени 2-й степени 3-й степени |
6 (12,8) 18 (38,3) 23 (48,9) 16 (34,0) 6 (12,8) 1 (2,1) |
22 (23,4) 42 (44,7) 30 (31,9) 24 (25,5) 6 (6,4) 0 (0) |
0,105 |
|
Прибавка массы тела более 5%, n (%) |
11 (23,4) |
20 (21,2) |
0,774 |
|
Глюкоза плазмы натощак, ммоль/л |
6,2 [ 5,7; 6,6] |
5,2 [ 4,9; 5,6] |
<0,001 |
|
HbA1с, % |
6,0 [ 5,7; 6,3] |
5,6 [ 5,4; 5,8] |
<0,001 |
|
Инсулин, мкМЕ/мл |
10,9 [ 8,9; 15,9] |
9,5 [ 6,1; 14,3] |
0,042 |
|
HOMA-IR |
2,98 [ 2,28; 3,91] |
1,94 [ 1,42; 2,92] |
0,001 |
|
HOMA-IR ≥2,7, n (%) |
19 (40,4) |
22 (23,4) |
0,012 |
Примечание: ГБ — гипертоническая болезнь;
НУО — нарушения углеводного обмена;
ИБС — ишемическая болезнь сердца;
СД — сахарный диабет;
ИМТ — индекс массы тела;
HbA1с — гликированный гемоглобин
HOMA-IR — Homeostasis model assessment of insulin resistance.
Как видно из представленных данных, больные с НУО были старше (р=0,024), чем больные с нормальным уровнем гликемии. Также среди этих больных чаще встречалась артериальная гипертензия (р<0,001). В постковидном периоде больные с НУО имели больший ИМТ по сравнению с больными без НУО, который соответственно составил 29,8 [ 26,3; 33,4] и 27,9 [ 25,7; 31,0] кг/м², однако по встречаемости ожирения и избыточной массы тела больные не отличались (р=0,105). У 60 больных (42,5%) выявлена прибавка массы тела, в том числе прибавка массы тела на 5% и более была установлена у 31 (22,0%) пациента. Однако количество лиц со значимой прибавкой массы тела не отличалось в исследуемых группах.
При оценке лабораторных параметров были выявлены различия по уровню базального инсулина (р=0,042) и значению индекса HOMA-IR (р=0,012) между группами. Значения индекса HOMA-IR у больных с НУО и пациентов с нормальным уровнем гликемии представлены на рис. 2. Необходимо отметить, что среди больных с НУО у 19 человек в постковидном периоде выявлено повышение индекса HOMA-IR, более или равное 2,7, что значимо чаще встречалось по сравнению с лицами с нормальным уровнем глюкозы (р=0,012).
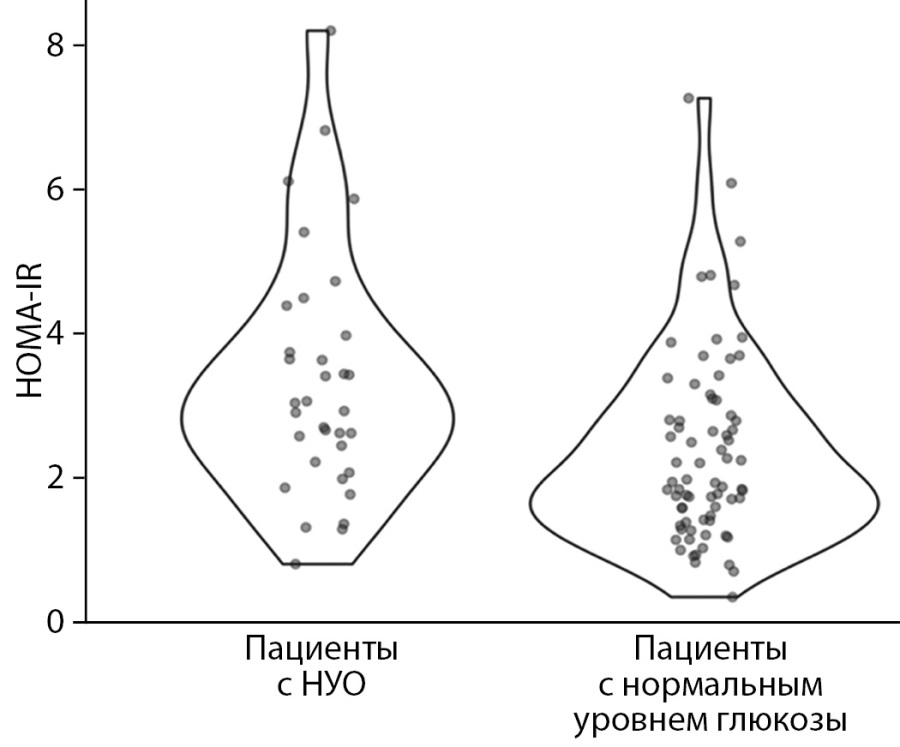
Рисунок 2. Значение индекса HOMA-IR
у больных с нарушениями углеводного обмена
и пациентов с нормальным уровнем глюкозы плазмы крови.
Примечание: НУО — нарушения углеводного обмена;
HOMA-IR — Homeostasis model assessment of insulin resistance.
С учетом выявленных в постковидном периоде НУО, дополнительно был проведен анализ течения острого периода COVID-19 для данных больных (табл. 3).
Таблица 3. Сравнительная характеристика острого периода COVID-19
больных с нарушениями углеводного обмена и больных без них,
выявленных в постковидном периоде.
|
Параметры |
Пациенты с НУО (n=47) |
Пациенты без НУО (n=94) |
р |
|
ИМТ, кг/м² |
28,4 [ 26,1; 32,7] |
27,9 [ 24,9; 30,6] |
0,124 |
|
Норма, n (%) Избыточная масса тела, n (%) Ожирение, n (%): 1-й степени 2-й степени 3-й степени |
9 (19,1) 18 (38,3) 20 (42,6) 13 (27,7) 6 (12,8) 1 (2,1) |
26 (27,6) 39 (41,5) 29 (30,9) 23 (24,5) 6 (6,4) 0 (0) |
0,328 |
|
Максимальный уровень глюкозы при случайном определении во время госпитализации, ммоль/л |
10,0 [ 7,8; 12,9] |
8,4 [ 6,6; 10,8] |
0,019 |
|
Уровень гликемии выше 11,0 ммоль/л при cлучайном определении во время госпитализации, n (%) |
18 (38,2) |
20 (21,2) |
0,032 |
|
СРБ, мг/л |
92,2 [ 40,4; 135] |
44,2 [ 23,2; 103] |
0,007 |
|
Ферритин, нг/мл |
634 [ 205; 874] |
424 [ 263; 700] |
0,448 |
|
ЛДГ, Ед/л |
262 [ 209; 359] |
231 [ 201; 289] |
0,110 |
|
Получали инсулин, n (%) |
13 (27,6) |
20 (21,2) |
0,335 |
|
Получали МАБы, n (%) |
11 (23,4) |
24 (25,5) |
0,725 |
|
Получали ГКС, n (%) |
41 (87,2) |
80 (85,1) |
0,606 |
|
Суммарная доза*, мг |
157 [ 94; 277] |
231 [ 131; 350] |
0,075 |
|
Процент поражения легких по КТ, % |
30 [ 21; 45] |
32 [ 20; 45] |
0,950 |
|
Степень по КТ, n (%) 0 1 2 3 4 |
1 (2,1) 17 (36,2) 21 (44,7) 7 (14,9) 1 (2,1) |
1 (1,1) 32 (34,0) 47 (50,0) 10 (10,6) 4 (4,3) |
0,845 |
|
Койко-дни, дни |
15 [ 12; 16] |
14 [ 12; 18] |
0,814 |
Примечание: НУО — нарушения углеводного обмена;
ИМТ — индекс массы тела;
СРБ — С-реактивный белок;
ЛДГ — лактатдегидрогеназа;
МАБы — препараты моноклональных антител;
ГКС — глюкокортикостероиды;
* — доза ГКС представлена в перерасчете на дексаметазон;
КТ — компьютерная томография.
Как видно из представленных в табл. 3 данных, в остром периоде COVID-19 пациенты не различались по ИМТ (р=0,124). В то же время, при сопоставлении данных лабораторного исследования больных в остром периоде COVID-19, у больных с НУО был выше уровень СРБ (р=0,007), однако значения концентраций других острофазных белков были одинаковы (р>0,05). Необходимо отметить, что больные были сопоставимы по степени поражения легочной ткани и длительности госпитализации, а также суммарной дозе ГКС, полученной за время госпитализации (р=0,075).
Анализ уровня гликемии во время госпитализации позволил выявить более высокие максимальные значения концентрации глюкозы в плазме крови при случайном определении у больных с НУО по сравнению с больными с нормальным уровнем глюкозы в постковидном периоде: 10,0 [ 7,8; 12,9] ммоль/л и 8,4 [ 6,6; 10,8] ммоль/л (р=0,019) соответственно и более частую встречаемость гликемии выше 11,1 ммоль/л при случайном определении, чем у больных без НУО (р=0,032). При анализе терапии не было выявлено различий в дозах ГКС, получаемых больными за время госпитализации (р=0,075).
По результатам корреляционного анализа выявлена положительная связь между значением индекса HOMA-IR и ИМТ у больных как в остром (р<0,001; r=0,389), так и в постковидном периоде (r=0,412; р<0,001). Уровень HbA1с положительно коррелировал со значением ИМТ как в остром периоде COVID-19 (р=0,019, r=0,202), так и в постковидном периоде (r=0,242; р=0,004).
Результаты морфологического исследования
Медиана возраста умерших больных составила 73 [ 65; 82] года, среди исследуемой группы 86 были мужчинами (43,7%). При гистологическом исследовании ткани ПЖ у 43 пациентов выявлены признаки хронического панкреатита, вне обострения.
Получены отличия по частоте некроза ПЖ у пациентов, умерших во 2-ю и 3-ю волну госпитализации: фокусы некроза были выявлены у 6 из 129 пациентов 2-й волны (4,7%) и 8 из 81 пациента 3 волны (9,9%). Белковое содержимое в протоках ПЖ было обнаружено у 16 из 129 пациентов 2-й волны (12,4%) и 17 из 81 пациента 3-й волны (21%). Расширенные протоки выявлены у 23 из 129 пациентов 2-й волны (17,8%) и 16 из 81 пациента 3-й волны (19,8%).
Выявлена положительная корреляционная связь между возрастом пациента и степенью липоматоза, фиброза, суммарного показателя липоматоза и фиброза, а также степени хронического повреждения. Таким образом, липоматоз являлся не столько специфическим показателем альтерации ПЖ, сколько показателем дегенеративно-дистрофического процесса, прогрессирующего с возрастом.
При ИГХ-исследовании ткани ПЖ выявлено окрашивание клеток островков Лангерганса антителами к SARS-CoV-2 spike protein, DPP4 и ACE2. Доля к SARS-CoV-2 spike protein позитивных клеток островков Лангерганса пациентов 2-й волны составила 1,85 [ 0–15,4]%, 3-й волны — 11,1 [ 5,3–14,8]%. Доля ACE2 позитивных клеток островков Лангерганса пациентов 2-й волны: 0,4 [ 0–1,7]%, 3-й волны — 0%. Доля DPP4 позитивных клеток островков Лангерганса пациентов 2-й волны: 0,5 [ 0–0,8]%, 3-й волны — 0 [ 0–0,4]% (рис. 3). При сравнении значений не выявлено значимых различий в экспрессии SARS-CoV-2 spike protein, DPP4 и ACE2 между пациентами 2-й и 3-й волн. Экспрессия SARS-CoV-2 spike protein, DPP4 и ACE2 в экзокринной части ПЖ в среднем не превышала 1% клеток.

Рисунок 3. А) Цитоплазматическое окрашивание клеток
эндокринной части поджелудочной железы SARS-CoV-2 spike protein;
Б) цитоплазматическое мелкогранулярное окрашивание
эндокринной части поджелудочной железы ACE2;
В) цитоплазматическое мелкогранулярное окрашивание
эндокринной части поджелудочной железы DPP4
Дополнительно, произведено иммунофлуоресцентное исследование с двойной меткой, результаты которого позволили выявить ко-локализацию инсулина-SARS-CoV-2 spike protein, инсулина-DPP4 и инсулина-ACE2 (рис. 4).
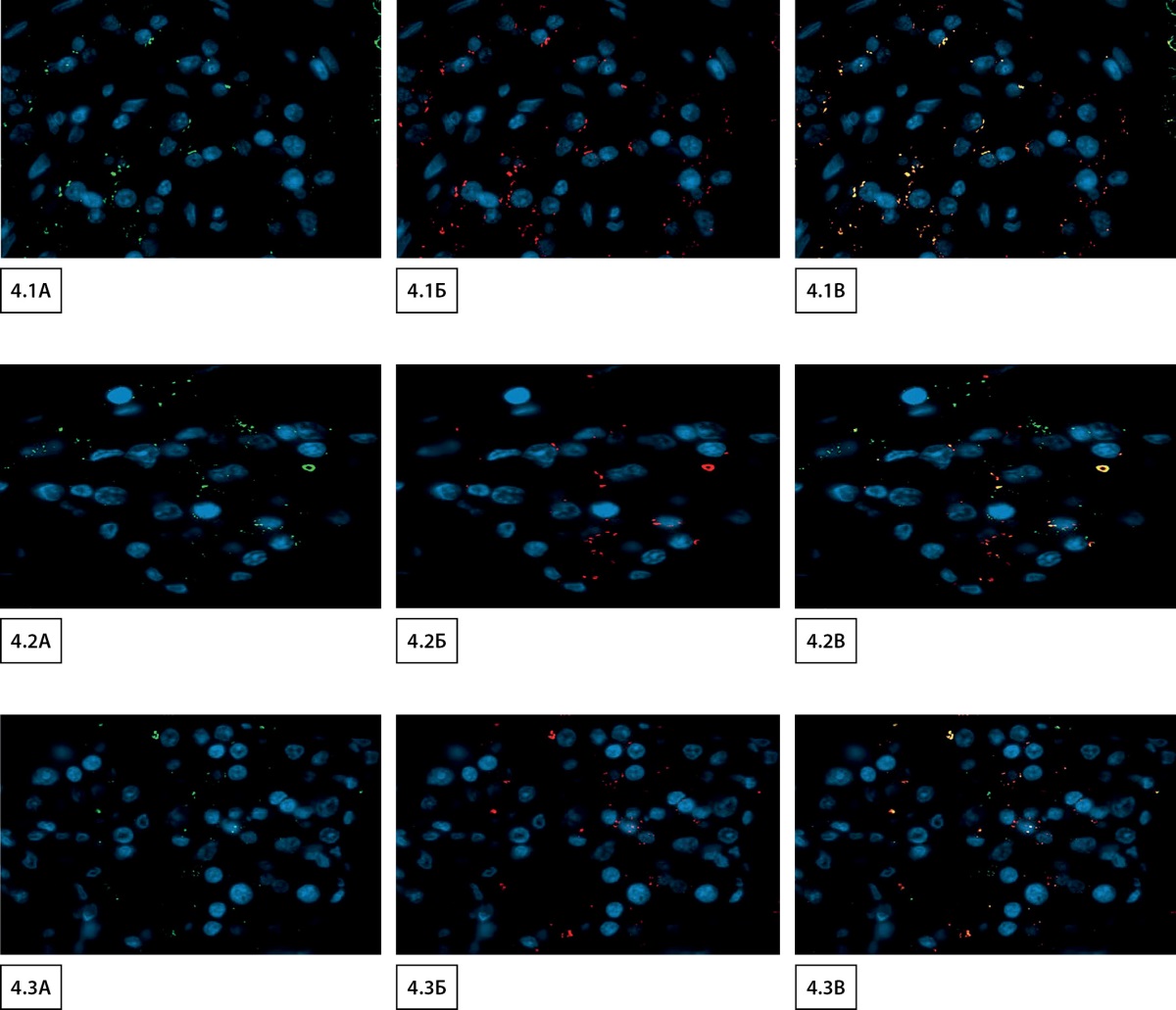
Рисунок 4. Флуоресцентная микроскопия с двойной меткой,
увеличение х680:
4.1 Экспрессия SARS-CoV-2 spike protein
в эндокринной части поджелудочной железы:
А) зеленый сигнал — распределение антитела SARS-CoV-2 spike protein;
Б) красный сигнал — распределение антитела к инсулину;
В) желтый сигнал — ко-локализация SARS-CoV-2 и инсулина.
4.2. Экспрессия DPP4 в эндокринной части поджелудочной железы:
А) зеленый сигнал — распределение антитела ACE2;
Б) красный сигнал — распределение антитела к инсулину;
В) желтый сигнал — ко-локализация ACE2 и инсулина.
4.3. Экспрессия SARS-CoV-2 spike protein, DPP4 и ACE2
в эндокринной части поджелудочной железы:
А) зеленый сигнал — распределение антитела DPP4;
Б) красный сигнал — распределение антитела к инсулину;
В) желтый сигнал — ко-локализация DPP4 и инсулина.
ОБСУЖДЕНИЕ
На сегодняшний день накоплено и систематизировано большое количество данных, отражающих повышение риска и встречаемости НУО в постковидном периоде. Так, по данным метаанализа T. Zhang и соавт., включившего 40 млн участников и 200 000 случаев выявленного СД, отмечен повышенный в 1,62 [ 1,45–1,80] раза относительный риск развития СД после перенесенного COVID-19 в разные временные сроки [18]. Аналогичные результаты были получены в ретроспективном когортном анализе, проведенном в Германии и включившем данные 35 865 пациентов в постковидном периоде с медианой наблюдения 119 дней. Было выявлено, что у лиц с перенесенным COVID-19 наблюдалась повышенная заболеваемость СД 2 типа по сравнению с пациентами, перенесшими другие ОРВИ верхних дыхательных путей (15,8 против 12,3 на 1000 человеко-лет) [19]. Интересными представляются и данные проспективного исследования B.Y. Keerthi и соавт.: из ста пациентов без ранее известного СД в анамнезе в остром периоде COVID-19 у 42% были выявлены НУО, а в группе без НУО у 10,3% спустя 3 мес после выписки из стационара развился предиабет, а у 13,8% больных — СД 2 типа [20].
Говоря о результатах отечественных исследований, при проспективном наблюдении пациентов развитие СД через 52±2 недели после выписки из инфекционного стационара зарегистрировано у 7,24% всех обследованных больных без СД в анамнезе [21].
В настоящем проспективном исследовании при наблюдении в динамике спустя 6–18 мес после выписки у лиц без известных на момент госпитализации НУО отмечены случаи впервые выявленного СД 2 типа (6,3%), а также высокая встречаемость отклонений показателей углеводного обмена от нормальных значений как по критериям AДA (59,6%), так и по критериям ВОЗ (26,9%). Учитывая патогенез СД 2 типа, логично предположить, что для больных с НУО должна быть характерна инсулинорезистентность. Однако, несмотря на более высокий уровень базального инсулина и значение индекса HOMA-IR у пациентов с НУО, лишь у 40,4% из них индекса HOMA-IR превышал 2,7, а у остальных 60% показатель находился в пределах нормальных значений. Учитывая тот факт, что у больных с последующим появлением НУО степень тяжести COVID-19, длительность госпитализации и даже суммарная доза ГКС не отличались от данных показателей у лиц с нормальным уровнем глюкозы, целесообразен поиск дополнительных механизмов развития гипергликемии.
В связи с этим, был проанализирован морфологический материал пациентов, умерших в острый период COVID-19. Полученные нами результаты свидетельствуют об экспрессии SARS-CoV-2 spike protein в эндокринной части ПЖ и подтверждаются мировыми данными. Так, SARS-CoV-2 был идентифицирован в островках Лангерганса не только ИГХ-методом, но и с помощью методов RT-PCR, электронной микроскопии и гибридизации in situ [4][5][22]. В то же время на сегодняшний день нет окончательной позиции относительно экспрессии ACE2 и DPP4 и других составляющих рецепторного аппарата, способствующих интернализации эндокринной части ПЖ вирусом [8–11][23]. Согласно полученным нами данным, экспрессия трансмембранных переносчиков ACE2 и DPP4 в островках Лангерганса была представлена минимально. В то же время, выявленная ко-локализация SARS-CoV-2 spike protein и его белков-переносчиков с инсулином позволяет предположить интернализацию именно эндокринного аппарата ПЖ вирусом.
Важно отметить, что все больше внимания уделяется роли и других рецепторов, выступающих в роли кофакторов для АСЕ-2 зависимого механизма проникновения вируса в клетку, а именно трансмембранной протеазе серина 2 типа (TMPRSS2), трансферриновым рецепторам (TRFC и нейропилину 1 (NRP1). Данные трансмемебранные рецепторы экспрессируются в β-клетках, по данным ряда авторов [11][24], что может объяснять тропность SARS-CoV-2 к эндокринному аппарату ПЖ.
Ассоциированное прямое цитотоксическое повреждение β-клеток, возможно, сказывается на их секреторной функции и обеспечивает отсутствие выраженной гиперинсулинемии в постковидном периоде.
Таким образом, полученные нами результаты подтверждают ранее опубликованные зарубежными авторами, свидетельствующие об экспрессии белков вируса SARS-CoV-2 в ПЖ, и апоптозе β-клеток, ассоциированном с прямым поражением эндокринного аппарата [7][8][9]. Дополнительно к вышесказанному, иммунологические сдвиги и гиперцитокинемия, характерные для острого периода COVID-19, могут представлять собой дополнительные важные факторы, приводящие к развитию инсулинорезистентности, гиперстимуляции β-клеток с последующей их дисфункцией [25][26]. Однако механизмы повреждения островков Лангерганса при новой коронавирусной инфекции, вызванной SARS-CoV-2, остаются до конца не изученными и требуют проведения дальнейших исследований.
Ограничения исследования
Одним из ограничений исследования можно считать отсутствие данных об уровне HbA1c в острый период COVID-19, а также концентрации инсулина в сыворотке крови до начала и на фоне терапии ГКС. Дополнительно, в данном исследовании в постковидном периоде не проводился пероральный глюкозотолерантный тест, использование которого могло повлиять на показатели встречаемости НУО.
ЗАКЛЮЧЕНИЕ
Полученные в ходе проведенного исследования данные указывают на высокую встречаемость НУО в отдаленном периоде COVID-19, патогенез которых, вероятно, имеет многофакторный характер и требует детального изучения. В частности, развитие нарушений метаболизма глюкозы может быть обусловлено как прямым цитотоксическим действием SARS-CоV-2, так и иммунопосредованной гиперстимуляцией β-клеток с развитием в последующем их дисфункции. Дополнительно, нельзя исключить и вклад терапии ГКС в развитие инсулинорезистентности и глюкозотоксичности, что диктует необходимость проведения дальнейших проспективных исследований с целью усовершенствования подходов комплексной терапии COVID-19.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2022-301 от 20.04.2022).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Участие авторов. Каронова Т.Л. — разработка концепции исследования, финальное редактирование текста; Митрофанова Л.Б. — разработка концепции исследования, анализ морфологичсексого материала, редактирование текста; Михайлова А.А., Лагутина Д.И., — сбор литературного материала, сбор и анализ научного материала, написание текста; Воробьева О.М. — сбор и обработка научного материала, написание текста; Воробьева О.М. — сбор и обработка гистологического материала, морфометрия, статистический анализ написание текста; Григорьева Д.О., Стерхова К.А. — морфометрия; Малько В.А., Михеева А.Г. — сбор научного материала, написание текста; Шляхто Е.В. — разработка концепции исследования.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы
Список литературы
1. Gorbalenya AE, Baker SC, Baric RS, et al. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol. 2020;5(4):536-544. doi: https://doi.org/10.1038/s41564-020-0695-z
2. Clarke SA, Abbara A, Dhillo WS. Impact of COVID-19 on the Endocrine System: A Mini-review. Endocrinology. 2022;163(1):bqab203. doi: https://doi.org/10.1210/endocr/bqab203
3. Mirza SA, Sheikh AAE, Barbera M, et al. COVID-19 and the endocrine system: A review of the current information and misinformation. Infect Dis Rep. 2022;14(2):184-197. doi: https://doi.org/10.3390/idr14020023
4. Millette K, Cuala J, Wang P, et al. SARS-CoV2 infects pancreatic beta cells in vivo and induces cellular and subcellular disruptions that reflect beta cell dysfunction. Preprint. Res Sq. 2021;rs.3.rs-592374. doi: https://doi.org/10.21203/rs.3.rs-592374/v1
5. Coate KC, Cha J, Shrestha S, et al. SARS-CoV-2 Cell entry factors ACE2 and TMPRSS2 are expressed in the microvasculature and ducts of human pancreas but are not enriched in β cells. Cell Metab. 2020;32(6):1028-1040.e4. doi: https://doi.org/10.1016/j.cmet.2020.11.006
6. Yang L, Han Y, Nilsson-Payant BE, et al. A human pluripotent stem cell-based platform to study SARS-CoV-2 tropism and model virus infection in human cells and organoids. Cell Stem Cell. 2020;27(1):125-136.e7. doi: https://doi.org/10.1016/j.stem.2020.06.015
7. Yang JK, Lin SS, Ji XJ, Guo LM. Binding of SARS coronavirus to its receptor damages islets and causes acute diabetes. Acta Diabetol. 2010;47(3):193-199. doi: https://doi.org/10.1007/s00592-009-0109-4
8. Liu F, Long X, Zhang B, et al. ACE2 expression in pancreas may cause pancreatic damage after SARS-CoV-2 infection. Clin Gastroenterol Hepatol. 2020;18(9):2128-2130.e2. doi: https://doi.org/10.1016/j.cgh.2020.04.040
9. Fignani D, Licata G, Brusco N, et al. SARS-CoV-2 receptor angiotensin I-converting enzyme type 2 (ACE2) is expressed in human pancreatic β-Cells and in the human pancreas microvasculature. Front Endocrinol (Lausanne). 2020;(11). doi: https://doi.org/10.3389/fendo.2020.596898
10. Coate KC, Cha J, Shrestha S, et al. SARS-CoV-2 cell entry factors ACE2 and TMPRSS2 are expressed in the microvasculature and ducts of human pancreas but are not enriched in β cells. Cell Metab. 2020;32(6):1028-1040.e4. doi: https://doi.org/10.1016/j.cmet.2020.11.006
11. Steenblock C, Richter S, Berger I, et al. Viral infiltration of pancreatic islets in patients with COVID-19. Nat Commun. 2021;12(1):3534. doi: https://doi.org/10.1038/s41467-021-23886-3
12. Cure E, Cumhur Cure M. COVID-19 may affect the endocrine pancreas by activating Na+/H+exchanger 2 and increasing lactate levels. J Endocrinol Invest. 2020;43(8):1167-1168. doi: https://doi.org/10.1007/s40618-020-01307-4
13. Lambeir AM, Durinx C, Scharpé S, De Meester I. Dipeptidyl-peptidase IV from bench to bedside: an update on structural properties, functions, and clinical aspects of the enzyme DPP IV. Crit Rev Clin Lab Sci. 2003;40(3):209-294. doi: https://doi.org/10.1080/713609354
14. Drucker DJ. Coronavirus infections and type 2 diabetesshared pathways with therapeutic implications. Endocr Rev. 2020;41(3):bnaa011. doi: https://doi.org/10.1210/endrev/bnaa011
15. Rubino F, Amiel SA, Zimmet P, et al. New-onset diabetes in Covid-19. N Engl J Med. 2020;383(8):789-790. doi: https://doi.org/10.1056/NEJMc2018688
16. Rey-Reñones C, Martinez-Torres S, Martín-Luján FM, et al. Type 2 diabetes mellitus and COVID-19: A narrative review. Biomedicines. 2022;10(9):2089. doi: https://doi.org/10.3390/biomedicines10092089
17. Govender N, Khaliq OP, Moodley J, Naicker T. Insulin resistance in COVID-19 and diabetes. Prim Care Diabetes. 2021;15(4):629-634. doi: https://doi.org/10.1016/j.pcd.2021.04.004
18. Huang C, Huang L, Wang Y, et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021;397(10270):220-232. doi: https://doi.org/10.1016/S0140-6736(20)32656-8
19. Zhang T, Mei Q, Zhang Z, et al. Risk for newly diagnosed diabetes after COVID-19: a systematic review and meta-analysis. BMC Med. 2022;20(1):444. doi: https://doi.org/10.1186/s12916-022-02656-y
20. Rathmann W, Kuss O, Kostev K. Incidence of newly diagnosed diabetes after Covid-19. Diabetologia. 2022;65(6):949-954. doi: https://doi.org/10.1007/s00125-022-05670-0
21. Shestakova M, Kononenko I, Kalmykovа Z, et al. Glycated hemoglobin level dynamics in COVID-19 survivors: 12 months follow-up study after discharge from hospital. PLoS One. 2022;17(11):e0275381. doi: https://doi.org/10.1371/journal.pone.0275381
22. Millette K, Cuala J, Wang P, Marks C, et al. SARS-CoV2 infects pancreatic beta cells in vivo and induces cellular and subcellular disruptions that reflect beta cell dysfunction. Preprint. Res Sq. 2021:rs.3.rs-592374. doi: https://doi.org/10.21203/rs.3.rs-592374/v1
23. Geravandi S, Mahmoudi-Aznaveh A, Azizi Z, et al. SARS-CoV-2 and pancreas: a potential pathological interaction? Trends Endocrinol Metab. 2021;32(11):842-845. doi: https://doi.org/10.1016/j.tem.2021.07.004
24. Wu CT, Lidsky PV, Xiao Y, et al. SARS-CoV-2 infects human pancreatic β cells and elicits β cell impairment. Cell Metab. 2021;33(8):1565-1576. e5. doi: https://doi.org/10.1016/j.cmet.2021.05.013
25. Keerthi BY, Sushmita G, Khan EA, et al. New onset diabetes mellitus in post-COVID-19 patients. J Family Med Prim Care. 2022;11(10):5961-5968. doi: https://doi.org/10.4103/jfmpc.jfmpc_316
26. Montefusco L, Ben Nasr M, D’Addio F, et al. Acute and long-term disruption of glycometabolic control after SARS-CoV-2 infection. Nat Metab. 2021;3(6):774-785. doi: https://doi.org/10.1038/s42255-021-00407-6
Об авторах
Т. Л. КароноваРоссия
Каронова Татьяна Леонидовна, д.м.н., гл.н.с., профессор
Scopus Author ID: 55812730000
г. Санкт-Петербург
А. А. Михайлова
Россия
Михайлова Арина Алексеевна, клинический ординатор
197341, г. Санкт-Петербург, ул. Аккуратова, 2
Д. И. Лагутина
Россия
Лагутина Дарья Ивановна, клинический ординатор
г. Санкт-Петербург
О. М. Воробьева
Россия
Воробьева Ольга Михайловна, к.м.н., ассистент
Scopus Author ID: 57205331117
г. Санкт-Петербург
Д. О. Григорьева
Россия
Григорьева Дарья Олеговна, ординатор
г. Санкт-Петербург
К. А. Стерхова
Россия
Стерхова Ксения Анатольевна, ординатор
г. Санкт-Петербург
В. А. Малько
Россия
Малько Валерия Алексеевна, аспирант
Scopus Author ID: 57280835300
г. Санкт-Петербург
А. Г. Михеева
Россия
Михеева Анна Геннадьевна, аспирант
г. Санкт-Петербург
А. Т. Черникова
Россия
Черникова Алёна Тимуровна, младший научный сотрудник
г. Санкт-Петербург
Л. Б. Митрофанова
Россия
Митрофанова Любовь Борисовна, д.м.н., доцент, гл.н.с.
Scopus Author ID: 6603104513
г. Санкт-Петербург
Е. В. Шляхто
Россия
Шляхто Евгений Владимирович, д.м.н., академик РАН
Researcher ID: A-6939-2014;
Scopus Author ID: 16317213100
г. Санкт-Петербург
Дополнительные файлы
|
|
1. Рисунок 1. Характеристика нарушений углеводного обмена, выявленных в постковидном периоде у пациентов, перенесших COVID-19 средней и тяжелой степени тяжести. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(133KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Значение индекса HOMA-IR у больных с нарушениями углеводного обмена и пациентов с нормальным уровнем глюкозы плазмы крови. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(85KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. А) Цитоплазматическое окрашивание клеток эндокринной части поджелудочной железы SARS-CoV-2 spike protein; Б) цитоплазматическое мелкогранулярное окрашивание эндокринной части поджелудочной железы ACE2; В) цитоплазматическое мелкогранулярное окрашивание эндокринной части поджелудочной железы DPP4 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(567KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Флуоресцентная микроскопия с двойной меткой, увеличение х680: 4.1 Экспрессия SARS-CoV-2 spike protein в эндокринной части поджелудочной железы: А) зеленый сигнал — распределение антитела SARS-CoV-2 spike protein; Б) красный сигнал — распределение антитела к инсулину; В) желтый сигнал — ко-локализация SARS-CoV-2 и инсулина. 4.2. Экспрессия DPP4 в эндокринной части поджелудочной железы: А) зеленый сигнал — распределение антитела ACE2; Б) красный сигнал — распределение антитела к инсулину; В) желтый сигнал — ко-локализация ACE2 и инсулина. 4.3. Экспрессия SARS-CoV-2 spike protein, DPP4 и ACE2 в эндокринной части поджелудочной железы: А) зеленый сигнал — распределение антитела DPP4; Б) красный сигнал — распределение антитела к инсулину; В) желтый сигнал — ко-локализация DPP4 и инсулина. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(401KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Каронова Т.Л., Михайлова А.А., Лагутина Д.И., Воробьева О.М., Григорьева Д.О., Стерхова К.А., Малько В.А., Михеева А.Г., Черникова А.Т., Митрофанова Л.Б., Шляхто Е.В. Нарушения углеводного обмена, ассоциированные с COVID-19: клинико-морфологическое исследование. Сахарный диабет. 2023;26(6):515-525. https://doi.org/10.14341/DM13041
For citation:
Karonova T.L., Mikhailova A.A., Lagutina D.I., Vorobeva O.M., Grigoreva D.O., Sterkhova K.A., Malko V.A., Mikheeva A.G., Chernikova A.T., Mitrofanova L.B., Shlyakhto E.V. Glucose metabolism disorders associated with COVID-19: clinical and morphological study. Diabetes mellitus. 2023;26(6):515-525. (In Russ.) https://doi.org/10.14341/DM13041
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































