Перейти к:
Эффективность и безопасность инициации терапии агонистами рецепторов глюкагоноподобного пептида-1 у пациентов с сахарным диабетом 2 типа, госпитализированных с коронавирусной инфекцией
https://doi.org/10.14341/DM13015
Аннотация
ОБОСНОВАНИЕ. Актуальной задачей системы здравоохранения остается поиск новых эффективных методов лечения и профилактики коронавирусной инфекции (COVID-19) у пациентов с сахарным диабетом 2 типа (СД2). По данным литературы, препараты из группы агонистов рецепторов глюкагоноподобного пептида-1 (арГПП-1) продемонстрировали ряд противовоспалительных эффектов.
ЦЕЛЬ. Оценить эффективность и безопасность инициации терапии арГПП-1 у пациентов с СД2, госпитализированных с COVID-19.
МЕТОДЫ. В исследование включены пациенты с СД2, индексом массы тела (ИМТ) >27 кг/м² и подтвержденной COVID-19. Основную группу составили пациенты, которым инициирована терапия дулаглутидом 1,5 мг в неделю (n=53), группу контроля — больные, получавшие сахароснижающую терапию без арГПП-1 (n=50). Оценивали влияние терапии на углеводный обмен, лабораторные и клинические показатели, исход COVID-19 и безопасность терапии (гипогликемические явления, побочные эффекты).
РЕЗУЛЬТАТЫ. В сравниваемых группах не выявлено различий в степени снижения уровня гликемии: глюкоза плазмы натощак (ГПН) на 7-й день — 8,2 [6,0; 9,8] ммоль/л vs 8,1 [6,5; 9,8] ммоль/л (р=0,935), среднесуточная гликемия
(ССГ) — 9,7 [8,3; 11,8] ммоль/л vs 11,1 [8,7; 12,8] ммоль/л (p=0,182). Терапия дулаглутидом благоприятно влияла на маркеры воспаления: С-реактивный белок (СРБ) (15,8 vs 24,4 мг/л, р=0,035), уровень лактатдегидрогеназы (ЛДГ) (261,6 vs 326,1 ЕД/л, р=0,016) и уровень лимфоцитов (1,2 vs 0,9 × 109/л, р=0,049). Старт терапии арГПП-1 оказал положительный эффект на клинические показатели: сатурацию (96% vs 93%, р=0,05), необходимость оксигенотерапии (37,3% vs 60,4%, р=0,021) и риск тяжелого течения по шкале NEWS2 (1 балл vs 3 балла, р=0,021). Частота летального исхода в группе, получающей арГПП-1, в 3,5 раза ниже по сравнению с группой контроля (5,7% vs 20,0%, р=0,038). Инициация терапии дулаглутидом у пациентов с СД2, госпитализированных с COVID-19, снижала шанс летального исхода и перевода на искусственную вентиляцию легких в 4,2 раза при сравнении с контрольной группой (ОШ=0,24, 95% ДИ 0,062–0,931). Терапия арГПП-1 у пациентов с COVID-19 и СД2 является безопасной в отношении гипогликемических явлений и побочных эффектов.
ЗАКЛЮЧЕНИЕ. Инициация терапии арГПП-1 приводит к снижению ГПН и ССГ, сопоставимому с контрольной группой. Старт терапии арГПП-1 у госпитализированных пациентов с COVID-19 и СД2 снижает шанс летального исхода, благоприятно влияя на лабораторные (СРБ, ЛДГ, лимфоциты) и клинические (сатурация, необходимость оксигенотерапии) показатели.
Ключевые слова
Для цитирования:
Маркова Т.Н., Лысенко М.А., Стас М.С., Анчутина А.А. Эффективность и безопасность инициации терапии агонистами рецепторов глюкагоноподобного пептида-1 у пациентов с сахарным диабетом 2 типа, госпитализированных с коронавирусной инфекцией. Сахарный диабет. 2023;26(6):537-548. https://doi.org/10.14341/DM13015
For citation:
Markova T.N., Lysenko M.A., Stas M.S., Anchutina A.A. Efficacy and safety of glucagon-like peptide-1 receptor agonists therapy initiation in patients with type 2 diabetes hospitalized with coronavirus infection. Diabetes mellitus. 2023;26(6):537-548. (In Russ.) https://doi.org/10.14341/DM13015
ОБОСНОВАНИЕ
Коронавирусная инфекция (COVID-19), вызванная вирусом SARS-CoV-2, с декабря 2019 г. стала настоящим испытанием как для медицинского сообщества, так и для населения планеты в целом. Учитывая высокую распространенность заболевания (по данным Всемирной организации здравоохранения, по состоянию на 22 января 2023 г. зарегистрировано более 664 млн подтвержденных случаев и более 6,7 млн случаев смерти), система здравоохранения продолжает поиск новых методов лечения и профилактики COVID-19 [1]. Известно, что существуют определенные группы населения, подверженные более тяжелому течению COVID-19 и имеющие высокий риск госпитализации и летального исхода, к которым относятся пациенты, страдающие хроническими заболеваниями, в том числе сахарным диабетом (СД). Так, метаанализ 18 исследований показал, что общая распространенность СД среди пациентов с COVID-19 составляет 11,5%, при этом диабет был связан с высоким риском тяжелого течения COVID-19 по сравнению с пациентами без СД [2]. По данным разных авторов, СД 2 типа (СД2) увеличивает риск летального исхода у больных с COVID-19 в несколько раз по сравнению с общей популяцией [3][4]. Н.Г. Мокрышевой и соавт. проведен анализ летальности за 2020–2022 гг. среди пациентов с СД, перенесших COVID-19. Согласно полученным данным, среди 337 991 пациентов смертность составила 17,1% (СД1 — 8,8%; СД2 — 17,5%) [5]. В когортном исследовании населения Шотландии на 1 марта 2020 г. (n=5 463 300) 319 349 человек страдали диабетом (5,8%), 1082 человека (0,3%) из которых на 31 июля 2020 г. заболели COVID-19 со смертельным исходом или переводом в отделение реанимации и интенсивной терапии (ОРИТ), тогда как среди населения без диабета смертельный исход/перевод в ОРИТ развился у 4081 (0,1%) из 5 143 951 человек [6]. Также факторами риска повышенной смертности от COVID-19 признаны мужской пол, пожилой возраст, почечная недостаточность, не европеоидная этническая принадлежность, социально-экономическое состояние, перенесенный инсульт и сердечная недостаточность [7].
Известно, что гипергликемия является независимым фактором риска тяжелого течения COVID-19 как у пациентов с СД, так и без такового, при этом выявлено как прямое, так и опосредованное влияние вируса SARS-CoV-2 на бета-клетки поджелудочной железы, что усложняет достижение целевых показателей гликемии [8]. Согласно решению совета экспертов Российской Ассоциации Эндокринологов по выбору антигипергликемической терапии в зависимости от тяжести течения COVID-19, при среднетяжелом течении заболевания возможно использование с осторожностью всех гипогликемических препаратов неинсулинового ряда (кроме тиазолидиндионов), а при тяжелом и крайне тяжелом течении рекомендован переход на инсулинотерапию [9].
Результаты различных исследований продемонстрировали ряд эффектов агонистов рецепторов глюкагоноподобного пептида-1 (арГПП-1), которые могли бы повлиять на течение и исходы COVID-19. Так, обнаружен антиапоптотический и противовоспалительный эффекты, которые могут реализоваться через различные внутриклеточные сигнальные пути. Одним из путей является подавление арГПП-1 апоптоза бета-клеток поджелудочной железы путем активации фосфатидилинозитол-3-киназы (PI3K), протеинкиназы C типа дзета (PRKCZ) и протеинкиназы B (PKB), приводящей к ингибированию транскрипционного ядерного фактора κB и активации каспаз (каспаза 8 и каспаза 1), участвующих в продукции таких провоспалительных цитокинов, как интерлейкин-1-β и фактор некроза опухоли α (ФНО-α) (рис. 1) [10–12]. При этом подавление транскрипционного ядерного фактора κB, протеинкиназы С типа α и никотинамидадениндинуклеотидфосфат-оксидазы (НАДФ-оксидазы) оказывает антиоксидантный эффект в эндотелиальных клетках сосудов, что ингибирует воспаление и окислительные реакции [13]. В метаанализе 40 рандомизированных клинических исследований J.J.H. Bray и соавт. (2021) отмечают значительное снижение уровней С-реактивного белка (СРБ), ФНО-α и малонового диальдегида (маркер оксидативного стресса) у пациентов с СД2 (без COVID-19), получающих арГПП-1 по сравнению с прочей сахароснижающей терапией и плацебо [14].
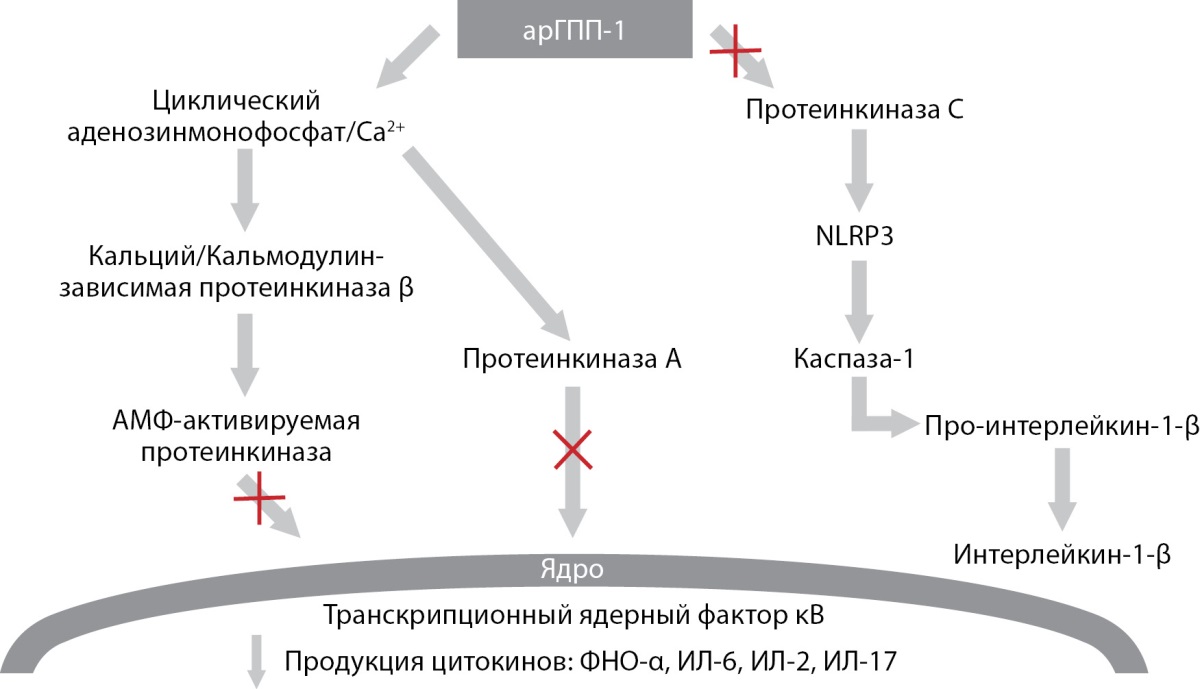
Рисунок 1. Противовоспалительный и антиапоптотический эффекты
агонистов рецепторов глюкагоноподобного пептида-1.
Адаптировано из «Anti-Inflammatory Effects of GLP-1-Based Therapies
beyond Glucose Control» Lee YS, Jun HS [ 15].
Примечание. NLRP3 — инфламмасома, нуклеотид-связывающий
домен-рецептор и белок-адаптер с доменом 3,
ФНО-α — фактор некроза опухоли α,
ИЛ — интерлейкин.
АрГПП-1, связываясь с рецептором ГПП-1, блокирует протеинкиназу С
или активацию транскрипционного ядерного фактора κB
и последующую экспрессию NLRP3, ИЛ1-β, ФНО-α, ИЛ-6.
Известно, что вирус SARS-CoV-2 оказывает непосредственное действие на дыхательную систему, вызывая пневмонию и уменьшая уровень сурфактанта, что в итоге может привести к развитию острого повреждения легких и острого респираторного дистресс-синдрома [16]. Имеются данные о благоприятном влиянии арГПП-1 на альвеолоциты 2 типа: так, инкретины могут воздействовать на протеинкиназу А и протеинкиназу C, стимулирующие продукцию фосфатидилхолина, что увеличивает секрецию сурфактанта в легочной ткани [17].
На сегодня достаточно работ, оценивших влияние догоспитального применения арГПП-1 на риск госпитализации, перевода в ОРИТ, использования инвазивной искусственной вентиляции легких (ИВЛ) и смертности от COVID-19, однако данные о влиянии инициации терапии арГПП-1 при верификации COVID-19 отсутствуют. В связи с этим целью нашего исследования является оценка эффективности и безопасности инициации арГПП-1 как компонента патогенетической и гипогликемизирующей терапии у госпитализированных пациентов с СД2 и COVID-19.
ЦЕЛЬ
Оценить эффективность и безопасность (влияние на компенсацию углеводного обмена, лабораторные показатели, клиническое течение и исход) инициации терапии арГПП-1 у пациентов с СД2, госпитализированных по поводу COVID-19.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
С июля 2021 г. по февраль 2022 г. на базе ГБУЗ г. Москвы «ГКБ №52» проведено наблюдательное одноцентровое ретроспективное сравнительное исследование госпитализированных пациентов с подтвержденной COVID-19 (методом полимеразной цепной реакции (ПЦР) и по данным компьютерной томографии) среднетяжелого и тяжелого течения, в возрасте от 18 до 85 лет (n=103), имеющих в анамнезе СД2 (рис. 2). Выборка формировалась сплошным отбором.

Рисунок 2. Дизайн исследования.
Примечание:
АрГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1,
СРБ — С-реактивный белок,
АЛТ — аланинаминотрансфераза,
АСТ — аспартатаминотрансфераза,
ЛДГ — лактатдегидрогеназа,
NEWS — шкала оценки тяжести состояния пациента,
АД — артериальное давление,
ЧСС — частота сердечных сокращений,
ЧДД — частота дыхательных движений,
ОРИТ — отделение реанимации и интенсивной терапии,
ИВЛ — искусственная вентиляция легких,
ПЦР — полимеразная цепная реакция,
КТ 1–3 — степень поражения легочной ткани
по данным компьютерной томографии,
иДПП-4 — ингибиторы дипептидилпептидазы 4,
иНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера 2-го типа.
Критерии соответствия
Критерии включения: ПЦР-положительный результат исследования мазка из носо- и ротоглотки на вирус SARS-CoV-2, возраст от 18 до 85 лет, наличие в анамнезе СД2, наличие признаков вирусной пневмонии по данным компьютерной томографии органов грудной клетки (КТ ОГК), индекс массы тела (ИМТ) более 27,0 кг/м², отмена препаратов (ингибиторы дипептидилпептидазы-4 (иДПП-4), ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2)) в связи с повышенным риском диабетического кетоацидоза. Критерии исключения: возраст менее 18 лет, беременность, медуллярный рак щитовидной железы в анамнезе (в том числе в семейном), множественная эндокринная неоплазия 2 типа, почечная недостаточность тяжелой степени (клиренс креатинина менее 30 мл/мин), печеночная недостаточность тяжелой степени, хроническая сердечная недостаточность IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркской кардиологической ассоциации)), острый панкреатит, желудочно-кишечные расстройства в виде тяжелой диареи и рвоты.
Условия проведения
Исследование проведено на базе ГБУЗ «ГКБ № 52» ДЗМ, перепрофилированной для оказания помощи пациентам с COVID-19, включены пациенты из эндокринологического, терапевтического и кардиологического отделений.
Продолжительность исследования
Период наблюдения — 01.07.2021–28.02.2022 гг. Пациенты находились под наблюдением в период госпитализации. В исследуемых группах оценивались изучаемые параметры при поступлении и далее в двух контрольных точках: на 3-и и 7-е сутки.
Описание медицинского вмешательства
Сбор клинико-анамнестических и лабораторных данных проводился при анализе электронных историй болезни. Изучались следующие параметры/признаки.
- Демографические и антропометрические: пол, возраст, ИМТ.
- Характеризующие коморбидность: наличие в анамнезе цереброваскулярного заболевания, инфаркта миокарда, застойной сердечной недостаточности, болезни периферических артерий, деменции, хронического заболевания легких, болезней соединительной ткани, язвенной болезни, поражения печени, сахарного диабета, гемиплегии, злокачественных опухолей, лейкемии, лимфомы, синдрома приобретенного иммунодефицита. С целью расчета выраженности сопутствующих заболеваний с помощью таблицы-калькулятора рассчитывался индекс коморбидности Charlson (CCI) [18]. Коморбидность разделили на умеренную — до 5 баллов, высокую — 6–7 баллов, очень высокую — 8 баллов и выше.
- Тяжесть состояния по шкале NEWS2 (National Early Warning Score) при поступлении, включающей следующие показатели: частота дыхательных движений (ЧДД) за 1 минуту, уровень сатурации, потребность в оксигенации, систолическое артериальное давление (САД), частота сердечных сокращений (ЧСС) в минуту, температура тела, нарушение сознания. Сумма баллов по шкале NEWS2 от 1 до 4 соответствовала низкому риску, 5–6 баллов — среднему риску, выше 7 баллов — высокому риску.
- Лабораторные показатели: при поступлении и в контрольных точках оценивали уровень глюкозы плазмы натощак (ГПН), гликемический профиль, среднесуточную гликемию (ССГ, вычисляемую по сумме уровней гликемии в течение дня, разделенной на количество измерений глюкозы), СРБ, лактатдегидрогеназы (ЛДГ), аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), лимфоцитов и D-димера.
- Инструментальная диагностика: степень поражения легких по данным КТ ОГК при поступлении и на 7-й день госпитализации. Объем поражения легких до 25% соответствовал КТ 1 степени, от 25 до 50% — КТ 2 степени, от 50 до 75% — КТ 3 степени, более 75% — КТ 4 степени.
Все пациенты получали лечение согласно актуальным временным методическим рекомендациям по профилактике, диагностике и лечению COVID-19.
Основной исход исследования
В качестве конечных точек исследования принимались: влияние на изучаемые лабораторные, клинические показатели и исходы (летальность/выживаемость, перевод в ОРИТ, использование ИВЛ).
Анализ в подгруппах
В статистический анализ включены 103 пациента, госпитализированных с COVID-19 среднетяжелого и тяжелого течения. Пациенты разделены на две группы в зависимости от получаемой сахароснижающей терапии. Первая группа (основная): 53 пациента, которым была инициирована гипогликемическая терапия, включающая арГПП-1, в течение первых 24 ч госпитализации (дулаглутид по 1,5 мг подкожно 1 раз в неделю). Вторая (контрольная) группа: 50 человек — группа контроля, получившая сахароснижающую терапию без арГПП-1.
Показаниями для назначения арГПП-1 являлись нецелевые показатели гликемии при поступлении, наличие избыточной массы тела/ожирения и отсутствие противопоказаний. Терапия арГПП-1 назначалась в дополнение к исходной сахароснижающей терапии, скорректированной с учетом тяжести состояния пациентов, госпитализированных в эндокринологическое отделение.
Методы регистрации исходов
Определение ГПН осуществлялось глюкозооксидазным методом, измерения для гликемического профиля проводились с помощью глюкометра OneTouch Verio Pro+. Содержание СРБ, АЛТ, АСТ, ЛДГ, лимфоцитов и D-димера определяли по стандартной методике.
Тяжесть заболевания и степень поражения легочной ткани по данным КТ ОГК оценивались согласно актуальным временным методическим рекомендациям по диагностике, лечению и профилактике COVID-19.
Этическая экспертиза
Согласно протоколу № 03/0322 заседания комитета по этике ГБУЗ «ГКБ №52» ДЗМ от 30 марта 2022 г., проведение исследования одобрено. Все пациенты подписали информированное согласие для участия в исследовании.
Статистический анализ
Размер выборки предварительно не рассчитывался. Данные из медицинских истории болезни были занесены в электронную базу данных Microsoft Office Excel 2017 (Microsoft Corp., США). Обработка статистических данных выполнялась с помощью программ IBM SPSS Statistics, 26 версия (SPSS: An IBM Company, США). Проводился анализ на определение нормальности распределения количественных данных, при нормальном распределении количественные показатели представлены в виде средних величин и стандартного отклонения [M±SD], при распределении, отличном от нормального, — в виде медианы и интерквартильного размаха Me [Q1; Q3], качественные — как процент (абс.). Различия количественных показателей при нормальном распределении представлены с помощью вычисления t-критерия Стьюдента, при ненормальном распределении — с помощью вычисления U-критерия Манна–Уитни, качественных показателей — с использованием критерия Хи-квадрат для таблиц вида 2×2 или точного критерия Фишера при количестве наблюдений в одной из ячеек четырехпольной таблицы <5. Для связанных совокупностей при сравнении 3 этапов использовался критерий Фридмана с post-hoc анализом (поправка на множественность сравнений, критерий Данна). Различия считались статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Количество пациентов, соответствующих критериям включения, составило 103 человека. Возраст — от 18 до 85 лет, средний возраст 62,3±8,6 года, женщины — 56,3%, мужчины — 43,7%. В основной группе мужчин — 41,5% (22 пациента), женщин — 58,5% (31 пациентка), медиана возраста составила 61 [ 56; 68] год; в контрольной группе мужчин — 46% (23 пациента), женщин — 54% (27 пациенток), медиана возраста составила 65 [ 59; 69] лет. Диагноз COVID-19-инфекции подтверждали наличием вируса SARS-CoV-2 по результатам ПЦР-теста и типичных изменений в легких по данным КТ ОГК. Все пациенты имели верифицированный СД2 (медиана продолжительности заболевания 8,5 [ 3; 14] лет). В общей когорте пациентов 96 человек (91,2%) страдали ожирением (ИМТ≥30 кг/м²). Медиана ИМТ составила 35,5 кг/м² [ 31,5; 40,0]. По данным КТ ОГК у 45,6% (47) пациентов определялась легкая степень поражения легочной ткани (КТ1), у 48,6% (50) пациентов — умеренная степень (КТ2), у 5,8% (6) пациентов — среднетяжелая степень (КТ3). Общая когорта наблюдения характеризовалась умеренным уровнем коморбидности, медиана ССI составила 5,0 [ 4,0; 6,0] балла. Исходно 81,5% (84) пациентов получали таблетированную гипогликемическую терапию, 11,7% (12) пациентов — комбинированную терапию, состоящую из пероральных сахароснижающих препаратов и инсулинотерапии, 6,8% (7) — только инсулинотерапию.
Исследуемые группы были сопоставимы по возрасту, полу, длительности СД2, ИМТ, CCI, тяжести состояния и показателям провоспалительного статуса при поступлении, догоспитальной гипогликемической терапии, стартовой патогенетической и этиологической терапии. Характеристики групп на момент поступления представлены в табл. 1.
Таблица 1. Сравнение показателей/параметров групп при поступлении
|
Показатель/параметр |
Основная группа (n=53) |
Группа контроля (n=50) |
p-value |
|
Анамнестические |
|||
|
Возраст, лет, M±SD |
61,2±9,7 |
63,6±7,2 |
рt-test=0,150 |
|
Длительность диабета, лет, Me [ Q1; Q3] |
8 [ 2; 13] |
10 [ 4; 15] |
р*=0,464 |
|
Мужской пол, абс. (%) |
22/41,5 |
23/46,0 |
рx2=0,646 |
|
Женский пол, абс. (%) |
31/58,5 |
27/54 |
рx2=0,646 |
|
ИМТ≥27 кг/м², абс. (%) |
5/9,4 |
4/8,0 |
рФ=1,000 |
|
ИМТ≥30 кг/м², абс. (%) |
48/90,6 |
46/92,0 |
рФ=1,000 |
|
ИМТ, кг/м², Me [ Q1; Q3] |
36,4 [ 33,9; 41,9] |
35,1 [ 32,7; 37,2] |
р*=0,06 |
|
Таблетированные препараты, абс. (%) |
42/79,2 |
42/84,0 |
рф=0,132 |
|
Метформин, абс. (%) |
39/73,6 |
37/74,0 |
рx2=0,962 |
|
Препараты сульфонилмочевины, абс. (%) |
15/28,3 |
13/26,0 |
рx2=0,793 |
|
иДПП-4, абс. (%) |
7/13,2 |
12/24,0 |
рФ=0,206 |
|
иНГЛТ-2, абс. (%) |
14/26,4 |
6/12 |
рФ=0,083 |
|
Комбинированная терапия, абс. (%) |
9/17,0 |
3/6,0 |
рФ=0,124 |
|
Инсулинотерапия, абс. (%) |
2/3,8 |
5/10,0 |
рФ=0,261 |
|
Наличие ГБ, абс. (%) |
51/96,2 |
44/88 |
рФ=0,153 |
|
Лабораторные |
|||
|
Гликемия при поступлении, ммоль/л, Me [ Q1; Q3] |
10,3 [ 7,06; 14,06] |
8,6 [ 6,48; 13,6] |
р*=0,296 |
|
СРБ, мг/л, Me [ Q1; Q3] |
38,3 [ 18,7; 85,3] |
56,8 [ 30,1; 103,96] |
р*=0,128 |
|
АЛТ, ЕД/л, Me [ Q1; Q3] |
28,2 [ 20,4; 43,1] |
31,2 [ 19,7; 46,6] |
р*=0,989 |
|
АСТ, ЕД/л, Me [ Q1; Q3] |
31,7 [ 24,3; 42,2] |
35,1 [ 24,9; 49,9] |
р*=0,273 |
|
ЛДГ, ЕД/л, Me [ Q1; Q3] |
280,2 [ 222,9; 337,5] |
273,7 [ 238,7; 337,7] |
р*=0,357 |
|
Лимфоциты, 10⁹/л, Me [ Q1; Q3] |
1,2 [ 0,9; 1,6] |
1,2 [ 0,8; 1,6] |
р*=0,561 |
|
D-димер, нг/мл, Me [ Q1; Q3] |
191 [ 129; 320] |
184 [ 115; 293,5] |
р*=0,261 |
|
Клинические |
|||
|
Сатурация, %, Me [ Q1; Q3] |
95 [ 92; 97] |
95 [ 92; 96] |
р*=0,559 |
|
САД, мм рт.ст., Me [ Q1; Q3] |
130 [ 120; 140] |
130 [ 120; 140] |
р*=0,792 |
|
ДАД, мм рт.ст., Me [ Q1; Q3] |
80 [ 70; 87] |
80 [ 70; 80] |
р*=0,187 |
|
ЧСС, уд/мин., Me [ Q1; Q3] |
82 [ 77; 90] |
83 [ 78; 92] |
р*=0,434 |
|
ЧДД, движений/мин, Me [ Q1; Q3] |
18 [ 17; 19] |
18 [ 17; 19] |
р*=0,447 |
|
CCI, балл, Me [ Q1; Q3] |
5 [ 3; 6] |
5 [ 4; 6] |
р*=0,262 |
|
NEWS2, балл, Me [ Q1; Q3] |
1 [ 1; 3] |
2 [ 1; 3] |
р*=0,438 |
|
КТ1, абс. (%) |
25/47,2 |
22/44,0 |
рx2=0,949 |
|
КТ2, абс. (%) |
25/47,2 |
25/50 |
рx2=0,949 |
|
КТ3, абс. (%) |
3/5,7 |
3/6,0 |
рx2=0,949 |
Примечание. Результаты представлены как медиана
(ИКР — интерквартильный размах),
среднее ±стандартное отклонение или частоты, абс (%);
рt-test — t-критерий Стьюдента,
р* — U-критерий Манна-Уитни;
рx2 — χ² Пирсона с поправкой Йейтса,
рФ — точный критерий Фишера.
ИМТ — индекс массы тела,
иДПП-4 — ингибиторы дипептидилпептидазы-4,
иНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера 2-го типа,
ГБ — гипертоническая болезнь,
СРБ — С-реактивный белок,
АЛТ — аланинаминотрансфераза,
АСТ — аспартатаминотрансфераза,
ЛДГ — лактатдегидрогеназа,
САД — систолическое артериальное давление,
ДАД — диастолическое артериальное давление,
ЧСС — частота сердечных сокращений,
ЧДД — частота дыхательных движений,
CCI — индекс коморбидности Charlson,
NEWS2 — шкала оценки тяжести состояния пациента,
КТ1 (2, 3) — объем поражения легких
по данным компьютерной томографии 1 степени (2 степени, 3 степени).
Также группы не отличались по стартовой патогенетической и этиологической терапии. Данные представлены на рис. 3.
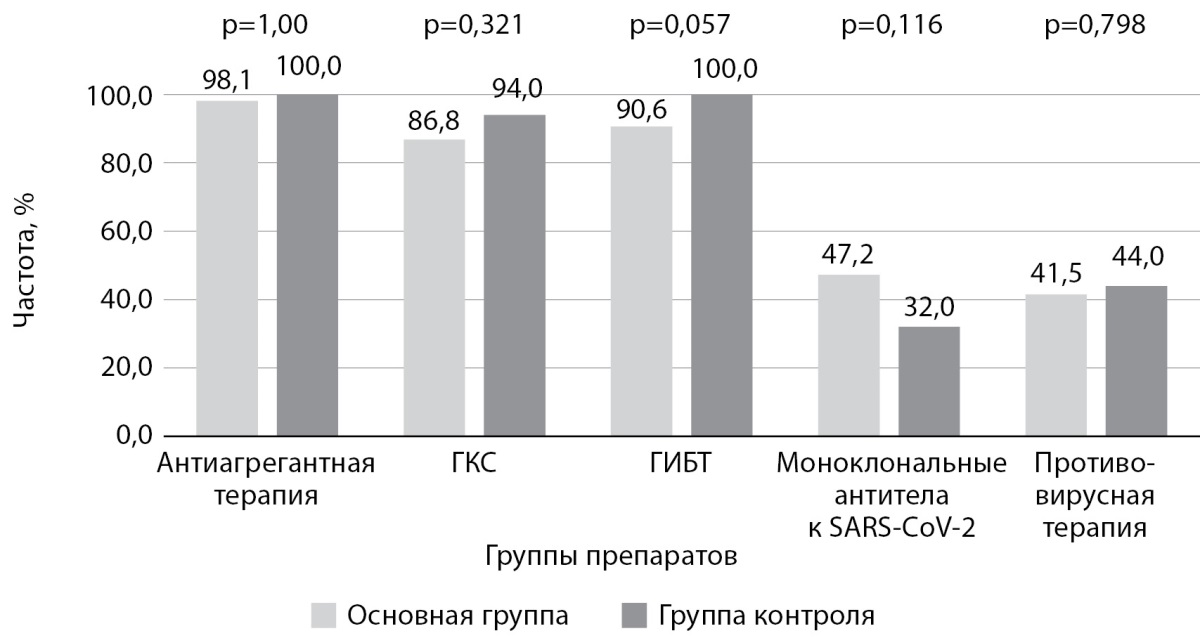
Рисунок 3. Сравнение стартовой терапии между исследуемыми группами.
Примечание. ГКС — глюкокортикостероиды,
ГИБТ — генно-инженерная биологическая терапия.
Ввиду применения стандартных доз генно-инженерных биологических препаратов (ГИБП) сравнивалась частота применения данной терапии, а не дозовый режим.
Основные результаты исследования
В группах в динамике лечения наблюдалось достоверное внутригрупповое снижение уровня гликемии: в основной группе медиана ГПН на 7-й день снизилась в 1,3 раза (11,0 vs 8,2 ммоль/л, p=0,013), отмечалось снижение уровня ССГ в 1,2 раза (11,45 vs 9,7 ммоль/л, p=0,022). Сопоставимое снижение уровня глюкозы выявлено и в группе контроля: медиана ГПН на 7-й день снижалась в 1,2 раза (9,3 vs 8,1 ммоль/л, p=0,003), однако не достигнуто статистически значимое внутригрупповое снижение уровня ССГ в динамике. Группы были сопоставимы по компенсации углеводного обмена: в 1-й день медиана ГПН в основной группе составляла 11,0 ммоль/л [ 7,4; 14,1] и 9,3 ммоль/л [ 7,4; 13,3] в группе контроля (p=0,598), на 3-й день — 9,0 ммоль/л [ 7,0; 10,7] vs 10,4 ммоль/л [ 7,7; 13,0] (р=0,131), на 7-й день — 8,2 ммоль/л [ 6,0; 9,8] vs 8,1 ммоль/л [ 6,5; 9,8] соответственно (p=0,935) (рис. 4а). Также в 1-й день ССГ в основной группе составляла 11,45 ммоль/л [ 8,7; 15,2] и 11,5 ммоль/л [ 9,1; 15,1] в контрольной группе (p=0,985), на 3-й день — 10,6 ммоль/л [ 9,1; 12,8] vs 11,2 ммоль/л [ 9,2; 14,3] (р=0,263), на 7-й день — 9,7 ммоль/л [ 8,3; 11,8] vs 11,1 ммоль/л [ 8,7; 12,8] соответственно (p=0,182) (рис. 4б).
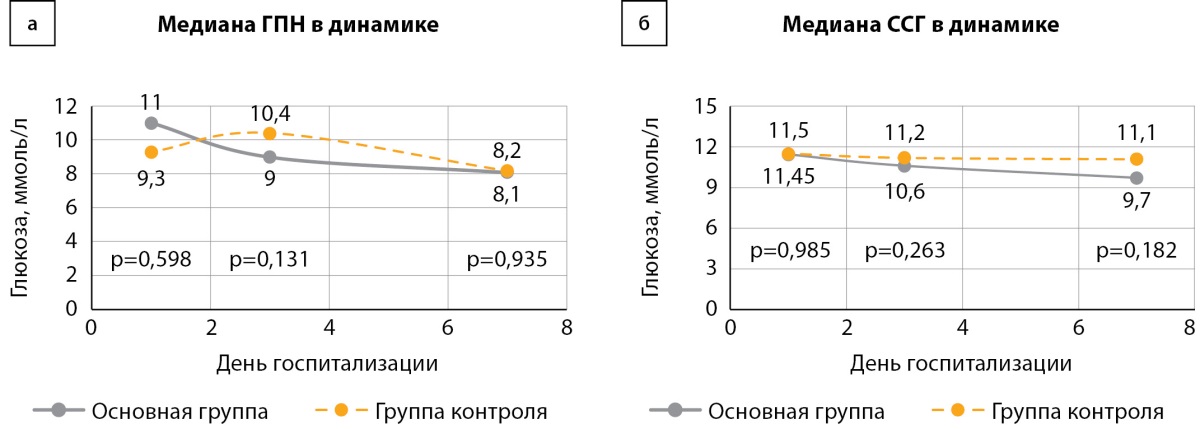
Рисунок 4. Сравнение уровня глюкозы плазмы натощак
и среднесуточной гликемии в группах в динамике.
В основной группе в ходе госпитализации 79,2% (n=42) пациентов получали инсулинотерапию, в группе контроля — 90,0% (n=45, р=0,176), при этом различий в дозе инсулина, рассчитанной на массу тела (0,52 Ед/кг vs 0,55 Ед/кг, р=0,583), в суточной потребности базисной и болюсной инсулинотерапии в исследуемых группах не выявлено (35 Ед vs 41,0 Ед, p=0,402 и 24 Ед vs 24 Ед, p=0,935 соответственно). Таким образом, вне зависимости от инициации терапии дулаглутидом, в исследуемых группах достигнута компенсация углеводного обмена.
Проведен сравнительный анализ динамики основных лабораторных показателей между группами и внутри каждой группы на 3-й и 7-й дни госпитализации (табл. 2).
Таблица 2. Динамика лабораторных показателей
|
Показатели |
Основная группа, n=53 |
Группа контроля, n=٥٠ |
р* |
|
СРБ на 3-й день, мг/л |
15,8 [ 8,82; 24,7] |
22,4 [ 12,8; 41,7] |
0,035* |
|
СРБ на 7-й день, мг/л |
2,39 [ 1,17; 4,53] |
3,41 [ 1,63; 5,97] |
0,192 |
|
АЛТ на 3-й день, ЕД/л |
34,0 [ 20,6; 45,0] |
31,1 [ 19,2; 40,8] |
0,642 |
|
АЛТ на 7-й день, ЕД/л |
50,4 [ 37,0; 83,1] |
61,3 [ 37,6; 97,1] |
0,609 |
|
АСТ на 3-й день, ЕД/л |
27,3 [ 23,4; 36,2] |
30,2 [ 22,6; 36,8] |
0,917 |
|
АСТ на 7-й день, ЕД/л |
28,3 [ 17,3; 36,3] |
32,8 [ 25,6; 46,0] |
0,076 |
|
ЛДГ на 3-й день, ЕД/л |
260 [ 219; 343] |
296,4 [ 253; 341] |
0,178 |
|
ЛДГ на 7-й день, ЕД/л |
262 [ 221; 333] |
326 [ 260; 451] |
0,016* |
|
Лимфоциты на 3-й день, 10⁹/л |
1,2 [ 0,7; 1,6] |
0,9 [ 0,7; 1,2] |
0,049* |
|
Лимфоциты на 7-й день, 10⁹/л |
1,45 [ 0,8; 1,8] |
1,3 [ 0,8; 1,7] |
0,731 |
|
D-димер на 3-й день, нг/мл |
275 [ 166; 390] |
290 [ 180; 450] |
0,289 |
|
D-димер на 7-й день, нг/мл |
275 [ 210; 495] |
450 [ 246; 771] |
0,063 |
Примечание. Данные представлены в виде медианы
и интерквартильного размаха (Me [ Q1; Q3]).
р* — U-критерий Манна–Уитни.
СРБ — С-реактивный белок,
АЛТ — аланинаминотрансфераза,
АСТ — аспартатаминотрансфераза,
ЛДГ — лактатдегидрогеназа.
На 3-й день госпитализации в основной группе уровень СРБ был значимо ниже, чем в группе контроля (15,8 vs 24,4 мг/л, p=0,025), при этом на 7-й день статистически значимого различия не выявлено (2,39 vs 3,41 мг/л, p=0,192). При оценке внутригрупповой динамики СРБ методом сравнения связанных совокупностей (критерий Фридмана) в обеих группах отмечалось достоверное снижение показателя на всех этапах наблюдения (p<0,001). На 3 и 7-й дни не выявлено различий по уровню АЛТ и АСТ, однако отмечается незначительное повышение активности АЛТ в динамике в обеих группах (р<0,001).
По концентрации ЛДГ группы были сопоставимы на 3-й день госпитализации (259,6 vs 296,4 ЕД/л, p=0,178), на 7-й день госпитализации выявлено достоверное различие — в основной группе ЛДГ ниже, чем в контрольной группе (261,6 vs 326,1 ЕД/л, p=0,016), в контрольной группе отмечается достоверный рост показателя с 273,7 до 326,1 ЕД/л (р=0,034).
Содержание лимфоцитов в крови на 3-й день госпитализации было выше в основной группе (1,2 vs 0,9×10⁹/л, p=0,049), на 7-й день показатели оказались сопоставимы (1,5 vs 1,3×10⁹/л, p=0,731). В обеих группах в динамике отмечается рост уровня лимфоцитов: в основной группе с 1,2 до 1,5×10⁹/л (p=0,001), в группе контроля с 1,2 до 1,3×10⁹/л (p=0,02).
Различий по уровню D-димера на 3-й и 7-й дни не наблюдалось, но в контрольной группе выявлено достоверное повышение с 184 до 460 нг/мл (р=0,015), тогда как в основной группе статистически значимого изменения показателя не наблюдается.
Динамика клинических показателей между исследуемыми группами представлена в табл. 3.
Таблица 3. Динамика клинических показателей
|
Показатели |
Основная группа, n=٥٣ |
Группа контроля, n=٥٠ |
р* |
|
Сатурация, 3-й день, % |
95 [ 91; 96] |
93 [ 90; 96] |
0,444 |
|
Сатурация, 7-й день, % |
96 [ 92; 97] |
93 [ 88,5; 97] |
0,05* |
|
САД, 3-й день, мм рт. ст. |
125 [ 115; 132] |
125 [ 120; 135] |
0,533 |
|
САД, 7-й день, мм рт. ст. |
125 [ 120; 130] |
124 [ 120; 137] |
0,247 |
|
ДАД, 3-й день, мм рт. ст. |
76 [ 70; 80] |
75 [ 70; 80] |
0,803 |
|
ДАД, 7-й день, мм рт. ст. |
80 [ 70; 80] |
74,5 [ 70; 80] |
0,726 |
|
ЧСС, 3-й день, уд/мин |
77 [ 73; 86] |
76 [ 72; 83] |
0,617 |
|
ЧСС, 7-й день, уд/мин |
75 [ 68; 79] |
73 [ 64,5; 80] |
0,533 |
|
ЧДД, 3-й день, движений/мин |
18 [ 17; 18] |
18 [ 17; 19] |
0,019* |
|
ЧДД, 7-й день, движений/мин |
18 [ 17; 18] |
18 [ 17; 19] |
0,357 |
|
NEWS2, 3-й день, балл |
2 [ 0; 3] |
3 [ 1; 4] |
0,086 |
|
NEWS2, 7-й день, балл |
1 [ 0; 2] |
3 [ 0; 4] |
0,021* |
Примечание. Данные представлены в виде медианы
и интерквартильного размаха (Me [ Q1;Q3]).
р* — U-критерий Манна–Уитни.
САД — систолическое артериальное давление,
ДАД — диастолическое артериальное давление,
ЧСС — частота сердечных сокращений,
ЧДД — частота дыхательных движений,
NEWS2 — шкала оценки тяжести состояния пациента.
Уровень сатурации на 7-й день госпитализации был выше в основной группе (96% vs 93%, p=0,05). У пациентов, получающих арГПП-1, при оценке внутригрупповой динамики отмечалось повышение сатурации с 95% до 96% (p=0,004), при этом большая динамика прослеживается с 3 по 7-й день госпитализации (р=0,008), в то время как в контрольной группе статистически достоверного изменения показателя в динамике не наблюдалось. В группе контроле на 3 и 7-й дни наблюдалась высокая частота необходимости кислородной поддержки по сравнению с основной группой, 3-й день — 59,2% vs 37,7% (р=0,03), на 7-й день — 60,4% vs 37,3% (р=0,021). Группы были сопоставимы на 1 и 7-й дни по уровню САД, ЧСС и ЧДД (табл. 3). Обращает внимание то, что на 7-й день количество баллов по шкале NEWS2 в группе контроля было достоверно выше (3 балла), чем в основной группе (1 балл, р=0,021).
В основной группе 17,0% пациентов были переведены в ОРИТ, в группе контроля — 28% (p=0,18). Все пациенты, переведенные на ИВЛ, заканчивали летальным исходом: у больных, получающих дулаглутид, — 5,7%, в контрольной группе — 20,0%, смертность в контрольной группе была в 3,5 раза выше по сравнению с основной (р=0,038) (рис. 5). Не выявлено различий длительности госпитализации (10 койко-дней в основной группе vs 11 койко-дней в группе контроля, p=0,258).
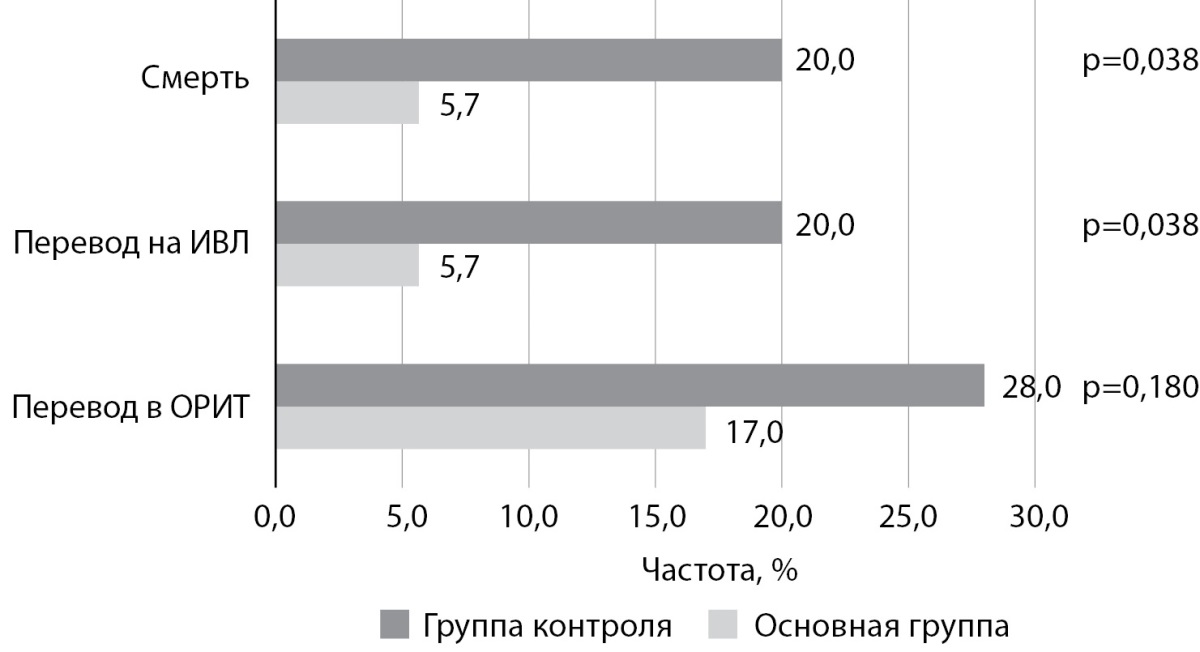
Рисунок 5. Основные исходы COVID-19.
Примечание: ИВЛ — искусственная вентиляция легких,
ОРИТ — отделение реанимации и интенсивной терапии.
В исследовании оценивали необходимость повторного введения ГИБП в связи с прогрессированием COVID-19. У пациентов, получающих дулаглутид, выявлена тенденция к более низкой потребности в повторном введении ГИБП (64,2% vs 80,0%, р=0,074). Терапия не влияла на максимальную суточную дозу дексаметазона (16 мг/сут vs 22 мг/сут, р=0,664).
Нежелательные явления
В обеих группах не наблюдались гипогликемические явления. В группах наблюдались диспептические явления вне зависимости от получаемой терапии, в основной группе у 11 пациентов (20,8%), в группе контроля — у 18 пациентов (36,0%, р=0,086). По структуре жалобы разделились на запоры — 6 (11,3%) vs 8 (16,0, p=0,572), метеоризм — 2 (3,77%) vs 0 (0%, p=0,496), диарею — 2 (3,77%) vs 11 (22,0%, p=0,007), тошноту — 1 (1,89%) vs 3 (6%, p=0,353), рвоту — 0 (0%) vs 2 (4%, p=0,233). У одного пациента из группы, получающей дулаглутид, развилась местная аллергическая реакция в виде кожных высыпаний — 1 (1,89%). Согласно данным литературы, COVID-19 характеризуется высокой распространенностью желудочно-кишечных симптомов (до 50% пациентов), поэтому интерпретация полученных результатов только как нежелательных явлений от использования арГПП-1 сомнительна [19].
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Эффективность терапии была сопоставима в группах по показателям компенсации углеводного обмена. В соответствии с полученными данными старт терапии дулаглутидом в первые 24 ч госпитализации способствовал более эффективному улучшению провоспалительного статуса, влияя на уровни СРБ, ЛДГ и лимфоцитов, в сравнении с контрольной группой, благоприятно влиял на течение заболевания, снижая необходимость в оксигенотерапии и повышая уровень сатурации в динамике.
Частота летального исхода и перевода на ИВЛ была статистически значимо выше в контрольной группе по сравнению с основной группой (р=0,038). Инициация терапии арГПП-1 у пациентов с СД2, госпитализированных по поводу COVID-19, снижала шанс летального исхода и перевода на ИВЛ при сравнении с контрольной группой (ОШ=0,24, 95% ДИ 0,062–0,931). Связь между летальным исходом и терапией арГПП-1 была средней (V=0,216).
Обсуждение результатов исследования
С началом пандемии в медицинском сообществе активно обсуждались различные схемы гипогликемизирующей терапии с целью компенсации углеводного обмена у пациентов с COVID-19. Учитывая плейотропные эффекты арГПП-1, иДПП-4 и метформина, было предположено, что они могут быть применены у пациентов с СД2 в ходе госпитализации по поводу COVID-19 [20]. Китайскими учеными выявлено, что лечение инсулином пациентов с COVID-19 и СД2 было связано со значительным увеличением смертности (27,2% против 3,5%; скорректированный ОР 5,38, 95% ДИ 2,75–10,54) [21]. В ретроспективном исследовании E. Chertok Shacham и соавт. продемонстрировано преимущество в использовании комбинированной терапии (препараты неинсулинового ряда и инсулин) над использованием только инсулина в ходе госпитализации. Средний уровень глюкозы у пациентов, получавших только инсулин, был выше по сравнению с пациентами, получавшими комбинированную терапию (11,2±3,7 ммоль/л vs 10±3,9 ммоль/л, р=0,004) [22]. Также накаливаются данные о приоритетности значения инсулинорезистентности над повреждением бета-клеток поджелудочной железы в рамках нарушения гликемического контроля у пациентов с COVID-19 [23]. Поэтому применение арГПП-1 как компонента гипогликемической терапии у госпитализированных пациентов с COVID-19 и СД2 оправдано.
Изучаются факторы, которые могли бы повлиять на течение и исход COVID-19, в том числе и использование различных сахароснижающих препаратов. В литературе описано влияние догоспитального применения арГПП-1 на COVID-19. В исследовании A.R. Kahkoska и соавт. (2021) сообщается, что догоспитальный прием арГПП-1 снижал шанс общей смертности (ОШ 0,56, 95% ДИ 0,39–0,82), госпитализации (ОШ 0,73, 95% ДИ 0,62–0,87), перевода на ИВЛ (ОШ 0,73, 95% ДИ 0,55–0,97) в течение 14 дней после постановки диагноза COVID-19 по сравнению с использованием иДПП-4 [24]. Близкие данные представлены и в многонациональном ретроспективном когортном исследовании (J.E. Nyland и соавт.): использование арГПП-1 ассоциировалось со снижением респираторных осложнений (15,3% против 24,9%, ОР 0,62, 95% ДИ 0,52–0,73; p<0,001) и частоты смертности по сравнению с контрольной группой (1,9% против 3,3%, ОР 0,58, 95% ДИ 0,35–0,97, p=0,04) [25].
В то же время французские ученые в ходе исследования предикторов выписки из стационара и смертности в рамках исследования CORONADO при построении многофакторной модели смерти в течение 28 дней не нашли связи между применением арГПП-1 и частотой летального исхода (р=0,21), однако выявлено, что микрососудистые осложнения в анамнезе, рутинная антикоагулянтная терапия, одышка при поступлении и более высокий уровень АСТ, лейкоцитов и СРБ ассоциировались со сниженной вероятностью выписки [26]. Схожие результаты продемонстрированы и S.B. Israelsen и соавт. (2021). В данном исследовании авторы отмечают, что пациенты, получающие арГПП-1, имели скорректированный ОР госпитализации, перевода в ОРИТ и на ИВЛ, летального исхода 0,89 (95% ДИ 0,34–2,33), а больные, получающие иДПП-4, — 2,42 (95% ДИ 0,99–5,89) для 30-дневной смертности по сравнению с использованием и-НГЛТ-2. Таким образом, использование терапии на основе инкретинов у лиц с диабетом и тяжелым острым респираторным синдромом не было связано с улучшением клинических исходов [27].
Данные по безопасности и возможным рискам использования арГПП-1 при COVID-19 описаны в консенсусном решении совета экспертов Российской ассоциации эндокринологов по контролю и выбору гипогликемической терапии у пациентов с СД2 и COVID-19 и включают снижение аппетита и желудочно-кишечные симптомы, однако во всех исследованиях, включенных в анализ, изучалось влияние догоспитального назначения арГПП-1, и, возможно, в период госпитализации терапия корректировалась вплоть до отмены препарата [9].
В нашем исследовании продемонстрированы возможности инициации приема арГПП-1 у госпитализированных пациентов с СД2 не только с целью компенсации углеводного обмена в ходе COVID-19, но и с целью улучшения провоспалительного статуса, клинических показателей и снижения летальности.
Ограничения исследования
Ограничениями данного исследования являются малая выборка пациентов, небольшая длительность наблюдения за исследуемыми группами, невозможность использования плацебо в группе контроля и отсутствие рандомизации.
ЗАКЛЮЧЕНИЕ
Таким образом, инициация терапии арГПП-1 у пациентов с СД2, госпитализированных с COVID-19, позволяет эффективно и безопасно улучшать показатели углеводного обмена. Терапия дулаглутидом положительно влияла на провоспалительный статус и динамику клинических показателей, таких как сатурация, необходимость оксигенотерапии и риск тяжелого течения по шкале NEWS2. Старт терапии дулаглутидом снижал шанс летального исхода и перевода на ИВЛ в сравнении с контрольной группой.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа проведена за счет бюджетных средств учреждений.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Маркова Т.Н. — научное руководство проводимым исследованием, анализ полученных данных, написание текста статьи и редактирование текста рукописи; Стас М.С. — обработка материала, статистический анализ полученных данных и написание текста статьи; Анчутина А.А. — обработка материала, статистический анализ полученных данных; Лысенко М.А. — дизайн исследования, окончательное редактирование текста рукописи. Все авторы внесли существенный вклад в проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией.
Список литературы
1. World Health Organization [Internet]. Weekly epidemiological update on COVID-19 — 25 January 2023. Available at: https://www.who.int/publications/m/item/weekly-epidemiological-update-on-covid-19---25-january-2023 Accessed 10.12.2023.
2. Singh AK, Gillies CL, Singh R, et al. Prevalence of co-morbidities and their association with mortality in patients with COVID-19:A systematic review and meta-analysis. Diabetes Obes Metab. 2020;22(10):1915-1924. doi: https://doi.org/10.1111/dom.14124
3. Маркова Т.Н., Пономарева А.А., Самсонова И.В., и др. Факторы риска летального исхода у больных сахарным диабетом 2 типа и новой коронавирусной инфекцией // Эндокринология: новости, мнения, обучение. — 2022. — Т. 11. — №1. — C. 8-16. doi: https://doi.org/10.33029/2304-9529-2022-11-1-8-16
4. Palaiodimos L, Chamorro-Pareja N, Karamanis D, et al. Diabetes is associated with increased risk for in-hospital mortality in patients with COVID-19: a systematic review and meta-analysis comprising 18,506 patients. Hormones (Athens). 2021;20(2):305-314. doi: https://doi.org/10.1007/s42000-020-00246-2
5. Мокрышева Н.Г., Шестакова М.В., Викулова О.К., и др. Анализ рисков летальности 337 991 пациента с сахарным диабетом, перенесшего COVID-19, за период 2020–2022 гг.: всероссийское ретроспективное исследование // Сахарный диабет. — 2022. — Т. 25. — №5. — 404-417. doi: https://doi.org/10.14341/DM12954
6. McGurnaghan SJ, Weir A, Bishop J, et al. Public health Scotland COVID-19 health protection study group; Scottish diabetes research network epidemiology group. Risks of and risk factors for COVID-19 disease in people with diabetes: a cohort study of the total population of Scotland. Lancet Diabetes Endocrinol. 2021;9(2):82-93. doi: https://doi.org/10.1016/S2213-8587(20)30405-8
7. Holman N, Knighton P, Kar P, et al. Risk factors for COVID-19-related mortality in people with type 1 and type 2 diabetes in England: a population-based cohort study. Lancet Diabetes Endocrinol. 2020;8(10):823-833. doi: https://doi.org/10.1016/S2213-8587(20)30271-0
8. Lee MH, Wong C, Ng CH, et al. Effects of hyperglycaemia on complications of COVID-19: A meta-analysis of observational studies. Diabetes Obes Metab. 2021;23(1):287-289. doi: https://doi.org/10.1111/dom.14184
9. Дедов И.И., Мокрышева Н.Г., Шестакова М.В., и др. Контроль гликемии и выбор антигипергликемической терапии у пациентов с сахарным диабетом 2 типа и COVID-19: консенсусное решение совета экспертов Российской ассоциации эндокринологов // Сахарный диабет. — 2022. — Т. 25. — №1. — С. 27-49. doi: https://doi.org/10.14341/DM12873
10. de Rivero Vaccari JC, Dietrich WD, et al. The inflammasome in times of COVID-19. Front Immunol. 2020;11(3):4239. doi: https://doi.org/10.3389/fimmu.2020.583373
11. Gurung P, Kanneganti TD. Novel roles for caspase-8 in IL-1beta and inflammasome regulation. Am J Pathol. 2015;185(1):17-25. doi: https://doi.org/10.1016/j.ajpath.2014.08.025
12. Kandasamy M. NF-kappaB signalling as a pharmacological target in COVID-19: potential roles for IKKbeta inhibitors. Naunyn Schmiedebergs Arch Pharmacol. 2021;394(3):561-567. doi: https://doi.org/10.1007/s00210-020-02035-5
13. Shiraki A, Oyama J, Komoda H, et al. The glucagon-like peptide 1 analog liraglutide reduces TNF-alpha-induced oxidative stress and inflammation in endothelial cells. Atherosclerosis. 2012;221(2):375-382. doi: https://doi.org/10.1016/j.atherosclerosis.2011.12.039
14. Bray JJH, Foster-Davies H, Salem A, et al. Glucagon-like peptide-1 receptor agonists improve biomarkers of inflammation and oxidative stress: A systematic review and meta-analysis of randomised controlled trials. Diabetes Obes Metab. 2021;23(8):1806-1822. doi: https://doi.org/10.1111/dom.14399
15. Lee Y-S, Jun H-S. Anti-inflammatory effects of GLP-1-Based therapies beyond glucose control. Mediators Inflamm. 2016;2016(3):1-11. doi: https://doi.org/10.1155/2016/3094642
16. Schousboe P, Wiese L, Heiring C, et al. Assessment of pulmonary surfactant in COVID-19 patients. Crit Care. 2020;24(1):552. doi: https://doi.org/10.1186/s13054-020-03268-9
17. Vara E, Arias-Diaz J, Garcia C, et al. Glucagon-like peptide-1 (7-36)amide stimulates surfactant secretion in human type II pneumocytes. Am J Respir Crit Care Med. 2001;163(4):840-846. doi: https://doi.org/10.1164/ajrccm.163.4.9912132
18. Charlson ME, Pompei P, Ales KL, et al. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chron Dis. 1987;40(5):373-383. doi: https://doi.org/10.1016/0021-9681(87)90171-8
19. Freedberg DE, Chang L. Gastrointestinal symptoms in COVID-19: the long and the short of it. Curr Opin Gastroenterol. 2022;38(6):555-561. doi: https://doi.org/10.1097/MOG.0000000000000876
20. Lim S, Bae JH, Kwon H-S, Nauck MA. COVID-19 and diabetes mellitus: from pathophysiology to clinical management. Nat Rev Endocrinol. 2021;17(1):11-30. doi: https://doi.org/10.1038/s41574-020-00435-4
21. Yu B, Li C, Sun Y, Wang DW. Insulin treatment is associated with increased mortality in patients with COVID-19 and type 2 diabetes. Cell Metab. 2021;33(1):65-77.e2. doi: https://doi.org/10.1016/j.cmet.2020.11.014
22. Chertok Shacham E, Maman N, Ishay A. Blood glucose control with different treatment regimens in type 2 diabetes patients hospitalized with COVID-19 infection: A retrospective study. Medicine (Baltimore). 2023;102(3):e32650. doi: https://doi.org/10.1097/MD.0000000000032650
23. Mahmudpour M, Vahdat K, Keshavarz M, Nabipour The COVID-19-diabetes mellitus molecular tetrahedron. Mol Biol Rep. 2022;49(5):4013-4024. doi: https://doi.org/10.1007/s11033-021-07109-y
24. Kahkoska AR, Abrahamsen TJ, Alexander GC, et al. Association between glucagon-like peptide 1 receptor agonist and sodium-glucose cotransporter 2 inhibitor use and COVID-19 outcomes. Diabetes Care. 2021;44(7):1564-1572. doi: https://doi.org/10.2337/dc21-0065
25. Nyland JE, Raja-Khan NT, Bettermann K, et al. Diabetes, drug treatment, and mortality in COVID-19: A multinational retrospective cohort study. Diabetes. 2021;70(12):2903-2916. doi: https://doi.org/10.2337/db21-0385
26. Wargny M, Potier L, Gourdy P, et al. Predictors of hospital discharge and mortality in patients with diabetes and COVID-19: updated results from the nationwide CORONADO study. Diabetologia. 2021;64(4):778-794. doi: https://doi.org/10.1007/s00125-020-05351-w
27. Israelsen SB, Pottegård A, Sandholdt H, et al. Comparable COVID-19 outcomes with current use of GLP-1 receptor agonists, DPP-4 inhibitors or SGLT-2 inhibitors among patients with diabetes who tested positive for SARS-CoV-2. Diabetes Obes Metab. 2021;23(6):1397-1401. doi: https://doi.org/10.1111/dom.14329
Об авторах
Т. Н. МарковаРоссия
Маркова Татьяна Николаевна, д.м.н., профессор
Москва
М. А. Лысенко
Россия
Лысенко Марьяна Анатольевна, д.м.н., профессор, главный врач
Москва
М. С. Стас
Россия
Стас Мухамед Самих, аспирант
127473, Москва, ул. Делегатская, д. 20, стр. 1
А. А. Анчутина
Россия
Анчутина Анастасия Алексеевна, старший лаборант кафедры эндокринологии и диабетологии МГМСУ им. А.И. Евдокимова, врач отделения эндокринологии ГБУЗ «Городская клиническая больница № 52 ДЗМ»
Москва
Дополнительные файлы
|
|
1. Рисунок 1. Противовоспалительный и антиапоптотический эффекты агонистов рецепторов глюкагоноподобного пептида-1. Адаптировано из «Anti-Inflammatory Effects of GLP-1-Based Therapies beyond Glucose Control» Lee YS, Jun HS [15]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(175KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Дизайн исследования. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(577KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Сравнение стартовой терапии между исследуемыми группами. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(155KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Сравнение уровня глюкозы плазмы натощак и среднесуточной гликемии в группах в динамике. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(194KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Основные исходы COVID-19. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(102KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Маркова Т.Н., Лысенко М.А., Стас М.С., Анчутина А.А. Эффективность и безопасность инициации терапии агонистами рецепторов глюкагоноподобного пептида-1 у пациентов с сахарным диабетом 2 типа, госпитализированных с коронавирусной инфекцией. Сахарный диабет. 2023;26(6):537-548. https://doi.org/10.14341/DM13015
For citation:
Markova T.N., Lysenko M.A., Stas M.S., Anchutina A.A. Efficacy and safety of glucagon-like peptide-1 receptor agonists therapy initiation in patients with type 2 diabetes hospitalized with coronavirus infection. Diabetes mellitus. 2023;26(6):537-548. (In Russ.) https://doi.org/10.14341/DM13015
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































