Перейти к:
Кластеры сахарного диабета 2 типа в Новосибирской области
https://doi.org/10.14341/DM12993
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет 2 типа (СД2) является гетерогенным заболеванием. Выделение различных фенотипов СД2 поможет улучшить прогнозирование метаболических нарушений, риска развития осложнений и в перспективе привести к персонификации терапии диабета.
ЦЕЛЬ. Выделить кластеры СД2 у пациентов с различной длительностью диабета с изучением частоты диабетических осложнений и медикаментозной терапии в Новосибирской области.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование выполнено на базе Диамобиля в период 2013–2017 гг. Кластерный анализ К-средних был проведен у 2805 больных СД2 в возрасте от 44 до 70 лет, с длительностью диабета 7,84±6,53 года, проживающих в Новосибирской области, на основе 5 переменных: гликированный гемоглобин (HbA1c), возраст на момент постановки диагноза, индекс массы тела (ИМТ), уровень С-пептида, пол.
РЕЗУЛЬТАТЫ. По результатам кластерного анализа пациенты были отнесены к трем кластерам: кластер 1 был представлен 1003 пациентами (35,7%) с сохраненной функцией β-клеток (уровень С-пептида 765,18±161,9 нмоль/л), возрастом постановки диагноза СД2 51,72±8,29 года и ИМТ 33,50±5,74 кг/м²; мужской пол в этом кластере был ассоциирован с более высоким риском развития диабетической нефропатии, по сравнению с женщинами, на 27%. Кластер 2 состоял из 432 пациентов (15,4%) с повышенной функцией β-клеток (уровень С-пептида 1765,10±253,08 нмоль/л), возраст на момент постановки диагноза у больных СД2 был больше — 52,91±7,75 года, больные имели более высокий ИМТ (35,64±7,21 кг/м2) и более высокий уровень диастолического АД, раннее развитие диабетической ретинопатии, нефропатии и полинейропатии и лучший ответ на терапию метформином и комбинированную терапию метформином и сульфонилмочевиной. Кластер 3 был представлен 1370 пациентами (48,8%) со сниженной функцией β-клеток (уровень С-пептида 294,99±146,69 нмоль/л), в этом кластере возраст на момент постановки диагноза СД2 был меньше — 49,63±8,32 года, больные имели более низкий ИМТ (33,09±6,36 кг/м2) и отличались более длительным течением диабета, высоким уровнем глюкозы натощак; мужской пол был ассоциирован с более высоким риском развития диабетической нефропатии (на 26%) по сравнению с женщинами; первой линией терапии была инсулинотерапия у 52,8% больных.
ЗАКЛЮЧЕНИЕ. Проведенное исследование у больных СД2 с различной длительностью заболевания подтвердило возможность применения кластерного анализа для выделения фенотипов СД2 в российской популяции с использованием пяти переменных (HbA1c, возраст на момент постановки диагноза, ИМТ, уровень С-пептида, пол). Высокая частота раннего развития диабетической полинейропатии, нефропатии и ретинопатии была выявлена в кластере с повышенной функцией β-клеток, а мужской пол являлся дополнительным фактором риска диабетической нефропатии и полинейропатии.
Ключевые слова
Для цитирования:
Бондарь И.А., Шабельникова О.Ю. Кластеры сахарного диабета 2 типа в Новосибирской области. Сахарный диабет. 2023;26(3):243-251. https://doi.org/10.14341/DM12993
For citation:
Bondar I.A., Shabelnikova O.Y. Type 2 diabetes clusters in the Novosibirsk region. Diabetes mellitus. 2023;26(3):243-251. (In Russ.) https://doi.org/10.14341/DM12993
ОБОСНОВАНИЕ
Сахарный диабет 2 типа (СД2) является гетерогенным заболеванием, и в клинической практике могут встречаться пациенты как с преобладающим фенотипом инсулинорезистентности, но с достаточным резервом β-клеток, так и те, кому может потребоваться лечение инсулином на ранних стадиях своего заболевания. Об этом свидетельствуют многочисленные исследования, направленные на систематизацию и определение различных фенотипов СД2 для лучшего понимания и прогнозирования метаболических нарушений и развития осложнений, что в перспективе может привести к индивидуализированному лечению диабета [1]. Впервые Ahlqvist E. и соавт. на основе данных Датского регистра предложили использование кластерного анализа для выделения отдельных фенотипов СД2 [2]. Большинство последующих исследований было направлено на воспроизведение выделенных кластеров СД2 на основе пяти общих клинических переменных, которые включали гликированный гемоглобин (HbA1c), индекс массы тела (ИМТ), возраст на момент постановки диагноза и оценки индексов HOMA-IR и HOMA-В [3][4]. Китайскими, американскими, японскими и рядом европейских и индийских авторов были определены и воспроизведены пять кластеров: кластер 1 — аутоиммунный диабет, кластер 2 — тяжелый диабет с дефицитом инсулина, кластер 3 — тяжелый инсулинорезистентный диабет, кластер 4 — легкий диабет, связанный с ожирением, кластер 5 — легкий диабет пожилых [5–7]. Однако только китайские исследователи включали пациентов с различной длительностью СД2 [4], в то время как большинство других исследований выполнено на пациентах с недавно выявленным диабетом [2][5–7], что может являться ограничением данного метода для расширения возможной области применения. В Российской Федерации подобных исследований не было. А использование индексов HOMA-IR и HOMA-В при длительном СД2, особенно в группе больных, получающих инсулинотерапию, также имеет ограничения и может влиять на конечный результат при выделении кластеров. В связи с этим поиск клинических переменных, которые можно было бы использовать для выделения кластеров СД2 при различной длительности диабета независимо от инсулинотерапии, отражающих функциональное состояние β-клеток, для российской популяции является актуальным.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Выделить кластеры СД2 у пациентов с различной длительностью диабета с изучением частоты диабетических осложнений и медикаментозной терапии в Новосибирской области.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование выполнено на базе Диамобиля ГБУЗ НСО «Государственная Новосибирская областная клиническая больница» (главный врач — Юданов А.В.).
Время исследования. Исследование выполнено в период с апреля 2013 по ноябрь 2017 гг.
Изучаемые популяции
Всего были обследованы 4022 больных СД, проживающих в Новосибирской области. Кластерный анализ К-средних проведен у 2805 больных СД2.
Критерии включения: больные СД2 в возрасте от 18 до 70 лет. Верификацию диагноза СД2 проводили в соответствии с критериями Комитета экспертов Всемирной организации здравоохранения по СД (1999) и Алгоритмами оказания специализированной помощи больным сахарным диабетом, 10-й выпуск, 2021 г. [8].
Критерии исключения: СД 1 типа, наличие антител к β-клеткам и/или антител к декарбоксилазе глютаминовой кислоты (GADА), беременность, другие типы диабета, наличие у пациента онкологических заболеваний, сердечной недостаточности функциональных классов 3–4 в соответствии с классификацией Нью-Йоркской кардиологической ассоциации, хронической болезни почек 4–5 стадии, лечение кортикостероидами или эстрогенами, алкоголизм, наркомания, деменция или серьезные психические расстройства, острые воспалительные заболевания.
Способ формирования выборки из изучаемой популяции
Кластерный анализ К-средних был проведен у 2805 больных СД2, проживающих в Новосибирской области, на основе 5 переменных — HbA1c, возраст на момент постановки диагноза, ИМТ, уровень С-пептида, пол. Процесс очистки данных состоял из нескольких этапов. Исключались пациенты с отсутствующей информацией. При анализе сердечно-сосудистых заболеваний (ССЗ) исключались пациенты, у которых развитие ССЗ предшествовало началу СД2.
Дизайн исследования
Проведено обсервационное когортное одноцентровое неконтролируемое исследование с ретроспективным анализом во время выездов Диамобиля в районы Новосибирской области.
Описание медицинского вмешательства
Все лечебные и диагностические вмешательства являлись частью рутинной врачебной практики.
Методы
Больные проходили полное клинико-лабораторное обследование, которое включало осмотр эндокринологом, офтальмологом, кардиологом, неврологом. Диагностика осложнений проводилась в соответствии с Алгоритмами оказания специализированной помощи больным сахарным диабетом, 10-й выпуск, 2021 г. [8]. Для диагностики периферической нейропатии использовали шкалу признаков, составляющих так называемый нейропатический дисфункциональный счет — НДС (Neuropathy Dysability Score). Проводили оценку тактильной, болевой, температурной чувствительности, каждому виду чувствительности присваивались баллы в зависимости от выявленного уровня нарушения чувствительности: нет нарушений — 0 баллов, основание пальцев — 1 балл, середина стопы — 2 балла, лодыжки — 3 балла, середина голени — 4 балла, колено — 5 баллов. Для количественной оценки вибрационной чувствительности, исследованной с помощью камертона, использовали алгоритм оценки вибрационной чувствительности: при пороге вибрационной чувствительности на 1 пальце ≥7 УЕ, на лодыжке ≥7 УЕ — 0 баллов, на 1 пальце 6–5 УЕ, на лодыжке ≥7 УЕ — 1 балл, на 1 пальце 0–4 УЕ, на лодыжке 6–5 УЕ — 2 балла, на 1 пальце 0–4 УЕ, на лодыжке 0–4 УЕ — 3 балла, на 1 пальце 0 УЕ, на лодыжке 0–4 УЕ — 4 балла, на 1 пальце 0 УЕ, на лодыжке 0 УЕ — 5 баллов. Количественная оценка коленных и ахилловых рефлексов производилась следующим образом: без патологии — 0 баллов, рефлекторный ответ снижен (неадекватный рефлекс) — 1 балл, рефлекторный ответ отсутствует — 2 балла. Сумма средних значений каждого вида чувствительности и сумма значений каждого из четырех рефлексов составляли шкалу НДС. Количество баллов по шкале НДС от 0 до 4 баллов свидетельствовало об отсутствии либо наличии у пациента начальных признаков периферической сенсомоторной нейропатии; НДС от 5 до 13 баллов соответствовал умеренно выраженной нейропатии, НДС≥14 баллов — выраженной периферической полинейропатии, позволяющей отнести пациента к группе риска развития синдрома диабетической стопы. Во время выезда Диамобиля у пациентов осуществлялся забор биоматериала: крови на исследование НbA1c и биохимических параметров (глюкоза, креатинин, холестерин общий, триглицериды, липопротеиды высокой и низкой плотности, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), инсулин, С-пептид) и мочи на микроальбуминурию. Все биообразцы доставлялись в сертифицированную лабораторию ГБУЗ НСО «Государственная Новосибирская областная клиническая больница». Наличие фиброза печени оценивали по коэффициенту АСТ/АЛТ. Нормальным считали значение менее 0,8, значение более 1 свидетельствовало о выраженном фиброзе печени. Биохимические исследования, уровни инсулина, С-пептида выполняли на автоматическом анализаторе Immulite 2000. Исследование НbA1c проводили на автоматическом анализаторе для определения HbA1c D-10 фирмы BIO-RAD методом высокоэффективной жидкостной хроматографии с помощью наборов D-10 Reorder Pack, 400 Test (производства BIO-RAD LABORATORIES).
Статистический анализ
Кластерный анализ К-средних был проведен у 2805 больных СД2 на основе 5 переменных — HbA1c, возраст на момент постановки диагноза, ИМТ, уровень С-пептида, пол. Все данные были масштабированы до среднего значения нулевой и единичной дисперсии перед кластеризацией. Для формирования гипотезы о количестве возможных кластеров предварительно проводили иерархический анализ на случайно отобранных выборках (с небольшим количеством случаев). На основе проведенного иерархического анализа была сформирована гипотеза о 3 фенотипах, что в последующем в соответствии с алгоритмом Hartigan J.A., Wong M.A. и с учетом большого количества случаев в нашей выборке позволило применить кластерный анализ методом K-средних (K-Means Cluster Analysis).
Для описательной статистики между группами для категорийных переменных использовали χ2. Для количественных переменных при нормальном распределении данные представлены в виде среднего значения (М) и стандартного отклонения (SD). Для оценки межгрупповых различий использовался непараметрический метод Крускала–Уоллиса. Для анализа времени развития диабетических осложнений использовали анализ Каплана–Мейера. Для оценки связи между осложнениями диабета и кластерами с учетом гендерной стратификации использовали регрессию Кокса (относительный риск (ОР) (95% доверительный интервал (ДИ)). Критический уровень значимости принимали равным 0,05. Для статистической обработки использован пакет статистики SPSS13.0.
Этическая экспертиза
Протокол исследования одобрен комитетом по этике Новосибирского государственного медицинского университета (протокол №52 от 19.03.2013). Перед включением в исследование все пациенты подписывали информированное согласие.
РЕЗУЛЬТАТЫ
Основываясь на клинических характеристиках, пациентов отнесли к трем кластерам: кластер 1 был представлен 1003 пациентами (35,7%) с сохраненной функцией β-клеток (уровень С-пептида 765,18±161,9 нмоль/л), в возрасте на момент постановки диагноза СД2 51,72±8,29 года и ИМТ 33,50±5,74 кг/м². Кластер 2 состоял из 432 пациентов (15,4%) с повышенной функцией β-клеток (уровеньС-пептида 1765,10±253,08 нмоль/л), более старшего возраста на момент постановки диагноза СД2 — 52,91±7,75 года и с высоким ИМТ — 35,64±7,21 кг/м2. Кластер 3 представлен 1370 пациентами (48,8%) со сниженной функцией β-клеток (уровень С-пептида 294,99±146,69 нмоль/л), более раннего возраста на момент постановки диагноза — 49,63±8,32 года и с меньшим ИМТ — 33,09±6,36 кг/м². Общая характеристика популяции и клинические данные обследованных больных СД2 представлены в табл. 1.
Каждый из кластеров имел свои клинические особенности. Так, кластер 2 (с повышенной функцией β-клеток) достоверно отличался большей частотой больных мужского пола (34,7% против 22,7% при кластере 1 и 19,0% при кластере 3, р<0,001), меньшей длительностью диабета (5,49±5,23 года, р<0,001), более низкими показателями глюкозы крови натощак (8,11±2,06 ммоль/л, р<0,001) и более высоким уровнем диастолического артериального давления (ДАД) (91,48±12,18 мм рт. ст., р=0,024). В кластере 3 (со сниженной функцией β-клеток) отмечалась наибольшая длительность диабета (9,36±6,84 лет, р<0,001), высокий уровень глюкозы натощак (9,18±3,16 ммоль/л, р<0,001), более низкий уровень ДАД (89,66±12,13 мм рт. ст., р=0,024) по сравнению с кластерами 1 и 2. Кластер 1 (с сохраненной функцией β-клеток) имел промежуточные показатели. Статистически значимых различий по уровню липидов, функции печени и индексу фиброза печени в изучаемых кластерах выявлено не было (табл. 1).
При анализе частоты микрососудистых осложнений и времени до их развития отмечено, что в кластере 3 (со сниженной функцией β-клеток) была самая высокая частота осложнений (диабетической полинейропатии — 51,2% по сравнению с кластером 1 (34,4%) и кластером 2 (14,4%); диабетической нефропатии — 48,4% по сравнению с кластером 1 (34,3%) и кластером 2 (17,3%); диабетической ретинопатии — 50,2% по сравнению с кластером 1 (34,6%) и кластером 2 (15,3%)), данные различия не достигали уровня статистической значимости и могли быть объяснены большей длительностью диабета. При анализе времени до развития микрососудистых осложнений выявлено, что значимо раньше диабетические осложнения (полинейропатия, нефропатия и ретинопатия) развивались в кластере 2 (с повышенной функцией β-клеток) по сравнению с кластерами 1 и 3: нейропатия через 5,52±5,08 года против 6,48±5,91 года в кластере 1 и 9,48±6,97 года в кластере 3; нефропатия через 5,84±5,81 года против 6,9±6,31 года в кластере 1 и 9,52±7,04 года в кластере 3; ретинопатия через 5,38±4,80 года против 6,33±5,88 года в кластере 1 и 9,25±6,76 года в кластере 3) (табл. 2).
При анализе времени развития диабетической нефропатии, нейропатии и ретинопатии методом Каплана–Майера также было подтверждено, что при кластере 2 по сравнению с кластерами 1 и 3 раньше развиваются диабетическая нефропатия (χ2=26,645; р=0,0001), диабетическая нейропатия (χ2=8,489; р=0,014) и диабетическая ретинопатия (χ2=6,833; р=0,033) (рис. 1).
Значимых различий частоты макрососудистых осложнений между кластерами не отмечено. Частота ишемической болезни сердца в кластере 1 регистрировалась в 19,1%, в кластере 2 — 17,6%, в кластере 3 — 19,5% случаев (р=0,680), инфаркт миокарда в кластере 1 был у 7,0%, в кластере 2 — у 8,3% и у 7,2% пациентов в кластере 3 (р=0,645), цереброваскулярные заболевания — в 6,9, 5,8 и 7,5% случаев в кластерах 1, 2 и 3 соответственно (р=0,459),частота хронической сердечной недостаточности в кластере 1 составила 21,8%, в кластере 2 — 18,7%, в кластере 3 — 22,9% (р=0,188).
Нами была изучена связь между осложнениями диабета и кластерами с учетом гендерной стратификации. Было установлено, что в кластере 1 (с сохраненной функцией β-клеток) риск развития диабетической нефропатии был ниже у женщин по сравнению с мужчинами (ОР (95% ДИ): 0,724 (0,530–0,988); р=0,041), а в кластере 3 (со сниженной функцией β-клеток) риск развития диабетической нейропатии (ОР (95% ДИ): 0,735 (0,560–0,965); р=0,026) был ниже у женщин по сравнению с мужчинами. Риск развития ишемической болезни сердца, инфаркта миокарда, цереброваскулярной болезни и хронической сердечной недостаточности не зависел от пола при различных кластерах СД2 (табл. 3).
При сравнении ответа на сахароснижающую терапию, которую оценивали по достижению целевого уровня HbA1с (менее 7,0%) в различных кластерах СД2, было отмечено, что в кластере 2 (с повышенной функцией β-клеток) значимо чаще регистрировался хороший ответ на монотерапию метформином (МФ) (17,8% по сравнению с кластером 1 (с сохраненной функцией β-клеток) — 16,2% и кластером 3 (со сниженной функцией β-клеток) — 10,4% (р<0,0001)); на монотерапию препаратами сульфонилмочевины (СМ) (7,9% по сравнению с кластером 1 — 6,1% и кластером 3 — 2,3% (р<0,0001)); на комбинированную терапию МФ и СМ (14,1% по сравнению с кластером 1 — 13,2% и кластером 3 — 6,2% (р<0,0001)). Частота назначения инсулина была значимо выше в кластере 3 (со сниженной функцией β-клеток) — 22,6% (в кластере 1 — 3,8%, в кластере 2 — 0,7% (р<0,0001)); достоверно чаще в кластере 3 терапией первой линии была инсулинотерапия — 52,8% против 10,3% в кластере 1 и 0,9% в кластере 2 (табл. 4).
Таблица 1. Характеристика больных сахарным диабетом 2 типа выделенных кластеров
Параметр | Кластер 1 | Кластер 2 | Кластер 3 | Р |
N | 1003 | 432 | 1370 | |
Мужчины, n (%) Женщины, n (%) | 228 (22,7) 775 (77,3) | 150 (34,7) 282 (65,3) | 260 (19,0) 1110 (81,0) | <0,001 |
Возраст, лет | 58,4±7,06 | 58,4±6,79 | 58,97±6,75 | 0,100 |
Длительность СД2, лет | 6,78±6,09* | 5,49±5,23* | 9,36±6,84* | <0,001 |
Возраст дебюта СД2, лет | 51,7±8,29* | 52,9±7,75* | 49,6±8,32* | <0,001 |
ИМТ | 33,5±5,74* | 36,6±7,21* | 33,1±6,36* | <0,001 |
Глюкоза крови натощак, ммоль/л | 8,40±2,84* | 8,11±2,76* | 9,18±3,16* | <0,001 |
HbA1c, % | 8,49±2,01 | 7,72±2,22 | 8,74±2,11 | 0,036 |
САД, мм рт. ст. | 148,1±21,4 | 149,6±21,3 | 149,3±21,7 | 0,344 |
ДАД, мм рт. ст. | 90,1±11,9* | 91,5±12,2* | 89,7±12,13* | 0,024 |
рСКФ, мл/мин/1,73 м2 | 75,2±16,7 | 74,2±17,1 | 75,2±16,6 | 0,487 |
Мочевая кислота, мкмоль/л | 300,5±79,3 | 295,4±81,6 | 299,6±79,3 | 0,526 |
МАУ, мг/л | 35,1±88,1 | 37,5±113,0 | 39,8±124,1 | 0,601 |
С-пептид, нмоль/л | 765,2±161,9* | 1765,1±253,1* | 295,0±146,7* | <0,001 |
Общий холестерин, ммоль/л | 5,83±1,70 | 5,94±1,49 | 5,87±1,41 | 0,436 |
Триглицериды, ммоль/л | 2,22±1,71 | 2,29±1,84 | 2,25±1,69 | 0,789 |
ЛПВП, ммоль/л | 1,18±0,31 | 1,20±0,34 | 1,20±0,40 | 0,334 |
ЛПНП, ммоль/л | 3,21±0,88 | 3,32±1,03 | 3,26±1,15 | 0,184 |
АЛТ, Ед/л | 25,1±23,4 | 25,2±18,9 | 24,6±18,4 | 0,835 |
АСТ, Ед/л | 23,5±16,4 | 23,2±13,2 | 23,1±16,0 | 0,874 |
Соотношение АСТ/АЛТ | 3,56±0,92 | 3,67±1,10 | 3,58±0,86 | 0,119 |
Примечание: СД — сахарный диабет, СД2 — сахарный диабет 2 типа, ИМТ — индекс массы тела, САД — систолическое артериальное давление, ДАД — диастолическое артериальное давление, рСКФ — расчетная скорость клубочковой фильтрации, МАУ — микроальбуминурия, ЛПВП — липопротеиды высокой плотности, ЛПНП — липопротеиды низкой плотности, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза
*статистическая значимость различий: непараметрический метод Kruskal–Wallis test.
Таблица 2. Частота осложнений и время до развития осложнения у больных сахарным диабетом 2 типа выделенных кластеров
Параметр | Кластер 1 | Кластер 2 | Кластер 3 | Р |
N | 1003 | 432 | 1370 | |
Нейропатия, n (%) | 467 (34,4) | 196 (14,4) | 695 (51,2) | 0,052 |
Общий балл по шкале НДС, ед | 5,65±5,67 | 5,67±5,70 | 6,20±6,10 | 0,177 |
Время до развития нейропатии, лет | 6,48±5,91 | 5,52±5,08 | 9,48±6,97 | <0,001 |
Нефропатия (ХБП), n (%) | 310 (34,3) | 157 (17,3) | 438 (48,4) | 0,123 |
Время до развития нефропатии, лет | 6,90±6,31 | 5,84±5,81 | 9,52±7,04 | <0,001 |
Ретинопатия, n (%) | 290 (34,6) | 128 (15,3) | 421 (50,2) | 0,628 |
Время до развития ретинопатии, лет | 6,33±5,88 | 5,38±4,80 | 9,25±6,76 | <0,001 |
Примечание: НДС — нейропатический дисфункциональный счет, ХБП — хроническая болезнь почек.
*статистическая значимость различий: непараметрический метод Kruskal-Wallis test.
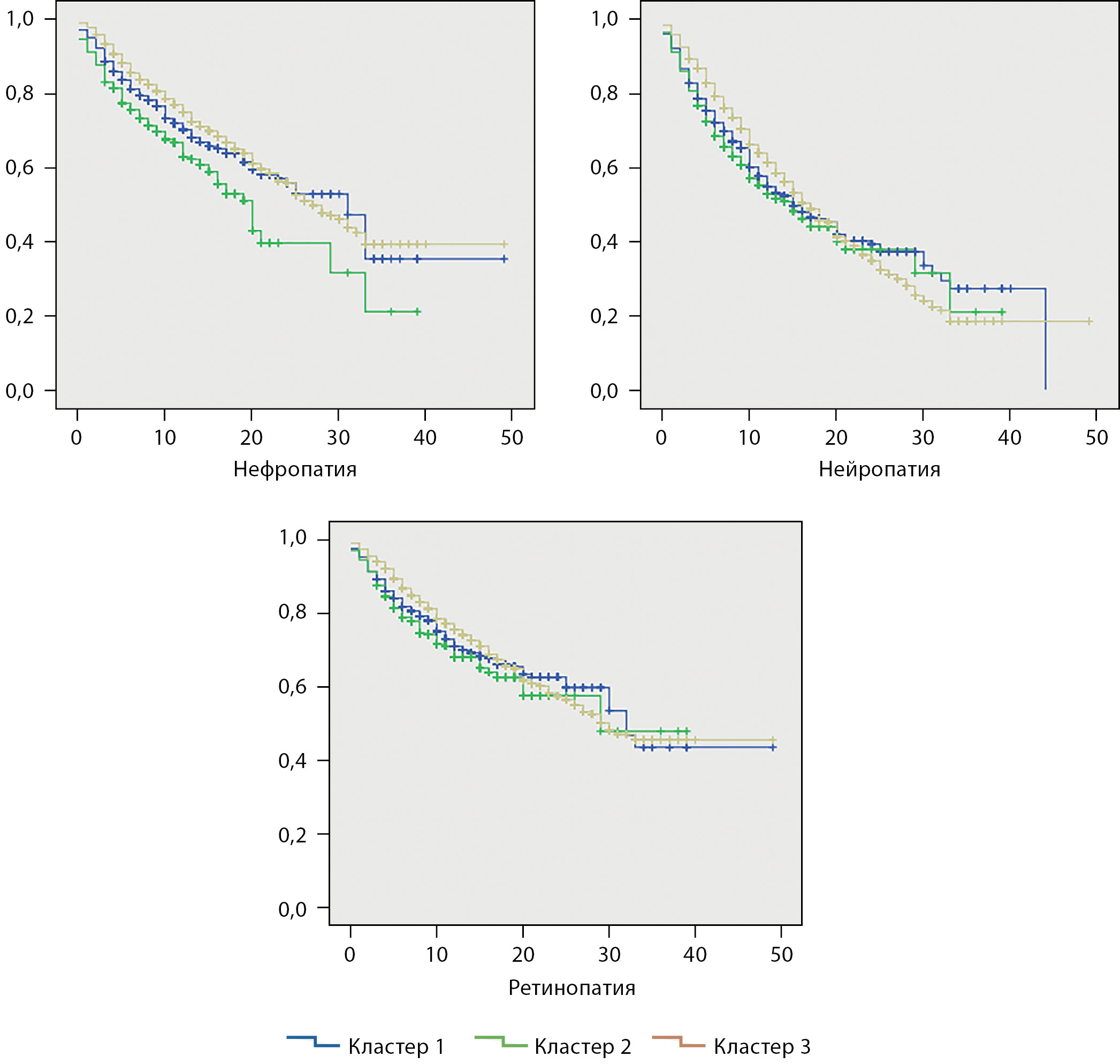
Рисунок 1. Время до развития диабетической нефропатии, нейропатии и ретинопатии при различных кластерах сахарного диабета 2 типа (кривая Каплана–Майера).
Ось Х — время в годах (от момента диагностики СД до момента верификации осложнения), ось Y — доля пациентов без осложнений, где 1,0 осложнения нет.
Таблица 3. Риск развития осложнений в различных кластерах с учетом пола
Осложнение | Кластер 1 | ОР (95%ДИ) | Р | |
Мужчина (n=228) | Женщина (n=775) | |||
Нейропатия, n (%) | 119 (52,2) | 348 (44,9) | 0,747 (0,555–1,004) | 0,052 |
Нефропатия, n (%) | 83 (36,4) | 227 (29,3) | 0,724 (0,530–0,988) | 0,041 |
Ретинопатия, n (%) | 73 (32,0) | 217 (28,0) | 0,826 (0,600–1,136) | 0,240 |
ИБС, n (%) | 49 (21,5) | 143 (18,5) | 0,827 (0,574–1,190) | 0,305 |
ИМ, n (%) | 16 (7,0) | 54 (7,0) | 0,992 (0,556–1,770) | 0,979 |
ЦВБ, n (%) | 19 (8,3) | 50 (6,5) | 0,759 (0,438–1,315) | 0,324 |
ХСН, n (%) | 50 (21,9) | 169 (21,8) | 1,007 (0,705–1,439) | 0,968 |
Осложнение | Кластер 2 | ОР (95% ДИ) | P | |
Мужчина (n=150) | Женщина (n=282) | |||
Нейропатия, n (%) | 65 (43,3) | 131 (46,5) | 1,134 (0,761–1,690) | 0,535 |
Нефропатия, n (%) | 60 (40,0) | 97 (34,4) | 0,786 (0,523–1,184) | 0,249 |
Ретинопатия, n (%) | 41 (27,3) | 87 (30,9) | 1,186 (0,765–1,840) | 0,446 |
ИБС, n (%) | 27 (18,0) | 49 (17,4) | 0,958 (0,571–1,608) | 0,871 |
ИМ, n (%) | 10 (6,7) | 26 (9,2) | 1,422 (0,666–3,034) | 0,361 |
ЦВБ, n (%) | 7 (4,7) | 18 (6,4) | 1,393 (0,568–3,414) | 0,467 |
ХСН, n (%) | 35 (23,3) | 46 (16,3) | 1,561 (0,954–2,556) | 0,075 |
Осложнение | Кластер 3 | ОР (95% ДИ) | р | |
Мужчина (n=260) | Женщина (n=1110) | |||
Нейропатия, n (%) | 148 (56,9) | 547 (49,3) | 0,735 (0,560–0,965) | 0,026 |
Нефропатия, n (%) | 86 (33,1) | 352 (31,7) | 0,940 (0,705–1,253) | 0,671 |
Ретинопатия, n (%) | 82 (31,5) | 339 (30,5) | 0,954 (0,713–1,277) | 0,754 |
ИБС, n (%) | 61 (23,5) | 206 (18,6) | 0,743 (0,537–1,028) | 0,072 |
ИМ, n (%) | 23 (8,8) | 75 (6,8) | 0,747 (0,458–1,216) | 0,239 |
ЦВБ, n (%) | 26 (10,0) | 77 (6,9) | 0,671 (0,421–1,070) | 0,092 |
ХСН, n (%) | 57 (21,9) | 1033 (23,2) | 0,932 (0,673–1,290) | 0,671 |
Примечание. Регрессионный анализ Кокса. ОР — относительный риск, ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ЦВБ — цереброваскулярная болезнь, ХСН — хроническая сердечная недостаточность.
Таблица 4. Сравнение применения препаратов в различных кластерах сахарного диабета 2 типа
Препарат | Кластер 1 | Кластер 2 | Кластер 3 | Р |
N | 1003 | 432 | 1370 | |
МФ хороший ответ, n (%) плохой ответ, n (%) | 162 (16,2)* 105 (10,5)* | 77 (17,8)* 54 (12,5)* | 143 (10,4)* 112 (8,2)* | <0,001 |
СМ хороший ответ, n (%) плохой ответ, n (%) | 61 (6,1)* 145 (14,5)* | 34 (7,9)* 50 (11,6)* | 31 (2,3)* 365 (26,6)* | <0,001 |
МФ+СМ хороший ответ, n (%) плохой ответ, n (%) | 132 (13,2)* 375 (37,4)* | 61 (14,1)* 151 (35,0)* | 85 (6,2)* 508 (37,1)* | <0,001 |
Только инсулинотерапия, n (%) | 103 (10,3)* | 4 (0,9)* | 723 (52,8)* | <0,001 |
Примечание: МФ — метформин, СМ — производные сульфонилмочевины.
*статистическая значимость различий: непараметрический метод Kruskal–Wallis test.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Клиническая характеристика обследованных нами больных согласуется с данными других эпидемиологических исследований [9] и отражает в целом популяцию больных СД2, что в определенной степени позволяет экстраполировать полученные нами результаты на целевую популяцию.
Сопоставление с другими публикациями
Проведенное исследование, включившее 2085 больных СД2 с различной длительностью заболевания, подтвердило возможность использования кластерного анализа для выделения фенотипов СД2 на российской популяции. Однако в отличие от предложенных Ahlqvist E. переменных: HbA1c, ИМТ, возраст на момент постановки диагноза и оценки индексов HOMA-IR и HOMA-В [2], мы использовали HbA1c, возраст на момент постановки диагноза, ИМТ, уровень С-пептида, пол. Выбор в качестве переменной уровня С-пептида, а не индексов HOMA-IR и HOMA-В был продиктован особенностями включенной в исследование популяции с различной длительностью диабета и инсулинотерапией. Аналогично нашей работе Pigeyre М. и соавт. при проведении кластерного анализа в когорте больных, участвовавших в исследовании ORIGIN, где пациенты получали только инсулинотерапию, использовали в качестве переменных уровень С-пептида, возраст на момент постановки диагноза, ИМТ, HbA1с, антитела GADA. Этим авторам удалось воспроизвести 5 кластеров: кластер 1 — аутоиммунный диабет, кластер 2 — тяжелый диабет с дефицитом инсулина, кластер 3 — тяжелый инсулинорезистентный диабет, кластер 4 — легкий диабет, связанный с ожирением, кластер 5 — легкий диабет пожилых [10].
Так, как в данном исследовании исключались пациенты старше 70 лет и больные СД при наличии антител к GADA, нами были выделены три кластера: кластер 1 с сохраненной функцией β-клеток встречался в 35,7% случаев и соответствовал ранее описанному кластеру с легким диабетом и ожирением, наши данные были такими же, как в исследовании Zou X. и соавт., — 38% [4]. Кластеру с выраженной инсулинорезистентностью в нашей работе соответствовал кластер 2 с повышенной функцией β-клеток, который был у 15,4% пациентов, что было сопоставимо с данными Pigeyre M. и соавт. — 13% [10]. Кластеру тяжелого инсулинодефицитного диабета соответствовал кластер 3 со сниженной функцией β-клеток, который регистрировался нами в 48,8%, что было значительно чаще, чем в исследовании Pigeyre M., — 23% [10]. Этот факт можно объяснить большей длительностью диабета у наших пациентов. Таким образом, для пациентов с длительным диабетом, независимо от получаемой терапии, для стратификации и определения фенотипа в качестве одной из переменных можно использовать уровень С-пептида, что расширяет возможности данного метода в клинической практике. Два ранее описанных кластера — аутоиммунного диабета и легкого диабета пожилых [2, 10] — нами не были определены, так как эти больные исключались из исследования.
Было установлено, что кластер с повышенной функцией β-клеток, так же, как и в других исследованиях, ассоциирован с более ранним развитием нефропатии [4–7][10][11]. Описанная Xing L. и соавт. [11] высокая частота поражения почек при СД2 у мужчин [11] нами выявлена только в кластере с сохраненной функцией β-клеток и составила 36,4%, у женщин — 29,3%, риск развития нефропатии в этом кластере у мужчин был выше на 27% по сравнению с женщинами (ОР (95% ДИ): 0,724 (0,530–0,988); р=0,041). В кластере с повышенной функцией β-клеток, так же, как и в работе немецких авторов [10], установлено более ранее развитие диабетической нейропатии. При этом в кластере со сниженной функцией β-клеток частота нейропатии была выше у мужчин — 56,9% по сравнению с женщинами — 49,3%, а риск развития нейропатии в данном кластере у мужчин был выше на 26% (ОР (95% ДИ): 0,735 (0,560–0,965); р=0,026) по сравнению с женщинами. В отличие от Pigeyre M. и соавт., которыми не выявлено различий в частоте развития диабетической ретинопатии при различных кластерах, Ahlqvist E. и соавт., установили, что кластер тяжелого инсулинодефицитного диабета ассоциирован с повышенным в 1,5 раза риском диабетической ретинопатии [2, 3, 7, 10]. Мы впервые отметили более ранее развитие диабетической ретинопатии в кластере с повышенной функцией β-клеток.
Различий в частоте возникновения ССЗ при различных кластерах выявлено не было, что сопоставимо с результатами других подобных исследований [13][14]. Однако в работе Kahkoska А. и соавт. [12], которые объединили пациентов с недавно диагностированным диабетом из трех глобальных исследований (DEVOTE, LEADER, SUSTAIN-6) и провели кластерный анализ на основе трех переменных (возраста на момент постановки диагноза, исходного уровня HbA1c и ИМТ), была установлена повышенная частота сердечно-сосудистых событий в кластере с высоким HbA1c и низким ИМТ [12].
При анализе медикаментозной стратегии, основанной на кластерном анализе, так же как и Dennis J.M. и соавт., которые выявили, что кластеры имеют различия в ответе на сахароснижающую терапию [13], нами выявлено, что в кластере 2 (с повышенной функцией β-клеток) достоверно чаще регистрировался хороший ответ на монотерапию МФ и комбинированную терапию МФ и СМ. Частота назначения инсулина была достоверно выше в кластере 3 (со сниженной функцией β-клеток), в котором инсулин был терапией первой линии у 52,8%. Dennis J.M. и соавт. проанализировал результаты двух проспективных исследований — ADOPT и RECORD, где сахароснижающая терапия у пациентов с впервые выявленным СД2 была представлена МФ, СМ и тиазолидиндионами. Авторами было отмечено преимущество по удержанию гликемического контроля в кластере тяжелого инсулинорезистентного диабета при использовании тиазолидиндионов и в кластере легкого диабета пожилых — препаратов СМ [13]. А исследование Pigeyre M. подтвердило целесообразность раннего назначения инсулина в группе инсулинодефицитного диабета [10].
Клиническая значимость результатов
В настоящее время нет клинических рекомендаций, основанных на кластерах диабета, но наши результаты в сочетании с данными других авторов позволяют предположить, что людям с выраженной инсулинорезистентностью и повышением функции β-клеток необходимо как можно раньше диагностировать хроническую болезнь почек с целью предотвращения неблагоприятных почечных исходов. А оценка специфичных для кластера вариантов эффективной сахароснижающей терапии может помочь в выборе класса сахароснижающих препаратов при гипергликемии. Таким образом, подход, сочетающий фенотипические показатели для прогнозирования осложнений диабета и ответа на терапию, имеет большую клиническую ценность.
Ограничения исследования
Наше исследование имеет несколько важных недостатков: умеренный размер выборки и включение пациентов с различной длительностью СД2, что может влиять на размер кластеров, увеличивая количество пациентов в кластере со сниженной функцией β-клеток и уменьшая количество больных в кластере с повышенной функцией β-клеток.
Направления дальнейших исследований
В настоящее время продолжается наблюдение за включенными в исследование пациентами для анализа риска развития осложнений и исходов в зависимости от клинического фенотипа СД2.
ЗАКЛЮЧЕНИЕ
На основе 5 переменных (HbA1c, возраст на момент постановки диагноза, ИМТ, уровень С-пептида, пол) выделено три кластера СД2: кластер 1 представлен 1003 пациентами (35,7%) с сохраненной функцией β-клеток, кластер 2 состоял из 432 пациентов (15,4%) с повышенной функцией β-клеток, кластер 3 представлен 1370 пациентами (48,8%) со сниженной функцией β-клеток. Выявлены клинические особенности СД в каждом кластере: кластер 2 (с повышенной функцией β-клеток) достоверно отличался большей частотой больных мужского пола, меньшей длительностью диабета, более низкими показателями глюкозы крови натощак и более высоким уровнем диастолического АД. В кластере 3 (со сниженной функцией β-клеток) отмечены наибольшая длительность диабета, высокий уровень глюкозы натощак, более низкое диастолическое АД. Кластер 1 (с сохраненной функцией β-клеток) имел промежуточные клинические и лабораторные параметры. Установлено более раннее развитие диабетических микрососудистых осложнений в кластере 2 по сравнению с кластерами 1 и 3. В кластере со сниженной функцией β-клеток терапией первой линии был инсулин в 52,8%, а в кластере с повышенной функцией β-клеток значимо чаще регистрировался хороший ответ на препараты, влияющие на инсулинорезистентность: монотерапию МФ и комбинированную терапию МФ и СМ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при поддержке гранта РФФИ 13-04-00520.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Бондарь И.А. — существенный вклад в концепцию исследования, в интерпретацию результатов исследования; внесение в рукопись существенной правки с целью повышения научной ценности статьи; Шабельникова О.Ю. — существенный вклад в концепцию исследования, в получение, анализ данных и интерпретацию результатов исследования, написание статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы выражают благодарность профессиональному математику Научно-исследовательского института терапии и профилактической медицины — филиала Федерального государственного бюджетного научного учреждения «Федеральный исследовательский центр Институт цитологии и генетики СО РАН» Лилии Валерьевне Щербаковой за помощь в проведении кластерного анализа.
Список литературы
1. Del Prato S. Heterogeneity of diabetes: heralding the era of precision medicine. Lancet Diabetes Endocrinol. 2019;7(9):659-661. doi: https://doi.org/10.1016/S2213-8587(19)30218-9
2. Ahlqvist E, Storm P, Käräjämäki A, et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol. 2018;6(5):361-369. doi: https://doi.org/10.1016/S2213-8587(18)30051-2
3. Bennet L, Nilsson C, Mansour-Aly D, et al. Adult-onset diabetes in Middle Eastern immigrants to Sweden: Novel subgroups and diabetic complications-The All New Diabetes in Scania cohort diabetic complications and ethnicity. Diabetes Metab Res Rev. 2021;37(6):e3419. doi: https://doi.org/10.1002/dmrr.3419
4. Zou X, Zhou X, Zhu Z, Ji L. Novel subgroups of patients with adult-onset diabetes in Chinese and US populations. Lancet Diabetes Endocrinol. 2019;7(1):9-11. doi: https://doi.org/10.1016/S2213-8587(18)30316-4
5. Tanabe H, Saito H, Kudo A, et al. Factors associated with risk of diabetic complications in novel cluster-based diabetes subgroups: A Japanese retrospective cohort study. J Clin Med. 2020;9(7):2083. doi: https://doi.org/10.3390/jcm9072083
6. Anjana RM, Baskar V, Nair ATN, et ai. Novel subgroups of type 2 diabetes and their association with microvascular outcomes in an Asian Indian population: a data-driven cluster analysis: the INSPIRED study. BMJ Open Diabetes Res Care. 2020;8(1):e001506. doi: https://doi.org/10.1136/bmjdrc-2020-001506
7. Zaharia OP, Strassburger K, Strom A, et al. German Diabetes Study Group. Risk of diabetes-associated diseases in subgroups of patients with recent-onset diabetes: a 5-year followup study. Lancet Diabetes Endocrinol. 2019;7(9):684-694. doi: https://doi.org/10.1016/S2213-8587(19)30187-1
8. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др Алгоритмы специализированной медицинской помощи больным сахарным диабетом (10-й выпуск) // Сахарный диабет. — 2021. — Т. 24 — №S1 — С. 1-235. doi: https://doi.org/10.14341/DM12802
9. Дедов И.И., Шестакова М.В., Викулова О.К. и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021 // Сахарный диабет. — 2021. — Т. 24. — №3. — С. 204-221. doi: https://doi.org/10.14341/DM12759
10. Pigeyre M, Hess S, Gomez MF, et al. Validation of the classification for type 2 diabetes into five subgroups: a report from the ORIGIN trial. Diabetologia. 2022;65(1):206-215. doi: https://doi.org/10.1007/s00125-021-05567-4
11. Xing L, Peng F, Liang Q, et al. Clinical characteristics and risk of diabetic complications in data-driven clusters among type 2 diabetes. Front Endocrinol (Lausanne). 2021;12(7):2083. doi: https://doi.org/10.3389/fendo.2021.617628
12. Kahkoska AR, Geybels MS, Klein KR, et al. Validation of distinct type 2 diabetes clusters and their association with diabetes complications in the DEVOTE, LEADER and SUSTAIN-6 cardiovascular outcomes trials. Diabetes Obes Metab. 2020;22(9):1537-1547. doi: https://doi.org/10.1111/dom.14063
13. Dennis JM, Shields BM, Henley WE, et al. Disease progression and treatment response in data-driven subgroups of type 2 diabetes compared with models based on simple clinical features: an analysis using clinical trial data. Lancet Diabetes Endocrinol. 2019;7(6):442-451. doi: https://doi.org/10.1016/S2213-8587(19)30087-7
14. Dennis JM. precision medicine in type 2 diabetes: Using individualized prediction models to optimize selection of treatment. Diabetes. 2020;69(10):2075-2085. doi: https://doi.org/10.2337/dbi20-0002
Об авторах
И. А. БондарьРоссия
Бондарь Ирина Аркадьевна - доктор медицинских наук, профессор
630091, Новосибирск, Красный проспект, д. 52
Конфликт интересов:
авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
О. Ю. Шабельникова
Россия
Шабельникова Олеся Юрьевна - кандидат медицинских наук.
Новосибирск
Конфликт интересов:
авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Время до развития диабетической нефропатии, нейропатии и ретинопатии при различных кластерах сахарного диабета 2 типа (кривая Каплана–Майера). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(282KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Бондарь И.А., Шабельникова О.Ю. Кластеры сахарного диабета 2 типа в Новосибирской области. Сахарный диабет. 2023;26(3):243-251. https://doi.org/10.14341/DM12993
For citation:
Bondar I.A., Shabelnikova O.Y. Type 2 diabetes clusters in the Novosibirsk region. Diabetes mellitus. 2023;26(3):243-251. (In Russ.) https://doi.org/10.14341/DM12993

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































