Перейти к:
Результаты ретроспективного исследования клинической эффективности и безопасности инсулина РинФаст® у детей с сахарным диабетом 1 типа
https://doi.org/10.14341/DM12977
Аннотация
ОБОСНОВАНИЕ. Актуальность исследования обоснована тем, что в течение последних лет в регионах Российской Федерации происходит замена оригинальных препаратов инсулина на биосимиляры. При этом исследований, описывающих применение биосимиляров инсулина у детей с сахарным диабетом 1 типа (СД1), в настоящее время мало как в отечественных, так и в зарубежных источниках.
ЦЕЛЬ. Оценить эффективность и безопасность терапии инсулином РинФаст® (ООО «ГЕРОФАРМ», Россия) в качестве болюсной терапии в комбинации с инсулином длительного действия и в качестве монотерапии в инсулиновой помпе у детей с СД1 в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ. Оценивались динамика гликированного гемоглобина (HbA1c) через 3 и 6 месяцев, изменение суточной потребности в инсулине, частота эпизодов постпрандиальной гипер- и гипогликемии, нежелательные реакции в местах инъекции, количество пациентов, достигших целевых значений HbA1c, среди детей с СД1, получавших РинФаст® не менее 6 месяцев после оригинального аналога инсулина аспарт.
РЕЗУЛЬТАТЫ. Исследование проводилось у 50 детей с СД1 от 1 до 18 лет (средний возраст 9,8±4,6 года) с длительностью СД1 более 1 года (средняя длительность 3,5±2,1 года), имевших HbA1c в начале наблюдения не более 9,5% и получавших лечение биосимиляром РинФаст® не менее 6 месяцев после перевода с оригинального аналога инсулина аспарт. Базис-болюсная инсулинотерапия у 36 детей проводилась с использованием многократных инъекций инсулина (МИИ), у 14 — с непрерывной подачей инсулина (НПИ) с помощью помпы. Результатом исследования стали сопоставимые с исходным уровни HbA1c через 3 и 6 месяцев после начала терапии биосимиляром РинФаст® (р>0,05), отсутствие изменений суточной потребности в инсулине (р>0,05) и отсутствие увеличения частоты эпизодов постпрандиальной гипер- (р>0,05) и гипогликемии (р>0,05) и нежелательных явлений (р>0,05). Отмечена высокая приверженность к лечению биосимиляром РинФаст®.
ЗАКЛЮЧЕНИЕ. Полученные результаты указывают на отсутствие клинически значимого ухудшения показателей гликемического контроля после перевода детей с СД1 на терапию биосимиляром РинФаст®, что дает возможность его безопасного и эффективного применения у данной категории пациентов.
Для цитирования:
Дианов О.А., Олейник Д.А., Фофанова А.В. Результаты ретроспективного исследования клинической эффективности и безопасности инсулина РинФаст® у детей с сахарным диабетом 1 типа. Сахарный диабет. 2024;27(2):113-119. https://doi.org/10.14341/DM12977
For citation:
Dianov O.A., Oleynik D.A., Fofanova A.V. Results of a retrospective study of the clinical efficacy and safety of insulin RinFast® in children with type 1 diabetes mellitus. Diabetes mellitus. 2024;27(2):113-119. (In Russ.) https://doi.org/10.14341/DM12977
ОБОСНОВАНИЕ
Сахарный диабет (СД) — это хроническое социально значимое заболевание, распространенность которого в детском возрасте увеличивается с каждым годом, а общая численность детей с СД в России сегодня превышает 55 тыс., при этом подавляющее большинство из них (97,5–98,0%) — дети с СД 1 типа (СД1); ежегодно заболевают 6,5–7,0 тыс. детей до 18 лет. Так, в Российской Федерации, по данным Федерального регистра пациентов с сахарным диабетом, распространенность СД1 среди детей в возрасте до 14 лет с 2017 по 2021 гг. увеличилась с 93,0 до 130,5 случаев на 100 тыс. детского населения, а подростков в возрасте 15–17 лет — с 217,9 до 272,8 случаев на 100 тыс. подросткового населения. Заболеваемость СД1 у детей в 2021 г. составила 20,4 на 100 тыс. детского населения, у подростков — 14,5 на 100 тыс. подросткового населения [1].
В большинстве стран, включая Россию, регистрируется нарастание заболеваемости СД1 в детском возрасте, особенно в развивающихся странах и странах с высоким экономическим ростом. В ряде стран наблюдается непропорционально высокое нарастание заболеваемости СД1 у детей моложе 5 лет [2].
Целью лечения детей с СД1 является достижение максимально близкого к нормальному состоянию уровня углеводного обмена, нормальное физическое и соматическое развитие ребенка, развитие самостоятельности и мотивации к самоконтролю, профилактика специфических осложнений СД1. Рекомендуется достижение и поддержание HbA1c у пациентов детского возраста с СД1 на уровне <7,0% для снижения риска развития и прогрессирования хронических осложнений СД1 [3].
Инсулинотерапия является основным неотъемлемым компонентом и единственным медикаментозным методом лечения СД1 у детей. Во всех возрастных группах основной целью инсулинотерапии является достижение и поддержание близкого к физиологическому уровню инсулинемии и оптимальный гликемический контроль.
Начиная с марта 2005 г. аналог инсулина короткого действия — инсулин аспарт разрешен к применению в клинической практике у детей с 1-го года. Отмечено, что гликемический контроль при постпрандиальном введении инсулина аспарт аналогичен таковому при препрандиальном введении [4]. При использовании непрерывного режима введения инсулина аспарт с помощью помпы отмечено достоверное снижение гликированного гемоглобина.
В данном клиническом исследовании будут оценены эффективность и безопасность лечения препаратом РинФаст® (биосимиляр аналога инсулина короткого действия аспарт) в качестве болюсной терапии в комбинации с базальной терапией препаратами длительного действия у пациентов детского возраста в условиях реальной клинической практики. Отдельно будут представлены данные о применении препарата РинФаст® у детей в виде монотерапии при непрерывном режиме введения с помощью инсулиновой помпы.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить эффективность и безопасность терапии инсулином РинФаст® (ООО «ГЕРОФАРМ», Россия) в качестве болюсной терапии в комбинации с инсулином длительного действия и в качестве монотерапии в инсулиновой помпе у детей сСД1 в реальной клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения
Клиническое исследование проводилось в ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России, на его клинической базе — Эндокринологический центр ГБУЗ Тверской области «Клиническая детская больница №2».
Время исследования
Набор пациентов проводился в период с 01.04.2021 по 30.11.2021 гг.
Изучаемые популяции
В клиническое исследование были включены 50 детей в возрасте от года до 18 лет с СД1, диагностированным в соответствии с Алгоритмами специализированной медицинской помощи больным сахарным диабетом (2019 г.) [3] с длительностью заболевания более 1 года, c уровнем гликированного гемоглобина (HbA1c) не более 9,5%, получающие инсулинотерапию в режиме многократных ежедневных инъекций или постоянной подкожной инфузии. Критерии исключения: нарушения функции печени, почек, надпочечниковая недостаточность, целиакия, нарушение функции щитовидной железы, наличие анемии, эпизодов диабетического кетоацидоза или тяжелой гипогликемии в течение последнего года.
Способ формирования выборки из изучаемой популяции
При формировании выборки использовался способ простого случайного отбора.
Дизайн исследования
Проведено одноцентровое динамическое ретроспективное одновыборочное неконтролируемое исследование.
Методы
Для оценки эффективности и безопасности применения инсулина РинФаст® анализировались следующие критерии: динамика HbA1c через 3 и 6 месяцев после перевода на инсулин РинФаст®, изменение суточной потребности в инсулине в Ед/кг/сут, частота эпизодов постпрандиальной гипергликемии (>10,0 ммоль/л) и гипогликемии (<3,9 ммоль/л) за каждые 3 месяца наблюдения по данным дневников самоконтроля, нежелательные реакции в местах инъекции (липодистрофии, аллергические реакции), количество пациентов, достигших целевых значений HbA1c (<7,0%).
Все пациенты и их законные представители перед переводом на инсулин РинФаст® прошли повторный курс обучения в школе самоконтроля СД1 и были обеспечены средствами самоконтроля (тест-полосками, а с 2022 года — непрерывным мониторингом глюкозы).
В конце исследования проводилось анкетирование пациентов и их законных представителей, по результатам которого рассчитывался средний балл по каждому из утверждений. Анкета состояла из серии заявлений, относительно которых участников оценки просили указать степень их согласия с каждым заявлением по шкале от 1 до 5 (1 — совершенно не согласен; 2 — не полностью согласен; 3 — нейтральное отношение; 4 — больше согласен; 5 — полное согласие). Для всех заявлений уровень значений в интервале до 2,5 интерпретируется как «низкий»; от 2,5 до 4,0 — как «средний»; более 4,0 — как «высокий» [5].
Статистический анализ
Статистический анализ проводился с использованием программы Microsoft Excel. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента.
Этическая экспертиза
Соответствие клинического исследования нормам биомедицинской этики подтверждено заключением Комитета по этике ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России (протокол №7 от 29.03.2021 г.). Все пациенты 15–18 лет и законные представители пациентов до 15 лет дали информированное письменное добровольное согласие на участие в настоящем клиническом исследовании.
РЕЗУЛЬТАТЫ
В 2021–2022 гг. на базе Эндокринологического центра ГБУЗ Тверской области «Клиническая детская больница №2» (клиническая база ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России) проведено ретроспективное исследование клинической эффективности и безопасности терапии инсулином РинФаст® (ООО «ГЕРОФАРМ», Россия) в качестве болюсной терапии в комбинации с инсулином длительного действия и в качестве монотерапии в инсулиновой помпе у детей с СД1 в реальной клинической практике.
В исследование включено 50 детей с СД1 от 1 до 18 лет (средний возраст 9,8±4,6 года) с длительностью заболевания более 1 года (средняя длительность — 3,5±2,1 года), имевших HbA1c в начале наблюдения не более 9,5% и получавших в лечении РинФаст® не менее 6 месяцев после оригинального аналога инсулина аспарт. Базис-болюсная инсулинотерапия у 36 детей проводилась с использованием многократных инъекций инсулина (МИИ), у 14 — непрерывной подачи инсулина (НПИ) с помощью инсулиновой помпы. Перевод на инсулинотерапию биосимиляром РинФаст® осуществлялся в соотношении 1:1, корректировали дозу пациенты самостоятельно. Выбываний пациентов из клинического исследования не было.
Средний уровень HbA1c у детей с СД1, получавших оригинальный аналог инсулина аспарт, перед переводом на РинФаст®, составил 7,84±1,36%. Через 3 месяца после перевода на РинФаст® средний уровень HbA1c у детей с СД1 составил 7,72±1,04% (р>0,05 в сравнении с исходным), а через 6 месяцев — 7,41±0,80% (р>0,05 в сравнении с исходным и через 3 месяца; рис. 1).
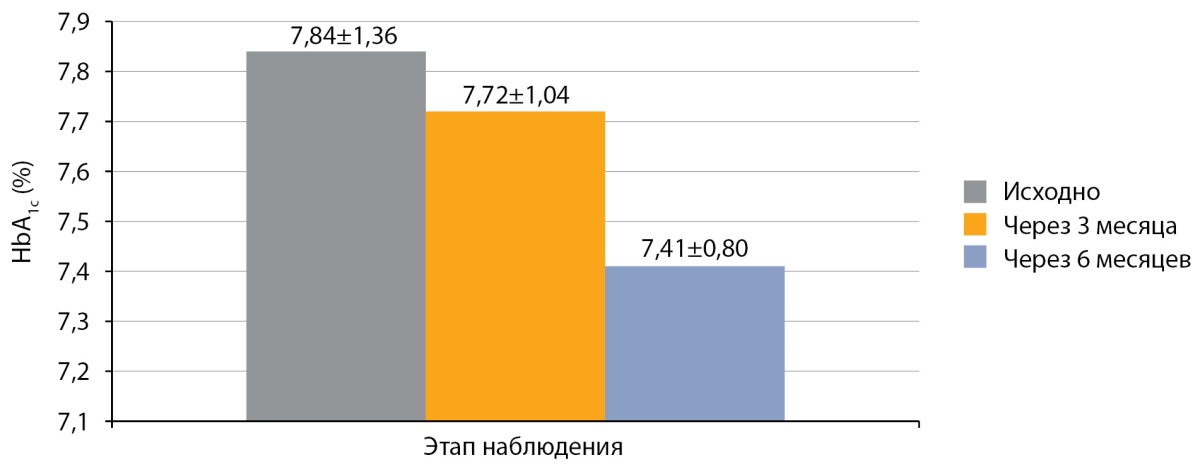
Рисунок 1. Динамика HbA1c после перевода на РинФаст®
у детей с сахарным диабетом 1 типа (n=50; M±SD).
Средний уровень HbA1c у детей с СД1, получавших оригинальный аналог инсулина аспарт на МИИ, перед переводом на РинФаст® составил 8,09±1,37%. Через 3 месяца после перевода на РинФаст® средний уровень HbA1c у детей с СД1 на МИИ составил 8,06±0,94% (р>0,05), а через 6 месяцев — 7,72±0,77% (р>0,05; рис. 2). Наблюдалась тенденция к снижению HbA1c через 6 месяцев, но достоверные различия отсутствовали.
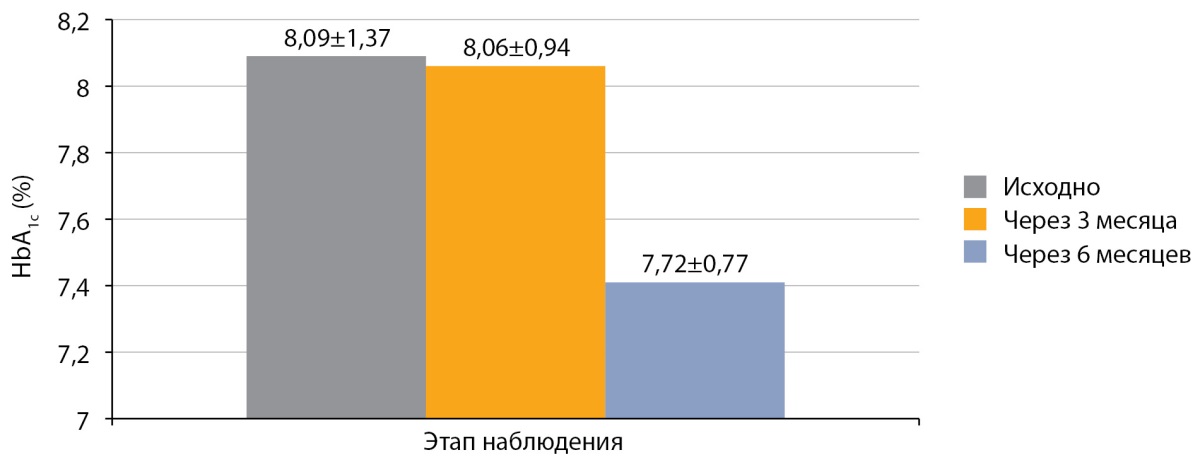
Рисунок 2. Динамика HbA1c после перевода на РинФаст®
у детей с сахарным диабетом 1 типа
на многократных инъекциях инсулина (n=36; M±SD).
Средний уровень HbA1c у детей с СД1, получавших оригинальный аналог инсулина аспарт на НПИ, перед переводом на РинФаст® составил 7,21±1,14%. Через 3 месяца после перевода на РинФаст® средний уровень HbA1c у детей с СД1 на НПИ составил 6,94±0,84% (р>0,05), а через 6 месяцев — 6,73±0,59% (р>0,05; рис. 3). Наблюдалась также тенденция к снижению HbA1c и через 3 месяца, и через 6 месяцев, но значимых различий не отмечалось.
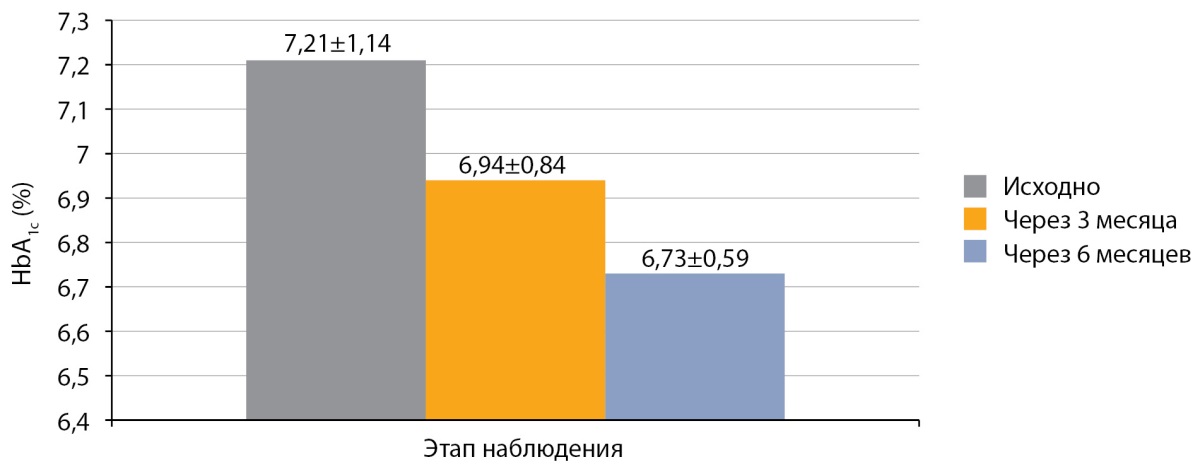
Рисунок 3. Динамика HbA1c после перевода на РинФаст®
у детей с сахарным диабетом 1 типа на инсулиновой помпе (n=14; M±SD).
Анализ динамики суточной потребности в инсулине после перевода на РинФаст® показал отсутствие достоверного изменения как через 3 месяца, так и через 6 месяцев у детей с СД1, как на МИИ, так и на НПИ (рис. 4).
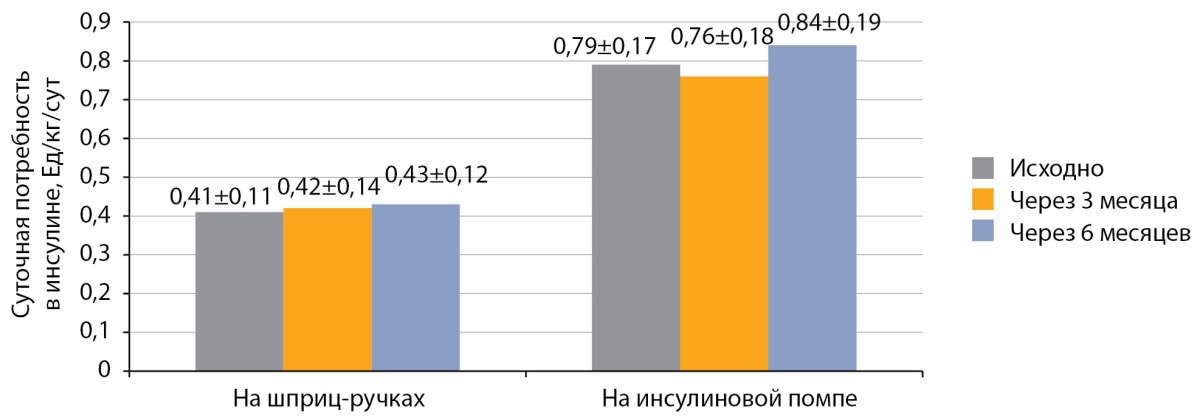
Рисунок 4. Динамика суточной потребности в инсулине после перевода на РинФаст®
у детей с сахарным диабетом 1 типа (Ед/кг/сут; M±SD).
Оценка данных самоконтроля гликемии не определила значимого изменения количества гипер- и гипогликемий, не удовлетворяющих целевые показатели гликемии (более 10,0 ммоль/л и менее 3,9 ммоль/л) через 3 и через 6 месяцев (p>0,05 в обоих случаях; рис. 5).
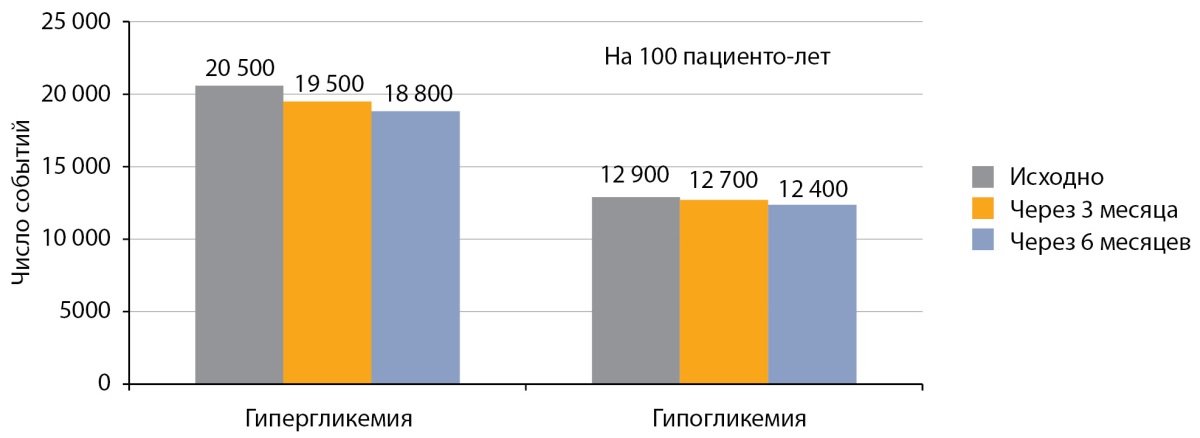
Рисунок 5. Динамика постпрандиальных гипергликемий (более 10 ммоль/л)
и гипогликемий (менее 3,9 ммоль/л) после перевода на РинФаст®
у детей с сахарным диабетом 1 типа (n=50).
Доля детей с СД1, имевших целевой уровень HbA1c (<7,0%), исходно составляла 26,0%. Через 3 месяца после начала использования инсулина РинФаст® эта доля детей составила 30,0%. К концу клинического исследования (через 6 месяцев) она составила 40,0% (рис. 6), что объясняется проведением повторного обучения в школе самоконтроля СД1 перед переводом на инсулин РинФаст® и началом использования в 2022 г. системы непрерывного мониторинга глюкозы.
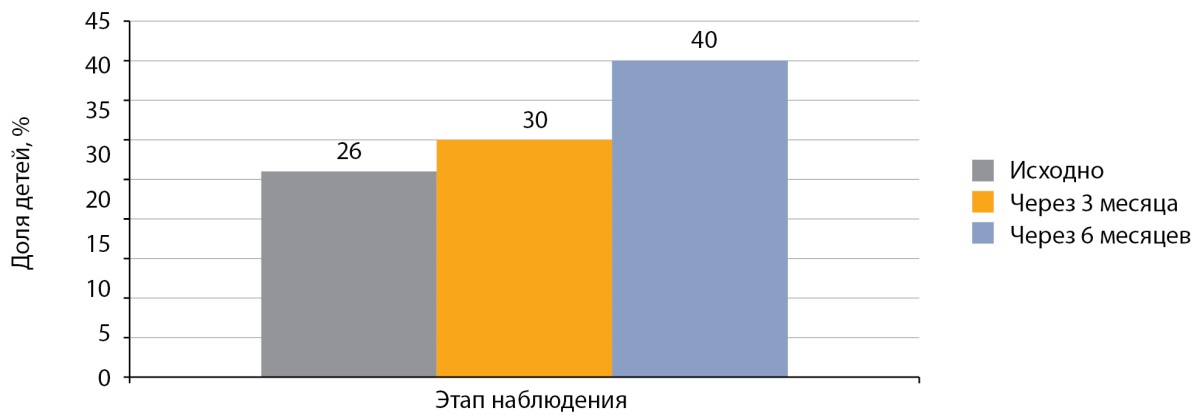
Рисунок 6. Доля детей с сахарным диабетом 1 типа,
достигших целевого уровня HbA1c (<7,0%), после перевода на РинФаст®.
Эпизодов тяжелой гипогликемии и диабетического кетоацидоза, требующих экстренной госпитализации детей с СД1, после перевода на РинФаст® зарегистрировано не было. Нежелательных реакций в местах инъекций РинФаст® (липодистрофии, аллергические реакции) у детей с СД1 за время исследования не наблюдалось.
Результаты проведенного анкетирования показали высокую удовлетворенность и приверженность пациентов к терапии инсулином РинФаст®. Средний балл степени согласия участников анкетирования по каждому из утверждений был более 4,0 (табл. 1).
Таблица 1. Результаты анкетирования пациентов после перевода на инсулин РинФаст® (M±SD)
|
№ |
Вопрос |
Результат, балл |
|
1 |
Шприц-ручка для инсулина РинФаст® проста в использовании, набор дозы и проведение инъекции не вызывает затруднений |
4,82±0,32 |
|
2 |
Меня устраивает эффективность терапии инсулином РинФаст® по достижению оптимального гликемического контроля |
4,24±0,64 |
|
3 |
Перевод на терапию инсулином РинФаст® не оказал негативного влияния на показатели гликемии |
4,18±0,59 |
|
4 |
Перевод на терапию инсулином РинФаст® не сопровождался возникновением нежелательных явлений |
4,60±0,31 |
|
5 |
Я хотел бы продолжать терапию инсулином РинФаст® |
4,24±0,64 |
ОБСУЖДЕНИЕ
Репрезентативность выборок
Репрезентативность выборки позволяет сделать выводы по настоящему клиническому исследованию и может экстраполироваться на целевую популяцию — детей с СД1, так как набор участников исследования проводился в лечебно-профилактическом учреждении федерального центра по территориальному принципу.
Сопоставление с другими публикациями
Биосимиляры аналогов инсулинов занимают все более значимое место в лечении пациентов, нуждающихся в инсулинотерапии, позволяя без ухудшения качества лечения значительно снизить его стоимость [6]. Проведение исследований клинической биоэквивалентности биосимиляра и оригинального препарата, а также иммуногенной безопасности, согласно требованиям регуляторных органов, позволяет говорить о безопасности и эффективности биоподобных препаратов. Проведенные ранее исследования выявили высокую степень схожести РинФаст® с референтным препаратом НовоРапид®: были получены высокой степени схожести данные в in vitro фармакодинамических исследованиях, были доказаны эквивалентная биодоступность в гиперинсулинемических эугликемических клэмпах и сопоставимая иммуногенность [7]. Доказанные в ходе физико-биохимических исследований биоэквивалентности, гиперинсулиновых эугликемических клэмп-исследований, а также наблюдательных исследований III фазы безопасность, в том числе иммуногенная, эффективность биосимиляров инсулинов, клиническая биоэквивалентность инсулина РинФаст® и оригинального препарата аспарт позволили экстраполировать на биосимиляр все показания, противопоказания, нежелательные реакции из инструкции по медицинскому применению референтного препарата.
Клиническая значимость результатов
Клиническая значимость результатов исследования дает возможность широкого использования РинФаст® (ООО «Герофарм», Россия) в педиатрической практике.
Ограничения исследования
Ограничение исследования — невключение детей с СД1, исходно получавших другие аналоги инсулина короткого действия и получавших аспарт менее 3 месяцев.
ЗАКЛЮЧЕНИЕ
Использование в реальной клинической практике для лечения СД1 у детей биосимиляра РинФаст® (ООО «Герофарм», Россия) показало отсутствие клинически значимого ухудшения показателей гликемического контроля после перевода детей с СД1 на терапию инсулином РинФаст®, так как уровень показателей гликемического контроля был сравним с таковым при использовании аналога инсулина аспарт, что указывало на достаточную эффективность, а отсутствие неотложных состояний и нежелательных местных реакций — на безопасность его применения. Проведенное анкетирование детей с СД1 и их законных представителей выявило удобство использования шприц-ручки РинФаст®, а также хорошую приверженность к лечению с применением инсулина РинФаст®.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Клиническое исследование и подготовка публикации проведены при поддержке ООО «Герофарм» (Россия).
Конфликт интересов. Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Дианов О.А. — концепция и дизайн исследования, анализ полученных данных, написание статьи и редактирование; Олейник Д.А. — получение и интерпретация результатов, анализ полученных данных; Фофанова А.В. — получение и интерпретация результатов, анализ полученных данных.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы выражают благодарность ФГБОУ ВО «Тверской государственный медицинский университет» Минздрава России (ректор — проф. Л.В. Чичановская) и ГБУЗ Тверской области «Клиническая детская больница №2» (главный врач — к.м.н. Э.П. Гнатенко) за помощь в организации и проведении клинического исследования.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Эпидемиологические характеристики сахарного диабета в Российской Федерации: клинико-статистический анализ по данным регистра сахарного диабета на 01.01.2021 // Сахарный диабет. — 2021. — Т. 24. — №3. — С. 204-221. https://doi.org/10.14341/DM12759
2. International Diabetes Federation. IDF Diabetes Atlas, 10th edn. Brussels, Belgium: International Diabetes Federation, 2021
3. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова (11-й выпуск) // Сахарный диабет. — 2023. — Т. 26. — № 2S. — С. 1-157. https://doi.org/10.14341/DM13042
4. Jovanovic L, Giammattei J, Acquistapace M, Bornstein K, Sommermann E, Pettitt DJ. Efficacy Comparison between preprandial and postprandial insulin aspart administration with dose adjustment for unpredictable meal size. Clin Ther. 2004;26(9):1492-1497. https://doi.org/10.1016/j.clinthera.2004.09.001
5. Национальные рекомендации Российского научного медицинского общества терапевтов по количественной оценке приверженности к лечению. — М., 2017. — 24 с.
6. Heinemann L. Biosimilar Insulin and Costs. J Diabetes Sci Technol. 2016;10(2):457-462. https://doi.org/10.1177/1932296815605337
7. Каронова Т.Л., Майоров А.Ю. Изучение эквивалентности и сопоставимой иммуногенности биосимиляра инсулина аспарт в сравнении с зарегистрированным аналогом // Медицинский совет. — 2022. — Т. 16. — №10. — С. 75-82. https://doi.org/10.21518/2079-701Х-2022-16-10-75-82
Об авторах
О. А. ДиановРоссия
Дианов Олег Августович - к.м.н., доцент; Scopus Author ID: 56712956700.
170000, Тверь, ул. Советская, д. 4
Конфликт интересов:
Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Д. А. Олейник
Россия
Олейник Дарина Александровна
Тверь
Конфликт интересов:
Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
А. В. Фофанова
Россия
Фофанова Анна Васильевна
Тверь
Конфликт интересов:
Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Динамика HbA1c после перевода на РинФаст® у детей с сахарным диабетом 1 типа (n=50; M±SD). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(105KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Динамика HbA1c после перевода на РинФаст® у детей с сахарным диабетом 1 типа на многократных инъекциях инсулина (n=36; M±SD). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(103KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Динамика HbA1c после перевода на РинФаст® у детей с сахарным диабетом 1 типа на инсулиновой помпе (n=14; M±SD). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(109KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Динамика суточной потребности в инсулине после перевода на РинФаст® у детей с сахарным диабетом 1 типа (Ед/кг/сут; M±SD). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(135KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Динамика постпрандиальных гипергликемий (более 10 ммоль/л) и гипогликемий (менее 3,9 ммоль/л) после перевода на РинФаст® у детей с сахарным диабетом 1 типа (n=50). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(124KB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Доля детей с сахарным диабетом 1 типа, достигших целевого уровня HbA1c (<7,0%), после перевода на РинФаст®. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(95KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дианов О.А., Олейник Д.А., Фофанова А.В. Результаты ретроспективного исследования клинической эффективности и безопасности инсулина РинФаст® у детей с сахарным диабетом 1 типа. Сахарный диабет. 2024;27(2):113-119. https://doi.org/10.14341/DM12977
For citation:
Dianov O.A., Oleynik D.A., Fofanova A.V. Results of a retrospective study of the clinical efficacy and safety of insulin RinFast® in children with type 1 diabetes mellitus. Diabetes mellitus. 2024;27(2):113-119. (In Russ.) https://doi.org/10.14341/DM12977

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































