Перейти к:
Роль специфических панкреатических антител в дифференциальной диагностике полной клинико-лабораторной ремиссии сахарного диабета 1 типа и MODY у детей
https://doi.org/10.14341/DM12921
Аннотация
ОБОСНОВАНИЕ. Сахарный диабет 1 типа (СД1) характеризуется аутоиммунным разрушением β-клеток, обусловленным влиянием факторов окружающей среды и генетической предрасположенностью. После начала инсулинотерапии у 80% детей с СД1 отмечаются снижение дозы инсулина и развитие клинико-лабораторной ремиссии СД1, или «медового месяца». При длительном отсутствии потребности в инсулине в случаях ранней доклинической диагностики СД1 и при полной клинико-лабораторной ремиссии СД1 более 6 мес возникает вопрос о необходимости проведения дифференциальной диагностики между аутоиммунным СД и неиммунными формами СД.
ЦЕЛЬ. Изучить клинические, иммунологические, генетические характеристики ремиссии СД1 и диабета взрослого типа у молодых лиц (MODY) у детей, определить дифференциально-диагностические критерии СД1 и MODY у детей.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое одномоментное двухвыборочное неконтролируемое сравнительное исследование, включающее данные 150 детей, госпитализированных в ФГБУ «НМИЦ эндокринологии» в 2016–2021 гг. Изучены 2 популяции пациентов: 1-я популяция — пациенты с полной клинико-лабораторной ремиссией СД1 (n=36), 2-я популяция — пациенты с MODY, подтвержденным в ходе молекулярно-генетического исследования (n=114).
РЕЗУЛЬТАТЫ. Медиана возраста манифестации СД значимо выше у пациентов с СД1 — 11,25 года [8,33; 13,78] против MODY — 7,5 года [4,6; 12,2] (p=0,004). У пациентов с ремиссией СД1 уровень гликированного гемоглобина составил 6,0% [5,6; 6,4], при MODY — 6,5% [6,2; 6,7] (p<0,001). Для пациентов с MODY наиболее характерно нарушение гликемии натощак — 6,27 ммоль/л [5,38; 6,72], тогда как для ремиссии СД1 характерна нормогликемия — 5,12 ммоль/л [4,17; 5,87]. При проведении перорального глюкозотолерантного теста уровни гликемии на 120-й минуте в 2 группах значимо не отличались (p=0,08). Отягощенный наследственный анамнез у пациентов с MODY отмечался чаще (93% против 66,7%). Положительный титр аутоантител (АТ) чаще определялся у пациентов с ремиссией СД1 — 77,8%, у пациентов с MODY — 11,4%. У пациентов с MODY выявлялось повышение титра не более 1 вида АТ.
ЗАКЛЮЧЕНИЕ. Наибольшую значимость для проведения дифференциальной диагностики СД1 и MODY при длительном инсулиннезависимом периоде (более 6 мес) у детей с СД показали АТ ZnT8 и IA2. При отсутствии АТ рекомендовано проведение молекулярной диагностики. При выявлении только одного типа АТ решение о необходимости молекулярно-генетического анализа должно проводиться на основании комплексного анализа фенотипических характеристик пациента, включая данные наследственного анамнеза, особенности манифестации, показателей углеводного обмена.
Для цитирования:
Сечко Е.А., Романенкова Е.М., Еремина И.А., Зильберман Л.И., Никанкина Л.В., Зураева З.Т., Безлепкина О.Б., Петеркова В.А., Лаптев Д.Н. Роль специфических панкреатических антител в дифференциальной диагностике полной клинико-лабораторной ремиссии сахарного диабета 1 типа и MODY у детей. Сахарный диабет. 2022;25(5):449-457. https://doi.org/10.14341/DM12921
For citation:
Sechko E.A., Romanenkova E.M., Eremina I.A., Zilberman L.I., Nikankina L.V., Zuraeva Z.T., Bezlepkina O.B., Peterkova V.A., Laptev D.N. The role of specific pancreatic antibodies in the differential diagnosis of complete clinical and laboratory remission of type 1 diabetes mellitus and MODY in children. Diabetes mellitus. 2022;25(5):449-457. (In Russ.) https://doi.org/10.14341/DM12921
ОБОСНОВАНИЕ
Сахарный диабет 1 типа (СД1) характеризуется аутоиммунным разрушением β-клеток, обусловленным влиянием факторов окружающей среды и генетической предрасположенностью. В детском возрасте более 90% всех случаев СД приходится на СД1 [1]. Развитие СД1 включает в себя 3 стадии: 1-я стадия характеризуется наличием аутоиммунного процесса, нарушения углеводного обмена отсутствуют; 2-я стадия — аутоиммунный процесс, который сопровождается дисгликемией, клинические симптомы СД отсутствуют; 3-я стадия — манифестация заболевания, появляются клинические проявления СД (полиурия, полидипсия, снижение массы тела и т.д.). По данным проспективных исследований по изучению детей из групп риска по развитию СД1, выявление гипергликемии возможно задолго (более 2 лет) до манифестных проявлений СД1 [2][3].
После начала инсулинотерапии у 80% детей с СД1 отмечаются снижение дозы инсулина и развитие клинико-лабораторной ремиссии СД1, или «медового месяца» [4]. У 0–3,2% возможна полная отмена инсулина, в таких случаях говорят о полной клинико-лабораторной ремиссии [1][5]. Развитие ремиссии отражает частичное функциональное восстановление β-клеток, повышение периферической чувствительности к инсулину [6]. Длительность «медового месяца» редко превышает полгода, вотдельных случаях может продолжаться в течение года и более [1].
При длительном отсутствии потребности в инсулине в случаях ранней доклинической диагностики СД1 и при полной клинико-лабораторной ремиссии СД1 более 6 мес возникает вопрос о необходимости проведения дифференциальной диагностики между аутоиммунными и неиммунными формами СД, в первую очередь MODY (акроним названия maturity-onset diabetes of the young — диабет взрослого типа у молодых лиц). Схожесть клинической картины при СД1 и MODY приводит надогенетическом этапе как к гипердиагностике MODY и избыточному направлению на молекулярно-генетическое исследование пациентов с аутоиммунным СД, так и недостаточному выявлению MODY. По данным В. Shields и соавт., до 80% случаев MODY не диагностированы, по данным исследования SEARCH, 94% молодых пациентов с MODY наблюдались с диагнозами СД1 и СД 2 типа (СД2) [7][8]. Правильный клинический диагноз оказывает влияние на выбор тактики ведения, определяет прогноз заболевания у пациента и позволяет рассчитать риск развития заболевания у родственников. Таким образом, вопрос дифференциальной диагностики полной клинико-лабораторной ремиссии СД1 и MODY у детей остается актуальным и требует дальнейшего изучения.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучение клинических, иммунологических, генетических характеристик ремиссии СД1 и MODY у детей, определение дифференциально-диагностических критериев СД1 и MODY у детей.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование проведено в детском отделении сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России.
Время исследования. В исследование включены данные из историй болезни пациентов, проходивших стационарное обследование с января 2016 г. по июнь 2021 г.
Изучаемые популяции (одна или несколько)
Изучены 2 популяции пациентов: 1-я популяция — пациенты с полной клинико-лабораторной ремиссией СД1. 2-я популяция — пациенты с MODY, подтвержденным в ходе молекулярно-генетического исследования.
Критерии включения для популяции пациентов с полной клинико-лабораторной ремиссией СД1:
- возраст менее 18 лет;
- диагноз СД1 установлен согласно диагностическим критериям по уровню гликемии и/или гликированного гемоглобина (HbA1c), а также наличию повышения титра одного или более аутоантител (АТ), ассоциированных с диабетом, при отсутствии АТ — наличию острого характера манифестации СД (диабетический кетоацидоз (ДКА) и/или повышенный уровень кетонов в крови/моче, полиурия, полидипсия, потеря массы тела и др.) и отсутствию патогенных вариантов при молекулярно-генетическом исследовании;
- длительность СД не менее 6 мес;
- отсутствие потребности в инсулине без ухудшения показателей гликемии на момент проведения обследования.
Критерии включения для популяции MODY:
- возраст менее 18 лет;
- выявление гетерозиготной мутации в одном из генов, известных как приводящие к моногенному СД (ABCC8, ALMS1, AKT2, ARMC5, BLK, CACNA1D, DIS3L2, EIF2AK3, FOXA2, GATA6, GCG, GCGR, GCK, GLIS3, GLUD1, GPC3, HADH, HNF1A, HNF1B, HNF4A, IGF1, IGF1R, INS, INSR, KDM6A, KCNJ11, LIPE, MC3R, MC4R, NEUROD1, NSD1, PAX4, PDX1, PGM1, PIK3CA, PPARG, PTF1A, RFX6, SH2B1, SIM1, SLC16A1, TUB, UCP2, WFS1, ZFP57). Критериями направления на молекулярно-генетическое исследование были: отсутствие или небольшая потребность в инсулине (менее 0,5 Ед/кг/сут), сохранная секреция инсулина и С-пептида, отсутствие специфических панкреатических антител и/или отягощенный семейный анамнез по СД.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборка формировалась сплошным методом.
Дизайн исследования
Исследование одноцентровое одномоментное двухвыборочное неконтролируемое сравнительное.
Методы
Изучены общеклинические данные, которые включали следующие показатели: возраст диагностики СД1, характер диагностики, наследственный анамнез, антропометрические показатели (SDS ИМТ (число стандартных отклонений от среднего индекса массы тела для конкретного возраста и пола)). За диагностический критерий ожирения был принят SDS ИМТ>2,0 (ВОЗ, 2007).
Оценка состояния углеводного обмена и секреция С-пептида проводились на основании стандартного перорального глюкозотолерантного теста (ПГТТ) из расчета 1,75 г безводной глюкозы на 1 кг массы тела ребенка, но не более 75 г сухого вещества (ВОЗ, 1998–2013): уровни глюкозы и С-пептида исследовались натощак, на 60-й и 120-й минуте в ходе нагрузки.
Молекулярно-генетическое исследование проводилось в ФГБУ «НМИЦ эндокринологии» методом NGS [9]. Иммунологическое исследование: количественное определение АТ к цитоплазматическим структурам β-клеток (ICA), к глутаматдекарбоксилазе (GAD) и антиинсулиновых АТ (IAA) проводилось с помощью иммуноферментных наборов Isletest-ICA, GADA, IAA фирмы Biomerica, АТ к тирозинфосфатазе (IA-2) — наборов Medizym фирмы Medipan MGBH, АТ к транспортеру цинка 8 (ZnT8) — иммуноферментных наборов Zinc Transporter 8 Autoantibody Human ELISA фирмы BioVendor.
Статистический анализ
Статистическая обработка полученных данных проводилась с использованием пакета статистических программ IBM SPSS Statistics 26.0 (США), MS Excel 2010 (Microsoft, США). Данные представлены в виде медианы значения и интерквартильного размаха (Ме (25; 75 перцентиль)); качественные данные представлены в виде абсолютных значений (n) и частот (%). Для сравнения двух независимых выборок по количественным признакам использовался критерий Манна–Уитни, по качественным признакам — критерий хи-квадрат (χ²). Критический уровень значимости различий принимался при p<0,05.
Этическая экспертиза
Протокол исследования был одобрен на заседании локального этического комитета ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол №7 от 24.04.2019 г.).
РЕЗУЛЬТАТЫ
Проанализированы данные историй болезни 1592 пациентов, которые проходили обследование в детском отделении сахарного диабета ФГБУ «НМИЦ эндокринологии» Минздрава России. Согласно установленным критериям, отобраны 2 группы пациентов: 36 пациентов с полной ремиссией СД1 с длительностью заболевания не менее 6 мес и 114 пациентов с MODY. У пациентов с MODY были выявлены гетерозиготные мутации в следующих генах: GCK — в 85,7% (n=98), HNF1A — в 3,5% (n=4),ABCC8 — в 1,8% (n=2), HNF1B — в 1,8% (n=2), INSR — в 1,8% (n=2), HNF4A — в 0,9% (n=1), INS — в 0,9% (n=1), WFS1 — в 0,9% (n=1), CEL — в 0,9% (n=1), AKT2 — в 0,9% (n=1), PTF1A — в 0,9% (n=1).
Клинико-лабораторная характеристика пациентов
Клинико-лабораторная характеристика пациентов представлена в табл. 1. Пациенты с ремиссией СД1 и MODY не отличались по полу. На момент проведения обследования пациенты были сопоставимы по возрасту в 2 группах. Длительность заболевания была меньше у пациентов с СД1.
Таблица 1. Клинико-лабораторная характеристика пациентов
|
Клинико-лабораторный показатель |
Ремиссия СД1 |
MODY |
p |
|
Соотношение полов, м:ж |
1,4:1 |
1:1,07 |
>0,05 |
|
Возраст при обследовании, лет |
13,5 [ 9,45; 15,3] |
11,9 [ 8,28; 14,4] |
>0,05 |
|
Длительность заболевания, лет |
1,1 [ 0,75; 2,2] |
2,1 [ 1,1; 4,8] |
<0,001 |
|
Возраст при диагностике, лет |
11,25 [ 8,33; 13,78] |
7,5 [ 4,6; 12,2] |
0,004 |
|
ИМТ, кг/м² |
19,05 [ 15,93; 22,13] |
17,62 [ 15,56; 20,56], |
>0,05 |
|
HbA1c, % |
6,0 [ 5,6; 6,4] |
6,5 [ 6,2; 6,7] |
<0,001 |
Примечания. СД1 — сахарный диабет 1 типа; MODY — акроним названия maturity-onset diabetes of the young — диабет взрослого типа у молодых лиц; ИМТ — индекс массы тела. Данные представлены в виде медианы и интерквартильного размаха: Me [Q1; Q3]. Сравнение групп проводилось с использованием критерия Манна–Уитни.
ИМТ и SDS ИМТ в обеих группах не различались. Доли пациентов с ожирением и избыточной массой тела были сопоставимы в 2 группах (p>0,05): при ремиссии СД1 ожирение встречалось у 8,3% пациентов (n=3), избыточная масса тела — у 16,7% (n=6), при MODY ожирение выявлено у 4,4% пациентов (n=5), избыточная масса тела — у 11,4% (n=13).
Характер манифестации СД
Пациенты с СД1 на момент диагностики нарушений углеводного обмена были значимо старше пациентов с MODY, причем СД был диагностирован в возрасте до 7 лет в 22,2% (n=8) и 42,1% (n=47), в возрасте от 7 до 12 лет — в 38,9% (n=14) и 31,6% (n=36), старше 12 лет — в 38,9% (n=14) и 26,3% (n=30) случаев при ремиссии СД1 и MODY соответственно (p=0,09). Клинические проявления СД при диагностике значительно чаще отмечались при СД1 (38,9%, n=14), чем при MODY (1,8%, n=2) (p<0,001).У 7 пациентов (19,4%) с ремиссией СД1 зафиксирован кетоз при манифестации, у 1 пациента (2,8%) — ДКА, в группе пациентов с MODY не зафиксировано ни одного случая ДКА. Умеренные клинические проявления СД (полиурия, полидипсия) отмечались у двух пациентов c GCK-MODY, в том числе у девочки с GCK-MODY отмечались кетонурия, снижение массы тела, при обследовании выявлен высокий уровень АТ (ZnT8A 145 Ед/л), у данной пациентки имеется сочетание моногенного иаутоиммунного СД.
Углеводный обмен
Уровень HbA1c был ниже у пациентов с ремиссией СД1 и составлял 6,0% [ 5,6; 6,4], в то время как при MODY — 6,5% [ 6,2; 6,7] (p<0,001).
Гликемия натощак была ниже у пациентов с ремиссией СД1 по сравнению с MODY — 5,12 ммоль/л [ 4,17; 5,87] и 6,27 ммоль/л [ 5,38; 6,72] соответственно. При проведении ПГТТ уровень глюкозы значимо не различался на 30, 90, 120-й минутах в двух группах. Уровень гликемии на 60-й минуте у пациентов с ремиссией СД1 был значимо выше, чем у пациентов с MODY, — 12,22 ммоль/л [ 9,73; 14,29] и 10,4 ммоль/л [ 8,52; 12,58] соответственно (рис. 1). Нормогликемия натощак была наиболее характерна для пациентов с ремиссией СД1, нарушенная гликемия натощак — для пациентов с MODY (p=0,003): натощак уровень гликемии соответствовал нормальным значениям у 63,8% (n=23) и 27,2% (n=31), нарушенной гликемии натощак — 25,0% (n=9) и 54,38% (n=62), диабетическому уровню — 14,1% (n=4) и 18,4% (n=21) пациентов при ремиссии СД1 и MODY соответственно. На 120-й минуте при проведении ПГТТ уровень гликемии в 2 группах значимо не отличался (p=0,08) и соответствовал нормальным значениям в 31,3% (n=10) и 29,8% (n=34), нарушенной толерантности к глюкозе — в 28,1% (n=9) и 48,0% (n=49), диабетическому уровню — в 40,6% (n=13) и 25,4% (n=29) случаев при ремиссии СД1 и MODY соответственно.
Уровни С-пептида натощак и в ходе ПГТТ в 2 группах не различались (рис. 2).
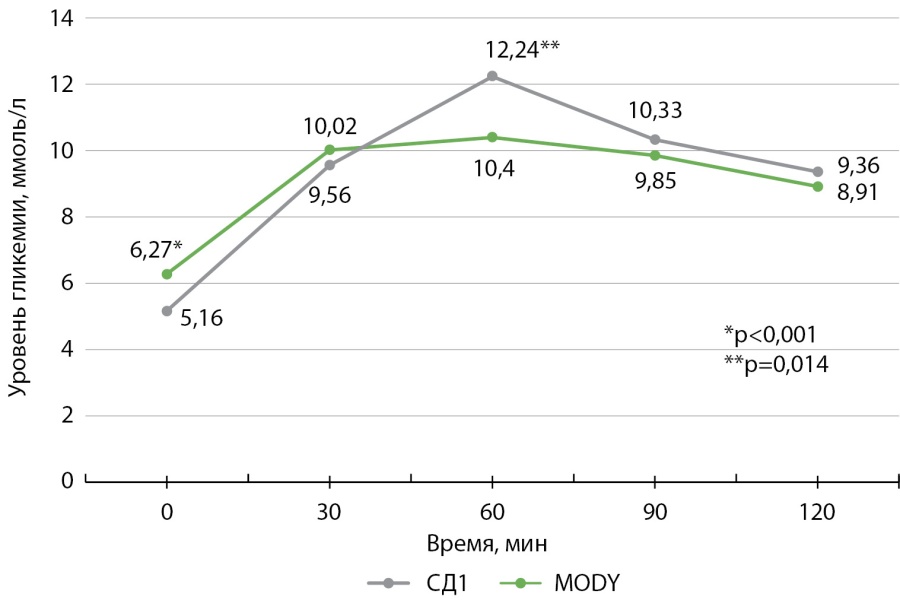
Рисунок 1. Уровень гликемии натощак и в ходе перорального глюкозотолерантного теста при ремиссии сахарного диабета 1 типа и диабете взрослого типа у молодых лиц (MODY).
Figure 1. Fasting and oral glucose tolerance test levels in remission type 1 diabetes mellitus and adult-onset diabetes in young adults (MODY).
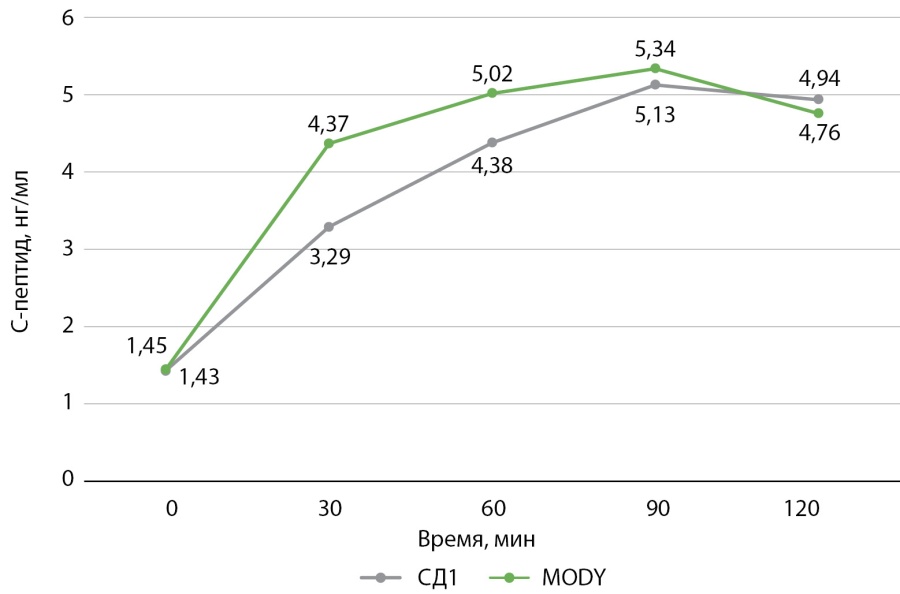
Рисунок 2. Уровень С-пептида натощак и в ходе перорального глюкозотолерантного теста у детей с полной клинико-лабораторной ремиссией сахарного диабета 1 типа и диабета взрослого типа у молодых лиц (MODY).
Figure 2. Fasting and oral glucose tolerance test C-peptide levels in children with complete clinical and laboratory remission of type 1 diabetes mellitus and adult type diabetes in young adults (MODY).
Анализ наследственного анамнеза
В наследственном анамнезе у пациентов с ремиссией СД1 нарушения углеводного обмена отмечались в 66,7% (n=24) случаев, в том числе у родственников 1-й степени родства (родители) — в 22,2% (n=8), что значимо реже, чем у пациентов с MODY. Родители пациентов с СД1 и ремиссией наблюдались с диагнозами: СД2 (n=3), гестационный СД (n=3), нарушенная толерантность к глюкозе (n=1), СД1 (n=1). При MODY нарушения углеводного обмена в наследственном анамнезе отмечались в 93% (n=106; p=0,014), в том числе у родственников 1-й степени родства — в 71,1% (n=81; p<0,001) случаев.
Антитела
Положительный титр 1 и более вида АТ значимо чаще определялся у пациентов с ремиссией СД1 — в 77,8% случаев (n=28) по сравнению с пациентами с MODY — 11,4% случаев (n=13) (рис. 3). Всем пациентам с отрицательным титром АТ в группе ремиссии СД1 проведено генетическое исследование. Патогенных вариантов в генах, ответственных за развитие MODY, не выявлено. Частота выявления АТ к ZnT8, IA2, ICA, GAD была значимо выше у пациентов с ремиссией СД1, частота выявления IAA в двух группах не различалась. При ремиссии СД1 один вид АТ определялся у 33,3% пациентов (n=12), 2 вида АТ — у 30,6% (n=11), более 3 видов АТ — у 13,9% (n=5). У пациентов с MODY выявлялось не более одного вида АТ.
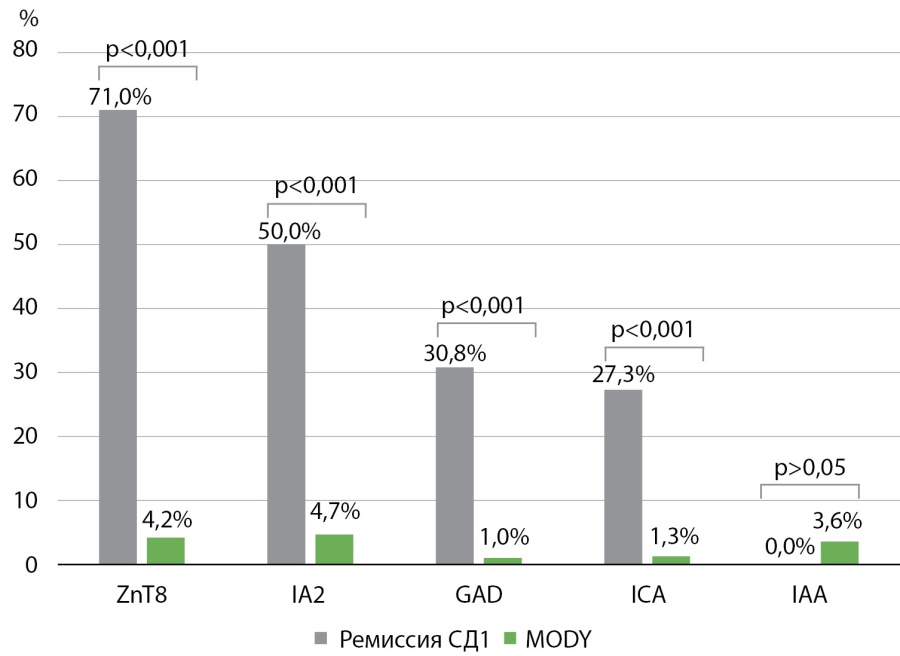
Рисунок 3. Частота выявления аутоантител у детей с ремиссией сахарного диабета 1 типа и диабета взрослого типа у молодых лиц (MODY).
Figure 3. Frequency of detection of autoantibodies in children with remission of type 1 diabetes mellitus and adult-onset diabetes in young adults (MODY).
ОБСУЖДЕНИЕ
В настоящее время остаются актуальными вопросы стратегии отбора и формирования систематического подхода направления пациентов на молекулярно-генетическое исследование генов, ответственных за развитие MODY. Данные подходы должны, с одной стороны, создавать условия для наибольшей идентификации случаев MODY, с другой — обеспечивать высокий процент положительных тестов. Вопрос о необходимости проведения дифференциальной диагностики СД1 с MODY возникает в случаях длительного периода клинико-лабораторной ремиссии (более 6 мес) или при ранней доклинической диагностике СД1, при наличии отягощенной наследственности по СД, а также в случаях отсутствия специфических панкреатических АТ.
Целью данного исследования являлось определение дифференциально-диагностических критериев полной клинико-лабораторной ремиссии СД1 типа и MODY. Группа пациентов с СД1 включала пациентов с полной клинико-лабораторной ремиссией и с ранней доклинической диагностикой СД1. У детей длительность клинико-лабораторной ремиссии, как правило, не превышает полгода. Согласно рекомендациям ISPAD, длительный период «медового месяца» должен быть основанием для исключения MODY [1], в связи с чем в наше исследование были включены пациенты с длительностью заболевания более 6 мес. В группу с MODY были включены пациенты с гетерозиготными мутациями в генах, известных как приводящие к моногенным формам СД. Особенностью формирования данной выборки пациентов является преобладание в данной группе GCK-MODY, что обусловлено наибольшей встречаемостью данного подтипа MODY в детском возрасте [10–12].
Ключевыми дифференциально-диагностическими критериями СД1 и MODY являются специфические АТ и наследственный анамнез, дополнительными критериями могут быть характер манифестации заболевания, показатели углеводного обмена. СД1 развивается в результате аутоиммунной агрессии организма к β-клеткам поджелудочной железы. У 85–93% пациентов с СД1 определяется положительный титр специфических АТ [13][14], однако отрицательный титр не исключает наличие у пациента СД1. Отсутствие панкреатических АТ является одним из основных критериев для проведения молекулярно-генетического анализа с целью дифференциальной диагностики с моногенными формами СД [15]. В нашем исследовании у пациентов с СД1 выявление специфических панкреатических АТ позволило исключить MODY у 77,8% пациентов, причем наибольшее дифференциально-диагностическое значение показали АТ к ZnT8 и IA2, которые выявлялись у пациентов с СД1 чаще, чем GAD, ICA, IAA. Полученные данные согласуются с результатами V. Bravis и соавт. [13]. В шведском педиатрическом исследовании изучена дифференциально-диагностическая роль GAD, IA2, ZnT8. В данное исследование были включены 3933 пациента с СД в возрасте от 1 года до 18 лет, у всех были исследованы специфические панкреатические АТ. Молекулярно-генетическое исследование проведено 76 пациентам с отрицательным титром АТ с фенотипом MODY и 227 серонегативным пациентам без фенотипа MODY, диагноз подтвержден в 34 и 12 случаях соответственно. Группу контроля составили 182 пациента с положительным титром АТ, MODY не выявлен ни у одного пациента. Таким образом, в данной работе продемонстрирована необходимость проведения иммунологического обследования перед генетическим анализом [16].
Однако у пациентов с СД и положительным титром АТ MODY не может быть полностью исключен. При наличии клинической картины MODY пациентов следует направлять на молекулярно-генетическое исследование. В данном исследовании 11,4% пациентов с MODY были серопозитивными. Следует отметить, что у пациентов с MODY определялось не более одного вида АТ, в то время как у 44,5% пациентов с ремиссией СД1 выявлялось 2 и более типов АТ. По данным литературы, у 1–25% пациентов с MODY отмечалось носительство АТ [17–19]. В работе Т. McDonald и соавт. исследование АТ GAD, IA2 проведено у 508 пациентов с MODY, и у 5 из них были выявлены АТ (менее 1%). Все пациенты были серопозитивны только по одному типу АТ. Низкая частота выявления АТ в данном исследовании связана с предварительным скринингом пациентов на специфические панкреатические АТ перед направлением на генетическое исследование. При выявлении АТ при MODY обсуждается возможное сочетание моногенного СД и СД1, поэтому необходимо наблюдение за данной группой пациентов [19]. Таким образом, исследование специфических панкреатических АТ целесообразно проводить перед проведением молекулярно-генетического исследования. При выявлении одного типа АТ решение о необходимости генетического исследования должно приниматься на основании комплексного анализа клинических и лабораторных характеристик. При наличии более одного вида АТ выявление мутаций в генах, характерных для MODY, маловероятно.
У пациентов с MODY, по сравнению с пациентами с ремиссией СД1, значимо чаще в наследственном анамнезе отмечались случаи СД у родителей, сибсов и родственников 2-й степени родства. Аналогичные данные получены в 5-летнем педиатрическом национальном исследовании, проведенном в Швеции, — СД у родителей был диагностирован в 12% при СД1 и 63% при MODY (p=6×10-5) [16]. По данным литературы, у 12,2–15% пациентов с СД1 типа диагностированы различные нарушения углеводного обмена у родственников 1-й степени родства [13][20]. В нашем исследовании выявлена более высокая частота СД у родственников 1-й степени родства в группе пациентов с СД1 по сравнению с литературными данными — 22%. V. Brаvis и соавт. показали, что у пациентов с отягощенным наследственным анамнезом по СД (у родителей или сибсов) риск манифестации СД1 с кетоацидозом был ниже, а вероятность развития ремиссии выше, чем у пациентов с СД1 без отягощенной наследственности, что может быть связано с повышенной осведомленностью о симптомах СД и более ранней диагностикой СД, когда сохранен резерв β-клеток [13].
У большинства пациентов в нашем исследовании нарушения углеводного обмена были диагностированы на доклинической стадии — 98,2% при MODY и 61,1% при полной клинико-лабораторной ремиссии СД1. Лишь у 1 пациента с ремиссией был ДКА при манифестации (2,8%) и у 7 пациентов (19,4%) — кетоз. Умеренные клинические симптомы СД отмечались у 2 пациентов с гетерозиготной мутацией в гене GCK, в том числе у одной пациентки с повышенным уровнем АТ, таким образом, в данном случае можно говорить о сочетании GCK-MODY с аутоиммунным СД. Мягкий характер манифестации СД1 является предрасполагающим фактором к развитию ремиссии СД. ДКА при манифестации СД в детском возрасте снижает вероятность развития ремиссии, что обусловлено взаимосвязью между развитием ДКА и количеством резидуальной β-клеточной массы [21][22]. В исследовании DPV, проведенном в Германии и Австрии, проанализированы данные 3657 детей с СД1. Показано, что у детей, у которых развивалась частичная клинико-лабораторная ремиссия, частота ДКА была статистически значимо ниже и составляла 13%, в то время как у детей с СД1 без ремиссии частота ДКА составила 21% [14]. В исследовании S. Bowden и соавт. также отмечалась более высокая частота ДКА у детей без ремиссии — 49,5% по сравнению со случаями СД1 с ремиссией — 18,3% [22]. Для наиболее распространенных форм MODY (GCK-MODY, HNF1A-MODY, HNF4A-MODY) характерна асимптоматическая диагностика нарушений углеводного обмена или возможны мягкие клинические проявления СД [10][15][23]. Острая манифестация MODY описана при гетерозиготных мутациях в генах NEUROD1, PDX1, INS [24].
Помимо характера манифестации, значимыми факторами развития ремиссии СД1 являются возраст дебюта заболевания и пол [5][14][21][25]. В нашем исследовании пациенты с ремиссией СД1 были старше пациентов с MODY. В группе пациентов с MODY наиболее часто (в 42,1% случаев) СД был диагностирован до 7 лет, в то время для ремиссии СД1 был характерен дебют в предпубертатном (38,9%) и пубертатном возрасте (38,9%). По данным различных исследований, возраст на момент диагностики СД1 оказывает значимое влияние на вероятность развития ремиссии. Частота развития частичной ремиссии у детей раннего возраста (до 2–5 лет) невысока и составляет 16,7–27,4%, у детей старше 5 лет — 37,1–42,1%. Наиболее часто, в56,6%, ремиссия развивается при дебюте СД в предпубертатном и постпубертатном возрасте [22][25–28]. Возраст диагностики MODY варьирует в зависимости от подтипа MODY. При GCK-MODY, который превалирует в исследованной нами в выборке MODY, нарушения углеводного обмена могут быть выявлены уже в первые дни жизни [29], и, как правило, возраст диагностики СД совпадает с возрастом исследования гликемии, медиана возраста диагностики составляет 7,6 года [30]. При других формах MODY возраст диагностики углеводного обмена выше: средний возраст диагностики нарушений углеводного обмена при MODY-HNF1A и MODY-HNF4A составляет 18–25 лет [31], MODY-HNF1B — 16 лет [32]. Таким образом, наличие стойкой ремиссии СД у детей раннего возраста может служить дополнительным основанием для проведения дифференциальной диагностики типа СД.
Для пациентов с ремиссией СД1 более характерна гипергликемия при проведении ПГТТ, а для пациентов с MODY — гипергликемия натощак при ПГТТ, что, вероятно, обусловлено преобладанием в группе с MODY пациентов с гетерозиготными мутациями в гене GCK, для которых типичен данный тип гликемической кривой [29][30]. Уровень HbA1c у пациентов с ремиссией СД1 был ниже, чем у пациентов с MODY, что, вероятно, говорит о большем влиянии гликемии натощак на средний уровень глюкозы.
Определение С-пептида широко используется для оценки функции β-клеток [33]. Выявление сохранной секреции С-пептида является одним из оснований для проведения дифференциальной диагностики между СД1 и моногенными формами СД [15].В настоящем исследовании не выявлено различий между базальным и стимулированными уровнями С-пептида у пациентов с ремиссией СД1 и MODY. Таким образом, определение С-пептида как натощак, так и в процессе проведения ПГТТ у детей с СД без потребности в инсулине не позволяет дифференцировать СД1 и MODY.
ЗАКЛЮЧЕНИЕ
Наибольшую значимость для проведения дифференциальной диагностики СД1 и MODY при длительном инсулиннезависимом периоде у детей с СД показали АТ ZnT8 и IA2. При отсутствии АТ рекомендовано проведение молекулярной диагностики. При выявлении только одного типа АТ решение о необходимости молекулярно-генетического анализа должно проводиться на основании комплексного анализа фенотипических характеристик пациента, включая данные наследственного анамнеза, особенности манифестации, показатели углеводного обмена.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено в рамках государственного задания «Персонализированный подход к прогнозированию развития и дифференциальной диагностике сахарного диабета 1 типа у детей и подростков», регистрационный номер АААА-А20-120012190131-9.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Сечко Е.А. — концепция и дизайн исследования, набор материала, написание текста, получение, анализ, статистическая обработка и интерпретация полученных данных; Романенкова Е.М. — набор материала, написание и редактирование текста, получение, анализ, статистическая обработка и интерпретация полученных данных; Еремина И.А. — набор материала, написание и редактирование текста, получение, анализ и интерпретация полученных данных; Зильберман Л.И. — набор материала, редактирование текста, получение, анализ и интерпретация полученных данных; Никанкина Л.В. — выполнение лабораторных исследований; Зураева З.Т. — выполнение лабораторных исследований; Безлепкина О.Б. — редактирование текста; Петеркова В.А. — редактирование текста; Лаптев Д.Н. — концепция и дизайн исследования, набор материала, написание и редактирование текста, получение, анализ, статистическая обработка и интерпретация полученных данных. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Mayer-Davis EJ, Kahkoska AR, Jefferies C, et al. ISPAD Clinical practice consensus guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents. Pediatr Diabetes. 2018;19(S27):7-19. doi: https://doi.org/10.1111/pedi.12773
2. Sosenko JM, Skyler JS, Herold KC, Palmer JP. The Metabolic Progression to Type 1 Diabetes as Indicated by Serial Oral Glucose Tolerance Testing in the Diabetes Prevention Trial–Type 1. Diabetes. 2012;61(6):1331-1337. doi: https://doi.org/10.2337/db11-1660
3. Insel RA, Dunne JL, Atkinson MA, et al. Staging Presymptomatic Type 1 Diabetes: A Scientific Statement of JDRF, the Endocrine Society, and the American Diabetes Association. Diabetes Care. 2015;38(10):1964-1974. doi: https://doi.org/10.2337/dc15-1419
4. Lombardo F, Valenzise M, Wasniewska M, et al. Two-year prospective evaluation of the factors affecting honeymoon frequency and duration in children with insulin dependent diabetes mellitus: the key-role of age at diagnosis. Diabetes Nutr Metab. 2002;15(4):246-251.
5. Abdul-Rasoul M, Habib H, Al-Khouly M. “The honeymoon phase” in children with type 1 diabetes mellitus: frequency, duration, and influential factors. Pediatr Diabetes. 2006;7(2):101-107. doi: https://doi.org/10.1111/j.1399-543X.2006.00155.x
6. Akirav E, Kushner JA, Herold KC. Beta-cell mass and type 1 diabetes: going, going, gone? Diabetes. 2008;57(11):2883-2888. doi: https://doi.org/10.2337/db07-1817
7. Pihoker C, Gilliam LK, Ellard S, et al. Prevalence, Characteristics and clinical diagnosis of maturity onset diabetes of the young due to mutations in HNF1A, HNF4A, and glucokinase: results from the SEARCH for diabetes in youth. J Clin Endocrinol Metab. 2013;98(10):4055-4062. doi: https://doi.org/10.1210/jc.2013-1279
8. Shields BM, Hicks S, Shepherd MH, et al. Maturity-onset diabetes of the young (MODY): how many cases are we missing? Diabetologia. 2010;53(12):2504-2508. doi: https://doi.org/10.1007/s00125-010-1799-4
9. Гиоева О.А., Колодкина А.А., Васильев Е.В., и др. Наследственный вариант сахарного диабета, обусловленного дефектом гена NEUROD1 (MODY6): первое описание в России // Проблемы Эндокринологии. — 2016. — Т. 62. — №3. — C. 16 — 20. doi: https://doi.org/10.14341/probl201662316-20
10. Кураева Т.Л., Сечко Е.А., Зильберман Л.И., и др. Молекулярно-генетические и клинические варианты MODY2 и MODY3 у детей в России // Проблемы эндокринологии. — 2015. — Т. 61. — №5. — С. 14-25. doi: https://doi.org/10.14341/probl201561514-25
11. Mozzillo E, Salzano G, Barbetti F, et al. Survey on etiological diagnosis of diabetes in 1244 Italian diabetic children and adolescents: Impact of access to genetic testing. Diabetes Res Clin Pract. 2015;107(3):e15-e18. doi: https://doi.org/10.1016/j.diabres.2015.01.003
12. Fendler W, Borowiec M, Baranowska-Jazwiecka A, et al. Prevalence of monogenic diabetes amongst Polish children after a nationwide genetic screening campaign. Diabetologia. 2012;55(10):2631-2635. doi: https://doi.org/10.1007/s00125-012-2621-2
13. Bravis V, Kaur A, Walkey HC, et al. Relationship between islet autoantibody status and the clinical characteristics of children and adults with incident type 1 diabetes in a UK cohort. BMJ Open. 2018;8(4):e020904. doi: https://doi.org/10.1136/bmjopen-2017-020904
14. Nagl K, Hermann JM, Plamper M, et al. Factors contributing to partial remission in type 1 diabetes: analysis based on the insulin dose-adjusted HbA1c in 3657 children and adolescents from Germany and Austria: Partial remission based on IDAA1c. Pediatr Diabetes. 2017;18(6):428-434. doi: https://doi.org/10.1111/pedi.12413
15. Hattersley AT, Greeley SAW, Polak M, et al. ISPAD Clinical Practice Consensus Guidelines 2018: The diagnosis and management of monogenic diabetes in children and adolescents. Pediatr Diabetes. 2018;19:47-63. doi: https://doi.org/10.1111/pedi.12772
16. Carlsson A, Shepherd M, Ellard S, et al. Absence of islet autoantibodies and modestly raised glucose values at diabetes diagnosis should lead to testing for MODY: Lessons from a 5-year pediatric Swedish National Cohort Study. Diabetes Care. 2020;43(1):82-89. doi: https://doi.org/10.2337/dc19-0747
17. Schober E, Rami B, Grabert M, et al. Phenotypical aspects of maturity-onset diabetes of the young (MODY diabetes) in comparison with Type 2 diabetes mellitus (T2DM) in children and adolescents: experience from a large multicentre database. Diabet Med. 2009;26(5):466-473. doi: https://doi.org/10.1111/j.1464-5491.2009.02720.x
18. Urbanová J, Rypáčková B, Procházková Z, et al. Positivity for islet cell autoantibodies in patients with monogenic diabetes is associated with later diabetes onset and higher HbA 1c level. Diabet Med. 2014;31(4):466-471. doi: https://doi.org/10.1111/dme.12314
19. McDonald TJ, Colclough K, Brown R, et al. Islet autoantibodies can discriminate maturity-onset diabetes of the young (MODY) from Type 1 diabetes: Pancreatic autoantibodies can discriminate MODY from Type 1 diabetes. Diabet Med. 2011;28(9):1028-1033. doi: https://doi.org/10.1111/j.1464-5491.2011.03287.x
20. Parkkola A, Härkönen T, Ryhänen SJ, et al. The finnish pediatric diabetes register. extended family history of type 1 diabetes and phenotype and genotype of newly diagnosed children. Diabetes Care. 2013;36(2):348-354. doi: https://doi.org/10.2337/dc12-0445
21. Kara Ö, Esen İ, Tepe D. Factors influencing frequency and duration of remission in children and adolescents newly diagnosed with type 1 diabetes. Med Sci Monit. 2018;24:5996-6001. doi: https://doi.org/10.12659/MSM.908450
22. Bowden SA, Duck MM, Hoffman RP. Young children (<5 yr) and adolescents (>12 yr) with type 1 diabetes mellitus have low rate of partial remission: diabetic ketoacidosis is an important risk factor. Pediatr Diabetes. 2008;9(3pt1):197-201. doi: https://doi.org/10.1111/j.1399-5448.2008.00376.x
23. Овсянникова А.К., Шахтшнейдер Е.В., Иванощук Д.Е., и др. Течение сахарного диабета взрослого типа у молодых лиц старше 18 лет, обусловленного мутацией гена глюкокиназы (GCK-MODY): данные проспективного наблюдения // Сахарный диабет. — 2021. — Т. 24. — №2. — С. 133-140. doi: https://doi.org/10.14341/DM1231924
24. Aarthy R, Aston-Mourney K, Mikocka-Walus A, et al. Clinical features, complications and treatment of rarer forms of maturity-onset diabetes of the young (MODY) — A review. J Diabetes Complications. 2021;35(1):107640. doi: https://doi.org/10.1016/j.jdiacomp.2020.107640
25. Bonfanti R, Bognetti E, Meschi F, et al. Residual beta-cell function and spontaneous clinical remission in type 1 diabetes mellitus: the role of puberty. Acta Diabetol. 1998;35(2):91-95. doi: https://doi.org/10.1007/s005920050110
26. Muhammad BJ, Swift PGF, Raymond NT, Botha JL. Partial remission phase of diabetes in children younger than age 10 years. Arch Dis Child. 1999;80(4):367-369. doi: https://doi.org/10.1136/adc.80.4.367
27. Komulainen J, Kulmala P, Savola K, et al. Clinical, autoimmune, and genetic characteristics of very young children with type 1 diabetes. Childhood Diabetes in Finland (DiMe) Study Group. Diabetes Care. 1999;22(12):1950-1955. doi: https://doi.org/10.2337/diacare.22.12.1950
28. Hathout EH, Hartwick N, Fagoaga OR, et al. Clinical, Autoimmune, and HLA Characteristics of Children Diagnosed With Type 1 Diabetes Before 5 Years of Age. Pediatrics. 2003;111(4):860-863. doi: https://doi.org/10.1542/peds.111.4.860
29. Chakera AJ, Steele AM, Gloyn AL, et al. Recognition and Management of Individuals With Hyperglycemia Because of a Heterozygous Glucokinase Mutation. Diabetes Care. 2015;38(7):1383-1392. doi: https://doi.org/10.2337/dc14-2769
30. Сечко Е.А., Кураева Т.Л., Зильберман Л.И., и др. Неиммунный сахарный диабет у детей, обусловленный гетерозиготными мутациями в гене глюкокиназы (GCK-MODY): анализ данных 144 пациентов // Сахарный диабет. — 2022. — Т. 25. — №2. — С. 145-154. doi: https://doi.org/10.14341/DM12819
31. Harries LW, Ellard S, Stride A, et al. Isomers of the TCF1 gene encoding hepatocyte nuclear factor-1 alpha show differential expression in the pancreas and define the relationship between mutation position and clinical phenotype in monogenic diabetes. Hum Mol Genet. 2006;15(14):2216-2224. doi: https://doi.org/10.1093/hmg/ddl147
32. Madariaga L, García-Castaño A, Ariceta G, et al. Variable phenotype in HNF1B mutations: extrarenal manifestations distinguish affected individuals from the population with congenital anomalies of the kidney and urinary tract. Clin Kidney J. 2019;12(3):373-379. doi: https://doi.org/10.1093/ckj/sfy102
33. Романенкова Е.М., Еремина И.А., Титович Е.В., и др. Уровень С-пептида и распространенность панкреатических аутоантител у детей с сахарным диабетом 1 типа при разной длительности заболевания // Сахарный диабет. — 2022. — Т. 25. — №2. — С. 155-165. doi: https://doi.org/10.14341/DM12843
Об авторах
Е. А. СечкоРоссия
Сечко Елена Александровна - кандидат медицинских наук; Researcher ID: S-4114-2016; Scopus Author ID: 55880018700; eLibrary SPIN: 4608-5650.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. М. Романенкова
Россия
Романенкова Елизавета Михайловна - Researcher ID: AAB-7186-2021; eLibrary SPIN: 6190-0118.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. А. Еремина
Россия
Еремина Ирина Александровна - кандидат медицинских наук; Researcher ID: S-3979-2016; Scopus Author ID: 6701334405.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. И. Зильберман
Россия
Зильберман Любовь Иосифовна - кандидат медицинских наук; eLibrary SPIN 4488-7724.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. В. Никанкина
Россия
Никанкина Лариса Вячеславовна - кандидат медицинских наук; eLibrary SPIN: 4679-9356.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
З. Т. Зураева
Россия
Зураева Замира Тотразовна - кандидат медицинских наук; eLibrary SPIN: 6002-0455.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. Б. Безлепкина
Россия
Безлепкина Ольга Борисовна - доктор медицинских наук; Researcher ID: B-6627-2017; Scopus Author ID: 6507632848; eLibrary SPIN: 3884-0945.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. А. Петеркова
Россия
Петеркова Валентина Александровна - доктор медицинских наук, профессор, академик РАН; e-library SPIN: 4009-2463.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Д. Н. Лаптев
Россия
Лаптев Дмитрий Никитич - доктор медицинских наук; Researcher ID: O-1826-2013; Scopus Author ID: 24341083800; e-library SPIN: 2419-4019.
Москва
Конфликт интересов:
отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Уровень гликемии натощак и в ходе перорального глюкозотолерантного теста при ремиссии сахарного диабета 1 типа и диабете взрослого типа у молодых лиц (MODY). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(132KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Уровень С-пептида натощак и в ходе перорального глюкозотолерантного теста у детей с полной клинико-лабораторной ремиссией сахарного диабета 1 типа и диабета взрослого типа у молодых лиц (MODY). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(118KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Частота выявления аутоантител у детей с ремиссией сахарного диабета 1 типа и диабета взрослого типа у молодых лиц (MODY). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(137KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Сечко Е.А., Романенкова Е.М., Еремина И.А., Зильберман Л.И., Никанкина Л.В., Зураева З.Т., Безлепкина О.Б., Петеркова В.А., Лаптев Д.Н. Роль специфических панкреатических антител в дифференциальной диагностике полной клинико-лабораторной ремиссии сахарного диабета 1 типа и MODY у детей. Сахарный диабет. 2022;25(5):449-457. https://doi.org/10.14341/DM12921
For citation:
Sechko E.A., Romanenkova E.M., Eremina I.A., Zilberman L.I., Nikankina L.V., Zuraeva Z.T., Bezlepkina O.B., Peterkova V.A., Laptev D.N. The role of specific pancreatic antibodies in the differential diagnosis of complete clinical and laboratory remission of type 1 diabetes mellitus and MODY in children. Diabetes mellitus. 2022;25(5):449-457. (In Russ.) https://doi.org/10.14341/DM12921
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































