Перейти к:
Трансплантация фекальной микробиоты в составе комплексной терапии сахарного диабета у сибсов с ожирением: клинический случай
https://doi.org/10.14341/DM12893
Аннотация
Ожирение и связанные с ним метаболические заболевания часто сопровождаются изменениями кишечной микробиоты, приводящими к снижению разнообразия генов метагенома. Одним из наиболее эффективных методов коррекции микрофлоры кишечника является трансплантация фекальной микробиоты (ТФМ), полученной от здоровых доноров, хорошо зарекомендовавшая себя при лечении инфекций, вызываемых Clostridium difficile. Применение ТФМ для коррекции метаболических расстройств перспективно, однако данные о ее использовании ограничены и имеют противоречивые результаты. В нашей работе двум пациентам (родным братьям) с ожирением II степени и различными типами сахарного диабета (СД) (старший брат (44 года) с СД 2 типа (СД2), младший брат (39 лет) с СД 1 типа (СД1)) была проведена ТФМ в составе комплексной противодиабетической терапии. У обоих пациентов в ходе лечения отмечено снижение массы тела (динамика — 4–5 кг за первый месяц наблюдения, далее — 1–2 кг в месяц). Через 1 год после ТФМ у пациента с СД2 отмечены снижение выраженности инсулинорезистентности (ИР), оцененной методом гиперинсулинемического эугликемического клэмп-теста (исходный М-индекс 2,42 мг/кг/мин, через 1 год — 3,83 мг/кг/мин), а также сохранение удовлетворительной компенсации углеводного обмена при уменьшении объема проводимой сахароснижающей терапии. У пациента с СД1 значимой динамики показателей углеводного обмена, включая уровень гликированного гемоглобина, дозы инсулина и показатель индекса ИР, не выявлено. Метагеномное секвенирование образцов кала (n=20), собранных от обоих пациентов до и в течение 1 года после проведения ТФМ, показало отсутствие значимых изменений в таксономическом профиле микробиоты на уровне микробных семейств. Метаболомный анализ состава фекалий показал отсутствие направленных изменений в композиции метаболитов после процедуры ТФМ, характер изменений внутри группы образцов от каждого пациента в течение всего периода исследования носит случайный характер. Таким образом, ТФМ не оказала влияния на течение СД1, но послужила пусковым моментом для снижения массы тела и улучшения показателей гликемии при СД2. Однако убедительных данных, подтверждающих причинно-следственную взаимосвязь между ТФМ и улучшением течения СД2, не получено.
Ключевые слова
Для цитирования:
Покровская Е.В., Жгун Е.С., Шестакова Е.А., Скляник И.А., Федюшкина И.В., Олехнович Е.И., Конанов Д.Н., Кардонский Д.А., Кислун Ю.В., Сорокина Е.А., Зильберман Л.И., Зайцева Н.В., Ильина Е.Н., Говорун В.М., Шестакова М.В. Трансплантация фекальной микробиоты в составе комплексной терапии сахарного диабета у сибсов с ожирением: клинический случай. Сахарный диабет. 2022;25(4):405-417. https://doi.org/10.14341/DM12893
For citation:
Pokrovskaya E.V., Zhgun E.S., Shestakova E.A., Sklyanik I.A., Fedushkina I.V., Olekhnovich E.I., Konanov D.N., Kardonsky D.A., Kislun Yu.V., Sorokina E.A., Zilberman L.I., Zaytseva N.V., Ilina E.N., Govorun V.M., Shestakova M.V. Feсal microbiota transplantation in the format of complex therapy in obesive siblings: clinical case. Diabetes mellitus. 2022;25(4):405-417. (In Russ.) https://doi.org/10.14341/DM12893
ВВЕДЕНИЕ
Эпидемиологические исследования показывают, что более 2,1 млрд человек в мире имеют избыточный вес или ожирение, и, если тенденция не изменится, то к 2030 г. 38% взрослого населения мира будут иметь избыточный вес, а еще 20% будут страдать ожирением [1][2].
Наряду с генетическими факторами и чрезмерным потреблением калорий одним из регуляторов метаболизма является кишечная микробиота. Накопленные данные свидетельствуют о связи между нарушением регуляции кишечного микробиома и ожирением, нарушением гликемического контроля и, следовательно, патофизиологией сахарного диабета 2 типа (СД2) [3][4].
К настоящему времени проведено несколько исследований по полногеномному секвенированию микробиоты пациентов с ожирением и СД2, которые показали, что эти патологии характеризуются достаточно умеренным дисбиозом с общим уменьшением численности бактерий — производителей бутирата и увеличением оппортунистических патогенов [5]. Изменение соотношения Firmicutes/Bacteroidetes при ожирении и СД2 не нашло доказательной взаимосвязи [6]. Более того, изменения микробиоты оказались крайне вариативны в зависимости от возраста, образа жизни и места географического проживания индивидуумов, что не позволило точно дифференцировать состав микробиоты при данных патологиях [7]. Метагеномные исследования выявили специфические изменения микробиоты кишечника у пациентов с метаболическим синдромом, касающиеся главным образом существенного уменьшения количества пропионатсинтезирующих бактерий (Prevotella copri, Bacteroides vulgatus и др.), способствующих развитию устойчивости к инсулину, а также бутиратсинтезирующих бактерий (Faecalibacterium prausnitzii) и муцин-деградирующей бактерии Akkermansia muciniphila, ассоциированных, в свою очередь, с повышенной чувствительностью к инсулину [8][9], что может являться дискриминационным признаком, позволяющим выделить данное патологическое состояние на микробиологическом уровне.
С учетом связи метаболических заболеваний с изменением профиля кишечной микробиоты, с 2004 г. проводятся исследования по пересадке кишечной микробиоты на животных моделях [10], с 2012 г. — у пациентов с ожирением и СД2 [11]. Процедура трансплантации фекальной микробиоты (ТФМ) заключается во введении с помощью эндоскопа, колоноскопа или перорально в организм пациента микробиоты, полученной от здорового донора. В результате происходят колонизация кишечника донорской микробиотой и восстановление нормальной микрофлоры кишечника [12]. В США процедура официально одобрена FDA для лечения лекарственно-резистентной формы Clostridium difficile [13]. Некоторые исследования, проводимые на животных моделях [14][15] и на небольших выборках в человеческой популяции, показали улучшение чувствительности к инсулину при стабильной массе тела и восстановление многообразия видов кишечной микрофлоры [11].
Совокупность полученных данных позволяет предположить, что ТФМ пациентам с СД2 от здоровых доноров может быть эффективна в лечении метаболических расстройств.
Также изучается роль микробиоты в развитии сахарного диабета 1 типа (СД1) — предположено, что микробиота кишечника может быть вовлечена в прогрессирование аутоиммунитета против β-клеток. В некоторых исследованиях выявили определенные различия в составе кишечной микробиоты и общее снижение микробного разнообразия у пациентов с СД1, однако в связи с многофакторным характером заболевания на сегодняшний день не найдено четких корреляций [16]. В 2021 г. были опубликованы результаты единственного исследования по ТФМ при СД1, в котором сравнивали аллогенную и аутологичную ТФМ у пациентов с впервые выявленным СД1, в результате которого участники, получившие собственный аутологичный образец стула, сохранили функцию β-клеток (уровень стимулированного С-пептида) по сравнению с участниками, получившими ТФМ от аллогенного здорового донора, эти изменения коррелировали с определенными микробными метаболитами [17].
В данном исследовании мы описываем наблюдение двух родных братьев с ожирением II степени и различными типами СД (СД1 и СД2), которым была проведена ТФМ. Целью работы явилась оценка нормализации массы тела и улучшения метаболических и микробиомных показателей обоих пациентов в течение 12 мес после ТФМ.
МАТЕРИАЛЫ И МЕТОДЫ
Антропометрическое исследование
Рост измеряли утром с помощью ростомера.
Массу тела измеряли утром натощак во время биоимпедансного исследования (методология проведения описана далее).
Расчет индекса массы тела (ИМТ) производился по формуле отношения массы тела в килограммах к значению роста, выраженному в метрах в квадрате (кг/м2).
Измерение окружности талии (ОТ) в сантиметрах проводили в средней точке между нижним краем последнего прощупываемого ребра и верхней частью гребня подвздошной кости
Анкетирование оценки качества жизни
Опросник (форма SF-36) — неспецифический опросник для оценки качества жизни пациентов, который отражает общее благополучие и степень удовлетворенности сторонами жизнедеятельности человека, на которые влияет состояние здоровья. Опросник состоит из 36 вопросов, сгруппированных в 8 шкал.
Лабораторные методы исследования крови
Общий анализ крови проводился на 5DIFF — гематологическом анализаторе SysmexXN 1000, Japan.
Определение гликированного гемоглобина (HbA1c) (референсные значения 4−6%) проводилось методом высокоэффективной жидкостной хроматографии HPLC (High performance liquid chromatography) на анализаторе BioRad (D-10) с использованием стандартных наборов BioRad D-10.
Для определения уровня С-пептида и иммунореактивного инсулина (ИРИ) использовался электрохемилюминесцентный иммуноанализ с помощью анализатора Cobas 6000 (ROCHE). Референсные значения уровня С-пептида: кровь — 1,1–4,4 нг/мл, 0,37–1,47 нмоль/л. Референсные значения ИРИ натощак — 2,3−26,4 мЕд/л.
Стандартный биохимический анализ крови выполнен на аппарате ARCHITECT 8000 с использованием коммерческих наборов фирмы Abbott для определения глюкозы (референсные значения натощак 3,1−6,1 ммоль/л), показателей липидного спектра (липопротеиды высокой плотности (референсные значения 1,15–2,6 ммоль/л), липопротеиды низкой плотности (референсные значения 1,1–3 ммоль/л), общий холестерин (референсные значения 3,3–5,2 ммоль/л), триглицериды (референсные значения 0,1–1,7 ммоль/л)), мочевины (референсные значения 3,5–7,2 ммоль/л), креатинина (референсные значения 50–98 мкмоль/л), уровня мочевой кислоты (референсные значения 142–339 мкмоль/л).
Выполнение теста со стандартизированной смешанной пищевой нагрузкой (ССПН), для которого была использована смесь Oral Impact (Nestle Health Science, Швейцария): 1 порция — 237 мл, 18 г белков, 9,2 г жиров, 44,8 г углеводов. При проведении ССПН последний прием любых сахароснижающих препаратов происходил не позже чем за 12 ч до начала теста. Забор крови проводили из локтевой вены, натощак, через 30, 90 и 120 мин в ходе ССПН в пробирки с разделительным гелем (для глюкозы крови, ИРИ, С-пептида). Пробы крови в пробирке с разделительным гелем после центрифугирования при температуре +4°С на скорости 3000 оборотов в минуту в течение 15 мин (центрифуга с охлаждением LMC-4200R, Biosan, Латвия) сразу поступали в работу для постановки на соответствующие анализаторы.
Определение показателей инсулинорезистентности
Выраженность инсулинорезистентности (ИР) была оценена методом гиперинсулинемического эугликемического клэмп-теста DeFronzo (метод является золотым стандартом определения чувствительности периферических тканей к инсулину) [18]. За48 ч до клэмп-теста пациенту с СД2 был отменен прием метформина в связи с его влиянием на ИР, накануне исследования (не менее чем за 12 ч) обоим пациентам отменена инъекция инсулина длительного действия, последний прием пищи осуществлялся за 16 ч до исследования. Техника включала внутривенное введение инсулина [инсулин растворимый (человеческий генно-инженерный)] с постоянной скоростью для достижения достаточного уровня гиперинсулинемии (100 мкЕд/мл) и подавления собственной секреции инсулина поджелудочной железой и глюкозы печенью. Одновременно внутривенно вводился 20% раствор глюкозы (точность введения глюкозы обеспечивалась волюметрическим инфузионным насосом Infusomat fmS; B. Braun, Германия), и с помощью изменения ее скорости поддерживался нормальный уровень гликемии. Скорость инфузии инсулина (точность введения инсулина обеспечивалась инфузионной системой Perfusor compact; B. Braun, Германия) составляла 1 мЕд/кг в минуту. Измерение гликемии проводилось каждые 5−10 мин с помощью госпитального глюкометра OneTouch Verio Pro+ (LifeScan, Швейцария). Для устранения влияния гипергликемии на утилизацию глюкозы использовался нормогликемический вариант клэмп-теста, целевые значения гликемии были выбраны от 5,1 до 5,6 ммоль/л. При снижении гликемии скорость введения глюкозы увеличивалась, при повышении — снижалась. Примерно через 120−180 мин достигалось динамическое равновесие, т.е. скорость введения глюкозы была равна скорости ее поглощения тканями. После удержания динамического равновесия в течение 30−40 мин инфузию инсулина останавливали, затем скорость инфузии раствора глюкозы увеличивали до достижения глюкозы крови 9−10 ммоль/л с целью предотвращения гипогликемии. Выражением ИР, определенной с помощью клэмп-теста, служит М-индекс, рассчитываемый как среднее арифметическое из 6−8 дискретных значений скорости инфузии глюкозы в течение 30−40 мин равновесного состояния, деленное на массу тела за 1 мин. Таким образом, М-индекс отражает количество поглощаемой глюкозы 1 кг тела пациента в минуту (мг/кг в минуту). За градации степени тяжести ИР по данным М-индекса были приняты следующие значения: ≤2 — тяжелая, >2−4 — средняя; >4−6 — легкая степень, >6 — нет ИР [19].
Определение состава тела, массы тела
Для оценки массы тела и количества подкожного и висцерального жира пациентам проведена биоимпедансометрия. Исследование проводилось натощак до клэмп-теста или ССПН: с помощью анализатора InBody-770 (Inbody Co., LTD, Корея).
Скрининг доноров
В работе использовали фекальный материал от метаболически здорового донора с нормальным ИМТ (женщина, 19 лет). Донор находился на обычной сбалансированной европейской диете в течение всего периода исследования и проходил клиническое обследование в соответствии с протоколом, рекомендованным Европейской консенсусной конференцией по трансплантации фекальной микробиоты в клинической практике [20]. У донора были исключены наличие в анамнезе заболеваний ЖКТ (включая воспалительные заболевания кишечника и онкологические заболевания), известных инфекционных заболеваний, прием антибиотиков в течение последних 3 мес до вступления в исследование, беременность или кормление грудью, прием наркотических и психотропных средств, ядовитых и сильнодействующих веществ, гормональных препаратов в течение последних 6 мес; отказ от употребления алкоголя, табакокурения в течение минимум 3 нед; отказ от нанесения татуировок, пирсинга в течение последних 6 мес. Донору была проведена оценка состояния здоровья на основании анкетирования, анализа пищевых предпочтений и информации о ранее перенесенных заболеваниях, а также клинико-лабораторного обследования. Клинико-лабораторное исследование включало общий и биохимический анализ крови (мочевина, креатинин, общий белок, общий билирубин, аланинаминотрансфераза, аспартатаминотрансфераза, глюкоза, лактатдегидрогеназа, щелочная фосфатаза; общий анализ мочи; ИФА анализ крови на наличие антител к гепатитам В (Hbs-Ag и АнтиHbcor суммарный) и С, вирус иммунодефицита человека, сифилиса, иммуноглобулины IgG и IgМ к цитомегаловирусу (cytomegalovirus — CMV)и вирусу Эпштейна–Барр (Epstein-Barr virus — EBV)); копрограмму; микробиологическое исследование фекалий: культуральное; на наличие паразитов (исследование кала на яйца гельминтов) и простейших; наличие токсинов Clostridium difficile A/B; определение генов резистентности к антибиотикам с помощью полимеразной цепной реакции (ПЦР); количественное определение с помощью ПЦР вирусов острых кишечных инфекций, EBV, CMV.
Приготовление капсул для ТФМ
Образец свежего донорского кала (не менее 40 г) разводили в стерильном 0,1 М фосфатно-солевом буфере (ФСБ, в таблетках, «Биолот», Россия), рН 7,4, к конечному объемному соотношению фекалии: ФСБ 1:4. Для получения однородной массы использовали бытовой погружной блендер с объемом измельчителя 0,7 л (Philips, Китай). Гомогенизацию проводили в течение 1 мин. Полученную суспензию фильтровали через чайное ситечко (диаметр отверстий 1–2 мм) и разливали в стерильные пластиковые банки для замораживания объемом 50 мл (Sarstedt, Германия). Рассчитанное количество сахарозы (Sigma-Aldrich, США) добавляли в смеси до конечной процентной концентрации 10%. Каждый подготовленный образец (40 мл) заливали в 2 стеклянных стакана для лиофилизации и замораживали при -80°С. Лиофилизацию проводили в течение 48 ч на установке лиофилизации MSLFV01 (MEDSINGLONG Co Ltd, Китай) (давление — 0,01–0,03 атм., температура -50°С). Лиофилизированный фекальный материал дважды инкапсулировали в кислотоустойчивые капсулы из гипромеллозы размером 00 и 000 (DRCaps, Capsugel Cambridge, MA, USA), расфасовывали по 15 штук в контейнер и хранили при -80°C. 15 капсул содержат микроорганизмы, полученные примерно из 30 г фекального материала, в зависимости от диеты донора.
Газохроматографическое определение короткоцепочечных жирных кислот (КЖК) проводили на газовом хроматографе «Кристалл 5000.2» («Хроматэк», Россия) с пламенно-ионизационным детектором и капиллярной хроматографической колонкойсо сшитой неподвижной жидкой фазой Carbowax (длина 30 м, внутренний диаметр 0,32 мм, толщина пленки 1,0 мкм) по методу, разработанному ранее [21]. Кратко, к точной навеске (0,1–0,5 г) исследуемого образца добавляли деионизированную воду, подкисленную соляной кислотой (вода:соляная кислота 6 рН 9:1) в соотношении 1:10 и оставляли на орбитальном шейкере на 2 ч, центрифугировали в течение 5 мин при 3000 об/мин. К 500 мкл надосадочной жидкости добавляли 450 мкл ацетонитрила и 50 мкг диоксана, встряхивали. Для проведения газохроматографического анализа использовали 1 мкл смеси. Температурный режим колонки изменялся по следующей схеме: 80°С в течение 2 мин, далее линейный градиент 80–220°С со скоростью 20°С в минуту. Общее время анализа составляло 30 мин. Газ-носитель — азот, давление на входе в колонку — 70 кПа. Расходы водорода и воздуха — 15 мл/мин и 150 мл/мин соответственно. Ввод пробы (1 мкл) с делением потока 1:5. Газ-носитель — азот. Температурный режим колонки изменялся по следующей схеме: 80°С в течение 2 мин, далее линейный градиент 80–220°С со скоростью 20°С в минуту. Общее время анализа составляло 30 мин. Газ-носитель — азот, давление на входе в колонку — 70 кПа. Расходы водорода и воздуха 15 мл/мин и 150 мл/мин соответственно. Ввод пробы (1 мкл) с делением потока 1:5. Газ-носитель — азот.
Газохроматографический анализ наджидкостной фазы образцов фекалий
Образец фекалий весом 0,25 г помещали в 20-миллилитровые флаконы с завинчивающейся крышкой для экстрактора головного пространства Shimadzu HS-20. Для повышения ионной силы раствора добавляли 1,7 г смеси солей (сульфат аммония и дигидрофосфат калия в соотношении 4:1). Параметры экстрактора: температура печи 80°C, температура линии подачи пробы 220°C, время уравновешивания 15 мин, время нагнетания давления 2 мин, время загрузки 0,5 мин, время инжекции 1 мин, время промывки иглы 7 мин.
Флаконы запечатывали и анализировали на газовом хроматографе Shimadzu QP2010 Ultra GC/MS с экстрактором наджидкостной фазы Shimadzu HS-20 на колонке VF-WAXMS длиной 30 м, диаметром 0,25 мм и толщиной фазы 0,25 мкм. Начальная температура колонки 80°C, скорость нагрева 20°C/мин до конечной температуры 240°C в течение 20 мин. Газ-носитель — гелий 99,9999, ввод пробы без деления потока, скорость потока 1 мл/мин. Температура источника ионов — 230°C. Температура поверхности раздела — 240°C. Результаты фиксировали в режиме мониторинга общего ионного тока. Анализ полученных масс-спектров проводили с использованием библиотеки масс-спектров NIST 2014.
Молекулярно-генетическое тестирование пациентов
Диагностика HLA-системы II класса
Молекулярно-генетический анализ: типирование генов HLA II класса проводилось на аппарате ДНК-технологии ДТ-96.
HLA-типирование включало в себя определение конкретных вариантов из всех возможных и проводилось методом ПЦР в режиме реального времени.
Использовались наборы реагентов для типирования генов HLA-DRB1, HLA-DQA1.
HLA-DQB1 — методом ПЦР в режиме реального времени. Для контроля качества использовались реагенты ДНК (КВМ), предназначенные для определения и приблизительной оценки количества геномной ДНК человека в биологическом материале (цельная кровь). При одновременной постановке образца на все локусы, в качестве контроля качества ДНК используется КВМ из набора HLA-DRB1.
Выделение ДНК и секвенирование образцов фекалий
Полногеномное секвенирование образцов фекалий
Полногеномное секвенирование проводили на секвенаторе Ion Proton (Thermo Fisher Scientific/Life Technologies). Выделение геномной ДНК проводили при помощи набора Wizard Genomic DNA Purification Kit (Promega) в соответствии с рекомендациями производителя.
Библиотеки для секвенирования генома на секвенаторе Ion Proton (Thermo Fisher Scientific/Life Technologies) готовили в соответствии с протоколами производителя с использованием набора ION AMPLISEQ EXOME RDY KIT и Ion Xpress Barcode Adapters 1–16 (Life Technologies). Кратко, 1,2 мкг геномной ДНК подвергали ферментативной очистке (8 мин инкубации при 37°C), восстановление концов и лигирование адаптеров проводили с помощью Ion Xpress Barcode Adapters 1–16 (Thermo Fisher Scientific/Life Technologies). Амплификацию проводили на амплификаторе DNA Engine Tetrad 2 (BioRad). Качество полученных ДНК библиотек материала оценивали на биоанализаторе Agilent 2100 (Agilent, Santa Clara, CA, USA) в соответствии с инструкцией производителя.
Методы обработки полученных данных
Общие клинические и лабораторные данные обрабатывали с помощью программы Microsoft Excel, StatSoft Statistica 13.0. Для описания данных малой выборки использовали определение значения верхнего и нижнего квартилей Ме [Q1; Q3] — медиана [нижний квартиль; верхний квартиль]. Для исследования взаимосвязи между количественными признаками использовался метод ранговой корреляции по Спирмену (p<0,05).
Параметры биоинформационного анализа. Первичная обработка первичных прочтений IonProton Software; выравнивание на референсную последовательность ДНК версии hg19 с помощью программы BWA 0.7.9; выявление вариантов относительно референсной последовательности: Samtools 1.7.31; аннотация по базе данных dcSNP NCBI и аннотация новых, потенциально значимых вариантов: ANNOVAR.
Для медицинской аннотации результатов проводился поиск генетических вариантов, отличающихся от референсной последовательности генома человека (версия hg19).
Полногеномное метагеномное секвенирование
Выделение ДНК из образцов стула проводили с использованием набора реагентов для выделения нуклеиновых кислот (MagNa Pure Compact Nucleic Acid Isolation Kit I, Roche) согласно инструкции производителя. Далее ДНК элюировали 50 мкл буфера, входящего в комплект, и хранили при -18°С. Всего было взято 250 нг геномной ДНК для подготовки библиотеки для шотган-секвенирования. После обработки ДНК ультразвуком на системе Covaris S220 (Covaris, Woburn, MA, USA) до размера 400–500 п.н. качество фрагментированных образцов оценивали на биоанализаторе Agilent 2100 (Agilent, Санта-Клара, Калифорния, США) в соответствии с инструкцией производителя. Набор NEBNext Ultra II DNA Library Prep Kit (New England Biolabs, Ипсвич, Массачусетс, США) использовали для подготовки библиотеки парных концов, а набор NEBNext Multiplex Oligos для Illumina (96 Index Primers, New England Biolabs, Ипсвич, Массачусетс, США) используется для индексации библиотек. Библиотеки количественно оценивали с помощью набора для анализа ДНК Quant-iT High Sensitivity (Thermo Scientific, Уолтем, Массачусетс, США). Секвенирование ДНК (2 × 125 п.н.) проводили на платформе HiSeq 2500 (Illumina, Сан-Диего, Калифорния, США) в соответствии с рекомендациями производителя.
Обработка метагеномных данных
Качество необработанных метагеномных данных оценивали с использованием FastQC [https://github.com/s-andrews/FastQC]. Технические последовательности и низкокачественные основания (Q<30) были удалены с помощью инструмента Trimmomatic [22]. Геномные последовательности человека из метагеномных образцов удаляли с помощью bbmap [23] и последней версии генома человека. Таксономическое профилирование метагеномных образцов проводили с помощью MetaPhlAn2 [24][25]. Описанные вычислительные шаги реализованы в конвейере метагеномики Assnake [https://github.com/ASSNAKE]. Несходство Брея–Кертиса использовалось в качестве меры сравнения таксономических профилей метагеномов стула пациентов, в то время как неметрическое многомерное масштабирование — для двумерной визуализации. Для дополнительных сравнений использовали метагеномы здоровых людей без вмешательств [26] и пациентов с метаболическим синдромом, перенесших аутологичную и аллогенную фекальную трансплантацию [16]. Визуализация данных выполнялась с использованием библиотек ggplot2 [https://ggplot2.tidyverse.org] и vegan [27], реализованных для GNU/R [28].
Медицинское вмешательство
К участию в исследовании были привлечены 2 пациента (родные братья) с ожирением II степени и различными типами СД: старший брат (пациент С., 44 года на момент исследования) с СД2, младший брат (пациент А., 39 лет на момент исследования) с СД1, проходящих лечение в ФГБУ «НМИЦ эндокринологии» МЗ России. Медицинские данные пациентов представлены в табл. 1. Исследование одобрено ЛЭК ФГБУ «НМИЦ эндокринологии» Минздрава России, выписка из протокола №1 от 22 января 2020 г. Исследование зарегистрировано на сайте Clinical.trials.gov (NCT04579263).
Таблица 1. Медицинские данные пациентов, включенных в исследование
|
Пациент А. |
Пациент С. |
Норма |
|
|
Пол |
M |
M |
|
|
Возраст, лет |
39 |
44 |
|
|
Возраст манифестации СД, лет |
11 |
40 |
|
|
Длительность заболевания, годы |
29 |
4 |
|
|
Тип СД |
1-й тип |
2-й тип |
|
|
ИМТ, кг/м2 |
36,5 |
39,5 |
|
|
Вес, кг |
113 |
125 |
|
|
ОТ, см |
127 |
135 |
|
|
Рост, см |
176 |
178 |
|
|
Глюкоза плазмы натощак, ммоль/л |
13,6 |
7,66 |
3,1–6,1 |
|
HbA1c, % |
8,8 |
6,9 |
4,0–6,0 |
|
ИРИ натощак, пмоль/л |
1,68 |
25,74 |
2,6–24,9 |
|
M-индекс, мг/кг/мин |
3,18 |
2,42 |
>6 |
|
С-пептид, нг/мл |
0,01 |
4,45 |
1,100–4,400 |
|
Холестерин общий, ммоль/л |
5,01 |
4,55 |
3,3–5,2 |
|
ЛПНП, ммоль/л |
2,4 |
3,07 |
1,1–3,0 |
|
ТГ, ммоль/л |
3,76 |
1,43 |
0,1–1,7 |
|
История заболевания |
СД1 диагностирован в 11 лет на фоне избыточного веса, гликемия в дебюте заболевания 8,2 ммоль/л. В течение первого года находился только на диетотерапии, затем, в связи с развитием кетонурии, переведен на инсулинотерапию базальным инсулином, через 7 лет с момента дебюта заболевания к терапии добавлен инсулин ультракороткого действия. Уровень С-пептида в 2019 г. — 0,01 нг/мл, через 30 и 120 мин после нагрузки глюкозой — 0,01 нг/мл. Специфические аутоантитела не исследовались. В течение всего периода заболевания предпринимались как немедикаментозные (физическая активность, диета), так и медикаментозные (метформин, лираглутид) многочисленные попытки снижения веса, на фоне чего удавалось достигнуть снижения на 4–5 кг с последующим набором веса до исходного |
СД2 диагностирован в 40 лет на фоне избыточного веса, гликемия в дебюте заболевания 20 ммоль/л. Антитела к инсулину, бета-клеткам поджелудочной железы, глутаматдекарбоксилазе не выявлены, гормональный анализ крови на С-пептид — 4,09 нг/мл (N — 1,1–4,4)). Пациенту назначена базис-болюсная инсулинотерапия аналогами инсулина человека (Аспарт + Гларгин 300). После достижения компенсации углеводного обмена к базис-болюсной инсулинотерапии добавлен метформин 2000 мг/сут. При попытке отмены ультракороткого инсулина наблюдалась декомпенсация углеводного обмена. В течение жизни предпринимались многочисленные попытки снижения веса с помощью физической активности, диеты, максимальное снижение веса — 9 кг |
|
|
Терапия на момент включения в исследование |
Базис-болюсная инсулинотерапия аналогами инсулина человека (Аспарт 25–35 Ед/сут, Гларгин 300 Ед/мл 28 Ед/сут) |
Базис-болюсная инсулинотерапия аналогами инсулина человека (Аспарт 12–20 Ед/сут, Гларгин 300 Ед/мл 8 Ед/сут); метформин 2000 мг/сут |
|
|
Сопутствующие заболевания/осложнения основного заболевания |
Ожирение II степени; ХБП С2 А2, пролиферативная стадия диабетической ретинопатии с неоднократными сеансами лазерной коагуляции сетчатки на оба глаза; диабетическая дистальная полинейропатия; атеросклероз периферических артерий |
Ожирение II степени; диабетическая дистальная полинейропатия, атеросклероз периферических артерий |
Примечание. ЛПНП — липопротеины низкой плотности; ТГ — триглицериды; ХБП — хроническая болезнь почек; ИРИ — иммунореактивный инсулин, ХБП — хроническая болезнь почек.
На момент включения в исследование у братьев были исключены: острая декомпенсация углеводного обмена, острое нарушение мозгового кровообращения, острый инфаркт миокарда в течение последнего месяца, тяжелые сопутствующие заболевания (декомпенсация хронической сердечной недостаточности, хронической обструктивной болезни легких, почечная, печеночная недостаточности), оперативные вмешательства на тонкой и толстой кишке в анамнезе, онкологические заболевания, острые или хронические заболевания органов пищеварения, протекающие с хронической диареей, прием лекарственных препаратов: антибиотиков и антибактериальных средств. Оба пациента дали письменное информированное согласие на участие в исследовании.
Перед проведением ТФМ пациентам выполнены эугликемический гиперинсулинемический клэмп-тест и ССПН, оценка уровня С-пептида, ИРИ, Hb1Ac, биохимический и общеклинический анализы крови (табл. 1). Пациентам была проведена капсульная ТФМ (замороженные капсулы, 15 шт. одномоментно, однократно, внутрь, запивая стаканом воды в течение 5 мин) от донора с нормальной массой тела (женщина, 19 лет) (критерии включения донора, тестирование донора, процедура проведения ТФМ описаны в разделе «Материалы и методы»). Пациентам было рекомендовано привычное питание. От участников исследования были получены образцы фекалий, собранные после естественной дефекации во временных точках, согласно дизайну исследования (приложение, табл. 1). Общее число собранных образцов кала составило 20. До начала анализа все образцы хранили в контейнерах при -80°С.
После ТФМ у пациентов проводились контроль состояния, анализ дневника самоконтроля гликемии, динамики массы тела, ОТ, анализ состава тела с помощью биоимпедансометрии, контроль биохимических показателей, Hb1Ac, заполнение опросника по изменению качества жизни, оценка уровня ИР с помощью эугликемического гиперинсулинемического клэмп-теста, а также сбор анализов крови, мочи и кала для метаболомного и метагеномного анализов во временных контрольных точках согласно дизайну исследования (приложение, табл. 1).
РЕЗУЛЬТАТЫ
Молекулярно-генетическое тестирование пациентов
Учитывая семейный анамнез заболевания СД, было высказано предположение о вероятности наличия моногенных форм заболевания (MODY), в связи с чем было проведено молекулярно-генетическое исследование у обоих пациентов, а также у детей пациентов и их родителей, и типирование генов HLA II класса, которые связаны с риском развития СД1 [29–31]. По результатам исследования у пациента А. (с СД1) выявлены гаплотипы высокого риска СД1, включающие аллельные варианты генов: локус DRB1*04/*04 и сцепленные с ним локусы: DQA1 (генотип *03:01/*03:01); DQB1 (генотип *03:01/*03:02). У пациента С. (с СД2) выявлены гаплотипы высокого риска СД1, включающие аллельные варианты генов: локус DRB1*01/*04 и сцепленные сним локусы: DQA1 (генотип *01:01/*03:01); DQB1 (генотип *05:01/*03:02).
В связи с наличием ожирения у обоих братьев и нетипичным течением заболевания было проведено дополнительное молекулярно-генетическое исследование пациентов и их ближайших родственников (отец, мать, сын пробанда А. и дочь пробанда С.) с целью исключения моногенных форм СД методом секвенирования по панели, включающей 27 генов [32]. Также всем членам семьи (отец, мать, оба пробанда, дети) было проведено определение последовательности кодирующих участков всех генов организма (полноэкзомное секвенирование) технологией секвенирования следующего поколения (NGS).
По результатам генетических исследований у пациента А. были выявлены 2 мутации: первая мутация в гене HNF1B (NM_000458.4:c.1473A>G:p.P491P) в гетерозиготном состоянии (генотип A/G), ранее не описанная, со статусом патогенности — вероятно доброкачественная (likely benign) и вторая мутация в гене RFX6 (NM_173560.4:c.2039C>A:p.T680K) в гетерозиготном состоянии (генотип С/A) со статусом патогенности — вероятно доброкачественная (likely benign). У пациента С. была выявлена одна мутация, такая же, как у его брата: в гене RFX6 (NM_173560.4:c.2039C>A:p.T680K) в гетерозиготном состоянии (генотип С/A) со статусом патогенности — вероятно доброкачественная (likely benign).
В ходе исследования ближайших родственников братьев у матери были выявлены обе мутации, которые обнаружены у пробанда А.: первая мутация в гене HNF1B (NM_000458.4:c.1473A>G:p.P491P) в гетерозиготном состоянии (генотип A/G), ранее неописанная, со статусом патогенности — вероятно доброкачественная (likely benign) и вторая мутация в гене RFX6 (NM_173560.4:c.2039C>A:p.T680K) в гетерозиготном состоянии (генотип С/A) со статусом патогенности — вероятно доброкачественная (likely benign). Также у матери диагностировано нарушение гликемии натощак (глюкоза натощак — 6,36 ммоль/л, через 2 ч после нагрузки глюкозой — 8,39 ммоль/л, HbA1с — 6,5%) (приложение, рис. 1). У отца, сына пациента А. и дочери пациента С. ни одной из описанных выше мутаций обнаружено не было.
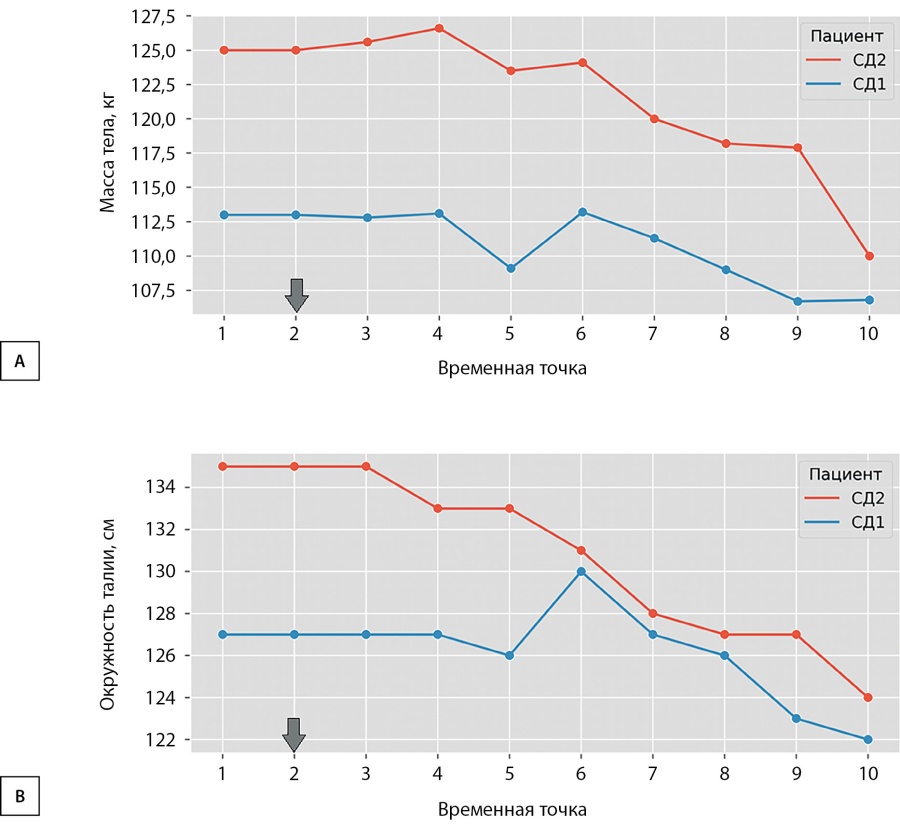
Рисунок 1. Динамика изменения антропометрических показателей у пациентов: А — динамика изменения массы тела; В — динамика изменения окружности талии. Стрелкой на рисунке указана точка вмешательства.
По итогам проведенных генетических исследований можно предположить, что нетипичное течение СД1 и СД2 у обоих пробандов может быть связано с сочетанием высокорисковых аллелей генов HLA II класса, и, вероятно доброкачественных, но, достаточно редких полиморфных вариантов, ассоциированных с повышенным риском CД2 и гиперинсулинизма. Исходя из семейного генетического анамнеза, рисковые аллели были унаследованы обоими пациентами в разной степени по материнской линии. Вероятно, необычное течение СД1 у пациента А. может быть связано с наличием гаплотипов высокого риска СД1 в генах HLA II класса и двух мутаций в генах, повышающих риск СД2, в то время как у пациента С. наряду с аллельными вариантами высокого риска СД1 в генах HLA II класса обнаружена только одна мутация, ассоциированная с риском СД2 [33–35].
Клинические и лабораторные изменения
В течение всего периода наблюдения не было отмечено серьезных нежелательных явлений и неблагоприятных изменений биохимических показателей.
Динамика антропометрических показателей
У обоих пациентов в ходе наблюдения отмечено снижение массы тела после ТФМ (динамика -4–5 кг за первый месяц наблюдения, далее -1–2 кг в месяц). У пациента А. отмечено снижение массы тела на 7,5 кг (масса тела перед процедурой 113,0 кг, через 1 год — 106,8 кг, снижение на 5,5% исходной, уменьшение ОТ с 127 до 122 см соответственно; рис. 1). У пациента С. снижение массы тела на 15,0 кг (масса тела перед процедурой 125 кг, через 1 год — 110, кг, снижение на 12,0% исходной, уменьшение ОТ с 135 до 124 см соответственно). Динамика показателей биоимпедансного исследования приведена в приложении, рис. 2 и 3. Оба пациента во время исследования сохраняли привычный режим питания и физической активности. Пациент С. придерживался питания с ограничением животных жиров, быстроусвояемых углеводов, рацион питания состоит из 2–3 полноценных приемов пищи, периодических перекусов (чаще фрукты), также присутствует минимальная физическая активность (прогулки несколько раз в неделю, велотренажер) как до, так и после проведения ТФМ.
Пациент А. не строго придерживался диетических рекомендаций (в рационе питания присутствует избыточное количество животных жиров, быстроусвояемых углеводов), рацион питания состоит из 3 основных приемов пищи, перекусов (в том числе в поздние вечерние и ночные часы), физическая активность минимальная (бытовые физические нагрузки, периодические прогулки) как до, так и после проведения ТФМ.
Динамика оценки качества жизни в соответствии с результатами анкетирования (SF-36)
Использовали опросник оценки качества жизни, подразделенный на 8 шкал, которые составлены таким образом, что более высокая оценка указывает на более высокий уровень качества жизни. Показатели каждой шкалы варьируют от 0 до 100, где 100 представляет полное здоровье. У исследуемых пациентов по некоторым шкалам, таким как физическая и жизненная активность, наблюдалось улучшение спустя 1 год после ТФМ (приложение, табл. 2).
Динамика показателей углеводного и липидного обмена
У пациента С. (СД2) отмечено уменьшение степени выраженности ИР (исходный М-индекс 2,42 мг/кг/мин, через 6 мес — 2,105 мг/кг/мин, через 1 год — 3,83 мг/кг/мин), а также сохранение компенсации углеводного обмена при уменьшении объема сахароснижающей терапии и улучшение показателей липидного спектра крови (рис. 2, табл. 2).
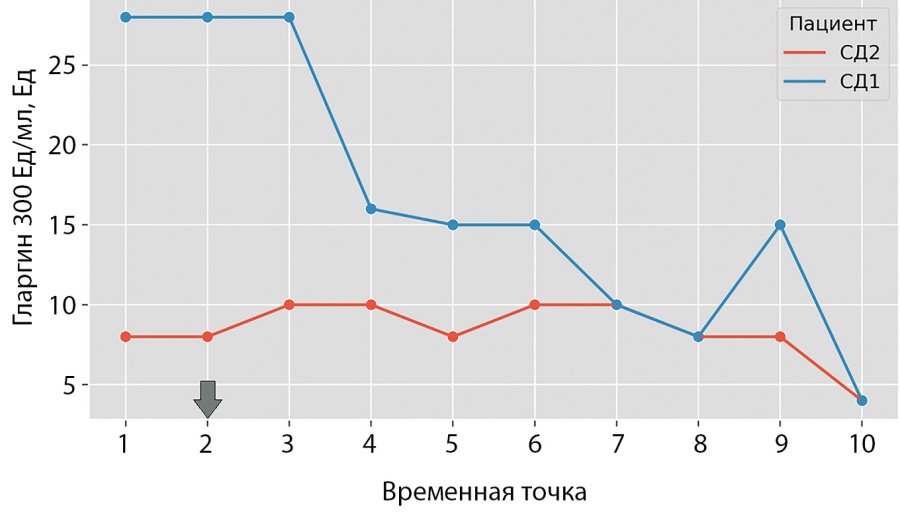
Рисунок 2. Динамика сахароснижающей терапии пациентов после проведения трансплантации фекальной микробиоты. Cтрелкой на рисунке указана точка вмешательства.
Таблица 2. Изменение лабораторных показателей у пациентов после проведения трансплантации фекальной микробиоты
|
Пациент А. (СД1) |
Пациент С. (СД2) |
||||||
|
до ТФМ |
через 6 мес после ТФМ |
через 1 год после ТФМ |
до ТФМ |
через 6 мес после ТФМ |
через 1 год после ТФМ |
Норма |
|
|
Глюкоза плазмы натощак, ммоль/л |
13,89 |
9,0 |
13,9 |
7,66 |
7,42 |
8,1 |
3,1–6,1 |
|
HbA1c, % |
8,8 |
9,0 |
9,4 |
6,9 |
7,66 |
7 |
4,0–6,0 |
|
Холестерин общий, ммоль/л |
5,01 |
7,89 |
6,93 |
4,55 |
3,5 |
3,4 |
3,3–5,2 |
|
ЛПНП, ммоль/л |
2,4 |
4.5 |
3,5 |
3,07 |
2,1 |
1,9 |
1,1–3,0 |
|
ТГ, ммоль/л |
3,76 |
5,42 |
5,33 |
1,43 |
1,03 |
1,01 |
0,1–1,7 |
|
Мочевая кислота, мкмоль/л |
359,27 |
505,68 |
419 |
408,38 |
402,66 |
478 |
142–339 |
Примечание. ТГ – триглицериды; ЛПНП – липопротеины низкой плотности.
У пациента А. (СД1) по данным гиперинсулинемического эугликемического клэмп-теста изменения уровня ИР не получено (исходный М-индекс 3,18 мг/кг/мин, через 1 год — 2,93 мг/кг/мин), в контрольной точке 6 мес у пациента А. гиперинсулинемический эугликемический клэмп-тест не проведен по техническим причинам. Пациент самостоятельно снижал дозу получаемых инсулинов (в 2,5–3 раза по сравнению с исходными) в связи с частыми ночными гипогликемиями которые купировались избыточным количеством углеводов (со слов больного), однако не было отмечено положительной динамики HbA1c. Также зафиксировано ухудшение показателей липидного спектра крови (рис. 2, табл. 2).
Метаболомный анализ
Метаболомный анализ образцов фекалий пациентов был проведен двумя физико-химическими методами независимо. Для строгой оценки содержания в фекалиях основных КЖК, бутирата, пропионата и ацетата использовался метод ГХ-ПИД. Результаты анализа показали заметные различия в представленности КЖК между пациентами СД1 и СД2: образцы пациента с СД1 имеют заметное снижение относительной концентрации масляной кислоты (p-value=0,0011) относительно нормального значения. У пациента с СД2 наблюдается незначительное снижение концентрации пропионовой кислоты (p-value=0,043). Показатели уксусной кислоты оказались незначительно завышены у обоих пациентов, но только для пациента с СД1 превышение нормы было статистически значимо (p-value=0,016) (приложение, рис. 4).
Дополнительно был проведен ненаправленный анализ метаболитного состава стула пациентов с помощью метода ГХ-МС с применением парофазной экстракции для оценки композиции всех летучих органических соединений, содержащихся в образцах. Здесь необходимо отметить, что значения, полученные этими двумя методами, могут сильно различаться как в абсолютных, так и в относительных величинах, поскольку ГХ-ПИД оценивает концентрацию напрямую в образце, в то время как ГХ-МС с парофазной экстракцией измеряет относительные парциальные давления летучих соединений в паровой фазе, которые могут сильно отличаться от относительных концентраций в исходном образце вследствие различий в летучести. Сравнительные диаграммы для каждого достоверно обнаруженного соединения приведены в приложении на рис. 5. Различия в уровне пропионовой и масляной кислоты полностью согласуются с результатами анализа ГХ-ПИД. Отличия в поведении ацетата могут быть связаны со сложностью точной количественной оценки содержания ацетата посредством паровой фазы, так как ацетат как достаточно полярная молекула слабо реагирует на изменение ионной силы раствора. Дополнительно значимые отличия между пациентами были показаны для валериановой, капроновой кислот (преобладают у пациента с СД2 по сравнению с СД1) и декановой кислоты (преобладают у пациента с СД1 по сравнению с СД2).
Данные, полученные с помощью ГХ-МС, были проанализированы с помощью метода главных компонент. После понижения размерности было обнаружено, что в ходе исследования никаких направленных изменений в композиции метаболитов стула после процедуры ТФМ не наблюдалось (приложение, рис. 4, B). Отметим, что PCA дополнительно подтвердил наличие значимого различия между метаболомами пациентов, но характер изменений у каждого пациента в течение всего периода исследования носит случайный характер.
Анализ данных, полученных при помощи метагеномного секвенирования образцов фекалий пациентов
В результате секвенирования образцов фекалий реципиентов было получено 6,5±3,6 млн парных предварительно обработанных прочтений размером 250 пар оснований на образец. Метод MetaPhlAn2, основанный на уникальных кладоспецифичных маркерах, позволил идентифицировать суммарно во всех образцах 98 видов микроорганизмов, принадлежащих к 58 родам и 27 семействам. Список наиболее многочисленных микробных семейств включал: Bacteroidaceae (22,5±15,4%), Lachnospiraceae(19,3±10,1%), Ruminococcaceae (17,4±6,8%). Стоит отметить, что Bifidobacteriaceae многочисленны у пациента с СД2, однако практически отсутствуют у донора и пациента с СД1 (приложение, рис. 6).
Значения альфа-разнообразия, которые описывают богатство микробного сообщества, были относительно стабильными для пациента с СД1 с течением времени. В то же время СД2 показывал большую изменчивость по данному признаку (приложение, рис. 7, А). Двумерная визуализация, полученная при помощи непараметрического многомерного шкалирования с использованием несходства Брея–Кертиса, не показала явного сдвига содержания видов стула пациентов в сторону донора (приложение, рис. 7, В). Стоит отметить, что метагеномные образцы группируются согласно принадлежности конкретному пациенту. Дисперсионный анализ с использованием PERMANOVA показал, что идентификаторы пациентов были в значительной степени связаны с таксономическим составом (R2=0,41, скорректированное p<0,001, несходство Брея–Кертиса, 10 000 перестановок).
Однако стоит отметить, что при отслеживании метрики несходства Брея–Кертиса микробиота реципиентов меняется с течением времени (рис. 8, A). У пациентов микробиота изменяется в большей степени по сравнению с микробиотой здоровых индивидов без вмешательства (0,49±0,10 против 0,27±0,10, критерий суммы рангов Вилкоксона р<0,001) [26], больными с метаболическим синдромом с аллогенной (0,49±0,10 против 0,37) ±0,11; критерий суммы рангов Вилкоксона p<0,01) или аутологичной фекальной трансплантацией (0,49±0,10 против 0,33±0,07; критерий суммы рангов Вилкоксона p<0,001) [16]. В то же время влияния донорской микробиоты не было обнаружено (приложение, рис. 8, В; корреляция Спирмена p>0,05 в обоих случаях). Также не было различий в этих показателях между двумя пациентами. Таким образом, наблюдаемые изменения не могут быть связаны с колонизацией донорскими микробами.
ОБСУЖДЕНИЕ
Причины ожирения и ИР крайне многофакторны, и, наряду с генетическими факторами и чрезмерным потреблением калорий, вклад кишечной микробиоты в регуляцию метаболизма на сегодняшний день не вызывает сомнений [3][4]. Это подтверждается в различных исследованиях, в которых сообщается о различной реакции пациентов на попытки искусственного внесения изменений в микробиом. Из всего кажущегося объема информации к настоящему времени проведено только 6 рандомизированных клинических исследований, данные которых показывают, что ТФМ может играть роль в лечении метаболического синдрома, однако доказательств, подтверждающих эффективность ее использования в клинической практике, пока недостаточно [36].
Многие исследования по ТФМ показали, что одним из факторов успеха является базовый уровень микробиомного пейзажа пациента. Прослеживается четкая закономерность хорошего ответа на терапию ТФМ у пациентов с более низким базовым разнообразием фекальной микробиоты [37].
В нашем клиническом случае по результатам проведенного микробиомного исследования микробиота пациентов отличается от донорской и между пациентами, при этом существенно меняется с течением времени, однако влияния донорской микробиоты на разнообразие кишечника пациентов выявлено не было. Пациенты отличались друг от друга по количеству метаболитов, но в ходе исследования никаких направленных изменений в композиции метаболитов стула после процедуры ТФМне наблюдалось. Оба пациента показали сходный положительный ответ в отношении снижения массы тела, несмотря на клинически подтвержденные разные типы СД. Наблюдая достаточно несущественные микробиомные сдвиги у обоих пациентов, нельзя не отметить значительное улучшение метаболических показателей, а именно снижение массы тела, улучшение чувствительности к инсулину и уменьшение объема проводимой сахароснижающей терапии у пациента с СД2, а также снижение массы тела у пациента с СД1 при сохранении привычного режима питания и физической активности. Интересно, что данные нескольких исследований показали противоположные результаты: приживление донорской кишечной микробиоты происходило у большинства реципиентов и микробный пейзаж был схож с донорским к 12-й неделе наблюдения при отсутствии положительных метаболических сдвигов [38–40]. В [37][38] в последующем наблюдалось возвращение микробного разнообразия к исходному. В исследовании [40] дальнейшее наблюдение за пациентами не проводилось, однако при вторичном анализе результатов исследования у пациентов в группе ТФМ было обнаружено снижение изменения площади под кривой уровней глюкозы и инсулина по сравнению с первоначальным уровнем. Одновременно с этим в исследованиях, которые помимо различий микробного состава показали положительные тенденции метаболических показателей, изменения носили временный характер. Так, в исследовании [37] микробный состав и метаболические изменения, зафиксированные в контрольной точке 6 нед, вернулись к первоначальной картине через 18 нед. В другом исследовании [11] метаболические сдвиги наблюдались в контрольной точке 6 нед, последующее наблюдение за пациентами не проводилось. В нашем клиническом случае снижение массы тела наблюдалось с начала 3-й недели после проведения ТФМ с периодическими колебаниями, а стойкое постепенное снижение массы тела началось с контрольной точки в 1,5 мес. При этом интересно отметить, что проведенный у пациента с СД2 промежуточный эугликемический гиперинсулинемический клэмп-тест как золотой стандарт оценки уровня ИР в контрольной точке 6 мес не показал положительной динамики, несмотря на значительное снижение массы тела к этому времени, а контрольный тест во временной точке 1 год уже показал значимое улучшение чувствительности к инсулину. Положительные эффекты могут быть отчасти связаны с повышенным врачебным контролем за пациентами в течение первых 6 мес наблюдения, но, поскольку они сохранялись и в последующем, а также принимая во внимание данные исследований, вкоторых наблюдение за пациентами проводилось максимально в течение 4,5–6 мес, возможно, имеют место отдаленные эффекты ТФМ, однако эти результаты следует интерпретировать с осторожностью, учитывая недостаточную выборку участников. Обращает на себя внимание факт снижения массы тела с момента ТФМ у пациента с СД1 (учитывая, что все предыдущие традиционные немедикаментозные и медикаментозные попытки снижения массы тела не приводили к успеху), уменьшение объема проводимой сахароснижающей терапии и сохранение этих эффектов в течение всего периода наблюдения, несмотря на отсутствие положительной динамики в показателях гликемического контроля, и отсутствие приверженности пациента кбазовым диетическим рекомендациям. Различные клинические эффекты ТФМ у пациентов могут быть связаны с различной природой заболеваний, а также длительностью с момента манифестации заболевания.
ЗАКЛЮЧЕНИЕ
Продолжение исследования ТФМ при ожирении и СД представляется нам особенно актуальным ввиду высокой распространенности метаболического синдрома в современном мире. Особенно интересны изучение микробного и метаболомного состава реципиентов относительно базовых характеристик донора и поиск возможных способов приживления «здоровой» микробиоты. Остается открытым вопрос о долгосрочности полученных изменений, в связи с чем целесообразно продолжение дальнейшего изучения ТФМ с расширением когорты исследуемых и поиска возможных способов пролонгации полученных положительных эффектов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Финансирование работы. Работа выполнена в рамках государственного задания ААА-А20-120011790164-4 «Ремиссия сахарного диабета 2 типа после бариатрической хирургии: роль гормонов желудочно-кишечного тракта (инкретинов), желчных кислот и микробиоты кишечника».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациентов. Пациенты добровольно подписали информированное согласие на публикацию персональной медицинской информации в обезличенной форме в данном журнале.
ПРИЛОЖЕНИЕ
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Таблица 1. Дизайн исследования
|
Обследование |
Параметр |
Точка 1 |
Точка 2 |
Точка 3 |
Точка 4 |
Точка 5 |
Точка 6 |
Точка 7 |
Точка 8 |
Точка 9 |
Точка 10 |
|
|
1 день до ТФМ |
ТФМ |
1 неделя после ТФМ |
2 недели после ТФМ |
3 недели после ТФМ |
1–1.5 месяца после ТФМ |
3–5 месяцев после ТФМ |
6 месяцев после ТФМ |
8 месяцев после ТФМ |
1 год после ТФМ |
|||
|
1 |
Анкетирование (форма SF-36) |
+ |
+ |
|||||||||
|
2 |
Стандартное физикальное обследование |
Масса тела |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
ИМТ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
ОТ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
3 |
Лабораторное обследование |
+ |
+ |
+ |
||||||||
|
4 |
Клэмп-тест |
+ |
+ |
|||||||||
|
5 |
Забор материала для проведения молекулярно-генетического и метаболомного исследования |
Кал |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Моча |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
Кровь |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
6 |
Анализ дневника самоконтроля гликемии |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
7 |
Анализ состава тела с помощью биоимпедансометрии |
+ |
+ |

Рисунок 1. Генеалогическое древо.

Рисунок 2. Динамика изменения биоимпедансного исследования у пациента А.
(А — до проведения трансплантации фекальной микробиоты; В — после проведения трансплантации фекальной микробиоты).

Рисунок 3. Динамика изменения биоимпедансного исследования у пациента С.
(А — до проведения трансплантации фекальной микробиоты; В — после проведения трансплантации фекальной микробиоты).
Таблица 2. Динамика изменения качества жизни у пациентов по результатам опросника SF-36
|
Шкалы опросника |
Пациент С. |
Пациент С. |
Пациент А. |
Пациент А. |
|
Физическое функционирование |
95 |
100 |
90 |
95 |
|
Ролевое функционирование, обусловленное физическим состоянием |
100 |
100 |
100 |
100 |
|
Интенсивность боли |
100 |
100 |
100 |
100 |
|
Общее состояние здоровья |
57 |
60 |
87 |
87 |
|
Жизненная активность |
95 |
100 |
70 |
75 |
|
Социальное функционирование |
87,5 |
100 |
100 |
100 |
|
Ролевое функционирование, обусловленное эмоциональным состоянием |
100 |
100 |
100 |
100 |
|
Психическое здоровье |
92 |
100 |
80 |
80 |

Рисунок 4. Метаболомный анализ образцов фекалий пациентов: A — относительные концентрации уксусной (A1), пропионовой (A2) и масляной (A3) кислот в образцах фекалий пациентов с сахарным диабетом 1 типа (красные распределения) и сахарным диабетом 2 типа (синие распределения), измеренные с помощью GC-FID метода; B — анализ методом главных компонент (PCA) изменений метаболического профиля пациентов с сахарным диабетом 1 типа и сахарным диабетом 2 типа в течение исследования. Концентрации метаболитов оценивались с помощью GC-MS с парофазной экстракцией.

Рисунок 5. Относительные представленности метаболитов в паровой фазе в образцах пациентов с сахарным диабетом 1 типа (красные распределения) и сахарным диабетом 2 типа (синие распределения).

Рисунок 6. Наиболее многочисленные микробные семейства в метагеномах фекалий пациентов. Цвета клеток обозначают относительную представленность семейств, полученных с помощью алгоритма MetaPhlAn2 после логарифмического преобразования, более высокое значение соответствует более высокой относительной представленности. Строки соответствуют образцам пациента (донор — для образцов донора, СД1 и СД2 — для обоих пациентов соответственно). Порядковый номер после идентификатора пациента соответствует моменту времени отбора проб. На рисунке показаны таксоны, присутствующие не менее чем в 20% образцов.
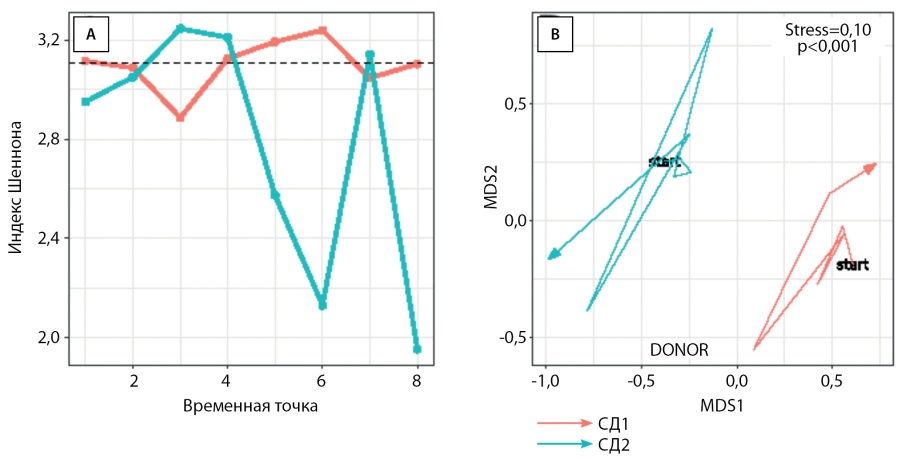
Рисунок 7. A — оценка альфа-разнообразия метагеномных образцов пациентов с течением времени по индексу Шеннона. Черная пунктирная линия обозначает индекс Шеннона донорского метагеномного образца. B — двумерная визуализация таксономических профилей (видовой уровень) метагеномных образцов пациентов, полученная при помощи непараметрического многомерного шкалирования с использованием метрики несходства Брея–Кертиса. Пациентам соответствуют разные цвета: красный цвет для СД1, синий цвет для СД2. Исходный момент времени показан как «start», тогда как образец донора обозначен как «DONOR».
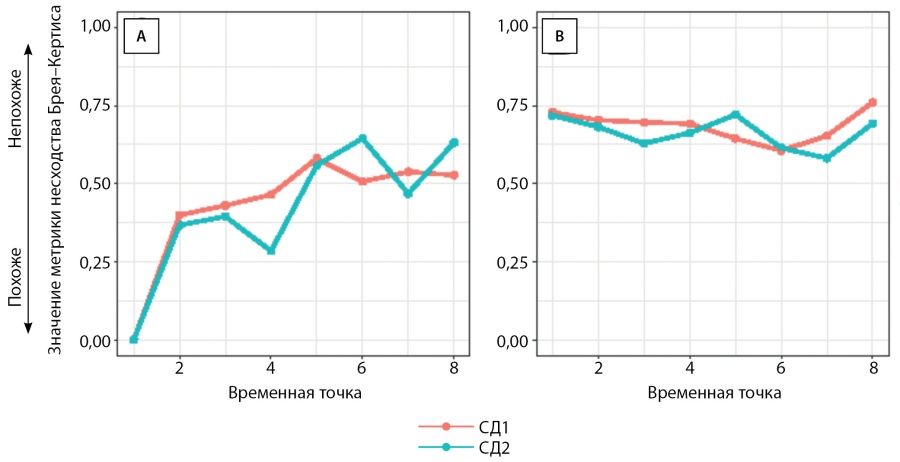
Рисунок 8. Оценка изменений, вызванных фекальной трансплантацией, в таксономических профилях метагеномов фекалий пациентов (видовой уровень) с течением времени. A — оценка метрики несходства Брея–Кертиса между исходными метагеномами реципиентов до фекальной трансплантации и метагеномами других временных точек после фекальной трансплантации. B — оценка метрики несходства Брея–Кертиса между метагеномами стула донора и метагеномами временных точек реципиента.
Список литературы
1. Smith KB, Smith MS. Obesity Statistics. Prim Care Clin Off Pract. 2016;43(1):121-135. doi: https://doi.org/10.1016/j.pop.2015.10.001
2. Hanson RL, Imperatore G, Bennett PH, Knowler WC. Components of the “Metabolic Syndrome” and Incidence of Type 2 Diabetes. Diabetes. 2002;51(10):3120-3127. doi: https://doi.org/10.2337/diabetes.51.10.3120
3. Aydin Ö, Nieuwdorp M, Gerdes V. The Gut Microbiome as a Target for the Treatment of Type 2 Diabetes. Curr Diab Rep. 2018;18(8):55. doi: https://doi.org/10.1007/s11892-018-1020-6.
4. Harsch I, Konturek P. The Role of Gut Microbiota in Obesity and Type 2 and Type 1 Diabetes Mellitus: New Insights into “Old” Diseases. Med Sci. 2018;6(2):32. doi: https://doi.org/10.3390/medsci6020032
5. Le Chatelier E, Nielsen T, Qin J, et al. Richness of human gut microbiome correlates with metabolic markers. Nature. 2013;500(7464):541-546. doi: https://doi.org/10.1038/nature12506
6. Duncan SH, Lobley GE, Holtrop G, et al. Human colonic microbiota associated with diet, obesity and weight loss. Int J Obes (Lond). 2008;32(11):1720-1724. doi: https://doi.org/10.1038/ijo.2008.155
7. Karlsson F, Tremaroli V, Nielsen J, Bäckhed F. Assessing the human gut microbiota in metabolic diseases. Diabetes. 2013;62(10):3341-9. doi: https://doi.org/10.2337/db13-0844
8. de Groot PF, Frissen MN, de Clercq NC, Nieuwdorp M. Fecal microbiota transplantation in metabolic syndrome: History, present and future. Gut Microbes. 2017;8(3):253-267. doi: https://doi.org/10.1080/19490976.2017.1293224
9. Allin KH, Tremaroli V, Caesar R, et al. Aberrant intestinal microbiota in individuals with prediabetes. Diabetologia. 2018;61(4):810-820. doi: https://doi.org/10.1007/s00125-018-4550-1
10. Bäckhed F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci. 2004;101(44):15718-15723. doi: https://doi.org/10.1073/pnas.0407076101
11. Vrieze A, Van Nood E, Holleman F, et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012;143(4):913-916.e7. doi: https://doi.org/10.1053/j.gastro.2012.06.031
12. Hamilton MJ, Weingarden AR, Unno T, et al. High-throughput DNA sequence analysis reveals stable engraftment of gut microbiota following transplantation of previously frozen fecal bacteria. Gut Microbes. 2013;4(2):125-135. doi: https://doi.org/10.4161/gmic.23571
13. Food & Drug Administration. Fecal Microbiota for Transplantation: Scientific and Regulatory Issues 309, May 2, 2013 [FR Doc. 2013–04232 Filed 2–22–13; 8:45 am]
14. Wang H, Lu Y, Yan Y, et al. Promising Treatment for Type 2 Diabetes: Fecal Microbiota Transplantation Reverses Insulin Resistance and Impaired Islets. Front Cell Infect Microbiol. 2020;9. doi: https://doi.org/10.3389/fcimb.2019.00455
15. Zhang PP, Li LL, Han X, et al. Fecal microbiota transplantation improves metabolism and gut microbiome composition in db/db mice. Acta Pharmacol Sin. 2020;41(5):678-685. doi: https://doi.org/10.1038/s41401-019-0330-9
16. Dedrick S, Sundaresh B, Huang Q, et al. The Role of Gut Microbiota and Environmental Factors in Type 1 Diabetes Pathogenesis. Front Endocrinol (Lausanne). 2020;11:78. doi: https://doi.org/10.3389/fendo.2020.00078
17. de Groot P, Nikolic T, Pellegrini S, et al. Faecal microbiota transplantation halts progression of human new-onset type 1 diabetes in a randomised controlled trial. Gut. 2021;70(1):92-105. doi: https://doi.org/10.1136/gutjnl-2020-322630
18. DeFronzo RA, Tobin JD, Andres R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 1979;237(3):E214-223. doi: https://doi.org/10.1152/ajpendo.1979.237.3.E214
19. Майоров А.Ю. Состояние инсулинорезистентности в эволюции сахарного диабета 2 типа. — М.; 2009. — 217 c.
20. Cammarota G, Ianiro G, Tilg H, et al. European FMT Working Group. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017;66(4):569-580. doi: https://doi.org/10.1136/gutjnl-2016-313017
21. Жгун Е.С., Кислун Ю.В., Калачнюк Т.Н., и др. Оценка уровня метаболитов в фекалиях пациентов с воспалительными заболеваниями кишечника // Биомедицинская химия. — 2020. — Т. 66. — №3. — С. 233-240. doi: https://doi.org/10.18097/pbmc20206603233
22. Bolger AM, Lohse M, Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 2014;30(15):2114-2120. doi: https://doi.org/10.1093/bioinformatics/btu170
23. Bushnell B. BBMap: A Fast, Accurate, Splice-Aware Aligner. Lawrence Berkeley National Laboratory. LBNL Report #: LBNL-7065E. 2014. [Internet]. Available from: https://escholarship.org/uc/item/1h3515gn
24. Segata N, Waldron L, Ballarini A, et al. Metagenomic microbial community profiling using unique clade-specific marker genes. Nat Methods. 2012;9(8):811-814. doi: https://doi.org/10.1038/nmeth.2066
25. Truong DT, Franzosa EA, Tickle TL, et al. MetaPhlAn2 for enhanced metagenomic taxonomic profiling. Nat Methods. 2015;12(10):902-903. doi: https://doi.org/10.1038/nmeth.3589
26. Voigt AY, Costea PI, Kultima JR, et al. Temporal and technical variability of human gut metagenomes. Genome Biol. 2015;16(1):73. doi: https://doi.org/10.1186/s13059-015-0639-8
27. Oksanen J, Blanchet FG, Kindt R, et al. Package ‘vegan’. Community ecology package, version 2.9. 2013;1–295.
28. The R Development Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. 2015. Available online at https://www.R-project.org/
29. Cerolsaletti K, Hao W, Greenbaum CJ. Genetics Coming of Age in Type 1 Diabetes. Diabetes Care. 2019;42(2):189-191. doi: https://doi.org/10.2337/dci18-0039
30. Trowsdale J, Knight JC. Major Histocompatibility Complex Genomics and Human Disease. Annu Rev Genomics Hum Genet. 2013;14(1):301-323. doi: https://doi.org/10.1146/annurev-genom-091212-153455
31. Redondo MJ, Oram RA, Steck AK. Genetic Risk Scores for Type 1 Diabetes Prediction and Diagnosis. Curr Diab Rep. 2017;17(12):129. doi: https://doi.org/10.1007/s11892-017-0961-5
32. Ellard S, Lango Allen H, De Franco E, et al. Improved genetic testing for monogenic diabetes using targeted nextgeneration sequencing. Diabetologia. 2013;56(9):1958-1963. doi: https://doi.org/10.1007/s00125-013-2962-5
33. Pociot F, Akolkar B, Concannon P, et al. Genetics of type 1 diabetes: what’s next?. Diabetes. 2010;59(7):1561-1571. doi: https://doi.org/10.2337/db10-0076
34. Taleb N, Polychronakos C. RFX6 is needed for the development and maintenance of the β-cell phenotype. Islets. 2011;3(5):291-293. doi: https://doi.org/10.4161/isl.3.5.15944
35. Clissold RL, Hamilton AJ, Hattersley AT, et al. HNF1B-associated renal and extra-renal disease-an expanding clinical spectrum. Nat Rev Nephrol. 2015;11(2):102-112. doi: https://doi.org/10.1038/nrneph.2014.232
36. Proenca I, Allegretti JR, Bernardo WM, et al. Fecal microbiota transplantation improves metabolic syndrome parameters: systematic review with meta-analysis based on randomized clinical trials. Nutr Res. 2020;83:1-14. doi: https://doi.org/10.1016/j.nutres.2020.06.018
37. Kootte RS, Levin E, Salojärvi J, et al. Improvement of Insulin Sensitivity after Lean Donor Feces in Metabolic Syndrome Is Driven by Baseline Intestinal Microbiota Composition. Cell Metab. 2017;26(4):611-619.e6. doi: https://doi.org/10.1016/j.cmet.2017.09.008
38. Yu EW, Gao L, Stastka P, et al. Fecal microbiota transplantation for the improvement of metabolism in obesity: The FMT-TRIM doubleblind placebo-controlled pilot trial. PLOS Med. 2020;17(3):e1003051. doi: https://doi.org/10.1371/journal.pmed.1003051
39. Leong KSW, Jayasinghe TN, Wilson BC, et al. Effects of Fecal Microbiome Transfer in Adolescents With Obesity. JAMA Netw Open. 2020;3(12):e2030415. doi: https://doi.org/10.1001/jamanetworkopen.2020.30415
40. Allegretti JR, Kassam Z, Mullish BH, et al. Effects of Fecal Microbiota Transplantation With Oral Capsules in Obese Patients. Clin Gastroenterol Hepatol. 2020;18(4):855-863.e2. doi: https://doi.org/10.1016/j.cgh.2019.07.006
Об авторах
Е. В. ПокровскаяРоссия
Покровская Елена Владиславовна, научный сотрудник
117036, Москва, ул. Дмитрия Ульянова, д. 11
eLibrary SPIN: 8769-5010
Е. С. Жгун
Россия
Жгун Елена Сергеевна, кандидат биологичнских наук, старший научный сотрудник
Москва
eLibrary SPIN: 7696-5117
Е. А. Шестакова
Россия
Шестакова Екатерина Алексеевна, кандидат медицинских наук, ведущий научный сотрудник
Москва
eLibrary SPIN: 1124-7600
И. А. Скляник
Россия
Скляник Игорь Александрович, кандидат медицинских наук, старший научный сотрудник
Москва
eLibrary SPIN: 7081-8077
И. В. Федюшкина
Россия
Федюшкина Ирина Викторовна, кандидат биологичнских наук, научный сотрудник
Москва
eLibrary SPIN: 8307-3721
Е. И. Олехнович
Россия
Олехнович Евгений Иванович, кандидат биологичнских наук, научный сотрудник
Москва
Д. Н. Конанов
Россия
Конанов Дмитрий Николаевич, младший научный сотрудник
Москва
eLibrary SPIN: 8951-4992
Д. А. Кардонский
Россия
Кардонский Дмитрий Александрович
Москва
eLibrary SPIN: 7827-6565
Ю. В. Кислун
Россия
Кислун Юрий Викторович, кандидат биологических наук
Москва
Е. А. Сорокина
Россия
Сорокина Екатерина Андреевна, студентка
Москва
Л. И. Зильберман
Россия
Зильберман Любовь Иосифовна, кандидат медицинских наук, ведущий научный сотрудник
Москва
eLibrary SPIN 4488-7724
Н. В. Зайцева
Россия
Зайцева Наталья Владиславовна, кандидат медицинских наук, ведущий научный сотрудник
Москва
eLibrary SPIN: 8894-8815
Е. Н. Ильина
Россия
Ильина Елена Николаевна, член-корреспонден РАН, доктор биологических наук, профессор РАН
Москва
eLibrary SPIN: 6720-8230
В. М. Говорун
Россия
Говорун Вадим Маркович, доктолр биологических наук, академик РАН
Москва
eLibrary SPIN: 4187-7742
М. В. Шестакова
Россия
Шестакова Марина Владимировна, доктор медицинских наук, профессор, академик РАН
Москва
eLibrary SPIN: 7584-7015
Дополнительные файлы
|
|
1. Рисунок 1. Динамика изменения антропометрических показателей у пациентов: А — динамика изменения массы тела; В — динамика изменения окружности талии. Cтрелкой на рисунке указана точка вмешательства. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(287KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Динамика сахароснижающей терапии пациентов после проведения трансплантации фекальной микробиоты. Cтрелкой на рисунке указана точка вмешательства. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(113KB)
|
Метаданные ▾ | |

|
3. Приложение. Дополнительные материалы. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Покровская Е.В., Жгун Е.С., Шестакова Е.А., Скляник И.А., Федюшкина И.В., Олехнович Е.И., Конанов Д.Н., Кардонский Д.А., Кислун Ю.В., Сорокина Е.А., Зильберман Л.И., Зайцева Н.В., Ильина Е.Н., Говорун В.М., Шестакова М.В. Трансплантация фекальной микробиоты в составе комплексной терапии сахарного диабета у сибсов с ожирением: клинический случай. Сахарный диабет. 2022;25(4):405-417. https://doi.org/10.14341/DM12893
For citation:
Pokrovskaya E.V., Zhgun E.S., Shestakova E.A., Sklyanik I.A., Fedushkina I.V., Olekhnovich E.I., Konanov D.N., Kardonsky D.A., Kislun Yu.V., Sorokina E.A., Zilberman L.I., Zaytseva N.V., Ilina E.N., Govorun V.M., Shestakova M.V. Feсal microbiota transplantation in the format of complex therapy in obesive siblings: clinical case. Diabetes mellitus. 2022;25(4):405-417. (In Russ.) https://doi.org/10.14341/DM12893
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































