Перейти к:
Дистанционное наблюдение подростков с сахарным диабетом 1 типа с использованием мобильного приложения
https://doi.org/10.14341/DM12776
Аннотация
Актуальность. Распространенность сахарного диабета 1 типа (СД1) в детском возрасте увеличивается с каждым годом. Подростковый возраст является наиболее трудным в отношении достижения оптимального метаболического контроля СД1. Телемедицина уже продемонстрировала эффективность у детей с этим заболеванием, однако исследований среди подростков проведено недостаточно. Использование мобильных приложений для диабета может быть связано с лучшим гликемическим контролем у пациентов с СД1.
Цель. Оценить эффективность и безопасность модели медицинской помощи подросткам с СД1 с применением дистанционного консультирования и мобильного приложения.
Материалы и методы. В исследование включались подростки в возрасте ≥14 и <18 лет, с длительностью СД1 >3 мес. Длительность исследования составляла 26 нед. Проведено 3 очных и не менее 4 дистанционных визитов с использованием мобильного приложения. Всем пациентам проводились стандартный осмотр и антропометрия, исследование НbА1с, регистрация и анализ показателей, оценка и коррекция проводимого лечения. Исходно и в конце исследования оценивалось качество жизни подростков. В конце исследования проводился опрос подростков и лечащих врачей в отношении оценки программы.
Результаты. Были включены 56 пациентов, 7 подростков прервали участие. Уровень НbА1с статистически значимо снизился уже к 12-й неделе исследования (0,3%; p=0,005), к концу исследования изменение НbА1с составило –0,5% (p<0,001). Отмечалось статистически значимое увеличение процентов измерений глюкозы в целевом диапазоне (+5,3 п.п.; p=0,016) и снижение вариабельности глюкозы крови (-3,1 п.п.; p=0,015). Отмечено статистически значимое улучшение как совокупной оценки качества жизни пациентами (+2,9 балла; p=0,008), так и отдельных составляющих ее показателей: отношение к диабету (+3,0 балла; p=0,049), отношение к лечению (+4,6 балла; p=0,010) и общение с окружающими (+4,5 балла; p=0,015). Большинство врачей и пациентов положительно оценили участие в исследовании. Частота нежелательных явлений значимо не изменилась в процессе исследования по сравнению с исходным уровнем.
Заключение. Дистанционное консультирование с использованием мобильного приложения для управления диабетом является безопасным и эффективным в отношении гликемического контроля и качества жизни подходом у подростков с СД1, обеспечивающим удобство и быстроту взаимодействия.
Ключевые слова
Для цитирования:
Лаптев Д.Н., Еремина И.А., Карпушкина А.В., Петряйкина Е.Е., Безлепкина О.Б., Петеркова В.А. Дистанционное наблюдение подростков с сахарным диабетом 1 типа с использованием мобильного приложения. Сахарный диабет. 2021;24(5):404-413. https://doi.org/10.14341/DM12776
For citation:
Laptev D.N., Eremina I.A., Karpushkina A.V., Petryaykina E.E., Bezlepkina O.B., Peterkova V.A. Remote monitoring of adolescents with type 1 diabetes mellitus using a mobile application. Diabetes mellitus. 2021;24(5):404-413. (In Russ.) https://doi.org/10.14341/DM12776
АКТУАЛЬНОСТЬ
Сахарный диабет 1 типа (СД1) — это хроническое социально значимое заболевание, распространенность которого в детском возрасте увеличивается с каждым годом [1]. Так, в Российской Федерации, по данным Федерального регистра пациентов с сахарным диабетом, распространенность СД1 среди детей в возрасте до 14 лет с 2013 по 2016 г. увеличилась с 81 до 93,5 случая на 100 000 детского населения, а подростков в возрасте 15–17 лет — с 212,8 до 221,7 случая на 100 000 подросткового населения [2].
Наиболее трудным с точки зрения достижения оптимального метаболического контроля СД1 является подростковый возраст, что определяется биологическими и психосоциальными изменениями, связанными с половым созреванием, создающими нехарактерные для другого возраста потребности и проблемы для самих подростков с диабетом и их семей [3]. В результате в подростковом возрасте наблюдается наиболее высокий уровень гликированного гемоглобина (НbА1с) [2]. При этом по сравнению со взрослыми метаболический контроль в подростковом возрасте, по-видимому, имеет большее влияние на риск микрососудистых осложнений в более позднем возрасте [4], что указывает на необходимость более тщательного контроля диабета.
В последнее время на фоне происходящей информатизации общества в целом и благодаря своей доступности и удобству широкое распространение получают различные мобильные приложения для контроля диабета. С помощью таких приложений пациенты с СД1 и их родители могут собрать все данные по самоконтролю в одном месте и получить совет своего лечащего врача по инсулинотерапии, подсчету углеводов или настройке устройств. Использование мобильных приложений может быть связано с лучшим гликемическим контролем у пациентов с СД1 [5].
Препятствиями для использования мобильных приложений для управления диабетом являются недостаточная осведомленность о подходящих продуктах и уверенность в том, что приложение не принесет пользы [5]. Кроме того, определять эффективность могут функциональные возможности, так, среди характеристик мобильных приложений, которые связаны с лучшим уровнем НbА1с, — наличие структурированного представления данных самоконтроля [6].
Телемедицина уже продемонстрировала свою эффективность у детей с СД1 [7], однако исследований у подростков проведено недостаточно. Поскольку подавляющее большинство подростков не достигают целевого гликемического контроля, принимая во внимание особые потребности в этом возрасте, целесообразно оценить эффективность дистанционной модели наблюдения с применением мобильного приложения, чтобы повысить эффективность медицинской помощи.
ЦЕЛЬ
Оценить эффективность и безопасность модели медицинской помощи подросткам с СД1 с применением дистанционного консультирования и мобильного приложения.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Многоцентровое проспективное открытое неконтролируемое клиническое исследование было проведено в 10 медицинских организациях, находящихся на территории г. Москвы и оказывающих медицинскую помощь в амбулаторных условиях. В исследование были включены подростки в возрасте ≥14 и <18 лет, с длительностью СД1 >3 мес, получающие интенсифицированную инсулинотерапию (путем множественных инъекций инсулина — МИИ или непрерывной подкожной инфузии инсулина — НПИИ).
Процедуры исследования и регистрация показателей
Длительность исследования составляла 26 нед, исследование включало два периода: период введения и основной период. Длительность периода введения составляла 2 нед, в течение которых проводилась только регистрация показателей гликемии по данным исследовательского глюкометра без мобильного приложения и дистанционного наблюдения. Длительность основного периода составила 24 нед, в течение которых было проведено три очных (исходно, через 12 и 24 нед) и не менее 4 дистанционных визитов (через 4, 8, 16, 20 нед) с использованием мобильного приложения.
Всем пациентам на очных визитах проводились стандартный осмотр и антропометрия, осуществлялись исследование уровня HbA1c методом реакции агглютинации моноклональных антител на анализаторе DCA Vantage Analyzer (Siemens, Германия), регистрация и анализ показателей гликемии и суточных доз инсулина, оценка и коррекция проводимого лечения, давались рекомендации по самоконтролю и наблюдению. Исходно и в конце исследования проводилась оценка качества жизни подростков. Помимо этого, в конце исследования был проведен опрос подростков и лечащих врачей в отношении оценки программы дистанционного наблюдения с применением мобильного приложения.
Мобильное приложение OneTouch Reveal (OT Reveal)
Все пациенты были обеспечены глюкометром OneTouch Select Plus Flex с возможностью автоматической передачи данных на смартфон в специализированное мобильное приложение OT Reveal для управления СД и обучены его использованию. Mобильное приложение OT Reveal представляет собой дневник самоконтроля в электронном формате с автоматическим построением структурированных отчетов и возможностью направлять их в электронном виде медицинскому работнику. Приложение предназначено для граждан Российской Федерации и доступно на русском языке.
Пациенту или его законному представителю было рекомендовано выполнять измерения глюкозы крови с частотой не менее 4 раз в сутки (перед едой, через 2 ч после еды, перед сном, периодически ночью) с помощью совместимого глюкометра. Помимо этого, пациентам было рекомендовано вносить в мобильное приложение данные о времени и количестве принятых углеводов (в хлебных единицах и граммах), времени и дозе введенного инсулина, времени и характере других событий (физические нагрузки, гипогликемия и др.). При использовании непрерывного мониторинга глюкозы (НМГ) пациент также мог самостоятельно вносить данные по уровню гликемии в мобильное приложение.
Дистанционное консультирование
Дистанционное консультирование проводилось лечащими врачами, наблюдавшими пациента в амбулаторных условиях, на основании данных электронных структурированных отчетов, формируемых в приложении OneTouch Reveal. Принимая во внимание полученные данные, лечащий врач дистанционно консультировал пациента и при необходимости корректировал проводимую терапию/давал рекомендации по самоконтролю.
Оценка качества жизни и дистанционного консультирования с применением мобильного приложения OT Reveal
Оценка качества жизни детей и родителей проводилась с использованием специализированных опросников. Опросник состоит из 28 элементов (ситуаций), составляющих 5 модулей: Диабет, Лечение-I, Лечение-II, Беспокойство, Общение. В опроснике пациентам предлагается оценить, насколько затруднительными для них были различные ситуации в течение последнего месяца. Каждый элемент может быть оценен по 5-балльной шкале от 0 (никогда) до 4 (почти всегда). Для подсчета полученных результатов баллы по каждому элементу трансформируются в обратном порядке по шкале от 0 до 100 следующим образом: 0=100, 1=75, 2=50, 3=25, 4=0. Затем рассчитывается средний балл по всем элементам в целом и по каждому разделу отдельно. Чем выше балл, тем лучше качество жизни пациента.
Оценка программы дистанционного консультирования с мобильным приложением проводилась с использованием специально разработанных опросников, в которых пациентам и врачам было предложено охарактеризовать удобство, сложности и преимущества использованного в исследовании информационного подхода. Опросник для врачей включал в себя 8 вопросов, 5 из которых необходимо было оценить по 5-балльной шкале от 1 (совсем не согласен) до 5 (полностью согласен) и на 3 ответить «да» или «нет». Опросник для подростков включал в себя 10 вопросов, 7 из которых необходимо было оценить по 5-балльной шкале от 1 (совсем не согласен) до 5 (полностью согласен) и на 3 ответить «да» или «нет».
Основной исход исследования
Изменение HbA1c к концу исследования по сравнению с исходным уровнем и доля пациентов, достигших HbA1c менее 7,0 и 7,5% к концу исследования.
Дополнительные исходы исследования
Изменение к концу исследования по сравнению с исходным уровнем: 1) показателей гликемического контроля: средний уровень гликемии, вариабельность гликемии (SD и CV), процент измерений в диапазоне от 3,9 до 10,0, менее 3,9 и более 10,0 ммоль/л; 2) показателей качества жизни; 3) острых осложнений СД1: частота эпизодов диабетического кетоацидоза (ДКА), тяжелой гипогликемии и гипергликемии с кетозом.
Этическая экспертиза
Исследование одобрено локальным комитетом по этике ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол номер №11 от 14.10.2015). До включения в исследование законные представители пациентов подписали информированное согласие на участие в нем.
Статистический анализ
Размер выборки предварительно не рассчитывался. Обработка и анализ статистических данных проводились в программах Statistica 8.0 (StatSoft, США), MS Excel 2010 (Microsoft, США). Количественные данные представлены в виде среднего значения и его стандартного отклонения M (SD) в случае нормального распределения признака или в виде медианы и интерквартильного размаха Me (25–75 перцентиль) – в случае распределения признака, отличного от нормального; качественные данные представлены в виде абсолютных значений (n) и/или частот (%), данные о ДКА, кетозах и тяжелой гипогликемии представлены также в виде частоты эпизодов в пересчете на 1 пациента в год. Различие между количественными признаками в зависимых выборках оценивалось с помощью Т-критерия Вилкоксона, в независимых выборках — с помощью критерия Манна–Уитни. В случае множественных сравнений использовалась поправка Бонферрони. Различие между качественными признаками оценивалось с помощью точного критерия Фишера. Значение р менее 0,05 считалось статистически значимым.
РЕЗУЛЬТАТЫ
Всего в исследование были включены 56 подростков, однако в процессе наблюдения 7 из них прервали свое участие в проекте по собственному желанию (n=2) либо без объяснения причин (n=5). Таким образом, во всех процедурах, предусмотренных протоколом, приняли участие 49 пациентов.
Клиническая характеристика пациентов, принявших участие в проекте, представлены в табл. 1.
Таблица 1. Клиническая характеристика участников исследования
Показатель (n=49) | Значение |
Пол, м/ж | 23/26 |
Возраст, лет | 15,6 (14,7–16,8) |
Длительность СД1, лет | 6,8 (3,5–10,3) |
Медиана длительности участия пациента в проекте составила 182 дня. За это время было проведено 266 дистанционных консультаций, что составило в среднем 5,4 консультации на одного участника, медиана продолжительности консультации составила 18 минут.
Гликемический контроль
Показатели НbА1с статистически значимо снизились уже к 12-й неделе исследования (–0,3%; p=0,005), а к концу исследования изменение НbА1с относительно исходного уровня составило –0,5% (p<0,001) (рис. 1).
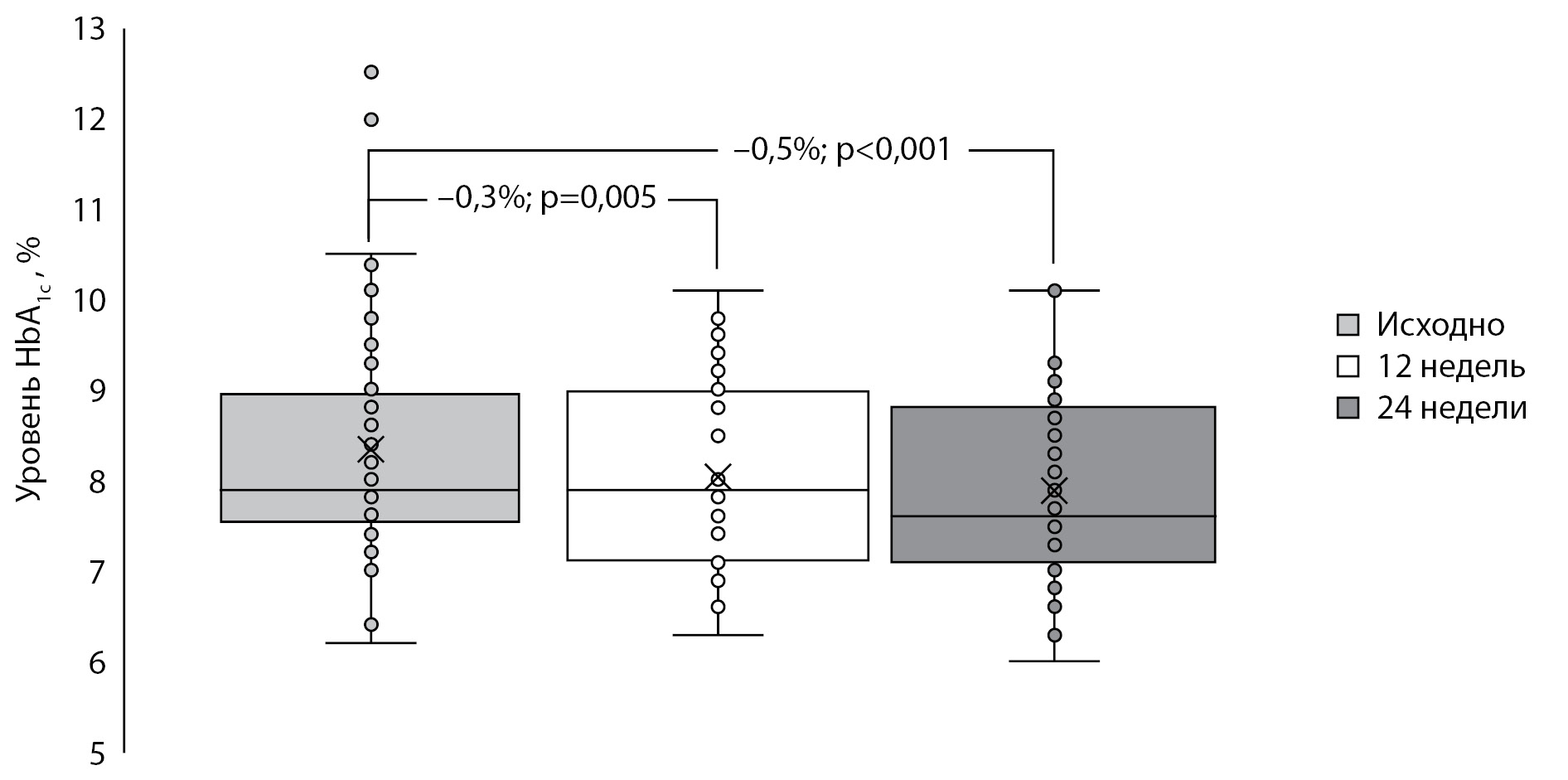
Рисунок 1. Динамика показателей гликированного гемоглобина. Данные представлены в виде медианы (–), среднего значения (х), интерквартильного размаха 25–75 ([]) и отдельных значений.
В отношении других показателей гликемического контроля также наблюдалась положительная динамика (табл. 2). Так, к концу исследования отмечалось статистически значимое увеличение процентов измерений глюкозы в целевом диапазоне 3,9–10,0 ммоль/л (+5,3 п.п.; p=0,016) и снижение вариабельности глюкозы крови, оцениваемое по показателю CV (-3,1 п.п.; p=0,015).
Таблица 2. Показатели гликемического контроля исходно, через 12 и 24 недели наблюдения
Показатель | Исходно | 12 нед | 24 нед | Р* | Р** |
Измерений в диапазоне 3,9–10 ммоль/л, % | 49,7 (38,3–62,5) | 56,3 (44,8–62,3) | 57,2 (44,6–69,6) | н/з | 0,016 |
Измерений >10 ммоль/л, % | 41,8 (28,3–55,6) | 38,4 (29,3–50,5) | 37,2 (26,1-47,7) | н/з | н/з |
Измерений <3,9 ммоль/л, % | 6 (3,1–9,4) | 4,1 (2–9,4) | 6 (1,8–10) | н/з | н/з |
Вариабельность гликемии, SD, ммоль/л | 3,9 (3,3–4,8) | 3,6 (2,9–4,7) | 3,7 (2,9–4,7) | н/з | н/з |
Вариабельность гликемии, CV, % | 43,7 (36,8–46,4) | 40,6 (33,6–45,9) | 39,8 (32,9–45,6) | н/з | 0,015 |
* — уровень р при сравнении показателей исходно и через 12 нед, ** — уровень р при сравнении показателей исходно и через 24 нед.
Значимое снижение среднего уровня НbА1с сопровождалось также увеличением числа и доли пациентов, достигнувших целевого уровня НbА1с <7,0%, с 3 (6%) до 8 (16%) пациентов и <7,5% с 10 (20%) до 18 (37%) пациентов, однако данные различия не были статистически значимыми (рис. 2).
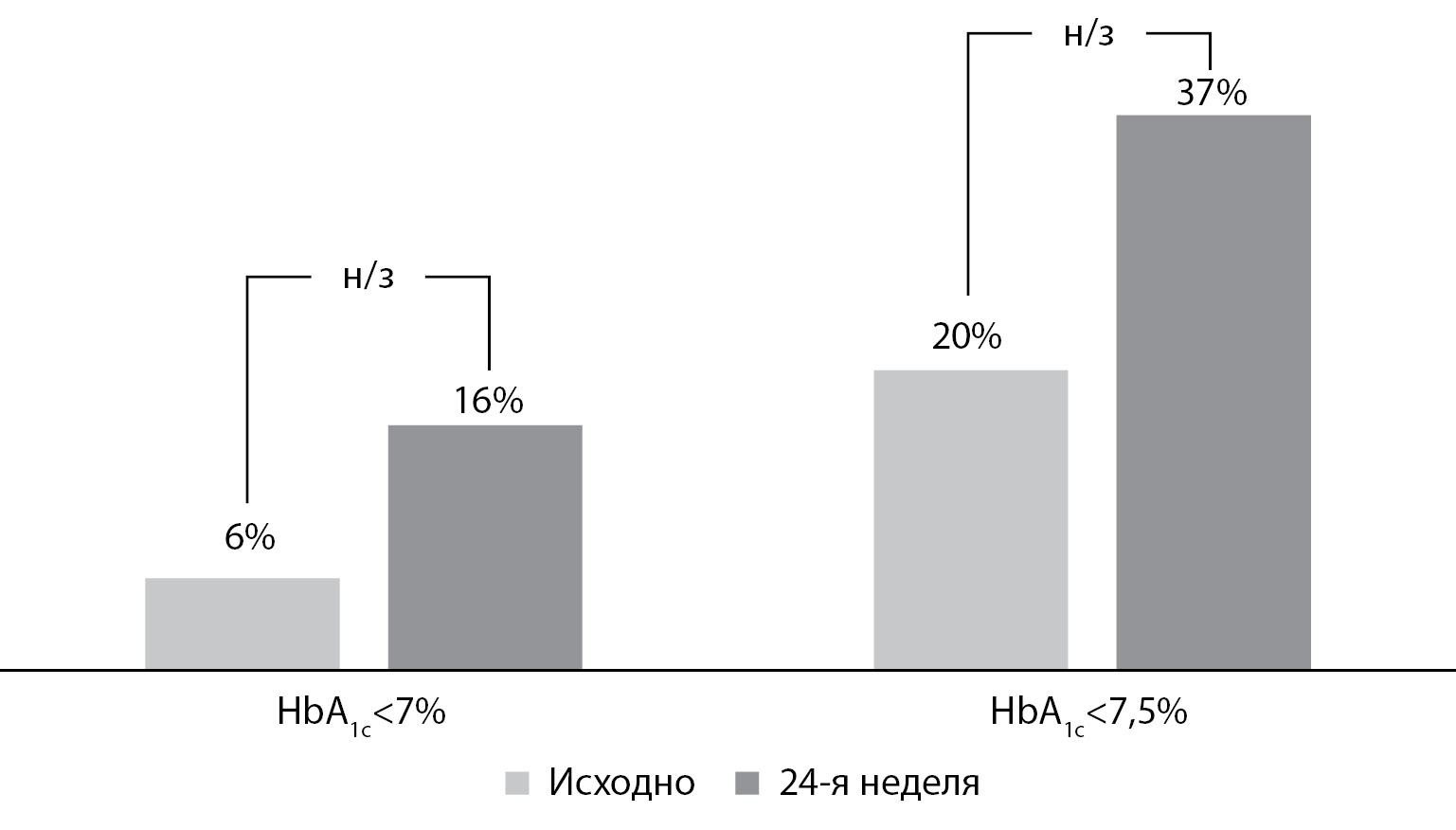
Рисунок 2. Доля пациентов, достигнувших показателя гликированного гемоглобина <7,0 и <7,5%, исходно и по окончании исследования (различия статистически не значимы).
Качество жизни
Результаты исследования качества жизни показали статистически значимое улучшение как совокупной оценки (общего балла) качества жизни пациентами (+2,9 балла; p=0,008), так и отдельных составляющих ее показателей: отношение к диабету (шкала «Диабет» +3,0 балла; p=0,049), отношение к лечению (шкала «Лечение-I» +4,6 балла; p=0,010) и общение с окружающими (шкала «Общение» +4,5 балла; p=0,015) (рис. 3).
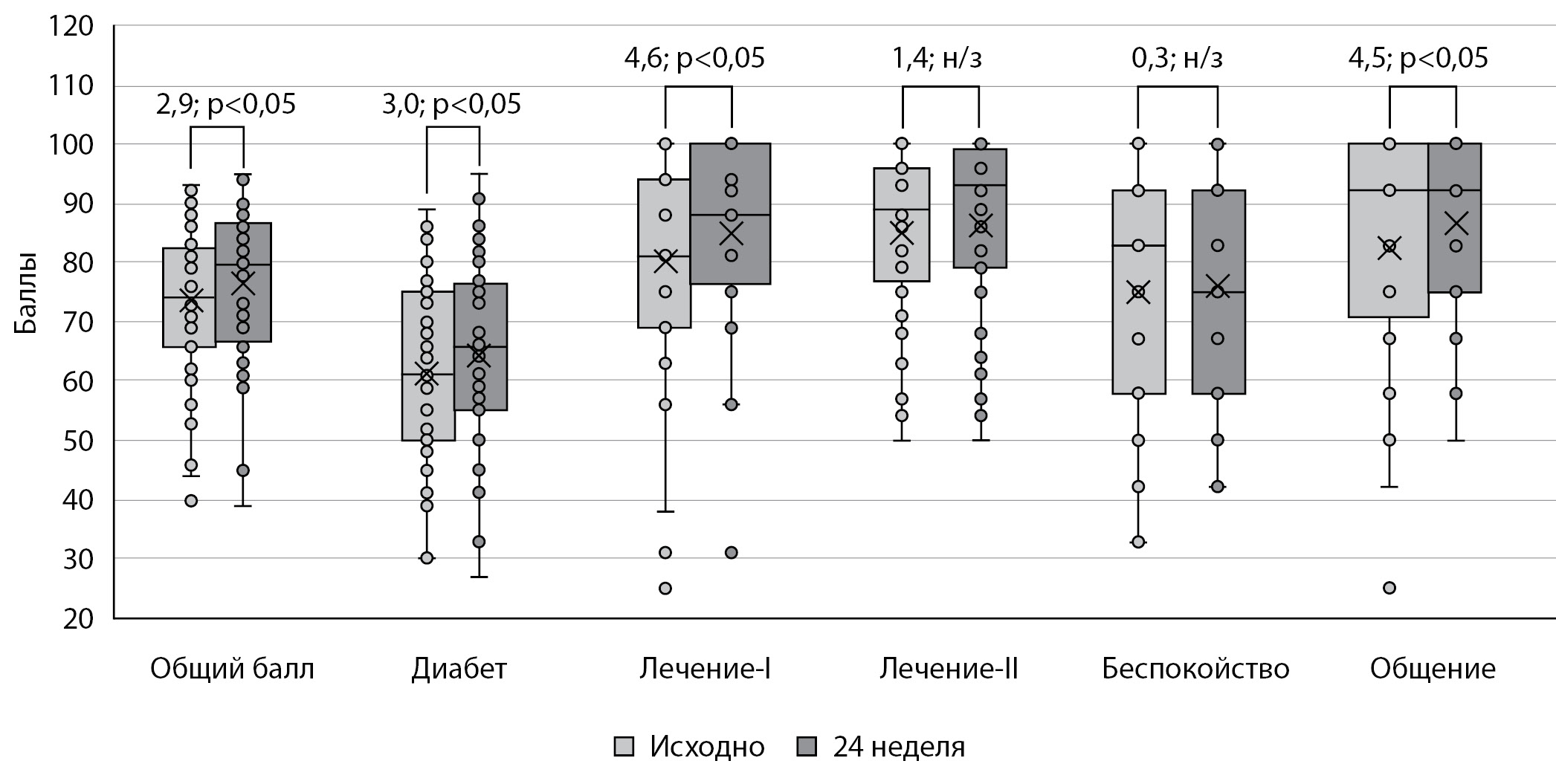
Рисунок 3. Показатели качества жизни PedsQL по окончании исследования по сравнению с исходным уровнем. Данные представлены в виде медианы (–), среднего значения (х), интерквартильного размаха 25–75 ([]) и отдельных значений.
Результаты в зависимости от длительности дистанционных консультаций
Принимая во внимание возможную зависимость эффекта дистанционного консультирования на гликемический контроль от длительности консультаций, а также влияние активного взаимодействия между врачом и пациентом на качество жизни, дополнительно была проведена оценка изменения показателей гликемического контроля и качества жизни у пациентов в зависимости от средней продолжительности дистанционной консультации: более и менее 20 минут (табл. 3).
Таблица 3. Изменение показателей гликемического контроля и качества жизни в зависимости от средней продолжительности дистанционной консультации
Показатель | Изменение к 24-й неделе | Р | |
средняя длительность консультации | |||
>20 мин (n=19) | <20 мин (n=30) | ||
Гликемический контроль | |||
HbA1c, % | -0,8 (-1,9–-0,2) | -0,3 (-0,5–-0,1) | 0,049 |
Измерений в диапазоне 3,9–10 ммоль/л, % | 7,6 (-14,8–24,5) | 3,8 (0,1–10,6) | н/з |
Измерений >10 ммоль/л, % | -8,5 (-24,5–13,1) | -1,7 (-10,1–4,2) | н/з |
Измерений <3,9 ммоль/л, % | -0,1 (-7,6–2,5) | -1,5 (-3,9–2,7) | н/з |
Вариабельность гликемии SD, ммоль/л | -0,2 (-0,6–0,5) | -0,1 (-0,6–0,1) | н/з |
Вариабельность гликемии CV, % | -3,2 (-9,5–-0,8) | -2,2 (-5,2–3,2) | н/з |
Качество жизни | |||
Общий балл | 4,4 (0,9–8,1) | 4,5 (-0,9–8) | н/з |
Диабет | 6,8 (-2,3–11,4) | 4,5 (-4,5–13,6) | н/з |
Лечение-I | 0 (-6,3–6,3) | 6,3 (0–12,5) | н/з |
Лечение-II | 0 (0–7,1) | 0 (-3,6–3,6) | н/з |
Беспокойство | 0 (-8,3–8,3) | 0 (-8,3–0) | н/з |
Общение | 0 (-8,3–0) | 0 (0–16,7) | н/з |
Было установлено, что в группе пациентов со средней длительностью дистанционных консультаций >20 минут отмечалось статистически значимо более выраженное снижение уровня НbА1с к концу исследования, которое составило -1,0% по сравнению с 0,2% в группе пациентов с длительностью консультаций <20 минут. При этом между данными группами пациентов не наблюдалось статистически значимых различий в показателях качества жизни.
Оценка удобства дистанционного консультирования и мобильного приложения OT Reveal пациентами и врачами
Результаты проведенного опроса подростков с СД1 и врачей представлены на рис. 4 и 5. Большинство врачей и пациентов положительно (не менее чем на 4 балла) оценили преимущества и удобство дистанционного консультирования с использованием мобильного приложения OT Reveal, его положительное влияние на уровень знаний по вопросам СД и показатели глюкозы, также подростки высоко оценили приватность и комфорт такого взаимодействия. Порядка 90% врачей и пациентов среди основных преимуществ дистанционного консультирования отметили возможность быстрой связи между врачом и пациентом.
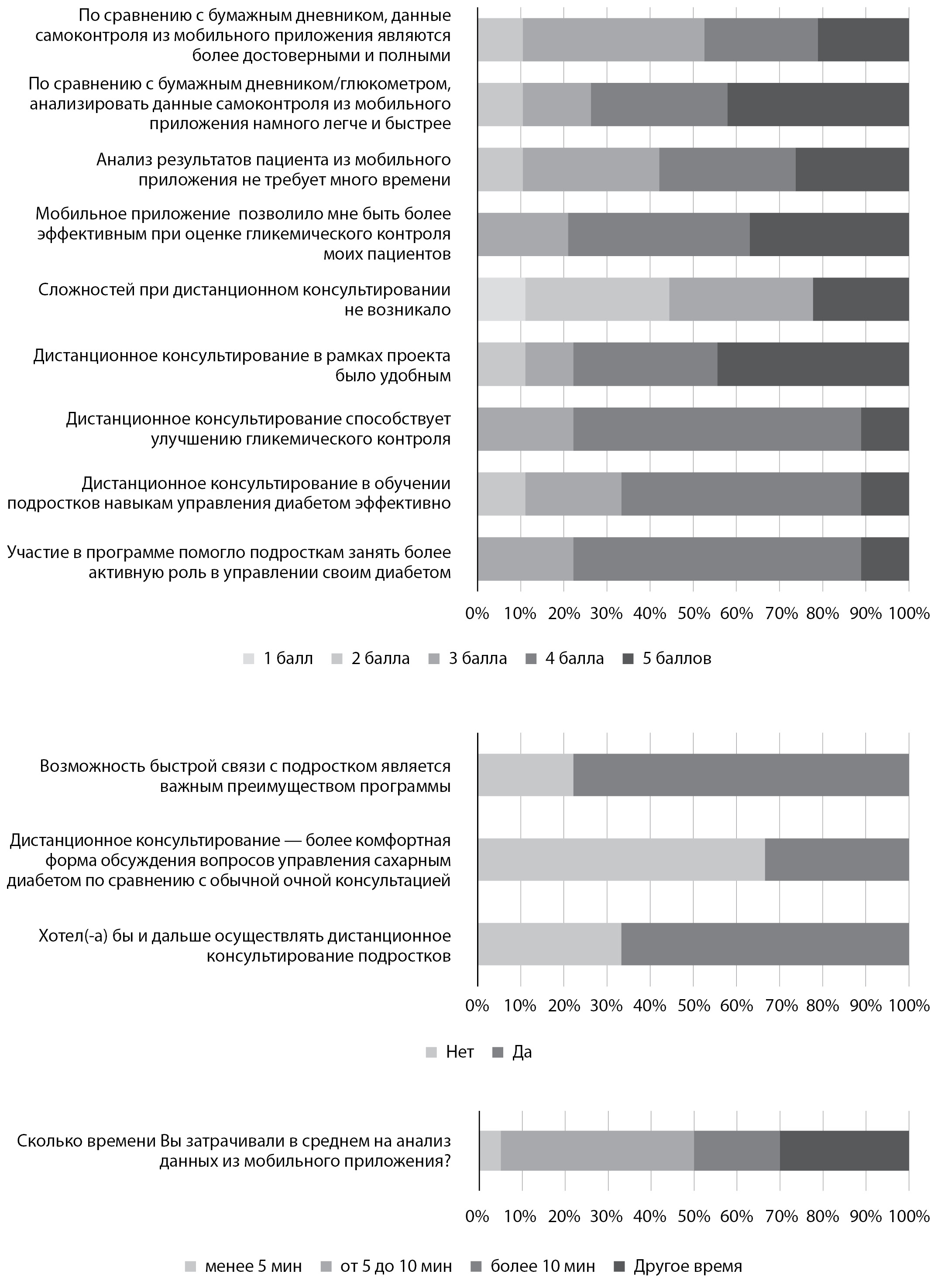
Рисунок 4. Оценка программы дистанционного консультирования и мобильного приложения (врачи).
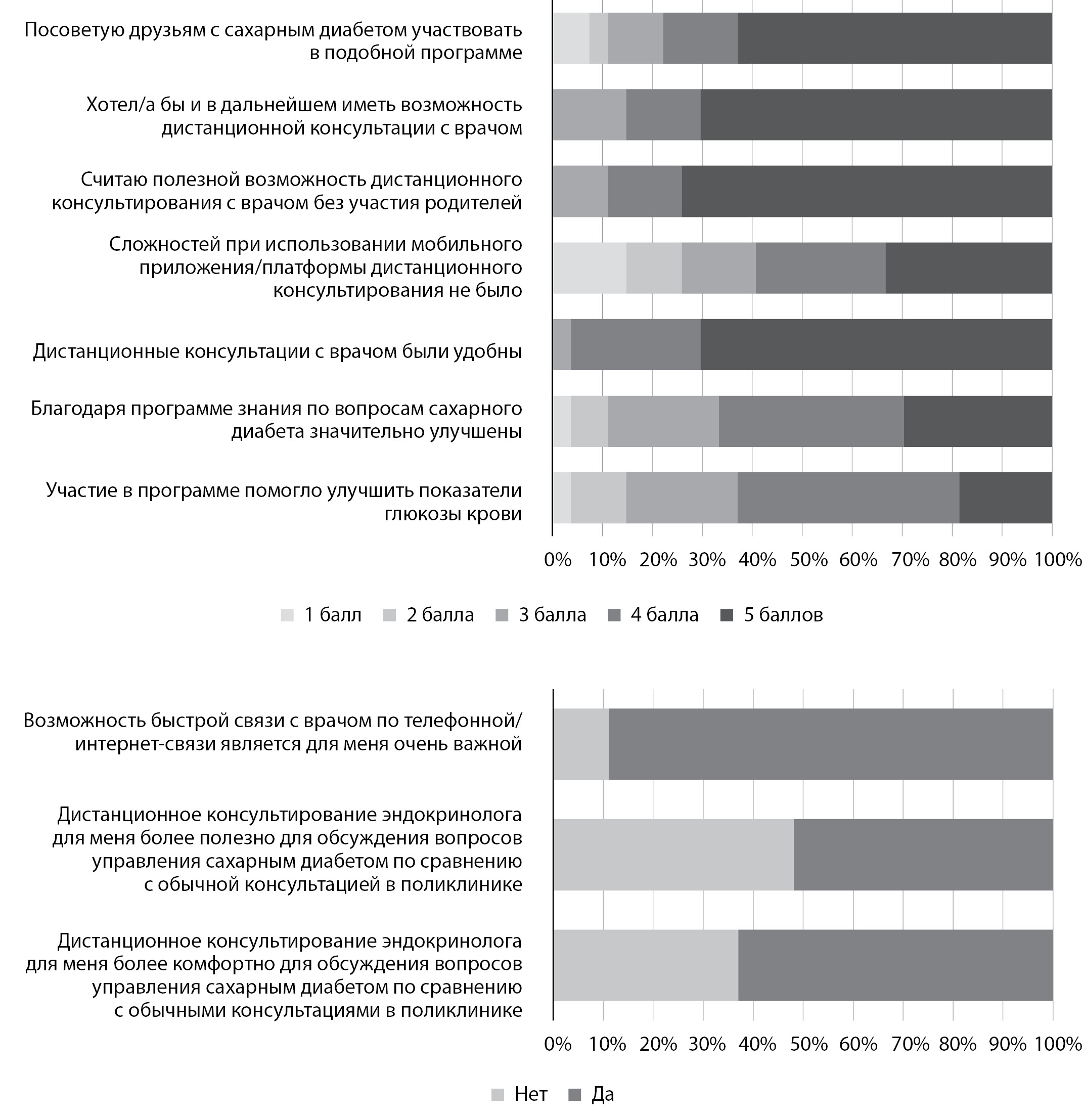
Рисунок 5. Оценка программы дистанционного консультирования и мобильного приложения (подростки).
Острые осложнения СД1
Частота нежелательных явлений (кетоз, диабетический кетоацидоз, тяжелая гипогликемия) значимо не изменилась в процессе исследования по сравнению с исходным уровнем (табл. 4).
Таблица 4. Нежелательные явления. Данные представлены в виде: частота развития — количество и доля пациентов среди всех участников; случаи — число эпизодов среди всех участников и частота событий на одного пациента в год
Показатель | Исходно | Исследование | Р | ||
частота развития, n (%) | случаи | частота развития, n (%) | случаи | ||
Гипергликемии с кетозом | 3 (6,1%) | 3 (0,27) | 5 (10,2%) | 5 (0,21) | н/з |
Диабетический кетоацидоз | 1 (2%) | 1 (0,09) | 0 (0%) | 0 (0,00) | н/з |
Тяжелая гипогликемия | 2 (4,1%) | 6 (0,53) | 9 (18,4%) | 16 (0,67) | н/з |
ОБСУЖДЕНИЕ
Результаты исследования позволяют сделать вывод о достаточной эффективности дистанционного консультирования с использованием мобильного приложения OT Reveal в группе подростков с СД1 в отношении как показателей гликемического контроля, так и качества жизни.
В нашем исследовании использование мобильного приложения OT Reveal позволило достигнуть снижения HbA1c на 0,5%, что является клинически значимым эффектом [8]. Принимая во внимание сложности, связанные с подростковым возрастом, которые приводят к ухудшению гликемического контроля, в том числе в результате ограниченного взаимодействия с лечащим врачом из-за дефицита времени, вопросов приватности и др., использование телемедицины демонстрирует возможности заполнить возникающие пробелы. Данные с носимых устройств для лечения СД1 (инсулиновые помпы, системы НМГ, глюкометры) могут быть считаны с использованием программного обеспечения производителя, что позволяет пациентам и родителям визуализировать данные, просматривать сводные статистические результаты и анализировать тенденции. Это также позволяет врачам просматривать такие данные дистанционно между визитами и делать более частые корректировки дозировки. Регулярная загрузка и просмотр данных о гликемии связаны со значительно более низким HbA1c (7,2% против 8,1%; p=0,03) [9].
Телемедицина может помочь уменьшить различия при лечении диабета, особенно в отдаленных регионах, за счет улучшения доступа к медицинской помощи и снижения затрат на медицинскую помощь. Результаты систематического обзора с метаанализом указывают на то, что применение телемедицины у подростков может быть эффективным со средней разницей в HbA1c, равной -0,32%, по сравнению с традиционной схемой наблюдения [10]. Интересно, что большую результативность продемонстрировали исследования с большей продолжительностью (не менее 6 мес) и те, в которых были пациенты с более высокими исходными значениями HbA1c (≥9%).
Результаты проведенного опроса свидетельствуют о высоком принятии дистанционного консультирования как среди врачей, так и среди подростков. Среди очевидных преимуществ дистанционного консультирования для врачей и пациентов можно выделить удобство и быстроту взаимодействия. Мобильное приложение OT Reveal позволяет вести пациенту электронный дневник и формировать структурированные отчеты, которые позволяют врачу наглядно оценить проводимое лечение и сформировать необходимые рекомендации. Очевидное удобство взаимодействия, доступность и приватность консультаций лечащего врача, а также положительное влияние на показатели глюкозы в совокупности способствуют, вероятно, повышению качества жизни подростков, что немаловажно в данном возрасте в связи со снижением данного показателя в результате воздействия как самого по себе сахарного диабета, так и других психосоциальных факторов [3]. Снижение качества жизни у пациентов с СД1 сопряжено с худшим гликемическим контролем, и наоборот, повышение уровня качества жизни может сопровождаться лучшей компенсацией диабета [3][11]. Кроме того, использование сложных технологических и организационных решений при лечении СД1 у подростков может негативно отразиться на качестве жизни и, следовательно, на принятии таких подходов [12][13], что придает большей значимости результатам этой работы.
Более активное взаимодействие между врачом и пациентом, как показано в нашей работе, может способствовать большей эффективности дистанционного консультирования без ущерба качеству жизни пациента. На данную взаимосвязь указывают и другие работы. Например, показано, что отправка лечащим врачом пациентам большего количества текстовых сообщений с рекомендациями сопровождается более выраженным снижением уровня HbA1c (1,0% против 0,5%; р<0,05) [14]. Эти обстоятельства указывают на важность тесного контакта между врачом и пациентом и необходимость поиска и формирования оптимального алгоритма при дистанционном наблюдении.
Частота нежелательных явлений (тяжелая гипогликемия, ДКА, кетоз) была высокой как исходно, так и за время исследования, однако значимо не изменилась, что указывает на безопасность применяемого подхода при наблюдении подростков с СД1. В целом увеличение частоты острых осложнений СД1 не является ожидаемым явлением при использовании телемедицины [7][10].
ЗАКЛЮЧЕНИЕ
Дистанционное консультирование с использованием мобильного приложения является эффективным в отношении гликемического контроля и качества жизни подходом у подростков с СД1, применение которого обеспечивает удобство и быстроту взаимодействия, а для подростков — еще и необходимый уровень комфорта и приватности.
Существенный процент отказа от участия в исследовании и высокий риск острых осложнений СД1 среди участников в очередной раз указывают на сложность ведения данной категории пациентов и важность оптимального контроля сахарного диабета, что также определяет необходимость формирования соответствующей среды оказания медицинской помощи и поддержки данной категории пациентов [3].
Клинически значимое улучшение показателей гликемии на фоне сохранения и повышения качества жизни при использовании технологий дистанционного консультирования свидетельствует о потенциальной перспективности широкого применения телемедицины у подростков с СД1.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена в рамках национальной благотворительной программы помощи детям с эндокринными заболеваниями «Альфа-Эндо» при финансовой поддержке фонда «КАФ». Компания ООО «ЛайфСкан Раша» предоставила для исследования тест-полоски и глюкометры.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Благодарность. Авторы выражают благодарность участникам и их семьям, исследователям, а также спонсору — фонду «КАФ» за финансовую поддержку в проведении этого исследования.
Информация о вкладе каждого автора. Лаптев Д.Н. — концепция и дизайн исследования, анализ полученных данных, написание текста; Еремина И.А. — сбор и обработка материала, редактирование текста; Карпушкина А.В. — концепция и дизайн исследования; Петряйкина Е.Е. — концепция исследования, сбор материала; Безлепкина О.Б. — концепция и дизайн исследования; Петеркова В.А. — концепция исследования, редактирование текста.
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ И КЛИНИКО-ЛАБОРАТОРНЫЕ ХАРАКТЕРИСТИКИ МОНОГЕННОГО САХАРНОГО ДИАБЕТА, ОБУСЛОВЛЕННОГО МУТАЦИЯМИ ГЕНА INS
ОБОСНОВАНИЕ
В последние годы все большее внимание уделяется моногенному сахарному диабету (МГСД), обусловленному дефектами гена INS.
В 1976 г. К. Gabbay и соавт. описали большую семью, у многих членов которой наблюдались гиперпроинсулинемия в сочетании с эпизодической гипогликемией либо нарушение толерантности к глюкозе или сахарный диабет (СД) легкого течения [1]. Исследователи предположили, что все эти нарушения обусловлены каким-то генетическим дефектом синтеза инсулина. Эта гипотеза подтвердилась в 1990 г., когда F. Barbetti и соавт. обнаружили у двух неродственных пациентов с семейной гиперпроинсулинемией одну и ту же мутацию гена INS, приводящую к замене аргинина на гистидин в положении 65 молекулы проинсулина [2].
В 2007 г. J. Stoy и соавт. [3] и в 2008 г. C. Сolombo и соавт. [4] независимо друг от друга идентифицировали гетерозиготные мутации в кодирующем регионе INS у пациентов с перманентным неонатальным СД (ПНСД).
В 2008 г. Е. Edghill и соавт. [5] выявили гетерозиготные мутации в гене INS у 2/86 (2,3%) пациентов с дебютом СД от 6 до 12 мес жизни, у 1/296 (0,3%) с фенотипом МОDY и 1/463 (0,2%) с СД 2 типа. В то же время связь мутаций гена INS c фенотипом МОDY была показана А. Molven и соавт. [6].
В 2010 г. I. Garin и соавт. [7] описали принципиально новый механизм развития неонатального СД (НСД) — нарушение биосинтеза инсулина у пациентов с гомозиготными мутациями INS. А М. Liu и соавт. [8] для обозначения случаев неиммунного инсулинзависимого СД у молодых лиц, связанного с гетерозиготными мутациями в гене INS, предложили термин — MIDY (Mutant INS-gene-induced Diabetes of Youth).
В 2012 г. впервые была описана сплайсинг-мутация в терминальном интроне гена INS, ассоциированная с ПНСД у пробанда и его отца [9].
Таким образом, в мировой литературе на сегодняшний день описано более 50 мутаций гена INS у пациентов с гиперпроинсулинемией, транзиторным неонанатальным СД (ТНСД), ПНСД, инсулинзависимым СД без признаков аутоиммунного процесса (СД тип 1В), МОDY10 и СД 2 типа [10]. Понимание молекулярно-генетических основ возникновения СД на современном этапе является необходимым компонентом для разработки новых терапевтических подходов для успешной терапии заболевания [11].
Между тем в нашей стране имеются лишь единичные описания пациентов раннего возраста с СД, ассоциированным с гетерозиготными мутациями в кодирующем регионе гена INS [12–14].
Впервые в отечественной литературе мы представляем описание большой группы пациентов с различными клиническими формами СД, обусловленного мутациями как в кодирующем, так и в некодирующем регионах гена INS. Пациенты с мутацией в интроне гена INS описаны впервые.
ЦЕЛЬ
1. Оценить распространенность мутаций гена INS у пациентов с НСД, дебютом СД от 7 до 12 мес жизни включительно, а также среди пациентов детского возраста с фенотипом МОDY.
2. Проанализировать особенности течения СД в данных клинических группах.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Клиническое и лабораторное обследование пациентов и их отбор для включения в исследование проводили во всех учреждениях — участниках работы. Поиск мутаций INS проводили в ФГБУ «НМИЦ эндокринологии» МЗ РФ (Москва).
Исследование продолжалось с 12.2009 по 12.2019 г.
Изучаемые популяции
В исследование были включены 3 группы пациентов:
1-я группа — 60 пациентов с изолированным течением НСД (1а — 12 пациентов с ТНСД, 1б — 48 с ПНСД);
2-я группа — 52 пациента с манифестацией СД от 7 до 12 мес жизни включительно и отсутствием основных аутоиммунных маркеров СД 1 типа (отрицательные антитела к глутаматдекарбоксилазе (GAD), островковым клеткам (ICA), фосфотирозинфосфатазе (IA-2));
3-я группа — 650 пациентов с фенотипом МОDY.
Возраст пациентов на момент проведения исследования варьировал от 1 мес до 18 лет. Медиана возраста пациентов на момент проведения исследования составила 9,8 года [11 мес; 12,3 года].
Критерии постановки диагноза MODY соответствовали рекомендациям ISPAD 2018 г.
1. Наличие СД или гипергликемии натощак у родственников 1-й линии в 2–3 поколениях.
2. Отсутствие признаков аутоиммунного процесса (отрицательный титр антител IAA, ICA, GADA, Zn8) в дебюте заболевания.
3. Сохранная секреция С-пептида и низкая потребность в экзогенном инсулине в течение 5 лет от начала заболевания.
4. Отсутствие выраженного ожирения и/или признаков инсулинорезистентности.
Критерии исключения
1. Наличие аутоиммунных маркеров СД 1 типа.
2. Синдромальные формы СД.
Дизайн исследования
Схема исследования: однократное молекулярно-генетическое обследование пациентов с ПНСД и ТНСД, пациентов с манифестацией СД в возрасте от 7 до 12 мес и пациентов с фенотипом МОDY на предмет выявления мутаций INS. Вид исследования: обсервационное поперечное.
Описание медицинского вмешательства
Взятие крови из периферической вены для молекулярно-генетического исследования.
Основной исход исследования
Обнаружение и молекулярно-генетическая характеристика мутации INS у пациента.
Дополнительные исходы исследования
Особенности клинической картины СД и лабораторных показателей у пациента с мутацией INS. Обнаружение и молекулярно-генетическая характеристика мутаций INS у родственников пациента.
Методы
Молекулярно-генетический анализ проводился в лаборатории отделения наследственных эндокринопатий ФГБУ «НМИЦ эндокринологии» Минздрава России.
Геномную ДНК выделяли из лейкоцитов периферической крови стандартным методом (набор PureLink, Genomic DNA MiniKit, LifeTechnologies, США). Для молекулярно-генетического анализа применялся метод NGS.
Использовалась разработанная в отделении наследственных эндокринопатий ФГБУ «НМИЦ эндокринологии» панель праймеров для мультиплексной ПЦР и секвенирования с применением технологии IonAmpliseq™ Custom DNA Panel (LifeTechnologies, США). Секвенирование осуществлялось на полупроводниковом секвенаторе PGM (IonTorrent, LifeTechnologies, США).
Биоинформатическая обработка результатов секвенирования проводилась с помощью программного модуля TorrentSuite 4.2.1 (IonTorrent, LifeTechnologies, США) и пакета программ Annovar (версия 2014Nov12). В качестве референсных последовательностей кДНК генов-кандидатов использовались ссылки Genbank (http://www.ncbi.nlm.nih.gov/genbank). Интерпретация результатов исследований и оценка патогенности нуклеотидных изменений проводились согласно международным рекомендациям [15]. Все единичные нуклеотидные варианты с частотой минорного аллеля более чем 0,001 были исключены из последующего анализа [16]. Обозначение мутаций проводилось в соответствии с рекомендациями J. den Dunnen и S. Antonarakis [17].
Все выявленные мутации и полиморфизмы были подтверждены методом Сэнгера. Секвенирование по Сэнгеру проводилось на автоматическом секвенаторе ABI GeneticAnalyzer 3130 (Applied Biosystems, США).
Статистический анализ
Статистический анализ проводился в программе RStudio (Version 1.1.463-2009-2018 RStudio, Inc) с использованием пакета R версии 3.4.4). Нормальность распределения количественных признаков оценивалась по тесту Шапиро–Уилка. Описательная статистика представлена медианами c границами межквартильного интервала. Номинальные данные описывались с указанием абсолютных значений и процентных долей.
Этическая экспертиза
Информированное согласие об участии в исследовании и согласие на молекулярно-генетическое исследование было подписано родителями всех пациентов. Протокол исследования был одобрен в локальном этическом комитете (протокол № 22 от 29.10.2009 года; ФГБУ «Эндокринологический научный центр» Минздрава России).
РЕЗУЛЬТАТЫ
В гене INS мы идентифицировали 13 гетерозиготных мутаций (12 миссенс-мутаций, 1 сплайсинг-мутация) у 16 пробандов и 9 родственников. В 10 случаях мутации возникли de novo, в 6 — были унаследованы от одного из родителей с СД.
Все миссенс-мутации (A22P, L30R, L30P, C31W, G32S, E37K, L41P, V42G, R46P, F48C, R89C, С96Y) были расположены в кодирующей части гена INS, сплайсинг-мутация (с.188–31G>A) — в интроне.
Наиболее часто встречалась мутация G32S: выявлена у 3 пробандов и 2 родственников.
Мутации A22P, L30R, C31W, E37K, L41P, V42G ранее не были описаны.
Спектр нуклеотидных изменений, выявленных в гене INS, представлен в табл. 1.
Таблица 1. Сведения о пациентах — носителях мутаций гена INS
№ | Нуклеотидная замена | Аминокислотная замена | Пол | Масса тела при рождении, г | Клинические и лабораторные данные пациента на момент манифестации СД | Отягощенность семейного анамнеза по СД | |||||
Фенотип | Возрастa | Кетоз или ДКА в дебюте СД | Гликемия в дебюте, ммоль/лб | C-пептид в сыворотке, нг/млв | Терапияг | ||||||
1 | с.64G>C | p.A22P | м | 3550 | ПНСД | 3 мес | Кетоз | 18,9 | 0,2 | ИТ (0,9) | Нет |
2 | с.89T>C | p.L30P | м | 3480 | ПНСД | 1,5 мес | Кетоз | 21,8 | 0,15 | ИТ (1,1) | Нет |
3 | c.89T>G | p.L30R | ж | 3000 | СД | 7 мес | ДКА | 20,7 | 0,3 | ИТ (0,9) | Нет |
4 | c.93C>G | p.C31W | м | 3120 | MODY10 | 6,5 года | Нет | 9,0 | 0,9 | Гликлазид | Отец: СД с 6 лет, ИТ + ПССП Бабушка* по линии отца: СД, ПССП |
5 | c.94G>A | p.G32S | м | 2637 | СД | 8 мес | Нет | 15,4 | 0,25 | ИТ (0,5) | Мать: ПНСД с 5 мес, ИТ |
6 | c.94G>A | p.G32S | м | 3100 | ПНСД | 2 мес | Нет | 18,7 | 0,18 | ИТ (1,0) | Нет |
7 | c.94G>A | p.G32S | м | 3050 | ПНСД | 6 мес | Нет | 19,2 | 0,35 | ИТ (0,5) | Отец: СД с 9 мес, ИТ |
8 | c.109G>A | p.E37K | ж | 3700 | MODY10 | 4 года | Нет | 13,0 | 0,7 | ИТ (0,6) | Мать: СД с 11 лет; тетя: СД с 12 лет; дед* по линии матери: СД с 18 лет |
9 | c.122T>C | p.L41P | м | 3060 | СД | 8 мес | ДКА | 16,3 | 0,2 | ИТ (0,8) | Нет |
10 | c.125T>G | p.V42G | ж | 2450 | ПНСД | 5 мес | Нет | 20,1 | 0,1 | ИТ (0,9) | Нет |
11 | c.137G>C | p.R46P | м | 2080 | ПНСД | 4,5 мес | Нет | 24,3 | 0,15 | ИТ (0,8) | Мать: СД с 9 мес, ИТ |
12 | c.143 T>G | p.F48C | ж | 3190 | ПНСД | 1,5 мес | Нет | 17,2 | 0,25 | ИТ (1,0) | Нет |
13 | с.265C>T | p.R89C | ж | 3230 | СД | 12 мес | Нет | 20,5 | 0,2 | ИТ (0,8) | Мать: СД с 3 лет, ИТ; сестра: СД с 18 мес, ИТ |
14 | с.287G>A | p.C96Y | м | 1790 | ПНСД | 3 мес | ДКА | 17,9 | 0,3 | ИТ (1,0) | Нет |
15 | с.18831G>A | Нетд | ж | 2600 | ПНСД | 2 мес | Кетоз | 18,0 | 0,1 | ИТ (0,9) | Нет |
16 | с.18831G>A | Нетд | ж | 3060 | CД | 7 мес | Нет | 19,2 | 0,15 | ИТ (0,4) | Нет |
б Уровень гликемии на момент первой госпитализации.
в Уровень базального С-пептида в дебюте СД, определенного при первой госпитализации. Референтные значения: 1,1–4,4 нг/мл.
г Терапия, назначенная при первой госпитализации. Для инсулинотерапии указаны суточные дозы инсулина (Ед/кг/сут).
д Мутация в интроне.
ДКА — диабетический кетоацидоз; ИТ — инсулинотерапия; ПССП — пероральные сахароснижающие препараты.
* — молекулярно-генетическое исследование не проводилось.
Подавляющее большинство мутаций было выявлено среди пациентов с ПНСД (9/48, 18,75%) и с дебютом СД от 7 до 12 мес жизни (5/52; 9,6%). В группе с фенотипом МОDY мутации в гене INS были выявлены у 2 пациентов (2/650, 0,3%). У пациентов с ТНСД мутации в гене INS выявлены не были.
Анализ клинических данных у пациентов 1б и 2 групп не показал существенных различий в течении заболевания. В подавляющем большинстве случаев отмечались нормальные весовые показатели при рождении, отражающие достаточную внутриутробную секрецию инсулина; высокий уровень гликемии наряду с неопределяемым уровнем С-пептида при манифестации СД; значительная потребность в инсулинотерапии (табл. 1).
Диабетический кетоацидоз (ДКА) в дебюте заболевания был зарегистрирован у одного пациента с ПНСД и у 2/5 пациентов с манифестацией заболевания от 7 до 12 мес жизни.
Описание клинических случаев
Мутация с.188–31G>A в интроне гена INS была найдена у 2 пациентов с манифестацией СД в 2 и 7 мес жизни.
В первом случае (пациент №15, табл. 1) отмечалось типичное течение ПНСД с кетозом, гипергликемией до 18 ммоль/л в дебюте заболевания и высокой потребностью в инсулинотерапии (0,9 Ед/кг/cут).
У второго пробанда (№16) на фоне полного здоровья при плановом обследовании в возрасте 7 мес была выявлена глюкозурия.
При обследовании в условиях эндокринологического отделения уровень гликемии натощак составил 6,8 ммоль/л, средний уровень гликемии в течение дня — 8,0 ммоль/л, отмечались эпизодические подъемы до 12,0–14,5 ммоль/л после еды, HbA1c — 7,2% (норма до 6%); С-пептид — 566,1 пмоль/л (343–742), инсулин — 12,15 мкМЕ/мл (2,0–25,0); антитела к β-клеткам, GAD, IA-2 — отрицательные.
Учитывая сохранную секрецию инсулина, отказ родителей от инсулинотерапии, была рекомендована диета с ограничением углеводов с высоким гликемическим индексом. На этом фоне через 4 мес: HbA1c 8,7%, С-пептид 2,2 нг/мл (1,1–4,4), инсулин 8,5 мкМЕ/мл (2,3–26,4). В связи со стойкой декомпенсацией углеводного обмена инициирована инсулинотерапия по базис-болюсной схеме.
В группе с фенотипом МОDY мутации в гене INS были выявлены у 2 пациентов (2/650, 0,3%). В обоих случаях заболевание носило семейный характер. Приводим описание одной семьи.
Мутация E37K выявлена у пробанда (дебют СД в 4 года), матери пробанда (СД с 11 лет), родной тети по линии матери (СД с 12 лет), двоюродной сестры по материнской линии (СД с 8 лет). У дедушки пробанда по линии материи СД был диагностирован в 18 лет, генетическое исследование не проводилось.
У пробанда СД манифестировал в 4 года с классических симптомов (слабость, утомляемость, жажда), выявлено повышение гликемии до 9,3 ммоль/л. По месту жительства установлен диагноз СД 1 типа, назначена инсулинотерапия по базис-болюсной схеме (лизпро, гларгин).
До 9 лет течение заболевания стабильное на фоне инсулинотерапии 0,6 Ед/кг/cут, HbA1c 7,5–7,8%.
В возрасте 9 лет обследована в связи с жалобами на головные боли, утомляемость, снижение остроты зрения. По данным МРТ головного мозга выявлено объемное образование хиазмально-селлярной области (краниофарингиома), в послеоперационном периоде диагностирован пангипопитуитаризм (СТГ-дефицит, вторичный гипотиреоз, вторичный гипокортицизм, несахарный диабет).
В послеоперационном периоде течение СД лабильное, HbA1c около 9–10%, достижение компенсации углеводного обмена затруднено в связи с неконтролируемым чувством голода, прогрессирующей прибавкой массы тела, приемом глюкокортикоидов.
В возрасте 13 лет при плановом обследовании в ФБГУ «НМИЦ эндокринологии», учитывая отягощенный семейный анамнез по СД, проведено молекулярно-генетическое обследование. В гене INS выявлена гетерозиготная мутация E37K.
Клинические характеристики пациентов представлены в табл. 1.
ОБСУЖДЕНИЕ
Нуклеотидная последовательность гена INS впервые была расшифрована G. Bell и соавт. [18] в 1980 г.
Ген INS картирован на коротком плече хромосомы 11p15.5, состоит из 3 экзонов (экзон 1 — некодирующий) и двух интронов. Второй экзон кодирует сигнальный пептид, В-цепь и часть С-пептида; третий экзон кодирует остаток С-пептида и А-цепь.
Все мутации в гене INS можно разделить на две большие группы: наследуемые по аутосомно-доминантному (АД) и аутосомно-рецессивному типам (АР).
АР-мутации локализованы преимущественно в зоне промотора INS.
Данный тип мутаций вызывает нарушение биосинтеза инсулина на уровне как транскрипции, так и трансляции с помощью различных механизмов, включающих делецию гена, потерю инициирующего сигнала трансляции и нарушение стабильности мРНК [7][19].
Часть мутаций приводит к делеции зоны промотора INS, которая регулируется MAFA и NEUROD1, или к разрушению ДНК-связывающих сайтов для других регуляторных белков, обеспечивающих клеточную специфичность и скорость транскрипции инсулина [7][10].
На сегодняшний день гомозиготные мутации в гене INS описаны преимущественно при ТНСД и также являются наиболее частой причиной ПНСД без экстрапанкреатических проявлений у пациентов, рожденных от близкородственных браков, однако редко встречаются у пациентов с НСД из неродственных семей [7][10][14].
Все мутации, выявленные у наших пациентов, относятся к гетерозиготным миссенс- и сплайсинг-мутациям и расположены как в нетранслируемых областях гена INS (сплайсинг-мутация), так и в кодирующей последовательности (12 миссенс-мутаций), включая область сигнального пептида, A- и В-цепи инсулина и сайт протеолитического расщепления между А-цепью и С-пептидом.
Подавляющее большинство найденных мутаций локализовано во 2-м (L30P, L30R, C31W, G32S, E37K, L41P, V42G, R46P, F48C) и 3-м (С96Y, R89C) экзонах INS, кодирующих критические регионы В-цепи в области формирования эволюционно консервативных дисульфидных связей В7–А7 и В19–А20. Известно, что мутации такого типа приводят к некорректному замыканию дисульфидных связей и нарушению фолдинга молекулы проинсулина [3][4]. Избыточная экспрессия мутантного проинсулина провоцирует развитие стресса эндоплазматического ретикулума (ЭР) и преждевременный апоптоз β-клеток [3][20–22].
В настоящее время появляется все больше данных, что в дополнение к цитотоксическому эффекту накопление мутантного проинсулина блокирует выход проинсулина дикого типа из ЭР панкреатических β-клеток, тем самым уменьшая его продукцию с неповрежденной аллели, что также приводит к дефициту инсулина [8].
Мутации L30R, L41P, C31W, E37K, V42G, А22P ранее не были описаны. В пользу патогенности мутаций L30R, L41P, C31W, E37K, V42G свидетельствует локализация мутаций в критических регионах В-цепи (в частности, описаны миссенс-мутации L30P/V/M/Q, затрагивающие тот же кодон, что и мутация L30R, и мутация C31Y в том же кодоне, что и C31W, ассоциированные с СД) [23], а также (для мутаций С31W и E37K) выявление идентичных мутаций в нескольких поколениях родственников, страдающих СД.
Мутация А22P локализована в сигнальном пептиде и, вероятнее всего, приводит к нарушению отщепления сигнального пептида от препроинсулина с последующим нарушением фолдинга проинсулина и развитием стресса ЭР [24][25].
Клинически для пациентов с гетерозиготными мутациями в кодирующем регионе гена INS было характерно изолированное нарушение углеводного обмена (в подавляющем большинстве случаев — инсулинзависимый СД) с дебютом заболевания как в течение первого полугодия жизни, так и в более старшем возрасте.
Подавляющее большинство мутаций было выявлено у пациентов с ПНСД, что согласуется с данными литературы. Наименьшее количество случаев — в группе пациентов с фенотипом MODY, что еще раз подчеркивает, что MODY10 является редкой формой моногенного СД.
Интересно, что идентичные мутации были найдены среди пациентов из разных возрастных групп.
Существует мнение, что разный возраст начала СД у пациентов с идентичной мутацией может быть связан с индивидуальной скоростью β-клеточного апоптоза, способностью клеток к регенерации и влиянием факторов окружающей среды [26].
Наибольший интерес, на наш взгляд, представляет группа пациентов с манифестацией СД от 7 до 12 мес жизни. Процент выявленных мутаций в гене INS в данной группе достаточно высокий (9,6%), при этом пациенты не подходят ни под возрастные критерии НСД, ни под клинические критерии MODY: в 4 из 5 случаев картина заболевания соответствовала СД 1 типа: острое начало (в 2 случаях — тяжелый диабетический кетоацидоз), выраженное снижение С-пептида, значительная потребность в заместительной инсулинотерапии (0,8–1,0 Ед/кг). Причинами для проведения генетического исследования у этих пациентов послужили относительно ранее начало СД (до 12 мес жизни), наличие СД у одного из родителей (в 2 случаях) и отсутствие основных аутоиммунных маркеров СД 1 типа.
Патогенные мутации в некодирующем регионе гена INS впервые были описаны в зарубежной литературе в 2012 г. [8]. В нашей стране нами впервые была идентифицирована гетерозиготная сплайсинг-мутация: с.188–31G>A (n=2) в интроне гена INS.
Мутация с.188–31G>A была впервые описана I. Garin и соавт. [9] в 2012 г. у двух пациентов с НСД (пробанд и его отец). Данная мутация локализована в терминальном интроне гена и вызывает нарушение сплайсинга путем инсерции 29 нуклеотидов из интронной последовательности в мРНК. Среди наших пациентов мутация с.188–31G>A была найдена у 2 пациентов с манифестацией СД в 2 и 7 мес жизни. Интересно, что в первом случае отмечалось типичное течение ПНСД с кетозом, гипергликемией до 18 ммоль/л в дебюте заболевания и высокой потребностью в заместительной инсулинотерапии (0,9 Ед/кг/сут) с момента манифестации заболевания. Во втором случае заболевание было выявлено в возрасте 7 мес в доклинической стадии при плановом обследовании ребенка (глюкозурия). Инсулинотерапия была назначена только спустя 4 мес от момента установки диагноза и составила 0,3 Ед/кг/cут.
ЗАКЛЮЧЕНИЕ
В статье проанализирован вклад мутаций гена INS в структуру НСД, MODY и СД с дебютом от 7 до 12 мес жизни на большой группе пациентов. Проведен анализ клинической картины заболевания. Впервые в России представлена клиническая характеристика случаев СД, обусловленного мутацией в интроне гена INS.
Полученные данные еще раз подчеркивают необходимость анализа гена INS не только у пациентов с ПНСД и фенотипом MODY, но и среди пациентов с манифестацией СД от 7 до 12 мес жизни и отсутствием аутоиммунных маркеров СД 1 типа. Причем отсутствие изменений в кодирующем регионе гена INS является поводом для активного поиска мутаций в интроне.
Еще несколько лет назад результаты генетического исследования у пациентов с мутациями в гене INS могли быть использованы преимущественно для прогнозирования дальнейшего течения заболевания и проведения медико-генетического консультирования в вопросах планирования семьи. Понимание молекулярно-генетических основ возникновения СД на современном этапе является необходимым компонентом для разработки новых терапевтических подходов для успешной терапии заболевания.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование было проведено при содействии Фонда поддержки и развития филантропии «КАФ», гранта РНФ №17-75-30035, бюджетных средств лечебно-профилактических учреждений — участников исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с настоящей публикацией.
Благодарность. Авторы выражают благодарность Фонду поддержки и развития филантропии «КАФ» за помощь в проведении генетического исследования. Выражаем благодарность пациентам и их семьям за участие в исследовании, а также всем региональным эндокринологам России за помощь в проведении обследования пациентов.
Участие авторов: Тихонович Ю.В., Тюльпаков А.Н. — концепция и дизайн исследования; Тихонович Ю.В., Тюльпаков А.Н., Соркина Е.Л., Тимофеев А.В. — написание текста; Тихонович Ю.В., Зубкова Н.А., Гаряева И.В., Рыбкина И.Г., Петряйкина Е.Е., Соркина Е.Л., Тимофеев А.В., Киселев С.Л., Панова А.В., Андрианова Е.А., Светлова Г.Н., Зильберман Л.И., Калинин А.Л., Кулиева Б.П., Малиевский О.А., Колодкина А.А., Шрёдер Е.В. — сбор материала, анализ полученных данных; Тюльпаков А.Н., Васильев Е.В., Петров В.М., Краснова Т.С. — проведение молекулярно-генетического исследования. Рецензия и одобрение рукописи к печати: А.Н. Тюльпаков, А.В. Тимофеев, Е.Е. Петряйкина, С.Л. Киселев, П.М. Рубцов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
КАЧЕСТВО ЭЯКУЛЯТА У МУЖЧИН С САХАРНЫМ ДИАБЕТОМ 2 ТИПА, ВАКЦИНИРОВАННЫХ ПРЕПАРАТОМ ГАМКОВИДВАК (СПУТНИК V)
В конце 2019 г. в мире возникла новая коронавирусная инфекция, которая была впервые выявлена в Китае, а ее возбудителю дано название SARS-CoV-2 [1]. С декабря 2019 г. по март 2020 г. вирус распространился на территории страны, в которой подтвержденные случаи заболевания были зарегистрированы во всех административных образованиях [2]. С конца января 2020 г. случаи заболевания регистрировались уже по всему миру [3]. 11 марта 2020 г. ВОЗ объявила о начале пандемии [4]. Заболевание COVID-19 при сахарном диабете 2 типа (СД2) часто имеет тяжелое течение, в связи с чем рационально применять вакцинацию [1]. В связи с тяжелой эпидемиологической обстановкой по COVID-19 по экстренным показаниям зарегистрирована новая вакцина ГамКовидВак (Спутник V) [5]. Однако у многих пациентов возникают опасения в отношении ее безопасности и влияния на фертильность. В связи с этим вызывает интерес оценка этого влияния, что и является обоснованием актуальности нашего исследования.
ЦЕЛЬ
Оценка качества эякулята на фоне применения вакцины ГамКовидВак (Спутник V) при СД2.
МЕТОДЫ
Дизайн исследования
Пилотное наблюдательное проспективное исследование.
Критерии соответствия
Критерием включения в исследование являлись: мужской пол, СД2, возраст пациента 40–50 лет. Критерии исключения: объем любого из яичек менее 15 мл, нарушения кариотипа, задержка полового развития, наличие в анамнезе крипторхизма, варикоцеле, воспалительных заболеваний, опухолей, травм или хирургических вмешательств на половых органах и области головного мозга, включая гипофиз, криптозооспермия, азооспермия, бактериоспермия, лейкоспермия, урогенитальные инфекции, носительство антиспермальных антител, гипогонадизм, невыполнение программы исследования, противопоказания к вакцинации в соответствии с официальной инструкцией [5].
Условия проведения
Медицинские данные получены в БУЗ ВО «Воронежский областной клинический центр специализированных видов медицинской помощи».
Продолжительность исследования
Период сбора материала с февраля 2021 по июнь 2021 г. Данные были получены двукратно.
Описание медицинского вмешательства
Осуществлялся забор крови в пробирки типа «вакутейнер» в утреннее время натощак из локтевой вены, а также эякулята в стерильные контейнеры путем мастурбации (половое воздержание 3–5 сут) перед вакцинацией и через 90 дней. Все пациенты получили обе дозы вакцины ГамКовидВак в соответствии с официальной инструкцией к препарату [5].
Основной исход исследования
Основным исходом исследования является получение данных о динамике показателей качества эякулята на фоне вакцинации препаратом ГамКовидВак у пациентов с СД2.
Дополнительные исходы исследования
Получение данных о динамике показателей гликированного гемоглобина (HbA1c) и уровня общего тестостерона на фоне вакцинации препаратом ГамКовидВак у пациентов с СД2.
Методы регистрации исходов
Анамнестические данные были получены путем опроса, а также анализа карты государственного регистра сахарного диабета. Уровни общего тестостерона определялись на анализаторе Architect i2000 (Abbot, США) методом хемилюминесцентного иммуноанализа на микрочастицах, а HbA1c — на анализаторе CAPILLARYS-2 (Sebia, США) методом капиллярного электрофореза. Оценка спермограмм осуществлялась в соответствии с рекомендациями ВОЗ, 2010 г., путем световой микроскопии с помощью микроскопа Olimpus 41 CX (Япония) и камеры Маклера того же производителя [6].
Этическая экспертиза
Этический комитет ФГБОУ ВО «Воронежский государственный медицинский университет имени Н.Н. Бурденко» Минздрава России постановил одобрить проведение исследования «Репродуктивная реабилитация мужчин с сахарным диабетом 2 типа» (протокол №7 от 22.10.2020). Представляемая работа является фрагментом исследования. Всеми пациентами подписано информированное согласие на участие в исследовании.
Статистический анализ
Принципы расчета размера выборки: исследование пилотное, объем выборки предварительно не рассчитывался.
Методы статистического анализа данных: статистическая обработка полученных данных была проведена с использованием пакета прикладных программ STATISTICA (StatSoft Inc. США, версия 8.0); количественные данные представлены в виде медиан и границ интерквартильного отрезка; сравнение групп осуществлялось непараметрическим методом с использованием теста Вилкоксона. Статистически значимыми считали различия при p<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование были включены 30 мужчин с СД2 медиана возраста 46 [ 42; 48] лет, медиана индекса массы тела — 26,9 [ 25,7; 28,7] кг/м2.
Основные результаты исследования
Несмотря на наблюдаемые у ряда пациентов общесоматические побочные эффекты от введения вакцины, не было отмечено статистически значимых изменений в концентрации сперматозоидов, их жизнеспособности, подвижности и морфологии (табл. 1).
Таблица 1. Динамика исследуемых показателей сперматозоидов
Показатель | До вакцинации (n=30) | Через 90 дней (n=30) | p* |
Кол-во, млн в мл | 26 [ 18; 37] | 28 [ 21; 42] | 0,190 |
Живые, % | 89 [ 82; 91] | 89 [ 81; 95] | 0,336 |
Подвижность А+В, % | 47 [ 22; 62] | 36 [ 22; 59] | 0,713 |
Норм. формы, % | 3 [ 2; 8] | 4 [ 3; 7] | 0,301 |
Уровень общего тестостерона, нмоль/л | 16,6 [ 14,0; 20,9] | 15,8 [ 14,6; 21,0] | 0,393 |
Уровень гликированного гемоглобина, % | 6,4 [ 6,1; 7,4] | 6,5 [ 6,0; 7,2] | 0,862 |
Кроме того, уровни HbA1c и общего тестостерона также статистически значимо не изменились.
Нежелательные явления
У 19 пациентов (63%) отмечалось повышение температуры тела длительностью до 2 сут, у 26 (87%) — боль в месте инъекции (длительностью до 5 сут) после введения препарата ГамКовидВак.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Вакцинация препаратом ГамКовидВак (Спутник V) не оказала влияния на показатели качества эякулята, уровни общего тестостерона и компенсацию углеводного обмена.
Обсуждение основного результата исследования
Имеются лишь единичные исследования, в которых изучалось влияние вакцинации на репродуктивную функцию человека. В качестве возможного механизма нарушения репродуктивной функции под действием вакцинации является развитие аутоиммунного процесса с вовлечением гонад [7]. Было экспериментально установлено, что введение столбнячного анатоксина вместе с адъювантами может иметь риск в отношении нарушений функции репродуктивной системы [7]. Кроме того, проводилось сравнение параметров спермограммы и необходимости проведения программ вспомогательных репродуктивных технологий вследствие развития бесплодия у вакцинированных и невакцинированных мужчин при вакцинации сибиреязвенной вакциной, отрицательного влияния выявлено не было [8]. Однако эти исследования не касались вакцин от коронавирусной инфекции. С.А. Зайцевская и соавт. (2020) в своем обзоре, включившем данные публикаций, представленных в базе данных PubMed по данной теме, отмечают, что в литературе прошлых лет не описано ни одного проспективного исследования, в котором бы изучалось влияние вакцин на репродуктивную функцию человека, данные о возможном негативном влиянии вакцин носят предположительный характер, поэтому необходимо проведение исследований по изучению влияния различных видов вакцин на репродуктивную функцию. В нашем исследовании мы не выявили негативного влияния изучаемой вакцины на показатели качества эякулята, а также на другие параметры – углеводный обмен и уровень тестостерона, что согласуется с данными литературы [9]. В других работах, появившихся только в текущем году, также не выявлено отрицательного воздействия вакцины ГамКовидВак на качество эякулята. Так, в одной из работ в пилотное наблюдательное проспективное исследование были включены 30 мужчин с нормозооспермией и 30 с патозооспермией, вакцинированных препаратом ГамКовидВак. Влияния вакцинации ни на уровни общего тестостерона, ни на параметры спермограммы у пациентов с патозооспермией выявлено не было. В группе пациентов с нормозооспермией среди пациентов с ухудшением подвижности сперматозоидов, которая составляла -5 [-7; -3]% и не имела клинического значения, статистически значимо чаще отмечалось повышение температуры после вакцинации [10]. В другом исследовании, включившем 44 мужчин репродуктивного возраста, не имеющих лабораторно подтвержденного COVID-19 в анамнезе и вакцинированных вакциной ГамКовидВак, сравнительный анализ показателей спермограммы до и после вакцинации против COVID-19 выявил некоторые изменения, но они укладывались в интервал нормативных значений и характеризовались как нормозооспермия. Следует отметить, что все показатели гормонального профиля и параклинических данных находились в пределах референсных значений. Полученные в ходе данного исследования результаты свидетельствовали об отсутствии неблагоприятного влияния вакцины [11]. В еще одной работе оценивалось влияние вакцинации против COVID-19 ГамКовидВак на молекулярно-генетические характеристики эякулята на основании анализа профиля экспрессии генов у 6 мужчин репродуктивного возраста, не имеющих лабораторно подтвержденного COVID-19 в анамнезе. Группу контроля составили 4 мужчин. Сравнительный анализ паттерна экспрессии генов в образцах эякулята, полученных до и после вакцинации от COVID-19, не выявил статистически значимых изменений в функционировании внутриклеточных молекулярных путей. Полученные в ходе данного исследования результаты свидетельствуют об отсутствии неблагоприятного влияния вакцины на молекулярно-генетические характеристики эякулята [12]. В зарубежном исследовании применялась вакцина другого типа, созданная на основе мРНК, и также проводилась оценка ее негативного влияния на показатели сперматогенеза у 45 мужчин репродуктивного возраста. Авторами не было отмечено никаких клинически значимых изменений в показателях качества эякулята после вакцинации [13]. Этого нельзя сказать о мужчинах, перенесших COVID-19. В литературном обзоре 2020 г. авторы приводят множество исследований, демонстрирующих наличие негативного влияния коронавируса на сперматогенез [14]. Наличие рецептора ACE2 обнаружено на клетках Сертоли и сперматогониях, что позволяет вирусу активно проникать в эти клетки и подвергать их деструкции. Ситуация усугубляется тем, что коронавирус также способен поражать и клетки Лейдига, приводя к развитию гипогонадизма. Так, в одном из исследований, включившем 143 пациента, перенесших COVID-19, распространенность гипогонадизма составила 28,7% [15]. В другом исследовании пациенты были разделены на две группы: 1-я группа — 35 мужчин со среднетяжелой и тяжелой формой COVID-19 с наличием коморбидности в возрасте 53,5±14 года и 2-я группа — 49 мужчин со среднетяжелой формой COVID-19 без коморбидности в возрасте 31,9±13 года [16]. Распространенность гипогонадизма в 1-й группе составила 75,6%, а во 2-й — 20,6%. Таким образом, COVID-19 действительно влияет на мужское репродуктивное здоровье, в отличие от вакцинации.
Ограничения исследования
Формирование выборки проводилось из пациентов, наблюдавшихся в региональном медицинском центре, следовательно, результаты в общей популяции могут отличаться. Также ограничением является малый размер выборки.
ЗАКЛЮЧЕНИЕ
Не выявлено отрицательного влияния вакцины на качество эякулята, уровни общего тестостерона и компенсацию углеводного обмена.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование выполнено при поддержке ФГБОУ ВО «Воронежский государственный медицинский университет имени Н.Н. Бурденко» Минздрава России из внебюджетных средств.
Конфликт интересов. Есауленко Д.И. — конфликт интересов отсутствует; Роживанов Р.В. — конфликт интересов отсутствует; Шишкина В.В. — конфликт интересов отсутствует.
Участие авторов. Есауленко Д.И. — сбор и обработка научного материала, написание текста; Роживанов Р.В. — разработка концепции исследования, обработка научного материала, редактирование текста; Шишкина В.В. — разработка концепции исследования, редактирование текста.
ЭТНИЧЕСКИЕ ОСОБЕННОСТИ РЕМОДЕЛИРОВАНИЯ КОСТНОЙ ТКАНИ У ПАЦИЕНТОК С САХАРНЫМ ДИАБЕТОМ 2 ТИПА
ОБОСНОВАНИЕ
Гипергликемия при сахарном диабете (СД) способствует изменениям органов и тканей, в том числе и костной. По данным ряда авторов, у лиц пожилого возраста с СД 2 типа (СД2) наблюдается высокий риск остеопоротических переломов, что позволило выделить СД2 в качестве самостоятельного фактора риска остеопороза независимо от возраста, индекса массы тела (ИМТ) и минеральной плотности костной ткани (МПК) [1]. В клинических исследованиях показаны нарушения минерализации костной ткани у СД [2][3]. При СД2 рост МПК дает количественную оценку костной массы и не отражает прочность костной ткани [4][5]. I. De Liefde и соавт. считают, что использование параметров МПК становится не всегда информативным [6]. В последние годы для оценки микроархитектоники костной ткани шире используется трабекулярный костный индекс (ТКИ), относящийся к перспективным методам диагностики [5]. Продолжаются исследования, связанные с изучением патогенетических факторов, в том числе этнического характера, способных оказывать влияние на механизм формирования обменных процессов при диабете и его осложнениях. В этой связи являются актуальными работы о состоянии костной ткани и костного метаболизма у больных СД2 в разных этнических группах [7–9]. Работы по изучению структурно-метаболических особенностей костной ткани в бурятской популяции пока не проводились.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить показатели метаболизма костной ткани, микроархитектоники и МПК у пациенток с СД2 бурятской популяции.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование выполнено на базе клинико-диагностического центра ИГМАПО — филиала ФГБОУ ДПО РМАНПО Минздрава России, г. Иркутск.
Время исследования. Исследование проведено в период с 2016 по 2019 г.
Изучаемые популяции (одна или несколько)
В исследование были включены пациентки бурятской и русской популяций с диагнозом СД2.
Критериями исключения являлись: СД 1 типа и другие заболевания, приводящие к развитию вторичного остеопороза (ревматоидный артрит, хронические заболевания печени, онкологические заболевания, тиреотоксикоз, хроническая надпочечниковая недостаточность, гиперкортицизм), переломы в анамнезе, терапия глюкокортикоидами и антирезорбтивными препаратами.
Были сформированы две группы пациенток с СД2 в зависимости от функционального состояния яичников. Первую группу составили женщины, больные СД2, репродуктивного периода, которые были разделены на две подгруппы русской и бурятской популяций. Вторую группу сформировали пациентки с СД2 постменопаузального периода, которые также были разделены разделены на две подгруппы русской и бурятской популяций.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
В исследовании применялся произвольный способ формирования выборок.
Дизайн исследования
Проведено одноцентровое наблюдательное одномоментное двухвыборочное сравнительное исследование.
Описание медицинского вмешательства (для интервенционных исследований)
Всех участниц обследовали по единому протоколу: после проведения анализа анамнестической информации, общеклинического обследования с занесением в анкеты, разработанные для исследования, проводился забор венозной крови утром натощак с 8 до 9 ч. МПК и ТКИ определяли с помощью двухэнергетической рентгеновской абсорбциометрии (DXA).
Методы
В исследование были включены пациентки бурятской и русской популяций с верифицированным диагнозом СД2 (ВОЗ, 1999–2013). Национальная принадлежность определялась женщинами, считавшими себя и своих предков (3–4 поколения) бурятами или русскими. Функциональное состояние яичников оценивалось в соответствии с критериями STRAW+10. Критерии исключения определялись на врачебном приеме с учетом анализа медицинской документации.
Уровни С-концевого телопептида коллагена I типа (β-Cross laps) и ионизированного кальция (iCa) плазмы крови, остеокальцина (ОК), N-терминального пропептида проколлагена 1-го типа (P1NP) и 25(ОН) витамина D сыворотки крови определялись иммунохемилюминесцентным и ионоселективным методами (анализаторы Architect i2000, Cobas 601, Konelab PRIME 30, лаборатория «Инвитро»). Оценивали МПК, используя DXA проксимального отдела бедренной кости (Total hip), шейки бедра (Neck) и поясничных позвонков (L1–L4). На основе полученных данных был определен ТКИ поясничного отдела позвоночника (денситометр Prodigy, Lunar, GE Healhcare).
Статистический анализ
Размер выборки предварительно не рассчитывался. Методы статистического анализа данных: статистический анализ осуществлялся с помощью пакета программ Statistica 10 (StatSoft Inc, США). Данные представлены в виде медианы (Ме) и квартилей (25 и 75 процентили, Q25–75). Сравнение независимых групп по количественным признакам осуществлялось непараметрическим методом с использованием U-критерия Манна–Уитни. Анализ корреляции переменных производился по методу Спирмена. Статистически значимыми считали различия при p<0,05.
Этическая экспертиза
Протокол исследования одобрен на заседании Комитета по этике научных исследований ИГМАПО — филиала ФГБОУ ДПО РМАНПО Минздрава России от 28 января 2016 г. (протокол №1). Всеми пациентами подписаны информированные согласия на участие в исследовании.
РЕЗУЛЬТАТЫ
В исследование включены 73 пациентки с СД2, которые в зависимости от функционального состояния яичников разделены на две группы: репродуктивного и постменопаузального периодов. В каждой группе были выделены подгруппы в зависимости от этнического статуса. Первая группа включала 34 женщины, больных СД2, репродуктивного периода, из них 16 пациенток бурятской популяции, медиана возраста 42,5 [ 41,5; 45,5] года, и 18 пациенток русской популяции, медиана возраста 44 [ 42; 47] года. Подгруппы женщин существенно не отличались по длительности СД2 и его осложнениям. Вторая группа сформирована из 39 женщин, больных СД2, постменопаузального периода, из них 17 пациенток бурятской популяции, медиана возраста 59 [ 57; 61] лет, и 22 пациентки русской популяции, медиана возраста 57,5 [ 55; 62] года. Подгруппы женщин также существенно не отличались по длительности СД и его осложнениям.
Установлено, что у пациенток с СД2 репродуктивного периода бурятской популяции (табл. 1) наблюдалось повышение показателей P1NP (р=0,035), ОК (р=0,047) и β-Cross laps (р=0,040) относительно пациенток с СД2 репродуктивного периода русской популяции. Показатели МПК и ТКИ женщин, больных СД2, бурятской популяции репродуктивного периода были на уровне соответствующих показателей пациенток с СД2 русской популяции репродуктивного периода (p>0,05).
У пациенток с СД2 постменопаузального периода бурятской популяции процессы ремоделирования костной ткани характеризовались увеличением уровней P1NP (р=0,016), ОК (р=0,048) и β-Cross laps (р=0,020) относительно женщин с СД2 периода постменопаузы русской популяции (табл. 2). Обращает внимание снижение значений ТКИ у пациенток с СД2 бурятской популяции сравнительно с женщинами, больными СД2, в периоде постменопаузы русской популяции на фоне отсутствия различий в показателях МПК (p=0,029).
Таблица 1. Результаты исследования показателей двухэнергетической рентгеновской абсорбциометрии и маркеров костного метаболизма у женщин репродуктивного периода (результаты представлены в виде Me [Q1; Q3])
Показатель | Бурятская популяция (n=16) | Русская популяция | p-value |
Возраст, лет | 42,5 [ 41,5; 45,5] | 44 [ 42; 47] | 0,321 |
ИМТ, кг/м2 | 32,9 [ 30,5; 35,9] | 32,5 [ 30,9; 34,7] | 0,783 |
HbA1c, % | 7,5 [ 6,8; 7,7] | 7,2 [ 7,0; 7,5] | 0,406 |
МПК Neck, г/см2 | 1,000 [ 0,951; 1,094] | 1,037 [ 0,945; 1,104] | 0,969 |
МПК Total hip, г/см2 | 1,144 [ 1,075; 1,236] | 1,170 [ 1,117; 1,264] | 0,406 |
МПК L1–L4, г/см2 | 1,203 [ 1,077; 1,347] | 1,258 [ 1,176; 1,324] | 0,418 |
ТКИ | 1,338 [ 1,262; 1,379] | 1,324 [ 1,206; 1,411] | 0,797 |
β-Cross laps, нг/мл | 0,228 [ 0,194; 0,367] | 0,160 [ 0,114; 0,244] | 0,040 |
ОК, нг/мл | 12,0 [ 8,0; 15,5] | 9,5 [ 7,0; 11,0] | 0,047 |
P1NP, нг/мл | 30,5 [ 24,5; 38,7] | 24,2 [ 17,3; 31,8] | 0,035 |
25(ОН) витамин D, нг/мл | 18,0 [ 14,0; 24] | 25,0 [ 20,0; 27,0] | 0,084 |
iCa, ммоль/л | 1,11 [ 1,09; 1,14] | 1,12 [ 1,10; 1,15] | 0,499 |
Таблица 2. Результаты исследования показателей двухэнергетической рентгеновской абсорбциометрии и маркеров костного метаболизма у женщин в постменопаузальном периоде (результаты представлены в виде Me [Q1; Q3])
Показатель | Бурятская популяция (n=17) | Русская популяция | p-value |
Возраст, лет | 59 [ 57; 61] | 57,5 [ 55; 62] | 0,712 |
ИМТ, кг/м2 | 30,1 [ 28,5; 31,6] | 30,9 [ 27,4; 34,1] | 0,777 |
HbA1c, % | 7,5 [ 7,0; 7,6] | 7,5 [ 7,1; 7,8] | 0,434 |
МПК Neck, г/см2 | 0,875 [ 0,759; 0,971] | 0,940 [ 0,886; 0,988] | 0,179 |
МПК Total hip, г/см2 | 1,002 [ 0,913; 1,075] | 1,024 [ 0,949; 1,072] | 0,453 |
МПК L1–L4, г/см2 | 1,072 [ 1,015; 1,191] | 1,099 [ 1,025; 1,185] | 0,745 |
FRAX, % | 10,5 [ 7,4; 12,0] | 7,9 [ 7,3; 9,9] | 0,251 |
ТКИ | 1,191 [ 1,156; 1,306] | 1,314 [ 1,234; 1,367] | 0,029 |
β-Cross laps, нг/мл | 0,450 [ 0,284; 0,560] | 0,254 [ 0,158; 0,409] | 0,020 |
ОК, нг/мл | 16,0 [ 14,0; 22,0] | 14,0 [ 12,0; 17,0] | 0,048 |
P1NP, нг/мл | 39,2 [ 32,8; 47,4] | 27,5 [ 22,6; 40,8] | 0,016 |
25(ОН) витамин D, нг/мл | 18,0 [ 15,0; 21,0] | 20,0 [ 17,0; 27,0] | 0,052 |
iCa, ммоль/л | 1,13 [ 1,10; 1,16] | 1,13 [ 1,10; 1,17] | 0,649 |
Проведенный сравнительный анализ состояния костной ткани в зависимости от функциональной активности яичников показал, что для женщин бурятской популяции с СД2 периода постменопаузы характерно повышение маркеров остеосинтеза (ОК (р=0,004) и P1NP (р=0,019)) с увеличением маркера остеорезорбции (β-Cross laps (р=0,004)) на фоне снижения ТКИ (р=0,020) относительно соответствующих данных пациенток с СД2 репродуктивного возраста (табл. 1). У пациенток с СД2 русской популяции состояние постменопаузы сопровождалось только повышением концентрации ОК (р=0,001) и β-Cross laps (р=0,013) на фоне отсутствия различий показателей ТКИ (р=0,745) относительно пациенток с СД2 репродуктивного периода русской популяции.
У пациенток с диабетом бурятской популяции постменопаузальный период характеризовался снижением показателей МПК Neck (р=0,006), МПК Total hip (р=0,003) и МПК L1-L4 (р=0,049) по сравнению с аналогичными показателями репродуктивного периода. У женщин с СД2 русской популяции в постменопаузальном периоде также наблюдалось снижение МПК Neck (р=0,024), МПК Total hip (р=0,002) и МПК L1–L4 (р=0,001) относительно соответствующих показателей пациенток репродуктивного периода.
Корреляционный анализ установил положительные взаимосвязи 25(OH) витамина D c ОК (р=0,71), P1NP (р=0,56) у женщин, больных СД2, репродуктивного периода бурятской популяции. Кроме этого, для женщин-буряток с диабетом репродуктивного периода была характерна корреляционная взаимосвязь ТКИ и МПК L1–L4 (р=0,59), ТКИ от ИМТ (р=0,53) и отрицательная взаимосвязь ТКИ и P1NP (p=-0,56).
Выраженная тенденция к снижению концентрации 25(ОН) витамина D отмечена у пациенток с СД2 в постменопаузальном периоде бурятской популяции относительно женщин с диабетом периода постменопаузы русской популяции (р=0,052). Менее выраженная тенденция к снижению 25(ОН) витамина D наблюдалась у женщин-буряток с диабетом репродуктивного периода относительно аналогичной подгруппы женщин русской популяции (табл. 1 и 2). Сравнительный анализ показал, что особой стабильностью обладает iCa, уровни которого не отличались между группами и подгруппами женщин (p>0,05).
Во время исследования нежелательных явлений не отмечено.
ОБСУЖДЕНИЕ
Репрезентативность выборок
Набор участников исследования проводился на базе клинико-диагностическом центра ИГМАПО — филиала ФГБОУ ДПО РМАНПО Минздрава России (г. Иркутск).
Сопоставление с другими публикациями
Низкие значения МПК у пациенток с СД2 в постменопаузальном периоде по сравнению с репродуктивным возрастом согласуются с данными других исследователей, которые показали увеличение темпов снижения МПК у женщин в возрасте старше 40–45 лет, что обусловлено дефицитом эстрогенов в период постменопаузы. Известно, что распространенность переломов коррелирует с низкими показателями МПК поясничного отдела позвоночника и проксимальных отделов бедренных костей [3][5]. Наши данные также показали снижение МПК поясничного отдела позвоночника, шейки бедра, проксимального отдела бедренной кости у пациенток с СД2 постменопаузального периода относительно женщин репродуктивного периода как русской, так и бурятской популяций. Нами не выявлено разницы в МПК при сравнении подгрупп женщин бурятской и русской популяций как репродуктивного периода, так и постменопаузального.
У женщин с СД2 в постменопаузе бурятской популяции установлены низкие значения ТКИ относительно пациенток с диабетом в постменопаузе русской популяции (табл. 2). Проведенный нами сравнительный анализ показал снижение ТКИ у женщин в постменопаузе относительно репродуктивного периода бурятской популяции. Как известно, снижение ТКИ может свидетельствовать о нарушении микроархитектоники костной ткани с высоким риском низкотравматичных переломов. Вместе с тем ТКИ отражает структуру трабекулярной ткани поясничных позвонков и способен более точно прогнозировать риск низкотравматических переломов при диабете [10]. Согласно исследованиям, к основным факторам нарушений костной ткани при СД2 относят деградацию микроархитектоники со снижением качественных характеристик, а не депрессию МПК [11][12].
Нами показано, что в бурятской популяции у женщин с СД2 в постменопаузе наблюдается одновременное увеличение остеорезорбции (повышение β-Cross laps) и остеосинтеза (повышение P1NP, ОК) относительно женщин репродуктивного периода (табл. 1, 2). В свою очередь, в русской популяции у пациенток с СД2 в постменопаузальном периоде выявлено одновременное повышение ОК и β-Cross laps по сравнению с женщинами репродуктивного периода. По мнению ряда авторов, процессы костного ремоделирования оказывают непосредственное влияние на состояние МПК [13–15]. Наши данные согласуются с результатами авторов, продемонстрировавших в постменопаузальном периоде параллельное повышение маркеров остеорезорбции и остеосинтеза, что ассоциируется с потерей костной массы [16][17].
Проведенное исследование показало, что у женщин с СД2 как репродуктивного, так и постменопаузального периодов бурятской популяции зафиксировано значимое повышение P1NP, ОК и β-Cross laps по сравнению с показателями аналогичных подгрупп пациенток с СД2 русской популяции, что свидетельствует об активации как остеорезорбции, так и остеосинтеза. Подобный метаболизм костной ткани в репродуктивном периоде у женщин с СД2 бурятской популяции способен приводить к негативным изменениям в костях с повышением риска переломов.
У женщин бурятской популяции до и после менопаузы отмечалась тенденция к снижению уровней 25(ОН) витамина D относительно соответствующих групп женщин русской популяции (табл. 1 и 2), что обусловлено более темным тоном кожи, а также, возможно, и эпигенетическими особенностями в метаболизме витамина D. Установленная положительная корреляционная связь 25(OH) витамина D и маркеров костного синтеза у женщин, больных СД2, репродуктивного периода бурятской популяции способна оказывать влияние на процессы костного ремоделирования.
Клиническая значимость результатов
Оптимальный выбор диагностических мероприятий способствует оценке риска структурно-метаболических нарушений костной ткани у женщин, больных СД2, репродуктивного и постменопаузального периодов разных этнических групп и подтверждает роль своевременной профилактики с коррекцией наиболее значимых «управляемых» факторов риска. Полученные результаты могут быть использованы при составлении программ лечебно-профилактического характера в регионах с неоднородным по национальному составу населением.
Ограничения исследования
Одномоментный дизайн не позволяет судить о причинно-следственных взаимосвязях между признаками. Объем выборки требует осторожности при интерпретации полученных данных.
Направления дальнейших исследований
Дальнейшее изучение этнических аспектов состояния костной ткани у больных СД2 с оценкой факторов риска заключается в необходимости планирования проведения дальнейших исследований с формированием расширенных групп.
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что у женщин, больных СД2, бурятской популяции независимо от состояния функции яичников наблюдается повышение маркеров костного ремоделирования (P1NP, ОК и β-Cross laps) относительно пациенток с СД2 русской популяции. МПК и ТКИ у женщин, больных СД2, репродуктивного периода бурятской популяции соответствовали показателям русской популяции. Показатели МПК у женщин с диабетом постменопаузального периода бурятской и русской популяций не отличались, однако у пациенток бурятской популяции наблюдалась депрессия ТКИ.
Таким образом, для женщин, больных СД2, репродуктивного периода бурятской популяции характерно только ускорение процессов ремоделирования костной ткани, а в периоде постменопаузы дополнительно определяются структурные изменения. Есть основания считать, что выявленные структурно-метаболические изменения костной ткани носят этнический характер и могут способствовать негативным последствиям, в том числе повышению риска переломов у женщин бурятской популяции.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование проведено за счет бюджетных средств организации.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Бардымова Т.П. — концепция и дизайн исследования, анализ данных, написание текста; Шестакова М.В. — концепция и идея; Сандаков Я.П. — дизайн исследования, анализ данных; Мистяков М.В. — анализ литературы, сбор клинического материала, статистическая обработка результатов, написание основного текста; Березина М.В. — анализ литературы, написание основного текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
ДЛИТЕЛЬНОЕ ПЕРСИСТИРОВАНИЕ МАРКЕРОВ АУТОИММУННОЙ ДЕСТРУКЦИИ β-КЛЕТОК И ОСТАТОЧНАЯ СЕКРЕЦИЯ C-ПЕПТИДА ПРИ САХАРНОМ ДИАБЕТЕ 1 ТИПА
Сахарный диабет 1 типа (СД1) — хроническое заболевание, обусловленное аутоиммунной деструкцией β-клеток островков Лангерганса и, как следствие, развитием абсолютного дефицита инсулина [1]. Сформировалось мнение, что симптомы СД1 обычно проявляются при потере 90–95% β-клеток. Тем не менее, как показали последние исследования, развитие клинической симптоматики заболевания наблюдалось и при сохранении большего числа инсулинсекретирующих клеток, чем предполагалось ранее.
СД1 ассоциирован с появлением аутоантител (АТ) к компонентам островковых клеток за много месяцев или лет до проявления клинической симптоматики. Характерными АТ, которые можно обнаружить при СД1, являются АТ к цитоплазматическим структурам β-клеток (ICA), глутаматдекарбоксилазе (GADA), тирозинфосфатазе (IA2), транспортеру цинка 8 (ZnT8A) [2].
Остаточная масса островковых клеток, не подверженных аутоиммунному разрушению, с характерными признаками пролиферации β-клеток, апоптоза и инфильтрации Т-клеток определялась у пациентов с длительным анамнезом СД1 и высокими уровнями АТ [3].
В исследовании J.J. Meier и соавт. показано, что остаточные инсулинсекретирующие β-клетки присутствуют у большинства пациентов (88%) с СД1 и количество этих клеток не связано с продолжительностью заболевания, возрастом дебюта диабета и смерти пациентов [4].
Однако в другом исследовании [5] в более позднем возрасте дебюта заболевания выявляли более высокие уровни С-пептида натощак спустя 5–15 лет.
ЦЕЛЬ
Целью нашего исследования являлась оценка длительности персистирования маркеров аутоиммунной деструкции β-клеток, остаточной секреции С-пептида и их взаимосвязи с длительностью СД1 и возрастом его дебюта.
МЕТОДЫ
Дизайн исследования
Проведено обсервационное одноцентровое одномоментное сравнительное нерандомизированное исследование.
Критерии соответствия
Критерии включения и исключения для СД1.
Критерии включения:
1. СД1;
2. возраст от 18 до 55 лет;
3. ИМТ от 18,5 кг/м2 до 29,9 кг/м2.
Критерии исключения:
1. тяжелая печеночная недостаточность или наличие воспалительных заболеваний поджелудочной железы (ПЖ);
2. онкологические заболевания печени и ПЖ в анамнезе;
3. период беременности и лактации.
Критерии включения и исключения для группы здоровых лиц.
Критерии включения:
1. отсутствие ранее известных нарушений углеводного обмена;
2. возраст от 18 до 55 лет;
3. ИМТ от 18,5 до 29,9 кг/м2.
Критерии исключения:
1. тяжелая печеночная недостаточность или наличие воспалительных заболеваний ПЖ;
2. онкологические заболевания печени и ПЖ в анамнезе;
3. период беременности и лактации;
4. уровни АТ к компонентам β-клеток (ZnT8, IA-2, GAD) выше значений референсного интервала (более 10 Ед/мл);
5. выявление нарушений углеводного обмена (гликированный гемоглобин (HbA1с) более 5,8%).
Условия проведения
Исследование проводилось на базе ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, со сплошным включением пациентов отделения «Референс-центра обучения» Института диабета, соответствующих критериям включения и подписавших информированное согласие.
Продолжительность исследования
Исследование проведено в период с 05.2017 по 05.2019 гг.
Описание медицинского вмешательства
Всем пациентам проведен забор крови из периферической вены для проведения иммунологического исследования, включавшего определение АТ к GADA, IA2, ZnT8A и гормонального анализа уровня С-пептида натощак. Также оценивались клинические и лабораторные данные, в том числе возраст манифестации и длительность СД1, уровень HbA1с.
Основной исход исследования
Определены длительное персистирование маркеров аутоиммунного процесса (положительный титр АТ к GAD, IA-2, ZnT8) и минимальная остаточная секреторная функция β-клеток (С-пептид более 0,09 нг/мл) у пациентов с СД1 старше 18 лет.
Дополнительные исходы исследования
Выявлена взаимосвязь между остаточным уровнем С-пептида у пациентов с длительностью СД1 более 10 лет с возрастом дебюта заболевания.
Анализ в подгруппах
В зависимости от длительности заболевания пациенты были разделены на 4 группы: «А» — до 1 года, «Б» — 1–5 лет, «В» — 5–10 лет, «Г» — более 10 лет.
В зависимости от возраста дебюта СД1 (до и после 18 лет) пациенты из групп «В» и «Г» были разделены на 2 группы.
Методы регистрации исходов
Исследование антител к IA2, ZnT8, GAD проводилось твердофазным иммуноферментным методом (ИФА) ELISA (АТ к GAD — EUROIMMUN, Германия; АТ к ZnT8 — Medipan, Германия; АТ к IA2 — Medipan, Германия) в лаборатории клинической иммунологии и генетики ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России. Определение уровня С-пептида натощак проводилось на иммунохимическом автоматическом анализаторе Cobas 6000 методом ИФА. HbA1с был определен с помощью автоматического анализатора BIO-RAD D10 методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Референсные значения для АТ к компонентам островковых клеток составляли 0–10 Ед/мл, для С-пептида — 1,1–4,4 нг/мл. Исходя из ряда иных исследований, в нашей работе за минимальную остаточную инсулинсекреторную функцию, определяемую по уровню С-пептида натощак, выбран уровень 0,09 нг/мл, или 0,03 нмоль/л.
Этическая экспертиза
Все пациенты или их законные представители, которым проводились медицинские манипуляции в рамках исследования, подписали информированное согласие.
Проведение исследования было одобрено локальным этическим комитетом ФГБУ «Национальный медицинский исследовательский центр эндокринологии» МЗ РФ. Заключение ЛЭК №17 от 27.09.2017.
Статистический анализ
Принципы расчета размера выборки.
Минимальный размер выборки предварительно не рассчитывался.
Методы статистического анализа данных.
Статистическая обработка полученных данных была проведена с использованием прикладных программ STATISTICA (StatSoft inc., США, версия 13.0). Распределение количественных данных пациентов представлено в виде медианы (Ме) и интерквартильного размаха (Q1; Q3). Распределение качественных признаков описано абсолютными (n) и относительными частотами (%).
Сравнение между группами проводили с использованием критерия Краскела–Уоллиса с 3 и более группами сравнения и U-теста Манна–Уитни для сравнения 2 групп. Различия признавались статистически значимыми при p<0,05. В случае множественных сравнений применялась поправка Бонферрони.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование были включены 237 пациентов с СД1 старше 18 лет (91 мужчина, 146 женщин). Медиана (Ме) возраста пациентов составила 28 лет [ 23; 36], Ме возраста дебюта диабета — 19 лет [ 11; 25]. Группу контроля составили 20 здоровых лиц (без нарушения углеводного обмена) в возрасте от 23 до 52 лет (9 мужчин, 11 женщин).
Диагноз СД1 ставился на основании рекомендаций (критериев) ВОЗ 2019.
Группу «А» составили 69 (29%) пациентов, «Б» — 52 (22%), «В» — 57 (24%) и «Г» — 59 лиц (25%).
В ходе исследования зависимости уровня С-пептида и АТ к компонентам островковых клеток от возраста дебюта заболевания пациенты групп «В» и «Г» были разделены на 2 подгруппы — дебют СД1 до и после 18 лет. Подгруппу до 18 лет составили 54 пациента (46,6%), а после 18 лет — 62 (53,4%).
Основные результаты исследования
Положительный титр хотя бы одного из исследованных АТ выявлен у 72 (30,4%) обследованных пациентов. Частота определения и уровни АТ в каждой из обследованных групп представлены в табл. 1. Взаимосвязи характера выявленных АТ с уровнем С-пептида не отмечено. Взаимосвязь наблюдалась лишь в более частом определении комбинаций ZnT8+IA2 в группах «А» и «Б». У пациентов с двумя и более видами выявленных АТ чаще встречались комбинации ZnT8+IA2 (73%). Обследованные группы значимо отличались по уровню С-пептида (p=0,0013) и возрасту дебюта СД1 (p=0,0034), однако в данном случае стоит учесть отсутствие среди обследованных нами лиц пациентов с длительностью СД1 менее 3 лет и возрастом менее 18 лет. Значимых различий уровней HbA1c, ИМТ и АТ выявлено не было. В группе контроля у 1 обследованного выявлен уровень АТ к ZnT8 и IA2 более 10 Ед/мл, в связи с чем он исключен из исследования. У остальных 19 обследованных лиц из группы контроля АТ к антигенам компонентов β-клеток не выявлены, уровни HbA1c и С-пептида соответствовали показателям популяции без нарушений углеводного обмена (табл. 2).
В группе «Г» у 13 (22%), а в «В» — у 26 (45,6%) из числа обследованных пациентов уровень С-пептида натощак составил более 0,09 нг/мл. В группах «А» и «Б» уровень С-пептида более 0,09 нг/мл был выявлен у 46 (66,7%) и 29 (55,8%) пациентов соответственно.
С целью оценки влияния возраста дебюта СД1 на уровни АТ и остаточную секрецию С-пептида при длительности СД более 5 лет (группы «В» и «Г») пациенты были разделены на 2 подгруппы (табл. 3).
Таблица 1. Общая характеристика обследованных пациентов
Длительность СД1, лет | Группа «А» (n=69) | Группа «Б» (n=52) | Группа «В» (n=57) | Группа «Г» (n=59) | P, ANOVA K-W |
Возраст участников, лет | 28 [ 23; 32] | 28 [ 24; 33] | 26 [ 22; 31] | 32 [ 27; 38] | P=0,1167 |
Возраст дебюта СД1, лет | 27 [ 23; 31] | 23,5 [ 19; 30] | 22 [ 19; 25] | 11 [ 7; 13] | P=0,0034 |
ИМТ, кг/м2 | 21,7 [ 19,3; 23,5] | 23,1 [ 21,6; 24,1] | 23,3 [ 20,2; 24,6] | 22,5 [ 20,2; 23,9] | P=0,4601 |
С-пептид, нг/мл | 0,86 [ 0,53; 1,4] | 0,65 [ 0,27; 0,98] | 0,19 [ 0,17; 0,23] | 0,01 [ 0,01; 0,01] | P=0,0013 |
HbA1c, % | 10,7 [ 8,4; 13,3] | 8,1 [ 7,3; 8,6] | 8,2 [ 7,1; 9,8] | 7,5 [ 6,9; 8,3] | P=0,0942 |
ZnT8A, Ед/мл | 249,5 [ 56,0; 526,5] | 285,6 [ 83,2; 489,0] | 156,3 [ 33,4; 289,5] | 79,3 [ 46,9; 239,5] | P=0,0267 |
IA2, Ед/мл | 263,5 [ 234,2; 366,2] | 245,7 [ 104,4; 374,6] | 107,1 [ 39,2; 268,3] | 49,4 [ 33,5; 215,3] | P=0,0723 |
GADA, Ед/мл | 384,4 [ 60,2; 1526,1] | 93,4 [ 49,0; 251,2] | 84,6 [ 43,3; 359,2] | 83,5 [ 45,2; 227,0] | P=0,1254 |
Наличие 1 антитела, % | 37% | 33% | 29% | 23% | |
Наличие 2 антител, % | 13% | 14% | 12% | 5% |
Таблица 2. Показатели группы контроля — здоровых лиц без сахарного диабета и иных форм нарушений углеводного обмена
Группа контроля (n=19) | Значения |
Возраст участников, лет | 26 [ 24; 43] |
ИМТ, кг/м2 | 22,8 [ 20,4; 25,7] |
С-пептид, нг/мл | 1,99 [ 1,78; 3,21] |
HbA1c, % | 5,1 [ 4,8; 5,3] |
ZnT8A, Ед/мл | 3,7 [ 1,2; 6,4] |
IA2, Ед/мл | 1,4 [ 1,0; 2,8] |
GADA, Ед/мл | 0,39 [ 0,27; 0,4] |
Наличие 1 антитела, % | 0, ДИ 0–17% |
Наличие 2 антител, % | 0, ДИ 0–17% |
Таблица 3. Уровни С-пептида натощак, антител к транспортеру цинка T8, тирозинфосфатазе и глутаматдекарбоксилазе в зависимости от возраста дебюта сахарного диабета в группах «В» и «Г»
Дебют после 18 лет n=62 | Дебют до 18 лет n=54 | P, M-W U-test | |
С-пептид, нг/мл | 0,19 [ 0,01; 0,4] | 0,01 [ 0,01; 0,01] | p=0,0027 |
ZnT8A, Ед/мл | 7,6 [ 6,2; 51] | 9,3 [ 5,1; 56,3] | p=0,0312 |
IA2, Ед/мл | 22,3 [ 4,2; 119] | 6,7 [ 4,1; 87,8] | p=0,1607 |
GADA, Ед/мл | 0,8 [ 0,4; 131] | 0,4 [ 0,3; 3,7] | p=0,1018 |
В группе дебюта СД1 после 18 лет выявлено 28 (77,8%) пациентов с уровнем С-пептида более 0,09 нг/мл, а в группе до 18 лет — 11 (22,2%). Подгруппы достоверно различались по уровню С-пептида. Статистически значимых различий по уровню АТ в данных подгруппах выявлено не было.
Нежелательные явления
Изначально объем группы контроля составлял 20 человек. Однако у одного из обследованных были выявлены положительные уровни АТ к ZnT8 и IA2 — 21,3 и 19,9 Ед/мл соответственно. Нарушение углеводного обмена не выявлено, уровень HbA1c составил 5,2%, глюкоза натощак (при дополнительном обследовании) — 4,9 ммоль/л. Учитывая выявленные уровни АТ к компонентам β-клеток, участник был исключен из группы контроля.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Положительный титр АТ к компонентам островковых клеток выявлен у 72 (30,4%) обследованных пациентов. Распределение положительного уровня АТ по группам составило: «А» — 26 (37%), «Б» — 17 (33%), «В» — 15 (29%) и «Г» — 14 (23%). Уровень С-пептида натощак более 0,09 нг/мл был выявлен у 46 (66,7%) пациентов в группе «А», у 29 (55,8%) — в «Б», 26 (45,6%) — «В» и 13 (22%) — «Г». У пациентов с дебютом СД1 после 18 лет отмечались более высокие уровни С-пептида, нежели у лиц, заболевших до достижения данного возраста.
Обсуждение основного результата исследования
Положительный уровень АТ к антигенам компонентов островковых клеток определялся как в дебюте заболевания, так и спустя 10 лет и более. Исходя из результатов проведенного нами исследования можно подтвердить факт наличия длительно сохраняющегося персистирования маркеров аутоиммунного процесса у пациентов с СД1, характеризующийся отсутствием корреляции между уровнями АТ и длительностью заболевания. Аналогичные результаты были отмечены также и в некоторых зарубежных исследованиях [1][6–9]. Например, в исследовании H.A. Keenan и соавт. среди 411 пациентов с длительностью СД1 более 50 лет у 29,7% (n=111) определялось по крайней мере одно из исследованных АТ [6].
Распространение данного явления носит повсеместный характер, так, в 2018 г. учеными из Китая были опубликованы материалы обследования 95 пациентов с длительным анамнезом СД1 (более 30 лет). АТ к GAD, IA-2 и ZnT8 были обнаружены у 17,1, 5,7 и 1,4% участников соответственно [7]. Данное исследование отражает длительное персистирование маркеров аутоиммунного процесса у лиц с СД1 не только в европейской или американской популяции, но и у пациентов стран азиатского континента.
Все чаще учеными отмечаются случаи, когда при длительном течении СД1 сохраняется и остаточная секреция инсулина β-клетками [5][6][8]. Мы выявили 13 (22%) пациентов в группе «Г» и 26 (45,6%) — в группе «В», у которых уровень С-пептида натощак был более 0,09 нг/мл, что может свидетельствовать о наличии минимальной остаточной секреции данного гормона. В группах «А» и «Б» уровень С-пептида более 0,09 нг/мл был выявлен у 46 (66,7%) и 29 (55,8%) пациентов соответственно.
Данные, опубликованные в 2019 г., показали, что из 1019 обследованных пациентов с длительным анамнезом СД1 (более 50 лет) у 32% был обнаружен уровень С-пептида >0,05 нг/мл, что является минимальным определяемым уровнем в данном исследовании, в то время как 44% из них имели положительный титр АТ к GAD и IA2 [9].
В публикации [5] авторы заявляют о 29% (900 обследованных лиц) случаев выявления определяемого уровня С-пептида натощак, составляющего более 0,017 нмоль/л, или 17 пмоль/л, или 0,05 нг/мл. По нашему мнению, данный уровень С-пептида не следует расценивать как наличие остаточной секреции инсулина, однако ученые также заявляли о положительном ответе уровня С-пептида в ходе проведения теста ММТТ (Mixed Meal Tolerance Test – тест со смешанной пищей) в 40% случаев. В этом же исследовании было установлено, что в 78% случаев диагноз был поставлен в возрасте старше 18 лет, а в 46% до достижения данного возраста, что также подтверждается результатами нашего исследования и рядом других работ [10–12].
В исследовании [13] были предложены иные пиковые уровни С-пептида в ходе ММТТ, отображающие остаточную секрецию: как ее отсутствие — при уровне менее 0,02 нг/мл, низкие — 0,05–0,6 нг/мл, средние — 0,6–1,2 нг/мл и высокие — более 1,2 нг/мл.
В другой опубликованной работе [14] приведены иные варианты классификации остаточной секреции С-пептида, а именно высокий уровень остаточной секреции определялся как более 0,6 нг/мл, средний — от 0,09 нг/мл до 0,6 нг/мл и низкий — от 0,009 нг/мл до 0,09 нг/мл.
Сохранение остаточного уровня С-пептида в когорте пациентов с длительным течением СД1 может говорить об ошибочной диагностике заболевания и возможном наличии диабета типа MODY, а именно вариантах моногенного диабета HNF1α и HNF4α. Однако в одном из недавних исследований [15] типов диабета MODY сообщалось о минимальных уровнях С-пептида — 1,087 нг/мл, что значительно выше тех уровней, что определялись в ряде ранних исследований [5][10–12], включая наше.
В исследовании The Pittsburgh Epidemiology of Diabetes Complications Study авторы также выявили взаимосвязь между высокими уровнями АТ у пациентов с более чем 30-летним анамнезом СД1 и более поздним возрастом дебюта заболевания [16].
В одной из работ были обследованы 3668 пациентов с СД1 различных возрастных групп. С целью оценки уровня C-пептида натощак в зависимости от возраста дебюта заболевания пациенты были разделены на 4 группы: менее 5 лет (n=344); 5–10 лет (n=668); 10–18 лет (n=991) и более 18 лет (n=1655). Полученные результаты, по мнению ученых, отражали прямую зависимость более высоких уровней С-пептида натощак в зависимости от более позднего возраста дебюта СД1 [11].
Полученные нами результаты также свидетельствуют о взаимосвязи между более поздним возрастом дебюта СД1 и наличием более высоких уровней АТ и уровня С-пептида натощак у пациентов с длительностью СД1 более 5 лет (табл. 3). Нами установлено, что из 116 пациентов с длительностью СД1 более 5 лет остаточная секреция С-пептида на уровне более 0,09 нг/мл была сохранена у 28 (77,8%) пациентов в группе дебюта СД1 после 18 лет и у 11 (22,2%) в группе до 18 лет.
В настоящее время все чаще отмечается возможная взаимосвязь остаточной секреции С-пептида и частоты эпизодов гипогликемии. В одном из крупнейших исследований шотландской популяции, состоящей из 6076 пациентов с СД1, выявлено, что уровни С-пептида 0,09–0,6 нг/мл были ассоциированы с низкой распространенностью эпизодов гипогликемии, низкими дозами инсулина и, как следствие, более адекватной компенсацией углеводного обмена в сравнении с теми пациентами, чей уровень С-пептида находился вне спектра определения — менее 0,01 нг/мл [17]. Эти данные противоречат исследованию [18], где было заявлено о более высоких (более 0,39 нг/мл) минимальных уровнях С-пептида, благотворно влияющих на снижение частоты эпизодов гипогликемии. По данным [14], уровень С-пептида более 0,09 нг/мл был также связан с более низкой распространенностью эпизодов тяжелой гипогликемии и, как следствие, развития микрососудистых осложнений СД1. Нами подобных исследований проведено не было, однако они имеют определенную практическую ценность.
Сохранение остаточных инсулинпродуцирующих островковых клеток демонстрируют и данные материалов аутопсии. В публикациях [6][9] было проведено исследование 68 гистологических препаратов материалов аутопсии ПЖ, и во всех исследованных образцах были выявлены секретирующие β-клетки: а) только рассеянные синглеты/дублеты (n=9); б) рассеянные и несколько инсулинсекретирующих клеток в некоторых островках (n=45); в) рассеянные и некоторые отдельные дольки с большим количеством инсулинсекретирующих клеток в островках (n=14).
В течение более чем 10-летнего наблюдения за 73 пациентами с ежегодными измерениями уровня С-пептида и HbA1c выявлено, что определяемые (или остаточные) уровни С-пептида более характерны для лиц женского пола и тех, у кого показатель уровня HbA1c был ниже в течение первых 3 лет от дебюта СД1 [19]. Подобной взаимосвязи нами отмечено не было, однако в нашем случае это было однократное измерение, а не длительное наблюдение в течение 5–10 лет. Возможно, лучший контроль углеводного обмена у пациентов с СД1 может быть следствием, а не причиной сохранной инсулинсекреторной функции клеток.
Ограничения исследования
В проведенном нами исследовании пациенты из группы «А» всегда были старше 18 лет, в связи с чем исследование различных показателей в зависимости от возраста дебюта СД1 в данной группе не представлялось возможным.
ЗАКЛЮЧЕНИЕ
Длительное персистирование маркеров аутоиммунной деструкции β-клеток отмечается при различной длительности СД1, отражая данный факт выявлением в группах «В» и «Г» высоких уровней АТ к компонентам островковых клеток (ZnT8, IA2 и GAD) в 29 и 23% соответственно.
Нами было подтверждено мнение о более высокой, чем было установлено ранее, сохранности остаточной секреции С-пептида как отражение минимальной активности β-клеток у людей с различной длительностью СД1. По полученным данным определено, что при дебюте СД1 после 18 лет уровни С-пептида выше, чем у лиц, заболевших до достижения данного возраста.
Однако остается не до конца установленным, является ли остаточная секреция инсулина доказательством образования новых клеток либо не все клетки подвержены аутоиммунному разрушению и, следовательно, сохраняют остаточную секреторную функцию.
Таким образом, существует множество гипотез и предположений о природе остаточной секреторной функции β-клеток и длительном персистировании маркеров аутоиммунной деструкции островковых клеток, их взаимосвязи и влиянии на течение заболевания.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование выполнено на средства гранта Российского научного фонда № 17-75-30035 «Аутоиммунные эндокринопатии с полиорганными поражениями: геномные, постгеномные и метаболомные маркеры. Генетическое прогнозирование рисков, мониторинг, ранние предикторы, персонализированная коррекция и реабилитация».
Конфликт интересов. Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Участие авторов. Рагимов М.Р., Деревянко О.С. — концепция и дизайн исследования, сбор и обработка материалов, анализ полученных данных, написание текста; Малышева Н.М., Зураева З.Т., Никанкина Л.В. — выполнение лабораторных исследований; Никонова Т.В. — концепция и дизайн исследования, редактирование текста. Все авторы внесли существенный вклад в написание статьи, прочли и одобрили финальный вариант рукописи.
Благодарности. Выражаем благодарность пациентам за участие в исследовании, а также всем докторам и сотрудникам клинико-диагностической лаборатории ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России.
СОСТОЯНИЕ ФУНКЦИИ ЭНДОТЕЛИЯ У МУЖЧИН С ГИПОГОНАДИЗМОМ
ОБОСНОВАНИЕ
Широкая распространенность сахарного диабета (СД) в мире, ее неуклонный рост наряду с высокой смертностью данной категории больных от сердечно-сосудистых заболеваний делают изучение этой проблемы неизменно актуальным. Установлено, что кардиоваскулярный риск у больных СД вдвое выше, чем в популяции, что обусловлено влиянием на сосудистое русло глюкозо- и липотоксичности, оксидативного стресса и многих других факторов [1][2]. Являясь первым барьером для гипергликемии и гиперлипидемии, эндотелий подвержен их повреждающему влиянию, что приводит к эндотелиальной дисфункции (ЭД) [2][3]. Важным является тот факт, что появление ЭД происходит за несколько лет до клинических симптомов кардиоваскулярных заболеваний, что при своевременном ее выявлении позволяет предотвратить развитие сосудистых осложнений СД [4–6]. Это диктует необходимость проведения исследований, посвященных изучению ЭД как стартового механизма поражения органов и тканей при СД у пациентов с высоким кардиоваскулярным риском.
В то же время известно, что нарушения углеводного обмена и дефицит тестостерона (Т) у мужчин взаимно отягощают друг друга [7, 8], а смертность от сердечно-сосудистых заболеваний больных СД 2 типа (СД2) в сочетании с гипогонадизмом более чем вдвое выше, чем у эугонадных пациентов [9]. По данным различных исследований, распространенность гипогонадизма у мужчин с СД2 составляет от 30% до более чем 50% [7][10]. С одной стороны, дефицит Т ухудшает многие метаболические параметры — показатели углеводного и липидного обменов, инсулинорезистентность, функцию жировой ткани, что способствует развитию декомпенсации СД и прогрессии его осложнений [8][10][11]. С другой стороны, больные СД2 имеют более низкие уровни Т, чем мужчины без нарушений углеводного обмена [7]. Сочетание этих факторов синергично отягощает течение сердечно-сосудистых заболеваний, а увеличение кардиоваскулярных рисков у мужчин с дефицитом Т вне зависимости от наличия СД позволяет предполагать, что гипогонадизм является независимым фактором риска сердечно-сосудистой смертности [9]. Помимо негативного влияния гипогонадизма на многочисленные факторы кардиоваскулярных рисков, существует и прямое действие Т на сердце и сосуды, осуществляющееся через геномные и негеномные механизмы [9][12]. Предполагается, что эндотелий является самостоятельным органом-мишенью для андрогенов. Так, в эндотелиоцитах обнаружена экспрессия рецепторов андрогенов, через взаимодействие с которыми Т реализуются его биологические эффекты [13][14]. Было показано нарушение функции эндотелия при снижении чувствительности андрогеновых рецепторов вне зависимости от уровня Т [15]. Однако работы о влиянии Т на эндотелий крайне малочисленны, а механизмы этого воздействия остаются неизученными.
ЦЕЛЬ
Оценить влияние гипогонадизма на функцию эндотелия у мужчин с СД2.
МЕТОДЫ
Дизайн исследования
Проведено интервенционное сплошное одномоментное одноцентровое проспективное сравнительное исследование.
Критерии соответствия
Критерии включения: СД2 длительностью не менее 1 года, мужской пол, возраст 40–65 лет, лечение СД2 пероральными сахароснижающими препаратами, стабильность сопутствующей терапии в течение 3 мес, информированное согласие на участие в исследовании.
Критерии исключения: острые или обострение хронических воспалительных заболеваний, инсулинотерапия СД2, инфаркт миокарда в анамнезе за последние 6 мес, установленный диагноз онкологического заболевания, классические формы гипогонадотропного или гипергонадотропного гипогонадизма, гиперпролактинемический синдром и нарушения функции щитовидной железы.
Условия проведения
Исследование проводили на базе эндокринологического отделения клиники ФГБОУ ВО «Ростовский государственный медицинский университет» МЗ РФ. В исследование включали как больных, находившихся на стационарном лечении, так и пациентов, обратившихся за амбулаторной помощью.
Продолжительность исследования
Включение пациентов в исследование производили с 2014 по 2018 гг.
Описание медицинского вмешательства
Проводили сбор жалоб, изучение анамнеза, измерение антропометрических показателей (масса тела, рост, индекс массы тела (ИМТ), окружность талии (ОТ), окружность бедер (ОБ)). У пациентов осуществляли забор венозной крови объемом 10 мл, строго натощак после 12-часового голодания. Для проведения биохимических анализов использовали свежую сыворотку крови, иммуноферментные исследования осуществляли из сыворотки, замороженной при температуре -20° С. Состояние углеводного и липидного обменов оценивали при помощи следующих показателей: глюкоза и иммунореактивный инсулин (ИРИ) натощак с расчетом индекса инсулинорезистентности НОМА, гликированный гемоглобин (НbА1с) и липидограмма (общий холестерин, уровень триглицеридов, ЛПНП). Также изучали содержание половых гормонов — общего Т, глобулина, связывающего половые гормоны (ГСПГ), расчетного свободного Т, лютеинизирующего гормона (ЛГ) и маркеров функции эндотелия — оксида азота (NO), эндотелиальной синтазы оксида азота 3 типа (eNOS3), эндотелина, молекул адгезии ICAM-1, VCAM-1, p- и е-селектинов, кадгерина. Инструментальное обследование включало ультразвуковое исследование эндотелий-зависимой вазодилатации (ЭЗВД) плечевой артерии (ПА) по методике D. Celermajer (1992) и ультразвуковое исследование сонных артерий с оценкой толщины комплекса интима-медиа (КИМ).
Основной исход исследования
В качестве основных конечных точек исследования были приняты показатели сосудодвигательной функции эндотелия (ЭЗВД ПА и время развития максимальной вазодилатации ПА) по данным ультразвукового исследования и показатели секреторной функции эндотелия (концентрации NO, eNOS3, эндотелина, ICAM-1, VCAM-1, p- и е-селектинов, кадгерина).
Дополнительные исходы исследования
Дополнительными конечными точками исследования были показатели углеводного и липидного обменов, показатель КИМ сонных артерий.
Анализ в подгруппах
На основании проведенного клинического и лабораторного обследования, в зависимости от наличия или отсутствия гипогонадизма пациенты были разделены на две группы.
- В 1-ю группу были включены мужчины с СД2 с впервые установленным диагнозом гипогонадизма.
- Во 2-ю группу включили эугонадных пациентов с СД2.
Методы регистрации исходов
Оценку показателей гликемии, липидограммы и ферментов печени проводили при помощи анализатора Bayer ADVIA 1650, определение НbА1с — Siemens Healthcare Diagnostics DCA 2000+. Иммуноферментный анализ выполняли с использованием анализатора Zenyth 340. Иммуноферментный анализ уровней половых гормонов проводили при помощи лабораторных наборов «Алкор-Био» (Россия), ИРИ — Monobind Inc. (США). Степень выраженности инсулинорезистентности определяли при помощи расчета индекса НОМА по формуле: HOMA-IR = гликемия натощак (ммоль/л) × уровень инсулина (мкЕд/мл) / 22,5.
Маркеры функции эндотелия определяли при помощи лабораторных наборов: ICAM-1, VCAM-1, p- и е-селектинов, кадгерина — «Бендер Медсистемс Гмбх» (Австрия); eNOS3 — BCM Diagnostics (США), эндотелина — «Биомедика Медицин продукте ГмбХ & Ко КГ» (Австрия). Содержание NO в сыворотке крови определяли расчетным методом путем вычисления разности нитритов и нитратов как продуктов метаболизма NO в соответствии с рекомендациями производителя (R&D, США).
Ультразвуковое исследование артериальной вазореактивности проводили с помощью теста реактивной гиперемии с последующим проведением пробы с сублингвальным приемом нитроглицерина согласно методике D. Celermajer. Изучение ЭЗВД проводили на ПА, для получения изображения и измерения диаметра которой использовали ультразвуковую систему Philips HD 11, оснащенную линейным датчиком с фазированной решеткой (частота 7,0 МГц). ЭЗВД ПА при проведении пробы с реактивной гиперемией рассчитывали по формуле:

Помимо общепринятой оценки прироста диаметра ПА, характеризующего пространственные характеристики ЭЗВД, в ходе теста с реактивной гиперемией производили измерение времени развития максимальной вазодилатации ПА, отражающего временные характеристики ЭЗВД. В ходе исследования диаметр ПА измеряли исходно, на 1-й минуте — каждые 15 с, затем каждые 30 с вплоть до 5 мин после декомпрессии. При проведении статистического анализа использовали показатель времени развития максимальной вазодилатации ПА, то есть значение секунды, на которой произошло наибольшее расширение ПА после декомпрессии манжеты. Помимо этого, всем пациентам проводили ультразвуковое исследование толщины КИМ задней стенки общих сонных артерий согласно стандартизованной методике P. Pignoli.
Этическая экспертиза
Все пациенты до начала исследования подписали форму информированного согласия, одобренную Локальным этическим комитетом Ростовского государственного медицинского университета (протокол №13/14 от 11.09.2014).
Статистический анализ
Принципы расчета размера выборки. Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных. Статистический анализ данных проводили при помощи пакета прикладных программ Statistica 10.0 (StatSoft Inc., США). Переменные были проверены на нормальность распределения с помощью критерия Колмогорова–Смирнова. Данные представлены в виде медиан и интерквартильного размаха Me [Q1; Q3]. Сравнение групп осуществляли для качественных признаков — непараметрическим методом χ2 с поправкой Йейтса, а для количественных признаков — U-тестом Манна–Уитни для двух независимых групп. Статистически значимым считали различие при значении р<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование вошли 276 мужчин с СД2 (возраст 54,0 [ 49; 60] года, длительность СД2 — 6,0 [ 2,0; 10,0] года). Пациенты были разделены на 2 группы в соответствии с наличием или отсутствием симптомного гипогонадизма, диагностированного согласно критериям Российской ассоциации эндокринологов (2017) и Европейской ассоциации урологов (2014): 1-я — 124 мужчины, страдающие СД2 в сочетании с гипогонадизмом, 2-я — 152 эугонадных пациента с СД2. Группы были сопоставимы по возрасту, длительности СД2, массе тела, ИМТ, ОТ и ОБ (табл. 1).
Таблица 1. Характеристика групп пациентов в исследовании
Показатель | С гипогонадизмом (n=124) | Без гипогонадизма (n=152) | р |
Возраст, лет | 54,0[ 50; 58] | 53,5 [ 49,5; 58] | 0,661 |
Длительность СД2, лет | 5,0 [ 2,0; 8,0] | 5,0 [ 2,0; 10,0] | 0,414 |
Антропометрические показатели | |||
Масса тела, кг | 103 [ 92; 112] | 101,0 [ 94; 107] | 0,143 |
ИМТ, кг/м2 | 32,8 [ 30,6; 36,1] | 32,7 [ 30,6; 34,2] | 0,130 |
ОТ, см | 112 [ 105; 122] | 112 [ 106; 117] | 0,162 |
ОБ, см | 110 [ 104; 116] | 108 [ 103; 114] | 0,128 |
Содержание гормонов в сыворотке крови | |||
Общий тестостерон, нмоль/л | 10,1 [ 7,7; 11,4] | 17,3 [ 14,6; 20,4] | <0,001 |
Глобулин, связывающий половые гормоны, нмоль/л | 26,1 [ 17,9; 37,6] | 31,0 [ 23,7; 48,2] | 0,002 |
Свободный тестостерон, пмоль/мл | 212 [ 146; 236] | 362 [ 292; 448] | <0,001 |
ЛГ, мМЕ/мл | 3,8 [ 2,3; 5,3] | 4,4 [ 2,7; 5,9] | 0,072 |
Согласно принципу деления пациентов на группы, они значимо отличались по уровням общего и свободного Т (р<0,001), кроме того, были выявлены отличия в содержании ГСПГ, который был выше во 2-й группе по сравнению с 1-й (р=0,002). Обращает на себя внимание несколько более высокий уровень ЛГ во 2-й группе (р=0,07) относительно 1-й группы.
Нужно отметить, что наличие и тяжесть сердечно-сосудистых заболеваний не являлись критериями исключения из исследования, однако их структура и сопутствующая терапия требовали дополнительного анализа. Статистический анализ не выявил значимых различий в частоте ишемической болезни сердца и хронической сердечной недостаточности среди пациентов 1-й и 2-й групп (р>0,05). Так, ишемическая болезнь сердца была диагностирована у 36 человек (29%) 1-й группы и 39 мужчин (25,7%) 2-й группы, а хроническая сердечная недостаточность — у 24 (19,4%) и 26 (17,1%) пациентов соответственно. Частота артериальной гипертензии у мужчин с гипогонадизмом была несколько выше, чем у эугонадных пациентов (95 (76,6%) против 107 (70,4%)), однако различие в уровнях систолического и диастолического артериального давления в группах не было статистически значимым, что позволяет проводить сравнительный анализ ЭД в группах. Сопутствующая терапия сердечно-сосудистых заболеваний была представлена гипотензивными и гиполипидемическими препаратами. Структура сопутствующей терапии была следующей: ингибиторы ангиотензинпревращающего фермента получали 36%, β-адреноблокаторы и диуретики — по 30,2%, антагонисты кальция — 15,1%, блокаторы рецепторов ангиотензина II — 12,6%, агонисты имидазолиновых рецепторов — 2,9%. Согласно медицинской документации, статины были назначены 82% больных, однако при сборе анамнеза было установлено, что регулярно их принимали лишь 65,8% пациентов. При этом все препараты применялись в группах с сопоставимой частотой и в эквивалентных дозировках.
Основные результаты исследования
Нарушение сосудодвигательной функции эндотелия было выявлено у 32,4% больных 2-й группы и у 55,3% 1-й группы, что с высокой степенью достоверности (χ2=6,1; р=0,01) позволяет утверждать, что гипогонадизм у мужчин с СД2 ассоциирован с развитием ЭД.
При проведении теста реактивной гиперемии значения исходного и максимального диаметров ПА между группами значимо не отличались (табл. 2). Однако было выявлено снижение ЭЗВД ПА на 29,8% (р<0,001) у пациентов 1-й группы по сравнению со 2-й. Статистический анализ показал, что время развития максимальной вазодилатации ПА было больше на 30 с у больных 1-й группы по сравнению со 2-й (р<0,001). То есть дефицит Т у мужчин с СД2 приводит не только к снижению артериальной вазореактивности почти на треть, но и к удлинению интервала времени развития ЭЗВД ПА.
Таблица 2. Показатели эндотелий-зависимой вазодилатации
Показатель | С гипогонадизмом (n=124) | Без гипогонадизма (n=152) | р |
Исходный диаметр плечевой артерии при ЭЗВД, мм | 4,8 [ 4,3; 5,0] | 4,6 [ 4,2; 5,0] | 0,215 |
Максимальный диаметр плечевой артерии при ЭЗВД, мм | 5,3 [ 4,7; 5,6] | 5,2 [ 4,9; 5,5] | 0,864 |
ЭЗВД, % | 9,4 [ 6,9; 13,0] | 12,2 [ 10,0; 16,7] | <0,001 |
Время развития максимальной вазодилатации ПА, с | 120 [ 90; 180] | 90 [ 60; 90] | <0,001 |
Как видно из рис. 1, содержание NO в 1-й группе было снижено в 1,6 раза (р=0,001), что сопровождалось уменьшением концентрации eNOS3 в 1,5 раза (р=0,038) по сравнению со 2-й группой. Поскольку известно, что NO является мощнейшим вазодилататором, столь значимый дефект его синтеза в условиях дефицита Т может являться основной причиной замедления и снижения ЭЗВД, показанных ранее. При этом содержание эндотелина в группах статистически значимо не различалось — его уровень в 1-й группе составил 1,1 [ 0,7; 1,9] фмоль/мл, во 2-й — 1,0 [ 0,6; 1,8] фмоль/мл (р=0,446).
Сравнительный анализ содержания молекул адгезии у пациентов 1-й и 2-й групп представлен на рис. 2. Концентрация VCAM-1 была выше на 32,5% (р<0,001), ICAM-1 — на 43,5% (р<0,001), р-селектина — на 19,3% (р=0,004) в 1-й группе по сравнению со 2-й (р<0,001). Аналогично, высокодостоверные данные были продемонстрированы в отношении еще одной молекулы адгезии — кадгерина, содержание которого было в 6 раз выше у мужчин, имевших дефицит Т, по сравнению с эугонадными пациентами (р<0,001). Так, содержание кадгерина в 1-й группе составило 1,3 [ 0,1; 2,3] нг/мл, тогда как во 2-й группе его уровень достигал лишь 0,2 [ 0,1; 0,4] нг/мл. Уровни е-селектина значимо между группами не отличались (р=0,259).

Рисунок 1. Сравнительный анализ содержания оксида азота и эндотелиальной синтазы 3 типа у мужчин с сахарным диабетом 2 типа в зависимости от наличия или отсутствия гипогонадизма. *— p<0,05.

Рисунок 2. Сравнительный анализ содержания молекул адгезии у мужчин с сахарным диабетом 2 типа в зависимости от наличия или отсутствия гипогонадизма. *— p<0,01.
Дополнительные результаты исследования
При анализе показателей углеводного обмена (табл. 3) было установлено, что группы значимо не отличались по уровню гликемии натощак и HbA1c. В то же время выраженность гиперинсулинемии в 1-й группе была на 27,6% выше (р=0,002), а индекс инсулинорезистентности HOMA-IR — в 1,3 раза выше (р<0,001), чем во 2-й.
Таблица 3. Показатели углеводного и липидного обменов
Показатель | С гипогонадизмом (n=124) | Без гипогонадизма (n=152) | р |
Глюкоза натощак, ммоль/л | 7,8 [ 6,5; 10,7] | 7,9 [ 6,4; 9,6] | 0,661 |
HbA1c, % | 7,9 [ 6,8; 10,3] | 7,7 [ 6,6; 9,1] | 0,198 |
ИРИ, мкМЕ/мл | 16,2 [ 10,5; 30,2] | 12,7 [ 8,4; 21,0] | 0,002 |
Индекс HOMA-IR, ед | 6,2 [ 3,8; 11,0] | 4,6 [ 2,8; 7,0] | <0,001 |
ОХС, ммоль/л | 5,7 [ 4,8; 6,6] | 5,1 [ 4,6; 6,1] | 0,048 |
ТГ, ммоль/л | 2,1 [ 1,5; 2,9] | 1,6 [ 1,3; 2,0] | <0,001 |
ЛПВП, ммоль/л | 1,5 [ 1,3; 1,6] | 1,4 [ 1,3; 1,6] | 0,743 |
ЛПОНП, ммоль/л | 1,1 [ 0,8; 1,6] | 0,8 [ 0,6; 0,9] | <0,001 |
ЛПНП, ммоль/л | 3,3 [ 2,5; 4,2] | 2,9 [ 2,4; 3,6] | 0,020 |
ИА, ед. | 2,9 [ 2,6; 3,3] | 2,6 [ 2,5; 3,0] | 0,007 |
При изучении липидного спектра крови было выявлено статистически значимое увеличение уровней общего холестерина на 11,3% (р=0,048), триглицеридов — на 28% (р<0,001), липопротеидов низкой плотности — на 9,5% (р=0,02), а липопротеидов очень низкой плотности — в 1,4 раза (р<0,001) у больных с гипогонадизмом по сравнению с эугонадными пациентами. Уровни липопротеидов высокой плотности были сопоставимы в обеих группах (р=0,743). Это сопровождалось увеличением индекса атерогенности на 9,5% в 1-й группе по сравнению со 2-й (р=0,007).
Толщина КИМ сонных артерий в нашей выборке больных была статистически значимо (р=0,03) больше на 10% у лиц с гипогонадизмом по сравнению с эугонадными пациентами (1 [0,9; 1,2] мм против 0,9 [0,7; 1,1] мм).
Нежелательные явления
В ходе исследования нежелательные явления не были зарегистрированы.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
На основании анализа результатов исследования, проведенного на 276 мужчинах с СД2, было установлено, что гипогонадизм сопряжен с увеличением частоты ЭД. Сочетание СД2 и гипогонадизма у мужчин ассоциировано с ухудшением сосудодвигательной функции эндотелия: снижением ЭЗВД наряду с увеличением времени развития максимальной вазодилатации ПА. Гипогонадизм приводит к нарушению секреторной функции эндотелия: увеличению концентраций молекул адгезии VCAM-1, ICAM-1, р-селектина, кадгерина и, напротив, уменьшению уровней NO, eNOS3.
Обсуждение основного результата исследования
Дисфункция эндотелия, определенная при помощи ультразвукового исследования, у мужчин с СД2 и гипогонадизмом встречалась в 1,7 раза чаще, что сопровождалось повышением толщины КИМ сонных артерий на 10% по сравнению с эугонадными пациентами. Толщина КИМ сонных артерий является важным прогностическим показателем атеросклеротического процесса, увеличение которого расценивается как неблагоприятный фактор прогрессии ЭД и отражает структурные изменения средней оболочки сонной артерии, что, по данным многочисленных исследований, ассоциируется с увеличением риска сердечно-сосудистых заболеваний. Известно, что увеличение данного показателя всего на 0,1 мм повышает риск развития инфаркта миокарда на 11%, причем значение толщины КИМ более 0,9 мм как медиана показателя в группе гипогонадных пациентов свидетельствует о наличии доклинического атеросклероза [16]. То есть на фоне дефицита Т очевидно не только снижение сосудодвигательной функции эндотелия, но и структурные изменения средней оболочки сонной артерии, ассоциированные с увеличением риска сердечно-сосудистых заболеваний. Выявленные закономерности имеют особое значение для пациентов с СД2 и высоким кардиоваскулярным риском.
Традиционно при исследовании ЭЗВД изучаются ее пространственные характеристики, то есть прирост диаметра ПА в ходе теста реактивной гиперемии. В проведенном нами исследовании впервые было определено влияние дефицита Т не только на пространственные, но и на временные характеристики вазодилатации, то есть на то, как быстро развивается максимальная ЭЗВД ПА после декомпрессии. Детальное рассмотрение сосудодвигательной функции эндотелия привело к заключению, что гипогонадизм способствует снижению ЭЗВД на 29,8%, но особую важность имеют данные о временных характеристиках вазодилатации. Впервые нами было установлено, что дефицит Т замедляет время развития эндотелий-зависимой вазодилатации. Особую важность имеет тот факт, что нарушение именно временных характеристик ЭЗВД происходит задолго до клинических проявлений сердечно-сосудистых заболеваний и ухудшения ее пространственных параметров [15][17].
Объяснение этого феномена нужно искать в особенностях секреторной функции эндотелия, являющейся важнейшей составляющей его нормального функционирования. Для исследования нами были отобраны наиболее диагностически значимые молекулы, отражающие многочисленные функции эндотелия интимы сосудов: контроль сосудистого тонуса — эндотелин и NO; регуляция адгезивности сосудистой стенки — VCAM-1, ICAM-1, е- и р-селектины, кадгерин. Важнейшим и одним из наиболее изученных веществ, выделяемых эндотелием, является NO, который оказывает не только выраженное вазодилатирующее, но и вазопротекторное, антиагрегантное, противосвертывающее и противовоспалительное действия, в то же время поддерживает тонус сосудов и неадгезивность их внутренней поверхности [4][18]. Синтезируется NO ферментом NO-синтазой, которая представлена в эндотелии eNOS3. Активность фермента eNOS3, количество и скорость синтеза NO определяют благополучие эндотелия [18]. Проведенное нами исследование четко продемонстрировало выраженное снижение содержания как NO, так и eNOS3 у мужчин с гипогонадизмом, что свидетельствует об ослаблении механизмов эндотелиальной защиты и является патогенетической базой для нарушения вазодилятации. Физиологическим антагонистом NO в регуляции тонуса сосудов является эндотелин. Повышение его концентрации отмечено при ряде состояний, сопровождающихся ЭД, — инфаркте миокарда, легочной гипертензии, нарушениях ритма сердца. Однако в нашем исследовании содержание эндотелина в группах статистически значимо не различалось. Таким образом, можно утверждать, что дефицит Т приводит к значимому ослаблению вазодилататорных механизмов ЭД, существенно не влияя на вазоконстрикторные. Известно, что хроническая гипергликемия при СД2 снижает продукцию и биодоступность NO [2][3]. Недавно было описано снижение концентрации NO наряду со снижением репаративных возможностей эндотелия у лиц с гипогонадизмом [19], то есть можно считать, что дефицит Т в значительной степени усугубляет нарушение продукции NO, вызываемое глюкозотоксичностью.
Одним из ранних признаков поражения эндотелия является повышение адгезивности сосудистой стенки, обусловленной гиперпродукцией сывороточных молекул адгезии: сосудистой (VCAM-1) и межклеточной (ICAM -1), е- и р- селектинов, кадгерина. Усиление их экспрессии на поверхности эндотелиоцитов на ранних стадиях атерогенеза способствует адгезии лейкоцитов и субэндотелиальному проникновению липопротеидов, формирующих атеросклеротическую бляшку [4][20]. Нами было установлено, что у мужчин с гипогонадизмом повышены концентрации VCAM-1 на 32,5%, ICAM-1 — на 43,5%, р-селектина — на 19,3%, а кадгерина — в 6 раз по сравнению с пациентами с нормотестостеронемией. Экспрессия данных молекул адгезии, не синтезирующихся в нормальных условиях, является отражением активации эндотелия, возникающей на фоне хронической гипергликемии и глюкозотоксичности и усугубляемой дефицитом Т. Повышение адгезивности эндотелия способствует атерогенезу и прогрессии микро- и макрососудистых осложнений диабета, что особенно актуально у мужчин с СД2 в сочетании с гипогонадизмом.
Таким образом, можно утверждать, что дефицит Т приводит к ЭД за счет ослабления синтеза вазодилататоров и усиления адгезивности сосудистой стенки.
Ограничения исследования
Ограничением исследования является отсутствие расчета объема выборки. Все пациенты в исследовании имели диагноз СД2, что не позволяет экстраполировать полученные результаты на популяцию мужчин с дефицитом Т без нарушений углеводного обмена и требует дальнейшего проведения исследований.
Направления дальнейших исследований
В дальнейшем вызывают интерес изучение влияния заместительной терапии Т на функцию эндотелия у мужчин с СД2 и определение роли чувствительности андрогеновых рецепторов в реализации эффектов Т на эндотелий.
ЗАКЛЮЧЕНИЕ
На сегодняшний день известно, что смертность мужчин с СД2 в сочетании с гипогонадизмом от кардиоваскулярных заболеваний вдвое выше, чем у эугонадных пациентов, однако механизмы действия Т на сердечно-сосудистую систему до конца не изучены. Результаты проведенного нами исследования выявили нарушение функции эндотелия у мужчин с гипогонадизмом по сравнению с эугонадными пациентами, что проявляется в ослаблении ЭЗВД и замедлении ее развития, а также нарушении секреторной активности эндотелия — снижении синтеза NO и активации экспрессии молекул адгезии VCAM-1, ICAM-1, р-селектина и кадгерина. Нарушение сосудодвигательной функции эндотелия наряду с нарастанием адгезивности сосудистой стенки может являться универсальным патогенетическим механизмом развития сердечно-сосудистых заболеваний при гипогонадизме у мужчин с СД2.
У больных СД ИБС часто протекает в бесссимптомной форме. В задачи исследования не входрил поиск ССЗ при помощи дополнительных инструментальных исследований. Информацию о наличии/отсутствии ССЗ, сопутствующей терапии получали из доступной медицинской документации и со слов пациента.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена при поддержке Российского научного фонда, грант № 14-25-00052.
Конфликт интересов. Авторы статьи заявляют об отсутствии финансовой заинтересованности и других потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Хрипун И.А. — концепция и дизайн исследования, сбор и анализ результатов, написание текста; Воробьев С.В. — дизайн исследования, коррекция текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы выражают признательность всем членам научного коллектива, осуществлявшим работу по реализации гранта Российского научного фонда № 14-25-00052.
ИММУНОГИСТОХИМИЧЕСКИЕ ОСОБЕННОСТИ КОСТНОЙ ТКАНИ СТОПЫ У БОЛЬНЫХ ДИАБЕТИЧЕСКОЙ НЕЙРООСТЕОАРТРОПАТИЕЙ ПРИ САХАРНОМ ДИАБЕТЕ 2 ТИПА
Диабетическая нейроостеоартропатия (стопа Шарко, ДНОАП) — тяжелое осложнение сахарного диабета (СД), которое может привести к развитию грубых деформаций стопы, нарушению ее опороспособности, а также формированию трофических язв. Под ДНОАП понимают прогрессирующее деструктивное неинфекционное поражение костей и суставов на фоне неврологического дефицита.
Распространенность этого осложнения диабета, по данным различных литературных источников, составляет около 0,56% среди всех пациентов с СД [1]. Качество жизни у этой категории лиц значительно снижается, а риск смертности возрастает [2]. Патогенез ДНОАП полностью не изучен. Считается, что главную роль в ее развитии играют автономная и сенсомоторная полинейропатия, травмы, различные оперативные вмешательства. Остается дискутабельной роль конечных продуктов гликирования (КПГ) в развитии костно-суставных нарушений при СД. Имеются работы, которые демонстрируют существенное негативное влияние КПГ на развитие диабетических осложнений [3].
Оценка морфологических особенностей костной ткани нижних конечностей у пациентов с ДНОАП и без этого осложнения с целью более глубокого изучения его патофизиологических механизмов вызывает большой интерес у специалистов. Известно, что в результате неферментативной реакции между углеводами и свободными аминогруппами белков, нуклеиновых кислот и липидов образуются различные КПГ, которые влияют на свойства коллагена, формирующего костный матрикс [4].
На данный момент известно более 20 типов коллагена, однако к основным относятся I, II, III, V типы. Фибриллы, в состав которых входят коллагены I, II, III типов, составляют основу соединительной ткани организма (хрящи, кости, сухожилия). Коллаген I типа составляет до 90% органического матрикса и состоит из трех аминокислотных цепей, которые переплетены в виде спирали [5]. Его предшественником является проколлаген I типа, содержащий терминальные фрагменты С и N, при отщеплении которых образуется коллаген. Отделившиеся терминальные фрагменты попадают в межклеточную жидкость, а далее — в периферический кровоток. Диагностически ценным является N-терминальный пропептид проколлагена I типа (PINP), более стабильный в отличие от С-терминального фрагмента. Содержание PINP в костной ткани позволит оценить количество вновь синтезированного коллагена [6].
Избыточное накопление КПГ в волокнах коллагена делает данный белок более жестким и менее восприимчивым к протеолитическому расщеплению из-за образования неферментативных поперечных сшивок. У пациентов с СД механизм внутриклеточного протеолиза может нарушаться, что приводит к еще большему накоплению свободных продуктов гликирования. Они аккумулируются в зонах развития диабетической микроангиопатии: клубочках почек, периферических нервах, сетчатке глаза [7]. Циркулирующие КПГ соединяются с рецепторами (receptors for advanced glycatedend-products, или RAGE), которые являются трансмембранными гликопротеинами 1 типа, относящимися к семейству иммуноглобулинов. Под их влиянием в клетках активируется целый ряд сигнальных систем, ответственных за иммунные и воспалительные реакции, пролиферацию и клеточную миграцию [8].
Известно, что гипергликемия подавляет дифференцировку остеобластов и передачу сигналов, что может явиться одной из причин нарушения формирования кости [9]. Еще одно следствие хронической гипергликемии — неферментативное гликозилирование белков (например, коллагена) и других клеточных компонентов (например, ДНК), которые вместе именуются КПГ [10]. Различные КПГ и их рецепторы (RAGE) вовлечены в развитие осложнений диабета, включая поражение скелета стопы у лиц с нарушенным углеводным обменом.
В проведенном исследовании у пациентов с СД 1 типа (СД1) и переломами определялись более высокие уровни КПГ в сыворотке по сравнению с группой сравнения (СД1 без переломов) [11].
Коллаген III типа, фибриллообразующий коллаген, является основным компонентом внеклеточного матрикса во многих внутренних органах и коже. Он также экспрессируется остеобластами зрелой кости. Небольшое количество коллагена III типа также присутствует в коллаген I-содержащих фибриллах костей. Основная роль коллагена III типа в развитии скелета подтверждается его появлением в мезенхимальных конденсатах, предшествующих образованию хряща и кости, востребованностью в нем при ускорении роста остеобластов и его ролью в сохранении остеогенного потенциала мезенхимальных стволовых клеток [12].
Оценка морфологических особенностей костной ткани у пациентов с ДНОАП вызывает интерес в связи с прогрессивным ростом заболеваемости СД и, как следствие, его осложнений. Это позволит глубже изучить патофизиологические механизмы формирования ДНОАП и впоследствии снизить риск развития инвалидизации данной когорты пациентов.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить иммуногистохимические особенности костной ткани стопы у пациентов с СД 2 типа (СД2) и ДНОАП по сравнению с больными без данной костной патологии.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
ФГБУ «НМИЦ эндокринологии», отделение диабетической стопы, Первый МГМУ имени И.М. Сеченова Минздрава России (Сеченовский университет), кафедра патологической анатомии. Сбор материала проводился с октября 2019 по декабрь 2020 г.
Изучаемые популяции (одна или несколько)
В исследование включены 20 пациентов с СД2, которые были разделены на 2 группы. 1-ю группу составили больные СД2 с ДНОАП, 2-ю группу составили лица с СД2 без данного осложнения.
Критерии включения:
1. СД2;
2. возраст до 65 лет;
3. длительность СД2 менее 35 лет;
4. наличие ДНОАП (хроническая стадия).
Критерии невключения:
1. СД1;
2. наличие гиперпаратиреоза;
3. диабетическая нефропатия, хроническая болезнь почек 4–5-й ст.;
4. наличие острой стадии ДНОАП и остеомиелита (на основании данных анамнеза, клинической картины и результатов рентгенографии и МРТ).
В исследование были включены 20 пациентов. Первую группу составляли лица с СД2 и ДНОАП — 10 человек, 2-я группа (контрольная) была сформирована из пациентов с СД2 и нейропатической формой синдрома диабетической стопы без ДНОАП — 10 человек. Все пациенты были госпитализированы в клинику ФГБУ «НМИЦ эндокринологии» Минздрава России в плановом порядке для проведения хирургического лечения по поводу выраженной деформации стопы, обусловленной хронической стадией ДНОАП, или нейропатической формы синдрома диабетической стопы.
Диагностика хронической стадии нейроостеоартропатии основывалась на оценке состояния периферической иннервации (определение периферической чувствительности и сухожильных рефлексов по стандартной методике), оценке рентгенологической и МРТ-картины (отсутствие очагов остеолиза и отека костного мозга). Раневые дефекты у больных этой группы отсутствовали.
Диагноз нейропатической формы синдрома диабетической стопы у пациентов 2-й группы базировался на клинической картине (наличие длительно незаживающего раневого дефекта плантарной поверхности, Wagner 2–3), результатах оценки артериального кровотока (дуплексное сканирование артерий нижних конечностей) и периферической иннервации, данных рентгенографического исследования (отсутствие остеолиза).
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборка формировалась путем сплошного включения наблюдений, другая — подбором пар к наблюдениям первой выборки.
Дизайн исследования
Работа выполнена в дизайне наблюдательного одноцентрового одномоментного контролируемого нерандомизированного исследования.
Для морфологического исследования использовали следующий биопсийный материал:
- фрагменты плюсневых и кубовидных костей от 10 пациентов с хронической стадией стопы Шарко;
- фрагменты плюсневых и кубовидных костей от 10 пациентов с СД без стопы Шарко (контрольная группа).
Описание медицинского вмешательства (для интервенционных исследований)
Пациентам в ходе оперативного вмешательства (в 1-й группе — реконструктивные операции по коррекции деформации стопы, во 2-й группе — в ходе хирургической обработки хронического раневого дефекта) производился забор интактного костного фрагмента объемом около 1 см3. Наличие остеомиелита в образце кости было исключено как клинически (в ходе операции выполнялся забор интактной кости, не имеющей связи с раневым дефектом), так и морфологически в ходе гистологического и иммуногистохимического исследования.
Методы
Материал фиксировали в 10% растворе формалина. Морфологический анализ костной ткани включал гистологическое исследование биоптатов костной ткани.
Для светооптического изучения образцы кости фиксировали в 2% растворе глутарового альдегида на 0,13 М какодилатном буфере и декальцинировали в смеси Na2-ЭДТА и 2% глутарового альдегида на том же буфере. Материал заключали в парафин. Проводили гистологическую оценку соотношения клеток костной ткани (остеобластов, остеокластов и остеоцитов) и их функционального состояния. Для этого готовили парафиновые срезы толщиной 5 мкм и окрашивали гематоксилином и эозином по стандартной методике. Количественное соотношение клеток считали с помощью окулярной сетки Г.Г. Автандилова. При оценке состояния волокнистых структур учитывали их толщину, направленность и целостность, являющиеся морфологическими критериями их зрелости. Определяли преимущественный тип костной резорбции.
Иммуногистохимическое (ИГХ) исследование проведено на иммуностейнере Leica BOND-MAX (Германия) по стандартному протоколу. В качестве первичных антител для ИГХ-исследования использовались кроличьи поликлональные антитела к специфичному рецептору конечных продуктов гликирования (RAGE) (титр разведения 1:50, Cloud-Clone Corp., США), мышиные моноклональные антитела к PINP-терминальному пропептиду проколлагена I типа (клон C6, титр разведения 1:100, Cloud-Clone Corp., США) и PIIINP-терминальному пропептиду проколлагена III типа (клон H10, титр разведения 1:100, Cloud-Clone Corp., США). При выполнении ИГХ-исследования одновременно с основными реакциями ставились позитивные и негативные контрольные реакции.
Исследование и фотографирование гистологических и ИГХ-микропрепаратов проводилось на микроскопе Olympus BX46 кафедры патологической анатомии (зав. каф. — проф. Коган Е.А.).
Оценка экспрессии маркеров осуществлялась полуколичественным методом с помощью балльной оценки, где 1 «+» — слабо выражено, 2«+» — умеренно выражено, 3 «+» — сильно выражено, 4 «+» — очень сильно выражено.
Статистический анализ
Полученные в ходе проведения исследования результаты ИГХ-исследований обрабатывались методами описательной статистики (средние значения, стандартные ошибки средних, медианы, моды, стандартные отклонения). Значимость различий средних оценивалась при помощи непараметрического Т-критерия Уилкоксона. Различия считались значимыми при p<0,05.
Этическая экспертиза
Локальный этический комитет при ФГБУ «НМИЦ эндокринологии» МЗ РФ постановил одобрить возможность проведения данной научно-исследовательской работы, протокол № 2 от 31.01.2018 г. Всеми пациентами подписаны информированные согласия на участие в исследовании.
РЕЗУЛЬТАТЫ
Исследуемые группы пациентов с СД2 (1-я группа — 10 человек, 2-я группа — 10 человек) были сопоставимы по половозрастным характеристикам, длительности диабета и уровню его контроля.
В табл. 1 представлена клинико-лабораторная характеристика обследованных больных.
Таблица 1. Клинико-лабораторная характеристика обследованных пациентов (n=20)
Показатель | Группа 1 (n=10) | Группа 2 (n=10) |
Возраст, лет, Me [ 25; 75] | 54 [ 49; 64] | 62 [ 56; 69] |
Пол, м/ж | 4/6 | 6/4 |
Длительность течения СД2, лет Me [ 25; 75] | 16 [ 9; 25] | 13 [ 9; 25] |
Дистальная диабетическая полинейропатия (n): Нет Есть | 0 10 | 0 10 |
Диабетическая ретинопатия (n) Отсутствует Непролиферативная Препролиферативная Пролиферативная | 0 3 2 5 | 3 4 1 2 |
Диабетическая нефропатия, ХБП, стадия (n) С1 С2 С3а С3б | 6 1 1 2 | 6 2 1 1 |
HbA1c, %, Me [ 25; 75] | 9,0 [ 7,2; 10,0] | 7.8 [ 6,9; 9,8] |
хс-ЛПНП, моль/л, Me [ 25; 75] | 3,0 [ 2,4; 3,6] | 3,2 [ 1,1; 6] |
Гемоглобин, г/л, Me [ 25; 75] | 120,5 [ 110; 126] | 137 [ 84; 186] |
Лейкоциты, 109/л, Me [ 25; 75] | 5,8 [ 5,5; 8,7] | 7,4 [ 4,7; 11,7] |
СОЭ, мм/ч, Me [ 25; 75] | 33,5 [ 27; 39] | 22,7 [ 2; 88] |
рСКФ (MDRD), мл/мин/1,73 м2, Me [ 25; 75] | 94 [ 71,6; 95] | 75,0 [ 62,0; 86,0] |
Кальций общ., ммоль/л Me, [ 25; 75] | 2,2 [ 2,2; 2,3] | 2,39 [ 2,3; 2,45] |
Хронические раны стоп (%) | 0 | 100 |
Примечания: группы были сопоставимы по перечисленным характеристикам (p>0,05). СД — сахарный диабет; ХБП — хроническая болезнь почек; хс-ЛПНП — холестерин липопротеинов низкой плотности; рСКФ — расчетная скорость клубочковой фильтрации; СОЭ — скорость оседания эритроцитов. p-value > 0,05
При лабораторном исследовании у пациентов как 1-й, так и 2-й группы признаков системного воспаления выявлено не было.
Микроскопическое исследование.
В биоптатах ткани пациентов с ДНОАП имелась костная и костномозговая ткань. В костной ткани — поля остеолизиса кости с врастанием в очаги разрушения грануляционной ткани с гиалинозом стенок микрососудов и набуханием эндотелия. Грануляционная ткань содержала выраженные воспалительные инфильтраты и склеротические изменения. В очагах остеолизиса обнаруживалось большое количество остеокластов (рис. 1А). В биоптатах пациентов контрольной группы также выявлялись фрагменты костной и костномозговой ткани без патологических изменений (рис. 1, Б).

Рисунок 1. Гистологическая картина костной ткани при диабетической нейроостеоартропатии: А — поля остеолизиса кости с врастанием в очаги разрушения грануляционной ткани с гиалинозом стенок микрососудов и набуханием эндотелия. Грануляционная ткань содержит выраженные воспалительные инфильтраты и склеротические изменения. В очагах остеолизиса обнаруживается большое количество остеокластов; Б — костная ткань без патологических изменений пациентов с сахарным диабетом (контроль).
Иммуногистохимическое исследование
PINP, PIIINP и КПГ обнаруживались в биоптатах ткани пациентов с ДНОАП, цитоплазме фибробластических элементов и клеток воспалительного инфильтрата грануляционной ткани, а также остеокластов в виде коричневой окраски цитоплазмы (рис. 2А, 3А, 4А).
В контрольной группе PINP, PIIINP и КПГ располагались в цитоплазме отдельных остеобластов и клетках костномозговой ткани, имеющих коричневое окрашивание цитоплазмы (рис. 2Б, 3Б, 4Б).
В ходе ИГХ-исследования было зафиксировано значимое увеличение относительного содержания рецепторов к PINP, PIIINP и КПГ в группе пациентов с ДНОАП по сравнению с группой контроля (p<0,05) (рис. 5).
Рисунок 2. Иммуногистохимическая картина экспрессии PINP в костной ткани: А — высокая экспрессия маркера в фибробластических элементах и клетках воспалительного инфильтрата грануляционной ткани, а также в остеокластах у пациентов с диабетической нейроостеоартропатией; Б — слабая экспрессия маркера в отдельных остеобластах и клетках костного мозга у пациентов контрольной группы.
Рисунок 3. Иммуногистохимическая картина экспрессии PIIINP в костной ткани: А — высокая экспрессия маркера в фибробластических элементах и клетках воспалительного инфильтрата грануляционной ткани, а также в остеокластах у пациентов с диабетической нейроостеоартропатией; Б — слабая экспрессия маркера в отдельных остеобластах и клетках костного мозга у пациентов контрольной группы.
Рисунок 4. Иммуногистохимическая картина экспрессии рецепторов КПГ в костной ткани. А — умеренная экспрессия маркера в фибробластических элементах и клетках воспалительного инфильтрата грануляционной ткани, а также в остеокластах у пациентов с диабетической нейроостеоартропатией; Б — слабая экспрессия маркера в отдельных остеобластах и клетках костного мозга у пациентов контрольной группы.

Рисунок 5. Иммуногистохимическая характеристика PINP, PIIINP и КПГ в биоптатах костной ткани при диабетической нейроостеоартропатии (стопа Шарко) и без нее (контроль).
Полученные морфологические и ИГХ-результаты исследования свидетельствуют о патологии коллагенообразования и, как следствие, о нарушении формирования и резорбции кости у пациентов с ДНОАП.
ОБСУЖДЕНИЕ
Репрезентативность выборок
ДНОАП — достаточно редкое осложнение СД, его распространенность, по данным различных литературных источников, колеблется от 0,16 до 18% среди всех пациентов с СД.
В исследование были включены пациенты, проходившие лечение в специализированном отделении диабетической стопы ФГБУ «НМИЦ эндокринологии».
Выборка репрезентативна, а полученные данные могут быть экстраполированы на общую популяцию.
Сопоставление с другими публикациями
Сопоставление с данными литературы затруднительно ввиду их отсутствия.
Полученные результаты исследования ИГХ-особенностей костного метаболизма у пациентов с СД2 и ДНОАП выполнены впервые.
Интересно, что в группе с ДНОАП определялась более активная экспрессия коллагенов I и III типов, в отличие от группы контроля.
На рис. 1–4 представлена ИГХ-картина биоптатов костных фрагментов у лиц с ДНОАП и группы контроля.
Таким образом, можно предположить, что активная перманентная травматизация и усиленный кровоток вызывают нарушение выработки и формирования коллагенов и интенсификации костного ремоделирования, что приводит к формированию ДНОАП.
Кроме того, в исследовании зафиксировано избыточное накопление КПГ в группе со стопой Шарко. Это может провоцировать дисбаланс формирования и резорбции кости у лиц с СД2 и служить прогностическим маркером формирования ДНОАП.
В исследовании D. Farlay и соавт. было отмечено, что пациенты с СД1 и повышенными значениями КПГ сыворотки крови имели более высокие риски переломов, чем пациенты с нормальными значениями КПГ крови [11].
Ввиду отсутствия морфологических исследований оценки накопления КПГ в костной ткани сопоставить полученные результаты с данными литературы не представляется возможным.
Клиническая значимость результатов
Полученные данные о повышении экспрессии PINP и PIIINP подтверждают предположение, что нарушение синтеза коллагена при СД2 может служить причиной формирования ДНОАП.
Кроме того, можно предположить, что повышенная экспрессия рецепторов КПГ у лиц с ДНОАП может быть следствием генетической детерминированности и являться прогностическим маркером формирования ДНОАП у лиц с СД2.
Ограничения исследования
Данное исследование было пилотным. Относительно невысокая распространенность ДНОАП ограничивает включение большого количества пациентов и формирование большей выборки. Требуется проведение дальнейших исследований на большей выборке.
Для определения прогностической значимости выявленных маркеров ДНОАП следует провести корреляцию с уровнями данных маркеров в сыворотке крови.
Направления дальнейших исследований
Следующим этапом исследования будет являться определение и изучение корреляций уровней PINP, PIIINP и КПГ в сыворотке крови и данных ИГХ-исследования.
ЗАКЛЮЧЕНИЕ
Впервые проведено ИГХ-исследование маркеров костной резорбции и КПГ у лиц с ДНОАП. Полученные результаты свидетельствуют о нарушении коллагенообразования и, как следствие, о нарушении формирования и резорбции кости у пациентов с СД2 и ДНОАП: в группе 1 выявлено статистически значимое повышение экспрессии рецепторов PINP, PIIINP и КПГ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено в рамках НИР «Иммунологические, биохимические и гуморальные факторы и их роль в терапевтическом прогнозе при сахарном диабете 2 типа».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Токмакова А.Ю. — разработка дизайна исследования, написание статьи; Коган Е.А. — разработка дизайна исследования, проведение морфологического и ИГХ-исследования, микрофотографирование препаратов, написание статьи; Демура С.А. — проведение морфологического и ИГХ-исследования, написание статьи; Жарков Н.В. — проведение ИГХ-реакций, статистика, написание статьи; Зайцева Е.Л. — сбор клинического материала, его анализ, написание статьи; Каландия М.М. — сбор клинического материала, его анализ, написание статьи; Галстян Г.Р. — разработка дизайна исследования, написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Благодарности. Авторы выражают благодарность сотрудникам отделения диабетической стопы ФГБУ «НМИЦ эндокринологии» Минздрава России, врачам-лаборантам и сотрудникам кафедры патологической анатомии ПМГМУ им. Сеченова (Сеченовский университет) за помощь в подготовке и получении результатов для данной публикации.
ФИЗИЧЕСКАЯ АКТИВНОСТЬ И РИСК САХАРНОГО ДИАБЕТА 2 ТИПА В ПОПУЛЯЦИИ УДУПИ (ИНДИЯ)
According to International Diabetes Federation (IDF), it has been reported that globally 415 million adults have type 2 Diabetes Mellitus (T2DM) and expected to rise upto 642 million by 2040. It has been reported that roughly 75% of adults with T2DM subsist in low and middle-income countries. In India 69.2 million adults are living with T2DM. [1] According to World Health Organization (WHO) report more than 19% of the total population diagnosed for T2DM resides in India.[2] In Costal Karnataka 16% of the population were found to have T2DM.[3]
More than 50% of the population with T2DM in rural India is oblivious about the critical outcome of the disease [4][5], which is an additional cause for exponential growth in the burden of the disease. Early identification and optimization of therapy may pick up results in patients with T2DM. In Southeast Asia T2DM likely stem from lifestyles marked by over-consumption, lack of physical activity, excess stress, overweight, and obesity.[6] It was reviewed that with the steady migration from rural to urban areas, ascend in socio-economic standard, and consequent changes in lifestyle are all upsetting the state of T2DM in India.[7]
There are potential strategies to find out the possible risk for the T2DM and the purpose of which is to identify asymptomatic individuals. Risk factor approach can be looked forward as an aggressive identification for planning prevention strategies and even for early diagnosis.[8] The Indian Diabetes Risk Score (IDRS), a simple screening tool was developed at the Madras Diabetes Research Foundation (MDRF), Chennai by Dr. Mohan and colleagues for prediction of undiagnosed diabetes.[9] The MDRF-IDRS formed a scoring system of 0 to 100 with a score of ≥60 had an optimum sensitivity (72.5%) and specificity (60.1%) for determining undiagnosed diabetes with the Area Under the Curve (AUC) for the Receivers Operating Characteristics (ROC) curve of 0.698.[10] This risk score was derived using four simple variables which included two modifiable and two non-modifiable risk factors namely age, family history, physical activity and waist circumference.
Physical inactivity is measured as the fourth leading risk for global mortality, causing an estimated 3.2 million deaths globally.[11] Large clinical trials have shown that increased physical activity reduces the risk of developing T2DM by 15–60%. Studies have been done to find the risk score in the coastal areas of Karnataka. However, screening of Udupi population was not carried out. Thus, this study aims at finding out the risk for T2DM using IDRS and physical activity levels in Udupi population.
MATERIAL & METHODS
The study was initiated after the approval from institutional ethics committee (IEC) conducted at diabetic clinic, Department of Physiotherapy, Kasturba Hospital, Manipal, Dr. TMA Pai Hospital, Udupi, community centers in Udupi and various Health check-up camps. The study was approved by the Institutional Ethics Committee, Kasturba Hospital, Manipal, Karnataka, India. The convenient study sampling design was used.
In the current study, we included asymptomatic and undiagnosed participants for T2DM whose age ranged between 30yrs–65yrs. Participants with the history of any previous neurological conditions and were pregnant at the time of assessment were excluded. Participants were explained the purpose of the study by principal investigator, those who were willing to take part in the study, written informed consent was obtained. RBS was measured using Accu-check Performa nano-glucometer. Blood pressure was measured in high sitting position, with back straight, feet touching the ground and arm at the level of heart stabilized on hard surface using digital sphygmomanometer Omron (HEM-7121). Both glucometer and digital sphygmomanometer were calibrated periodically.
Along with demographic details of the participants’ anthropometric measurements like height, weight, waist circumference was noted. Height was measured stadiometer and weight was measured using health sense personal scale (PS 130). Waist circumference was measured using an inch tape in horizontal plane, at the level of iliac crest at the end of normal expiration.
Risk for the development of diabetes mellitus was assessed using the IDRS and the participants were categorized as high risk if the score ≥60, moderate risk score 30–50 and low risk score <30. The participants level of physical activity was assessed using GPAQ questionnaire, and the overall energy expenditure using GPAQ data was calculated in the form of MET minute/wk. level of physical activity was further classified based on MET minute/week into four groups as Sedentary (0–600 MET-min/wk), minimally active (600–1200 MET-min/wk), active (1200–6000 MET-min/wk) and highly active (≥6000 MET-min/wk).
Data was analyzed using Statistical Package for the Social Sciences (SPSS) version 15. A test for normality was done. Normally distributed data were represented as a mean and standard deviation. The level of significance was kept at p≤0.05.
RESULTS
A total of 27,000 participants were screened, based on inclusion and exclusion criteria 23,960 participants were included in the study. The average age of the participants was 49.06 ± 14.44, the mean body mass index (BMI) was 28.8 kg/m². The demographic characteristics of the study participants are mentioned in table 1. The average RBS, BP and IDRS score is mentioned in table 2.
In the present study, the risk stratification for the development of type 2 diabetes was done based on IDRS under which 6.9% were under lower risk category, 24.9% were under moderate risk category, and 68.2% were under higher risk category table 3. Using GPAQ, level of physical activity was estimated of the study participants. Based on MET value participants were classified as sedentary, minimally active, very active and highly active. 14% of the participants were under sedentary lifestyle category, 27.6% participants were minimally active, 53.7% participants were very active, and 4.6% were highly active. 8.0% of the participants below 35 yrs of age, 15.5% participants between 35–49 yrs and 18.1% participants above 49 years fall under sedentary and minimally active PA levels and 7.8% and 14.7% of the male participants and 6.2%, and 12.9% of the female participants fall under sedentary and minimally active level of physical activity category respectively table 4. Significant correlation was found between IDRS score and level of physical activity Rs 0.04 table 5.
Table 1: Demographic characteristics of the participants (n=23,960)
Variable | Mean ± SD |
Age, yrs | 49.06 ± 14.44 |
Weight, kg | 57.11 ± 63.23 |
BMI, kg/m2 | 28.80 ± 1.26 |
Table 2: Parameters of the study participants
Variable | Mean ± SD |
RBS, mg % | 114.87 ± 41.81 |
Systolic blood pressure, mm Hg | 126.23 ± 24.4 |
Diastolic blood pressure, mm Hg | 94.71 ± 16.5 |
IDRS score | 66 ± 24 |
Table 3: Risk for development of type 2 diabetes mellitus based on The Indian Diabetes Risk Score
Risk | IDRS range | Percentage value | ||
Low risk | score | <30 | 6.9% | |
Moderate risk | 30–50 | 24.9% | ||
High risk | >60 | 68.2% | ||
Table 4: Risk stratification and physical activity profile of the participants
PA level | IDRS Categorization | |||
Low risk | Moderate risk | High risk | Total | |
Sedentary & minimum active, | 1.8 | 18.6 | 23.3 | 41.7 |
Very active & highly active, | 4.1 | 28.6 | 25.7 | 58.3 |
Table 5: Association between risk stratification and physical activity profile
Variable | Mean | p value |
IDRS and PA levels | 6.109 | 0.047 |
DISCUSSION
Simplified Indian diabetes risk Score is a tool that can be used for identifying the risk of T2DM in future. It includes both the modifiable and non-modifiable risk factors which contribute to predicting the risk of T2DM. In the present study, we have used simplified Indian diabetes risk Score for identifying newly detected high-risk participants in the Udupi population.
In the current study, based on IDRS risk stratification 68.2% participants have a higher risk of developing T2DM in Udupi population. Similar findings were reported in the study conducted in urban Pondicherry, [12] urban slum in Pune [13] and the rural areas of Tamil Nadu [14] with 31.2%, 36.55% and 18.66% of the population having a higher risk score respectively. The difference in the risk prevalence between the current study and the one with Pondicherry and Pune may be due to lifestyle and environmental variation and dietary modification of the population.
A study conducted in Southern Indian population in coastal Karnataka found out that using an IDRS score, 62.2% of people living with undiagnosed diabetes in that population could be detected with a specificity of 73.7%.[15] A similar study was conducted using IDRS to Distinguish T2DM from Non-T2DM in which an IDRS of less than 60 was optimal for identifying non-T2DM and ≥60 for identifying T2DM with a sensitivity and specificity of 79.9% and 83.8%.[16] A study was done in Srilanka using IDRS to screen undiagnosed diabetes wherein the study concluded the screening tool as a simple, low-cost and a non-invasive tool for stepwise community level screening.[17]
PA has beneficial effects on glucose metabolism with an increase in PA levels there can be an increase in peripheral insulin sensitivity which in turn increases muscle glucose uptake. In the present study, 14% and 27.6% of the participants fall under sedentary and minimally active PA levels of which 7.8% and 14.7% of the male participants and 6.2% and 12.9% of the female participants fall under the same PA levels. A similar study was performed which found that physical inactivity was 67.3% and 71.0% for males and females, but the study included young population. [18]
In a meta-analysis which included low versus high PA, leisure time activity, occupational activity, walking and cardiorespiratory fitness, showed a significant statistical reduction in most of the activities and these were associated with 25–40% reduction in the relative risk of T2DM, while walking, occupational activity and cardiorespiratory fitness was associated with 15%, 15% and 55% decrease in the relative risk of T2DM, respectively. Besides, participants with increased PA levels or those into high PA levels over time had a 36% and 41% and subsequently had a lower risk of T2DM. [19] Lower PA levels in the present study can be associated with other risk factors, including BMI and the waist circumference on the higher side and participants above 49 years of age were minimally active in most of the PA domains including occupational PA or recreational PA thus showed more of a sedentary lifestyle.
CONCLUSION
The present study concludes that based on IDRS risk stratification 68.2% participants have a higher risk of developing T2DM in future. Regarding physical activity levels, 14% and 27.6% of the participants included in the study falls under sedentary and minimally active.
ACKNOWLEDGEMENT
We would like to acknowledge World Diabetes Foundation ‘Diabetic Foot Care: Stepping Ahead’ — WDF: 15–941.
We would like to acknowledge Centre for Diabetic Foot Care and Research.
Conflict of interest: All the authors declare that there is no potential conflict of interest present in this study.
РОЛЬ КОНЕЧНЫХ ПРОДУКТОВ ГЛИКИРОВАНИЯ В ПАТОГЕНЕЗЕ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ
Диабетическая нефропатия (ДН) является ведущей причиной развития терминальной cтадии почечной недостаточности (ТПН) и вносит несомненный вклад в сердечно-сосудистую смертность пациентов с сахарным диабетом (СД). Основным механизмом развития микрососудистых осложнений СД является гипергликемия, запускающая целый ряд патологических процессов, приводящих в конечном итоге к структурным и функциональным нарушениям почек. Под воздействием высокого уровня гликемии в организме происходит образование конечных продуктов гликирования (AGE) (advanced glycation end products). AGE — гетерогенная группа соединений, образующихся в результате необратимой неферментативной реакции, известной как гликирование, между редуцирующими углеводами и свободными аминогруппами белков, липидов, нуклеиновых кислот [1][2]. Ограниченное образование AGE является частью нормального метаболизма, однако возникающее при определенных условиях избыточное накопление этих гликотоксинов имеет негативные последствия [3][4].
ПРОЦЕСС ОБРАЗОВАНИЯ AGE
Гликирование белков — процесс, известный как реакция Майяра. Эта реакция названа в честь французского врача и химика Луи Камиля Майяра, который впервые описал образование коричнево окрашенных соединений в ходе реакции между глюкозой и аминокислотами в начале 1900-х гг. [5]. Реакция Майяра протекает в несколько этапов. Первоначально глюкоза (или другие редуцирующие углеводы, такие как фруктоза, пентоза, галактоза, манноза, ксилулоза) реагирует со свободной аминогруппой аминокислот с образованием нестабильного соединения — основания Шиффа. Основание Шиффа (альдимин) претерпевает спонтанные перестройки с образованием относительно стабильного кетоамина (1-амино-1-дезокси-2-кетоза) — соединения Амадори [6]. Дальнейшая деградация этих ранних продуктов гликирования приводит к гетерогенной группе необратимых соединений — AGE (рис. 1, А).
Помимо этого, в ходе реакции Майяра происходит образование промежуточных соединений, таких как глиоксаль, метилглиоксаль и 3-дезоксиглюкозон, которые могут образовываться как в результате аутоокисления моносахаридов (например, глюкоза: реакция Вольфа) [7], так и в результате перегруппировки основания Шиффа (реакция Намики) [8] или соединения Амадори (реакция Ходжа) [9]. Также они могут образоваться и в результате катаболизма кетоновых тел или окисления липидов. Эти высокореакционноспособные промежуточные соединения могут вступать в реакцию со свободными аминогруппами с образованием AGE (рис. 1, Б).

Рисунок 1. Механизм образования конечных продуктов гликирования (AGE).
А — классическая реакция образования AGE (реакция Майяра); Б — реакции образования AGE вследствие преобразования промежуточных соединений, образующихся в ходе реакции Майяра. Адаптировано из [1].
Для образования оснований Шиффа может потребоваться от нескольких часов до нескольких дней, в то время как образование соединений Амадори и AGE занимает от нескольких дней до нескольких лет, что является отражением длительного воздействия гипергликемии и подтверждает участие этих соединений в формировании феномена «метаболической памяти», cуть которого заключается во влиянии предсуществующего контроля гликемии на развитие и прогрессирование сосудистых осложнений СД [10][11].
Гликирование белков представляет собой многоэтапный процесс, который в конечном итоге приводит к модификациям структуры белков и топологии молекулярной поверхности, что может влиять на биохимические свойства измененных молекул [12]. Поскольку гликируются свободные аминогруппы, потенциально любой белок может быть подвержен этому процессу, и, следовательно, накопление гликотоксинов может происходить в различных тканях организма [13]. AGE, как cвободные, так и связанные с белками, обнаруживаются в плазме, кровеносных сосудах, хрусталике глаза, сетчатке и тканях почки. Описано не менее 20 различных AGE, из них N-карбоксиметиллизин, пентозидин и гидроимидазолоны являются относительно инертными и выступают в качестве биомаркеров содержания AGE в тканях [10][13]. Накапливаясь в тканях, изменяя структуру белков и запуская развитие патологических реакций, эти соединения служат одними из основных факторов развития таких заболеваний, как катаракта [14], атеросклероз [15], ДН [16], и нейродегенеративных заболеваний, включая болезнь Альцгеймера [17][18].
РОЛЬ AGE В РАЗВИТИИ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ
Особый интерес вызывает роль AGE в развитии и прогрессировании ДН. В условиях прогрессивного снижения почечной функции, помимо длительно персистирующей гипергликемии, открывается ряд дополнительных факторов, способствующих накоплению и образованию AGE, в результате чего концентрация AGE увеличивается их концентрация и усиливается воздействие на органы и ткани [19]. Так, T. Miyata и соавт. описали роль реактивных карбонильных соединений в качестве фактора, способствующего формированию AGE у пациентов с уремией, независимо от гипергликемии [4]. Еще одним возможным объяснением такого повышения AGE в условиях хронической болезни почек (ХБП) может служить и тот факт, что по мере прогрессирующего снижения скорости клубочковой фильтрации (СКФ) уменьшается выведение образующихся AGE с мочой, что в конечном итоге способствует еще большему накоплению как циркулирующих AGE, так и AGE в тканях. В качестве подтверждающего это факта в исследовании Z. Makita и соавт. показано, что у пациентов с ТПН уровень AGE в тканях в два раза выше, чем у пациентов с удовлетворительной функцией почек [20]. У пациентов с ТПН, длительно получающих гемодиализ (ГД), также повышено формирование AGE [22] ввиду высокого уровня окислительного стресса из-за усиленного образования свободных радикалов, а также снижения уровня антиоксидантов, что в целом характерно и для додиализных стадий ХБП [21].
В результате патологического воздействия высокого уровня AGE в организме запускается целый ряд процессов, включая воспалительные и профибротические изменения, которые являются значимыми факторами риска как дальнейшего прогрессирования ДН, так и повышения сердечно-сосудистого риска и смертности у пациентов с ХБП [23].
Поражение почек у больных СД характеризуется как гемодинамическими (гиперфильтрация), так и структурными нарушениями (гломерулосклероз, интерстициальный фиброз, утолщение гломерулярной базальной мембраны (ГБМ), уменьшение количества подоцитов в клубочке (подоцитопения), структурно-функциональные изменения подоцитов (подоцитопатия), увеличение мезангиального матрикса). Непосредственная роль AGE в патогенезе повреждения почек при СД была подтверждена исследованием на здоровых крысах, без нарушений углеводного обмена, которым вводили гликированный альбумин посредством внутривенной инфузии в течение нескольких месяцев, что приводило к развитию очагового гломерулосклероза, увеличению мезангиального матрикса и альбуминурии — признакам, характерным для ДН [24]. Подобный результат был получен в другом эксперименте, в котором введение гликированного альбумина здоровым мышам в течение 4 нед приводило к гипертрофии клубочков и избыточной экспрессии генов коллагена IV типа, ламинина, а также трансформирующего фактора роста бета (TGFβ) и других факторов, способствующих активации воспаления и, в конечном итоге, развитию фиброза в тканях почки [25].
Таким образом, экспериментально доказано, что AGE вызывают структурные изменения почек, приводящие к прогрессированию ХБП, и это, в свою очередь, обуславливает последующее увеличение концентрации AGE, создавая тем самым «порочный круг».
УЧАСТИЕ AGE В МОДИФИКАЦИИ ТКАНЕЙ ПОЧКИ
Одним из механизмов, посредством которых AGE вносит свой вклад в развитие ДН, является модификация белков внеклеточного матрикса. Из матриксных белков, подвергнутых гликированию, наиболее широко изучены коллаген и ламинин. Гликирование коллагена приводит не только к уменьшению его гибкости и растворимости, но и к изменению профиля заряда мономеров коллагена, что нарушает их агрегацию в волокна и влияет на архитектуру базальной мембраны нефронов, меняя ее конфигурацию. В дополнение к нарушению межмономерных взаимодействий гликирование коллагена влияет на его взаимодействие с другими компонентами внеклеточного матрикса, такими как протеогликаны, витронектин и ламинин [26].
Гликирование ламинина уменьшает его способность к полимеризации и связыванию с компонентами базальной мембраны, такими как гепарансульфат и коллаген [27].
Опосредованное влияние AGE на различные матриксные белки ухудшает их деградацию матриксными металлопротеиназами, способствуя утолщению базальной мембраны и расширению мезангия — характерным признакам ДН [28].
В патогенезе гломерулосклероза и тубулоинтерстициального фиброза при ДН важную роль играет индуцированная AGE экспрессия TGFβ как в подоцитах, так и в клетках проксимальных канальцев, что отражено в эксперименте F. Ziyadeh и соавт., в котором длительное лечение мышей с СД 2 типа (CД2) блокирующими антителами против TGFβ замедляло развитие гломерулосклероза, подоцитопении и, следовательно, предотвращало развитие почечной недостаточности [29].
В норме белки ГБМ отрицательно заряжены, однако их гликирование и накопление AGE во внеклеточном матриксе приводят к потере зарядоселективности базальных мембран клубочков, способствуя развитию и прогрессированию альбуминурии [30].
Все вышеперечисленные изменения в конечном итоге приводят к нарушению структурной и функциональной целостности фильтрационного аппарата почек, что способствует прогрессивно нарастающей альбуминурии, способствующей дальнейшему снижению почечной функции вплоть до развития ТПН.
РОЛЬ ВЗАИМОДЕЙСТВИЯ AGE С RAGE В РАЗВИТИИ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ
Еще одним путем реализации патологического воздействия AGE является результат его взаимодействия с RAGE (receptor for advanced glycation end products), который проявляется в активации различных сигнальных путей. RAGE — трансмембранный белок, который экспрессируется в большом количестве клеток, таких как макрофаги, эндотелиальные клетки, нейроны, а также канальцевые и клубочковые эпителиальные клетки в почках [1]. Поскольку накопление AGE и активация RAGE вызывают в том числе эпигенетические изменения, которые индуцируют экспрессию различных генов в клетках и активируют воспаление, повреждение тканей, предполагается, что ось AGE-RAGE играет центральную роль в феномене метаболической памяти, значение которого в прогрессировании и развитии диабетических осложнений подтверждено в исследовании DCCT/EDIC [28][31–34].
Связывание AGE с клеточным RAGE вызывает образование активных форм кислорода (reactive oxygen species, ROS) через активацию НАДФН-оксидазы, которая, в свою очередь, активирует ядерный фактор-каппа В (NF-kB), что приводит к увеличению экспрессии многочисленных провоспалительных генов, способствуя развитию и прогрессированию связанных с СД осложнений [35][36] (рис. 2).

Рисунок 2. Различные взаимодействия AGE и RAGE и обусловленные ими эффекты в отношении диабетической нефропатии (ДН): AGE — конечные продукты гликирования; RAGE — рецептор AGE; sRAGE — растворимый RAGE; другие рецепторы AGE: AGE-R1 — олигосахарилтрансфераза-48; AGE-R2 — 80 K-H фосфопротеин; AGE-R3 — галектин-3; EN-RAGE, также известный как S100A12 — лиганд RAGE; TGF-β1 — трансформирующий фактор роста-β1; ZEB2 (zinc finger E-box binding homeobox 2) — фактор транскрипции семейства «цинковых пальцев», управляющий эпителиально-мезенхимальным переходом; NF-kB — ядерный фактор-каппа В.
По мере развития и прогрессирования ДН экспрессия RAGE повышается. Подтверждением этого является эксперимент, в котором у мышей, трансгенных по RAGE, ДН быстро прогрессировала, что сопровождалось гипертрофией клубочков, экспансией мезангия, гломерулосклерозом и протеинурией [37].
ВЛИЯНИЕ AGE НА ПОДОЦИТЫ
Подоциты — высокоспециализированные эпителиальные клетки почечных клубочков, которые являются ключевым компонентом фильтрационного барьера почки. Исследования у людей и на животных моделях с СД показали, что начальные стадии альбуминурии связаны с подоцитопатией и подоцитопенией [38]. При биопсии почек у пациентов с ДН накопление AGE в основном обнаруживается в ГБМ, что активирует рецептор RAGE на подоцитах [39]. Механизм влияния AGE на подоциты до конца не изучен, но при этом повреждение подоцитов посредством AGE подтверждено в экспериментах на животных моделях [40]. В экспериментах на мышах без патологии почек также было показано, что активация оси AGE-RAGE приводит к NF-kB-индуцированному эпителиально-мезенхимальному переходу (ЭМП). ЭМП, как и обратный ему мезенхимально-эпителиальный переход, происходят в эмбриональном развитии и при различных патологических процессах. Подоциты развиваются из метанефрической мезенхимы путем трансдифференцировки мезенхимы в эпителий. ЭМП — процесс, при котором эпителиальные клетки утрачивают присущие им свойства и приобретают фенотип мезенхимальных клеток, что приводит к дисфункции этих клеток [41]. Вызывают интерес роль ЭМП и запускающие его пусковые механизмы в отношении подоцитов. Известно, что NF-kB активирует ZEB2 — фактор транскрипции, который управляет ЭМП путем подавления E-кадгерина (эпителиальный маркер) и активации N-кадгерина (мезенхимальный маркер) [42]. В исследовании было показано, что ЭМП подоцитов способствует их отделению от ГБМ, уменьшая количество подоцитов в клубочках, что экспериментально подтверждено у крыс с СД. Кроме того, ZEB2 подавляет экспрессию белка Р-кадгерина, который является компонентом щелевой диафрагмы клубочков. Как ЭМП, так и снижение экспрессии Р-кадгерина может способствовать развитию альбуминурии [42].
С другой стороны, культивируемые подоциты подвергаются апоптозу при воздействии TGFβ1, что также может выступать одним из механизмов потери подоцитов [43]. Помимо этого, в исследованиях не только на подоцитах клеточной культуры и мышиных моделях, но и на биоптатах тканей человека с ДН выявлено снижение экспрессии нейролептина-1 (NRP-1) AGE-модифицированным альбумином. Снижение уровня NRP-1 вызывает изменения белков цитоскелета, таких как α-актин, что пагубно влияет на структуру подоцитов и их функции [44].
Изменение количества и структуры подоцитов в конечном итоге способствует увеличению проницаемости фильтрационного барьера почек.
Протективная роль sRAGE и ассоциированные с этим перспективные новые маркеры осложнений СД.
Стоит отметить, что, помимо мембраносвязанной формы, существуют также другие формы рецептора RAGE, включая растворимую — sRAGE (soluble receptor for advanced glycation end-products), которая образуется в результате расщепления полноразмерного RAGE матриксными металлопротеиназами (MMP) и ADAM10 [45][46]. В результате расщепления sRAGE лишен трансмембранного домена и цитоплазматического хвоста, отвечающего за трансдукцию сигнала [1]. Вызывает интерес способность sRAGE конкурировать с RAGE за связывание с AGE, предотвращая тем самым их взаимодействие и возникающие вследствие активации оси AGE-RAGE неблагоприятные последствия, что оказывает тем самым протективный эффект в отношении органов-мишеней. Принимая это во внимание, возникает интерес в отношении sRAGE как возможного прогностического маркера. В ряде исследований более низкие уровни sRAGE в сыворотке крови по сравнению с контрольной здоровой группой были ассоциированы с воспалением, окислительным стрессом, атеросклерозом, сердечной недостаточностью и риском прогрессирования диабетических осложнений [47–49]. Однако в настоящее время отсутствуют данные о конкретных значениях sRAGE, которые могли бы являться клинически значимыми при каком-либо состоянии ввиду сложности интерпретации получаемых результатов.
У пациентов с ТПН уровень sRAGE выше по сравнению с лицами без заболеваний почек [50–52]. Предполагается, что более высокая концентрация sRAGE в плазме крови при ХБП, подобно AGE, ассоциирована со сниженным почечным клиренсом и уменьшением их выведения с мочой [53][54]. Другой возможной причиной может являться результат увеличения экспрессии мРНК RAGE вследствие высокого уровня циркулирующих AGE. Таким образом, учитывая, что sRAGE — расщепленная форма RAGE, концентрация sRAGE в плазме может коррелировать с количеством RAGE [55]. Корреляция повышения уровня sRAGE со степенью снижения СКФ также может отражать протективный ответ в отношении активации процессов воспаления, окислительного стресса и накопления уремических токсинов [56].
Однако возможный протективный эффект sRAGE в отношении ДН все еще остается спорным, поскольку, согласно результатам исследования M. Jenny и соавт., в котором проведена оценка уровней sRAGE у 3647 пациентов с СД 1 типа (СД1) с целью изучения ассоциации между sRAGE и ДН, высокие уровни sRAGE, напротив, отражали повышенный риск прогрессирующего снижения СКФ вплоть до развития ТПН [57].
Вероятно, это обусловлено тем, что при ХБП и СД повышены уровни как AGE, так и sRAGE, и при этом уровень AGE выше уровня sRAGE. В этой связи выдвинута гипотеза, что повышенное соотношение AGE/sRAGE, а не отдельные уровни AGE и sRAGE следует рассматривать как прогностически значимый маркер прогрессирования ассоциированных с СД состояний. Эта гипотеза нашла свое подтверждение в ряде исследований [58][59].
Таким образом, необходимы дальнейшие исследования, направленные на изучение соотношения AGE/sRAGE у пациентов с СД1 и ДН, чтобы прояснить несоответствие между высокой концентрацией sRAGE и продолжающимся прогрессированием ДН, несмотря на доказанное протективное действие sRAGE.
В то же время в отношении пациентов, находящихся на заместительной почечной терапии ГД или перитонеальным диализом (ПД), проведено исследование, согласно результатам которого выявлено, что более высокий уровень sRAGE коррелирует с повышением уровня BNP, что отражает потенциальную роль sRAGE как предиктора смертности у пациентов с ХБП С5Д и ремоделированием сердца. В этом же исследовании показано, что более высокий уровень sRAGE наблюдается у пациентов, находящихся на ГД, по сравнению с пациентами, получающими ПД, однако показатели смертности в группах пациентов не различались [60]. Полученные в этом исследовании данные относительно уровней sRAGE являются неоднозначными и свидетельствуют о необходимости дальнейшего накопления знаний в данной области.
ДРУГИЕ ВОЗМОЖНЫЕ МЕХАНИЗМЫ ПРОТЕКТИВНОГО ВОЗДЕЙСТВИЯ
С позиции потенциальной прогностической ценности интерес представляет работа I. Baragetti и соавт. относительно -374T/A RAGE полиморфизма, в которой было показано, что присутствие А-аллели у пациентов сопряжено с плохим прогнозом в отношении прогрессирования ХБП, тогда как Т-аллель имеет протективный характер в отношении снижения почечной функции [61].
Помимо RAGE, AGE также могут связываться с другими рецепторами, включая олигосахарилтрансферазу-48 (известную как AGE-R1), 80 K-H фосфопротеин (известный как AGE-R2), галектин-3 (известный как AGE-R3) (см. рис. 2). Интересен тот факт, что при ДН отмечается снижение экспрессии рецептора AGE-R1, который обладает протективным действием, поскольку его активация способствует выведению AGE. В эксперименте мыши, трансгенные по AGE-R1, оказались защищенными от развития ДН [62].
Взаимодействие AGE с AGE-R3 приводит к активации эндоцитоза AGE макрофагами [62]. Роль AGE-R3 подтверждена в эксперименте на мышах с диабетом, в котором у AGE-R3-дефицитных мышей выявлялись гломерулопатия, увеличение мезангиального матрикса и протеинурия [62]. Роль же AGE-R2 остается неизвестной, но, как предполагается, заключается в передаче различных внутриклеточных сигналов [63]. Таким образом, AGE-R1 и AGE-R3 участвуют в деградации AGE и снижении его уровня в организме.
В последнее время внимание научного сообщества привлекает циркулирующий лиганд RAGE S100A12, также известный как EN-RAGE. Взаимодействие этого лиганда с RAGE приводит к индуцированному воспалением повреждению эндотелия и миграции гладкомышечных клеток в стенках кровеносных сосудов, что в конечном итоге приводит к развитию атеросклероза и кальцификации атеросклеротических бляшек. Так, было обнаружено повышение уровня данного лиганда у пациентов с СД1, получающих ГД, причем его уровень был четко ассоциирован с сердечно-сосудистой смертностью [64]. Кроме того, было продемонстрировано, что повышение уровня EN-RAGE на величину 1 стандартного отклонения ассоциировано с повышением общего риска смертности на 32%, однако тот факт, что соотношение S100A12/sRAGE у диализных пациентов также оставалось повышенным, позволил авторам предположить, что потенциальная протективная роль sRAGE недостаточна для противодействия очевидным пагубным эффектам очень высокого уровня S100A12 [56]. В работе B. Choi и соавт. было показано, что S100A12 является фактором риска прогрессирования кальцификации брюшной аорты, в особенности у пациентов с СД на ГД [65], соответственно, может являться потенциальной терапевтической мишенью для уменьшения сосудистой кальцификации, как показано в экспериментах на животных [66].
ИЗВЕСТНЫЕ ВОЗМОЖНОСТИ МЕДИКАМЕНТОЗНОЙ И ТАРГЕТНОЙ ТЕРАПИЙ
Помимо благоприятного эффекта достижения и стойкого поддержания целевых значений гликемии в отношении уменьшения потенциально вредоносного эффекта гипергликемии, представляют интерес эффекты длительно используемых препаратов, назначаемых пациентам с СД.
Некоторые сахароснижающие препараты непосредственно ингибируют образование AGE, включая метформин и пиоглитазон, что отражено в исследованиях I. Kanazawa и соавт. и S. Rahbar и соавт., которые продемонстрировали снижение уровня пентозидина в сыворотке крови у пациентов с СД [67][68].
Кроме того, в исследовании S. Zhang и соавт. на клеточной культуре подоцитов показано, что глюкагоноподобный пептид-1 частично ингибирует апоптоз подоцитов, индуцированный AGE, вероятно, через уменьшение экспрессии RAGE и уровня окислительного стресса [69].
Основа нефропротекции, ингибиторы ангиотензинпревращающего фермента и блокаторы рецепторов ангиотензина, ослабляют продукцию реактивных карбонильных предшественников и накопление AGE у животных с СД [70].
Интересны эффекты гиполипидемической терапии — правастатин подавляет экспрессию RAGE, предотвращает апоптоз клеток канальцев, индуцированный AGE, таким образом защищая почки от тубулярного повреждения при ДН, регулирует уровень NO в клетках канальцев почки [71]. Аторвастатин в эксперименте ингибировал экспрессию RAGE, индуцированную AGE, у здоровых крыс [72]. Церивастатин предотвращал стимулированное AGE повышение экспрессии VEGF и NF-kB, воздействуя на процесс ангиогенеза [73].
У пациентов на ГД с вторичным гиперпаратиреозом, получавших лечение кальцитриолом, было обнаружено повышение уровня sRAGE и снижение уровня интерлейкина-6, что может отражать его противовоспалительный эффект в отношении патологических механизмов, запускаемых воздействием образующихся AGE [74]. Многообещающим в качестве возможного терапевтического препарата для снижения риска прогрессирования ДН является карбонат севеламера ввиду его выявленных благоприятных эффектов у пациентов с СД и ХБП на додиализных стадиях в виде снижения уровня AGE, маркеров окислительного стресса и повышения уровня антиоксидантов [75].
Перспективным в снижении эффектов AGE является использование таргетной терапии. Так, белок HDAC класса III, SIRT1, подавляет индуцированную AGE экспрессию профибротических генов посредством повышения регуляции антиоксидантного гена в клубочковых мезангиальных клетках, введение агониста SIRT1 — BF175 мышам с диабетом (OVE26) уменьшало степень повреждения почек, предполагая, что стимуляция HDAC может иметь терапевтическую ценность [76][77].
Изучается также терапия, направленная на блокирование связывания AGE с RAGE, что может иметь положительный эффект в отношении замедления прогрессирования диабетических осложнений. Так, в исследовании на крысах с диабетом проводилось изучение влияния скринированных ДНК-аптамеров, направленных против RAGE (RAGE-аптамеры) in vitro, на развитие и прогрессирование ДН. RAGE-аптамер связывался с RAGE и таким образом блокировал связывание AGE с RAGE, что приводило к уменьшению окислительного стресса, уровня воспалительных и фиброзных маркеров, альбуминурии. Кроме того, аналогичные результаты были получены в культивируемых мезангиальных клетках человека при оценке влияния RAGE-аптамера [78].
Для лечения болезни Альцгеймера был исследован препарат азелирагон (PF-04494700, или TTP488), пероральный антагонист RAGE (NCT02080364).
В экспериментах на крысах с диабетом было показано, что введение анти-AGE-агентов, таких как ALT-711 (алагебриум), препятствовало гликированию коллагена, уменьшало экспрессию мРНК RAGE, что в конечном итоге приводило к профилактике диабетических осложнений у экспериментальных животных, что позволяет предположить возможное использование средств, разрушающих AGE, в качестве средства лечения, направленного на развитие тубулоинтерстициального фиброза [79].
ЗАКЛЮЧЕНИЕ
Патогенез ДН сложен и многофакторен. Большой вклад в прогрессирование ДН вносят AGE, которые реализуют свой потенциал с помощью влияния на структуру белков и активации оси AGE-RAGE, что влечет за собой целый ряд патологических изменений. Ввиду многочисленных негативных воздействий AGE поиск новых терапевтических стратегий, в том числе таргетных, направленных как на снижение уровня AGE, так и прерывание каскада запускаемых взаимодействием AGE-RAGE событий, может являться перспективным и оправданным для разработки новых подходов к профилактике и лечению диабетических осложнений, включая ДН.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа проведена в рамках выполнения Государственного задания Минздрава России (АААА-А20-120011790181-1).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Гаврилова А.О. — анализ литературы, написание статьи; Северина А.С. — концепция и дизайн статьи, редактирование текста, утверждение итогового варианта текста рукописи; Шамхалова М.Ш. — редактирование текста, утверждение итогового варианта текста рукописи; Шестакова М.В. — редактирование текста; утверждение итогового варианта текста рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
СОЧЕТАНИЕ НЕСОВЕРШЕННОГО ОСТЕОГЕНЕЗА И САХАРНОГО ДИАБЕТА 1 ТИПА
АКТУАЛЬНОСТЬ
Несовершенный остеогенез (НО) — наследственное заболевание соединительной ткани, сопровождающееся повышенной хрупкостью костей. В 85–90% случаев причиной повышенной ломкости костей являются мутации в генах COL1A1 и COL1A2, которые отвечают за синтез коллагена 1-го типа [1]. Эти мутации можно подразделить на две группы: количественные дефекты и структурные аномалии. В первом случае структура коллагена не нарушена, но его количество примерно наполовину ниже нормы. Это отклонение является причиной НО 1-го типа и характеризуется достаточно легким течением заболевания. Вторая группа мутаций обусловлена изменением нормальной структуры волокон коллагена и по степени тяжести может варьироваться от умеренной, наблюдающейся при 3-м и 4-м типах НО, до летальной, характерной для 2-го типа [2]. Продолжительность жизни у данной группы пациентов значительно ниже, чем в общей популяции [3][4]. Остальные 10–15% случаев вызываются либо мутациями в генах, ответственных за посттрансляционные изменения и внутриклеточный транспорт коллагена 1-го типа, либо возникают вследствие нарушения формирования костной ткани и ее минерализации. Такие нарушения присущи НО 5-го типа, который характеризуется среднетяжелым течением и отличается от других типов НО кальцификацией межкостных мембран предплечья, вывихами головки лучевой кости и тенденцией к образованию костных гиперпластических мозолей в местах переломов.
Диагноз НО, как правило, ставится на основании результатов генетического исследования. В связи с развитием методов молекулярно-генетической диагностики постоянно обнаруживаются новые мутации, ответственные за развитие НО. Так, в [5] сообщается о случае НО 5-го типа, вызванного редкой мутацией в гене IFITM5. На данный момент насчитывается 20 типов НО, каждый из которых определяется различными генными локусами и обозначается римской цифрой. Поскольку на практике клинические и радиологические признаки данных типов часто бывают неразличимыми, а прогноз заболевания определяется фенотипическими проявлениями, в настоящее время преимущественно используется клиническая классификация, учитывающая степень тяжести заболевания и обозначающаяся арабскими цифрами от 1 до 5 [6] (табл. 1).
Таблица 1. Соотношение фенотипической и генетической классификаций несовершенного остеогенеза
Фенотипический тип | Ген | Генетический тип | Дефектный белок | Тип наследования |
1 (недеформирующий тип с голубыми склерами) | COL1A1/ COL1A2 | I | α-1 (I) цепь коллагена/ α-2 (I) цепь коллагена (преждевременный стоп-кодон) | АД |
2 (перинатально-летальный) | COL1A1/ COL1A2 | II | α-1 (I) цепь коллагена/ α-2 (I) цепь коллагена (замена глицина) | АД |
CRTAP | VII | Хрящ-ассоциированный белок (CRTAP) | АР | |
LEPRE1 | VIII | Пролил-3-гидроксилаза-1 (P3H1) | АР | |
PPIB | IX | Циклофилин B (CyPB) | АР | |
3 (прогрессивно-деформирующий) | COL1A1/ COL1A2 | III | α-1 (I) цепочка коллагена/ α-2 (I) цепочка коллагена | АД |
IFITM5 | V | Интерферон-индуцированный трансмембранный белок 5 | АД | |
SERPINF1 | VI | Пигментный фактор эпителиального происхождения (PEDF) | АР | |
CRTAP | VII | Хрящ-ассоциированный белок (CRTAP) | АР | |
LEPRE1 | VIII | Пролил-3-гидроксилаза-1 (P3H1) | АР | |
PPIB | IX | Циклофилин B (CyPB) | АР | |
SERPINH1 | X | Белок теплового шока 47 (HSP47) | АР | |
FKBP10 | XI | Пептидил-пролил-цис/транс-изомераза (FKBP10) | АР | |
BMP1 | XIII | Костный морфогенетический белок 1 | АР | |
TMEM38B | XIV | Трансмембранный белок 38 B (TRIC-B) | АР | |
WNT1 | XV | Белки WNT-сигнального пути | АР | |
CREB3L1 | XVI | Белки семейства OASIS | АР | |
SPARC | XVII | Остеонектин | АР | |
TENT5A | XVIII | Семейство сходных последовательностей 46A | АР | |
4 (вариабельный с нормальными склерами) | COL1A1/ COL1A2 | IV | α-1 (I) цепочка коллагена/ α-2 (I) цепочка коллагена (замена глицина) | АД |
WNT1 | XV | Белки WNT-сигнального пути | АД | |
IFITM5 | V | Интерферон-индуцированный трансмембранный белок 5 | АД | |
CRTAP | VII | Хрящ-ассоциированный белок | АР | |
PPIB | IX | Циклофилин B (CyPB) | АР | |
FKBP10 | XI | Пептидил-пролил-цис/транс-изомераза (FKBP10) | АР | |
SP7 | XII | Остерикс | АР | |
5 (с кальцификацией межкостных мембран и/или с гипертрофическими мозолями) | IFITM5 | V | Интерферон-индуцированный трансмембранный белок 5 | АД |
Главным клиническим проявлением НО является повышенная хрупкость костной ткани, которая ассоциирована с высоким риском развития переломов. При тяжелых формах НО переломы могут возникать внутриутробно или вскоре после рождения. При более легких формах переломы начинаются в момент обучения ребенка ходьбе, и их частота значительно снижается к подростковому возрасту, когда зоны роста закрываются и снижается скорость обмена костной ткани. Однако частота переломов может повторно возрастать к периоду постменопаузы у женщин и к старческому возрасту [1]. Для пациентов с НО также характерны деформации костей и задержка роста. Коллаген является одним из основных белков внеклеточного матрикса соединительной ткани, и при нарушениях его структуры и/или синтеза могут наблюдаться такие симптомы, как голубые склеры, несовершенный дентиногенез, гипермобильность крупных суставов, нарушения слуха, мышечная слабость и другие.
Причины снижения прочности костей при НО до сих пор не выяснены до конца. Одной из них могут служить структурные нарушения, которые приводят к задержке незрелых цепей коллагена в эндоплазматическом ретикулуме, что обуславливает более длительное воздействие на них посттрансляционных ферментов [7]. В результате чрезмерно модифицированные молекулы коллагена собираются в аномальные фибриллы и образуют аберрантный клеточный матрикс. В некоторых случаях аномальный коллаген может частично сохраняться в эндоплазматическом ретикулуме, что вызывает аутофагию, нарушает дифференцировку остеобластов и уменьшает синтез коллагена [8]. Все эти нарушения усугубляют дисфункцию матрикса, что, в свою очередь, приводит к снижению костной массы и повышению риска развития переломов.
Сахарный диабет 1 типа (СД1) также является фактором риска снижения минеральной плотности кости (МПК) и развития переломов [9]. Можно условно выделить несколько причин снижения МПК у пациентов с СД1.
1) Дефицит инсулина и инсулиноподобного фактора роста 1 типа (ИФР-1) при СД1 негативно влияет на костный метаболизм. Инсулин оказывает прямое анаболическое действие на остеобласты путем активации рецептора инсулина, вследствие чего увеличивается синтез коллагена остеобластами [10].
2) Гипергликемия приводит к повышению уровня конечных продуктов гликирования (КПГ), которые могут отрицательно воздействовать на костную ткань. Активация рецептора КПГ, экспрессируемого клетками костной ткани, может усилить выработку провоспалительных цитокинов, приводя к развитию хронического воспаления и резорбции кости [11]. Помимо этого, КПГ участвуют в неферментативном гликировании коллагена, вследствие чего между волокнами коллагена образуются сшивки, нарушая их структуру. Замедленное обновление костной ткани при СД1 приводит к накоплению аномального коллагена и еще большему снижению качества костной ткани [12]. Формирование кости также может быть нарушено посредством подавления функции остеобластов КПГ и ингибирования синтеза коллагена 1-го типа и остеокальцина [13][14]. К дополнительному неблагоприятному воздействию гипергликемии можно отнести способность КПГ сдвигать дифференцировку мезенхимальных стволовых клеток в сторону адипогенеза [15].
Представляемый клинический случай является редким сочетанием двух заболеваний с ярко выраженным отрицательным влиянием на костную ткань, что повышает риск развития переломов.
ОПИСАНИЕ СЛУЧАЯ
Пациент А., 18 лет, поступил в августе 2020 г. в Клинику эндокринологии Первого МГМУ им. И.М. Сеченова (Сеченовский Университет) с целью коррекции инсулинотерапии и скрининга поздних осложнений СД.
Родился в срок от 1-й беременности, протекавшей без осложнений. Роды через естественные родовые пути, осложнившиеся переломом правой ключицы. С 2002 по 2007 гг. наблюдалось более 8 переломов костей скелета: предплечье, голень, бедро, которые происходили при незначительных травмах. Последний перелом произошел в мае 2015 г. В 2004 г. поставлен диагноз несовершенного остеогенеза 1-го типа, который в дальнейшем, в 2012 г., был подтвержден молекулярно-генетическим исследованием, в результате которого выявлена замена нуклеотидов с.3261+31T>C в гене COL1A1.
При обследовании в НИИ педиатрии и детской хирургии в семилетнем возрасте (в 2007 г.) выявлены нарушение походки (хромота), левосторонний грудо-поясничный сколиоз, гипермобильность крупных суставов, выраженная мышечная гипотония. При проведении рентгеновской денситометрии диагностировано снижение МПК по Z-критерию (-2,1). Начата антирезорбтивная терапия кальцитонином в комбинации с альфакальцидолом.
В феврале 2012 г. Z-критерий в L2-L4 -3,2, начата терапия памидроновой кислотой из расчета 40 мг/сут в течение 3 дней в сочетании с приемом препаратов кальция и витамина D. Суммарно проведено 4 курса терапии. В апреле 2013 г. Z-критерий -1,0, прекращена терапия бисфосфонатами и рекомендовано продолжить прием препаратов кальция и витамина D. По данным денситометрии в августе 2018 г. — Z-критерий -2,3.
В 2007 г. получал терапию гормоном роста по поводу низкорослости.
В 2017 г., в 16 лет, при обследовании по поводу жалоб на выраженную жажду, тошноту, снижение массы тела диагностирован СД1. В первые месяцы после начала инсулинотерапии гликированный гемоглобин (HbA1c) находился в пределах 6%. В начале 2018 г., в связи с неудовлетворительными показателями гликемического контроля (HbA1c 8%), пациент переведен на помповую инсулинотерапию. В августе 2019 г. на фоне непрерывного подкожного введения инсулина гликемия от 9 ммоль/л до 25 ммоль/л, гипогликемии до 3,0 ммоль/л 2–3 раза в неделю, тяжелые гипогликемии отсутствовали. С того же времени у пациента наблюдается выраженный страх гипогликемий. С сентября 2019 г. использует флеш-мониторинг глюкозы. По результатам амбулаторного профиля глюкозы (АПГ), полученного за 7 дней, в августе 2020 г.: средняя глюкоза крови — 14,5 ммоль/л; прогнозируемый уровень HbA1c — 10,7%; среднее количество сканирований в день — 18; время в диапазоне — 16%, время выше диапазона — 84%, время ниже диапазона — 0%. Обращает на себя внимание тенденция к повышению гликемии в постпрандиальном периоде (рис. 1).

Рисунок 1. Амбулаторный профиль глюкозы пациента А.
При обследовании в клинике в августе 2020 г.
Объективно: вес 60 кг, рост 180 см, ИМТ 18,52 кг/м2. Участок липогипертрофии в левой околопупочной области, в месте установки инфузионной системы. АД 120/60 мм рт. ст.
HbA1c — 9,8%; креатинин, кальций, фосфор, щелочная фосфатаза, паратиреоидный гормон в крови в пределах референсного интервала. Липопротеиды высокой плотности 1,21 ммоль/л (>1,0); липопротеиды низкой плотности — 3,22 ммоль/л; триглицериды — 1,37 ммоль/л (<1,7); холестерин — 5,05 ммоль/л (<4,5).
Проведен скрининг поздних осложнений СД: расчетная скорость клубочковой фильтрации (по MDRD) 102,11 мл/мин/1,73 м2; суточная альбуминурия 16 мг/сут (0–30).
При офтальмоскопии с расширенным зрачком данных за наличие диабетической ретинопатии нет.
Диагностирована диабетическая нейропатия дистального типа, сенсорная симметричная форма.
По данным двухэнергетической рентгеновской абсорбциометрии поясничного отдела позвоночника в августе 2020 г.: Z-критерий в L1-L4 -2,6 (рис. 2).
Проведена боковая рентгенография грудного и поясничного отделов позвоночника, компрессионных переломов тел позвонков не выявлено (рис. 3).

Рисунок 2. Денситометрия поясничного отдела позвоночника пациента пациента А.

Рисунок 3. Боковая рентгенография грудного и поясничного отделов позвоночника пациента А.
ОБСУЖДЕНИЕ
Сочетание НО с различными эндокринопатиями встречается крайне редко [16–18]. В частности, случаи, аналогичные рассматриваемому в данной работе, упоминаются только в нескольких источниках [19][20].
Многие пациенты с НО 1-го типа при рождении имеют среднестатистический рост, который постепенно снижается к школьному возрасту и остается ниже средних значений у взрослых больных. Это может быть связано с нарушениями, возникающими при преобразовании хрящевой ткани в костную. Несмотря на нормальное содержание гормона роста (ГР) в крови у таких пациентов, терапия стандартными дозами рекомбинантного ГР может давать значительное увеличение линейной скорости роста и увеличивать МПК в поясничном отделе позвоночника [21]. В связи с этим пациенту в 7-летнем возрасте (2007 г.) проведена терапия ГР, и на данный момент его рост составляет 180 см.
Несмотря на то что частота переломов может уменьшаться с возрастом, риск их развития у взрослых пациентов с НО приблизительно равен 25% [22]. В настоящее время нет общепринятых алгоритмов ведения взрослых больных с НО. К выбору фармакологического лечения подходят индивидуально, учитывая частоту переломов, показания МПК по данным денситометрии и другие факторы. Пациентам с НО особенно важно получать достаточное количество кальция и витамина D в дополнение к другой терапии [23].
В настоящее время бисфосфонаты являются основной фармакологической группой препаратов, применяемой для лечения НО как у детей, так и у взрослых [1]. Показано, что и пероральные, и внутривенные формы увеличивают МПК у пациентов с НО всех возрастных категорий [24][25].
У пациентов с НО 1-го типа в клинических исследованиях с использованием анаболической терапии терипаратидом или ингибиторами склеростина было показано значительное увеличение МПК и маркеров костеобразования [26–28]. Однако не все работы рассматривали переломы в качестве конечных точек.
Пациенту рекомендовано продолжение приема колекальциферола, употребление продуктов с достаточным содержанием кальция, расширение физической активности, выполнение денситометрии через 2 года после последнего исследования с последующим решением о необходимости назначения препаратов, снижающих риск переломов. Также рекомендовано продолжить помповую инсулинотерапию в комбинации с непрерывным мониторингом гликемии с целью достижения компенсации СД1. В связи с сохраняющимся страхом гипогликемии пациенту рекомендована консультация психотерапевта.
ЗАКЛЮЧЕНИЕ
Описанный клинический случай представляет собой чрезвычайно редкое сочетание НО и СД1. Оба этих заболевания оказывают негативное влияние на костную ткань, что требует особой тактики ведения пациентов с комбинацией данных патологий из-за повышенного риска развития переломов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Мармалюк Д.А. — анализ полученных данных, написание статьи; Рунова Г.Е. — концепция и идея статьи, получение данных, написание статьи; Мошенина С.Э. — получение и анализ данных; Шапка М.П. — получение и анализ данных; Фадеев В.В. — редактирование, финальное утверждение рукописи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациента. Пациент добровольно подписал информированное согласие на публикацию персональной медицинской информации в обезличенной форме в медицинском журнале.
ПАМЯТИ ПОТЕМКИНА ВЛАДИМИРА ВАСИЛЬЕВИЧА

Рисунок 1. Потемкин Владимир Васильевич.
31 июля 2021 г. ушел из жизни Владимир Васильевич Потемкин — один из ведущих специалистов-эндокринологов в нашей стране, основатель и руководитель первого в СССР курса эндокринологии (1973–2017), а затем и профильной кафедры Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, почетный профессор РНИМУ им. Н.И. Пирогова, профессор кафедры эндокринологии лечебного факультета, заслуженный врач РФ, заслуженный работник высшей школы РФ.
64 года научно-педагогической и врачебной деятельности одного из ведущих специалистов-эндокринологов нашей страны, родоначальника вузовской эндокринологии, основателя и первого заведующего кафедрой эндокринологии Российского национального исследовательского медицинского университета (РНИМУ) им. Н.И. Пирогова, заслуженного работника высшей школы РФ, заслуженного врача РФ, профессора Потемкина Владимира Васильевича.
После окончания с золотой медалью средней школы в 1951 г. В.В. Потемкин поступил в Ленинградскую военно-медицинскую академию им. С.М. Кирова, по окончании которой работал войсковым врачом. В 1960 г. В.В. Потемкин поступил в клиническую ординатуру на кафедру эндокринологии Центрального института усовершенствования врачей (в настоящее время РМАПО), по окончании которой был зачислен в аспирантуру той же кафедры. В этот период им успешно защищена кандидатская диссертация на тему «Взаимоотношения показателей углеводного и липидного обмена при сахарном диабете и их клиническое значение».
С 1965 г. педагогическая, научная и врачебная деятельность В.В. Потемкина полностью связана с РНИМУ им. Н.И. Пирогова (ранее 2-й Московский государственный медицинский институт им. Н.И. Пирогова). Впервые в нашей стране В.В. Потемкин стал преподавать эндокринологию на кафедре внутренних болезней педиатрического факультета, которую в те годы возглавлял академик АМН СССР П.Н. Юренев. В 1973 г. после перехода на лечебный факультет В.В. Потемкин организовал курс эндокринологии при кафедре факультетской терапии, которой в тот период заведовал академик АМН СССР, профессор А.И. Нестеров. Вскоре курс эндокринологии обрел самостоятельность, а затем был преобразован в кафедру.
Будучи прекрасным методистом, В.В. Потемкин организовал на первых этапах становления вузовской эндокринологии центр по методике преподавания эндокринологии для профессорско-преподавательского состава нашей страны. Лекции и семинары по методике преподавания эндокринологии отличались большой содержательностью, высоким методическим уровнем и получали высокую оценку со стороны профессорско-преподавательского состава.
Заведуя последовательно курсом и кафедрой в течение 40 лет, В.В. Потемкин проявил себя талантливым педагогом, ученым и прекрасным клиницистом.
В.В. Потемкин — автор первого в нашей стране учебника «Эндокринология», в котором он обобщил многолетний опыт преподавания эндокринологии в РНИМУ им. Н.И. Пирогова. В.В. Потемкиным написаны 7 учебников по эндокринологии, в том числе изданных на французском, испанском и дважды на английском языках. Вот уже 40 лет они являются настольными книгами не только для студентов медицинских вузов, курсантов институтов усовершенствования врачей и факультетов повышения квалификации, но и для врачей других специальностей. За 53 года работы в РНИМУ им. Н.И. Пирогова под руководством и при непосредственном участии профессора В.В. Потемкина прошли обучение свыше 37 тысяч студентов дневного и вечернего отделения лечебного факультета, педиатрического и медико-биологического факультетов.
Основная направленность научной деятельности профессора В.В. Потемкина сосредоточена на проблемах патогенеза, клинических проявлений и лечения сахарного диабета и ожирения. Изучение В.В. Потемкиным развития окислительного стресса и нарушения инсулинсвязывающей активности крови у больных с впервые выявленным сахарным диабетом 2-го типа с нормальной массой тела и ожирением позволили установить у них разные патогенетические механизмы развития гипергликемии. Это, естественно, диктует необходимость использовать у таких больных разную тактику лечения. Изучение В.В. Потемкиным роли цитокинов в развитии синдрома диабетической стопы позволило ему сделать вывод о том, что критериями эффективности лечения больных сахарным диабетом 2-го типа, осложненным синдромом диабетической стопы, наряду с нормогликемией являются также снижение активности процессов перекисного окисления липидов, стабилизация состояния антиоксидантной защиты, нормализация уровня провоспалительного цитокина фактора некроза опухоли-альфа (ФНО-α). Этот вывод В.В. Потемкина имеет большое практическое значение, так как дает возможность врачу более взвешенно подходить к оценке тяжести состояния заболевания и лечения пациентов с сахарным диабетом. Проведение В.В. Потемкиным исследования по иммунотерапии у пациентов с сахарным диабетом 2-го типа, осложненным синдромом диабетической стопы, показало, что включение иммунокоррекции с использованием препарата «Суперлимф» в комплексном лечении этих больных ведет к снижению активности перекисного окисления липидов, стабилизации антиоксидантной защиты, снижению эндогенной интоксикации, нормализации лимфоцитарного звена иммунитета, уровня циркулирующих иммуноглобулинов крови. Этот вывод В.В. Потемкина чрезвычайно важен, так как гангрена при сахарном диабете встречается в 40 раз чаще, чем при других заболеваниях. Внедрение в клиническую практику рекомендаций В.В. Потемкина способствует улучшению результатов лечения больных с синдромом диабетической стопы, профилактике у них гангрены, сокращению на них прямых и косвенных финансовых расходов.
Многолетний опыт работы В.В. Потемкина на базе городской клинической больницы скорой помощи № 68 обобщен им в монографиях «Неотложные состояния в клинике эндокринных болезней» (1984 г.) и руководстве для врачей «Неотложная эндокринология» (2008 г.). В.В. Потемкин является также автором многочисленных методических указаний, посвященных в основном вопросам неотложной эндокринологии.
В.В. Потемкиным опубликовано более 200 научных работ, в том числе 7 учебников «Эндокринология», руководство для врачей «Неотложная эндокринология», фундаментальное руководство для врачей «Эндокринология», большие главы по эндокринологии в многотомном руководстве для врачей по геронтологии и гериатрии, а также в руководстве для врачей по интенсивной терапии. Он является соавтором «Пособия по курсу внутренних болезней для студентов медицинских вузов».
Большое внимание В.В. Потемкин уделяет подготовке врачебных и научных кадров. Под его руководством успешно защищен целый ряд кандидатских диссертаций, подготовлены свыше 210 высококвалифицированных специалистов-эндокринологов, многие из которых теперь работают не только врачами-эндокринологами, но и преподавателями вузов и научными сотрудниками.
В.В. Потемкин — принципиальный руководитель, энергичный и хороший организатор. Особенно высокие требования он предъявляет к личности преподавателя, справедливо считая, что педагог вуза обязан не только словом, но и личным примером воспитывать студентов, нести ответственность за результаты их обучения.
За большие достижения в области здравоохранения и высшей школы В.В. Потемкину присвоено высокое звание Заслуженного врача РФ и Заслуженного работника высшей школы РФ, он награжден значком «Отличнику здравоохранения». В течение многих лет В.В. Потемкин был консультантом 4 Главного управления МЗ СССР и Главного управления по обслуживанию дипломатического корпуса МИД России (МЕДИНЦЕНТР).
Его ученики и коллеги глубоко скорбят и выражают искренние соболезнования родным и близким.
Редакция и читатели журнала «Сахарный диабет» искренне приносят соболезнования родным, близким, коллегам и ученикам Потемкина В.В.
КАНАГЛИФЛОЗИН: ОТ ГЛИКЕМИЧЕСКОГО КОНТРОЛЯ ДО УЛУЧШЕНИЯ СЕРДЕЧНО-СОСУДИСТОГО И ПОЧЕЧНОГО ПРОГНОЗА У ПАЦИЕНТОВ С САХАРНЫМ ДИАБЕТОМ 2 ТИПА. РЕЗОЛЮЦИЯ СОВЕТА ЭКСПЕРТОВ
КАНАГЛИФЛОЗИН — ИНГИБИТОР НАТРИЙ-ГЛЮКОЗНОГО КОТРАНСПОРТЕРА 2 ТИПА С ДВОЙНЫМ ИНСУЛИННЕЗАВИСИМЫМ МЕХАНИЗМОМ ДЕЙСТВИЯ
Канаглифлозин — препарат класса ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2), ингибируя НГЛТ-2 в проксимальных S1/S2 почечных канальцах, способствует уменьшению реабсорбции отфильтрованной глюкозы в почках, тем самым увеличивая выведение глюкозы с мочой в количестве 77 и 119 г/сут для дозировок 100 мг и 300 мг соответственно [1].
Отличительной особенностью канаглифлозина по сравнению с другими представителями класса иНГЛТ-2 является его способность умеренно ингибировать НГЛТ-1 (отношение констант ингибирования НГЛТ-2/НГЛТ-1 ≈1:200 [2]) в тонком кишечнике и почках [1].
В тонком кишечнике НГЛТ-1 локализованы на апикальной мембране энтероцитов тонкого кишечника и принимают участие в реабсорбции поступающей с пищей глюкозы. Было показано, что назначение канаглифлозина перед приемом пищи, особенно в дозе 300 мг, вызывает уже через 1 ч после еды значимое снижение уровня постпрандиальной гликемии, обусловленное транзиторным ингибированием НГЛТ-1 в кишечнике [2] как у здоровых лиц [3], так и у пациентов с сахарным диабетом 2 типа (СД2) [4]. В дальнейшем, через 2–4 ч после еды, имеет место отсроченное постепенное увеличение всасывания глюкозы, в результате чего не происходит ее мальабсорбции [3]. В сравнительном исследовании с перекрестным дизайном у 54 здоровых добровольцев показано значимое снижение постпрандиальной гликемии на фоне приема 300 мг канаглифлозина на 0,47 ммоль/л в отличие от 10 мг дапаглифлозина, практически не оказывающего на нее влияние (-0,04 ммоль/л) [5].
В почках НГЛТ-1 локализованы на апикальной мембране эндотелия сегмента S3 проксимальных почечных канальцев. В норме НГЛТ-1 отвечают только за 10%, тогда как находящиеся проксимально в сегментах S1/S2 НГЛТ-2 — за 90% реабсорбции глюкозы из мочи [6]. Показано, что роль почечных НГЛТ-2 и НГЛТ-1 в реабсорбции глюкозы возрастает у пациентов с СД2 по сравнению со здоровыми лицами [7]. При этом прием иНГЛТ-2 приводит к увеличению содержания глюкозы в моче и повышению ее реабсорбции через НГЛТ-1 в сегменте S3 [8].
Поэтому наличие у канаглифлозина, в отличие от дапа- и эмпаглифлозина, активности в отношении ингибирования почечных НГЛТ-1 позволяет добиться дополнительной 10% экскреции глюкозы с мочой [9].
Мнение экспертов
Таким образом, канаглифлозин, особенно в дозе 300 мг, является иНГЛТ-2 с особенным по отношению к другим представителям этого класса двойным инсулиннезависимым механизмом действия, связанным с ингибированием не только НГЛТ-2 почек, но также и НГЛТ-1. Ингибирование НГЛТ-1, локализованных в кишечнике и почках, обусловливает снижение пиков постпрандиальной гликемии и дополнительный эффект в отношении контроля гликемии за счет большего выведения глюкозы с мочой.
Влияние канаглифлозина, особенно в дозе 300 мг, на уровень глюкозы в первые 2 ч после еды, без влияния на дополнительную секрецию инсулина, имеет важное клиническое значение, т. к.:
1.постпрандиальная гликемия, по сравнению с гликемией натощак, вносит больший вклад в значение гликированного гемоглобина (HbA1c) при умеренно выраженном нарушении гликемического контроля (HbA1c <8,5%) [10], соответственно, ее снижение может повысить эффективность достижения целевого уровня HbA1c;
2.высокая постпрандиальная гликемия, по сравнению с гликемией натощак, является более мощным предиктором смерти от всех причин и сердечно-сосудистой смерти [11], соответственно, ее снижение может способствовать улучшению прогноза у пациентов с СД2.
Гликемические и негликемические эффекты канаглифлозина по данным рандомизированных клинических исследований и реальной клинической практики
Программа по изучению эффективности и безопасности канаглифлозина включала рандомизированные клинические исследования, в которых прежде всего оценивалось влияние канаглифлозина в дозах 100 и 300 мг на уровень HbA1c. Кроме того, изучалось действие препарата на массу тела, АД, уровни липидов и другие параметры. Был проведен широкий спектр исследований для изучения применения канаглифлозина как в режиме монотерапии, так и в составе двойной или тройной комбинированной терапии с различными сахароснижающими препаратами (ССП), включая инсулин. Канаглифлозин в обеих дозировках был эффективен в снижении HbA1c вне зависимости от длительности СД2, исходного HbA1c [12] и возраста пациента [13]. Дозировка 300 мг позволяла добиться лучшего результата в контроле не только гликемии, но и массы тела и АД по сравнению с дозировкой 100 мг [14].
Представляют безусловный интерес исследования, в которых канаглифлозин сравнивался с другими ССП при их добавлении к подобранной терапии метформином, поскольку комбинация ССП с метформином является рекомендованным стандартом лечения СД2 [15].
Так, было выполнено исследование пациентов с СД2 (n=1450) по оценке длительности гликемического контроля, снижения массы тела и безопасности на терапии канаглифлозином 100 или 300 мг или препаратом класса сульфонилмочевины (СМ) — глимепиридом (титрование дозы до 6 или 8 мг / день) при их добавлении к метформину. Основной период наблюдения составил 52 нед с последующим продлением наблюдения до 104 нед. Через 52 нед терапии канаглифлозин 100 мг не уступал, а канаглифлозин 300 мг превосходил глимепирид (средняя доза 5,6 мг, медиана 6,0 мг) в снижении HbA1c (∆HbA1с (95% ДИ) -0,12% (-022–-0,02)) [16], а уже через 104 нед обе дозировки канаглифлозина превосходили глимепирид по влиянию на этот параметр, прежде всего за счет ускользания эффекта контроля гликемии на препарате СМ при увеличении продолжительности терапии [17].
В другом исследовании, длившемся 52 нед, канаглифлозин 100 мг был столь же, а 300 мг значимо более эффективен, чем ситаглиптин 100 мг, в снижении HbA1c (∆HbA1с (95% ДИ) -0,15% (-0,27–-0,03)) при их добавлении к метформину у пациентов с СД2 [18]. Эти данные нашли подтверждение в исследовании реальной клинической практики (n≈25 000), в котором показано, что канаглифлозин обеспечивал лучший контроль HbA1c по сравнению с ситаглиптином в течение 2,5 года наблюдения, что дало важнейшие клинические преимущества: вероятность достижения целевого HbA1c <7,0% была достоверно на 15% выше, а риск необходимости интенсификации сахароснижающей терапии на 31% ниже при назначении канаглифлозина по сравнению с ситаглиптином [19].
Помимо высокой эффективности в контроле гликемии при добавлении к метформину, канаглифлозин, в отличие от препаратов СМ и ингибиторов дипептидилпептидазы 4 типа (иДПП-4), обеспечивал значимое снижение массы тела (-3,3 кг и -3,6 кг для дозировок 100 и 300 мг соответственно) и АД (-3,5 мм рт. ст. и 4,7 мм рт. ст. для дозировок 100 и 300 мг соответственно) [18], тем самым решая задачу комплексного воздействия на кардиометаболические риски, постулированную в действующих рекомендациях МЗ РФ [15].
Канаглифлозин не сравнивался напрямую в рамках рандомизированных клинических исследований с другими иНГЛТ-2. Тем не менее есть данные обсервационного исследования, показавшего преимущества канаглифлозина 300 мг перед дапаглифлозином 10 мг в контроле гликемии у пациентов с СД2. Так, вероятность достижения целевого HbA1c <7,0% была на 75% выше (ОР (95% ДИ) 1,75 (1,34–2,27); р<0,0001) у пациентов на канаглифлозине, чем дапаглифлозине [20]. Кроме того, результаты частотного сетевого метаанализа, включавшего 38 исследований (~24 000 пациентов с СД2), продемонстрировали, что канаглифлозин 100 мг не уступал, а 300 мг был эффективнее дапа- (5 и 10 мг) и эмпаглифлозина (10 и 25 мг) в снижении глюкозы плазмы натощак (ГПН) и уровня HbA1c [21]. Однако однозначные выводы об эффективности различных иНГЛТ-2 по контролю гликемии можно будет делать только по результатам прямых рандомизированных сравнительных исследований.
Мнение экспертов
Канаглифлозин обладает клинически значимым дозозависимым эффектом в снижении HbA1c, массы тела и АД. Дозировка канаглифлозина 100 мг может иметь сопоставимую, а 300 мг — вероятно большую эффективность в контроле гликемии по сравнению с другими пероральными сахароснижающими препаратами. Это, наряду с широким спектром плейотропных эффектов, включающих не только положительное влияние на массу тела и АД, но и снижение уровня мочевой кислоты, риска развития и обострения подагры [22], печеночной инсулинорезистентности [23], позволяет обоснованно использовать канаглифлозин при лечении широкого круга больных с СД2.
Сердечно-сосудистые эффекты канаглифлозина
Влияние канаглифлозина на сердечно-сосудистые (СС) исходы оценивалось в специально спланированной программе CANVAS (The Canagliflozin Cardiovascular Assessment Study), состоявшей из двух последовательных исследований: CANVAS, оценивавшем главным образом СС-исходы (МАСЕ: нефатальный инфаркт миокарда, нефатальный инсульт, сердечно-сосудистая смерть), и CANVAS-Renal (CANVAS-R). Результаты этих исследований затем были объединены в один анализ. Популяция пациентов с СД2, включенных в программу CANVAS (n=10 142), состояла из 65% лиц с имеющимися СС-заболеваниями (ССЗ) и 35% пациентов с факторами их развития. Критерии включения были одинаковыми для обоих исследований программы CANVAS: наличие СД2, HbA1с от ≥7,0% до ≤10,5%, расчетная скорость клубочковой фильтрации (рСКФ) ≥30 мл/мин/1,73 м2, возраст ≥30 лет для лиц с ССЗ в анамнезе или ≥50 лет — с ≥2 факторами риска ССЗ. Пациенты были рандомизированы в исследовании CANVAS в группы приема канаглифлозина 100 мг, канаглифлозина 300 мг и плацебо, а в исследовании CANVAS-R — канаглифлозина 100 мг (с возможностью повышения до 300 мг) и плацебо. Длительность наблюдения составила около 7 лет. Исследовательские центры в количестве 667 находились в 30 странах мира, в том числе в России.
Первичной конечной точкой программы CANVAS была частота MACE. Показано, что канаглифлозин, по сравнению с плацебо, значимо снижал риск ее развития на 14% (ОР 0,86; 95% ДИ 0,75–0,97). Среди пациентов с ССЗ эффективность канаглифлозина была еще выше и снижение MACE составило 18% (ОР 0,82; 95% ДИ 0,72–0,95). Заранее невозможно предсказать, какое СС-событие произойдет у пациента, поэтому важно подчеркнуть, что канаглифлозин продемонстрировал тенденцию к снижению каждого из компонентов MACE: нефатального инфаркта миокарда, нефатального инсульта, СС-смертности. В рамках анализа вторичных конечных точек было показано снижение риска госпитализации по поводу сердечной недостаточности (СН) на 33% (ОР 0,67; 95% ДИ 0,52–0,87), а также госпитализации по поводу СН и СС-смертности на 22% (ОР 0,78; 95% ДИ 0,67–0,91) на фоне терапии канаглифлозином по сравнению с плацебо. Были получены интересные результаты в отношении влияния на почечные исходы. Популяция пациентов «почечной» ветви программы CANVAS имела в целом сохраненную почечную функцию (средняя рСКФ=77 мл/мин/м2) с минимальной альбуминурией (медиана альбумин/креатинин 12,4 мг/г). Было показано, что канаглифлозин, по сравнению с плацебо, способствовал не только снижению риска прогрессирования альбуминурии на 27% (ОР 0,73; 95% ДИ 0,67–0,79), но и повышению вероятности регресса альбуминурии на 70% (ОР 1,70; 95% ДИ 1,51–1,91), что свидетельствует о значимом нефропротективном эффекте препарата при его назначении на ранней стадии диабетической нефропатии [24].
Мнение экспертов
Канаглифлозин — препарат с доказанной эффективностью в отношении улучшения СС-прогноза у пациентов с СД2 и ССЗ или факторами риска их развития.
Канаглифлозин снижал риск MACE в смешанной популяции пациентов с СД2 как с установленными ССЗ, так и факторами риска их развития — более репрезентативной популяции с точки зрения реальной клинической практики.
В отношении снижения риска госпитализаций по поводу СН эффективность канаглифлозина сопоставима с дапа- и эмпаглифлозином, что подтверждается результатами анализа базы данных реальной клинической практики, включающей более 700 000 пациентов с СД2 [25].
Нефропротективный эффект канаглифлозина, продемонстрированный при начальном поражении почек у пациентов с СД2, имел важное значение для дальнейшего изучения эффекта препарата на более поздних стадиях хронической болезни почек (ХБП).
Почечные эффекты канаглифлозина
Согласно эпидемиологическим данным, ХБП встречается у 40% пациентов с СД2 [26]. У лиц с рСКФ=30–59 мл/мин/1,73 м2 быстрое прогрессирование ХБП чаще отмечалось при наличии СД [27]. В результате СД, по сравнению с другими причинами ХПБ, имеет наибольший вклад в количество потенциальных лет жизни, утраченных из-за преждевременной смерти и нетрудоспособности [28]. До последнего времени у пациентов с ХБП и СД2 почти 20 лет не было препаратов с доказанным влиянием на почечные исходы. Принимавшиеся с этой целью ингибиторы ренин-ангиотензин-альдостероновой системы (иРААС), несмотря на свою эффективность в снижении почечных рисков на 16–20%, не позволяли в полной мере контролировать заболевание, и остаточный риск прогрессирования ХБП оставался высоким [29][30]. Поэтому выявленные в рамках анализа вторичных конечных точек исследований по СС-безопасности ренопротективные эффекты канаглифлозина и других иНГЛТ-2 [31] были восприняты медицинским сообществом с энтузиазмом. Однако данные эффекты иНГЛТ-2 должны были быть еще подтверждены в специально спланированных исследованиях с первичной конечной точкой, оценивающей именно почечные исходы.
Исследование с канаглифлозином CREDENCE (Canagliflozin and Renal Events in Diabetes with Established Nephropathy Clinical Evaluation) стало первым среди иНГЛТ-2, в котором было убедительно показано снижение риска почечных и сердечно-сосудистых исходов у пациентов с СД2 и ХБП. В это исследование был включен 4401 пациент с СД2 и ХБП (средняя рСКФ 56,2 мл/мин/1,73 м2) и альбуминурией (медиана отношения альбумин/креатинин — 927 мг/г), рандомизированных в группу канаглифлозина 100 мг или плацебо. Все пациенты получали терапию иРААС. Исследование было прекращено досрочно через 2,5 года (планируемая длительность 5,5 года) из-за значимого преимущества канаглифлозина в отношении снижения риска развития комбинированной почечно-сердечной конечной точки (терминальная ХБП, двукратное повышение концентрации креатинина в плазме крови, смерти вследствие почечных и сердечно-сосудистых заболеваний) на 30% (ОР 0,70; 95% ДИ 0,59–0,82). Кроме того, канаглифлозин уменьшал значимо на 34% (ОР 0,66; 95% ДИ 0,53–0,81) риск почечных (терминальная ХБП, удвоение креатинина и смерти от почечных причин) и на 20% (ОР 0,80; 95% ДИ 0,67–0,95) сердечно-сосудистых (инфаркт миокарда, инсульт, СС-смерть) осложнений. Также вновь было продемонстрировано снижение на 39% (ОР 0,61; 95% ДИ 0,47–0,80) риска госпитализации по поводу сердечной недостаточности [32].
В исследовании CREDENCE ежегодное снижение рСКФ на канаглифлозине (-1,85 мл/мин/1,73 м2 в год) было в 2,5 раза меньше, чем на плацебо (-4,59 мл/мин/1,73 м2 в год) [32]. Используя данные изменения рСКФ из исследования CREDENCE, была построена математическая модель, показавшая, что при условии длительного приема канаглифлозин позволяет на 13 лет отсрочить наступление терминальной стадии ХБП (рСКФ 10 мл/мин/1,73 м2), требующей проведения гемодиализа [33].
Благодаря результатам, полученным в исследовании CREDENCE, канаглифлозин стал первым в мире [34] и в РФ [1] препаратом из класса иНГЛТ-2 с официально одобренным почечным показанием, включающим снижение риска развития терминальной стадии ХБП, двукратного повышения концентрации креатинина в плазме крови, смерти вследствие ССЗ и госпитализации по поводу сердечной недостаточности у пациентов с СД2 и ХБП с альбуминурией. Необходимо подчеркнуть, что в случае своевременной инициации терапии канаглифлозином (рСКФ ≥30 мл/мин/1,73 м2), лечение препаратом в дозе 100 мг может быть продолжено вплоть до начала диализа или пересадки почки [1].
Мнение экспертов
Доказанное в исследовании CREDENCE нефропротективное действие канаглифлозина и последовавшее за ним изменение в инструкции позволяет уже сегодня использовать препарат для решения широкого круга задач в лечении СД2 в условиях реальной клинической практики. Важно помнить, что снижение СС- и почечных рисков возможно только при длительном (годы) приеме препарата, что возможно только при условии регулярного информирования врачом пациента о заболевании, подходах к его лечению, особенностях различных ССП, в том числе в контексте баланса их эффективности и безопасности.
Безопасность канаглифлозина
Безопасность терапии является важнейшим фактором приверженности пациента лечению. В свою очередь, высокая приверженность, постоянство и длительность терапии — необходимые условия для улучшения прогноза. В случае СД2 только длительный (в течение нескольких лет) прием современных классов ССП (иНГЛТ-2, агонистов рецепторов глюкагоноподобного пептида 1-го типа (арГПП-1)) в клинических исследованиях позволял добиваться снижения риска СС- и почечных осложнений и сделал эти классы ключевым компонентом лечения во многих клинических ситуациях [15].
Объединенный анализ безопасности 4 26-недельных плацебо-контролируемых исследований 3-й фазы (n=2113) [35] показал, что наиболее часто встречающимися нежелательными явлениями (НЯ) при применении канаглифлозина были:
- со стороны желудочно-кишечного тракта: запор, жажда, тошнота, возникавшие с частотой 1,8–2,3%;
- со стороны мочевыделительной системы: полиурия/поллакиурия, инфекции мочевыводящих путей, частота — 4,3–5,9%;
- генитальные инфекции у мужчин (3,7–4,2%) и женщин (10,4–11,4%).
Наиболее часто возникающими НЯ были генитальные инфекции, что было ожидаемым с точки зрения глюкозурического механизма действия препарата и является класс-специфичным осложнением для всех иНГЛТ-2. Риск генитальных инфекций на фоне применения канаглифлозина соответствует таковому у других представителей класса [36].
Необходимо отметить, что частота развития мочевой инфекции была сопоставимой при приеме канаглифлозина 100 и 300 мг и плацебо и составляла 5,9, 4,3 и 4,0% соответственно [1].
Благодаря инсулиннезависимому механизму действия канаглифлозин имеет низкий риск развития гипогликемии при назначении в монотерапии или в комбинации с ССП, отличный от СМ и инсулина [1].
Важно подчеркнуть, что в целом профили безопасности были сопоставимыми у обеих дозировок (100 и 300 мг) канаглифлозина [35].
Большой объем ценных данных по безопасности был получен в программе CANVAS и исследовании CREDENCE, в которых пациенты принимали канаглифлозин в течение нескольких лет. Очень важно, что в ходе длительного периода наблюдения частота всех НЯ, серьезных НЯ и НЯ, приведших к отмене препарата, была сопоставима между группами канаглифлозина и плацебо. Канаглифлозин ожидаемо чаще вызывал развитие генитальных грибковых инфекций и осмотического диуреза, что согласуется с данными предшествующих исследований. Однако привлекло внимание не это, а зарегистрированное в программе CANVAS повышение частоты ампутаций на канаглифлозине (6,3 на 1000 пациенто-лет) по сравнению с плацебо (3,4 на 1000 пациенто-лет). Выявленные прогностические факторы риска ампутации были аналогичны в обеих группах: предшествующий анамнез ампутаций, периферическая нейропатия, заболевания периферических артерий и др. Дозировка канаглифлозина 100 мг или 300 мг не влияла на риск ампутаций. При этом пациенты с факторами риска ампутаций получали максимальную пользу от применения канаглифлозина — снижение риска MACE на 19% (ОР 0,81; 95% ДИ 0,66–0,99) [24]. Проведенный дополнительный анализ не выявил увеличения числа провоцирующих ампутации событий при приеме канаглифлозина по сравнению с плацебо, также не обнаружено специфического для канаглифлозина фактора риска ампутаций [37]. В дальнейшем важнейшие данные в отношении риска ампутации были получены в исследовании CREDENCE, куда были включены пациенты с ХБП, альбуминурией, другими сопутствующими заболеваниями, которые априори имели очень высокий риск ампутаций. Было показано, что в этой тяжелой группе пациентов канаглифлозин не повышал риск развития этого нежелательного явления (ОР 1,11; 95% ДИ 0,79–1,56) [32]. В дополнение к этому были получены результаты анализа из реальной клинической практики, в который вошли более 700 000 пациентов с СД2 и который показал отсутствие повышения риска ампутаций у пациентов, получавших канаглифлозин по сравнению с другими иНГЛТ-2 и другими классами ССП [25]. В результате сначала в августе 2020 г. Управление по контролю пищевых продуктов и лекарственных препаратов США (FDA) [38], а затем в 2021 г. Американская диабетическая ассоциация (ADA) [39] и Российская ассоциация эндокринологов [15] удалили из своих регламентирующих документов специальное предостережение о повышении риска ампутаций на канаглифлозине.
Нужно отметить, что частота ампутаций 6,3 на 1000 пациенто-лет в программе CANVAS у пациентов, получавших канаглифлозин, очень близка к таковой в целом в популяции пациентов с СД2 — 5,6 на 1000 пациенто-лет [40], а также к аналогичной частоте, выявленной в исследованиях EMPA-REG-OUTCOME c эмпаглифлозином (6,5 на 1000 пациенто-лет) [41] и VERTIS-CV c эртуглифлозином (6,3 на 1000 пациенто-лет) [42]. В исследовании DECLARE-TIMI-58 c дапаглифлозином частота ампутаций была ниже (3,6 на 1000 пациенто-лет), что, вероятно, связано с более легкой в отношении ССЗ популяцией пациентов в этом исследовании [43].
Таким образом, в обширной программе клинических исследований канаглифлозин продемонстрировал сбалансированный профиль безопасности, что находит свое отражение в достаточно высокой приверженности к лечению. Так, при ретроспективном анализе данных реальной клинической практики (n= 23 702) было показано, что в течение 1 года приверженность и постоянство терапии были значительно выше на фоне приема канаглифлозина 100 мг или 300 мг по сравнению с дапаглифлозином, арГПП-1 и иДПП-4. При сравнении двух дозировок канаглифлозина оказалось, что пациенты на канаглифлозине 300 мг были более привержены терапии по сравнению с пациентами, получавшими канаглифлозин 100 мг [44].
Мнение экспертов
Канаглифлозин имеет сбалансированный для обеих дозировок (100 и 300 мг) профиль безопасности, сопоставимый с таковыми для других иНГЛТ-2.
Наибольший риск, связанный с приемом препарата, представляют грибковые генитальные инфекции, частота развития которых была небольшой: 3,7–4,2% у мужчин и 10,4–11,4% у женщин. Стоит отметить, что в 98% случаев имело место лишь однократное развитие генитального кандидоза, и в >99% не требовалось отмены препарата [33]. Данный риск является управляемым и предотвращаемым. Для этого важно объяснить пациенту механизм действия препарата, дать рекомендации по личной гигиене. При появлении первых признаков генитальных инфекций рекомендовано использование противогрибковых препаратов [36].
Канаглифлозин не отличается от других иНГЛТ-2 и остальных ССП по риску ампутаций. Важен регулярный осмотр стоп, который, согласно клиническим рекомендациям, должен проводиться не реже 1 раза в год всем пациентам с СД2 вне зависимости от факта приема иНГЛТ-2, поскольку вероятность ампутации зависит не только от предрасполагающих факторов риска, но и своевременности и уровня оказания помощи.
Назначение канаглифлозина не требует проведения какого-то специального предварительного обследования по сравнению с другими иНГЛТ-2.
Высокая приверженность к лечению канаглифлозином в реальной клинической практике является следствием баланса эффективности, безопасности и удобства приема препарата.
ЗАКЛЮЧЕНИЕ
Обширная доказательная база и опыт клинического применения делают канаглифлозин одним из наиболее изученных иНГЛТ-2. Канаглифлозин является иНГЛТ-2 с дополнительным по отношению к другим представителям этого касса двойным инсулиннезависимым механизмом действия, связанным с ингибированием не только НГЛТ-2 почек, но также и НГЛТ-1 в кишечнике и почках, что может способствовать лучшему контролю гликемии. Канаглифлозин в дозе 300 мг показывает максимальные эффекты в контроле гликемии и в отношении других кардиометаболических параметров. Канаглифлозин обладает доказанной эффективностью в отношении улучшения СС-прогноза у пациентов с СД2 как с установленными ССЗ, так и факторами риска их развития. Кроме того, канаглифлозин имеет зарегистрированное показание по снижению риска прогрессирования почечных и СС-исходов у пациентов с СД2 и ХБП и может применяться вплоть до терминальной стадии ХБП. Помимо высокой эффективности, канаглифлозин обладает сбалансированным профилем безопасности и переносимости, что делает его препаратом выбора в лечении широкого круга пациентов с СД2.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Совет экспертов, результаты которого легли в основу этой статьи, проводился при поддержке ООО «Мерк».
Конфликт интересов. Все авторы статьи принимали участие в совете экспертов по оценке эффектов канаглифлозина в лечении пациентов с СД2, который проводился при поддержке ООО «Мерк», и результаты которого легли в основу этой статьи.
Участие авторов. Шестакова М.В. — концепция, редактирование и финальное утверждение рукописи; Аметов А.С., Анциферов М.Б., Бардымова Т.П., Валеева Ф.В., Галстян Г.Р., Демидова Т.Ю., Карпова И.А., Киселева Т.П., Майоров А.Ю., Мкртумян А.М., Недогода С.В., Петунина Н.А., Руяткина Л.А., Суплотова, Л.А. Сухарева О.Ю., Фадеев В.В., Шамхалова М.Ш. — написание, редактирование и финальное утверждение рукописи. Все авторы внесли значимый вклад в написание рукописи и подготовку к печати.
ДЛЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ФОРСИГА® (ДАПАГЛИФЛОЗИН) ЗАРЕГИСТРИРОВАНО НОВОЕ ПОКАЗАНИЕ: ХРОНИЧЕСКАЯ БОЛЕЗНЬ ПОЧЕК
На данный момент Форсига® (дапаглифлозин) — единственный** препарат, доказавший у пациентов с хронической болезнью почек (ХБП) снижение риска прогрессирования почечной патологии, смерти от сердечно-сосудистых и ренальных осложнений на 39% (ОР 0,61%; 95% ДИ 0,51-0,72 р<0,001) [1].
Практически 20 лет в лечении ХБП не было масштабных инноваций и благодаря новому показанию препарата Форсига® у врачей появляется возможность пациентам с ХБП снизить риск развития ухудшения функции почек, риск сердечно-сосудистой и общей смертности и уменьшить число госпитализаций по причине хронической сердечной недостаточности [1].
Форсига® (дапаглифлозин) — селективный обратимый ингибитор натрийглюкозного котранспортера 2-го типа (иНГЛТ-2).
Ингибирование НГЛТ-2 дапаглифлозином вызывает снижение реабсорбции глюкозы из клубочкового фильтра в проксимальных почечных канальцах с сопутствующим снижением реабсорбции натрия, приводя к выведению глюкозы почками и осмотическому диурезу. Таким образом, дапаглифлозин увеличивает доставку натрия к дистальным канальцам, что усиливает канальцево-клубочковую обратную связь и снижает внутриклубочковое давление. В сочетании с осмотическим диурезом приводит к уменьшению перегрузки объемом, снижению артериального давления и уменьшению преднагрузки и постнагрузки, что может оказывать благоприятное влияние на ремоделирование сердца и сохранить функцию почек. Таким образом, дапаглифлозин способен оказывать на сердечно-сосудистую систему и почки благоприятное воздействие [2].
На территории РФ препарат Форсига® применяется по следующим показаниям.
- Сахарный диабет 2 типа у взрослых пациентов в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве монотерапии и комбинированной терапии.
- Сахарный диабет 2 типа у взрослых пациентов с установленным диагнозом сердечно-сосудистого заболевания или двумя и более факторами сердечно-сосудистого риска**для снижения риска госпитализации по поводу сердечной недостаточности.
- Хроническая сердечная недостаточность (II–IV функциональный класс по классификации NYHA) со сниженной фракцией выброса у взрослых пациентов для снижения риска сердечно-сосудистой смерти и госпитализации по поводу сердечной недостаточности.
1 октября 2021 г. было зарегистрировано новое показание для применения препарата Форсига®: «Хроническая болезнь почек у взрослых пациентов с риском ее прогрессирования для уменьшения риска устойчивого снижения расчетной скорости клубочковой фильтрации, наступления терминальной стадии хронической почечной недостаточности, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности» [2].
Таким образом Форсига® (дапаглифлозин) стал первым в РФ официально одобренным препаратом из группы ингибиторов НГЛТ-2 для пациентов с ХБП вне зависимости от наличия СД 2 типа, терапия дапаглифлозином может быть инициирована у данных пациентов при рСКФ >25 мл/мин/1,73 м².
Основанием для регистрации нового показания стали результаты исследования Dapagliflozin And Prevention of Adverse outcomes in Chronic Kidney Disease (DAPA-CKD) — это международное многоцентровое рандомизированное двойное слепое исследование III фазы с участием 4304 пациентов [1].
Целью исследования являлась оценка эффективности дапаглифлозина в дозе 10 мг по сравнению с плацебо у пациентов с ХБП 2–4-й стадии с повышенной экскрецией альбумина с мочой, независимо от наличия сахарного диабета 2 типа. Дапаглифлозин применяли 1 раз в сутки в дополнение к стандартной терапии. Комбинированной первичной конечной точкой было ухудшение функции почек или риск смерти (определена как общий результат снижения расчетной скорости клубочковой фильтрации (рСКФ) на 50% и более, развития терминальной почечной недостаточности (ТПН) и смерти от сердечно-сосудистых или почечных осложнений). Благодаря высокой эффективности препарата исследование было завершено досрочно. Медиана наблюдения составила 2,4 года [1].
Исследование DAPA-CKD показало, что добавление дапаглифлозина в дозе 10 мг 1 раз в день к стандартной терапии у пациентов с ХБП снижает относительный риск комбинированной первичной конечной точки по сравнению с плацебо на 39% (ОР 0,61; 95% ДИ 0,51–0,72; P<0,001), Number Needed to Treat (NNT) 19 (95% ДИ 15–27). В данном исследовании дапаглифлозин продемонстрировал преимущество в отношении всех вторичных конечных точек. ОР для почечной комбинированной конечной точки (стойкое снижение рСКФ на 50% и более, ТПН или смерть вследствие почечных причин) составило 0,56 (95% ДИ 0,45–0,68; P<0,001); комбинированной конечной точки, включающей сердечно-сосудистую смерть или госпитализацию по поводу сердечной недостаточности — 0,71 (95% ДИ 0,55–0,92; P=0,009); конечной точки смерти от любой причины — 0,69 (95% ДИ 0,53–0,88; P=0,004) [1].
* независимо от наличия сахарного диабета 2 типа и ХСН.
** возраст у мужчин ≥55 лет или ≥60 лет у женщин и наличие не менее одного фактора риска: дислипидемия, артериальная гипертензия, курение.
Список литературы
1. Mayer-Davis EJ, Kahkoska AR, Jefferies C, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents. Pediatr Diabetes. 2018;19:7-19. doi: https://doi.org/10.1111/pedi.12773
2. Дедов И.И., Шестакова М.В., Петеркова В.А. и др. Сахарный диабет у детей и подростков по данным Федерального регистра Российской Федерации: динамика основных эпидемиологических характеристик за 2013–2016 гг. // Сахарный диабет. — 2017. — Т. 20. — №6. — С. 392-402. doi: https://doi.org/10.14341/DM9460
3. Cameron FJ, Garvey K, Hood KK, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Diabetes in adolescence. Pediatr Diabetes. 2018;19:250-261. doi: https://doi.org/10.1111/pedi.12702
4. White M, Sabin MA, Magnussen CG, et al. Long term risk of severe retinopathy in childhood‐onset type 1 diabetes: a data linkage study. Med J Aust. 2017;206(9):398-401. doi: https://doi.org/10.5694/mja16.00712
5. Trawley S, Browne JL, Hagger VL, et al. The Use of Mobile Applications Among Adolescents with Type 1 Diabetes: Results from Diabetes MILES Youth — Australia. Diabetes Technol Ther. 2016;18(12):813-819. doi: https://doi.org/10.1089/dia.2016.0233
6. Wu Y, Yao X, Vespasiani G, et al. Mobile App-Based Interventions to Support Diabetes Self-Management: A Systematic Review of Randomized Controlled Trials to Identify Functions Associated with Glycemic Efficacy. JMIR mHealth uHealth. 2017;5(3):e35. doi: https://doi.org/10.2196/mhealth.6522
7. Лаптев Д.Н., Емельянов А.О., Самойлова Ю.Г., и др. Дистанционное наблюдение и лечение детей и подростков с сахарным диабетом 1 типа // Проблемы Эндокринологии. — 2020. — Т. 66. — №4. — С. 50-60. doi: https://doi.org/10.14341/probl12201
8. Little RR, Rohlfing CL. The long and winding road to optimal HbA1c measurement. Clin Chim Acta. 2013;418:63-71. doi: https://doi.org/10.1016/j.cca.2012.12.026
9. Wong JC, Neinstein AB, Spindler M, Adi S. A Minority of Patients with Type 1 Diabetes Routinely Downloads and Retrospectively Reviews Device Data. Diabetes Technol Ther. 2015;17(8):555-562. doi: https://doi.org/10.1089/dia.2014.0413
10. Lee SWH, Ooi L, Lai YK. Telemedicine for the Management of Glycemic Control and Clinical Outcomes of Type 1 Diabetes Mellitus: A Systematic Review and Meta-Analysis of Randomized Controlled Studies. Front Pharmacol. 2017;8:330. doi: https://doi.org/10.3389/fphar.2017.00330
11. Lee SWH, Ooi L, Lai YK. Children and Adolescents: Standards of Medical Care in Diabetes–2021. Diabetes Care. 2021;44(S1):180-199. doi: https://doi.org/10.2337/dc21-S013
12. Лаптев Д.Н., Переверзева С.В., Емельянов А.О., Петеркова В.А. Мониторинг применения помповой инсулинотерапии у детей, подростков и молодых пациентов с сахарным диабетом 1 типа в Российской Федерации // Проблемы Эндокринологии. — 2018. — Т. 64. — №2. — С. 85-92. doi: https://doi.org/10.14341/probl8756
13. Lee SWH, Ooi L, Lai YK. Diabetes Technology: Standards of Medical Care in Diabetes—2021. Diabetes Care. 2021;44(S1):85-99. doi: https://doi.org/10.2337/dc21-S007
14. Grady M, Katz LB, Cameron H, et al. Diabetes App-Related Text Messages From Health Care Professionals in Conjunction With a New Wireless Glucose Meter With a Color Range Indicator Improves Glycemic Control in Patients With Type 1 and Type 2 Diabetes: Randomized Controlled Trial. JMIR Diabetes. 2017;2(2):e19. doi: https://doi.org/10.2196/diabetes.7454
Об авторах
Д. Н. ЛаптевРоссия
Лаптев Дмитрий Никитич - доктор медицинских наук, elibrary SPIN: 2419-4019.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
нет
И. А. Еремина
Россия
Еремина Ирина Александровна - кандидат медицинских наук; eLibrary SPIN: 9411-4710.
Москва
Конфликт интересов:
нет
А. В. Карпушкина
Россия
Карпушкина Анна Викторовна - доктор медицинских наук; eLibrary SPIN: 2925-2033.
Москва
Конфликт интересов:
нет
Е. Е. Петряйкина
Россия
Петряйкина Елена Ефимовна - доктор медицинских наук; eLibrary SPIN: 5997-7464.
Москва
Конфликт интересов:
нет
О. Б. Безлепкина
Россия
Безлепкина Ольга Борисовна, доктор медицинских наук; eLibrary SPIN: 3884-0945.
Москва
Конфликт интересов:
нет
В. А. Петеркова
Россия
Петеркова Валентина Александровна - доктор медицинских наук, профессор, академик РАН; elibrary SPIN: 4009-2463.
Москва
Конфликт интересов:
нет
Дополнительные файлы
|
|
1. Рисунок 1. Динамика показателей гликированного гемоглобина. Данные представлены в виде медианы (–), среднего значения (х), интерквартильного размаха 25–75 ([]) и отдельных значений. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(118KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Доля пациентов, достигнувших показателя гликированного гемоглобина <7,0 и <7,5%, исходно и по окончании исследования (различия статистически не значимы). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(70KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Показатели качества жизни PedsQL по окончании исследования по сравнению с исходным уровнем. Данные представлены в виде медианы (–), среднего значения (х), интерквартильного размаха 25–75 ([]) и отдельных значений. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(236KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Оценка программы дистанционного консультирования и мобильного приложения (врачи). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(718KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Оценка программы дистанционного консультирования и мобильного приложения (подростки). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(542KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Лаптев Д.Н., Еремина И.А., Карпушкина А.В., Петряйкина Е.Е., Безлепкина О.Б., Петеркова В.А. Дистанционное наблюдение подростков с сахарным диабетом 1 типа с использованием мобильного приложения. Сахарный диабет. 2021;24(5):404-413. https://doi.org/10.14341/DM12776
For citation:
Laptev D.N., Eremina I.A., Karpushkina A.V., Petryaykina E.E., Bezlepkina O.B., Peterkova V.A. Remote monitoring of adolescents with type 1 diabetes mellitus using a mobile application. Diabetes mellitus. 2021;24(5):404-413. (In Russ.) https://doi.org/10.14341/DM12776

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































