Перейти к:
Сравнительная оценка кардиопротективных свойств эмпаглифлозина, канаглифлозина и ситаглиптина у крыс с экспериментальным сахарным диабетом 2 типа
https://doi.org/10.14341/DM12714
Аннотация
Актуальность. Инфаркт миокарда (ИМ) занимает лидирующие позиции в структуре смертности больных сахарным диабетом 2 типа (СД2), в связи с чем необходимо отдавать предпочтение сахароснижающим препаратам с оптимальными кардиопротективными свойствами. Сравнительное изучение защитных эффектов различных представителей класса ингибиторов натрий-глюкозного ко-транспортера-2 при экспериментальном ИМ в рамках одного исследования не производилось.
Цель. Оценить влияние эмпаглифлозина (ЭМПА) и канаглифлозина (КАНА) в сравнении с ситаглиптином (СИТА) на параметры гемодинамики и площадь повреждения миокарда у крыс с моделью СД2 при экспериментальном ИМ.
Материалы и методы. У крыс Вистар моделировался СД за счет 4-недельной высокожировой диеты и введения никотинамида 230 мг/кг и стрептозотоцина 60 мг/кг. Через 4 нед после индукции СД были сформированы группы «СД+СИТА» — терапия СИТА 50 мг/кг, «СД+ЭМПА» — терапия ЭМПА 2 мг/кг, «СД+КАНА» — терапия КАНА 25 мг/кг per os 1 раз в день 8 нед. Животные группы «СД» оставались без лечения последующие 8 нед. Крысы контрольной группы находились на стандартном рационе. Через 16 нед от начала эксперимента воспроизводилась транзиторная глобальная ишемия миокарда. Оценивались параметры гемодинамики и площадь некроза миокарда.
Результаты. Площадь некроза была больше в группе «СД», чем в контрольной группе (р=0,018). В группе «СД+СИТА» размер инфаркта не отличался от такового в группе «СД» (62,92 (41,29; 75,84) и 57,26 (45,51; 70,08)% соответственно, р=0,554). Площадь некроза в группах «СД+ЭМПА» и «СД+КАНА» была меньше, чем в группе «СД» (37,90 (20,76; 54,66)%, 46,15 (29,77; 50,55) vs 57,26 (45,51; 70,08)%, р=0,008 и р=0,009 соответственно). Размеры некроза не отличались между группами «СД+ЭМПА» и «СД+КАНА» (р=0,630). В группе «СД+КАНА» выраженность ишемической контрактуры была меньше, чем на фоне всех других сахароснижающих препаратов. В группе «СД+ЭМПА» наблюдалось нарастание коронарного кровотока по сравнению с группами «СД», «СД+КАНА» и «СД+СИТА».
Заключение. СИТА не оказывает кардиопротективного эффекта в условиях ишемического-реперфузионного повреждения у крыс с СД2. ЭМПА и КАНА обладают инфаркт-лимитирующими свойствами сходной выраженности. ЭМПА способен увеличивать скорость коронарного кровотока, кардиопротективное действие КАНА ассоциировано с уменьшением ишемической контрактуры.
Ключевые слова
Для цитирования:
Симаненкова А.В., Минасян С.М., Каронова Т.Л., Власов Т.Д., Тимкина Н.В., Хальзова А.К., Фукс О.С., Шимшилашвили А.А., Тимофеева В.А., Борщев Ю.Ю., Галагудза М.М. Сравнительная оценка кардиопротективных свойств эмпаглифлозина, канаглифлозина и ситаглиптина у крыс с экспериментальным сахарным диабетом 2 типа. Сахарный диабет. 2021;24(2):111-121. https://doi.org/10.14341/DM12714
For citation:
Simanenkova A.V., Minasian S.M., Karonova T.L., Vlasov T.D., Timkina N.V., Khalzova А.K., Fuks O.S., Shimshilashvili A.A., Timofeeva V.A., Borshchev Yu.Yu., Galagudza M.M. Comparative evaluation of empagliflozin, canagliflozin and sitagliptin cardioprotective properties in rats with experimental type 2 diabetes mellitus. Diabetes mellitus. 2021;24(2):111-121. (In Russ.) https://doi.org/10.14341/DM12714
В настоящее время сахарный диабет (СД) является глобальной проблемой, и по данным Атласа IDF 2019 г. установлено, что этим заболеванием страдают 463 млн человек, то есть каждый 11-й в возрасте от 20 до 79 лет [1]. Вместе с тем в структуре смертности больных СД одно из передовых мест занимает инфаркт миокарда (ИМ), который также относят и к одному из наиболее частых осложнений СД 2 типа (СД2). В России на 2019 г. 8,29 млн человек страдают СД, при этом ишемическая болезнь сердца, в частности ИМ, выявляется практически у 40% больных [1]. В этой связи в современных российских [2] и зарубежных [3] алгоритмах в терапии СД лидирующие позиции занимают сахароснижающие препараты, обладающие плейотропным кардиопротективным эффектом, потенциально способные снижать частоту развития фатального и нефатального ИМ.
Особый интерес в последние годы привлекают препараты класса ингибиторов натрий-глюкозного ко-транспортера (иНГЛТ-2). Результаты международного мультицентрового исследования EMPA-REG OUTCOME (Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients) показали, что применение эмпаглифлозина (ЭМПА) у пациентов с СД2 позволяет снизить общую и сердечно-сосудистую смертность, госпитализацию по поводу сердечной недостаточности, в то же время достоверно не влияя на частоту развития нефатальных ИМ [4]. Данные последнего суб-анализа EMPA-REG OUTCOME свидетельствую о том, что ЭМПА предотвращает риск не только первых, но и повторных событий. И если в отношение первых событий – нефатальных инфарктов - достоверного отличия показано не было, то, если говорить об общих (первых и повторных) событиях, у пациентов с СД2 и сердечно-сосудистыми заболеваниями лечение эмпаглифлозином привело к снижению относительного риска развития ИМ на 21% (ОР 0,79 ДИ (0,620, 0,998)) [5]. Аналогично, в исследовании CANVAS (CANagliflozin cardioVascular Assessment Study) канаглифлозин (КАНА) продемонстрировал способность снижать частоту госпитализаций по поводу сердечной недостаточности, однако частота ИМ не отличалась в группе больных СД2, получавших КАНА, по сравнению с плацебо [6].
Особого внимания, на наш взгляд, заслуживает изучение влияния иНГЛТ-2 не только на частоту развития ИМ, но и на тяжесть его течения, обусловленную в первую очередь объемом поражения миокарда, а также на исходы заболевания.
В настоящее время существует ограниченное число экспериментальных работ, освещающих влияние иНГЛТ-2 на объем некроза миокарда и выживаемость после ИМ, а результаты имеющихся — довольно противоречивы [7–10]. В нескольких работах показано, что ЭМПА не обладает инфаркт-лимитирующим потенциалом, несмотря на положительное влияние на суррогатные конечные точки [7, 8]. Так, в исследовании S.R. Yurista и соавт. терапия ЭМПА как до, так и после моделирования ИМ не повлиял на размер некроза. В то же время фракция выброса левого желудочка у животных, получавших ЭМПА, была достоверно выше, чем в контрольной группе. Дополнительно к этому применение ЭМПА уменьшало выраженность гипертрофии кардиомиоцитов, интерстициального фиброза и оксидативного стресса [7]. Hiroto Oshima и соавт. выявили, что применение ЭМПА в течение 14 дней до моделирования ишемии у крыс с экспериментальным СД позволяет улучшить показатели выживаемости на 70%, несмотря на отсутствие достоверных различий в объеме ИМ у крыс, получавших и не получавших ЭМПА [8]. Следует отметить, что моделирование было проведено на крысах без диабета.
Недавно было опубликовано проспективное, многоцентровое, рандомизированное, двойное-слепое, плацебо-контролируемое исследование на 105 пациентах EMBODY, которое демонстрирует влияние эмпаглифлозина на симпатическую активность у пациентов с острым инфарктом миокарда и СД2, в котором было показано, что раннее назначение эмпаглифлозина пациентам с ОИМ с СД2 может быть эффективным для улучшения иннервации сердца без каких-либо побочных эффектов. Авторы обсуждают потенциальные механизмы, которые могут лежать в основе благоприятного эффекта класса ингибиторов SGLT2 в отношение ИМ [9].
КАНА же, напротив, по данным ряда исследователей, продемонстрировал достоверный инфарктлимитирующий эффект. Так, A.A. Sayour и соавт. показали, что болюсное введение КАНА через 5 мин после начала ишемии миокарда крысам без СД приводит к уменьшению размера некроза по сравнению с применением физиологического раствора. Кроме того, авторы наблюдали более низкий уровень тропонина Т в группе животных, получавших КАНА. Препарат также улучшал систолическую и диастолическую функции миокарда левого желудочка, нарушение которых имело место вследствие ишемического и реперфузионного повреждения [10]. Результаты другого исследования, опубликованные в 2019 г., подтвердили, что назначение КАНА в течение 4 нед до моделирования ИМ как у крыс без СД, так и у крыс с СД вызывает уменьшение объема повреждения миокарда [11].
Насколько нам известно, результаты непосредственного сравнения эффектов ЭМПА и КАНА в рамках одного исследования в литературе отсутствуют. В связи с этим представляется актуальным проведение такого исследования для уточнения плейотропных эффектов и выбора наиболее эффективного, в отношении кардиопротективных свойств, сахароснижающего препарата с целью оптимизации схем терапии СД2.
Нами были выбраны эти два представителя класса иНГЛТ-2 в связи с имеющимися между ними различиями в степени селективности действия на натрий-глюкозный ко-транспортер (НГЛТ) 1 и 2 типа. В качестве препарата сравнения был использован ситаглиптин (СИТА) как представитель класса ингибиторов дипептидилпептидазы-4 (иДПП-4). Результаты международных рандомизированных клинических исследований [12] продемонстрировали, что данный препарат не увеличивает кардиоваскулярный риск, однако и не обладает дополнительным кардиопротективным действием, не приводя к уменьшению частоты развития нефатальных ИМ и не снижая сердечно-сосудистую смертность по сравнению с плацебо («non-inferiority»). Аналогично, в большинстве представленных экспериментальных работ [13][14] описано положительное влияние иДПП-4 на суррогатные конечные точки, такие как функциональное состояние миокарда, оцененное при помощи эхокардиографии, или степень выраженности фиброза, и не подтверждена возможность препаратов этого класса уменьшать объем повреждения миокарда. Таким образом, СИТА, как один из наиболее широко использующихся в клинической практике иДПП-4, может рассматриваться в качестве препарата сравнения с нейтральным влиянием на жесткую конечную точку, каковой является объем некроза миокарда.
ЦЕЛЬ
Изучить влияние ЭМПА и КАНА в сравнении с СИТА на параметры гемодинамики и размер некроза миокарда у крыс с СД в условиях экспериментального ИМ.
МЕТОДЫ
Дизайн
Крысы стока Вистар в течение 4 нед и далее в ходе эксперимента находились на диете с высоким содержанием насыщенных жиров (22%). Через 4 нед от начала опыта осуществлялось введение раствора никотинамида (Nicotimamide, Sigma-Aldrich, St. Louis, MO, США) 230 мг/кг внутрибрюшинно в качестве панкреатопротектора, через 15 мин — раствора стрептозотоцина (Streptozotocin, Sigma-Aldrich, St. Louis, MO, США) 60 мг/кг внутрибрюшинно в качестве панкреатотоксина для индукции СД2. Подобная методика моделирования СД2 при помощи содержания животных на диете, богатой насыщенными жирами, с последующим применением никотинамида и стрептозотоцина, применяется в экспериментальных исследованиях [15].
На 2-е и 3-и сутки после введения никотинамида и стрептозотоцина производилось определение гликемии в крови из хвостовой вены. Нормальными считались значения гликемии от 3,3 до 7,8 ммоль/л, поскольку измерение производилось не натощак. При выявлении в 2 измерениях, выполненных в разные дни, гликемии больше 11,1 ммоль/л диагностировался СД. При обнаружении меньших значений гликемии хотя бы в одном из измерений выполнялся пероральный глюкозотолерантный тест (ПГТТ). Определение гликемии производилось исходно (натощак), а также через 15, 30 и 60 мин после зондового введения 40% раствора глюкозы 3 г/кг массы тела животного. При выявлении во время ПГТТ, после введения глюкозы, в любой из точек гликемии больше 11,1 ммоль/л диагностировался СД. В случае обнаружения меньших значений гликемии такие животные исключались из дальнейшего эксперимента.
Через 4 нед после введения никотинамида и стрептозотоцина производилось повторное определение гликемии. В последующем животные были разделены на группы «СД» (без лечения), «СД+СИТА» (крысы с СД, получающие терапию СИТА), «СД+ЭМПА» (крысы с СД, получающие терапию ЭМПА), «СД+КАНА» (крысы с СД, получающие терапию КАНА).
Наблюдение за крысами и введение исследуемых препаратов продолжалось в течение 8 нед.
Параллельно была создана группа «Контроль» — крысы без СД, содержавшиеся на стандартном корме в течение 16 нед эксперимента.
Через 16 нед от начала опыта во всех группах осуществлялось моделирование транзиторной ишемии миокарда с применением методики перфузии изолированного сердца, с оценкой параметров гемодинамики и площади некроза миокарда при помощи окраски срезов раствором 2,3,5-трифенилтетразолия хлорида.
Дизайн исследования представлен на рис. 1.
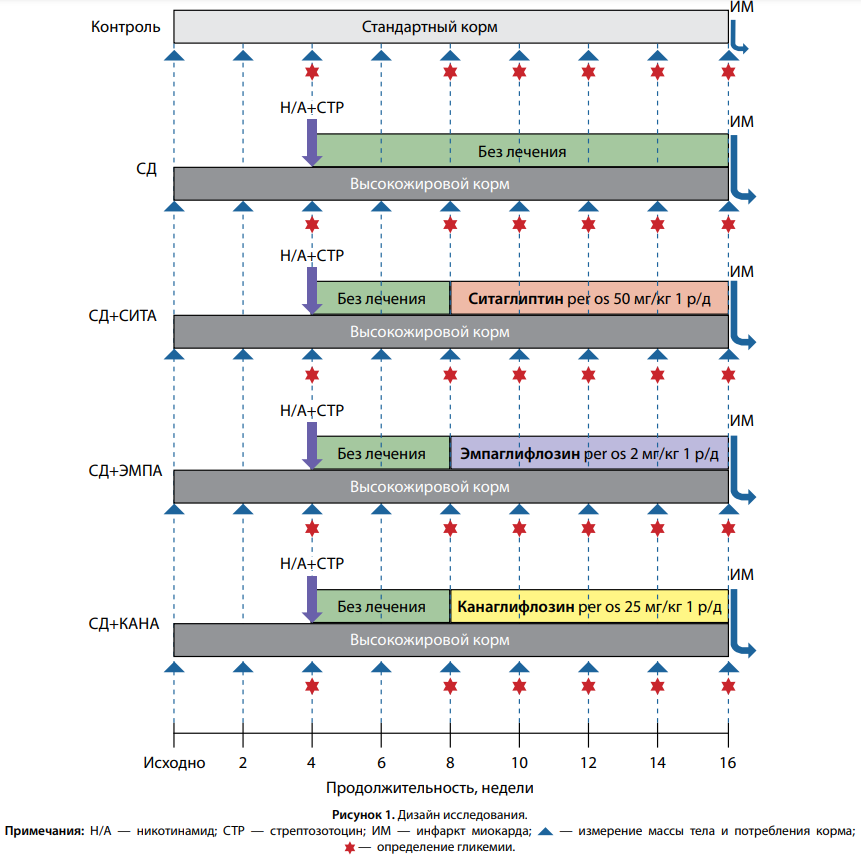
КРИТЕРИИ СООТВЕТСТВИЯ И УСЛОВИЯ ПРОВЕДЕНИЯ
Исследование выполнялось на крысах-самцах стока Вистар массой 150–250 г, полученных из питомника лабораторных животных «Пущино», на базе Центра доклинических и трансляционных исследований Института экспериментальной медицины НМИЦ им. В.А. Алмазова.
Крысы содержались не более чем по 5 голов в одной клетке, на неограниченном потреблении корма и воды, при фиксированном световом режиме 12.00:12.00 ч (свет:темнота). Температура поддерживалась в пределах 22–25° С, относительная влажность — 50–70%.
Длительность карантина (акклиматизационного периода) для всех животных составляла 14 дней. В течение карантина проводился ежедневный осмотр каждого животного. Оценивались окраска кожи и видимых слизистых, поведение, характер двигательной активности, наличие судорог, изменение характера дыхательных движений, положение хвоста. Взвешивание производилось при поступлении животных и в период карантина — не реже 1 раза в неделю. Животные, имевшие отклонения по весу, общему состоянию или поведению, не были включены в эксперимент.
ПРОДОЛЖИТЕЛЬНОСТЬ ИССЛЕДОВАНИЯ
Все животные были включены в исследование одномоментно.
Первоначально крысы общей экспериментальной группы находились на диете с повышенным содержанием жиров («Про Корм», «БиоПро», г. Новосибирск, Россия: обменная энергия 2690 ккал/кг, сырой протеин 20%, сырой жир 22%) в течение 4 нед. После индукции СД (введения никотинамида и стрептозотоцина) все крысы общей группы оставались без лечения в течение 4 нед. После разделения на исследуемые группы («СД», «СД+СИТА», «СД+ЭМПА», «СД+КАНА») эксперимент продолжался еще 8 нед. Таким образом, суммарная длительность опыта составляла 16 нед, сахароснижающие препараты вводились в течение 8 нед.
Животные контрольной группы находились на стандартном рационе (Koмбикорм JIБK-120_10 6002, ЗАО «Тосненский комбикормовый завод») в течение 16 нед.
Взвешивание животных и определение потребления корма производились 1 раз в 2 дня в ходе всего эксперимента.
В контрольной группе измерение гликемии осуществлялось в конце 4-й недели (28-й день), 8-й недели (56-й день), 10-й недели (70-й день), 12-й недели (84-й день), 14-й недели (98-й день) и 16-й недели (112-й день) эксперимента (постпрандиальные измерения).
В группе «СД» определение гликемии производилось через 4 нед эксперимента (на 2-й и 3-й день после введения стрептозотоцина), в конце 8-й недели (56-й день), 10-й недели (70-й день), 12-й недели (84-й день), 14-й недели (98-й день) и 16-й недели (112-й день) эксперимента (постпрандиальные измерения).
В группах «СД+СИТА», «СД+ЭМПА», «СД+КАНА» оценку гликемии проводили через 4 нед эксперимента (на 2-й и 3-й день после введения стрептозотоцина), в конце 8-й недели (56-й день), затем каждый 3-й день в течение 8 нед лечения в то же время дня (постпрандиальная гликемия), через 5 ч после лечения.
ОПИСАНИЕ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
Анестезию проводили золетилом (тилетамина гидрохлорид 30 мг/кг и золазепама гидрохлорид 30 мг/кг) внутримышечно и ксилазина гидрохлоридом 6 мг/кг внутримышечно. После достижения хирургической стадии наркоза производилась широкая тораколапаротомия, обнажались органы грудной полости и извлекалось сердце, после чего оно подключалось к модифицированному аппарату Лангендорфа. Перфузия осуществлялась ретроградно через восходящую аорту, при этом венозный отток перфузата происходил из правых камер сердца. В полость левого желудочка вводили полиэтиленовый баллон, соединенный с датчиком давления для регистрации внутрилевожелудочкового давления и создания адекватной преднагрузки. Перфузию осуществляли с использованием модифицированного буферного раствора Кребса–Хенселейта (состоящего из следующих компонентов [в ммоль/л]: NaCl 118,5; KCl 4,7; NaHCO3 25; KH2PO4 1,2; MgSO4 1,2; глюкоза 11 и CaCl2 1,5) при постоянном давлении 80 мм рт. ст. и температуре +37 °С [16]. При этом левый желудочек сокращался в изоволюметрическом режиме за счет того, что объем введенного в его полость баллона был постоянен и оказывал преднагрузку на физиологическом уровне (не более 12 мм рт. ст.).
После окончания стабилизационного периода продолжительностью 5 мин регистрировали функциональные параметры работы сердца: систолическое левожелудочковое давление (СЛЖД), диастолическое левожелудочковое давление (ДЛЖД), пульсовое левожелудочковое давление (ПЛЖД), а также интенсивность коронарной перфузии (скорость коронарного кровотока).
Полная 30-минутная нормотермическая ишемия миокарда и последующая 90-минутная реперфузия были вызваны обратимым выключением перфузии. В течение периода ишемии каждые 5 мин регистрировали значение внутрилевожелудочкового давления (ВЛЖД) с целью оценки тяжести ишемической контрактуры. В период реперфузии функциональные параметры (коронарный кровоток, СЛЖД, ДЛЖД и ПЛЖД) регистрировались каждые 15 мин.
ОСНОВНОЙ ИСХОД ИССЛЕДОВАНИЯ
Основным исходом данного исследования является влияние ЭМПА, КАНА и СИТА на гликемию и объем некроза миокарда. Кроме того, к основным исходам исследования следует отнести изменения гемодинамических параметров (ВЛЖД, ДЛЖД, ПЛЖД, коронарный кровоток), позволяющие дополнительно охарактеризовать потенциальное кардиопротективное действие изучаемых препаратов.
ДОПОЛНИТЕЛЬНЫЕ ИСХОДЫ ИССЛЕДОВАНИЯ
Дополнительные исходы включают динамику массы тела и потребления корма на фоне исследуемой терапии.
АНАЛИЗ В ПОДГРУППАХ
В ходе исследования были сформированы следующие группы животных:
1.«СД» (n=4) — крысы с экспериментальным СД2 не получали сахароснижающей терапии в течение 12 нед до моделирования ИМ;
2.«СД+СИТА» (n=4) — через 4 нед после индукции СД была начата 8-недельная терапия ситаглиптином (Янувия, Merck Sharp & Dohme B.V., Нидерланды) 50 мг/кг per os 1 раз в день, до моделирования ИМ;
3.СД+ЭМПА» (n=4) — через 4 нед после индукции СД была начата 8-недельная терапия эмпаглифлозином (Джардинс, Boehringer Ingelheim, Германия) 2 мг/кг per os 1 раз в день, до моделирования ИМ;
4.«СД+КАНА» (n=4) — через 4 нед после индукции СД была начата 8-недельная терапия канаглифлозином (Инвокана, Janssen-Cilag S.p.A, Италия) 25 мг/кг per os 1 раз в день, до моделирования ИМ;
5.«Контроль» (n=6) — крысы содержались на стандартном корме в течение 16 нед до моделирования ИМ.
МЕТОДЫ РЕГИСТРАЦИИ ИСХОДОВ
Оценка гемодинамических параметров
При проведении исследования на модели изолированного сердца в полость левого желудочка через левое предсердие вводили неэластичный полиэтиленовый баллон, соединенный с датчиком давления, для регистрации ВЛЖД в период ишемии, а также СВЖД и ДВЖД исходно и в реперфузионном периоде. Значение ПЛЖД рассчитывалось как разница между СЛЖД и ДЛЖД. Указанные параметры регистрировали с помощью программы PhysExp (Cardioprotect Ltd., Санкт-Петербург, Россия). Скорость коронарного кровотока определяли путем измерения времени оттока перфузата.
Определение площади инфаркта миокарда
По окончании реперфузии осуществлялось измерение объема необратимо поврежденного миокарда желудочков методом гистохимического окрашивания поперечных срезов сердца 1% раствором 2,3,5-трифенилтетразолия хлорида (MP Biomedicals, США). Срезы инкубировались в указанном растворе в течение 15 мин, при этом жизнеспособный миокард окрашивался в ярко-красный цвет. Участки необратимо поврежденного миокарда оставались неокрашенными. Затем производились фотографирование срезов и компьютерная обработка изображений с последующим вычислением значения площади поврежденного миокарда, выражаемой в процентах от общей площади миокарда желудочков, с помощью программ ImageJ, Adobe Photoshop 8.0.
Определение гликемии
Производилась пункция хвостовой вены, после чего содержание глюкозы в полученной капле венозной крови измерялось при помощи прибора определения гликемии и кетонемии StatStrip (Nova Biomedical, США).
Определение веса животных и корма
Масса тела крыс и масса потребленного корма определялись 1 раз в 2 дня в одно и то же время при помощи портативных весов.
ЭТИЧЕСКАЯ ЭКСПЕРТИЗА
Проведение настоящего исследования одобрено Комиссией по контролю содержания и использования лабораторных животных (IACUC) Национального медицинского исследовательского центра им. В.А. Алмазова, протокол № 19-1П3#V1 от 14.01.2019. Резюме Комиссии по контролю содержания и использования лабораторных животных: «Протокол утвержден».
СТАТИСТИЧЕСКИЙ АНАЛИЗ
Принципы расчета размера выборки: размер выборки предварительно не рассчитывался.
Методы статистического анализа данных: Статистическая обработка данных производилась при помощи программного пакета IBM SPSS Statistics-22 (IBM, США) и Statistica-10 (Statsoft, США). Статистический анализ производился при помощи непараметрических методов. Значимость различий между группами оценивалась с помощью непараметрического критерия Крускала–Уоллеса и Манна–Уитни для независимых выборок, с применением непараметрического дисперсионного анализа (апостериорное попарное сравнение групп при помощи критерия Данна). Все показатели представлены в виде «медиана (25%; 75%)». Значения Р меньше 0,05 рассматривались как значимые.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
За время акклиматизационного периода у животных не были обнаружены симптомы, не позволившие включить их в дальнейшее исследование. В опыт были включены 24 крысы Вистар массой 121,00 (201,75; 222,25) г.
Основные результаты исследования
Уровень гликемии в группе «СД» был достоверно выше такового в группе «Контроль» на протяжении всего эксперимента. Контроль гликемии при применении всех трех исследуемых препаратов был удовлетворительным и не превышал уровня 7,8 ммоль/л, характеризующего постпрандиальную гликемию в норме, в отсутствие СД. Показатели гликемии не различались между группами «СД+СИТА», «СД+ЭМПА» и «СД+КАНА» и не превышали таковые в группе здорового контроля (рис. 2).
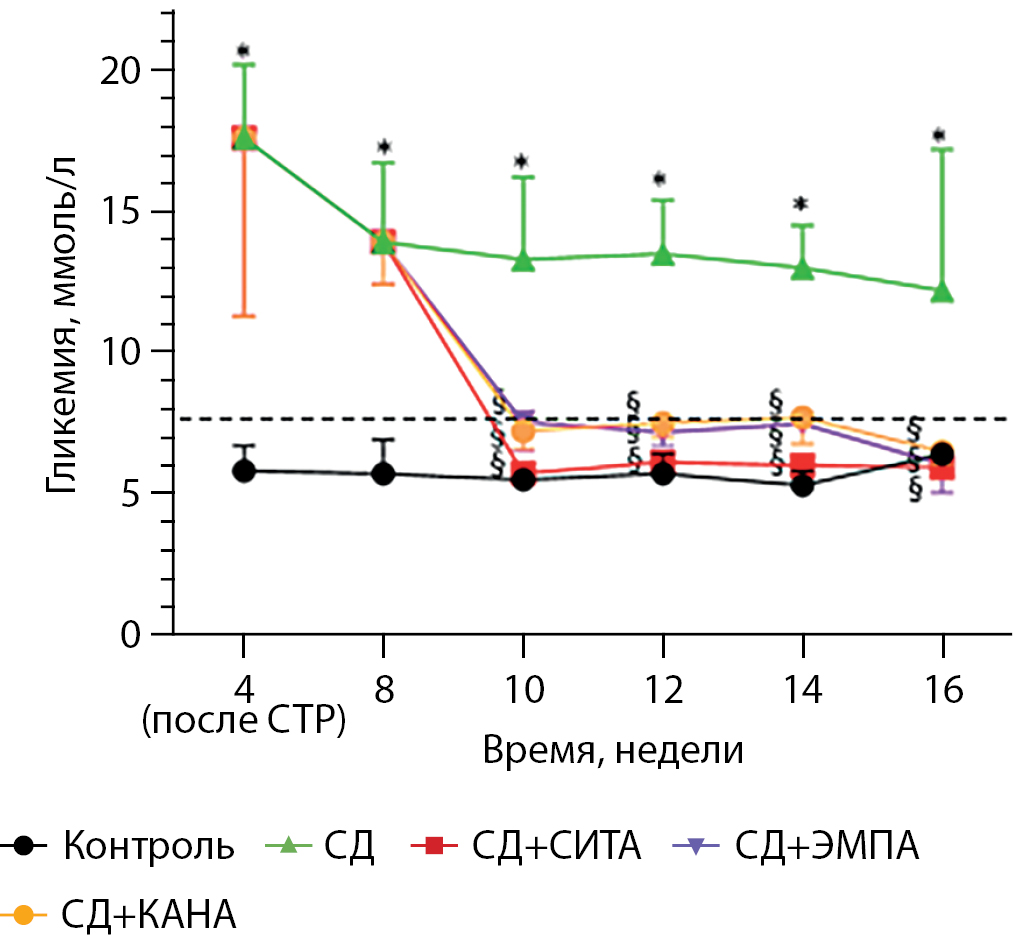
Рисунок 2. Динамика гликемии в ходе эксперимента.
Результаты представлены в виде медианы (25; 75)%. * — p<0,05 по сравнению с группой «Контроль». § — p<0,05 по сравнению с группой «СД». СТР — стрептозотоцин.
В ходе моделирования глобальной ишемии в группе «СД» наблюдалось достоверно более выраженное нарастание ВЛЖД, чем в контрольной группе. Ни один из исследуемых препаратов не вызвал значимого снижения ВЛЖД по сравнению с группой животных с СД без лечения. В то же время нами были обнаружены различия в степени выраженности ишемической контрактуры при применении СИТА, ЭМПА и КАНА. Так, ишемическая контрактура в группе «СД+КАНА» имела тенденцию к снижению по сравнению с таковой в группе «СД+СИТА» через 10 и 15 мин и была достоверно менее выраженной на 20-й минуте. Более того, ВЛЖД в группе «СД+КАНА» было ниже, чем в группе «СД+ЭМПА», начиная с 20-й минуты до конца периода ишемии. Необходимо отметить, что ВЛЖД у животных, получавших КАНА, не отличалось от значений данного параметра у здоровых животных контрольной группы на 10-й и 15-й минутах ишемического периода (рис. 3А). Таким образом, мы можем предположить, что КАНА способен уменьшать выраженность ишемической контрактуры, чем может быть обусловлен его потенциальный кардиопротективный эффект.
Мы не выявили различий в уровне ДВДЖ в реперфузионном периоде между группами «Контроль» и «СД». В то же время необходимо отметить, что в группе «СД+СИТА» уровень ДВДЖ был выше, чем в контрольной группе и даже выше, чем в группе «СД» в ряде точек измерения. У животных с СД, получавших ЭМПА, ДВЖД достоверно не отличалось от такового у животных с СД без лечения, в то же время будучи достоверно выше, чем в контрольной группе на 75-й и 90-й минутах реперфузии. Аналогично, в группе «СД+КАНА» ДВЖД не отличалось от этого показателя в группе «СД», но было выше, чем в группе «Контроль». ДВЖД было выше в группе «СД+СИТА», чем в группе «СД+ЭМПА», различия между группами «СД+ЭМПА» и «СД+КАНА» находились на уровне статистической тенденции (рис. 3Б).
Значение ПВЖД исходно было выше в группе «Контроль» по сравнению с группой «СД», однако, как и в случае с показателем ДВЖД, в реперфузионном периоде достоверных различий между группами выявлено не было. ПВЖД у животных с СД на фоне терапии СИТА не отличалось от такового у животных с СД без лечения. Аналогично, терапия ЭМПА не привела к нарастанию ПВЖД по сравнению с животными с СД без лечения. Достоверные различия между группами «СД+СИТА» и «СД+ЭМПА» отсутствовали. В то же время необходимо отметить, что у крыс, получавших КАНА, ПВЖД в ряде точек измерения было достоверно ниже, чем у крыс, получавших ЭМПА, и преимущественно не отличалось от ПВЖД в группе «Контроль», в ряде точек будучи также ниже показателей контрольной группы (рис. 3В).
Таким образом, можно заключить, что КАНА, достоверно снижая выраженность ишемической контрактуры, не оказывает положительного влияния на гемодинамические параметры в реперфузионном периоде.
Мы не обнаружили значимых различий в коронарном кровотоке между группами «Контроль» и «СД» исходно и в течение периода реперфузии. Коронарный кровоток в группе «СД+СИТА» не отличался от такового в группе «СД». В то же время крысы с СД, получавшие ЭМПА, имели значимо более высокую скорость кровотока на 15-й и 30-й минутах реперфузионного периода, чем крысы с СД без лечения, применение же КАНА не привело к нарастанию скорости кровотока по сравнению с группой «СД» без лечения. Коронарный кровоток был выше в группе «СД+ЭМПА», чем «СД+СИТА», во всех точках измерения, а также выше, чем в группе «СД+КАНА», на 30-й и 45-й минутах реперфузионного периода (рис. 3Г).
Площадь повреждения миокарда в группе «СД» (57,26 (45,51; 70,08)%) была больше, чем в группе «Контроль» (42,98 (33,26; 61,84)%), р<0,05. Применение СИТА не оказало инфаркт-лимитирующего действия, площадь некроза в группе «СД+СИТА» (62,92 (41,29; 75,84)%) не отличалась от таковой в группе «СД» без сахароснижающей терапии (57,26 (45,51; 70,08)%), р>0,05. В то же время размер инфаркта в группах «СД+ЭМПА» (37,90 (20,76; 54,66)%) и «СД+КАНА» (46,15 (29,77; 50,55)%) был достоверно меньше, чем в группе «СД» (р<0,05 для обоих сравнений). Различий между группами «СД+ЭМПА» и «СД+КАНА» не было. Более того, площадь некроза в группах «СД+ЭМПА» и «СД+КАНА» не отличалась от таковой в группе «Контроль» (р>0,05) (рис. 3Д). Репрезентативные изображения срезов миокарда при инкубации их с раствором 1% трифенилтетразолия хлорида представлены на рис. 3Е.
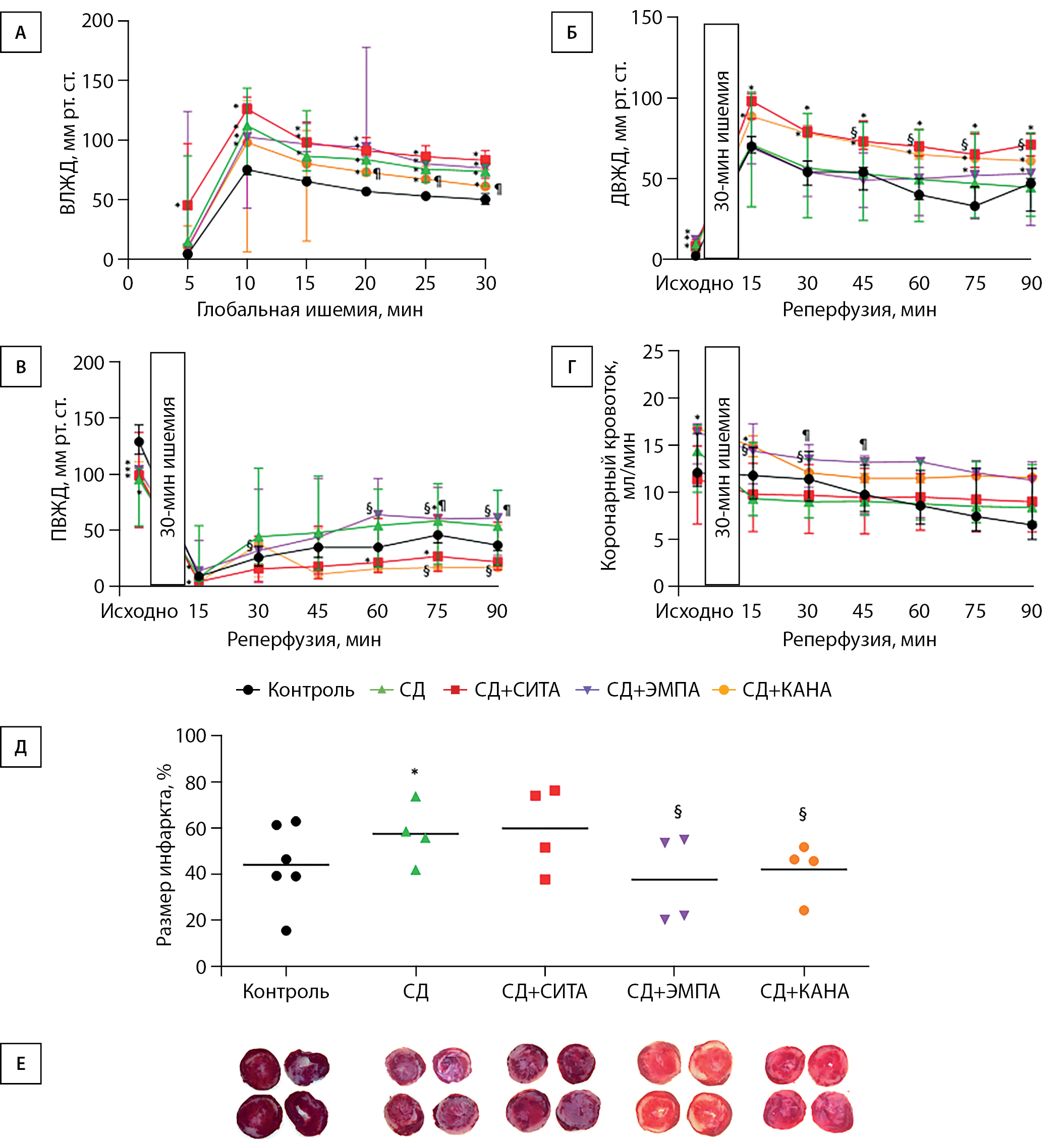
Рисунок 3. Гемодинамические параметры и размер инфаркта миокарда в изолированном сердце в условиях 30-минутной глобальной ишемии с последующей 90-минутной реперфузией.
(A) Ишемическая контрактура, (Б) ДВЖД, (В) ПВЖД, (Г). Коронарный кровоток исходно и в течение эксперимента. Результаты представлены в виде медианы (25; 75)%. (Д) Площадь инфаркта миокарда. (Е) Репрезентативные изображения срезов миокарда при инкубации с раствором 1% трифенилтетразолия хлорида. * — p<0,05 по сравнению с группой «Контроль». § — p<0,05 по сравнению с группой «СД». ¶ — <0,05 при сравнении между группами «СД+ЭМПА» и «СД+КАНА».
Дополнительные результаты исследования
Как в группе «Контроль», так и в группе «СД» прибавка массы тела была равномерной, при этом в группе «СД» она была более интенсивной на протяжении всего эксперимента. В группе «СД+СИТА» прибавка массы тела была больше, чем в контрольной группе, и больше, чем в группе «СД». Назначение КАНА животным с СД привело к замедлению прибавки массы тела, последняя оставалась стабильной на протяжении всего времени применения препарата. Масса тела крыс в группе «СД+КАНА» была достоверно меньше, чем в группе «СД+СИТА», в течение всего времени применения препаратов. Примечательно, что, вопреки имеющимся клиническим данным о способности ЭМПА снижать массу тела [17][18], мы не наблюдали данного феномена в ходе нашего эксперимента. В группе «СД+ЭМПА» прибавка массы тела была более интенсивной, чем в группах «СД», «СД+КАНА» и «СД+СИТА» (рис. 4А).
Потребление корма в группе «Контроль» было равномерным в течение всего эксперимента. В группе «СД» наблюдалось прогрессивное нарастание потребления корма, наиболее выраженное с 8-й по 12-ю неделю. Данный показатель был достоверно больше в группе «СД» по сравнению с «Контролем». В группе «СД+СИТА» после значительного нарастания потребления корма наблюдалась его стабилизация. В большинстве точек измерения различий между группами «СД» и «СД+СИТА» не было. Примечательно, что потребление корма в группах «СД+ЭМПА» и «СД+КАНА» превышало таковое в группе «СД» в конце эксперимента, с 14-й по 16-ю недели (рис. 4Б).
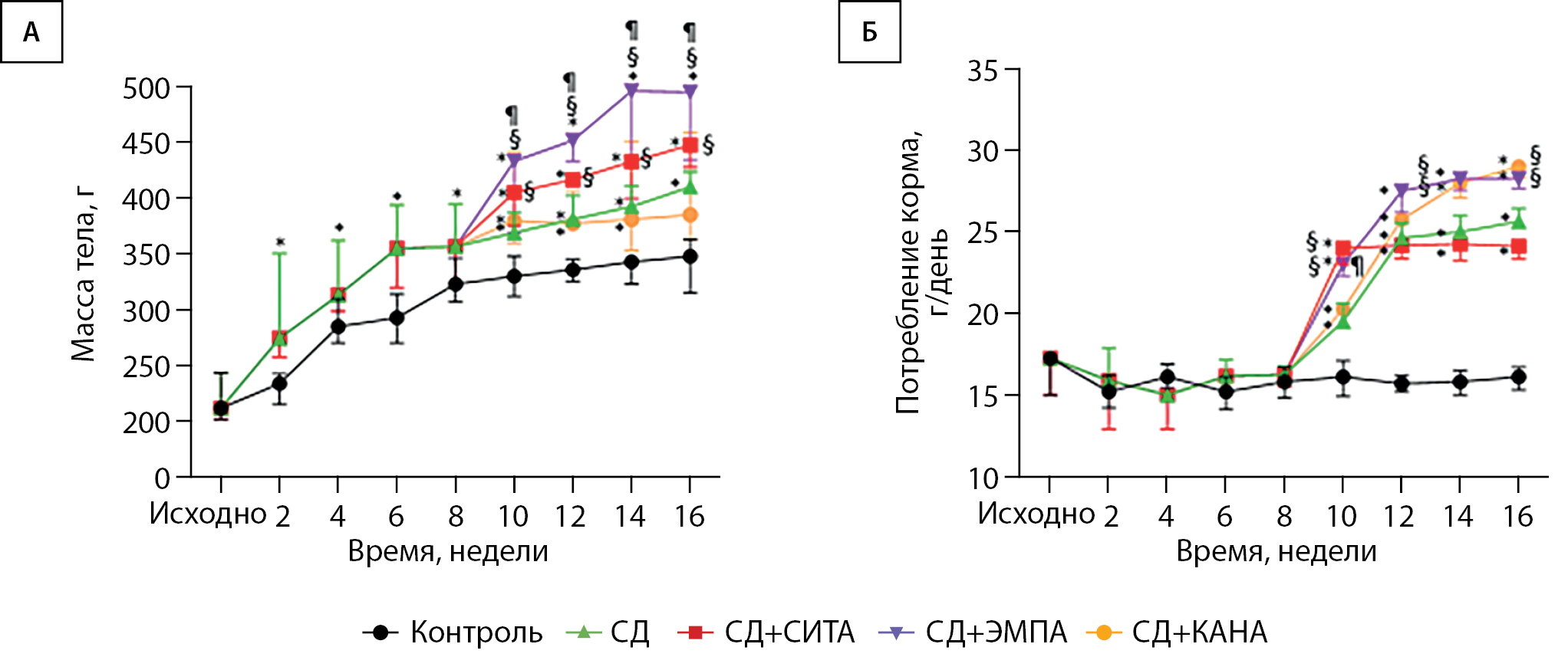
Рисунок 4. Динамика массы тела и потребления корма в ходе эксперимента.
Динамика (A) массы тела и (Б) потребления корма. Результаты представлены в виде медианы (25; 75)%. * — p<0,05 по сравнению с группой «Контроль». § — p<0,05 по сравнению с группой «СД». ¶ — <0,05 при сравнении между группами «СД+ЭМПА» и «СД+КАНА».
Таким образом, мы показали, что потребление корма при применении СИТА стабильно и не отличается от такового у животных с СД без лечения. СИТА не оказывает влияния на массу тела, не замедляя ее закономерный прирост. Нам не удалось выявить супрессивного действия иНГЛТ-2 ЭМПА и КАНА на аппетит животных — потребление корма при применении этих двух препаратов не различалось и было высоким, превышая даже таковое у животных с СД без лечения. В то же время применение КАНА, но не ЭМПА, привело к стабилизации массы тела, замедлив ее закономерный прирост. На наш взгляд, такое различие во влиянии данных двух препаратов на массу тела может быть связано со степенью селективности их взаимодействия с НГЛТ. Возможно, в данном случае замедление прибавки массы тела под влиянием КАНА обусловлено взаимодействием препарата с НГЛТ 1 типа в кишечнике, а значит, уменьшением всасывания углеводов [19][20], чего не происходит на фоне терапии высокоселективным в отношении НГЛТ-2 ЭМПА.
Нежелательные явления
В ходе исследования нежелательных явлений выявлено не было.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
В ходе нашего исследования было выявлено, что длительная терапия ЭМПА и КАНА оказывает инфаркт-лимитирующее действие у крыс с СД при моделировании транзиторной 30-минутной глобальной ишемии миокарда. Данный эффект одинаково выражен у высокоселективного иНГЛТ-2 ЭМПА и низкоселективного КАНА. Кроме того, оба препарата обладают положительным, при этом различным, влиянием на параметры гемодинамики. Так, применение КАНА позволяет уменьшить выраженность ишемической контрактуры, ЭМПА приводит к нарастанию перфузии миокарда. СИТА не обладает положительным влиянием ни на гемодинамические параметры, ни на площадь повреждения миокарда у крыс с экспериментальным СД. Кардиопротективный эффект ЭМПА и КАНА является плейотропным, не обусловленным положительным воздействием препаратов на гликемический профиль.
Обсуждение основного результата исследования
Насколько нам известно, наша работа представляет собой первое экспериментальное сравнительное исследование кардиопротективных свойств двух иНГЛТ-2 с разной степенью селективности в отношении типов НГЛТ. Мы не выявили различий в выраженности инфаркт-лимитирующего действия высокоселективного ЭМПА и низкоселективного КАНА.
НГЛТ-2 экспрессируется преимущественно в проксимальных канальцах почек и ответственен за реабсорбцию около 90% глюкозы, попадающей в первичную мочу. Отсутствуют достоверные данные о наличии НГЛТ-2 в эндотелии сосудов или миокарде. НГЛТ-1 представлен в слизистой оболочке тонкой кишки, в проксимальных канальцах почек, а также в миокарде и в капиллярах различных органов и тканей [21]. В связи с описанной экспрессией НГЛТ 1 и 2 типа особый интерес вызывает факт отсутствия существенных различий в выраженности кардиопротективного эффекта высоко- и низкоселективных иНГЛТ. Вероятным представляется вовлечение в процесс непрямых механизмов защиты.
Было показано, что применение ЭМПА до моделирования ишемии миокарда приводит к снижению уровня малонового диальдегида и интерлейкина-6, а также уменьшению экспрессии миокардиальной индуцибельной NO-синтазы, положительно влияя на регуляцию окислительно-восстановительных процессов и подавляя воспалительную реакцию [22]. Кроме того, терапия ЭМПА при экспериментальном ИМ приводит к снижению повреждения митохондриальной ДНК и стимулирует митохондриальный биогенез, что сопровождается нормализацией захвата и окисления глюкозы и жирных кислот кардиомиоцитами [6].
A.A. Sayour и соавт. обнаружили, что КАНА увеличивает фосфорилирование аденозин-монофосфат-активируемой протеинкиназы (АМРК) и эндотелиальной NO-синтазы. Кроме того, при применении исследуемого препарата в условиях экспериментального ИМ изменялось соотношение Bax/Bcl-2 в пользу превалирования антиапоптотических факторов. Наконец, при лечении КАНА наблюдалась значимо меньшая активность 4-гидроксиноненала, что свидетельствует о меньшей выраженности оксидативного стресса. Показательно, что in vitro инкубация поперечных срезов аорты с КАНА достоверно увеличивала эндотелий-зависимую вазодилатацию [8].
Несмотря на выявленный нами достоверный кардиопротективный эффект ЭМПА и КАНА, мы не обнаружили положительного воздействия СИТА ни на параметры гемодинамики, ни на площадь некроза миокарда. В то же время контроль гликемии был сходно удовлетворительным при применении всех трех изучаемых препаратов. Это позволило нам сделать вывод о том, что кардиопротективный эффект ЭМПА и КАНА является самостоятельным, не обусловленным их влиянием на гликемический профиль. Непосредственные механизмы реализации данного эффекта требуют дальнейшего изучения.
Мы предполагаем, что, учитывая наличие инфаркт-лимитирующего действия как у высокоселективного ЭМПА, так и у низкоселективного КАНА, можно заключить, что способность данных препаратов уменьшать объем повреждения миокарда в условиях ишемического и реперфузионного повреждения является класс-эффектом. Полученные данные, на наш взгляд, создают предпосылки для проведения дальнейших клинических исследований с оценкой способности иНГЛТ-2 уменьшать объем повреждения миокарда, что, в свою очередь, обусловливает потенциальное влияние этого класса на ближайший и отдаленный прогноз у данных больных.
Ограничения исследования
Ограничения данного исследования, на наш взгляд, связаны с тем, что проведение опыта на изолированном сердце не позволяет оценить выживаемость после ИМ на фоне различных вариантов сахароснижающей терапии, а также влияние препаратов на функциональный статус организма. В дальнейшем целесообразным представляется моделирование ИМ in vivo с последующим динамическим наблюдением за животными на фоне применения различных препаратов, в том числе иНГЛТ-2.
ЗАКЛЮЧЕНИЕ
Таким образом, ранее проведенные экспериментальные исследования предоставляют противоречивые данные о способности различных представителей класса иНГЛТ-2 оказывать инфаркт-лимитирующий эффект при моделировании ишемии миокарда. Сравнение выраженности кардиопротективного действия ЭМПА и КАНА между собой, а также с препаратом другого класса с нейтральным влиянием на сердечно-сосудистую систему, каким является СИТА, в рамках одного исследования ранее не производилось. Мы показали, что как высокоселективный иНГЛТ-2 ЭМПА, так и низкоселективный КАНА обладают одинаково выраженной способностью уменьшать площадь повреждения миокарда у животных с СД2 в условиях экспериментального ИМ. При этом, вероятно, кардиопротективный эффект КАНА, по крайней мере отчасти, обусловлен его способностью уменьшать ишемическую контрактуру, а ЭМПА — улучшать показатели перфузии миокарда, повышая коронарный кровоток.
Требуется дальнейшее изучение влияния иНГЛТ-2 на показатели гемодинамики и объем некроза миокарда in vivo, а также исследование подлежащих механизмов.
Данная экспериментальная работа создает предпосылки для клинического изучения потенциального инфаркт-лимитирующего действия иНГЛТ-2 с целью использования данного класса препаратов в качестве первичной и вторичной профилактики ИМ у пациентов с СД2.
Список литературы
1. IDF Diabetes Atlas [Internet]. [cited 2020 Dec 11]. Available from: https://diabetesatlas.org/data/en/world/
2. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С. 1-144. doi: https://doi.org/10.14341/DM221S1
3. Davies MJ, D’Alessio DA, Fradkin J, et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2018;61(12):2461-2498. doi: https://doi.org/10.1007/s00125-018-4729-5
4. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373(22):2117-2128. doi: https://doi.org/10.1056/NEJMoa1504720
5. McGuire DK, Zinman B, Inzucchi SE, et al. Effects of empagliflozin on first plus recurrent clinical events in patients with type 2 diabetes and atherosclerotic cardiovascular disease: Results from the EMPA-REG OUTCOME trial. Lancet Diabetes Endocrinol. 2020;8(12):949–959. doi: https://doi.org/10.1016/S2213-8587(20)30344-2
6. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 2017;377(7):644-657. doi: https://doi.org/10.1056/NEJMoa1611925
7. Yurista SR, Silljé HHW, Oberdorf-Maass SU, et al. Sodium-glucose co-transporter 2 inhibition with empagliflozin improves cardiac function in non-diabetic rats with left ventricular dysfunction after myocardial infarction. Eur J Heart Fail. 2019;21(7):862-873. doi: https://doi.org/10.1002/ejhf.1473
8. Oshima H, Miki T, Kuno A, et al. Empagliflozin, an SGLT2 Inhibitor, Reduced the Mortality Rate after Acute Myocardial Infarction with Modification of Cardiac Metabolomes and Antioxidants in Diabetic Rats. J Pharmacol Exp Ther. 2019;368(3):524-534. doi: https://doi.org/10.1124/jpet.118.253666
9. Lee MMY, Brooksbank KJM, Wetherall K, et al. Effect of Empagliflozin on Left Ventricular Volumes in Patients With Type 2 Diabetes, or Prediabetes, and Heart Failure With Reduced Ejection Fraction (SUGAR-DM-HF). Circulation. 2021;143(6):516–525. doi: https://doi.org/10.1161/CIRCULATIONAHA.120.052186
10. Sayour AA, Korkmaz-Icöz S, Loganathan S, et al. Acute canagliflozin treatment protects against in vivo myocardial ischemia-reperfusion injury in non-diabetic male rats and enhances endothelium-dependent vasorelaxation. J Transl Med. 2019;17(1):127. doi: https://doi.org/10.1186/s12967-019-1881-8
11. Lim VG, Bell RM, Arjun S, et al. SGLT2 Inhibitor, Canagliflozin, Attenuates Myocardial Infarction in the Diabetic and Nondiabetic Heart. JACC Basic Transl Sci. 2019;4(1):15-26. doi: https://doi.org/10.1016/j.jacbts.2018.10.002
12. Green JB, Bethel MA, Armstrong PW, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 2015;373(3):232-242. doi: https://doi.org/10.1056/NEJMoa1501352
13. Connelly KA, Zhang Y, Advani A, et al. DPP-4 inhibition attenuates cardiac dysfunction and adverse remodeling following myocardial infarction in rats with experimental diabetes. Cardiovasc Ther. 2013;31(5):259-267. doi: https://doi.org/10.1111/1755-5922.12005
14. Khodeer DM, Bilasy SE, Farag NE, et al. Sitagliptin protects diabetic rats with acute myocardial infarction through induction of angiogenesis: role of IGF-1 and VEGF. Can J Physiol Pharmacol. 2019;97(11):1053-1063. doi: https://doi.org/10.1139/cjpp-2018-0670
15. Bayrasheva VK, Babenko AY, Dobronravov VA, et al. Uninephrectomized High-Fat-Fed Nicotinamide-Streptozotocin-Induced Diabetic Rats: A Model for the Investigation of Diabetic Nephropathy in Type 2 Diabetes. J Diabetes Res. 2016;2016(1S1):1-18. doi: https://doi.org/10.1155/2016/8317850
16. Minasian SM, Galagudza MM, Dmitriev YV, et al. Myocardial protection against global ischemia with Krebs-Henseleit buffer-based cardioplegic solution. J Cardiothorac Surg. 2013;8:60. doi: https://doi.org/10.1186/1749-8090-8-60
17. Neeland IJ, McGuire DK, Chilton R, et al. Empagliflozin reduces body weight and indices of adipose distribution in patients with type 2 diabetes mellitus. Diab Vasc Dis Res. 2016;13(2):119-126. doi: https://doi.org/10.1177/1479164115616901
18. Pereira MJ, Eriksson JW. Emerging Role of SGLT-2 Inhibitors for the Treatment of Obesity. Drugs. 2019;79(3):219-230. doi: https://doi.org/10.1007/s40265-019-1057-0
19. Takebayashi K, Inukai T. Effect of Sodium Glucose Cotransporter 2 Inhibitors With Low SGLT2/SGLT1 Selectivity on Circulating Glucagon-Like Peptide 1 Levels in Type 2 Diabetes Mellitus. J Clin Med Res. 2017;9(9):745-753. doi: https://doi.org/10.14740/jocmr3112w
20. Polidori D, Sha S, Mudaliar S, et al. Canagliflozin lowers postprandial glucose and insulin by delaying intestinal glucose absorption in addition to increasing urinary glucose excretion: results of a randomized, placebo-controlled study. Diabetes Care. 2013;36(8):2154-2161. doi: https://doi.org/10.2337/dc12-2391
21. Yu AS, Hirayama BA, Timbol G, et al. Functional expression of SGLTs in rat brain. Am J Physiol Cell Physiol. 2010;299(6):1277-1284. doi: https://doi.org/10.1152/ajpcell.00296.2010
22. Andreadou I, Efentakis P, Balafas E, et al. Empagliflozin Limits Myocardial Infarction in Vivo and Cell Death in Vitro: Role of STAT3, Mitochondria, and Redox Aspects. Front Physiol. 2017;8(1-1):1-18. doi: https://doi.org/10.3389/fphys.2017.01077
Об авторах
А. В. СиманенковаРоссия
Симаненкова Анна Владимировна - кандидат медицинских наук; eLibrary SPIN: 3675-9216.
197341, Санкт-Петербург, ул. Аккуратова, д. 2
Конфликт интересов:
нет
С. М. Минасян
Россия
Минасян Саркис Минасович - кандидат медицинских наук, eLibrary SPIN: 5241-8875
Конфликт интересов:
нет
Т. Л. Каронова
Россия
Каронова Татьяна Леонидовна - доктор медицинских наук, профессор; eLibrary SPIN: 3337-4071
Конфликт интересов:
нет
Т. Д. Власов
Россия
Власов Тимур Дмитриевич - доктор медицинских наук, профессор; eLibrary SPIN: 8367-1246
Конфликт интересов:
нет
Н. В. Тимкина
Россия
Тимкина Наталья Владимировна; eLibrary SPIN: 6259-7745
Конфликт интересов:
нет
А. К. Хальзова
Россия
Хальзова Александра Константиновна
Конфликт интересов:
нет
О. С. Фукс
Россия
Фукс Оксана Станиславовна; eLibrary SPIN: 2899-7812
Конфликт интересов:
нет
А. А. Шимшилашвили
Россия
Anzhelika A. Shimshilashvili
Конфликт интересов:
нет
В. А. Тимофеева
Россия
Valeria A. Timofeeva
Конфликт интересов:
нет
Ю. Ю. Борщев
Россия
Борщев Юрий Юрьевич - кандидат биологических наук; eLibrary SPIN: 3454-4113
Конфликт интересов:
нет
М. М. Галагудза
Россия
Галагудза Михаил Михайлович - доктор медицинских наук, профессор, член-корреспондент РАН; eLibrary SPIN: 2485-4176
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Симаненкова А.В., Минасян С.М., Каронова Т.Л., Власов Т.Д., Тимкина Н.В., Хальзова А.К., Фукс О.С., Шимшилашвили А.А., Тимофеева В.А., Борщев Ю.Ю., Галагудза М.М. Сравнительная оценка кардиопротективных свойств эмпаглифлозина, канаглифлозина и ситаглиптина у крыс с экспериментальным сахарным диабетом 2 типа. Сахарный диабет. 2021;24(2):111-121. https://doi.org/10.14341/DM12714
For citation:
Simanenkova A.V., Minasian S.M., Karonova T.L., Vlasov T.D., Timkina N.V., Khalzova А.K., Fuks O.S., Shimshilashvili A.A., Timofeeva V.A., Borshchev Yu.Yu., Galagudza M.M. Comparative evaluation of empagliflozin, canagliflozin and sitagliptin cardioprotective properties in rats with experimental type 2 diabetes mellitus. Diabetes mellitus. 2021;24(2):111-121. (In Russ.) https://doi.org/10.14341/DM12714

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































