Перейти к:
Патоморфологические и патохимические особенности остеомиелитического очага у пациентов с диабетической остеоартропатией (стопа Шарко)
https://doi.org/10.14341/DM12708
Аннотация
ОБОСНОВАНИЕ. Остеомиелит при диабетической остеоартропатии встречается в 65% случаев и является главной причиной нетравматических ампутаций. Выбор оптимальных технологий лечения должен базироваться на понимании патогенетических особенностей данного заболевания.
ЦЕЛЬ. Изучение патоморфологической и патохимической картины остеомиелитического очага у пациентов с диабетической нейроостеоартропатией.
МАТЕРИАЛЫ И МЕТОДЫ. Объект — 20 пациентов (55,3±9,33 года) с сахарным диабетом 2 типа, диабетической нейроостеоартропатией, хроническим остеомиелитом костей стопы. Лечение заключалось в хирургической санации гнойного очага с забором материала для патоморфологического и биохимического исследований, репозиции и адаптации костных отломков костей с фиксацией голени и стопы аппаратом Илизарова для формирования костного анкилоза скомпрометированного сустава.
РЕЗУЛЬТАТЫ. В 80% наблюдений зарегистрировано подострое и острое течение хронического остеомиелита. Среди патогистологических изменений костной ткани наиболее значимые: некроз и наличие воспалительного инфильтрата разной степени выраженности в зависимости от фазы воспалительного процесса. Структура суставного хряща во всех наблюдениях нарушена. Отмечена активация остеокластов в остеомиелитическом очаге, особенно в субхондральной зоне. В большей части наблюдений субхондральная костная пластинка отсутствовала или сохранялись лишь ее фрагменты. Патогистологическое исследование мягких тканей, сопряженных с остеомиелитическим очагом, свидетельствовало о наличии микроциркуляторных и денервационных расстройств вследствие некроза и гиалиноза значительной части микрососудов на фоне компенсаторной гиперваскуляризации и хронического воспаления, сужения и облитерации просветов питающих артерий, практически полного отсутствия в тканях нервных элементов либо их деструктивных изменений. Выявлено увеличение активности литических ферментов в интерстициальной среде тканей, окружающих остеомиелитический очаг (увеличение активности кислой фосфатазы в 138 раз, остеолитический индекс интерстиция превышал индекс сыворотки крови в 7,2 раза).
ЗАКЛЮЧЕНИЕ. У большинства пациентов выявлены патоморфологические признаки подострого и острого течения хронического остеомиелита. Нарушение структуры суставного хряща сопровождалось инвазией сосудов, воспалительного инфильтрата и активацией остеокластов в субхондральной зоне. Этиопатогенетическими факторами развития данного заболевания могут служить деструктивные изменения сосудов и нервов в сопряженных с остеомиелитическим очагом мягких тканях. Технологии купирования данного процесса должны базироваться на обязательной санации очага с секвестрнекрэктомией, с постоянным мониторингом состояния оперированного сегмента.
Для цитирования:
Судницын А.С., Ступина Т.А., Варсегова Т.Н., Стогов М.В., Киреева Е.А., Мезенцев И.Н. Патоморфологические и патохимические особенности остеомиелитического очага у пациентов с диабетической остеоартропатией (стопа Шарко). Сахарный диабет. 2022;25(4):368-377. https://doi.org/10.14341/DM12708
For citation:
Sudnitsyn A.S., Stupina T.A., Varsegova T.N., Stogov M.V., Kireeva E.A., Mezentsev I.N. Pathomorphological and pathochemical characteristic of the osteomyelitis focus in patients with diabetic osteoarthropathy (Charcot foot). Diabetes mellitus. 2022;25(4):368-377. (In Russ.) https://doi.org/10.14341/DM12708
ОБОСНОВАНИЕ
В 2019 г. Международной федерацией диабета (IDF) в мире зарегистрировано 463 млн больных, страдающих сахарным диабетом (СД). Ежегодный прирост больных СД в последние годы составляет 9,3%. При этом погибают от осложнений СД ежегодно более 4 млн [1]. Почти 25% больных СД страдают от синдрома диабетической стопы (СДС) — одного из наиболее частых и потенциально опасных осложнений [1].
Выделяют три формы СДС: нейропатическая — трофическая язва; диабетическая нейроостеоартропатия — ДНОАП (стопа Шарко); нейроишемическая, ишемическая [2]. Диабетическая нейроостеоартропатия — относительно безболевая, прогрессирующая, деструктивная артропатия одного или нескольких суставов, сопровождающаяся неврологическим дефицитом, встречающаяся приблизительно у 70% данных пациентов [2], как правило, диагностируется у пациентов с длительностью течения диабета более 15 лет и неудовлетворительным контролем заболевания. Следует отметить, что остеомиелит, развившийся на фоне ДНОАП, встречается в 65% случаев среди инфицированных форм СДС, является главной причиной нетравматических ампутаций нижних конечностей в 30–70% случаев [3]. Одновременно с этим летальность среди больных ДНОАП в течение 1 года после ампутации достигает 28–40%, в последующие 5 лет после подобного радикального лечения выживаемость составляет всего 25–40% [4]. Таким образом, своевременная диагностика хронического остеомиелита и своевременное эффективное лечение являются ключевыми моментами при ДНОАП.
На протяжении многих лет СДС в России являлся предметом интереса преимущественно эндокринологов и хирургов, занимающихся лечением гнойно-некротических осложнений и сосудистых проявлений, и только на поздних стадиях — ортопедов-протезистов [1]. В настоящее время система лечения больных с ДНОАП, осложненной хроническим остеомиелитом, предусматривает обязательную хирургическую санацию очага гнойного воспаления с фиксацией костных отломков и курсом этиотропной антибактериальной терапии в послеоперационном периоде. Нужно отметить, что в настоящее время нет единого подхода к вопросу о методе фиксации костных отломков стопы — хирурги применяют гипсовые либо полимерные повязки, импланты (винты, накостные пластины и т.д.) и аппараты внешней фиксации. При этом далеко не все из вышеперечисленных методов могут обеспечить сохранение функции и опороспособности пораженной конечности. В этих условиях выбор оптимальных технологий лечения больных с ДНОАП, осложненной хроническим остеомиелитом, должен базироваться на понимании патогенетических особенностей данного процесса. Работы, касающиеся этой тематики, в доступной литературе единичны [5]. Выявление новых патоморфологических и патохимических аспектов этиопатогенеза ДНОАП необходимо для разработки новых методов лечения этой группы пациентов, в том числе фармакологических [6].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучение патоморфологической и патохимической картины остеомиелитического очага у пациентов с ДНОАП.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Набор пациентов осуществлялся в Клинике гнойной остеологии ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России (г. Курган, Россия).
Время исследования. Исследование проведено в период с 2017 по 2021 гг.
Изучаемые популяции (одна или несколько)
Пациенты с ДНОАП, осложненной хроническим остеомиелитом.
Критерии включения — пациенты с СД 2 типа (СД2), ДНОАП, осложненной хроническим остеомиелитом. Возраст 37–69 лет.
Критерии исключения — СД 1 типа, ДНОАП, неосложненная остеомиелитом, наличие других заболеваний или травм, оказывающих значительное влияние на мягкие ткани и костно-суставные структуры стоп.
Способ формирования выборки из изучаемой популяции (или нескольких выборок из нескольких изучаемых популяций)
Выборка сформирована путем сплошного включения наблюдений.
Дизайн исследования
Исследование открытое ретро- и проспективное моноцентровое.
Описание медицинского вмешательства (для интервенционных исследований)
Лечение всех больных по методу Илизарова заключалось в хирургической санации гнойного очага, в ходе которой выполнялась секвестрнекрэктомия с забором материала для патоморфологического и биохимического исследований, репозиции и адаптации костных отломков костей с последующей фиксацией голени и стопы аппаратом для формирования костного анкилоза скомпрометированного сустава.
Методы
Локальный осмотр проводили с применением классификаций PEDIS и Wagner [7–9], рентгенологическую картину оценивали с помощью классификаций Sanders и Eichen holtz [10][11], использовали стандартные методы микробиологической диагностики.
Объектами патоморфологического исследования являлись фрагменты костей стопы (пяточной, таранной костей и смежных суставов — подтаранного и таранно-ладьевидного, фаланговых и плюсневых костей и плюснефалангового сустава) и окружающие их мягкие ткани (n=20). Фиксированный в нейтральном формалине материал подвергался стандартной гистологической обработке. Костный материал предварительно декальцинировали. Парафиновые срезы, окрашенные трехцветным методом по Массону, по Ван-Гизону и гематоксилином и эозином, изучали и оцифровывали на микроскопе AxioScope.A1 с цифровой камерой AxioCam (CarlZeissMicroImagingGmbH, Германия). Определение фазы воспалительного процесса хронического остеомиелита проводили с помощью шкалы A. Tiemann и соавт.(2014) [12].
Объектами биохимического исследования являлись фрагменты мягких тканей из остеомиелитического очага (n=8), из которых получали интерстициальный экстракт (жидкость). Материал взвешивали и промывали трижды в пятикратном объеме охлажденного физиологического раствора. Затем измельчали на физиологическом растворе (8°С) в фарфоровой ступке до получения однородного гомогената. Конечное разведение физиологического раствора к навеске биологического материала составило 5:1 массовой доли соответственно. Далее гомогенат центрифугировали 10 мин при 3000 об/мин. Полученный надосадок, представляющий собой интерстициальную жидкость мягких тканей, использовали для биохимических исследований. В экстракте определяли общую протеазную активность по методу M.B. Jorgensen в модификации М.А. Ковинька [13], активность кислой фосфатазы и щелочной фосфатазы, а также концентрацию лактата. Активность фосфатаз и лактата определяли на автоматическом биохимическом анализаторе Hitachi/BM 902 (F. Hoffmann-La Roche Ltd./ Roche Diagnostics GmbH), используя наборы реагентов фирмы Vital Diagnostic (Россия). Активность ферментов рассчитывали на 1 г общего белка в пробе, который определяли по методу Лоури. Учитывая отсутствие данных по протеазной активности интерстициальной жидкости у здоровых людей, в качестве референсных значений мы использовали аналогичные показатели сыворотки крови 15 относительно здоровых людей в возрасте 40–60 лет.
Статистический анализ
Объем выборок рассчитывали на основании минимального количества, необходимого для получения достоверных результатов. Для расчета статистически значимых различий использовали непараметрический критерий Вилкоксона с принятием уровня значимости р<0,01. Статистическую обработку количественных данных провели в электронных таблицах Microsoft Excel с использованием программы Attestat (версия 9.3.1, разработчик Гайдышев И.П., Сертификат Роспатента № 2002611109).
Этическая экспертиза
Проведение исследования одобрено локальным Этическим комитетом ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава России, проводилось в соответствии с этическими стандартами, изложенными в Хельсинкской декларации 2013 г. (протокол № 2 (57) от 19.03.2018). От всех пациентов было получено информированное согласие на участие в исследовании.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Объектами исследования послужили 20 пациентов в возрасте от 37 до 69 лет (средний возраст 55,3±9,33 года), страдающих СД2, медиана уровня HbA1c — 7,4% [ 6,475–7,65], медиана уровня гликемии — 7,3 [ 5,79–10,66] ммоль/л, дистальной полинейропатией и развившимся на его фоне осложнением — ДНОАП, хроническим остеомиелитом костей стопы. Длительность заболевания СД у больных в среднем составила 9,5±6,565 года. Все больные обратились в клинику гнойной остеологии в период от 17 до 345 сут (в среднем 188,7±116,177 сут) с момента развития осложнения. При поступлении пациенты предъявляли жалобы на деформацию стопы и функционирующую, длительно не заживающую гнойную рану/свищ. В группу контроля биохимических исследований были включены 15 относительно здоровых людей, не страдающих СД и остеомиелитом.
Основные результаты исследования
У 15 больных функционировали раны (рис. 1) общей площадью от 60 до 3000 мм2 (в среднем 717,3±680,07 мм2). У 7 больных язвенные дефекты, соответствовавшие I и II стадиям по классификации PEDIS, локализовавшиеся на вершине деформации, не были вовлечены непосредственно в остеомиелитический очаг, однако у 5 из них были обнаружены свищевые ходы с гнойным отделяемым (табл. 1). У 2 больных с язвенными дефектами II стадии по PEDIS отсутствовал прямой контакт язв с костью, что являлось признаком начала ремиссии остеомиелитического процесса. Микробный пейзаж у всех больных характеризовался преимущественно грамположительной флорой как в моноинфекции, так и микробных ассоциациях. Наиболее часто у больных обнаруживался S. aureus — в 70% случаев. Микробные ассоциации обнаруживались в 25% случаев и были представлены грамположительной флорой. Грамотрицательная флора была представлена в виде моноинфекции (10%).
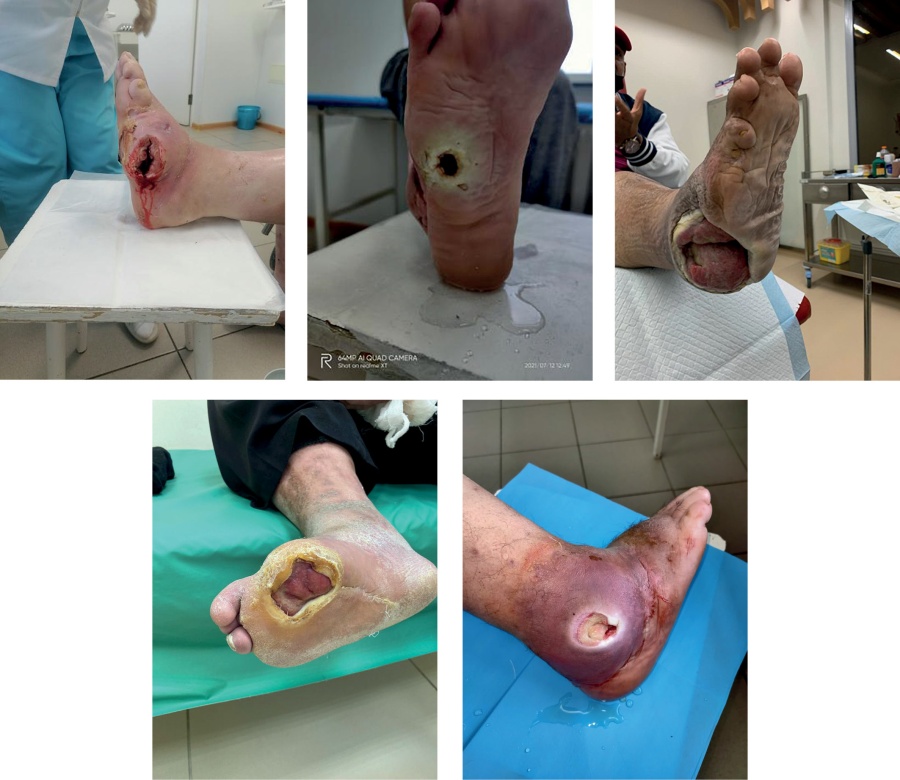
Рисунок 1. Локальная картина пораженных конечностей больных до лечения.
Таблица 1. Распределение пациентов согласно классификации PEDIS
|
P (perfusion) — изменения кровотока нижней конечности |
Е (extent/size) — размер дефекта тканей (язвы) стопы |
D (depth/tissue loss) — глубина поражения анатомических слоев стопы |
I (infection) — степень выраженности инфекционного процесса |
S (sensation) — нарушения чувствительности |
|||||
|
стадия |
кол-во |
мм2 |
кол-во |
стадия |
кол-во |
стадия |
кол-во |
стадия |
кол-во |
|
I |
20 |
0–60 |
6 |
I |
2 |
I |
1 |
I |
4 |
|
II |
- |
100–600 |
10 |
II |
5 |
II |
5 |
II |
16 |
|
III |
- |
800–3000 |
4 |
III |
13 |
III |
12 |
- |
- |
|
IV |
- |
- |
- |
IV |
2 |
- |
- |
||
Согласно классификации Sanders (табл. 2), определено расположение очага деструкции. Так, в большинстве случаев очаг деструкции локализовался в зоне сустава Шопара, что соответствует 3-му типу согласно классификации, и у 5 больных очаг был обнаружен в области голеностопного сустава — 5-й тип по Sanders.
Таблица 2. Распределение пациентов согласно классификации Sanders (локализация очага деструкции)
|
Тип локализации |
I |
II |
III |
IV |
V |
|
Кол-во больных |
2 |
1 |
8 |
4 |
5 |
Согласно классификации Eichenholtz (табл. 3), рентгенологически оценивалось течение патологического процесса от начала деструктивных изменений до консолидации фрагментов кости. В стадии консолидации было выявлено 14 больных, 6 пациентов — в период коалесценции.
Таблица 3. Распределение пациентов согласно классификации Eichenholtz (рентгенологическое течение патологического процесса)
|
Стадия |
0 |
I |
II |
III |
|
Кол-во больных |
- |
- |
6 |
14 |
В гистологических препаратах фрагментов костей и их суставных поверхностей выявлены признаки нарушения их структуры (рис. 2, 3). Структура суставного хряща во всех наблюдениях была нарушена (рис. 2). Суставная поверхность разволокнена, в части наблюдений отмечено полнослойное разволокнение хряща, отторжение его фрагментов в полость сустава (рис. 2А), гибель хрящевых клеток. На большем протяжении выявлено истончение и/или отсутствие зоны кальцифицированного хряща и субхондральной костной пластинки (рис. 2Б), активированные остеокласты, резорбирующие кальцифицированный хрящ (рис. 2В). Отмечены участки, в которых глубокая зона некальцифицированного хряща непосредственно контактировала с грануляционной тканью, содержащей нейтрофилы (см. рис. 2Г).
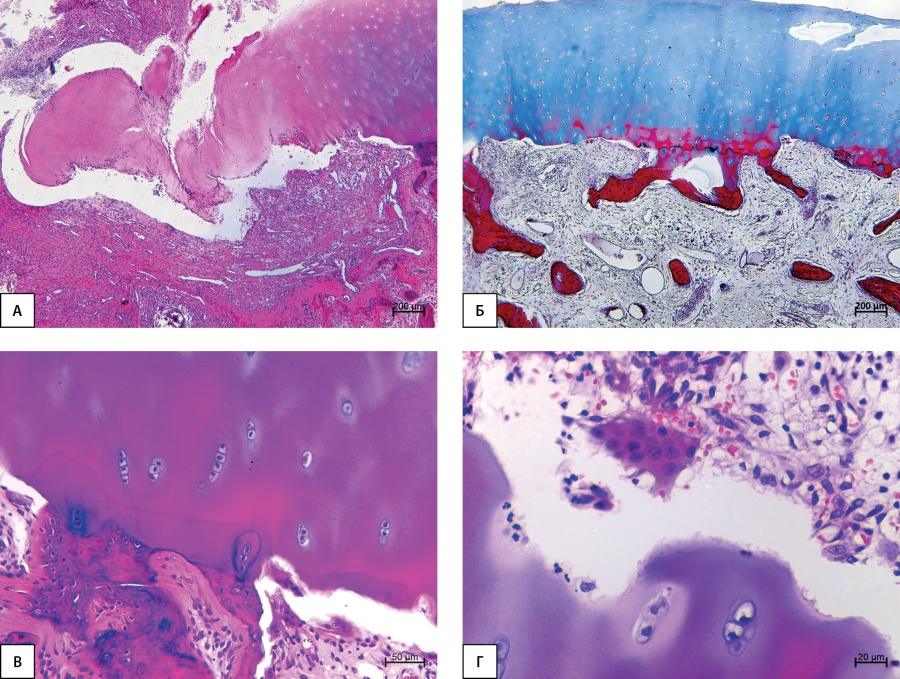
Рисунок 2. Суставная выстилка подтаранного сустава: А — фрагментация хряща; Б — грануляционная ткань в субхондральной зоне, отсутствует субхондральная костная пластинка; В — инвазирующая хрящ грануляционная ткань, остеокласты, резорбирующие кальцифицированный хрящ; Г — остеокласт и воспалительный инфильтрат с содержанием сегментоядерных нейтрофильных лейкоцитов. Окраска гематоксилином и эозином (А, В, Г), трехцветным методом по Массону (Б). Увеличение х40 (А, Б), х200(В), х400 (Г).
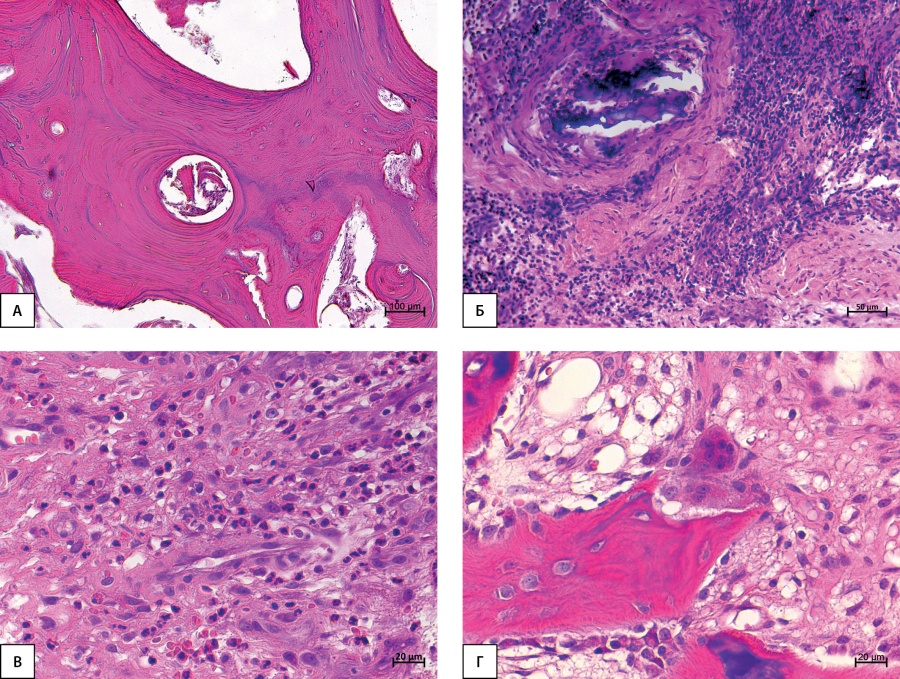
Рисунок 3. Активный хронический остеомиелит. А — остеонекроз; Б — плотный воспалительный инфильтрат вокруг микросеквестра; В — в составе инфильтрата нейтрофильные лейкоциты; Г — участок трабекулы с остеокластами. Парафиновые срезы, окраска гематоксилином и эозином. Увеличение 100х (А), 200х (Б), 400х (В, Г).
Среди патогистологических изменений костной ткани наиболее значимыми являлись: некроз и наличие воспалительного инфильтрата разной степени выраженности в зависимости от фазы воспалительного процесса.
При патоморфологическом исследовании у 3 пациентов оценка по шкале A. Tiemann и соавт. (2014) [12] составила 6–7 баллов и соответствовала стадии хронического активного остеомиелита, у 13 пациентов — 4–5 баллов и соответствовала подострой стадии хронического остеомиелита, у 4 пациентов — 2–3 балла и соответствовала ослабленному хроническому остеомиелиту (фаза ремиссии).
В фазе хронического активного остеомиелита отмечен обширный остеонекроз (рис. 3А), в межтрабекулярных пространствах отмечены многочисленные костные микросеквестры (рис. 3Б), окруженные грануляционной тканью разной степени зрелости. Обширные очаги плотного воспалительного инфильтрата — с большим содержанием нейтрофильных гранулоцитов (рис. 3В).
В подострой стадии хронического остеомиелита площадь остеонекроза составляла больше половины площади среза, воспалительный инфильтрат лимфо-гистиоцитарного типа умеренно выражен.
В фазе активного и подострого хронического остеомиелита наблюдалась активация остеокластической резорбции (рис. 3Г), признаки реактивного костеобразования слабо выражены.
В фазе ремиссии площадь остеонекроза — около 1/3 площади срезов, микросеквестры немногочисленны. Отмечены признаки репаративного остеогенеза, которые не приводили к восстановлению костной ткани. Костномозговые пространства заполнены зрелой соединительной тканью. Немногочисленные очаги воспалительной инфильтрации диффузного типа распределения состояли преимущественно из лимфоцитов, гистиоцитов и плазматических клеток.
При патоморфологическом исследовании толстой кожи обнаружены гипер- и паракератоз, псевдокарциноматозная гиперплазия эпидермиса (рис. 4А), отсутствие блестящего слоя, редкие фигуры митозов в базальном слое, признаки гиперваскуляризации и хронического воспаления всех слоев дермы.
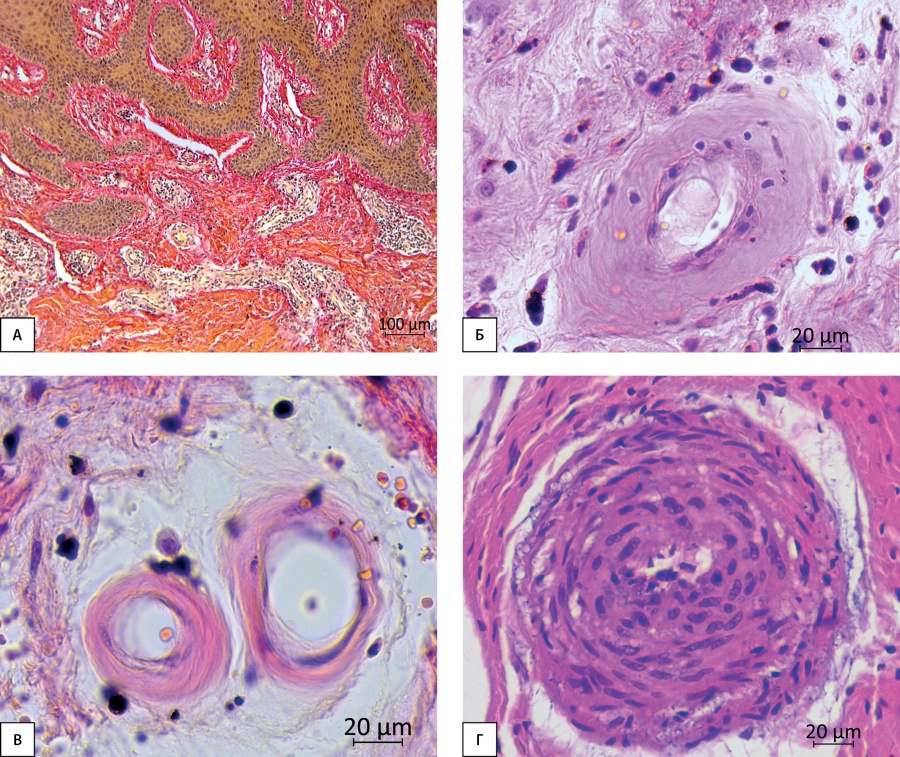
Рисунок 4. Окружающие мягкие ткани: А — фрагмент толстой кожи стопы с псевдокарциноматозной гиперплазией эпидермиса; Б, В — артериола и капилляры с признаками гиалиноза; Г — артерия с облитерированным просветом, гиперплазией гладкомышечных клеток. Окраска по Ван-Гизону (А), гематоксилином и эозином (Б-Г). Увеличение х40 (А), х400 (Б-Г)
Для окружающих мягких тканей также характерны картины хронического воспаления и гиперваскуляризации за счет роста числа капилляров, артериол и венул. В части микрососудов наблюдались картины некроза и гиалиноза: десквамация эндотелия, отложения гиалина, отсутствие либо некробиотическое изменение гладкомышечных клеток средней оболочки (рис. 4Б), часть артериол и капилляров напоминали стеклянные трубочки (рис. 4Б, В). Обнаруженные в мягких тканях питающие артерии имели суженные либо полностью облитерированные просветы, утолщенную среднюю оболочку за счет гиперплазии гладкомышечных клеток, часть из которых демонстрировали признаки некробиотических изменений (рис. 4Г). Нервные стволики являлись редкой находкой, единичные сохраняли нормальную структуру, в большинстве обнаруживались деструктивно измененные миелиновые нервные волокна.
Результаты биохимического исследования интерстициального экстракта мягких тканей, окружающих секвестр, представленные в табл. 4, демонстрируют высокую активность литических ферментов в интерстициальной среде тканей, окружающих остеомиелитический очаг у обследованных пациентов (табл. 4).
Таблица 4. Биохимические показатели интерстициального экстракта мягких тканей, окружающих секвестр
|
Показатель |
Интерстиций (M±m) |
|
Протеазная активность, Е/г белка |
7,35±2,15 |
|
Щелочная фосфатаза, Е/ г белка |
36,35±8,45 |
|
Кислая фосфатаза, Е/г белка |
9,66±3,22 |
|
Лактат, ммоль/л |
0,92±0,38 |
|
Остеолитическая активность (КФ/ЩФ) |
25,9±7,7 |
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Исследование показало, что для 80% наблюдений характерно подострое и острое течение хронического остеомиелита с некрозом костной ткани, наличием воспалительного инфильтрата, с нарушением структуры суставного хряща, активацией остеокластов в остеомиелитическом очаге и особенно в субхондральной зоне, с отсутствием либо частичной сохранностью субхондральной костной пластинки. Для мягких тканей, сопряженных с остеомиелитическим очагом, характерны микроциркуляторные и денервационные расстройства на фоне компенсаторной гиперваскуляризации и хронического воспаления, сужения и облитерации просветов питающих артерий, практически полного отсутствия в тканях нервных элементов либо их деструктивных изменений. Патохимические исследования выявили высокую активность литических ферментов в интерстициальной среде тканей, окружающих остеомиелитический очаг.
Обсуждение основного результата исследования
Выявленные патоморфологические признаки: очаги остеонекроза с образованием секвестров, замещение структур костного мозга грануляционной тканью и фиброзом, наличие воспалительной инфильтрации позволили сформулировать диагноз хронического остеомиелита.
На сегодняшний день отсутствует четкая теоретическая основа для определения гистопатологических критериев, присутствующих при каждом типе остеомиелита. Остаются большие разногласия относительно гистопатологических паттернов, которые патологи используют в качестве критериев для постановки диагноза остеомиелита. A. Cecilia-Matilla и соавт. (2013) опубликовали гистопатологическую классификацию остеомиелита, основанную на результатах исследования операционного материала от 165 пациентов, страдающих СД. Они выделили четыре типа остеомиелита: острый остеомиелит, хронический остеомиелит, активный хронический остеомиелит и стадия фиброза. Авторы акцентировали внимание на оценке фиброза [14]. В проведенном нами исследовании ДНОАП, осложненной хроническим остеомиелитом, мы использовали полуколичественную шкалу A. Tiemann и соавт. (2014), включающую оценку степени выраженности фиброза [12]. Ряд авторов считают, что дегенеративные изменения в микроархитектуре кости могут быть не следствием, а причиной артропатии Шарко. Установлено, что при ДНОАП недостаток инсулина снижает функции остеобластов, а метаболический ацидоз стимулирует активность остеокластов, что приводит к преобладанию процессов распада костной ткани [15].
Воспаление и повышенная активность остеокластов являются общепризнанными факторами быстрого разрушения кости, наблюдаемого при стопе Шарко, хотя связь между ними полностью не изучена. Повышенная остеокластическая активность может быть вызвана неконтролируемым воспалением вследствие активации провоспалительных цитокинов и, в частности, фактора некроза опухоли альфа. Остеокласты, полученные от пациентов со стопой Шарко, функционально более агрессивны по сравнению с остеокластами от пациентов с диабетом и здоровых людей [16].
В нашем исследовании также выявлена выраженная остеокластическая активность в субхондральной зоне, следствием которой явилось полное и/или частичное разрушение субхондральной костной пластинки.
Суставной хрящ является преградой для распространения остеомиелитического процесса, гипертрофированные хондроциты глубокой зоны формируют хондрогематический барьер, при этом контакт сосудов с хрящевой тканью блокирован [17].
При патологических состояниях, в данном случае при диабетической нейроостеоартропатии II и III стадии по Eichenholtz, у всех пациентов этот «барьер» нарушен, отмечено проникновение сосудов в хрящ.
В проведенных нами ранее исследованиях установлено, что интенсивность деструкции хряща зависела от воспалительной фазы хронического остеомиелита и была более выражена у больных СД [18].
Патогистологичеcкое исследование мягких тканей, сопряженных с остеомиелитическим очагом, свидетельствует о наличии микроциркуляторных и денервационных расстройств вследствие некроза и гиалиноза значительной части микрососудов на фоне компенсаторной гиперваскуляризации и хронического воспаления, сужения и облитерации просветов питающих артерий и некробиотических изменений клеточных элементов их стенок, практически полного отсутствия в тканях нервных элементов либо их деструктивных изменений, что согласуется с литературными данными [6][19]. Патогенез ДНОАП до сих пор остается предметом дискуссий [6][20], и обнаруженные нами изменения сосудистых и нервных компонентов мягких тканей, а также изменения интерстициальной жидкости могут служить этиопатогенетическими факторами развития и прогрессирования данного заболевания.
Ограничения исследования
Моноцентровой характер и малый объем выборки (набор пациентов в одном клиническом центре и относительно небольшой объем выборки обследованных) не позволяют однозначно судить о причинно-следственных связях между признаками.
Направления дальнейших исследований
Перспективны дальнейшие исследования особенностей структурных изменений суставов и мягких тканей стоп, связанных с воспалительной фазой и локализацией остеомиелитического очага, на больших выборках пациентов.
ЗАКЛЮЧЕНИЕ
У большинства пациентов выявлены патоморфологические признаки, характерные для подострого и острого течения хронического остеомиелита. Нарушение структуры суставного хряща сопровождалось васкуляризацией хряща, инвазией воспалительного инфильтрата и резорбцией субхондральной кости за счет активации остеокластов. Этиопатогенетическими факторами развития данного заболевания могут служить изменения в сопряженных с остеомиелитическим очагом мягких тканях — гиалиноз микрососудов, хроническое воспаление, некробиотические изменения стенок и облитерация просветов питающих артерий, практически полное отсутствие либо деструктивные изменения нервных элементов.
Патохимические исследования выявили повышенную остеолитическую активность в остеомиелитическом очаге при диабетической остеоартропатии. Следовательно, технологии купирования этого процесса должны базироваться на: 1) обязательной санации очага с секвестрнекрэктомией; 2) помимо мероприятий, направленных на подавление микрофлоры, должны быть выработаны механизмы подавления литической активности (возможно, фармакологической), для чего необходим постоянный мониторинг состояния оперированного сегмента.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа поддержана программой МЗ РФ в рамках государственного задания ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» для выполнения НИР на 2021–2023 гг.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Судницын А.С. — концепция и дизайн исследования, написание текста; Ступина Т.А. — получение, анализ данных, написание, редактирование текста; Варсегова Т.Н. — получение, анализ данных, написание, редактирование текста; Стогов М.В. — концепция и дизайн исследования, написание, редактирование текста; Киреева Е.А. — получение, анализ данных, написание, редактирование текста; Мезенцев И.Н. — получение, анализ данных, написание текста. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Huang Y, Karuranga S, Malanda B, Williams DRR. Call for data contribution to the IDF Diabetes Atlas 9th Edition 2019. Diabetes Res Clin Pract. 2018;140:351-352. doi: https://doi.org/10.1016/j.diabres.2018.05.033
2. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С. 1-144. doi: https://doi.org/10.14341/DM221S1
3. Лазарева И.Н. Диабетическая остеоартропатия (стопа Шарко) // Избранные вопросы судебно-медицинской экспертизы. — 2016. — №15. — С. 125-129.
4. Привольнев В.В., Забросаев В.С., Даниленков Н.В. Рекомендации по диагностике и лечению остеомиелита при синдроме диабетической стопы (обзор) // Вестник Смоленской государственной медицинской академии. — 2014. — Т. 13. — №3. — С. 56-60.
5. Байрамкулов Э.Д., Воротников А.А., Мозеров С.А., Красовитова О.В. Клинико-морфологическая характеристика остеомиелита при синдроме диабетической стопы // Фундаментальные исследования. — 2015. — № 1-1. — С. 23-27.
6. Галстян Г.Р., Каминарская Ю.А. Патогенез остеоартропатии Шарко: роль периферической нервной системы // Эндокринная хирургия. — 2014. — Т. 8. — №4. — С. 5-14. doi: https://doi.org/10.14341/serg201445-14
7. International Diabetes Federation, diabetes atlas. Fifth edition. 2015. Available from: http://iwgdf.org/consensus/pedis/
8. Meggitt B. Surgical management of the diabetic foot. Br J Hosp Med. 1976;16:227-232.
9. Wagner FW. The Dysvascular Foot: A System for Diagnosis and Treatment. Foot Ankle. 1981;2(2):64-122. doi: https://doi.org/10.1177/107110078100200202
10. Sanders LJ, Frykberg RG. Diabetic neuropathic osteoarthropathy: the Charcot foot. In: Frykberg RG, editor. The high risk foot in diabetes mellitus. New York: Churchill Livingstone; 1991. P. 297-338.
11. Eichenholtz SN. Charcot Joints. Springfield, IL, USA: Charles C. Thomas; 1966.
12. Tiemann A, Hofmann GO, Krukemeyer MG, et al. Histopathological Osteomyelitis Evaluation Score (HOES) — an innovative approach to histopathological diagnostics and scoring of osteomyelitis. GMS Interdiscip. Plast. Reconstr. Surg. DGPW. 2014;3:Doc08. doi: https://doi.org/10.3205/iprs000049.
13. Стогов М.В., Лунева С.Н., Митрофанов А.И., Ткачук Е.А. Особенности химического состава содержимого костных кист в зависимости от стадии их развития // Клиническая лабораторная диагностика. — 2012. — №11. — С. 21-22.
14. Cecilia-Matilla A, Lázaro-Martínez JL, Aragón-Sánchez J, et al. Histopathologic Characteristics of Bone Infection Complicating Foot Ulcers in Diabetic Patients. J Am Podiatr Med Assoc. 2013;103(1):24-31. doi: https://doi.org/10.7547/1030024
15. Karner CM, Long F. Glucose metabolism in bone. Bone. 2018;115(1):2-7. doi: https://doi.org/10.1016/j.bone.2017.08.008
16. Petrova NL, Petrov PK, Edmonds ME, Shanahan CM. Inhibition of TNF- α Reverses the Pathological Resorption Pit Profile of Osteoclasts from Patients with Acute Charcot Osteoarthropathy. J Diabetes Res. 2015;2015(1):1-10. doi: https://doi.org/10.1155/2015/917945
17. Fan X, Wu X, Crawford R, Xiao Y, Prasadam I. Macro, Micro, and Molecular. Changes of the Osteochondral Interface in Osteoarthritis Development. Front Cell Dev Biol. 2021;9(1):1-10. doi: https://doi.org/10.3389/fcell.2021.659654
18. Ступина Т.А., Мигалкин Н.С., Судницын А.С. Структурная реорганизация хрящевой ткани при хроническом остеомиелите костей стопы // Гений ортопедии. — 2019. — Т. 25. — №4. — С. 523-527. doi: https://doi.org/10.18019/1028-4427-2019-25-4-523-527
19. Насыбуллина Д.Д., Тимурханов И.М., Плакса И.Л., и др. Патологическая гистология «стопы Шарко» // Наука молодых (Eruditio Juvenium). — 2016. — №2. — С. 14-26.
20. Паршиков М.В., Бардюгов П.С., Ярыгин Н.В. Ортопедические аспекты классификаций синдрома диабетической стопы // Гений ортопедии. — 2020. — Т. 26. — №2. — С. 173-178. doi: https://doi.org/10.18019/1028-4427-2020-26-2-173-178
Об авторах
А. С. СудницынРоссия
Судницын Анатолий Сергеевич, кандидат медицинских наук
Курган
Researcher ID: AAE-2635-2020;
Scopus Author ID: 57195315430;
eLibrary SPIN: 8521-4839
Конфликт интересов:
отсутствует
Т. А. Ступина
Россия
Ступина Татьяна Анатольевна, доктор биологичнских наук
Курган
Researcher ID: Н-1290-2018;
Scopus Author ID: 15123224100;
eLibrary SPIN: 7598-4540
Конфликт интересов:
отсутствует
Т. Н. Варсегова
Россия
Варсегова Татьяна Николаевна, кандидат биологичнских наук
640014, Курган, ул. М. Ульяновой, д. 6
Researcher ID: O-6886-2018;
Scopus Author ID: 55207326100;
eLibrary SPIN: 1974-8274
Конфликт интересов:
отсутствует
М. В. Стогов
Россия
Стогов Максим Валерьевич, доктор биологичнских наук
Курган
Researcher ID: N-5847-20018;
Scopus Author ID: 26024482600;
eLibrary SPIN: 9345-8300
Конфликт интересов:
отсутствует
Е. А. Киреева
Россия
Киреева Елена Анатольевна, кандидат биологичнских наук
Курган
Researcher ID: G-9986-2018;
Scopus Author ID: 56716612200;
eLibrary SPIN: 9598-0838
Конфликт интересов:
отсутствует
И. Н. Мезенцев
Россия
Мезенцев Игорь Николаевич
Курган
eLibrary SPIN: 2685-7844
Конфликт интересов:
отсутствует
Дополнительные файлы
|
|
1. Рисунок 1. Локальная картина пораженных конечностей больных до лечения. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(481KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Суставная выстилка подтаранного сустава: А — фрагментация хряща; Б — грануляционная ткань в субхондральной зоне, отсутствует субхондральная костная пластинка; В — инвазирующая хрящ грануляционная ткань, остеокласты, резорбирующие кальцифицированный хрящ; Г — остеокласт и воспалительный инфильтрат с содержанием сегментоядерных нейтрофильных лейкоцитов. Окраска гематоксилином и эозином (А, В, Г), трехцветным методом по Массону (Б). Увеличение х40 (А, Б), х200(В), х400 (Г). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Активный хронический остеомиелит. А — остеонекроз; Б — плотный воспалительный инфильтрат вокруг микросеквестра; В — в составе инфильтрата нейтрофильные лейкоциты; Г — участок трабекулы с остеокластами. Парафиновые срезы, окраска гематоксилином и эозином. Увеличение 100х (А), 200х (Б), 400х (В, Г). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Окружающие мягкие ткани: А — фрагмент толстой кожи стопы с псевдокарциноматозной гиперплазией эпидермиса; Б, В — артериола и капилляры с признаками гиалиноза; Г — артерия с облитерированным просветом, гиперплазией гладкомышечных клеток. Окраска по Ван-Гизон (А), гематоксилином и эозином (Б-Г). Увеличение х40 (А), х400 (Б-Г) | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Судницын А.С., Ступина Т.А., Варсегова Т.Н., Стогов М.В., Киреева Е.А., Мезенцев И.Н. Патоморфологические и патохимические особенности остеомиелитического очага у пациентов с диабетической остеоартропатией (стопа Шарко). Сахарный диабет. 2022;25(4):368-377. https://doi.org/10.14341/DM12708
For citation:
Sudnitsyn A.S., Stupina T.A., Varsegova T.N., Stogov M.V., Kireeva E.A., Mezentsev I.N. Pathomorphological and pathochemical characteristic of the osteomyelitis focus in patients with diabetic osteoarthropathy (Charcot foot). Diabetes mellitus. 2022;25(4):368-377. (In Russ.) https://doi.org/10.14341/DM12708
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































