Перейти к:
Ранние функциональные и микроциркуляторные нарушения у пациентов с сахарным диабетом 1 типа без видимой диабетической ретинопатии
https://doi.org/10.14341/DM12532
Аннотация
ОБОСНОВАНИЕ. Диабетическая ретинопатия (ДР) — одно из самых частых офтальмологических осложнений сахарного диабета (СД), регистрируемое более чем у трети пациентов с СД. Выявление ранних маркеров ДР c помощью оптической когерентной томографии с функцией ангиографии (ОКТ-А) может способствовать совершенствованию диагностики и мониторинга заболевания.
ЦЕЛЬ. Изучить ранние функциональные и ОКТ-А-признаки ДР у пациентов с СД 1 типа (СД1) в отсутствие офтальмоскопических проявлений.
МЕТОДЫ. Были обследованы 68 человек (123 глаза), из них в группу СД вошли 40 пациентов (74 глаза, длительность СД 11,7±6,1 года), в контрольную группу — 28 здоровых добровольцев (49 глаз). Критерии включения: наличие СД1, отсутствие офтальмоскопических признаков ДР; возраст от 18 до 45 лет. Всем участникам исследования был проведен стандартный офтальмологический осмотр, а также выполнена оценка остроты зрения в условиях низкой освещенности (ОЗУНО), 7-польная фоторегистрация глазного дна, ОКТ, ОКТ-А. Оцениваемые параметры: дефицит ОЗУНО, площадь фовеальной аваскулярной зоны (ФАЗ), индекс ациркулярности (ИА), сосудистая плотность (СП), скелетизированная плотность (СкП), индекс диаметра сосудов (ИДС), фрактальная размерность (ФР), толщина внутренних слоев сетчатки.
РЕЗУЛЬТАТЫ. Дефицит ОЗУНО был значимо выше у пациентов с СД, чем в контрольной группе (0,16±0,05 и 0,10±0,04 соответственно, p<0,0001). При оценке ОКТ-А-параметров мы обнаружили значимую разницу в показателях ИА (в группе СД — 1,47±0,24, в контрольной группе — 1,31±0,15, p<0,0001). Показатели СП были значимо ниже в группе СД в поверхностном сосудистом (группа СД — 25,37±2,24%, контроль — 26,67±1,81%, p=0,028) и глубоком капиллярном сплетении (группа СД — 17,22±3,10%, контроль — 18,29±1,95%, p=0,015).
ЗАКЛЮЧЕНИЕ. Полученные результаты свидетельствуют о наличии ранних функциональных и ОКТ-А-изменений на доклинической стадии ДР. Прогностическую значимость обнаруженных ОКТ-А-маркеров планируется изучить в ходе дальнейшего исследования.
Ключевые слова
Для цитирования:
Стулова А.Н., Семенова Н.С., Железнякова А.В., Акопян В.С., Липатов Д.В., Шестакова М.В. Ранние функциональные и микроциркуляторные нарушения у пациентов с сахарным диабетом 1 типа без видимой диабетической ретинопатии. Сахарный диабет. 2021;24(3):243-250. https://doi.org/10.14341/DM12532
For citation:
Stulova A.N., Semenova N.S., Zheleznyakova A.V., Akopyan V.S., Lipatov D.V., Shestakova M.V. Early functional and microcirculatory changes in patients with type 1 diabetes mellitus and no apparent diabetic retinopathy. Diabetes mellitus. 2021;24(3):243-250. (In Russ.) https://doi.org/10.14341/DM12532
Диабетическая ретинопатия (ДР) — одно из самых частых офтальмологических осложнений сахарного диабета (СД), регистрируемое более чем у трети пациентов с СД. В 2016 г. распространенность ДР в РФ составила среди пациентов с СД 1 типа (СД1) — 38,3%, СД 2 типа (СД2) — 15,0% [1]. Основными диагностическими методами, используемыми для выявления и мониторинга ДР, являются офтальмоскопия на фоне мидриаза и 7-польная регистрация глазного дна [2], предложенная рабочей группой Early Treatment Diabetic Retinopathy Study (ETDRS) в 1991 г. Золотым стандартом диагностики пролиферативной ДР остается флюоресцеиновая ангиография, однако на ранних стадиях осложнения ее применение нецелесообразно ввиду потенциальных рисков и высокой стоимости исследования. Оптическая когерентная томография с функцией ангиографии (ОКТ-А) расширила диагностический арсенал и позволила изучать микроциркуляторные изменения в сетчатке без введения контрастных веществ. Проведение ОКТ-А у пациентов с СД без видимых проявлений ДР показало наличие ранних признаков нарушения кровотока: изменений фовеальной аваскулярной зоны (ФАЗ), сосудистой плотности, появления неперфузируемых зон. В последнее время опубликовано большое число работ, посвященных этому вопросу, но только единичные исследования носят проспективный характер [3].
ЦЕЛЬ
Целью нашего исследования стало изучение ранних функциональных и ОКТ-А-признаков ДР у пациентов с СД1 в отсутствие офтальмоскопических проявлений.
МЕТОДЫ
Дизайн исследования
Обсервационное двуцентровое одномоментное выборочное исследование.
Критерии соответствия
Критерии включения: возраст от 18 до 45 лет; наличие СД1, подтвержденного эндокринологом; отсутствие офтальмоскопических признаков ДР; наличие добровольного информированного согласия на участие в исследовании. Критерии исключения: миопия выше 6 диоптрий, помутнения оптических сред, другие заболевания органа зрения, хирургические вмешательства в анамнезе.
Условия проведения
Исследование проводилось на базе двух центров — кафедры офтальмологии ФФМ МГУ имени М.В. Ломоносова и отделения диабетической ретинопатии и офтальмохирургии ФГБУ «НМИЦ эндокринологии» Минздрава России.
Продолжительность исследования
Исследование проводилось с октября 2019 г. по март 2020 г.
Описание медицинского вмешательства
Всем участникам исследования был проведен стандартный офтальмологический осмотр (визометрия, тонометрия, офтальмоскопия на фоне мидриаза), а также выполнена оценка остроты зрения в условиях низкой освещенности (ОЗУНО), 7-польная фоторегистрация глазного дна, ОКТ, в том числе в режиме ангиографии. ОЗУНО оценивали по алгоритму Sunness J.S. и соавт. с помощью светофильтра нейтральной плотности с индексом затемнения 2.0 log [4]. Дефицит ОЗУНО рассчитывали по формуле:
Дефицит ОЗУНО = Максимальная корригированная ОЗ (МКОЗ) – ОЗУНО.
Оценку ОЗ проводили с помощью десятичной таблицы Снеллена, для подсчета дефицита ОЗУНО и статистической обработки полученные значения переводили в эквиваленты по шкале LogMAR.
ОКТ-А осуществляли на приборах Swept Source DRI OCT Triton (Topcon, Япония) и SOCT Copernicus REVO (Optopol, Польша). Всем пациентам и здоровым добровольцам выполняли объемный скан макулярной зоны (МЗ) и сканирование МЗ в режиме ангиографии (3×3 мм и 6×6 мм). Программное обеспечение SOCT Copernicus REVO позволяет автоматически выделять сосудистые сплетения в соответствии с классификацией Campbell J.P. и соавт. [5]. При работе с DRI OCT Triton сегментирование проводили вручную: границы поверхностного сосудистого сплетения (ПСС) — слоя нервных волокон сетчатки/слоя клеток ганглия (RNFL/GCL) — 23,4 мкм выше внутреннего сплетевидного слоя/внутреннего ядерного слоя (IPL/INL), промежуточного капиллярного сплетения (ПКС) — 23,4 мкм выше IPL/INL — 15,6 мкм ниже IPL/INL, глубокого капиллярного сплетения (ГКС) — 15,6 мкм ниже IPL/INL — 70,2 мкм ниже IPL/INL.
Обработку изображений и измерения проводили в программе Image J. Для вычисления площади и периметра ФАЗ использовали ОКТ-А-сканы поверхностного сплетения 3×3 мм. Границы ФАЗ обозначали вручную (рис. 1А). Для подсчета сосудистой плотности (СП) ОКТ-А-изображения преобразовывали в бинарную форму, после чего автоматически вычисляли отношение пикселей сосудистого рисунка к общему числу пикселей в кольцевых зонах диаметром 300 мкм (рис. 1Б). С помощью функции «skeletonize» выполняли скелетизацию бинарного изображения для подсчета скелетизированной плотности и фрактальной размерности (ФР) (рис. 1В).
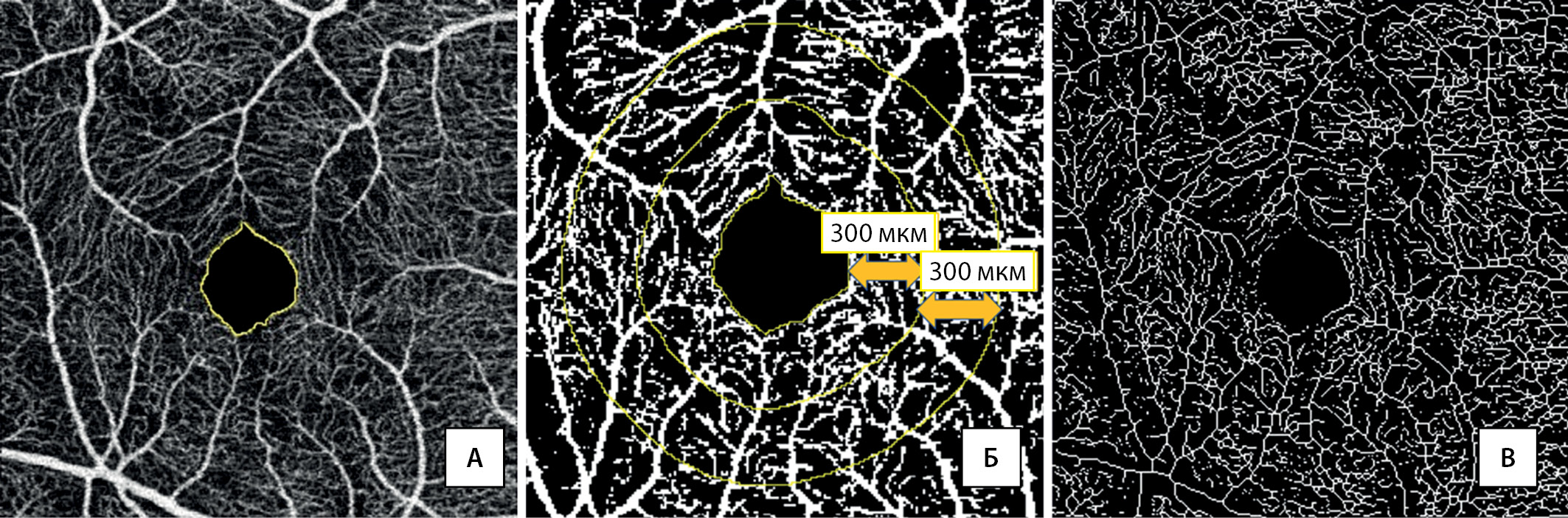
Рисунок 1. Этапы обработки изображения и подсчета количественных показателей. А — обозначение границ фовеальной аваскулярной зоны. Б — бинаризация изображения и выделение кольцевых зон для подсчета сосудистой плотности. В — скелетизация изображения для последующего вычисления скелетизированной плотности, индекса диаметра сосудов и фрактальной размерности.
В табл. 1 представлены перечень и краткое описание оцениваемых ангиографических параметров.
Таблица 1. Количественные ангиографические параметры, оцениваемые в ходе исследования
|
Название параметра |
Алгоритм расчета |
Краткое описание |
|
ФАЗ, мм2 |
Автоматическое вычисление площади в пикселях, конвертирование в мм2 |
Площадь ФАЗ (мм2), границы ФАЗ обозначены вручную |
|
ИА |
Вычисляется по формуле: ИА = |
Отражает отклонения формы ФАЗ от идеального круга |
|
СП, % |
Отношение числа пикселей сосудистого рисунка к общему числу пикселей в выбранной зоне. Две кольцевые зоны: СП0–300 (внутренняя граница — граница ФАЗ, внешняя граница — 300 мкм от ФАЗ) и СП300–600 (внутренняя граница — 300 мкм от ФАЗ, внешняя — 600 мкм от ФАЗ) |
Позволяет получить представление о плотности капиллярного рисунка в выбранной зоне |
|
СкП, % |
Отношение числа пикселей скелетизированного сосудистого рисунка к общему числу пикселей изображения 3×3 мм |
Выполняет ту же функцию, что и СП, но не зависит от диаметра сосудов |
|
ИДС |
Отношение числа пикселей васкулярной сети бинарного изображения к соответствующему числу пикселей скелетизированного |
Относительная величина для характеристики диаметра сосудов |
|
ФР |
Вычисляется автоматически с помощью плагина FractalCount |
Характеризует степень сложности ветвления сосудов |
Наряду с количественными параметрами анализировали и качественные — наличие неперфузируемых зон (НЗ) и микроаневризм (МА). Для оценки использовали ОКТ-А-сканы трех сплетений 3×3 мм и 6×6 мм. Два исследователя проводили независимый анализ ОКТ-А-сканов; НЗ и МА считали подтвержденными при совпадении двух мнений.
Анализ в подгруппах
В исследовании участвовали группа пациентов с СД1 без видимой ДР и контрольная группа (здоровые добровольцы).
Этическая экспертиза
Проведение исследования одобрено локальным этическим комитетом при ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол №13 от 04.09.2019).
Статистический анализ
Принципы расчета размера выборки. Расчет размера выборки проводили на основании следующих параметров: статистическая мощность — 80%, допустимая ошибка I рода — 5%, средний уровень индекса ациркулярности (ИА) и его среднеквадратичное отклонение — 1,08±0,09 [6]. Исходя из указанных параметров, необходимый размер выборки составил 51.
Методы статистического анализа данных. Статистическую обработку проводили в программе IBM SPSS Statistics v.23.0. Описательная статистика представлена в виде среднего значения ± стандартное отклонение для показателей с нормальным распределением и медианы [ 25-й; 75-й процентили] для показателей с отклонением от нормального распределения. Нормальность распределения определяли в соответствии с критерием Колмогорова–Смирнова. Для сравнения параметров между группами использовали обобщенную линейную модель — обобщенные уравнения оценки для учета корреляции между парными глазами. Корреляцию между отдельными параметрами анализировали с помощью критерия Спирмена. Статистически значимыми считали различия при p<0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
Были обследованы 68 человек (123 глаза). В группу СД1 вошли 40 пациентов (14 мужчин, 26 женщин) (74 глаза; медиана возраста 25 лет [ 21,5; 31,5] с длительностью заболевания 10,0 [ 6,0; 16,3] лет, с уровнем гликированного гемоглобина (HbA1с) 7,1±1,1%. В контрольную группу вошли — 28 здоровых добровольцев (10 мужчин и 18 женщин) (49 глаз; медиана возраста 25 лет [ 24; 26].
Основные результаты исследования
Сравнение функциональных показателей
При сравнении МКОЗ статистически значимых различий между группами обнаружено не было: группа СД1 — 1,0 [ 1,0; 1,0], контрольная группа — 1,0 [ 0,95; 1,0]. Дефицит ОЗУНО был значимо выше у пациентов с СД1, чем в контрольной группе: 0,16±0,05 и 0,10±0,04 соответственно, p<0,0001 (рис. 2).
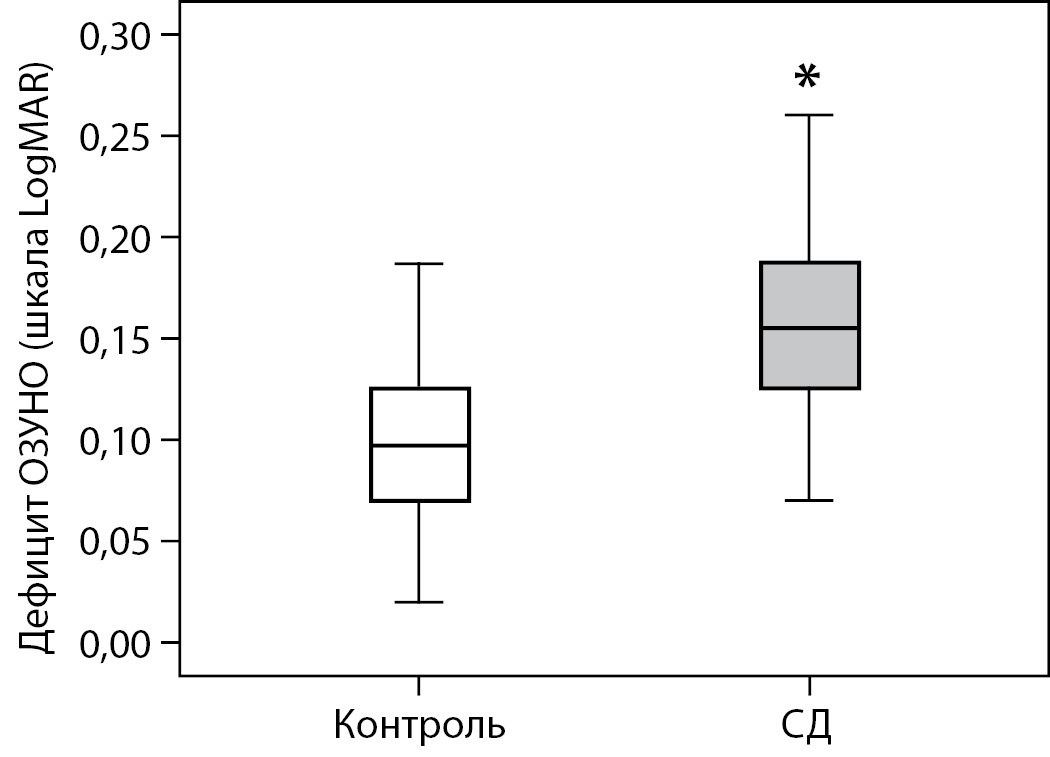
Рисунок 2. Сравнение дефицита остроты зрения в условиях низкой освещенности у пациентов с доклинической диабетической ретинопатией и в контрольной группе (*различия статистически значимы, p<0,0001, обобщенные линейные модели).
Сравнение структурных показателей
Мы провели сравнительный анализ толщины внутренних слоев сетчатки — слоя нервных волокон сетчатки (СНВС), слоя ганглиозных клеток и их дендритов (СГК+) и слоя ганглиозных клеток с дендритами и аксонами (СГК++). Сравнения проводили в отдельных секторах в соответствии с сеткой ETDRS, статистически значимых различий между группами не выявлено. При оценке корреляции между дефицитом ОЗУНО и толщиной отдельных слоев мы зарегистрировали слабую отрицательную корреляцию с толщиной СНВС, СГК+ и СГК++ в отдельных секторах, результаты представлены схематично на рис. 3.
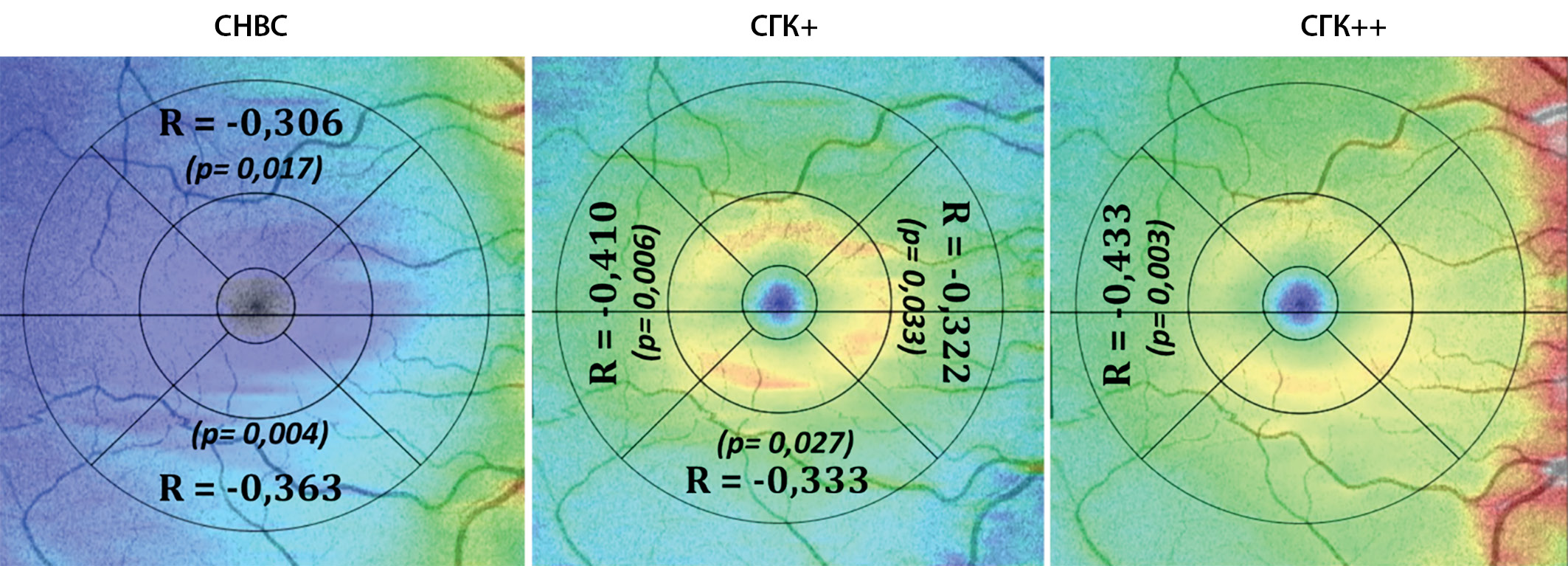
Рисунок 3. Схематичное изображение статистически значимых уровней корреляции толщины слоя нервных волокон сетчатки, слоя ганглиозных клеток и их дендритов (СГК+), слоя ганглиозных клеток с дендритами и аксонами (СГК++) в отдельных секторах и дефицита остроты зрения в условиях низкой освещенности (R — коэффициент корреляции Спирмена, p — уровень значимости).
Анализ параметров ОКТ-А
В ходе предварительного сравнения значений параметров ОКТ-А-сканов, полученных на разных томографах, были выявлены статистически значимые различия для показателей плотности сосудистого рисунка и отсутствие различий для значений ФАЗ и ИА. Поэтому для статистической обработки ФАЗ и ИА был использован весь объем выборки, а для анализа параметров васкулярной плотности — только ОКТ-А-сканы, полученные на Swept Source томографе DRI OCT Triton. Кроме того, отдельные изображения были исключены из-за наличия артефактов. В табл. 2 представлены результаты статистического анализа ОКТ-А-параметров с указанием числа глаз.
Таблица 2. Результаты статистического анализа исследуемых ангиографических параметров
|
Параметр |
Контрольная группа |
Группа СД |
Уровень значимости |
||
|
среднее ± стандартное отклонение или медиана |
Доверительный интервал |
среднее ± стандартное отклонение или медиана |
Доверительный интервал |
||
|
n=41 |
n=66 |
||||
|
ФАЗ, мм2 |
0,25±0,08 |
(0,23; 0,28) |
0,28±0,09 |
(0,25; 0,30) |
р=0,28 |
|
ИА |
1,31±0,15 |
(1,26; 1,36) |
1,47±0,24 |
(1,41; 1,53) |
p<0,0001* |
|
n=33 |
n=37 |
||||
|
СП0–300 ПСС ПКС ГКС |
29,00±1,89 29,00 [ 28,0; 30,0] 18,29±1,95 |
(28,33; 29,67) (28,74; 30,47) (17,59; 18,98) |
27,90±2,29 28,80 [ 27,4; 30,2] 17,22±3,10 |
(27,13; 28,66) (28,11; 30,17) (16,76; 17,67) |
р=0,057 p=0,694 p=0,015* |
|
СП300–600 ПСС ПКС ГКС |
26,67±1,81 26,66 [ 24,6; 28,1] 14,41±1,02 |
(26,03; 27,31) (25,80; 27,96) (14,05; 14,77) |
25,37±2,24 26,05 [ 24,4; 26,9] 14,37±1,19 |
(24,62; 26,11) (25,36; 27,54) (13,98; 14,77) |
p=0,028* p=0,787 p=0,876 |
|
СкП ПСС ПКС ГКС |
0,31 [ 0,30; 0,32] 0,18 [ 0,17; 0,19] 0,098±0,006 |
(0,30; 0,31) (0,18; 0,19) (0,096; 0,101) |
0,15 [ 0,14; 0,16] 0,18 [ 0,17; 0,19] 0,095±0,006 |
(0,15; 0,16) (0,18; 0,19) (0,093; 0,097) |
p<0,0001* p=0,364 p=0,015* |
|
ИДС ПСС ПКС ГКС |
1,97 [ 1,92; 2,03] 1,72±0,13 1,78±0,03 |
(1,94; 1,99) (1,67; 1,76) (1,77; 1,79) |
1,96 [ 1,91; 2,01] 1,69±0,04 1,80±0,03 |
(1,94; 1,98) (1,67; 1,90) (1,79; 1,81) |
p=0,450 p=0,229 p=0,036* |
|
ФР ПСС ПКС ГКС |
1,94 [ 1,93; 1,95] 1,95 [ 1,95;1,96] 1,93 [ 1,92; 1,93] |
(1,94; 1,94) (1,95; 1,95) (1,92; 1,93) |
1,94 [ 1,93; 1,94] 1,95 [ 1,95; 1,96] 1,92 [ 1,92; 1,93] |
(1,93; 1,94) (1,95; 1,95) (1,92; 1,93) |
p=0,069 p=0,849 p=0,916 |
В обеих исследуемых группах был обнаружен выраженный разброс значений площади ФАЗ, без значимых различий между группами: группа СД — 0,25±0,08 мм2, контрольная группа — 0,28±0,09 мм2, p=0,28. Однако у пациентов с СД1 был значимо выше ИА: группа СД1 — 1,47±0,24, контрольная группа — 1,31±0,15, p<0,0001, что может указывать на изменение формы ФАЗ уже на ранних стадиях ДР.
При сравнении результатов измерений сосудистой плотности (СП) в кольцевых зонах диаметром 300 мкм значимые различия были выявлены в поверхностном сосудистом сплетении (ПСС) и глубоком капиллярном сплетении (ГКС). Так, в поверхностном сплетении среднее значение СП300–600 в группе СД1 составило 25,37±2,24%, в контрольной группе — 26,67±1,81%, p=0,028. В глубоком сплетении значимая разница была зарегистрирована в ближней к ФАЗ кольцевой зоне: СП0–300 в группе СД1 — 17,22±3,10%, в группе контроля — 18,29±1,95%, p=0,015.
Наличие крупных сосудов в исследуемой зоне может искажать результаты анализа плотности васкулярной сети. Функция скелетизации позволяет устранить влияние диаметра сосудов. При оценке скелетизированная плотность (СкП) на всей площади ОКТ-А-скана 3×3 мм были зарегистрированы значимые различия в ПСС (в группе СД — 0,15±0,01%, контрольной группе — 0,31±0,02%, p<0,0001) и ГКС (в группе СД1 — 0,095±0,006%, контрольной группе — 0,098±0,006%, p=0,015). Кроме того, в ГКС у пациентов с СД1 был значимо выше ИДС (1,80±0,03 и 1,78±0,03, р=0,036).
При анализе ФР статистически значимых различий между группами обнаружено не было.
Дополнительные результаты исследования
Проведенный анализ корреляционной связи дефицита ОЗУНО и ангиографических параметров зарегистрировал отрицательную умеренную корреляцию между дефицитом ОЗУНО и СкП в ПСС (R=-0,516; p<0,0001), а также слабую корреляцию между дефицитом ОЗУНО и СП300–600 в ГКС (R=-0,307; p=0,045). Кроме того, дефицит ОЗУНО положительно коррелировал с ИДС в ПСС (R=-0,423; p=0,005).
При оценке качественных показателей в группе СД1 в 25,7% глаз были выявлены НЗ, регистрируемые преимущественно в ПКС. В 18,9% глаз при детальном изучении ОКТ-А-сканов мы обнаружили признаки МА — в 2 глазах изолированно в ПСС, в 5 глазах — в ПКС, в 2 — в ГКС, в 2 — в ПСС и ПКС, в 3 — в ПКС и ГКС. На рис. 4 представлены примеры НЗ и МА.
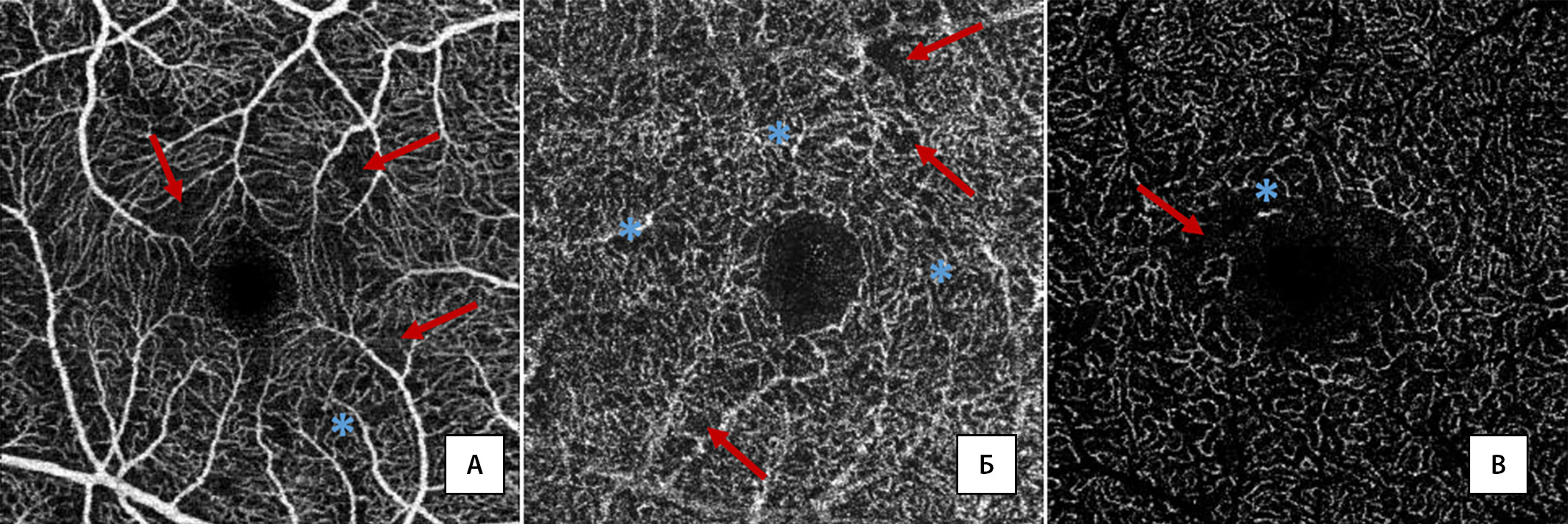
Рисунок 4. Примеры выявляемых неперфузируемых зон (НЗ) и микроаневризм (МА) в поверхностном сосудистом сплетении — А, промежуточном капиллярном сплетении — Б, глубоком капиллярном сплетении — В. Красные стрелки указывают на НЗ, голубые астериски — на МА.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
У пациентов с СД1 без офтальмоскопических признаков ДР было обнаружено статистически значимое снижение показателей СП и СкП на уровне ПСС и ГКС. Кроме того, на доклинической стадии ДР было выявлено повышение дефицита ОЗУНО и увеличение ациркулярности ФАЗ.
Обсуждение основного результата исследования
В нашем исследовании в качестве показателя зрительных функций мы использовали ОЗУНО. ОЗУНО была предложена Sunness J.S. и соавт. как предиктор снижения ОЗ у пациентов с сухой формой возрастной макулярной дегенерации (ВМД) [4]. Оценка дефицита ОЗУНО продемонстрировала свою воспроизводимость и прогностическую ценность у пациентов с ретинальными заболеваниями, затрагивающими МЗ [7].
Полученные нами результаты указывают на увеличение дефицита ОЗУНО на доклинической стадии ДР, что можно рассматривать как ранний признак нейродегенерации. В 1990 г. Midena E. и соавт. с помощью никтометрии продемонстрировали изменение макулярного ответа у 37,4% пациентов с СД без видимой ДР [8]. Функциональные изменения на доклинической стадии ДР были позже подтверждены в исследованиях с применением статической периметрии, ритмической и мультифокальной электроретинографии (мфЭРГ) [9].
В ходе исследования мы не выявили значимой разницы между толщиной внутренних слоев сетчатки у пациентов с СД и здоровых добровольцев, однако была зарегистрирована значимая корреляция дефицита ОЗУНО и толщины СНВС, СГК+ и СГК++ в отдельных секторах. Данные литературы по этому вопросу противоречивы — снижение толщины СНВС и СГК зарегистрировано у пациентов с СД2 типа (СД2) и в смешанных группах [10]. В исследованиях, проведенных только с участием пациентов с СД1, реже описаны структурные изменения [11]. Кроме того, Vujosevic S. и соавт. продемонстрировали, что у пациентов с СД1 толщина СГК была значимо выше, чем у пациентов с СД2, с учетом поправки на возраст [12]. Авторы объясняют это более высоким риском развития периферической нейропатии и сердечно-сосудистых нарушений при СД2, что может обусловливать разные темпы нейродегенерации. На основании этого можно сделать вывод о необходимости проведения дальнейших исследований в изолированных группах с учетом возраста и типа СД.
Обнаруженное нами увеличение ациркулярности ФАЗ и отсутствие значимых различий площади ФАЗ между группами согласуется с результатами Inanc M. и соавт. и указывает на то, что ИА является более чувствительным параметром, чем площадь ФАЗ [6]. Ранее увеличение ФАЗ было описано у пациентов без офтальмоскопических признаков ДР, однако многие авторы отмечают большой разброс значений площади ФАЗ в норме и, как следствие, трудности в сравнении этого параметра на доклинической стадии [13][14].
Результаты сравнения сосудистого рисунка свидетельствуют о наличии значимых различий СП и СкП в поверхностном и глубоком сплетениях. Большинство авторов описывают более выраженные изменения в ГКС, однако в настоящее время нет достаточных сведений о прогностической ценности показателей ОКТ-А в отдельных сплетениях [15]. Значимое увеличение ИДС в ГКС может указывать на ранние изменения диаметра сосудов вследствие нарушения механизмов ауторегуляции. Ранее Tang F. и соавт. зарегистрировали корреляцию ИДС с уровнем HbA1с и стадией ДР [16].
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования демонстрируют наличие значимых микроциркуляторных и функциональных изменений на доклинической стадии ДР. ОКТ-А позволяет регистрировать ранние нарушения капиллярного кровотока, проявляющиеся в изменении формы ФАЗ, снижении сосудистой плотности, появлении аваскулярных зон и МА. Рост дефицита ОЗУНО и его корреляция с ангиографическими показателями могут быть следствием сложного нейроваскулярного взаимодействия на ранних стадиях ДР. Обнаруженные изменения свидетельствуют о необходимости продолжения исследования в указанном направлении для установления прогностической ценности ОКТ-А-маркеров и разработки диагностических алгоритмов.
Список литературы
1. Липатов Д.В., Викулова О.К., Железнякова А.В., и др. Эпидемиология диабетической ретинопатии в Российской Федерации по данным Федерального регистра пациентов с сахарным диабетом (2013–2016 гг.) // Сахарный диабет. — 2018. — Т. 21. — №4. — С. 230-240. doi: https://doi.org/10.14341/DM9797
2. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — №S1. — С.1-144. doi: https://doi.org/10.14341/DM221S1
3. Forte R, Haulani H, Jürgens I. Quantative and qualitative analysis of the three capillary plexuses and choriocapillaris in patients with type 1 and type 2 diabetes mellitus without clinical signs of diabetic retinopathy: a prospective pilot study. Retina. 2020;40(2):333-344. doi: https://doi.org/10.1097/IAE.0000000000002376
4. Sunness JS, Rubin GS, Broman A, et al. Low Luminance Visual Dysfunction as a Predictor of Subsequent Visual Acuity Loss from Geographic Atrophy in Age-Related Macular Degeneration. Ophthalmology. 2008;115(9):1480-1488. doi: https://doi.org/10.1016/j.ophtha.2008.03.009
5. Campbell JP, Zhang M, Hwang TS, et al. Detailed vascular anatomy of the human retina by projection-resolved optical coherence tomography angiography. Sci Rep. 2017;7:1-11. doi: https://doi.org/10.1038/srep42201
6. Inanc M, Tekin K, Kiziltoprak H, et al. Changes in retinal microcirculation precede the clinical onset of diabetic retinopathy in children with type 1 diabetes mellitus. Am J Ophthalmol. 2019;207:37-44. doi: https://doi.org/10.1016/j.ajo.2019.04.011
7. Wood LJ, Jolly JK, Andrews CD, et al. Low-contrast visual acuity versus low-luminance visual acuity in choroideremia. Clin Exp Optom. 2021;104(1):90-94. doi: https://doi.org/10.1111/cxo.13087
8. Midena E, Segato T, Giuliano M, Zucchetto M. Macular recovery function (nyctometry) in diabetics without and with early retinopathy. Br J Ophthalmol. 1990;74(2):106-108. doi: https://doi.org/10.1136/bjo.74.2.106
9. Mermeklieva EA. Pattern electroretinography and retinal changes in patients with diabetes mellitus type 2. Neurophysiol Clin. 2019;49(3):209-215. doi: https://doi.org/10.1016/j.neucli.2019.04.002
10. Кулыбышева В.С., Ронзина И.А., Гамидов А.А., и др. Предикторы ранних изменений сетчатки при сахарном диабете // Офтальмология. — 2020. — Т. 17. — №1. — С. 88-95. doi: https://doi.org/10.18008/1816-5095-2020-1-88-95
11. Pierro L, Iuliano L, Cicinelli MV, et al. Retinal neurovascular changes appear earlier in type 2 diabetic patients. Eur J Ophthalmol. 2017;27(3):346-351. doi: https://doi.org/10.5301/ejo.5000887
12. Vujosevic S, Midena E. Retinal Layers Changes in Human Preclinical and Early Clinical Diabetic Retinopathy Support Early Retinal Neuronal and Müller Cells Alterations. J Diabetes Res. 2013;2013:1-8. doi: https://doi.org/10.1155/2013/905058
13. De Carlo TE, Chin AT, Bonini FMA, et al. Detection of microvascular changes in eyes of patients with diabetes but not clinical diabetic retinopathy using optical coherence tomography angiography. Retina. 2015;35(11):2364-2370. doi: https://doi.org/10.1097/IAE.0000000000000882
14. Бурнашева М.А., Куликов А.Н., Мальцев Д.С. Персонализированный анализ фовеальной аваскулярной зоны с помощью оптической когерентной томографии-ангиографии // Офтальмологические ведомости. — 2017. — Т. 10. — №4. — С. 32-40. doi: https://doi.org/10.17816/OV10432-40
15. Scarinci F, Picconi F, Giorno P, et al. Deep capillary plexus impairment in patients with type 1 diabetes mellitus with no signs of diabetic retinopathy revealed using optical coherence tomography angiography. Acta Ophthalmol. 2018;96(2):264-265. doi: https://doi.org/10.1111/aos.13510
16. Tang FY, Ng DS, Lam A, et al. Determinants of quantitative optical coherence tomography angiography metrics in patients with diabetes. Sci Rep. 2017;7(1):1-10. doi: https://doi.org/10.1038/s41598-017-02767-0
Об авторах
А. Н. СтуловаРоссия
Стулова Анна Николаевна, аспирант кафедры офтальмологии
Факультет фундаментальной медицины
119991, Москва, Ломоносовский пр-т, д. 27, к. 1
eLibrary SPIN: 5744-6530
Конфликт интересов:
Конфликт интересов отсутствует
Н. С. Семенова
Россия
Семенова Наталия Сергеевна, кандидат медицинских наук, доцент кафедры офтальмологии
Факультет фундаментальной медицины
Москва
eLibrary SPIN: 5767-4851
Конфликт интересов:
Конфликт интересов отсутствует
А. В. Железнякова
Россия
Железнякова Анна Викторовна, кандидат медицинских наук, старший научный сотрудник отделения эпидемиологии и государственного регистра СД
Москва
Scopus ID: 55939275900;
eLibrary SPIN: 8102-1779;
Researcher ID: J-3455-2017
Конфликт интересов:
Конфликт интересов отсутствует
В. С. Акопян
Россия
Акопян Владимир Сергеевич, доктор медицинских наук, профессор,
заведующий кафедрой офтальмологии
Москва
Факультет фундаментальной медицины
eLibrary SPIN: 7185-9577
Конфликт интересов:
Конфликт интересов отсутствует
Д. В. Липатов
Россия
Липатов Дмитрий Валентинович, доктор медицинских наук, профессор, заведующий отделением диабетической ретинопатии и офтальмохирургии
Москва
eLibrary SPIN: 9601-3993
Конфликт интересов:
Конфликт интересов отсутствует
М. В. Шестакова
Россия
Шестакова Марина Владимировна, доктор медицинскинаук, профессор, академик РАН
Москва
eLibrary SPIN: 7584-7015
Конфликт интересов:
Конфликт интересов отсутствует
Дополнительные файлы
Рецензия
Для цитирования:
Стулова А.Н., Семенова Н.С., Железнякова А.В., Акопян В.С., Липатов Д.В., Шестакова М.В. Ранние функциональные и микроциркуляторные нарушения у пациентов с сахарным диабетом 1 типа без видимой диабетической ретинопатии. Сахарный диабет. 2021;24(3):243-250. https://doi.org/10.14341/DM12532
For citation:
Stulova A.N., Semenova N.S., Zheleznyakova A.V., Akopyan V.S., Lipatov D.V., Shestakova M.V. Early functional and microcirculatory changes in patients with type 1 diabetes mellitus and no apparent diabetic retinopathy. Diabetes mellitus. 2021;24(3):243-250. (In Russ.) https://doi.org/10.14341/DM12532

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































