Перейти к:
Нарушение микроциркуляторного кровотока у больных сахарным диабетом 2 типа и кардиоваскулярной автономной нейропатией
https://doi.org/10.14341/DM12372
Аннотация
ОБОСНОВАНИЕ. Диабетическая кардиоваскулярная автономная нейропатия (КАН) ассоциирована с ранней смертностью и инвалидизацией пациентов. Нарушается иннервация как сердца, так и периферических сосудов.
ЦЕЛЬ. Оценить параметры микроциркуляторного кровотока кожи у больных сахарным диабетом (СД) и КАН. Выделить предикторы наличия КАН и оценить их значимость у больных СД.
МЕТОДЫ. В исследование включены 76 больных СД 2 типа (СД2) (24 больных с впервые выявленным СД и/или СД без микрососудистых осложнений, 26 с диабетической сенсомоторной нейропатией (ДСМН), 26 с хирургическими операциями по поводу синдрома диабетической стопы (СДС) в анамнезе). ДСМН диагностирована на основании жалоб, анамнеза и клинико-неврологического обследования. Для установления КАН выполнены кардиоваскулярные тесты (КВТ) как золотой стандарт диагностики: титл-тест, тест с глубоким дыханием, маневр Вальсальвы, тест с динамометром, холодовая вазоконстрикция. Согласно рекомендациям международной группы по исследованию нейропатии, все пациенты были разделены на группы: КАН 0 (все тесты нормальные), КАН 1 (возможная/ранняя стадия — один измененный тест), КАН 2 (подтвержденная стадия — как минимум два КВТ изменены), КАН 3 (тяжелая стадия — все случаи симптоматической и/или бессимптомной ортостатической гипотензии). Микроциркуляторный кровоток кожи околоногтевого валика кистей оценивался в покое, а также в ходе холодового теста методом высокочастотной ультразвуковой допплерографии на приборе «Минимакс Допплер К» (ООО «Минимакс», Санкт-Петербург, Россия).
РЕЗУЛЬТАТЫ. КАН 1 диагностирована у 8% больных с СД без микрососудистых осложнений и у 42% и 21% пациентов с ДСМН и операциями по поводу СДС в анамнезе соответственно. КАН 2 выявлена у 27% больных с ДСМН и у 58% с операциями на стопах в анамнезе. КАН 3 определена в 8% и 19% случаев у больных с ДСМН и СДС соответственно. Параметры базального микроциркуляторного кровотока были снижены значительно у пациентов с подтвержденной/тяжелой стадией КАН по сравнению с ранней стадией и больными без КАН (Vm=2,5±0,66 см/с и 4,4±0,54 см/с, 5,1±1,01 см/с соответственно; p=0,0033). Положительный результат холодового теста зарегистрирован у 94% пациентов с подтвержденной/выраженной КАН и у 26% больных с КАН 1.
ЗАКЛЮЧЕНИЕ. В исследовании на когорте больных СД2 с/без ДСМН, с/без ампутаций на стопах в анамнезе продемонстрировано увеличение риска подтвержденной/тяжелой стадии КАН в 6,4 раза в случаях снижения Vm (средней скорости микроциркуляторного кровотока по данным высокочастотной ультразвуковой допплерографии) менее 2,4 см/с. Положительный результат холодового теста ассоциирован с увеличением риска подтвержденной/тяжелой КАН в 28,6 раза.
Ключевые слова
Для цитирования:
Зеленина Т.А., Салухов В.В., Земляной А.Б., Железняк С.Г., Клиценко О.А. Нарушение микроциркуляторного кровотока у больных сахарным диабетом 2 типа и кардиоваскулярной автономной нейропатией. Сахарный диабет. 2021;24(1):32-44. https://doi.org/10.14341/DM12372
For citation:
Zelenina T.A., Salukhov V.V., Zemlianoi A.B., Zheleznjak S.G., Klitsenko O.A. Impairment of microvascular blood flow in patients with type 2 diabetes and cardiovascular autonomic neuropathy. Diabetes mellitus. 2021;24(1):32-44. (In Russ.) https://doi.org/10.14341/DM12372
Сахарный диабет (СД) — одна из самых распространенных эндокринных патологий, поражающая около 10% населения всего мира, а более половины случаев СД остаются недиагностированными [1, 2]. Риск сердечно-сосудистой патологии и смерти в 5–7 раз выше у больных СД, чем у лиц без СД [2, 3]. Снижение тяжести сердечно-сосудистых заболеваний и осложнений СД является приоритетной задачей его лечения [2–4]. Среди прочих факторов риска сердечно-сосудистой патологии кардиоваскулярная автономная нейропатия (КАН) — распространенное, однако часто игнорируемое осложнение СД — ассоциирована с ранней инвалидизацией и смертностью пациентов [5, 6]. Клинические проявления КАН, такие как безболевой инфаркт миокарда, нарушения сердечного ритма, постуральная гипотензия, внезапная смерть, зачастую необратимы и фатальны [6–8]. Распространенность КАН составляет 17–66% у больных СД 1 типа (СД1) и 31–73% у пациентов с СД 2 типа (СД2). Большой разброс обусловлен расхождениями и различиями в критериях, используемых для диагностики КАН [5, 6, 8]. Инструментальное обследование для выявления КАН необходимо проводить всем больным СД2 на момент постановки диагноза [4]. Для этого традиционно используются кардиоваскулярные тесты (КВТ) Ewing D.J. и Clarke B.F., которые, однако, не находят широкого распространения в клинической практике [9–11]. Таким образом, диагностические критерии КАН все еще остаются предметом обсуждений и требуют отдельного научного обоснования. Актуальными являются как выявление клинических предикторов различных стадий КАН, так и поиск новых инструментальных возможностей для ее диагностики [11–14].
Оценка микроциркуляторного кровотока у больных СД является важнейшей задачей, поскольку его патология лежит в основе всех микрососудистых осложнений СД, особенно КАН, когда страдает не только центральная, но и периферическая сосудистая иннервация [8, 13, 15]. Однако данные о состоянии микроциркуляторного кровотока при этом заболевании единичны и не систематизированы [15–17].
Перспективной является оценка микроциркуляторного кровотока кожи методом высокочастотной ультразвуковой допплерографии (ВЧУДГ) на приборе «Минимакс-Допплер-К» (ООО СП «Минимакс», Россия, Санкт-Петербург) с высокочастотными датчиками 20–25 МГц [14, 18, 19]. Метод основан на эффекте Допплера и позволяет получить как качественные, так и количественные характеристики микроциркуляторного кровотока в сосудах разного диаметра (0,3–2 мм) в покое и в ходе проведения различных функциональных тестов [14, 20].
ЦЕЛЬ
Определить параметры микроциркуляторного кровотока у больных СД2 и КАН по результатам ВЧУДГ в покое и в ходе функциональной (холодовой) пробы. Выделить предикторы наличия КАН и оценить их значимость у больных СД2.
МЕТОДЫ
Дизайн исследования
Выполнено обсервационное (наблюдательное) проспективное когортное двухцентровое исследование.
Критерии соответствия
В исследование вошли больные СД2, мужчины и женщины, в возрасте от 40 до 80 лет.
Включены следующие группы пациентов:
- группа больных СД2 без дистальной сенсомоторной нейропатии (ДСМН) и других микрососудистых осложнений СД;
- группа больных СД2 и ДСМН;
- группа больных СД2 с ДСМН и оперативными вмешательствами на стопах по поводу СДС в анамнезе.
Из исследования исключены больные с плохо контролируемым СД (HbA1c≥10%), острыми осложнениями СД (кетоз, кетоацидоз, гипер/гипогликемическая кома, лактат-ацидоз), хроническими осложнениями СД тяжелых стадий (диабетической ретинопатией, требующей лазерокоагуляции сетчатки, диабетической нефропатией с расчетной скоростью клубочковой фильтрации (рСКФ) ≤30 мл/мин/1,73 м2). Не вошли пациенты с фибрилляцией предсердий или наличием искусственного водителя сердечного ритма, тяжелой сердечной недостаточностью, обструктивной болезнью легких, а также другими хроническими заболеваниями в стадии декомпенсации. Исключены больные, страдающие алкоголизмом, полинейропатией недиабетической этиологии, пациенты с критической ишемией нижних конечностей по данным ультразвуковой допплерографии (лодыжечно-плечевой индекс ≤0,9). Ограничений по использованию тех или иных фармакологических препаратов, которые длительно применялись для лечения основного и сопутствующих заболеваний, не было.
Условия проведения
Исследование выполнено на базе Военно-медицинской академии им. С.М. Кирова, а также Северо-Западного государственного медицинского университета им. И.И. Мечникова.
Продолжительность исследования
Продолжительность периода включения в исследование и обследования пациентов: октябрь 2013 — март 2019 гг.
Описание медицинского вмешательства
Исследователями проведен сбор демографических данных, включающих возраст, пол, рост, вес пациентов, а также анализ медицинских документов для уточнения длительности СД, наличия гипертонической болезни, ишемической болезни сердца, а также микрососудистых осложнений СД.
Все манипуляции с больными проводились в стандартных условиях. Пациенты могли принимать обычную для них медикаментозную терапию, если она была постоянной на протяжении не менее 8 нед до начала исследования. За сутки до всех проводимых инструментальных манипуляций из рациона больных исключались алкоголь, кофеин и употребление сигарет. Сбор демографических данных и инструментальные манипуляции проводились в первой половине дня в специальном помещении с контролируемой температурой воздуха 22–24°С после 20 минут акклиматизации пациентов.
Взятие крови для определения уровней гликированного гемоглобина, липидного спектра, креатинина и рСКФ по формуле MDRD с поправкой на массу и площадь поверхности тела проводили утром после 8–10 ч голодания больных.
Исследование кардиоваскулярной автономной иннервации
Выполнены 5 стандартных кардиоваскулярных тестов (КВТ). Для оценки парасимпатической иннервации определяли динамику частоты сердечных сокращений во время теста Вальсальвы и теста с глубоким дыханием. Симпатическую иннервацию оценивали по изменению артериального давления во время проб с динамометром, пассивным ортостазом, определяли также холодовую вазоконстрикцию методом фотоплетизмографии по методикам, описанным ранее [21]. Результатам каждого из тестов присвоены 0 баллов в случае нормальных, 0,5 балла в случае пограничных и 1 балл при патологически измененных значениях (табл. 1).
Таблица 1. Значения кардиоваскулярных тестов и система присвоения баллов
Кардиоваскулярные тесты | Нормальные значения (0 баллов) | Пограничные значения (0,5 балла) | Патологические значения (1 балл) |
Тест Вальсальвы, усл. ед. | ≥1,41 | 1,40–1,20 | ≤1,19 |
Тест с глубоким дыханием, в минуту | ≥15 | 14–11 | ≤10 |
Проба с динамометром, мм рт. ст. | ≥15 | 14–11 | ≤10 |
Холодовая вазоконстрикция, % | ≥36 | 35–25 | ≤24 |
Проба с пассивным ортостазом, мм рт. ст. | ≤10 | 19–11 | ≥20 |
Подобная система присвоения баллов была предложена самими авторами КВТ и отработана в нескольких исследованиях позднее [10, 13, 21]. Согласно рекомендациям экспертной группы по изучению диабетической нейропатии (Торонто, 2009 г.), ранняя стадия КАН диагностирована при наличии ≥1 балла, подтвержденная форма КАН — в случаях ≥2 баллов, а тяжелая КАН – при выявленной симптоматической и/или бессимптомной ортостатической гипотензии [5, 6]. Пациенты без признаков КАН включены в группу КАН 0, с ранней стадией — в группу КАН 1, а с подтвержденными и тяжелыми формами — в группу КАН 2–3.
Исследование микроциркуляторного кровотока
Микроциркуляторный кровоток кожи определяли у ногтевого валика пальцев рук в положении пациентов лежа после 20 мин акклиматизации в стандартном помещении в тот же день, что и оценку КАН.
Установка датчика осуществлялась без сдавления кожи, для получения качественного сигнала использовался в качестве контактной среды акустический гель. При установке датчика в зоне локации меняли угол наклона датчика до получения максимального по амплитуде и звуку сигнала. Звуковой сигнал, полученный с участка микроциркуляторного русла от артериол, характеризовался пульсирующим тихим шумом, синхронизированным с фазой сердечного цикла, визуально сигнал имел в спектре систолический и диастолический пики (рис. 1).
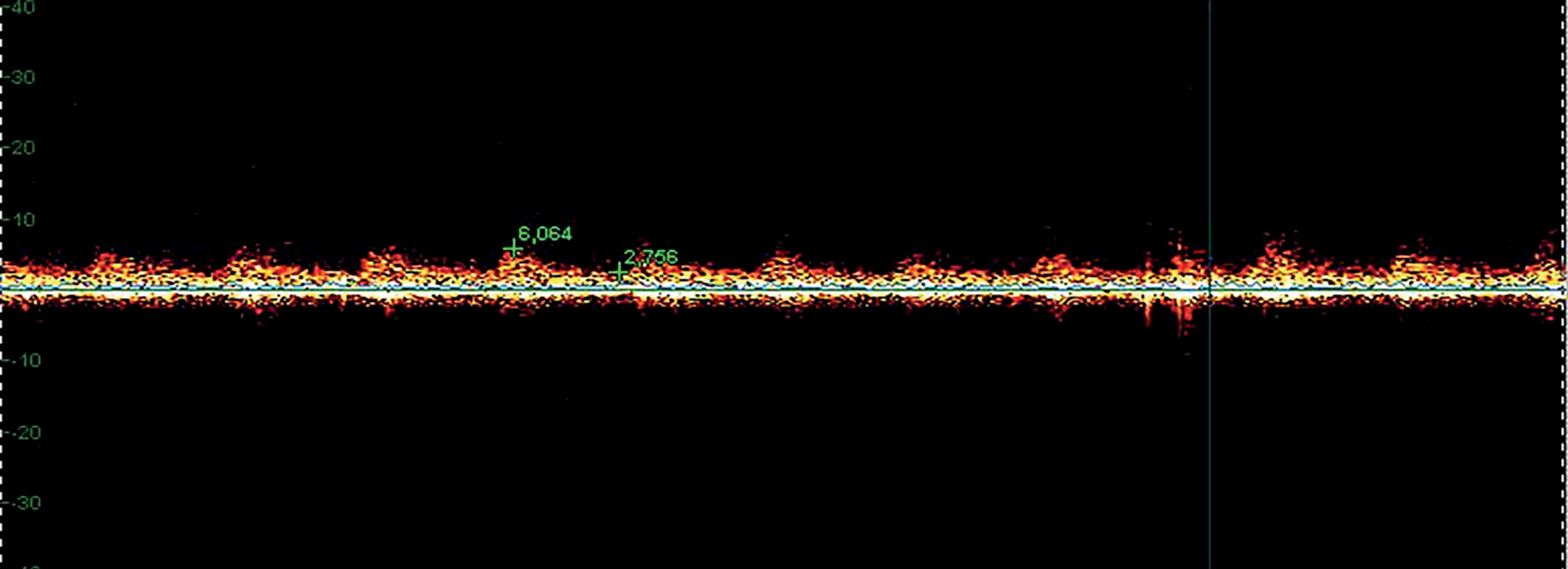 Рис. 1. Допплерограмма микроциркуляторного кровотока кожи ногтевого валика кистей в норме.
Рис. 1. Допплерограмма микроциркуляторного кровотока кожи ногтевого валика кистей в норме.После записи допплерограммы исследуемой области проводилась оценка как качественных показателей (формы, выраженности всех элементов, ширины спектрального окна, аудиохарактеристик кровотока), так и количественных линейных скоростных параметров, включающих систолическую (Vs), конечную диастолическую (Vd), а также среднюю за сердечный цикл скорости кровотока (Vm) (см. рис. 1).
Кровоток определялся в покое и во время функциональной холодовой пробы.
Холодовая проба. Тест применялся для оценки симпатической иннервации микрососудистого русла. Двойная симпатическая иннервация сосудов кожи, отвечающая как за вазоконстрикцию, так и за вазодилатацию, была открыта еще в 1930-х гг. [15, 16, 22]. Холодовой стимул на контралатеральной стороне вызывает рефлекторную активацию симпатических вазоконстрикторных нервов, что приводит к сосудистому спазму и снижению микроциркуляторного кровотока исследуемой конечности. После отмены холодового стимула происходит активация симпатических вазодилаторных нервов, отвечающих за последующее увеличение микроциркуляторного кровотока [16, 22]. Во время пробы кисть погружали на одну минуту в холодную воду с температурой 2–4°С (плавающий лед) и регистрировали кровоток кожи контралатеральной конечности. В норме кровоток во время охлаждения снижался на 30–50%, а после отмены холода возрастал на 20–30% выше исходного. Холодовая проба считалась отрицательной (сохраненная вазоконстрикция) во всех случаях адекватного снижения кровотока на холодовой стимул и/или адекватного прироста после отмены холода. В остальных случаях проба расценивалась как положительная (нарушение сосудистой иннервации) [14, 23].
Исследование сенсомоторной иннервации. Оценка жалоб пациентов со стороны нижних конечностей проводилась с применением шкалы Общего Симптоматического Счета (ОСС), включающей определение наличия, выраженности и частоты возникновения таких симптомов, как жжение, покалывание, боли и онемение в стопах. Исследование нарушений чувствительности и рефлексов выполнялось в ходе клинико-неврологического осмотра с использованием шкалы Нейропатического Дисфункционального Счета (НДС). Шкала НДС включает оценку в баллах коленных и ахилловых рефлексов, тактильной, болевой, температурной и вибрационной чувствительности. Балльная оценка, согласно этой шкале, коррелирует с результатами электронейромиографического исследования и с высокой чувствительностью и специфичностью позволяет диагностировать ДСМН [24].
Основной исход исследования
Основным оцениваемым параметром при исследовании микроциркуляторного кровотока кожи кистей больных СД в покое была выбрана Vm, поскольку именно этот показатель позволяет максимально полно его охарактеризовать, учитывая и систолическую (сердечный выброс), и диастолическую (сопротивление артериол и капилляров) составляющие [18, 23]. Результат холодовой пробы регистрировали как качественную переменную (положительный или отрицательный тест).
Дополнительные исходы исследования
Дополнительными предикторами наличия и выраженности КАН у больных СД предполагались такие демографические, анамнестические и клинические параметры, как пол, возраст, длительность СД, наличие диабетической ретинопатии, нефропатии, выраженность ДСМН по шкале НДС, ампутации стоп в анамнезе, а также биохимические параметры (уровень гликированного гемоглобина, липидный спектр сыворотки крови, креатинин и рСКФ).
Анализ в подгруппах
После выполнения КВТ все пациенты были поделены на три подгруппы: КАН 0, КАН 1 и КАН 2–3 согласно критериям, описанным ранее. Проведено сравнение количественных и качественных данных в подгруппах для выявления статистически значимых различий и выбора предикторов КАН с дальнейшим их включением в статистический анализ. Прогнозируемыми показателями были: 1) наличие любой стадии КАН; 2) наличие подтвержденной/тяжелой КАН. Таким образом, прогнозируемым параметром оказалась бинарная переменная (на первом этапе — КАН есть (подгруппа КАН 0) и КАН нет (объединенные подгруппы КАН 1–3), на втором этапе — подтвержденная/тяжелая КАН (КАН 2–3) и все остальные случаи (КАН 0, КАН 1)).
Методы регистрации исходов
Микроциркуляторный кровоток кожи кистей рук определялся в покое и во время холодовой пробы методом ВЧУДГ на приборе «Минимакс-Допплер-К» (ООО СП «Минимакс», Россия, Санкт-Петербург) с высокочастотными датчиками 20–25 МГц.
Для оценки КВТ проводилось постоянное измерение артериального давления (АД) на мониторе «Финометер-Про» (FMS, Нидерланды) с записью электрокардиограммы (ЭКГ). Холодовая вазоконстрикция оценивалась методом воздушной плетизмографии по Dohn [21].
Ахилловы и коленные рефлексы определяли с помощью неврологического молоточка, пороги вибрационной, температурной, тактильной и болевой чувствительности — с применением соответственно камертона 128-Гц, «типтерма», 10-граммового монофиламента, неврологической иглы [24].
Анамнестические данные относительно СД, его осложнений и сопутствующей патологии подтверждали записями в медицинской документации пациентов. Биохимические параметры определяли стандартными методами, принятыми в рутинной лабораторной практике.
Этическая экспертиза
Исследование одобрено этическим комитетом Северо-Западного государственного медицинского университета им. И.И. Мечникова, протокол №6 от 03.04.2013 г. Все пациенты подписали информированное согласие на участие в исследовании.
Статистический анализ
Принципы расчета размера выборки. Минимально достаточное количество наблюдений установлено по формулам доказательной медицины с применением таблиц определения размера выборки для достижения 80% мощности (α=0,05, двусторонняя).
Методы статистического анализа данных. Использовался пакет программ STATISTICA v.10. (Statsoft, USA). Тип распределения значений переменных оценивался путем построения гистограмм распределения. Все данные представлены как средняя ± стандартное отклонение для количественных переменных с нормальным распределением и как средняя ± 95% доверительный интервал (ДИ) для переменных с распределением, отличным от нормального. Качественные переменные приводятся в процентах. Для сравнения качественных переменных между группами использовался χ² с поправкой Йетса (для малых групп), критерий Фишера. Для сравнения количественных переменных применялись параметрические методы (однофакторный дисперсионный анализ, критерий Бонферрони при попарном сравнении наблюдений) и непараметрические (непараметрический дисперсионный анализ Краскела–Уоллиса, при попарном сравнении между группами — тест Манна–Уитни с уровнем статистической значимости p≤0,017).
Для оценки отношения шансов (ОШ) наличия КАН, а также ее подтвержденных/выраженных стадий в зависимости от выделенных предикторов использовали логистический регрессионный анализ. Для определения пороговых значений количественных величин применялся метод классификационных деревьев.
Была также построена ROC-кривая для определения диагностической ценности основного количественного фактора риска (Vm). Статистически значимыми считались различия при р≤0,05.
РЕЗУЛЬТАТЫ
Объекты (участники) исследования
В исследование были включены 24 больных СД2 без микрососудистых осложнений, 26 больных с ДСМН и 27 пациентов с оперативными вмешательствами на стопах по поводу СДС в анамнезе. Характеристики участников исследования представлены в табл. 2.
Таблица 2. Характеристики участников исследования
Параметры | СД2 (n=24) | ДСМН (n=26) | СДС в анамнезе (n=27) | р-значение |
Возраст, годы | 65,0 (95% ДИ 59,5–70,5) | 65,7 (95% ДИ 62,6–68,7) | 58,0 (95% ДИ 53,8–62,3) | 0, 03 |
Пол (м/ж) | 20/4 | 23/3 | 20/7 | 0,64 |
Длительность СД, годы | 2,0 (95% ДИ 0–4,5) | 9,6 (95% ДИ 6,7–12,5) | 7,7 (95% ДИ 5,6–9,7) | 0,0007 |
ГБ, n (%) | 19 (79,2) | 26 (100) | 21 (77,8) | 0,05 |
ИБС, n (%) | 15 (62,5) | 23 (88,5) | 20 (74,1) | 0,07 |
ДР, n (%) | 1 (4,2) | 7 (26,9) | 7 (25,9) | 0,07 |
Лечение аналогами инсулина, n (%) | 0 (0) | 0 (0) | 20 (74) | 0,00001 |
Лечение статинами, n (%) | 12 (50) | 20 (77) | 15 (56) | 0,09 |
ИМТ, кг/м² | 32,7±1,99 | 31,1±1,11 | 28,2±0,82 | 0,049 |
HbA1с, % | 6,0±0,13 | 6,9±0,24 | 7,2±0,23 | 0,03 |
обХс, ммоль/л | 4,7±0,26 | 4,1±0,24 | 4,8±0,24 | 0,044 |
ХсЛПНП, ммоль/л | 2,5±0,26 | 1,8±0,29 | 2,9±0,21 | 0,009 |
ХсЛПВП, ммоль/л | 1,1±0,17 | 1,2±0,06 | 1,2±0,07 | 0,20 |
ТГ, ммоль/л | 1,6±0,18 | 1,7±0,21 | 1,8±0,29 | 0,20 |
рСКФ, мл/мин/1,73 м² | 97,8±11,18 | 106,1±7,37 | 89,3±4,15 | 0,18 |
НДС, баллы | 3,4±0,24 | 8,2±0,52 | 10,4±0,86 | 0,00003 |
ОСС, баллы | 1,8±0,81 | 2,3±0,44 | 2,8±0,52 | 0,4 |
Vm, см/с | 5,1 (95% ДИ 2,8–7,4) | 4,9 (95% ДИ 3,5–6,3) | 1,8(95% ДИ 1,4–2,3) | 0,00003 |
Положительный результат холодовой пробы, n (%) | 1 (7,1%) | 7 (26,9%) | 19 (79,2%) | 0,00001 |
Подтвержденная и/или тяжелая КАН, n (%) | 0 | 4 (15,4%) | 14 (51,8%) | 0,0001 |
Примечание. СД2 — сахарный диабет 2 типа; ДСМН — дистальная сенсомоторная нейропатия; СДС — синдром диабетической стопы; ГБ — гипертоническая болезнь; ИБС — ишемическая болезнь сердца; ДР — диабетическая ретинопатия; ИМТ — индекс массы тела; НbA1с — гликированный гемоглобин; обХс — общий холестерин; ХсЛПНП — холестерин липопротеидов низкой плотности; ХсЛПВП — холестерин липопротеидов высокой плотности; ТГ — триглицериды; СКФ — скорость клубочковой фильтрации; НДС — шкала Нейропатического Дисфункционального Счета; ОСС — шкала Общего Симптоматического Счета; Vm — средняя за сердечный цикл скорость кровотока; КАН — кардиоваскулярная автономная нейропатия.
Больные с оперативным лечением СДС в анамнезе отличались от пациентов СД без микрососудистых осложнений длительностью основного заболевания (р=0,002), статистически незначимо уровнем гликированного гемоглобина (р=0,03), а также индексом массы тела (р=0,09). Только пациенты с ампутациями стоп в анамнезе получали в качестве сахароснижающей терапии инсулин в комбинации с таблетированными препаратами. Большинство больных, включенных в исследование, страдали гипертонической болезнью. В качестве гипотензивной терапии применялись ингибиторы ангиотензинпревращающего фермента — в 54,5%, антагонисты рецепторов ангиотензина-II — в 42,4%, β-блокаторы — в 63,6%, антагонисты кальция — в 40,9% случаев. Значимых различий в гипотензивной терапии между группами участников исследования не наблюдалось. Тяжесть ДСМН по результатам шкалы НДС, а также встречаемость подтвержденных/поздних стадий КАН прогрессировали от пациентов без микрососудистых осложнений к больным с ампутациями на уровне стоп в анамнезе. Именно в последней группе пациентов с СДС в анамнезе при проведении ВЧУДГ выявлено значительное снижение Vm по сравнению с остальными участниками исследования (р=0,000005 и р=0,00006 соответственно), а положительная реакция на холодовой стимул, свидетельствующая о нарушении периферической иннервации, зарегистрирована более чем в 75% случаев (табл. 2).
Основные результаты исследования
У больных СД2 без микрососудистых осложнений КАН выявлена лишь в 8,3% случаев в ранней стадии. В то же время КАН как в ранней, так и в выраженной/тяжелой форме диагностирована у большинства пациентов с ДСМН и у всех больных с оперативным лечением по поводу СДС в анамнезе (рис. 2).
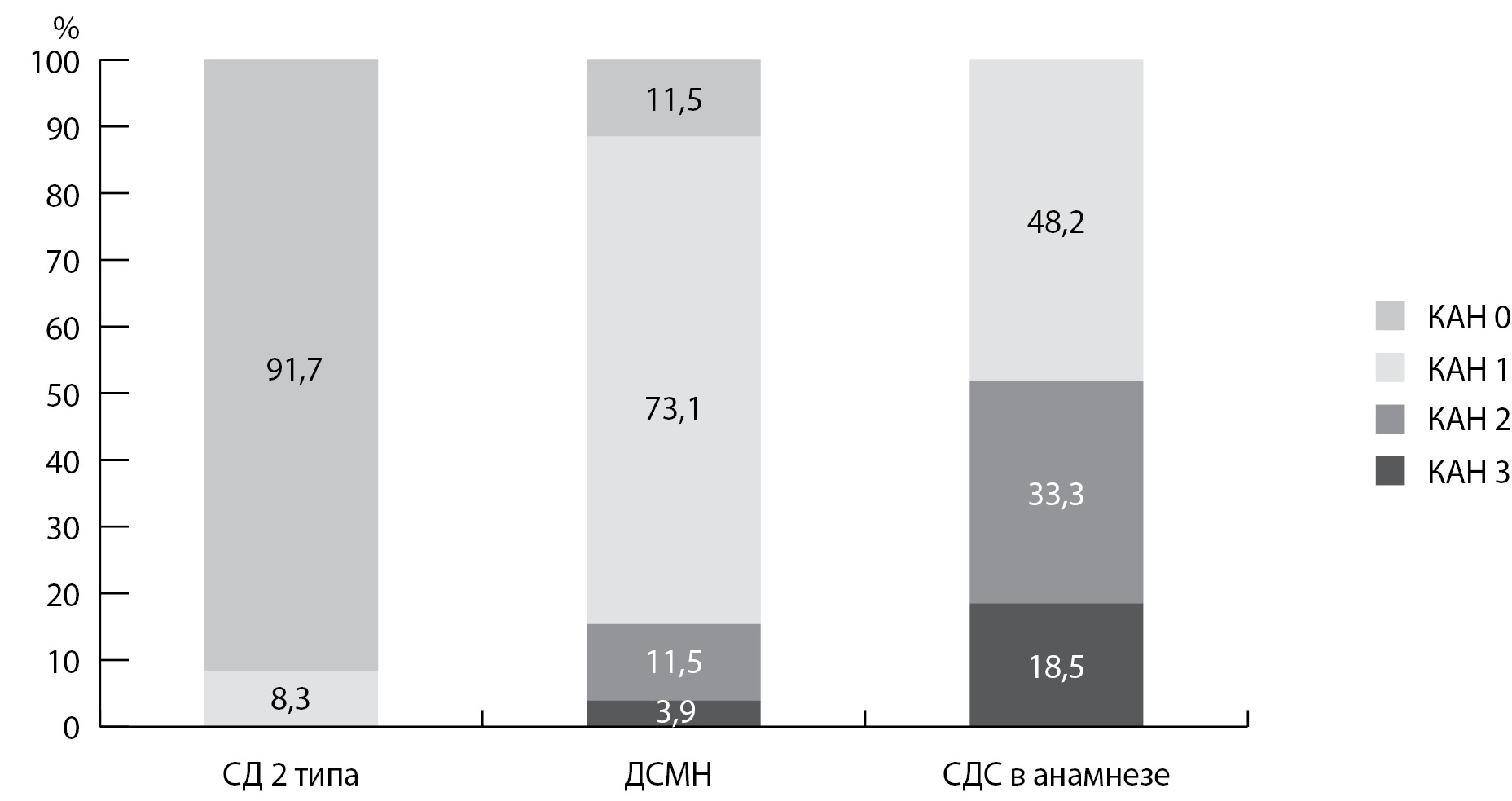 Рис. 2. Распространенность кардиоваскулярной автономной нейропатии (КАН) среди больных сахарным диабетом 2 типа: КАН 0 — кардиоваскулярной автономной нейропатии нет; КАН 1 — ранняя стадия; КАН 2 — подтвержденная стадия; КАН 3 — тяжелая форма, случаи клинической и/или бессимптомной ортостатической гипотензии. СД — сахарный диабет; ДСМН — диабетическая сенсомоторная нейропатия; СДС — синдром диабетической стопы.
Рис. 2. Распространенность кардиоваскулярной автономной нейропатии (КАН) среди больных сахарным диабетом 2 типа: КАН 0 — кардиоваскулярной автономной нейропатии нет; КАН 1 — ранняя стадия; КАН 2 — подтвержденная стадия; КАН 3 — тяжелая форма, случаи клинической и/или бессимптомной ортостатической гипотензии. СД — сахарный диабет; ДСМН — диабетическая сенсомоторная нейропатия; СДС — синдром диабетической стопы.Все пациенты разделены на подгруппы (КАН 0, КАН 1 и КАН 2–3) согласно результатам КВТ. Выполнено сравнение клинических, биохимических и инструментальных параметров между подгруппами больных, определены статистически значимые различия (табл. 3).
Таблица 3. Характеристики подгрупп исследования
Параметры | КАН 0 (n=25) | КАН 1 (n=34) | КАН 2–3 (n=18) | Р-значение |
Возраст, годы | 62,8 (95% ДИ 60,5–65,7) | 63,5 (95% ДИ 60,0–66,7) | 61,6 (95% ДИ 56,1–67,2) | 0,68 |
Длительность СД2, годы | 4,0 (95% ДИ 0,7–6,9) | 8,5 (95% ДИ 6,0–10,9) | 7,8 95% ДИ 4,9–10,6) | 0,09 |
Пол, м/ж | 22/3 | 26/8 | 15/3 | 0,43 |
СДС, n (%) | 0 | 13 (38,2) | 14 (77,8) | 0,00001 |
ДСМН, n (%) | 3 (12) | 32 (94,1) | 18 (100) | 0,00001 |
ДР, n (%) | 1 (4) | 8 (23,5) | 6 (33,3) | 0,03 |
ГБ, n (%) | 20 (80) | 31 (91,2) | 15 (83,3) | 0,39 |
ИБС, n (%) | 13 (52) | 30 (88,2) | 15 (83,3) | 0,005 |
НДС, баллы | 4,9±0,88 | 7,6±0,61 | 11,1±0,83 | 0,00008 |
ОСС, баллы | 1,3 (95% ДИ 0–3,2) | 2,4 (95% ДИ 1,5–3,1) | 3,1 (95% ДИ 1,7– 4,4) | 0,19 |
Лечение аналогами инсулина, n (%) | 0 (0) | 10 (29) | 10 (56) | 0,0001 |
Лечение статинами, n (%) | 12 (48) | 24 (71) | 11 (61) | 0,13 |
ИМТ, кг/м² | 34,0±1,86 | 29,8±0,89 | 28,7±1,19 | 0,02 |
НbА1с, % | 6,1±0,19 | 7,0±0,23 | 7,0±0,21 | 0,16 |
обХс, ммоль/л | 5,0±0,41 | 4,2±0,20 | 4,5±0,23 | 0,06 |
ХсЛПНП, ммоль/л | 2,5±0,45 | 2,4±0,26 | 2,7±0,21 | 0,37 |
ХсЛПВП, ммоль/л | 1,0±0,05 | 1,2±0,07 | 1,2±0,10 | 0,9 |
ТГ, ммоль/л | 1,8±0,23 | 1,6±0,18 | 1,7±0,33 | 0,86 |
рСКФ, мл/мин/1,73 м2 | 108,2±8,68 | 96,8±6,67 | 95,1±5,85 | 0,77 |
Vm, см/с | 4,3 (95% ДИ 2,3–6,0) | 4,3 (95% ДИ 3,1–5,5) | 2,5(95% ДИ 1,1–3,9) | 0,0033 |
Положительный результат холодовой пробы, % | 2 (8%) | 8 (23,5%) | 17 (94,4%) | 0,00001 |
Примечание. СД — сахарный диабет; СДС — синдром диабетической стопы; ДСМН — дистальная сенсомоторная нейропатия; ДР — диабетическая ретинопатия; ГБ — гипертоническая болезнь; ИБС — ишемическая болезнь сердца; НДС — шкала Нейропатического Дисфункционального Счета; ОСС — шкала Общего Симптоматического Счета; ИМТ — индекс массы тела; НbA1с — гликированный гемоглобин; обХс — общий холестерин; ХсЛПНП — холестерин липопротеидов низкой плотности; ХсЛПВП — холестерин липопротеидов высокой плотности; ТГ — триглицериды; СКФ — скорость клубочковой фильтрации; Vm — средняя за сердечный цикл скорость кровотока; КАН — кардиоваскулярная автономная нейропатия.
Пациенты с разными стадиями КАН не отличались по возрасту, соотношению мужчин и женщин, распространенности артериальной гипертензии, а также параметрам липидного спектра сыворотки крови.
Однако пациенты с КАН (любой стадии) имели тенденцию к более высокому уровню гликированного гемоглобина и длительности СД по сравнению с участниками исследования без КАН. Эти больные также чаще страдали другими микрососудистыми осложнениями СД (ДСМН, ретинопатией), ишемической болезнью сердца, в анамнезе имели ампутации на уровне стоп в связи с незаживающими ранами. Поскольку только пациенты с СДС получали в качестве сахароснижающей терапии инсулин в комбинации с таблетированными препаратами, и они же вошли в подгруппы КАН 1 и КАН 2–3, больные с КАН (любой стадии) отличались по этому параметру от пациентов без КАН. Это же обстоятельство (все больные с ампутациями на уровне стоп в анамнезе вошли в подгруппы КАН 1 и КАН 2–3) объясняет и различия в ИМТ между подгруппами.
Выраженность жалоб и симптомов ДСМН прогрессировали соответственно стадиям КАН.
Важно отметить значительное снижение скоростных параметров микроциркуляторного кровотока кистей рук по данным ВЧУДГ у больных КАН 2–3 по сравнению с другими участниками исследования (рис. 3).

Рис. 3. Скоростные параметры микроциркуляторного кровотока кожи у больных кардиоваскулярной автономной нейропатией.
Ответная положительная (патологическая) реакция микроциркуляторного кровотока на холодовой стимул встречалась чаще у больных c более тяжелой стадией КАН (рис. 4).
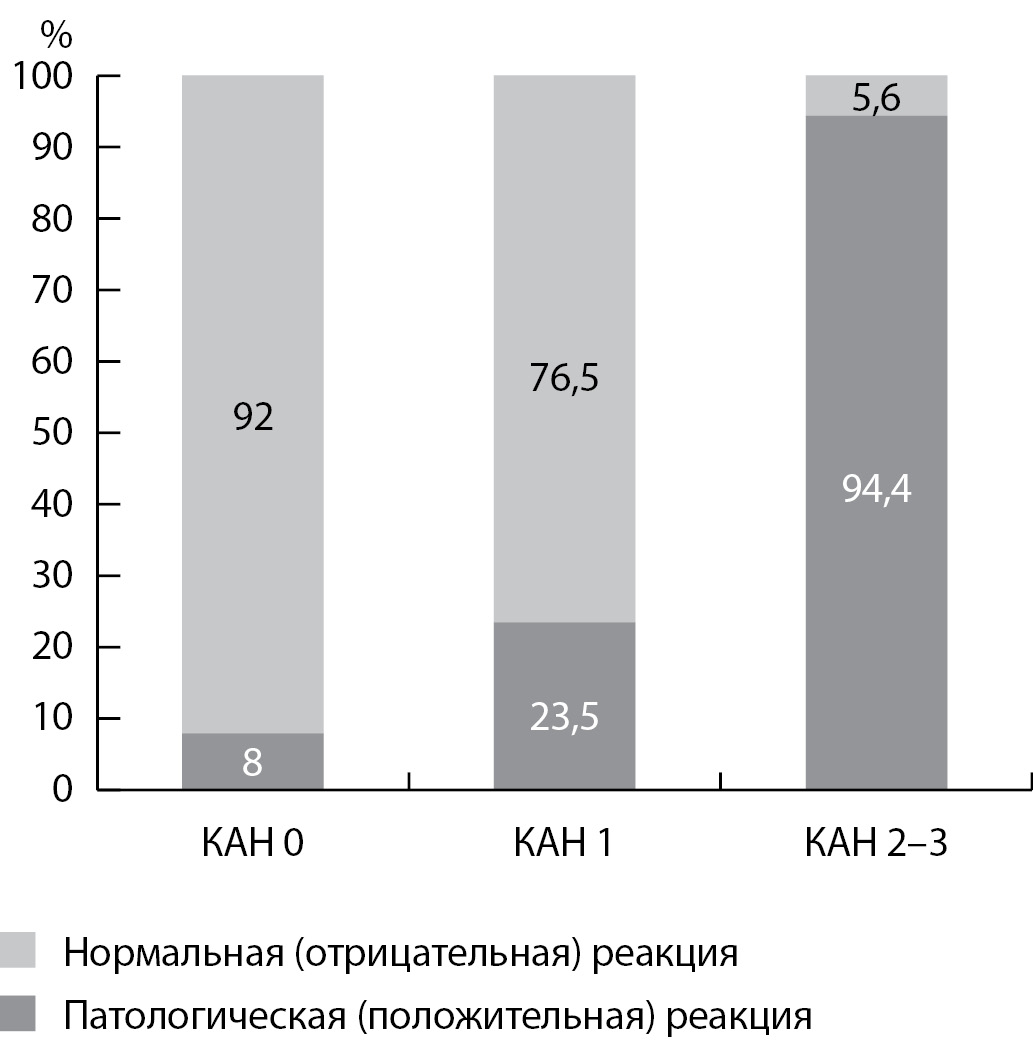
Рисунок 4. Ответная реакция микроциркуляторного кровотока кожи на холодовой стимул у больных кардиоваскулярной автономной нейропатией
После выполнения логистического регрессионного анализа, где КАН расценивалась как бинарная прогнозируемая переменная (КАН нет (подгруппа КАН 0) либо КАН есть (подгруппы КАН 1 и КАН 2–3)), были выделены следующие параметры, ассоциированные с КАН и являющиеся значимыми факторами риска: оперативные вмешательства на стопах в анамнезе, параметры микроциркуляторного кровотока по результатам ВЧУДГ, выраженность ДСМН по данным шкалы НДС, длительность СД, ИМТ и уровень гликированного гемоглобина (табл. 4). Так, оперативные вмешательства на стопах по поводу СДС в прошлом оказались сопряжены с возрастанием риска КАН в 18,6 раза, а снижение Vm ≤2,4 см/с — в 10,6 раза. Значение для прогноза КАН ответной положительной реакции на холодовой стимул не было статистически значимым, как и наличие ретинопатии, ишемической болезни сердца. В анализ не включена получаемая пациентами сахароснижающая и гиполипидемическая терапия, поскольку ее влияние оценивали через изменение метаболических параметров.
Затем были установлены факторы риска и их значимость для прогноза подтвержденных/тяжелых стадий КАН (табл. 5).
Таблица 4. Факторы риска кардиоваскулярной автономной нейропатии у больных сахарным диабетом 2 типа
Параметр | OШ | 95% ДИ | p-значение |
Операции на стопах в анамнезе | 18,6 | 3,2–37,2 | 0,0025 |
Vm ≤2,4 см/с | 10,4 | 2,2–18,9 | 0,0018 |
НДС >5,25 балла | 6,7 | 1,2–10,9 | 0,0046 |
Длительность СД2 >4 лет | 1,6 | 0,7–2,1 | 0,039 |
ИМТ ≤30, кг/м2 | 1,6 | 0,8–2,2 | 0,023 |
HbA1c >6,8% | 1,5 | 0,8–2,2 | 0,027 |
Ретинопатия | 3,6 | 0,9–5,6 | 0,11 |
ОСС | 2,1 | 0,9–4,8 | 0,16 |
Положительная реакция на холодовой стимул | 1,63 | 0,9–2,8 | 0,226 |
ИБС | 1,18 | 0,7–2,1 | 0,37 |
Таблица 5. Факторы риска подтвержденной/тяжелой кардиоваскулярной автономной нейропатии у больных сахарным диабетом 2 типа
OШ | 95% ДИ | p-значение | |
Положительная реакция на холодовой стимул | 28,6 | 9,6–75,8 | 0,0009 |
Vm ≤2,4 см/с | 6,4 | 1,9–12,7 | 0,0025 |
НДС ≥10 баллов | 4,1 | 1,2–7,1 | 0,0007 |
Оперативные вмешательства на стопах в анамнезе | 4,9 | 1,1–7,1 | 0,0009 |
Примечания: OШ — отношение шансов; ДИ — доверительный интервал; Vm — средняя за сердечный цикл скорость кровотока; НДС — шкала Нейропатического Дисфункционального Счета.
Этими параметрами оказались прежде всего характеристики микроциркуляторного кровотока, полученные в покое и при проведении холодовой пробы по данным ВЧУДГ. Так, пациенты с положительным результатом холодового теста имели в 28,6 раза выше риск подтвержденной/тяжелой стадии КАН по сравнению с больными с сохраненной реакцией (см. табл. 5).
Величина Vm ≤2,4 см/с показала высокую диагностическую ценность для прогноза подтвержденной/выраженной КАН с чувствительностью 82,4% и специфичностью 73,2%.
Далее мы оценили диагностическую ценность взятого отдельно холодового теста для выявления подтвержденной/тяжелой КАН, а также в сочетании с Vm по сравнению со стандартными КВТ. Положительный результат холодового теста оказался высокоинформативен для прогноза стадии КАН (чувствительность диагностического маркера 94,1%, специфичность 74,4%). Комбинация Vm и холодового теста продемонстрировала еще более высокую чувствительность (100%), однако специфичность оказалась ниже (63,4%) (табл. 6).
С целью оценки возможностей применения результатов холодового теста и Vm для диагностики подтвержденных/выраженных стадий КАН мы сравнили частоту выявления КАН у больных СД2 по результатам ВЧДГ и стандартных КВТ (табл. 7).
Таблица 6. Диагностическая ценность показателей микроциркуляторного кровотока (холодового теста и Vm) для прогноза подтвержденной/выраженной стадии кардиоваскулярной автономной нейропатии
Vm | Холодовой тест | Vm + Холодовой тест | |
Чувствительность, % | 82,4 | 94,1 | 100 |
Специфичность, % | 73,2 | 74,4 | 63,4 |
Таблица 7. Распространенность подтвержденной/выраженной кардиоваскулярной автономной нейропатии среди больных сахарным диабетом 2 типа по результатам холодового теста, Vm и кардиоваскулярных тестов
КВТ | Vm ≤2,4 см/с | Положительный холодовой тест | |
СД2 | 0 | 0 | 7,1% |
ДСМН | 15,4% | 19,2% | 26,9% |
СДС | 51,8% | 81,5% | 79,2% |
В группе больных СД2 без микрососудистых осложнений (24 человека) частота выявления подтвержденной/выраженной КАН по результатам холодового теста и величине Vm ≤2,4 см/с была 7,1% и 0,0% соответственно. Для пациентов с ДСМН частота выявления подтвержденной/выраженной КАН была выше, если использовался положительный холодовой тест, чем Vm ≤2,4 см/с. В группе больных с операциями на стопах в анамнезе распространенность подтвержденной/выраженной КАН оказалась одинаковой при применении как холодового теста, так и Vm ≤2,4 см/с. Во всех случаях выявляемость подтвержденной/выраженной патологии была статистически значимо выше по данным маркеров ВЧУДГ, чем стандартных КВТ.
Полученные результаты еще раз свидетельствуют о высокой чувствительности, однако невысокой специфичности обоих маркеров ВЧУДГ для прогноза подтвержденных/выраженных форм КАН. С другой стороны, эти результаты подтверждают гипотезу, что микроциркуляторные функциональные тесты позволяют выявлять патологические изменения раньше, чем другие методы диагностики [25, 26].
Нежелательные явления
Какие-либо нежелательные явления при проведении обследования пациентов отсутствовали.
ОБСУЖДЕНИЕ
Резюме основного результата исследования
Результаты оценки микроциркуляторного кровотока кожи кистей рук методом ВЧУДГ (Vm для кровотока в покое, а также ответ на функциональную холодовую пробу) позволили предсказать наличие подтвержденной/выраженной КАН как у больных с СД2 без микрососудистых осложнений, так и у пациентов с ДСМН и оперативными вмешательствами по поводу СДС в анамнезе. Положительный результат холодовой пробы (патологическая микрососудистая реактивность) увеличивал риск поздних форм КАН в 28,6 раза, а Vm, менее или равная 2,4 см/с — в 6,4 раза. Таким образом, показатели микроциркуляторного кровотока кожи кистей рук в покое (Vm), а также результат холодовой пробы, оцененные методом ВЧУДГ, являются потенциально новыми диагностическими критериями подтвержденной/тяжелой стадии КАН.
Обсуждение основного результата исследования
Выделение стадий (форм) КАН имеет принципиальное значение, поскольку ранние стадии КАН обратимы, а именно подтвержденные/выраженные ассоциированы с высоким риском сердечно-сосудистой смертности [6–8]. Актуальным остается расширение диагностических возможностей для выявления КАН и ее стадий с широким внедрением в повседневную врачебную практику [11–13].
Связь КАН с патологией микроциркуляторного русла широко обсуждается в современном научном мире, однако данные остаются противоречивыми [15–17]. Перспективным в этом плане является метод ВЧУДГ, который позволяет наглядно визуализировать микроциркуляторный кровоток, получить его объективные (в цифрах) скоростные параметры, а также провести ряд простых, легко воспроизводимых функциональных проб [18–20]. Хотя метод уже много лет применяется в различных отраслях медицины, в эндокринологии он стал использоваться относительно недавно. Первые исследования были проведены нами у больных с ДСМН [24]. Продемонстрирована высокая диагностическая ценность метода ВЧУДГ для мониторирования эффективности лечения больных СД с микрососудистыми осложнениями. В одной из последних работ показана связь ответов микроциркуляторного кровотока на функциональные пробы со стадиями КАН у пациентов с СДС по данным ВЧУДГ [14, 27].
Достоинством настоящего исследования является включение в него трех абсолютно разных групп пациентов. Отсутствие клинических проявлений и доступных инструментальных методов исследования делает КАН «темной лошадкой» для врача-клинициста. На помощь приходит ДСМН, выявление которой в повседневной врачебной практике в большинстве случаев не затруднительно, а многие многоцентровые, популяционные и клинические исследования демонстрируют связь КАН с ДСМН [6, 8, 24, 28, 29]. Таким образом, простой клинико-неврологический осмотр с диагностикой у больных ДСМН с высокой вероятностью, хотя и не во всех случаях, позволяет предположить наличие КАН (без разделения ее стадий).
Другой уникальной группой являются пациенты с нейропатической формой СДС, уже имеющие в связи с этим ампутации на уровне стоп. Во-первых, у всех таких больных есть ДСМН, а во-вторых, сам факт ампутации свидетельствует о таких тяжелых нарушениях микроциркуляции (при всех прочих равных условиях), которые не позволили язве зажить без оперативного лечения [16, 25, 28]. Известна низкая пятилетняя выживаемость больных СДС после ампутаций на уровне стоп (не учитывая высокие ампутации на уровне голени и бедра, где выживаемость еще ниже), не превышающая 50% [30]. Основная причина смерти — острая сердечно-сосудистая патология, однако это относится и к больным с нейропатической формой СДС, без распространенного атеросклероза [3, 8, 30]. В немногочисленных исследованиях показана связь ортостатической гипотензии (маркера тяжелой КАН) с пятилетней выживаемостью после высоких ампутаций [29].
С другой стороны, в большинстве работ продемонстрировано прогрессивное ухудшение микроциркуляторного кровотока у больных СД2, начиная с пациентов с предиабетом и впервые выявленным диабетом до пациентов с ампутациями по поводу СДС [15, 16, 25, 29, 31].
Таким образом, мы преднамеренно включали в исследование пациентов с СД2 без ДСМН (в эту же группу вошли и больные с впервые выявленным диабетом), пациентов с ДСМН и пациентов с ампутациями стоп в анамнезе, предполагая, основываясь на вышеизложенных рассуждениях, еще до проведения КВТ и оценки микроциркуляторного кровотока, что эти группы будут отличаться и встречаемостью, тяжестью КАН, и выраженностью микроциркуляторных расстройств.
Поэтому не удивительны различия между группами, полученные в ходе обследования в ряде биохимических и антропометрических показателей (к примеру, уровень гликированного гемоглобина и ИМТ). Хорошие показатели гликированного гемоглобина у пациентов с ДСМН и СДС, далекие от встречаемых обычно в рутинной практике, объясняются все тем же не случайным набором пациентов из поликлиник, медицинских центров и проч., а собственной базой больных, которые длительное время (месяцы, годы) находились под наблюдением и лечением. Не так просто, на первый взгляд, объяснить более низкий ИМТ у больных с СДС по сравнению с остальными участниками исследования. Все становится на свои места, если учесть, что эти больные перенесли в недавнем прошлом тяжелый и зачастую длительный гнойно-некротический процесс, тяжелое оперативное лечение и неоднократные госпитализации в хирургический стационар, что отнюдь не способствует прибавке массы тела.
Как мы и предполагали, у пациентов без ДСМН и других микрососудистых осложнений КАН встречалась относительно редко (8% случаев). Этих больных мы выделили в группу невысокого риска КАН. В этой группе КАН зарегистрирована только в ранней стадии, и микроциркуляторный кровоток кожи кистей рук, а также его реактивность оставались сохранными. Предикторами наличия КАН в группе низкого риска оказались такие клинические факторы, как длительность СД более 4 лет и показатели его компенсации (гликированный гемоглобин более 6,8%), что совпадает с результатами некоторых исследований [6, 12].
Наличие ДСМН и СДС в анамнезе назвать «факторами риска» можно только условно, такие пациенты сформировали группу высокого риска КАН, которая встречалась у них в 88,5 и 100% случаев соответственно. Именно в этой группе оценка микроциркуляторного кровотока методом ВЧУДГ позволила с высокой достоверностью разделить стадии КАН. Именно у этих пациентов снижение скоростных показателей микроциркуляторного кровотока (Vm) ≤2,4 см/с, а также патологическая (положительная) реакция на холодовой стимул свидетельствовали о наличии подтвержденных/выраженных стадий КАН.
Роль поражения микроциркуляторного русла в патогенезе ДСМН хорошо изучена. Еще в 1959 г. Fagerberg S.E. предложил сосудистую этиологию ДСМН, однако эта теория оказалась забыта до середины 1980-х гг., когда сниженный кровоток и эндоневральная гипоксия были выявлены как в экспериментальных моделях, так и на пациентах [28, 32]. В 1993 г. в своей ключевой работе Tesfaye S. и соавт. путем прямой микроскопии продемонстрировали значительные патологические изменения в анатомии эпиневральных артерий и венул, которые заключались в открытии артериовенозных шунтов у больных ДСМН. Авторы одними из первых показали, как на фоне общего увеличения кровенаполнения и венозного застоя у больных ДСМН страдает тканевая перфузия и прогрессирует тканевая гипоксия [28].
В течение последних десятилетий накапливались знания относительно нарушений микроциркуляторного русла при СД, в целом сформировались представления о роли микроангиопатии в поражении тонких и толстых нервных волокон при ДСМН [15, 16, 25, 26, 27]. Этому способствовало и широкое внедрение в клиническую практику инструментальных неинвазивных методов оценки микроциркуляции, таких как лазерная допплеровская флоуметрия и ВЧУДГ [18, 26].
Кожа остается излюбленной моделью исследователей для изучения микроциркуляции у больных СД [15, 16]. При этом кровоток оценивают как на нижних, так и на верхних конечностях, поскольку микроциркуляция поражается системно, однако патологические изменения кожи нижних конечностей опережают верхние [33]. Показано, что у больных с предиабетом и СД без ДСМН микроциркуляторный кровоток может быть сохранен, вместе с тем наблюдаются функциональные нарушения, такие как недостаточная ответная реакция на кратковременную окклюзию (манжеточная проба) [22, 25, 31]. У пациентов с ДСМН базальный микроциркуляторный кровоток уже снижен, снижена также ответная реакция на локальную гипертермию (нагревание кожи до 39–44 °С). Недостаточная реакция на тепловую пробу в настоящее время рассматривается как маркер поражения тонких немиелинизированных С-волокон, более надежный, чем «классические» методы диагностики, свидетельствующий также о нарушении процессов заживления, поскольку кровоток не может достигнуть своего максимума в ответ на стресс (высокая температура или повреждение) [15, 26, 29]. У пациентов с СДС базальный кровоток снижен значительно, зачастую наблюдается «десимпатизация» микроциркуляторного русла, проявляющаяся в открытии артериовенозных шунтов, сбросе крови, минуя капилляры, тяжелой тканевой гипоксии. В ряде исследований показано, что нарушение симпатической регуляции является надежным предиктором ампутаций у больных СДС [16, 28, 29].
Как известно, микроциркуляторный кровоток кожи контролируется симпатическими адренергическими вазоконстрикторными нервными волокнами и симпатическими вазодилататорными нервами путем открытия и закрытия артериовенозных анастомозов и прекапиллярных артериол [15, 16]. В нормальных условиях при нормальной температуре тонус микроциркуляторного русла обеспечивается только вазоконстрикторной системой, артериовенозные анастомозы закрыты. Поражение симпатической регуляции вследствие диабетической автономной нейропатии приводит к открытию шунтов и сбросу кровотока, минуя капилляры [15, 16, 29]. Особенно богата артериовенозными шунтами гладкая «безволосая» кожа кистей рук, чем она отличается от кожи предплечий, покрытой волосами [15, 33].
Симпатические вазоконстрикторные нервные волокна обеспечивают также местный вено-артериолярный аксон-рефлекс, активирующийся в ответ на гравитационный стресс. В норме при смене положения тела (из позиции лежа в положение стоя) увеличивается кровяное давление внутри капилляров и венул стоп, однако отека не наблюдается, поскольку нервные импульсы от вен передаются антидромно по постганглионарным симпатическим судомоторным аксонам, а затем ортодромно к артериолам, вызывая вазоконстрикцию прекапиллярных сфинктеров [16]. Таким образом, ортостатическая гипотензия у больных диабетической КАН во многом объясняется нарушением местного симпатического вено-артериолярного аксон-рефлекса.
Казалось бы, у больных СД с КАН нарушения микроциркуляции должны быть наиболее выражены, однако в ряде клинических исследований такая связь не была продемонстрирована [17, 30]. С другой стороны, ортостатическая гипотензия является прогностическим фактором летального исхода в ближайшие пять лет у больных с СДС после ампутаций [32]. По-видимому, отсутствие связи КАН с патологией микроциркуляторного русла свидетельствует о недостаточной эффективности традиционно используемых критериев и методов диагностики КАН и еще раз подчеркивает необходимость разработки и внедрения в клиническую практику новых технологий [11, 13, 14].
В нашем исследовании мы изучали у больных СД кровоток кожи кистей рук, которая, как указывалось выше, богата артериовенулярными анастомозами. Метод ВЧУДГ позволил наглядно визуализировать микроциркуляторный кровоток, дифференцировать его от кровотока по артериовенулярным шунтам, последний отличался скоростными, акустическими и спектральными характеристиками. Оказалось, что базальные параметры микроциркуляторного кровотока, а также его реактивность в ответ на холодовую пробу были сохранены у больных СД2 без КАН. Снижение скорости кровотока (Vm ≤2,4 см/с) в 10,4 раза увеличивало риск наличия КАН у больных CД2. По-видимому, нарушение иннервации микроциркуляторного русла вследствие автономной нейропатии вызывает, наряду с другими многочисленными причинами микроангиопатии при СД, снижение кровотока по капиллярам, а микроангиопатия, в свою очередь, способствует повреждению нервных волокон. Вместе с тем на начальных стадиях КАН реакция кровотока на холодовой стимул оставалась сохранной. Нарушение симпатической вазоконстрикции (о чем свидетельствовал положительный результат пробы) наблюдалось при подтвержденных/тяжелых формах КАН (увеличивало риск КАН в 28,6 раза) и, очевидно, способствовало симптоматической/бессимптомной ортостатической гипотензии у этих больных. Оба показателя (Vm и холодовая проба) с высокой чувствительностью и специфичностью предсказывали наличие подтвержденной/выраженной стадии в группе высокого риска КАН.
Ограничения исследования
Настоящая работа выполнена на небольшой когорте пациентов без длительного периода наблюдения. Проспективные исследования с большим числом наблюдений позволили бы подтвердить возможности метода ВЧУДГ для прогноза стадий КАН у больных СД.
Наше исследование не объясняет механизмы, лежащие в основе полученных результатов. Кроме того, существует множество параметров для оценки микроциркуляторного кровотока методом ВЧУДГ как в покое, так и в ходе проведения функциональных проб. Для ограничения количества исследуемых параметров и упрощения интерпретации результатов исследования мы оценивали только Vm для микроциркуляторного кровотока в покое, а результат холодового теста рассматривали как качественный параметр (положительный либо отрицательный ответ на пробу).
ЗАКЛЮЧЕНИЕ
КАН — распространенное осложнение СД, ассоциированное с развитием сердечно-сосудистой патологии и сердечно-сосудистой смертностью у этой категории больных. Однако факторы, определяющие развитие, прогрессирование либо регресс КАН, до конца не изучены. В ходе исследования выделены группы низкого риска КАН. Это пациенты с СД2, впервые выявленным, и/или без микрососудистых осложнений, у которых КАН встречалась не более чем в 10% случаев и только на начальных стадиях. В группу высокого риска вошли больные с ДСМН более 5,25 балла по шкале НДС и все пациенты с ампутациями стоп по поводу СДС в анамнезе.
Оценка микроциркуляторного кровотока кистей рук в покое (Vm), а также в ответ на холодовую пробу позволили разделить стадии заболевания и с высокой чувствительностью (100%) и специфичностью (74,4% для холодового теста) предсказать наличие подтвержденной/выраженной КАН в группе высокого риска.
Таким образом, параметры микроциркуляторного кровотока кистей рук, оцененные методом ВЧУДГ, являются потенциально новыми диагностическими критериями КАН у больных СД2.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: распространенность, заболеваемость, смертность, параметры углеводного обмена и структура сахароснижающей терапии по данным Федерального регистра сахарного диабета, статус 2017 г. // Сахарный диабет. — 2018. — Т. 21. — No3. — С. 144-159. https://doi.org/10.14341/DM9686
2. American Diabetes Association. Introduction: Standards of Medical Care in Diabetes—2018. Diabetes Care. 2018;41(Supplement 1):S1-S2. https://doi.org/10.2337/dc18-Sint01
3. Rawshani A, Rawshani A, Franzén S, et al. Mortality and Cardiovascular Disease in Type 1 and Type 2 Diabetes. N Engl J Med. 2017;376(15):1407-1418. https://doi.org/10.1056/NEJMoa1608664
4. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом: Клинические рекомендации (Вып. 9) // Сахарный диабет. — 2019. — Т. 22. — NoS1. — С.1-144. https://doi.org/10.14341/DM221S1.
5. Spallone V, Ziegler D, Freeman R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab Res Rev. 2011;27(7):639-653. https://doi.org/10.1002/dmrr.1239
6. Tesfaye S, Boulton AJM, Dyck PJ, et al. Diabetic Neuropathies: Update on Definitions, Diagnostic Criteria, Estimation of Severity, and Treatments. Diabetes Care. 2010;33(10):2285-2293. https://doi.org/10.2337/dc10-1303
7. Kempler P, Tesfaye S, Chaturvedi N, et al. Autonomic neuropathy is associated with increased cardiovascular risk factors: the EURODIAB IDDM Complications Study. Diabet Med. 2002;19(11):900-909. https://doi.org/10.1046/j.1464-5491.2002.00821.x
8. Vinik AI, Maser RE, Mitchell BD, Freeman R. Diabetic Autonomic Neuropathy. Diabetes Care. 2003;26(5):1553-1579. https://doi.org/10.2337/diacare.26.5.1553
9. Ewing DJ, Clarke BF. Diagnosis and management of diabetic autonomic neuropathy. Br Med J. 1982;285(6346):916-918. https://doi.org/10.1136/bmj.285.6346.916
10. Ewing DJ, Martyn CN, Young RJ, Clarke BF. The Value of Cardiovascular Autonomic Function Tests: 10 Years Experience in Diabetes. Diabetes Care. 1985;8(5):491-498. https://doi.org/10.2337/diacare.8.5.491
11. Lin K, Wei L, Huang Z, Zeng Q. Combination of Ewing test, heart rate variability, and heart rate turbulence analysis for early diagnosis of diabetic cardiac autonomic neuropathy. Medicine (Baltimore). 2017;96(45):e8296. https://doi.org/10.1097/MD.0000000000008296
12. Binns-Hall O, Selvarajah D, Sanger D, et al. One-stop microvascular screening service: an effective model for the early detection of diabetic peripheral neuropathy and the high-risk foot. Diabet Med. 2018;35(7):887-894. https://doi.org/10.1111/dme.13630
13. He T, Wang C, Zuo A, et al. Electrochemical Skin Conductance May Be Used to Screen for Diabetic Cardiac Autonomic Neuropathy in a Chinese Population with Diabetes. J Diabetes Res. 2017;2017:1-6. https://doi.org/10.1155/2017/8289740
14. Zelenina T, Salukhov V, Volkova E, et al. High-Frequency Ultrasonic Dopplerography May be used to Screen for Diabetic Cardiac Autonomic Neuropathy. Int J Endocrinol Metab Disord. 2019;5(2). https://doi.org/10.16966/2380-548X.160
15. Stirban A. Microvascular Dysfunction in the Context of Diabetic Neuropathy. Curr Diab Rep. 2014;14(11):541. https://doi.org/10.1007/s11892-014-0541-x
16. Chao CYL, Cheing GLY. Microvascular dysfunction in diabetic foot disease and ulceration. Diabetes Metab Res Rev. 2009;25(7):604-614. https://doi.org/10.1002/dmrr.1004
17. Eleftheriadou I, Tentolouris A, Grigoropoulou P, et al. The association of diabetic microvascular and macrovascular disease with cutaneous circulation in patients with type 2 diabetes mellitus. J Diabetes Complications. 2019;33(2):165-170. https://doi.org/10.1016/j.jdiacomp.2018.10.008
18. Lenasi H, Potočnik N, Petrishchev N, et al. The measurement of cutaneous blood flow in healthy volunteers subjected to physical exercise with ultrasound Doppler imaging and laser Doppler flowmetry. Clin Hemorheol Microcirc. 2017;65(4):373-381. https://doi.org/10.3233/CH-16204
19. Lee C-H, Kim E, Kim D. Detection of atrial fibrillation during pulpal blood flow assessment using Doppler ultrasound: a case report. Dentomaxillofacial Radiol. 2018;47(5):20170354. https://doi.org/10.1259/dmfr.20170354
20. Симаненкова А.В., Макарова М.Н., Васина Л.В., и др. Допплерография микроциркуляторного русла как способ оценки эндотелийпротективных свойств лекарственных препаратов у больных сахарным диабетом2 // Регионарное кровообращение и микроциркуляция. — 2018. — Т. 17. — No3. — С.120-128. https://doi.org/10.24884/1682-6655-2018-17-3-120-128
21. Mamontov OV, Babayan L, Amelin AV, et al. Autonomous control of cardiovascular reactivity in patients with episodic and chronic forms of migraine. J Headache Pain. 2016;17(1):52. https://doi.org/10.1186/s10194-016-0645-6
22. Charkoudian N. Mechanisms and modifiers of reflex induced cutaneous vasodilation and vasoconstriction in humans. J Appl Physiol. 2010;109(4):1221-1228. https://doi.org/10.1152/japplphysiol.00298.2010
23. Петрищев Н.Н., Власов Т.Д. Дисфункция эндотелия. Причины, механизмы, фармакологическая коррекция. — Издательство СПбГМУ; 2003.
24. Valk GD, de Sonnaville JJJ, van Houtum WH, et al. The assessment of diabetic polyneuropathy in daily clinical practice: Reproducibility and validity of Semmes Weinstein monofilaments examination and clinical neurological examination. Muscle Nerve. 1997;20(1):116-118. https://doi.org/10.1002/(SICI)1097-4598(199701)20:1<116::AID-MUS19>3.0.CO;2-2
25. Lanting SM, Barwick AL, Twigg SM, et al. Post-occlusive reactive hyperaemia of skin microvasculature and foot complications in type 2 diabetes. J Diabetes Complications. 2017;31(8):1305-1310. https://doi.org/10.1016/j.jdiacomp.2017.05.005
26. Fuchs D, Dupon PP, Schaap LA, Draijer R. The association between diabetes and dermal microvascular dysfunction non-invasively assessed by laser Doppler with local thermal hyperemia: a systematic review with meta-analysis. Cardiovasc Diabetol. 2017;16(1):11. https://doi.org/10.1186/s12933-016-0487-1
27. Зеленина Т.А., Белеванцева Н.Р., Земляной А.Б., и др. Метод высокочастотной ультразвуковой допплерографии для оценки результатов терапии поздних осложнений сахарного диабета // Регионарное кровообращение и микроциркуляция. — 2014. — Т. 13. — No3. — С. 38-44. https://doi.org/10.24884/1682-6655-2014-13-3-38-44
28. Tesfaye S, Harris N, Jakubowski JJ, et al. Impaired blood flow and arterio-venous shunting in human diabetic neuropathy: a novel technique of nerve photography and fluorescein angiography. Diabetologia. 1993;36(12):1266-1274. https://doi.org/10.1007/BF00400804
29. Schreuder SM, Nieuwdorp M, Koelemay MJW, et al. Testing the sympathetic nervous system of the foot has a high predictive value for early amputation in patients with diabetes with a neuroischemic ulcer. BMJ Open Diabetes Res Care. 2018;6(1):e000592. https://doi.org/10.1136/bmjdrc-2018-000592
30. Wukich DK, Armstrong DG, Attinger CE, et al. Inpatient Management of Diabetic Foot Disorders: A Clinical Guide. Diabetes Care. 2013;36(9):2862-2871. https://doi.org/10.2337/dc12-2712
31. De Boer MP, Meijer RI, Wijnstok NJ, et al. Microvascular Dysfunction: A Potential Mechanism in the Pathogenesis of Obesity-associated Insulin Resistance and Hypertension. Microcirculation. 2012;19(1):5-18. https://doi.org/10.1111/j.1549-8719.2011.00130.x
32. Fagerberg SE. Diabetic neuropathy: a clinical and histologic study on the significance of vascular affection. Acta Med Scan. 1959;(S. 345):1-80.
33. Tomešová J, Gruberova J, Lacigova S, et al. Differences in Skin Microcirculation on the Upper and Lower Extremities in Patients with Diabetes Mellitus: Relationship of Diabetic Neuropathy and Skin Microcirculation. Diabetes Technol Ther. 2013;15(11):968-975. https://doi.org/10.1089/dia.2013.0083
Об авторах
Т. А. ЗеленинаРоссия
Зеленина Татьяна Александровна, к.м.н.; eLibrary SPIN: 2382-8579
194044, Санкт-Петербург, ул. Боткинская, д. 21
В. В. Салухов
Россия
Салухов Владимир Владимирович, д.м.н., профессор; eLibrary SPIN: 4531-6011
Санкт-Петербург
А. Б. Земляной
Россия
Земляной Александр Борисович, д.м.н., профессор; eLibrary SPIN: 8820-0367
Москва
С. Г. Железняк
Россия
Железняк Сергей Григорьевич, к.м.н.
Санкт-Петербург
О. А. Клиценко
Россия
Ольга Анатольевна Клиценко, к.б.н.; eLibrary SPIN: 7354-3080
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Зеленина Т.А., Салухов В.В., Земляной А.Б., Железняк С.Г., Клиценко О.А. Нарушение микроциркуляторного кровотока у больных сахарным диабетом 2 типа и кардиоваскулярной автономной нейропатией. Сахарный диабет. 2021;24(1):32-44. https://doi.org/10.14341/DM12372
For citation:
Zelenina T.A., Salukhov V.V., Zemlianoi A.B., Zheleznjak S.G., Klitsenko O.A. Impairment of microvascular blood flow in patients with type 2 diabetes and cardiovascular autonomic neuropathy. Diabetes mellitus. 2021;24(1):32-44. (In Russ.) https://doi.org/10.14341/DM12372

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































