Перейти к:
Обзор систем поддержки принятия врачебных решений для диагностики диабетической ретинопатии
https://doi.org/10.14341/DM13354
Аннотация
Диабетическая ретинопатия (ДР) является одним из наиболее распространённых и опасных осложнений сахарного диабета, часто приводящим к слепоте. Учитывая высокую распространённость заболевания и ограниченные ресурсы офтальмологической службы, особую актуальность приобретает внедрение автоматизированных систем для раннего выявления и мониторинга ДР. Настоящий обзор посвящен анализу современных решений в области применения методов компьютерного зрения и искусственного интеллекта (ИИ) для диагностики ДР. Проведён систематический поиск с последующим анализом 31 работы, описывающих различные подходы, включая использование сверточных нейронных сетей, методов сегментации патологий глазного дна, гибридных алгоритмов и мобильных приложений для скрининга. Обсуждаются ключевые характеристики, архитектуры, чувствительность и специфичность предложенных моделей, а также применяемые датасеты. Особое внимание уделено внедрённым в клиническую практику решениям, таким как IDx-DR и EyeArt, одобренным регулирующими органами. Подчеркивается значимость интерпретируемости моделей, разнообразия обучающих данных и стандартизации изображений как критически важных факторов для повышения обобщающей способности и доверия к ИИ-системам в офтальмологии. Отличительной особенностью данной работы является всесторонний охват как международных, так и отечественных разработок, включая оценку перспектив их интеграции в систему здравоохранения России. Обзор подводит к выводу о зрелости ряда технологий, пригодных для клинического применения, при этом подчёркивая необходимость дальнейших исследований, направленных на повышение точности, устойчивости и прозрачности алгоритмов диагностики.
Ключевые слова
Для цитирования:
Першина-Милютина А.П., Козлов Е.В., Лысухин Д.Д., Аредов А.В., Ковалева Е.В., Мокрышева Н.Г. Обзор систем поддержки принятия врачебных решений для диагностики диабетической ретинопатии. Сахарный диабет. 2025;28(5):460-470. https://doi.org/10.14341/DM13354
For citation:
Pershina-Miliutina A.P., Kozlov E.V., Lysukhin D.D., Aredov A.V., Kovaleva E.V., Mokrysheva N.G. Review of medical decision support systems for the diagnosis of diabetic retinopathy. Diabetes mellitus. 2025;28(5):460-470. (In Russ.) https://doi.org/10.14341/DM13354
ВВЕДЕНИЕ
Сахарный диабет (СД) является самой частой эндокринопатией и признан глобальной социально значимой неинфекционной эпидемией с неуклонными темпами роста распространенности, находящейся под контролем Организации Объединенных Наций и национальных систем здравоохранения во всем мире. В Российской Федерации (РФ) так же, как и в других странах мира, продолжается рост распространенности СД — с 2000 г. численность пациентов с СД увеличилась более чем в 2 раза. По последним официальным данным, количество пациентов с СД в РФ на период окончания 2024 г. составило свыше 5 млн человек. При этом среди осложнений СД диабетическая ретинопатия (ДР) занимает одно из ведущих мест и выявляется у 28,9 и 12,3% пациентов с СД 1 и 2 типов соответственно [1]. Данная патология, по заключению Всемирной организации здравоохранения (ВОЗ), входит в первую пятерку причин слабовидения и слепоты у пациентов. Общая заболеваемость ДР по состоянию на 01.01.2023 г. в РФ составляет 706 407 человек. Согласно официальным данным федеральной статистической отчетности, в России ежегодно более 5 тыс. пациентов получают инвалидность вследствие заболеваний сетчатки. При этом ДР является одним из наиболее распространенных заболеваний сетчатки, приводящим к инвалидности, на которое приходится до 8% среди всей структуры инвалидности по зрению. Принципиально важное значение для предотвращения прогрессирования ДР и утраты зрения занимает скрининг — ежегодные осмотры всех пациентов с СД для своевременной идентификации лиц с риском развития тяжелой ДР [3][4]. Таким образом, на врача-офтальмолога ложится значительная нагрузка по скринингу пациентов с СД для оценки состояния глазного дна. Большая протяженность РФ, необходимость унифицировать диагностику ДР и мониторинга заболевания требуют обратить внимание на внедрение программ профилактики слепоты на региональных уровнях путем организации новой модели оказания медицинской помощи, позволяющей решить проблему слепоты и инвалидности вследствие ДР за счет организации проведения раннего цифрового скрининга заболевания. В связи с этим актуальной задачей является автоматизация данного диагностического процесса. Алгоритмы искусственных нейронных сетей, лежащие в основе современных методов компьютерного зрения, все шире применяются для анализа медицинских изображений. Одним из перспективных применений этих технологий является автоматизированный скрининг ДР, позволяющий снизить нагрузку на врачей-офтальмологов и повысить доступность диагностики. В этом контексте особую роль начинают играть системы поддержки принятия врачебных решений (СППВР, Clinical decision support system).
СППВР — это программное обеспечение, предназначенное для сбора и анализа медицинской информации с целью оказания помощи врачам в принятии клинических решений: обследовании пациента, диагностики, назначении лечения с целью снижения количества ошибок и повышения качества оказываемой медицинской помощи. В частности, среди СППВР выделяют тип, известный как интеллектуальные СППВР (иСППВР), которые имитируют или моделируют рассуждения врача. Модели для таких систем могут быть основаны на методах многомерной математической статистики или машинного обучения. Однако такие системы обычно слабо интерпретируются со стороны пользователя. В то же время существует другой вид иСППВР — системы, построенные с применением методов математической логики, которые, в отличие от предыдущих, обладают хорошей интерпретируемостью [5].
Целью данной статьи является поиск разработанных (или разрабатываемых) СППВР для диагностики ДР.
СИСТЕМАТИЧЕСКИЙ ОБЗОР СУЩЕСТВУЮЩИХ СИСТЕМ ДЛЯ ПОМОЩИ В ДИАГНОСТИКЕ ДИАБЕТИЧЕСКОЙ РЕТИНОПАТИИ НА ОСНОВЕ ИСКУССТВЕННОГО ИНТЕЛЛЕКТА
Проведен поиск публикаций по разработанным моделям анализа изображений глазного дна с целью диагностики/выявления ДР. Поиск выполнялся 18.04.2024 г. в Medline (https://pubmed.ncbi.nlm.nih.gov/) и eLibrary (https://elibrary.ru/defaultx.asp?) (рис. 1).
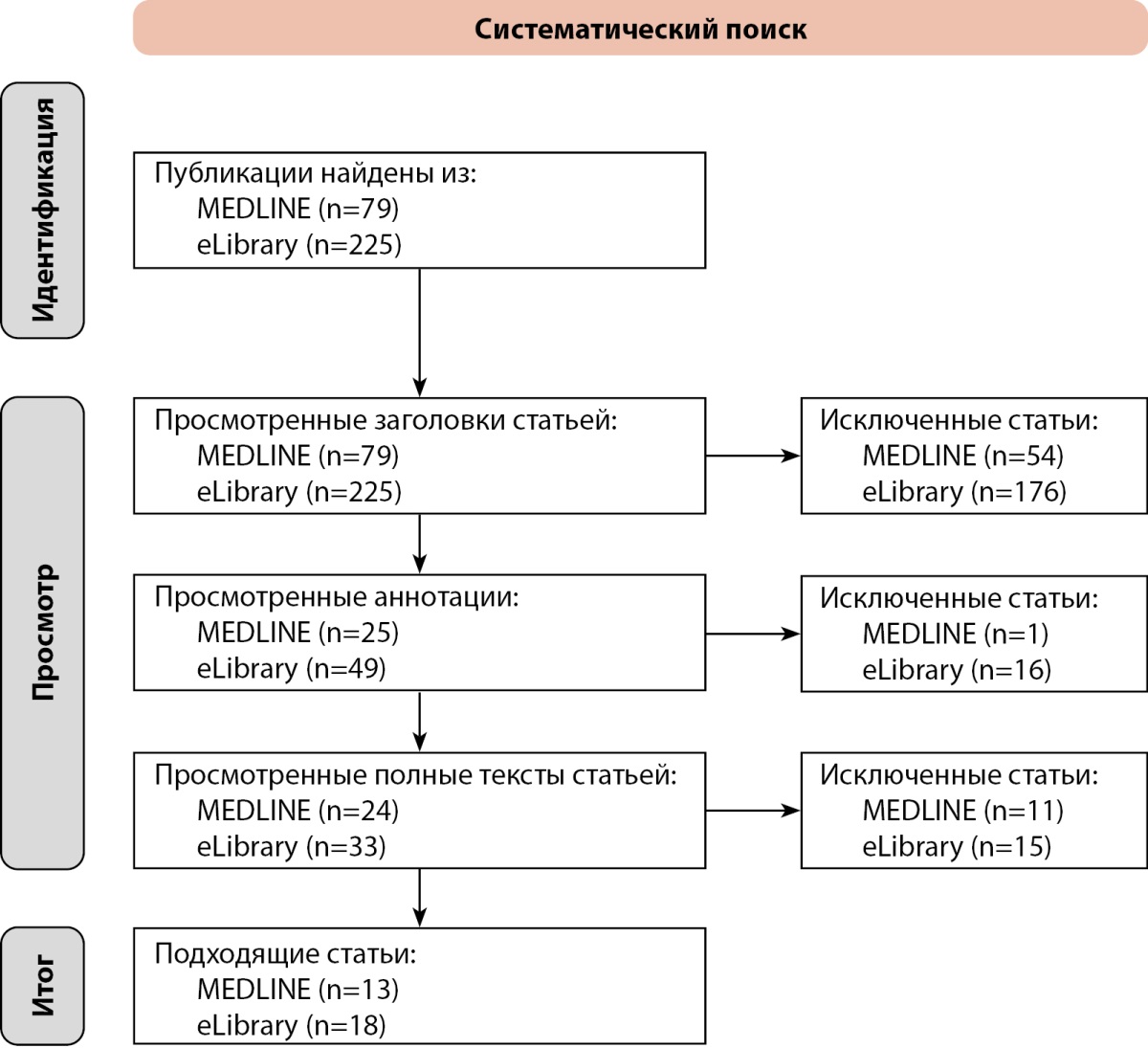
Рисунок 1. Потоковая диаграмма, отражающая систематический поиск научных публикаций по разработанным моделям анализа изображений глазного дна с целью диагностики/выявления диабетической ретинопатии.
Поисковой запрос в Medline включал фильтры: Free full text, Classical Article, Clinical Trial, Meta-Analysis, Randomized Controlled Trial, Review, Systematic Review, in the last 5 years, English, Russian; и был следующим: “((artificial intelligence) or (computer vision) or (expert system) or (clinical decision support system)) and (diabetic retinopathy) and (diagnostics)”. В базе данных Medline найдено 79 публикаций. В результате следующего поискового запроса в eLibrary: «((искусственный интеллект) или (компьютерное зрение) или (экспертная система) или (система поддержки принятия ((врачебных) или (клинических)) решений)) и (диабетическая ретинопатия) и (диагностика)», включающего фильтры: «текст полностью», «статьи», «за последние 5 лет (2019–2024)», «бесплатный полный текст», «искать с учетом морфологии», «2019–2024 г.г.», было выделено 225 публикаций. После первичной фильтрации для анализа была оставлена суммарно 31 статья, их основные характеристики представлены в табл. 1.
Таблица 1. Итоговая сводка систем диагностики диабетической ретинопатии
|
№ |
Название системы или автор (в случае отсутствия названия) |
Страна |
Год |
Используемый набор данных |
Чувствительность |
Специфичность |
Точность |
|
1 |
RetmarkerDR |
Португалия |
2011 |
348 |
73% |
||
|
2 |
DrishtiCare |
Индия |
2011 |
450 |
|||
|
3 |
IRIS |
США |
2016 |
15 015 пациентов, 30 030 глаз |
66,40% |
72,80% |
|
|
4 |
Google Inc, Gulshan et al. |
США, Индия |
2016 |
EyePACS-1 (9963 снимков) и Messidor-2 (1748 снимков) |
|||
|
5 |
Ji Y, Chen N, Liu S, Yan Z, Qian H, Zhu S, Zhang J, Wang M, Jiang Q, Yang W. |
Япония |
2017 |
9939 снимков |
96,00% |
||
|
6 |
SERI-NUS |
Сингапур |
2017 |
91,6% |
91,1% |
||
|
7 |
IDx-DR |
США |
2018 |
235 снимков |
82,24% |
85,47% |
|
|
8 |
Google Deep Mind |
США |
2018 |
9963 снимков и 1748 снимков |
90,3% и 87,0% |
98,1% и 98,5% |
96,60% |
|
9 |
Emil Saeed, Maciej Szymkowski, Khalid Saeed, Zofia Mariak |
Польша |
2019 |
- |
98,00% |
||
|
10 |
Wang Xin, Ju Lie, Zhao Xin et al. |
Австралия и Китай |
2019 |
- |
|||
|
11 |
Playout C., Duval R., & Cheriet F. |
Канада |
2019 |
- |
Только ROC кривая |
||
|
12 |
Phelcom Eyer |
Бразилия |
2019 |
10 569 снимков |
80,00% |
||
|
13 |
Eynuk Eyeart |
США |
2019 |
- |
94,90% |
86,70% |
|
|
14 |
DrishtiCare |
Индия |
2020 |
- |
|||
|
15 |
DART |
Чили |
2021 |
1123 глаза |
94,60% |
74,30% |
|
|
16 |
Ocular CellScope |
США |
2021 |
121 глаз |
100,00% |
80,00% |
|
|
17 |
DeepDR |
Китай |
2021 |
666 383 |
- |
||
|
18 |
Распознавание диабетической ретинопатии |
Россия |
2021 |
12 498 снимков |
89,30% |
92,10% |
91,10% |
|
19 |
Система распознавания дефектов сетчатки глаза |
Россия |
2021 |
35 126 снимков |
|||
|
20 |
Прототип сервиса для диагностики диабетической ретинопатии |
Россия |
2021 |
датасет Messidor (1200 глаз) |
85,00% |
||
|
21 |
Алгоритм сегментации визуальных признаков диабетической ретинопатии |
Россия |
2021 |
1510 снимков |
|||
|
22 |
RAIDS |
Китай |
2022 |
666 383 изображения, для 14 901 снимка была выполнена сегментация |
90,60% |
90,30% |
|
|
23 |
Нейросетевой классификатор для определения диабетической ретинопатии |
Беларусь |
2023 |
120 002 снимка |
97,14% |
||
|
24 |
Математическая модель для диагностики патологии сетчатки |
Россия |
2023 |
75 240 снимков |
89,70% |
||
|
25 |
Mahmood M.A.I., Aktar N., & Kader M.F. |
Бангладеш |
2023 |
- |
96.83% |
||
|
26 |
Remidio Non-Mydriatic Fundus |
Индия |
2024 |
- |
100,00% |
89,55% |
Самым ранним из выявленных исследований в области разработки интеллектуальных систем для диагностики ДР является программа DrishtiCare, разработанная Joshi G.D. и соавт. в 2011 г. Платформа принимает изображения, полученные с помощью фундус-камеры специалистом, и клиническую информацию через пользовательский интерфейс для сбора сведений и обрабатывает их с анализом качества в режиме реального времени. Анализ выполняется на основе сочетания нейросетевого и алгоритмического подходов. Построенная модель обнаруживает микроаневризмы, экссудаты и кровоизлияния. С помощью модели проводится предварительный скрининг. Система отбирает отклоняющиеся от нормы результаты и отправляет их специалисту. Таким образом происходит дополнительный предварительный процессинг изображений с выявлением аномалий сетчатки. В дополнение к основным функциям для повышения удобства работы врача-офтальмолога была добавлена возможность предобработки снимка путем корректировки яркости и контрастности. Данная система использует автоматизированный контроль качества изображений, скрининг и выявление участков поражений сетчатки [6][7].
В том же году Ribeiro M.L. и соавт. начали исследование по внедрению автоматической системы наблюдения за пациентами с ДР. Изначально система RetmarkerDR решала задачу бинарной классификации снимков глазного дна пациентов на категории «Есть заболевание» и «Нет заболевания», со временем ее функционал был расширен до возможности сравнения состояний глазного дна пациента в динамике. Для этого система определяет частоту появления новых и заживления старых микроаневризм. Для обучения использовался набор данных, включающий одно изображение только одного глаза каждого из 348 пациентов. Чувствительность системы составила для любой стадии ДР 73%, для ДР, требующей лечения (лазеркоагуляции или анти-vegf терапии), — 85%, для пролиферативной ДР — 97,9% [8][9][10].
В 2013 г. Tufail A и соавт. сравнили 3 системы для диагностики ДР: iGradingM, Retmarker и EyeArt. По результатам анализа авторы пришли к выводу, что системы Retmarker и EyeArt продемонстрировали приемлемую чувствительность (94,2%–95,2%) для любой стадии ретинопатии, и что данные системы могут стать экономически эффективным дополнением к «ручной» человеческой оценке стадии ДР [11].
В 2015 г. в США Walton В. и соавт. создали интеллектуальную систему визуализации IRIS (Intelligent Retinal Imaging Systems), для разработки которой использовали данные около 15 000 пациентов. В системе использовалась нейронная сеть с бинарным откликом: «требующий осмотра» или «не требующий осмотра», результаты которой сравнивали с оценками, выполненными в государственной системе здравоохранения округа Харрис штата Техас (Harris Health System), при этом чувствительность модели составила 66,4%, специфичность — 72,8% [7][12][13][14].
В крупномасштабном исследовании 2016 г., проведенном компанией Google Inc. совместно с Gulshan V. и соавт., решалась задача детектирования на изображениях с фундус-камеры ДР умеренной и более тяжелой стадии, а также макулярного отека. Для исследования в качестве тестировочных были использованы два общедоступных набора данных EyePACS-1 (9963 изображений) и Messidor-2 (1748), а также отдельный внутренний набор снимков для обучения (128 175), полученный из трех медицинских учреждений в Индии. Важной особенностью данного исследования стало привлечение 54 специалистов-офтальмологов для перекрестной разметки изображений с оценкой «надежности» каждого эксперта. Для каждого специалиста оценивался показатель, учитывающий консистентность ответов как по отношению к ответам других специалистов, так и по отношению к собственным ответам, данным ранее. В качестве архитектуры искусственной нейронной сети авторы использовали InceptionV3. Модель была обучена одновременно для нескольких бинарных откликов: “moderate or worse diabetic retinopathy (mild, moderate, severe, or proliferative)” (ДР умеренной степени), “severe or worse diabetic retinopathy” (ДР тяжелой степени), “referable diabetic macular edema” (макулярный диабетический отек, требующий направления к специалисту), “fully gradable” (пригодное изображение для оценки стадии ДР) [15][16]. Для оценки качества модели авторы использовали площадь под ROC-кривой, которая для набора данных EyePACS-1 составила 99,1%, для Messidor-2 — 99,0% [17][18].
В 2017 г. Takahashi H и соавт. был разработан алгоритм прогнозирования потребности в панретинальной лазеркоагуляции (ПЛК) у пациентов с ДР. Система классифицировала ДР на стадии: non-proliferative diabetic retinopathy (непролиферативная ДР), simple diabetic retinopathy (фоновая ДР), pre-proliferative retinopathy (препролиферативная ДР), proliferative diabetic retinopathy (пролиферативная ДР), оценивала динамику заболевания и прогнозировала потребность и сроки ПЛК. В результате сравнения нескольких архитектур, включая ResNet, для построения системы была выбрана GoogLeNet. Учитывая небольшой размер набора данных, была применена кросс-валидация (метод оценки качества обучения модели ИИ, при котором общий набор данных делится на k подвыборок, модель обучается k раз, при каждом обучении выбирается одна тестовая подвыборка, а остальные являются обучающими, итоговая метрика качества обучения рассчитывается как усреднение результатов на всех тестовых подвыборках). Точность алгоритма составила 96% [19][20].
Еще одним современным примером использования сверточной нейронной сети для задачи классификации ДР стало исследование 2017 г. Grzybowski A. и соавт., которые разработали систему SERI-NUS, и чувствительность которой составила 91,6%, а специфичность — 91,1%, на впечатляющем наборе данных, включающем полмиллиона снимков глазного дна [9][21].
Abramoff M.D. и соавт. внедрили технологию IDx-DR [22] в клиническую практику в 2018 г., которая стала первой автономной программой ИИ, одобренной FDA (Food and Drug Administration) для диагностики ДР у взрослых с СД. Национальные рекомендации по скринингу формирует целевая группа по профилактическим услугам (USPSTF). IDx-DR использует ИИ для автоматической диагностики ДР на основе анализа снимков сетчатки глаз без необходимости интерпретации врачом. Это позволяет проводить скрининг ДР во время визитов к врачу, даже если тот не специализируется на офтальмологии. Снимки глазного дна были получены с использованием фундус-камеры Topcon NW400. Система имеет чувствительность в 82,24% и специфичность — 85,47% [7][20][23–28].
Важным компонентом системы является модель помощи при съемке, который подсказывает, как лучше сделать снимок и анализирует его качество, что позволяет повысить результативность всей системы [29].
В 2018 г. компания Google Deep Mind (США) совместно с De Fauw J. и соавт. провела на базе британской офтальмологической клиники Moorfields Eye Hospital исследование программы ИИ для дифференциальной диагностики макулярных патологий по данным оптической когерентной томографии (ОКТ): хориоидальной неоваскуляризации (ХНВ), макулярного отека без ХНВ, макулярных друз, географической атрофии, эпиретинального тракционного синдрома, сквозных и ламеллярных макулярных разрывов, центральной серозной хориоретинопатии. Программа классифицировала патологии на 4 категории: неотложные, срочные, требующие лечения в плановом порядке, требующие наблюдения. Ее точность составила 96,6%, AUC — 0,999 [20][30–32].
В 2019-м Saeed E. и соавт. разработали систему, анализирующую изображения и выявляющую патологические изменения глазного дна, вызванные ДР. В этом исследовании предлагается нетипичный в данное время подход без использования ИИ. Вывод о патологических изменениях делается на основе многоэтапной предобработки изображений с последующей фильтрацией вен. Если на изображении остаются цветовые пятна, выявленные в красном фильтре, система делает вывод о наличии патологий. Итогом работы системы является идентификация патологических изменений. В случае отсутствия патологии автоматизированная система делает вывод о здоровой сетчатке у пациента [7][33].
Malerbi F.K. и соавт. разработали оптическое устройство Phelcom Eyer в виде накладки на смартфон, которая подключается к камере телефона и предназначена для освещения и получения изображения сетчатки. Специальное приложение, работающее в связке с устройством, отправляет снимки в облачную систему Eyer Cloud, которая сохраняет и обрабатывает изображения сетчатки пациентов с помощью модели ИИ. Врачи-офтальмологи могут подключаться к облачному сервису из любой точки мира. В работе устройства и программного обеспечения применяется модель, обученная на более, чем 10 000 фотографий. В качестве архитектуры использовалась модифицированная версия Xception. Несмотря на то, что данная модель выполняла задачу классификации, для улучшения интерпретируемости выводов системы была внедрена подсветка зон наибольшего интереса модели с помощью градиентной заливки. В настоящее время точность данной системы при выявлении ДР близка к 80%. По мере расширения базы данных точность, по мнению разработчиков алгоритма, будет достигать 95% [34][35].
Система EyeArt, разработанная компанией Eyenuk, была провалидирована в реальной клинической практике Bhaskaranand M. и соавт. в 2019 г. и одобрена FDA в 2020-м. Она подходит для анализа изображений с различных фундус-камер (Canon CR-2 AF, Canon CR-2 Plus AF, Topcon NW400) и используется в системах здравоохранения 13 стран мира (США, Канада и несколько стран Европы и Азии). Чувствительность программы варьируется от 96 до 97% и специфичность — от 88 до 90% [7][20][36–38].
В совместном исследовании Wang X. и соавт. из китайской компании Airdoc LLC и австралийского университета Монаша (Monash University) 2019 г. был предложен новый подход к определению патологий глазного дна по снимкам, полученным с фундус-камеры. В этом подходе определяются патологии трех типов: присущие только оптическому диску, только макуле и всему глазному дну в целом. Для этого с помощью нейросетевой модели на снимке определяются положения трех ограничивающих прямоугольников: для оптического диска, макулы и для обоих объектов одновременно (если один из них не может быть достоверно определен). Вторым этапом проводится классификация участков в каждом прямоугольнике по наличию какой-либо из патологий (всего 36 различных вариантов) [39].
В еще одной работе, проведенной в 2019 г. Playout С. и соавт., был предложен подход к определению наличия и сегментированию двух групп патологий («красных» и «светлых») глазного дна по изображениям с фундус-камеры. Архитектура сверточной нейронной сети включала энкодер и два отдельных декодера, которые решают задачу сегментации красных (геморрагий всех видов и аневризм) и светлых (твердых и мягких экссудатов, друз, ватообразных экссудатов) патологий. Для улучшения качества модели был добавлен классификатор, определяющий наличие или отсутствие на исходном изображении патологии каждого из двух типов. В результате в задаче определения наличия патологий на наборе данных Messidor авторам удалось достичь показателя площади под ROC-кривой = 0,839 [40].
В 2021 г. Arenas-Cavalli J.T. и соавт. была проведена исследовательская работа, посвященная оценке точности диагностики ДР с помощью разработанной ими ранее системы DART. В исследовании использовались результаты обследования 1123 глаз больных диабетом. Наличие ДР определялось на основании анализа изображений глазного дна с использованием двух сверточных нейронных сетей, одна из которых обнаруживала признаки диабетического макулярного отека, а вторая — признаки ДР. Конечное решение о наличии ДР определяли с помощью взвешивания двух прогнозов, оставляя результат с наибольшей вероятностью наличия ДР для каждого глаза. Система DART и опытный офтальмолог независимо классифицировали снимки на наличие и отсутствие ДР. Система DART продемонстрировала чувствительность 94,6% и специфичность — 74,3% [7][41].
В том же году в США Kim T.N. и соавт. была протестирована разработанная ранее система Ocular CellScope для скрининга на наличие ДР, продемонстрировавшая 100-процентную чувствительность и 80-процентную специфичность [7][42].
В 2021 г. Мамедов Т.Х. и соавт. из Красноярского государственного медицинского университета использовали сверточную нейронную сеть для распознавания ДР по изображениям глазного дна. В качестве материалов для обучения модели была использована база цифровых снимков из репозитория Kaggle. Всего было использовано 12 498 изображений, из которых 4584 имели признаки ДР, разделенные на четыре группы: легкая, умеренная, тяжелая непролиферативная и пролиферативная формы. При многоклассовой классификации модель продемонстрировала низкую точность и высокие значения функции потерь. Однако при классификации на наличие и отсутствие ДР точность модели достигла 91,1%, чувствительность — 89,3% и специфичность — 92,1% [43].
Также, используя снимки из репозитория Kaggle, Духова М.А. и соавт. из Московского технического университета связи и информатики разработала программный комплекс для автоматического распознавания дефектов сетчатки глаза на основе многослойной сверточной нейронной сети. Основная задача — помочь врачам выявлять три вида заболеваний: катаракту, глаукому и ДР по снимкам глазного дна [44].
Нероев В.В. и соавт. провели исследование, результатом которого является разработанный тестовый прототип сервиса для диагностики диабетических изменений глазного дна на основе снимков с помощью инструментов машинного обучения. Чувствительность модели в ходе диагностики (обнаружения) ДР даже на небольшой тестовой выборке и ограниченном времени обучения составила 85% [45].
Каталевская Е.А. и соавт. из компании «ООО Диджитал Вижн Солюшнс» разработали алгоритм ИИ для сегментации признаков ДР и диабетического макулярного отека на основе фундус-фотографий глазного дна, используя базы данных INDIAN DIABETIC RETINOPATHY IMAGE DATASET (IDRID), открытую базу “1000 Fundus images with 39 categories” и фотографии из Marashi Eye Clinic. Обучающая база содержала 1200 изображений, валидационная — 310. Все данные были проверены и размечены врачами. Врачи-офтальмологи вручную размечали изображения, выделяя полигональные области с различными признаками патологии, такими как микроаневризмы, экссудаты, геморрагии и неоваскуляризация. Алгоритм включал два типа нейросетей: нейросеть-детектор (для обнаружения центра макулы и оптического диска) и сегментационную нейросеть (для семантической сегментации признаков патологий). Использовали архитектуры CenterNet, EfficientNetB0 + FPN для «малых» признаков и MobileNetv2 + Unet для «крупных» признаков. Предобработка выполнялась для улучшения визуализации, включая коррекцию яркости и контраста каналов изображения и увеличение резкости. После этого данные обрабатывались нейросетью-детектором для выделения глазного дна и анатомических структур. Алгоритм продемонстрировал высокую точность при сегментации признаков ДР и диабетического макулярного отека [46].
В крупномасштабном исследовании, выполненном Dai L. и соавт. из нескольких университетов и медицинских центров Китая в 2021 г., была разработана система dauepDR, предназначенная для интерпретируемого определения стадии ДР. Система основана на нейросетевой архитектуре для решения трех подзадач: проверка качества снимка глазного дна, классификация стадии ДР и сегментация патологий глазного дна, ассоциированных с ДР. В качестве набора данных использовалась выборка из 666 383 изображений, полученных из различных медицинских учреждений. Каждый снимок был вручную аннотирован по стадии ДР и качеству снимка. Для 14 901 изображения была выполнена сегментация 4 патологий глазного дна: микроаневризм, геморрагий, твердых экссудатов и ватообразных экссудатов. Качество решения задачи определения стадии ДР составило 0,955 по метрике AUC на внутреннем наборе данных и 0,943 на наборе данных EyePACS; качество классификации наличия патологий составило от 0,901 (микроаневризмы) и до 0,967 (геморрагии) [47][48].
В 2022 г. в Китае Dong L. и соавт. разработали модель RAIDS, которая использует алгоритмы глубокого обучения. Система позволяет выявлять изображения сетчатки без патологий, в то время как диагностированные патологические изменения подвергались дополнительной оценке со стороны офтальмолога. Чувствительность подхода, основанного на применении ИИ в сочетании с оценками, проведенными офтальмологами, составила 90,6% [7][49].
Довольно необычный подход к решению задачи сегментирования патологий глазного дна был предложен в работе Mahmood M.A.I. и соавт. 2023 г. Данное исследование, в отличие от большинства современных работ, обращает внимание на вопросы предварительной обработки изображений и использования признаков, извлеченных вручную. В своей работе авторы активно используют такие классические методы обработки изображений, как CLAHE, билатеральный фильтр, использование альтернативных RGB цветовых пространств (HSV, Lab) и другие. На первых этапах алгоритма с помощью разных комбинаций этих методов на изображении глазного дна последовательно выделяются сосуды, диск оптического нерва и макула. После того, как выделенные сущности «отделяются» от изображения, переходят к этапу выделения целевых классов: микроаневризм и геморрагий (классическими методами) и неоваскуляризации (нейросетевой моделью классификации InceptionV3). На основе полученных предсказаний выполняется определение одной из 5 стадий ДР. Система продемонстрировала точность 96,83% на комбинации открытых наборов данных Drive, Messidor, Kaggle, Stare и DIARETDB0 [50].
В 2023 г. в Беларуси Лукашевич М.М. обучил модель на основе архитектуры EfficientNet. Она была выбрана из-за ее высокой производительности и эффективности в задачах распознавания изображений. Модель обучалась на наборе данных изображений сетчатки, состоящей из 2196 изображений для обучения, 733 для валидации и 733 для тестирования. Для улучшения качества обучения и увеличения разнообразия данных использовались методы аугментации, такие как повороты, масштабирование и изменение яркости изображений. Разработанный классификатор достиг высокой точности, равной 97,14% на тестовом наборе данных [51].
В Красноярске в 2023 г. Дзюба Д.В. и соавт. исследовали разные многомерные модели для диагностики патологий сетчатки. Были использованы изображения сетчатки из открытой базы данных Kaggle, состоящей из 75 240 изображений, распределенных по четырем классам: отсутствие патологии сетчатки; наличие друз (отложений на сетчатке); хороидальная неоваскуляризация; макулярный отек. Лучший результат показала сверточная нейронная сеть: общая точность — 89,7%, чувствительность — 91,1% и специфичность — 87,4% [52].
Совсем недавно, в 2024 г., Vijayaraghavan P. и соавт. из Индии разработали мобильное приложение для определения ДР. Фотографии, полученные с применением приложения Remidio Non-Mydriatic Fundus, были проанализированы с помощью алгоритма ИИ для смартфона на возможность обнаружения ДР. По результатам сравнения с оценками двух врачей-офтальмологов система продемонстрировала 100-процентную чувствительность и 89,55-процентную специфичность [7][53].
Сводные данные по рассмотренным системам для диагностики ДР приведены в табл. 1.
ПРОБЛЕМЫ СУЩЕСТВУЮЩИХ НАБОРОВ ДАННЫХ ДЛЯ ОБУЧЕНИЯ ИИ С ЦЕЛЬЮ ДИАГНОСТИКИ ДР
Наборы данных, подходящие для настройки и тестирования алгоритмов и моделей машинного обучения для решения задач, связанных с ДР, отличаются высокой вариативностью (табл. 2). Во-первых, самым очевидным свойством любого набора данных является размер; в случае с открытыми наборами для работы с ДР количество изображений в рамках одного набора варьируется от нескольких десятков (DIARETDB1) до десятков тысяч (EyePACS) экземпляров (табл. 2). Во-вторых, поскольку решение проблемы «определения ДР» может сводиться как минимум к трем формулировкам разной степени сложности (бинарная классификация наличия ДР выше определенной стадии; многоклассовая классификации наличия конкретной стадии ДР; классификация наличия или сегментирование патологий глазного дна), доступные наборы данных отличаются детализированностью разметки изображений. Например, в наборе данных DIARETDB1 для каждого изображения известен только факт «наличия ДР», в то время как в наборе данных FGADR для всех изображений известна стадия ДР, а для части набора данных приведены и сегментационные маски 6 различных патологий глазного дна. Безусловно, наличие даже неразмеченных и разнообразных данных является хорошим подспорьем при решении задачи, и при желании любой набор данных может быть размечен собственными силами для получения необходимого уровня разметки; тем не менее, как и многие другие задачи из области медицины и здравоохранения, стоимость разметки наборов данных из снимков глазного дна и определение стадии ДР и патологий требует специалистов определенной квалификации, что естественным образом повышает стоимость такой разметки.
Таблица 2. Обзор наборов данных снимков глазного дна для обучения искусственного интеллекта диагностике диабетической ретинопатии
|
№ |
Название |
Год создания |
Страна |
Количество изображений |
Тип разметки |
Ссылка |
|
1 |
DIARETDB1 |
2007 |
Финляндия |
89 |
Классификация наличия ДР (есть / нет) |
https://www.semanticscholar.org/paper/The-DIARETDB1-Diabetic-Retinopathy-Database-and-Kauppi-Kalesnykiene/062cea54e5d58ee41aea607cbf2ba0cf457aa4e7 |
|
2 |
Messidor |
2014 |
Франция |
1748 |
Оригинальный датасет не содержит разметки, однако существует версия со сторонними аннотациями (классификация стадий ДР (0-3)) |
https://www.adcis.net/en/third-party/messidor2/ https://www.kaggle.com/datasets/google-brain/messidor2-dr-grades |
|
3 |
EyePACS |
2015 |
США |
35 126 |
Классификация стадий ДР: 0 — No DR, 1 — Mild, 2 — Moderate, 3 — Severe, 4 — Proliferative DR |
https://www.kaggle.com/c/diabetic-retinopathy-detection/overview |
|
4 |
IDRID |
2018 |
Индия |
516 |
Классификация стадий ДР (0–4). (81) Сегментационные маски для патологий: - microaneurysms (MA), - soft exudates (SE), - hard exudates (EX), - hemorrhages (HE) (Также размечены координаты диска и макулы) |
https://www.mdpi.com/2306-5729/3/3/25 |
|
5 |
APTOS |
2019 |
Индия |
3662 |
Классификация стадий ДР (0–4) |
https://www.kaggle.com/c/aptos2019-blindness-detection/data |
|
6 |
ODIR |
2019 |
Китай |
7000 |
Классификация патологий: - Normal (N), - Diabetes (D), - Glaucoma (G), - Cataract (C), - Age related Macular Degeneration (A), - Hypertension (H), - Pathological Myopia (M), - Other diseases/abnormalities (O) |
https://www.kaggle.com/datasets/andrewmvd/ocular-disease-recognition-odir5k https://odir2019.grand-challenge.org/dataset/ |
|
7 |
DeepDRID |
2019 |
Китай |
2000 fundus 256 ultra-wide field |
Классификация стадий ДР (0–4). Оценка общего качества изображений по признакам |
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9214346/pdf/main.pdf https://github.com/deepdrdoc/DeepDRiD |
|
8 |
OIA-DDR |
2019 |
Китай |
13 673 |
Классификация стадий ДР (0–4). (757) Сегментационные маски для патологий: - microaneurysms (MA), - soft exudates (SE), - hard exudates (EX), - haemorrhages (HE) |
https://www.sciencedirect.com/science/article/abs/pii/S0020025519305377?via%3Dihub https://github.com/nkicsl/DDR-dataset |
|
9 |
FGADR |
2020 |
ОАЭ |
2842 |
(1000) Классификация стадий ДР (0–4). (1842) Сегментационные маски для патологий: - microaneurysms (MA), - hemorrhages (HE), - hard exudates (EX), - soft exudates (SE), - intra-retinal microvascular abnormalities (IRMA), -neovascularization (NV) |
https://arxiv.org/pdf/2008.09772 https://csyizhou.github.io/FGADR/ |
Также стоит отметить, что не всегда в разговорах о данных в контексте ДР упоминается такое их свойство, как разнообразие источников изображений. Несмотря на единый общий принцип работы фундус-камер, качественные и количественные характеристики изображений, получаемых с помощью аппаратов различных моделей и производителей, могут значительно различаться. В этой связи особую важность приобретает необходимость работы по улучшению обобщающей способности разрабатываемых моделей и алгоритмов; одним из известных факторов, положительно влияющих на эту способность, является разнообразие обучающих данных.
ЗАКЛЮЧЕНИЕ
Развитие технологий ИИ и компьютерного зрения открыло принципиально новые возможности в диагностике ДР. Современные системы автоматического анализа изображений глазного дна демонстрируют высокую чувствительность и специфичность, сопоставимые с результатами врачей-офтальмологов, а в ряде случаев — превосходящие их в условиях массового скрининга. Применение таких решений позволяет значительно снизить нагрузку на специалистов, повысить охват пациентов и обеспечить своевременное выявление патологии на ранних стадиях. Наиболее перспективными являются алгоритмы на основе сверточных нейронных сетей, обладающие высокой точностью и способностью к масштабируемости при условии достаточного разнообразия обучающих данных. В то же время сохраняются вызовы, связанные с интерпретируемостью моделей, стандартизацией входных изображений, а также необходимостью клинической валидации в реальных условиях. Особую значимость имеет повышение разнообразия признаков в обучающих наборах данных. Представленный обзор позволяет оценить текущее состояние и тенденции развития интеллектуальных систем в офтальмологии, подчеркивая их потенциал как инструмент повышения эффективности и качества медицинской помощи пациентам с СД.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Першина-Милютина А.П. — разработка концепции и дизайна исследования, получение и анализ данных, интерпретация результатов, создание иллюстративного материала, написание статьи; Козлов Е.В. — получение и анализ данных, интерпретация результатов, написание статьи; Лысухин Д.Д. — получение и анализ данных, интерпретация результатов, написание статьи; Аредов А.В. — получение и анализ данных, интерпретация результатов, создание иллюстративного материала, написание статьи; Мокрышева Н.Г. — разработка концепции и дизайна исследования, интерпретация результатов, редактирование текста статьи; Ковалева Е.В. — разработка концепции и дизайна исследования, интерпретация результатов, редактирование текста статьи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов ИИ, Шестакова МВ, Викулова ОK и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010-2022 гг. Сахарный диабет. 2023;26(2):104–123. https://doi.org/10.14341/DM13035
2. Клинические рекомендации "Сахарный диабет 1 типа у взрослых". Утв. Минздравом РФ; 2022.
3. Клинические рекомендации "Сахарный диабет 2 типа у взрослых". Утв. Минздравом РФ; 2022.
4. Реброва ОЮ. Жизненный цикл систем поддержки принятия врачебных решений как медицинских технологий. Врач и информационные технологии. 2020;(1):27–37.
5. Joshi GD, Sivaswamy J. DrishtiCare: A Telescreening Platform for Diabetic Retinopathy Powered with Fundus Image Analysis. Journal of Diabetes Science and Technology. 2011;5(1):23–31. https://doi.org/10.1177/193229681100500104
6. Андреев ДА, Камынина НА, Анциферов ЕИ и др. Телемедицинский скрининг диабетической ретинопатии с использованием цифровых технологий: зарубежный опыт. Здоровье мегаполиса. 2024;5(1):103–111. https://doi.org/10.47619/2713-2617.zm.2024.5.1.103-111
7. Ribeiro ML, Nunes SG, Cunha-Vaz JG. Microaneurysm turnover at the macula predicts risk of development of clinically significant macular edema in persons with mild nonproliferative diabetic retinopathy. Diabetes Care. 2013;36(5):1254–1259. https://doi.org/10.2337/dc12-1491
8. Grzybowski A, Brona P, Lim G, et al. Artificial intelligence for diabetic retinopathy screening: a review. Eye (Lond). 2020;34(3):451–460. https://doi.org/10.1038/s41433-019-0566-0
9. Straňák Z, Penčák M, Veith M. Artificial intelligence in diabetic retinopathy screening. A review. Cesk Slov Oftalmol. 2021;77(5):224–231. https://doi.org/10.31348/2021/6
10. Tufail A, Rudisill C, Egan C, et al. Automated diabetic retinopathy image assessment software: diagnostic accuracy and cost-effectiveness compared with human graders. Ophthalmology. 2017;124(3):343–351. https://doi.org/10.1016/j.ophtha.2016.11.014
11. Walton OB, Garoon RB, Weng CY, et al. Evaluation of Automated Teleretinal Screening Program for Diabetic Retinopathy. JAMA Ophthalmol. 2016;134(2):204–209. https://doi.org/10.1001/jamaophthalmol.2015.5083
12. Павлов ВГ, Сидамонидзе АЛ, Петрачков ДВ. Современные тенденции скрининга диабетической ретинопатии. Вестник офтальмологии. 2020;136(4):300–307. https://doi.org/10.17116/oftalma2020136042300
13. Nakayama LF, Zago Ribeiro L, Novaes F, et al. Artificial intelligence for telemedicine diabetic retinopathy screening: a review. Ann Med. 2023;55(2):2258149. https://doi.org/10.1080/07853890.2023.2258149
14. Gulshan V, Peng L, Coram M, et al. Development and validation of a deep learning algorithm for detection of diabetic retinopathy in retinal fundus photographs. JAMA. 2016;316(22):2402–2410. https://doi.org/10.1001/jama.2016.17216
15. Szegedy C, Vanhoucke V, Ioffe S, et al. Rethinking the Inception Architecture for Computer Vision. 2016 IEEE Conference on Computer Vision and Pattern Recognition (CVPR); Las Vegas, NV, USA; 2016: 2818–2826. https://doi.org/10.1109/CVPR.2016.308
16. Dutt S, Sivaraman A, Savoy F, et al. Insights into the growing popularity of artificial intelligence in ophthalmology. Indian J Ophthalmol. 2020;68(7):1339–1346. https://doi.org/10.4103/ijo.IJO_1754_19
17. Ji Y, Chen N, Liu S, et al. Research Progress of Artificial Intelligence Image Analysis in Systemic Disease-Related Ophthalmopathy. Dis Markers. 2022;2022:3406890. https://doi.org/10.1155/2022/3406890
18. Takahashi H, Tampo H, Arai Y, et al. Applying artificial intelligence to disease staging: Deep learning for improved staging of diabetic retinopathy. PLoS ONE. 2017;12(6):e0179790. https://doi.org/10.1371/journal.pone.0179790
19. Каталевская ЕА, Каталевский ДЮ, Тюриков МИ и др. Перспективы использования искусственного интеллекта в диагностике и лечении заболеваний сетчатки. РМЖ. Клиническая офтальмология. 2022;22(1):36–43. https://doi.org/10.32364/2311-7729-2022-22-1-36-43
20. Ting DSW, Cheung CY, Lim G, et al. Development and Validation of a Deep Learning System for Diabetic Retinopathy and Related Eye Diseases Using Retinal Images From Multiethnic Populations With Diabetes. JAMA. 2017;318(22):2211–2223. https://doi.org/10.1001/jama.2017.18152
21. Abramoff MD, Lavin PT, Birch M, et al. Pivotal trial of an autonomous AI-based diagnostic system for detection of diabetic retinopathy in primary care offices. NPJ Digit Med. 2018;1:39. https://doi.org/10.1038/s41746-018-0040-6
22. Keskinbora K, Güven F. Artificial Intelligence and Ophthalmology. Turk J Ophthalmol. 2020;50(1):37–43. https://doi.org/10.4274/tjo.galenos.2020.78989
23. Padhy SK, Takkar B, Chawla R, et al. Artificial intelligence in diabetic retinopathy: A natural step to the future. Indian J Ophthalmol. 2019;67(7):1004–1009. https://doi.org/10.4103/ijo.IJO_1989_18
24. Романова ДВ, Грицюк ЕМ, Степанова ЕА и др. О предмете развития экспертной системы диагностики ретинопатии недоношенных. Системная интеграция в здравоохранении. 2020;(2):35–42. https://www.elibrary.ru/item.asp?id=44733649
25. Мартусевич ЯА, Кобякова ОС, Люцко ВВ. Ранний цифровой скрининг диабетической ретинопатии (обзор литературы). Современные проблемы здравоохранения и медицинской статистики. 2023;(4):887–914. https://doi.org/10.24412/2312-2935-2023-4-887-914
26. Рябикин ДВ, Мищенко ЮВ, Турчанинов ГЕ. Обучение нейросетей для анализа и обработки медицинских данных и диагностики заболеваний. Университетская наука. 2023;(2):178–183. https://www.elibrary.ru/item.asp?id=56443912
27. Климонтов ВВ, Бериков ВБ, Сайк ОВ. Искусственный интеллект в диабетологии. Сахарный диабет. 2021;24(2):156–166. https://doi.org/10.14341/DM12665
28. Grzybowski A, Brona P. Analysis and Comparison of Two Artificial Intelligence Diabetic Retinopathy Screening Algorithms in a Pilot Study: IDx-DR and Retinalyze. J Clin Med. 2021;10(11):2352. https://doi.org/10.3390/jcm10112352
29. De Fauw J, Ledsam JR, Romera-Paredes B, et al. Clinically applicable deep learning for diagnosis and referral in retinal disease. Nat Med. 2018;24(9):1342–1350. https://doi.org/10.1038/s41591-018-0107-6
30. Рязанова СВ, Комков АА, Мазаев ВП. Перспективы медицинских технологий искусственного интеллекта. Научное обозрение. Медицинские науки. 2022;(4):90–94. https://doi.org/10.17513/srms.1279
31. Мяснянкина ОП, Пронькин НН. Достижения и перспективы искусственного интеллекта в медицине. International Journal of Professional Science. 2021;(4):27–32. https://www.elibrary.ru/item.asp?id=46179278
32. Saeed E, Szymkowski M, Saeed K, et al. An Approach to Automatic Hard Exudate Detection in Retina Color Images by a Telemedicine System Based on the d-Eye Sensor and Image Processing Algorithms. Sensors (Basel). 2019;19(3):695. https://doi.org/10.3390/s19030695
33. Malerbi FK, Andrade RE, Morales PH, et al. Diabetic Retinopathy Screening Using Artificial Intelligence and Handheld Smartphone-Based Retinal Camera. Journal of Diabetes Science and Technology. 2022;16(3):716–723. https://doi.org/10.1177/1932296820985567
34. Федорович АА, Горшков АЮ, Королев АИ и др. Смартфон в медицине — от справочника к диагностической системе. Обзор современного состояния вопроса. Кардиоваскулярная терапия и профилактика. 2022;21(9):66–74. https://doi.org/10.15829/1728-8800-2022-3298
35. Bhaskaranand M, Ramachandra C, Bhat S, et al. The Value of Automated Diabetic Retinopathy Screening with the EyeArt System: A Study of More Than 100,000 Consecutive Encounters from People with Diabetes. Diabetes Technol Ther. 2019;21(11):635–643. https://doi.org/10.1089/dia.2019.0164
36. Ferro Desideri L, Rutigliani C, Corazza P, et al. The upcoming role of Artificial Intelligence (AI) for retinal and glaucomatous diseases. J Optom. 2022;15(Suppl 1):S50–S57. https://doi.org/10.1016/j.optom.2022.08.001
37. Wewetzer L, Held LA, Steinhäuser J. Diagnostic performance of deep-learning-based screening methods for diabetic retinopathy in primary care-A meta-analysis. PLoS ONE. 2021;16(8):e0255034. https://doi.org/10.1371/journal.pone.0255034
38. Wang X, Ju L, Zhao X, et al. Retinal abnormalities recognition using regional multitask learning. Medical Image Computing and Computer Assisted Intervention – MICCAI 2019: 22nd International Conference; Shenzhen, China; 2019: 30–38. https://doi.org/10.1007/978-3-030-32245-8_4
39. Playout C, Duval R, Cheriet F. A Novel Weakly Supervised Multitask Architecture for Retinal Lesions Segmentation on Fundus Images. IEEE Transactions on Medical Imaging. 2019;38(10):2434–2444. https://doi.org/10.1109/TMI.2019.2906319
40. Arenas-Cavalli JT, Abarca I, Rojas-Contreras M, et al. Clinical validation of an artificial intelligence-based diabetic retinopathy screening tool for a national health system. Eye (Lond). 2022;36(1):78–85. https://doi.org/10.1038/s41433-020-01366-0
41. Kim TN, Myers F, Reber C, et al. A Smartphone-Based Tool for Rapid, Portable, and Automated Wide-Field Retinal Imaging. Transl Vis Sci Technol. 2018;7(5):21. https://doi.org/10.1167/tvst.7.5.21
42. Мамедов ТХ, Дзюба ДВ, Наркевич АН. Распознавание диабетической ретинопатии на цифровых изображениях глазного дна при помощи остаточной сверточной нейронной сети. Вестник новых медицинских технологий. 2021;28(3):73–76. https://doi.org/10.24412/1609-2163-2021-3-73-76
43. Духова МА, Усачев ВА. Проектирование и разработка системы распознавания дефектов сетчатки глаза на основе нейронной сети. DSPA: Voprosy primeneniya tsifrovoy obrabotki signalov. 2021;11(1):39–46. https://www.elibrary.ru/item.asp?id=45846815
44. Нероев ВВ, Брагин АА, Зайцева ОВ. Разработка прототипа сервиса для диагностики диабетической ретинопатии по снимкам глазного дна с использованием методов искусственного интеллекта. Национальное здравоохранение. 2021;2(2):64–72. https://doi.org/10.47093/2713-069X.2021.2.2.64-72
45. Каталевская ЕА, Каталевский ДЮ, Тюриков МИ и др. Алгоритм сегментации визуальных признаков диабетической ретинопатии (ДР) и диабетического макулярного отека (ДМО) на цифровых фотографиях глазного дна. Российский журнал телемедицины и электронного здравоохранения. 2021;7(4):17–27. https://doi.org/10.29188/2712-9217-2021-7-4-17-26
46. Dai L, Wu L, Li H, et al. A deep learning system for detecting diabetic retinopathy across the disease spectrum. Nature Communications. 2021;12. https://doi.org/10.1038/s41467-021-23458-5
47. Zhelev Z, Peters J, Rogers M, et al. Test accuracy of artificial intelligence-based grading of fundus images in diabetic retinopathy screening: A systematic review. J Med Screen. 2023;30(3):97–112. https://doi.org/10.1177/09691413221144382
48. Dong L, He W, Zhang R, et al. Artificial Intelligence for Screening of Multiple Retinal and Optic Nerve Diseases. JAMA Netw Open. 2022;5(5):e229960. https://doi.org/10.1001/jamanetworkopen.2022.9960
49. Mahmood MAI, Aktar N, Kader MF. A hybrid approach for diagnosing diabetic retinopathy from fundus image exploiting deep features. Heliyon. 2023;9. https://doi.org/10.1016/j.heliyon.2023.e19625
50. Лукашевич ММ. Нейросетевой классификатор для определения диабетической ретинопатии по изображениям сетчатки. Системный анализ и прикладная информатика. 2023;(1):25–34. https://doi.org/10.21122/2309-4923-2023-1-25-34
51. Дзюба ДВ, Наркевич АН, Курбанисмаилов РБ. Использование многомерных моделей для диагностики патологий сетчатки. Вестник Биомедицина и Социология. 2023;8(1):33–38. https://doi.org/10.26787/nydha-2618-8783-2023-8-1-33-38
52. Prathiba V, Rajalakshmi R, Arulmalar S, et al. Accuracy of the smartphone-based nonmydriatic retinal camera in the detection of sight-threatening diabetic retinopathy. Indian J Ophthalmol. 2020;68(Suppl 1):S42. https://doi.org/10.4103/ijo.IJO_1937_19
Об авторах
А. П. Першина-МилютинаРоссия
Першина-Милютина Анастасия Павловна
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Е. В. Козлов
Россия
Козлов Егор Васильевич
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Д. Д. Лысухин
Россия
Лысухин Даниил Дмитриевич
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
А. В. Аредов
Россия
Аредов Алексей Вячеславович
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Е. В. Ковалева
Россия
Ковалева Елена Владимировна
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Н. Г. Мокрышева
Россия
Мокрышева Наталья Георгиевна, д.м.н., профессор, академик РАН
Москва
Researcher ID: AAY-3761-2020
Scopus Author ID: 35269746000
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Дополнительные файлы
|
|
1. Рисунок 1. Потоковая диаграмма, отражающая систематический поиск научных публикаций по разработанным моделям анализа изображений глазного дна с целью диагностики/выявления диабетической ретинопатии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(449KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Першина-Милютина А.П., Козлов Е.В., Лысухин Д.Д., Аредов А.В., Ковалева Е.В., Мокрышева Н.Г. Обзор систем поддержки принятия врачебных решений для диагностики диабетической ретинопатии. Сахарный диабет. 2025;28(5):460-470. https://doi.org/10.14341/DM13354
For citation:
Pershina-Miliutina A.P., Kozlov E.V., Lysukhin D.D., Aredov A.V., Kovaleva E.V., Mokrysheva N.G. Review of medical decision support systems for the diagnosis of diabetic retinopathy. Diabetes mellitus. 2025;28(5):460-470. (In Russ.) https://doi.org/10.14341/DM13354
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































