Перейти к:
Клинический случай беременности пациентки с сочетанием двух орфанных заболеваний: семейной парциальной липодистрофии 4 типа и HNF1A-MODY на фоне лептин-заместительной терапии
https://doi.org/10.14341/DM13333
Аннотация
Липодистрофии — группа орфанных заболеваний (по разным источникам, распространенность заболевания варьируется от 1 до 5 случаев на 1 000 000 населения), которые могут иметь как наследственный, так и приобретенный характер. Заболевания данной группы представляют симптомокомплекс, характеризующийся различной степенью потери жировой ткани: полной (генерализованная липодистрофия) или частичной (парциальная липодистрофия), а также неправильным распределением подкожной жировой клетчатки, при условии отсутствия влияния алиментарного фактора и катаболических состояний. Липодистрофии характеризуются метаболическими изменениями: дислипидемией, нарушениями углеводного обмена, инсулинорезистентностью, метаболически ассоциированной жировой болезнью печени. Отдельно стоит обозначить репродуктивные нарушения, такие как синдром поликистозных яичников, бесплодие, невынашивание беременности и другие. Уменьшение содержания жировой ткани в организме приводит к снижению выработки гормона лептина, который влияет на нейроны гипоталамуса, регулирующие чувство голода и насыщения, а также увеличивает расход энергии за счет стимуляции термогенеза. Гиполептинемия является основной причиной метаболических нарушений, связанных с липодистрофией. В настоящее время зарегистрирован рекомбинантный аналог человеческого лептина — метрелептин, улучающий качество жизни пациентов посредством достижения компенсации метаболических нарушений, уменьшения гиперфагии, а также оказывая благоприятное влияние на фертильность.
HNF1A-MODY — сахарный диабет с аутосомно-доминантным типом наследования, ассоциированный с гетерозиготными вариантами гена HNF1A, участвующего в дифференцировке и функционировании поджелудочной железы. Для заболевания характерны: дебют в молодом возрасте, преобладание постпрандиальной гипергликемии, наличие глюкозурии, прогрессирующее течение с высоким риском развития микро- и макрососудистых осложнений, эффективность терапии препаратами сульфонилмочевины с появлением со временем потребности в назначении инсулинотерапии.
В данной статье представлен первый в России клинический случай, демонстрирующий беременность пациентки с сочетанием двух орфанных заболеваний: семейной парциальной липодистрофии 4 типа и MODY 3 (перечень редких (орфанных) заболеваний Минздрава России от 06 февраля 2023 г.), получавшей патогенетическое лечение метрелептином до подтверждения факта беременности.
Ключевые слова
Для цитирования:
Фролкова Н.В., Радкевич Е.Р., Кокшарова Е.О., Бурумкулова Ф.Ф., Васильев П.А., Минниахметов И.Р., Еремина И.А., Шестакова М.В. Клинический случай беременности пациентки с сочетанием двух орфанных заболеваний: семейной парциальной липодистрофии 4 типа и HNF1A-MODY на фоне лептин-заместительной терапии. Сахарный диабет. 2025;28(3):305-315. https://doi.org/10.14341/DM13333
For citation:
Frolkova N.V., Radkevich E.R., Koksharova E.O., Burumkulova F.F., Vasiliev P.A., Minniakhmetov I.R., Eremina I.A., Shestakova M.V. A clinical case of pregnancy of a patient with a combination of two orphan diseases: familial partial lipodystrophy type 4 and HNF1A-MODY on the background of therapy with recombinant human methionyl leptin. Diabetes mellitus. 2025;28(3):305-315. (In Russ.) https://doi.org/10.14341/DM13333
АКТУАЛЬНОСТЬ
Синдром липодистрофии — это группа крайне редких заболеваний, подразделяющаяся по этиологии на наследственные и приобретенные формы, по степени потери подкожной жировой клетчатки (ПЖК) — на генерализованные (полное отсутствие ПЖК практически во всех участках депонирования жира в организме человека) и на парциальные (отсутствие ПЖК затрагивает отдельные участки тела, например, верхние и нижние конечности). При парциальных липодистрофиях наблюдается также неправильное перераспределение ПЖК (по абдоминальному типу, иногда повышенное депонирование в области щек, надключичных областях и пр.), что необходимо учитывать при проведении дифференциальной диагностики, например, с типичным экзогенно-конституциональным абдоминальным ожирением, гиперкортицизмом, акромегалией и пр. Вышеперечисленные фенотипические изменения возникают при условии отсутствия предшествующего голодания или катаболического состояния [1–3]. Генез наследственных липодистрофий обусловлен мутацией одного из генов, отвечающих за адипогенез, дифференцировку и регуляцию апоптоза адипоцитов. Дефицит ПЖК приводит в свою очередь к дефициту лептина — гормона, участвующего в регуляции энергетического обмена, оказывая анорексигенное влияние на организм.
В настоящее время с целью патогенетического лечения липодистрофий зарегистрирован рекомбинантный аналог человеческого лептина — метрелептин, улучающий качество жизни пациентов посредством достижения компенсации метаболических нарушений, центрального воздействия на нервную систему, уменьшения гиперфагии, а также благоприятного влияния на фертильность. В связи с увеличением выявляемости и распространенности синдромов липодистрофии врачи различных специальностей должны быть информированы о особенностях ведения и лечения данной когорты пациентов. Особое значение имеет компетентность врачей в вопросах лечения пациенток репродуктивного возраста с синдромом липодистрофии и информированность о влиянии лептин-заместительной терапии на регуляцию репродуктивной системы.
HNF1A-MODY — сахарный диабет (СД) с аутосомно-доминантным типом наследования, ассоциированный с гетерозиготными вариантами гена HNF1A, кодирующего гепатоцитарный ядерный фактор 1A, необходимый для дифференцировки и функционирования поджелудочной железы. Для заболевания характерно начало в подростковом или молодом возрасте, преобладание постпрандиальной гипергликемии, наличие глюкозурии даже при компенсированном углеводном обмене. HNF1A-MODY имеет прогрессирующее течение с высоким риском развития микро- и макрососудистых осложнений. У большинства пациентов эффективна терапия препаратами сульфонилмочевины с появлением со временем потребности в назначении инсулинотерапии.
В данной статье представлен первый в России клинический случай пациентки с СД вследствие семейной парциальной липодистрофии 4 типа (гетерозиготный вариант c.1210-1delG в гене PLIN1) в сочетании с HNF1A-MODY (вариант с.1699G>А в гетерозиготном состоянии в гене HNF1A), получавшей патогенетическое лечение метрелептином до подтверждения факта беременности.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка О., 35 лет, с семейной парциальной липодистрофией 4 типа вследствие гетерозиготного варианта c.1210-1delG в гене PLIN1 и HNF1A-MODY вследствие гетерозиготного варианта с.1699G>А в гене HNF1A поступила в отделение терапии диабета ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ в июне 2024 г. на 8-й неделе физиологической беременности с жалобами на повышение гликемии до 20,0 ммоль/л, изжогу, чувство голода.
Из анамнеза известно, что в 1999 г., в возрасте 11 лет, пациентка отметила фенотипические изменения (мускулистые руки и ноги при отсутствии активной физической нагрузки).
В 2003 г., в возрасте 15 лет, пациентка амбулаторно обследована в ФГБУ «НМИЦ эндокринологии» МЗ РФ, диагностировано нарушение толерантности к глюкозе по результатам перорального глюкозотолерантного теста (гликемия натощак — 4,5 ммоль/л, через 120 мин — 10,5 ммоль/л). Была инициирована пероральная сахароснижающая терапия метформином по 850 мг 2 раза в день, принимала в течение 2 лет, затем отменила самостоятельно. В то же время на основании жалоб на нерегулярные менструации (менархе с 11 лет), при обращении к гинекологу был диагностирован синдром поликистозных яичников (СПЯ), по поводу которого пациентка длительно получала различные комбинированные оральные контрацептивы (КОК). В этот же период времени пациентка была впервые госпитализирована с диагнозом «Острый панкреатит», впоследствии происходили ежегодные госпитализации в связи с обострениями панкреатита (более 20 приступов, последний в феврале 2023 г.). Одновременно с этим, по данным УЗИ органов брюшной полости, были визуализированы изменения печени по типу жировой инфильтрации.
С 2006 г., в возрасте 18 лет, в биохимическом анализе крови впервые выявлена дислипидемия (гипертриглицеридемия), назначалась терапия фибратами и статинами, которая принималась нерегулярно. Максимальный уровень триглицеридов за весь период наблюдения, со слов, 73 ммоль/л (медицинская документация не предоставлена).
В 2007 г., в возрасте 19 лет, в связи с зафиксированным повышением уровня артериального давления (АД) была инициирована антигипертензивная терапия (в разное время назначались препараты из групп ингибиторы ангиотензинпревращающего фермента /блокаторов рецепторо ангиотензина II (АПФ/БРА)), впоследствии — в комбинации с β-блокаторами, а также диуретиками), со слов, с достижением целевых значений АД.
В 2009 г., в возрасте 21 года, при госпитализации в стационар по поводу острого аппендицита был диагностирован СД 2 типа (СД2) (уровень глюкозы плазмы — 20 ммоль/л). По данным обследований от 2010 г.: антитела к глутаматдекарбоксилазе (GAD) 0,46 Ед/мл (менее 1,0), к островковым клеткам поджелудочной железы (ICA) — отрицательные, эндогенная секреция инсулина сохранена (С-пептид — 1,31 нг/мл), гликированный гемоглобин (HbA1c) — 9,5%. Назначен глимепирид 2 мг/сут, на фоне приема в течение 6 мес. показатели гликемии не улучшились. В связи с чем доза глимепирида была увеличена до 3 мг/сут, добавлен инсулин детемир 14 Ед на ночь и метформин 1000 мг на ночь.
В 2011 г., в возрасте 23 лет, при обследовании на предмет наличия поздних осложнений СД была впервые диагностирована дистальная диабетическая полинейропатия. В 2017 г., в возрасте 29 лет, была впервые диагностирована непролиферативная ретинопатия, данных за диабетическую нефропатию ранее получено не было.
В 2018 г. исключена семейная гиперхолестеринемия. Учитывая фенотипические особенности пациентки (атлетическое телосложение, рельефность икроножных мышц, множественные ксантомы, acanthosis nigricans подмышечных и локтевых областей, стрии белого цвета на груди и животе, усиление венозного рисунка на нижних конечностях), данные проведенных обследований, а также семейный анамнез (подобные изменения во внешности (мускулистые руки и ноги) имелись у матери пациентки, которая умерла в возрасте 62 лет от инфаркта миокарда; у бабушки по материнской линии был диагностирован СД2, наследственность по отцовской линии не известна), у пациентки была заподозрена семейная парциальная липодистрофии.
В 20.07.2020 г. пациентка обследована в Медико-генетическом научном центре им. ак. Н.П. Бочкова. В результате массового параллельного секвенирования кастомной панели из 60 генов был выявлен гетерозиготный вариант в гене перилипина PLIN1: NM_002666.4:c.1210-1delG в гетерозиготном состоянии. Наличие данного генетического варианта было подтверждено с помощью прямого автоматического секвенирования по Сэнгеру. На основании критериев ACMG (2015 г.) и руководства по интерпретации данных массового параллельного секвенирования [4] данный вариант был оценен как патогенный (критерии PM2, PVS1, PP5). А также нуклеотидная замена NM_000545.6:с 1699G>А в гетерозиготном состоянии в гене HNF1A. В базе данных мутаций в генах человека (The Human Gene Mutation Database (HGMD) описан как патогенный у пациентов с СД MODY3.
После генетического подтверждения диагноза пациентка на протяжении нескольких лет по настоящий момент находится под динамическим наблюдением в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ с диагнозом «Сахарный диабет вследствие семейной парциальной липодистрофии 4 типа и HNF1A-MODY».
При обследовании в июне 2021 г., в возрасте 33 лет, был определен уровень лептина 2,87 нг/мл (3,70–11,10) и произведена рентгеновская денситометрия Total Body, в ходе которой при оценке жировой ткани получены следующие показатели: процент тканевой — 21,6%, процент регионарный — 20,8%, висцеральный жир — 642 г, жировая масса — 13,715 г. (в настоящее время точные диагностические критерии не установлены).
Во время госпитализации в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ в июне 2021 г. был проведен медицинский консилиум, по результатам которого, учитывая наличие прогрессирующего орфанного заболевания, высокий риск осложнений, низкую эффективность консервативного лечения, рекомендовано назначение патогенетической терапии аналогом лептина — метрелептином.
12.05.2023 г. в ГБУЗ МО «Балашихинская областная больница» была инициирована патогенетическая терапия метрелептином, было выполнено 30 инъекций препарата, последняя инъекция от 11.06.2023, далее по техническим причинам пациентка препарат не получала.
В июле 2023 г. пациентка была госпитализирована в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ с диагнозом:
основное заболевание: «Семейная парциальная липодистрофия 4 типа (гетерозиготный вариант c.1210-1delG в гене PLIN1)» [ Код по МКБ-10: Е88.1];
осложнения основного заболевания: «Сахарный диабет вследствие семейной парциальной липодистрофии 4 типа в сочетании с HNF1A-MODY (гетерозиготный вариант с.1699G>А в гетерозиготном состоянии в гене HNF1A). Дислипидемия, гипертриглицеридемия. Неалкогольная жировая болезнь печени. Хронический панкреатит, ремиссия»;
осложнения сахарного диабета: «Непролиферативная диабетическая ретинопатия правого глаза. Препролиферативная диабетическая ретинопатия левого глаза. Дистальная диабетическая полинейропатия, сенсорная форма»;
сопутствующие заболевания: «Гипертоническая болезнь II стадии, 1 степени на фоне терапии, риск ССО 4. Миопия слабой степени обоих глаз. Диффузная фиброзно-кистозная мастопатия. Киста правой молочной железы. Мочекаменная болезнь: конкремент левой почки. Киста правой почки. ХБП С1А1. Липома/миофиброма левой голени. Нарушение менструального цикла репродуктивного возраста. Синдром поликистозных яичников».
На момент госпитализации пациентка получала многокомпонентную лекарственную терапию:
- гипогликемическая: инсулин гларгин 300 ЕД/мл 65 ЕД, инсулин аспарт + никотинамид + аргинин по 30–50 Ед из соотношения УК 1 ХЕ:5-10 ЕД, дополнительно 5–15 ЕД на коррекцию гипергликемии. Ранее сахароснижающая терапия значительно варьировалась с 2010 до 2023 г., в том числе в виду реклассификации диагноза на СД 1 типа (СД1) в 2012 г., последовательность изменений сахароснижающей терапии продемонстрирована в таблице 1, однако достичь компенсации углеводного обмена не удавалось на всем протяжении заболевания;
- антигипертензивная терапия: лозартан 100 мг/сут, амлодипин 10 мг/сут;
- гиполипидемическая терапия: фенофибрат 145 мг на ночь, розувастатин 20 мг на ночь;
- комбинированная эстроген-гестагенная контрацептивная терапия: этинилэстрадиол 30 мкг + дроспиренон 3 мг.
Таблица 1. Последовательность изменений сахароснижающей терапии и оценка ее эффективности с момента постановки диагноза «Сахарный диабет»
|
Дата |
Сахароснижающая терапия |
Эффективность терапии |
|
2010 год |
Глимепирид 2 мг/сут |
HbA1c — 9,5% |
|
2010 год (через 6 мес.) |
Глимепирид 2 мг/сут → 3 мг + Метформин 1000 мг/сут, + инсулин детемир 14 Ед вечером |
Данные не предоставлены |
|
2011 год |
Отменен метформин Глимепирид 3 мг → репаглинид 10 мг/сут |
HbA1c — 7,4% |
|
2012 год |
Базис-болюсная инсулинотерапия посредством шприц-ручек |
HbA1c — 8,0% |
|
2017 год |
Непрерывная инсулинотерапия при помощи помповой инсулинотерапии |
HbA1c - 9,3 % |
|
2018 год |
Базис-болюсная инсулинотерапия посредством шприц-ручек |
Данные не предоставлены |
|
2019 год |
+ Дапаглифлозин 10 мг/сут с последующей отменой через несколько месяцев (дискомфорт при мочеиспускании) |
HbA1c - 7,3 % |
Примечание. HbA1c — гликированный гемоглобин.
Однако, несмотря на многокомпонентную лекарственную терапию, по результатам биохимического анализа крови выявлен хилез, что не позволило оценить другие показатели анализов крови. В связи с высоким риском развития острого панкреатита (жалобы на момент госпитализации на боли в животе, тошноту, анамнестические данные о многократных обострениях панкреатита, текущий хилез), проведен 1 сеанс плазмафереза, внешний вид плазмы крови по окончании процедуры приведен на рисунке 1.

Рисунок 1. Внешний вид плазмы крови пациентки по окончании процедуры плазмафереза.
Учитывая неэффективность проводимой многокомпонентной терапии, 13.07.2023 г. в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ повторно был проведен медицинский консилиум, согласно которому рекомендовано инициировать лечение метрелептином. Лептин-заместительная терапия в регулярном режиме начата в сентябре 2024 г.
С июля 2023-го по январь 2024 гг. в НМИЦК им. ак. Е.И. Чазова МЗ РФ проводились регулярные процедуры липидной фильтрации. В связи со стойким снижением уровня триглицеридов до 3–4 ммоль/л проведение терапевтического афереза прекращено в январе 2024 г.
Динамика лабораторных показателей относительно приема патогенетической терапии представлена в таблице 2.
Таблица 2. Динамика метаболических показателей на фоне проводимого лечения
|
HbA1c (%) |
С-пептид, нг/мл |
Холестерин общий, ммоль/л |
Холестерин ЛПНП, ммоль/л |
Холестерин ЛПВП, ммоль/л |
Триглицериды, ммоль/л |
Креатинин, мкмоль/л |
СКФ (CKD-EPI), мл/мин/1,73 м² |
Альбумин/креатинин в моче, мг/ммоль |
||
|
10.2019 |
7,3 |
- |
4,1 |
2,449 |
0,678 |
2,48 |
65,4 |
108 |
0,78 |
|
|
06.2021 |
11,1 |
1,37 |
7,32 |
2,01 |
0,52 |
15,6 |
64,9 |
108 |
1,49 |
|
|
07.2023 |
8,8 |
- |
Хилез |
- |
23,1 |
|||||
|
Сахароснижающая терапия: инсулин гларгин 300 ЕД/мл 65 Ед вечером, инсулин аспарт 40–50 Ед перед основными приемами пищи, дополнительно 4–10 Ед для коррекции гипергликемии Инициация терапии метрелептином |
||||||||||
|
09.2023 |
Проведение сеансов липидной фильтрации |
- |
- |
5,60 |
1,35 |
0,5 |
13,24 |
65,5 |
105 |
- |
|
12.2023 (до сеанса) |
- |
- |
3,82 |
2,28 |
0,55 |
4,09 |
69,4 |
98 |
- |
|
|
12.2023 (после сеанса) |
- |
- |
1,63 |
0,86 |
0,42 |
1,67 |
61,4 |
113 |
- |
|
|
01.2024 |
- |
- |
0,86 |
0,42 |
1,67 |
- |
- |
- |
||
|
05.2024 |
Сахароснижающая терапия: инсулин гларгин 300 ЕД/мл 30–40 Ед вечером, инсулин лизпро 20–30 Ед перед основными приемами, исходя из расчета углеводного коэффициента 1ХЕ:3 Ед перед завтраком и обедом, 1ХЕ:2,5 Ед перед ужином, дополнительно 2–8 Ед для коррекции гипергликемии Последняя инъекция метрелептина (отмена в связи с наступлением беременности) |
|||||||||
|
06.2024 |
8,0 |
- |
3,5 |
2,0 |
0,69 |
1,8 |
60,8 |
Не применимо |
0,63 |
|
|
Сахароснижающая терапия: инсулин гларгин 300 ЕД/мл 45–55 Ед вечером, инсулин лизпро 40–50 Ед перед основными приемами, исходя из расчета углеводного коэффициента 1ХЕ:6 Ед перед завтраком и обедом, 1ХЕ:5 Ед перед ужином, дополнительно 6–15 Ед для коррекции гипергликемии |
||||||||||
|
09.2024 |
- |
- |
6,36 |
2,6 |
0,52 |
15,1 |
54,6 |
Не применимо |
- |
|
Весной 2024 г. пациентка самостоятельно прекратила прием прогестерона и КОК, на фоне чего наступила беременность (по данным УЗИ ОМТ от 03.06.2024 г. УЗ-признаки прогрессирующей маточной беременности 6 недель 5 дней), ввиду чего терапия метрелептином была приостановлена (последняя инъекция метрелептина выполнена 27.05.2024 г.).
Принимая во внимание беременность и отсутствие компенсации основного заболевания, в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ была произведена коррекция терапии, включающая увеличение дозы инсулина длительного действия, уточнена потребность в прандиальном инсулине в разное время суток, с целью коррекции гипергликемических состояний в ночные часы рекомендовано выполнение инъекций ИУКД. Принимаемая ранее антигипертензивная терапия была скорректирована, инициирована терапия антигипертензивным препаратом центрального действия метилдопой, на фоне чего показатели АД находились в пределах целевых значений. К терапии добавлены фолиевая кислота 400 мкг/сут, калия йодид 200 мкг/сут, рекомендован приема колекальциферола 500 МЕ/сут.
В ГНЦ РФ ФГБУ «НМИЦ эндокринологии» МЗ РФ проведен медицинский консилиум, по результатам которого, учитывая наличие беременности сроком 8 недель, несмотря на наличие тяжелого, прогрессирующего орфанного заболевания принято решение приостановить патогенетическую терапию аналогом лептина — метрелептином вплоть до родоразрешения. Принимая во внимание высокий риск осложнений, в том числе острого панкреатита, низкую эффективность консервативного лечения, а также противопоказание к приему таких классов гиполипидемических препаратов, как статины и фибраты в виду беременности, для коррекции метаболических нарушений до момента возобновления терапии метрелептином целесообразно проведение симптоматической терапии, в том числе сеансов липопротеинового афереза (липидной плазмофильтрации). Для решения вопроса о периодичности сеансов афереза была проведена консультация кардиолога, специализирующегося на дислипидемиях, рекомендован контроль показателей липидного спектра с частотой 1 раз в 2 недели.
Пациентка была предупреждена о возможных рисках для плода (перинатальная смертность) и отсроченных неблагоприятных последствиях для новорожденного (пороки развития), связанных с зачатием ребенка на фоне приема метрелептина и антагониста рецепторов ангиотензина II, проинформирована о возможности развития пороков и фетопатий плода в связи с декомпенсацией углеводного обмена на момент наступления беременности, связанной с отсутствием подготовки к беременности на прегравидарном этапе, а также предупреждена о возможном дальнейшем ухудшении состояния компенсации липидного обмена с последующим высоким риском развития осложнений, связанным с временной отменой патогенетической терапии на период гестации. Принимая во внимание состояние здоровья пациентки, с целью минимизации возможных рисков рекомендован мультидисциплинарный подход к ведению беременности, а также приверженность к назначенной терапии.
На момент октября 2024 г.: беременность 25–26 неделя (рис. 2), пациентка соблюдает все предписанные рекомендации врачей. Зафиксирована положительная тенденция в достижении целевых показателей углеводного обмена (рис. 3), однако у пациентки отмечено ухудшение показателей липидного обмена (триглицериды 10–16,0 ммоль/л), в виду чего 10.10.2024 г. в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии им. академика В.И. Кулакова выполнен сеанс липопротеинового плазмафереза.
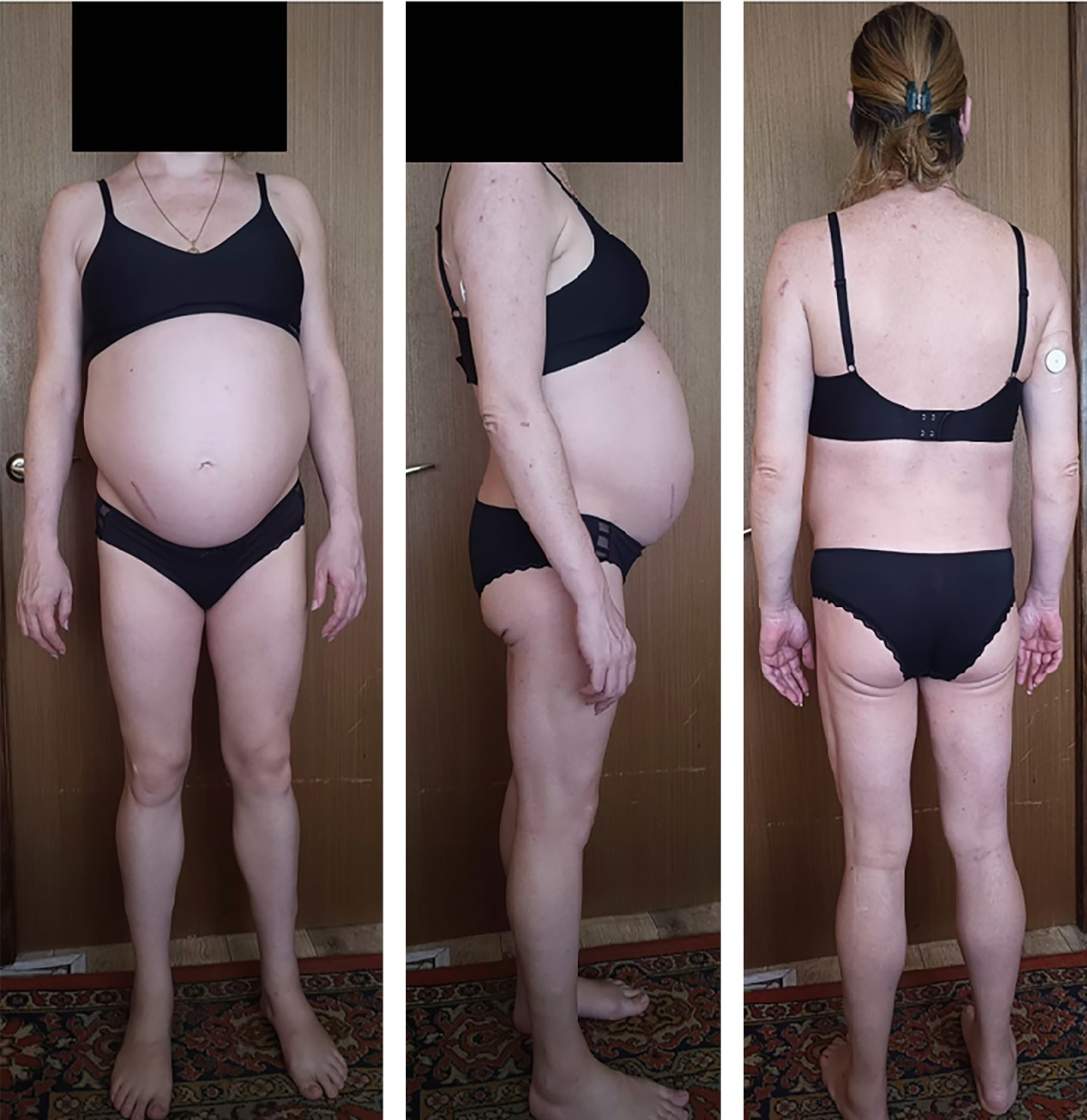
Рисунок 2. Фенотипические особенности пациентки О.
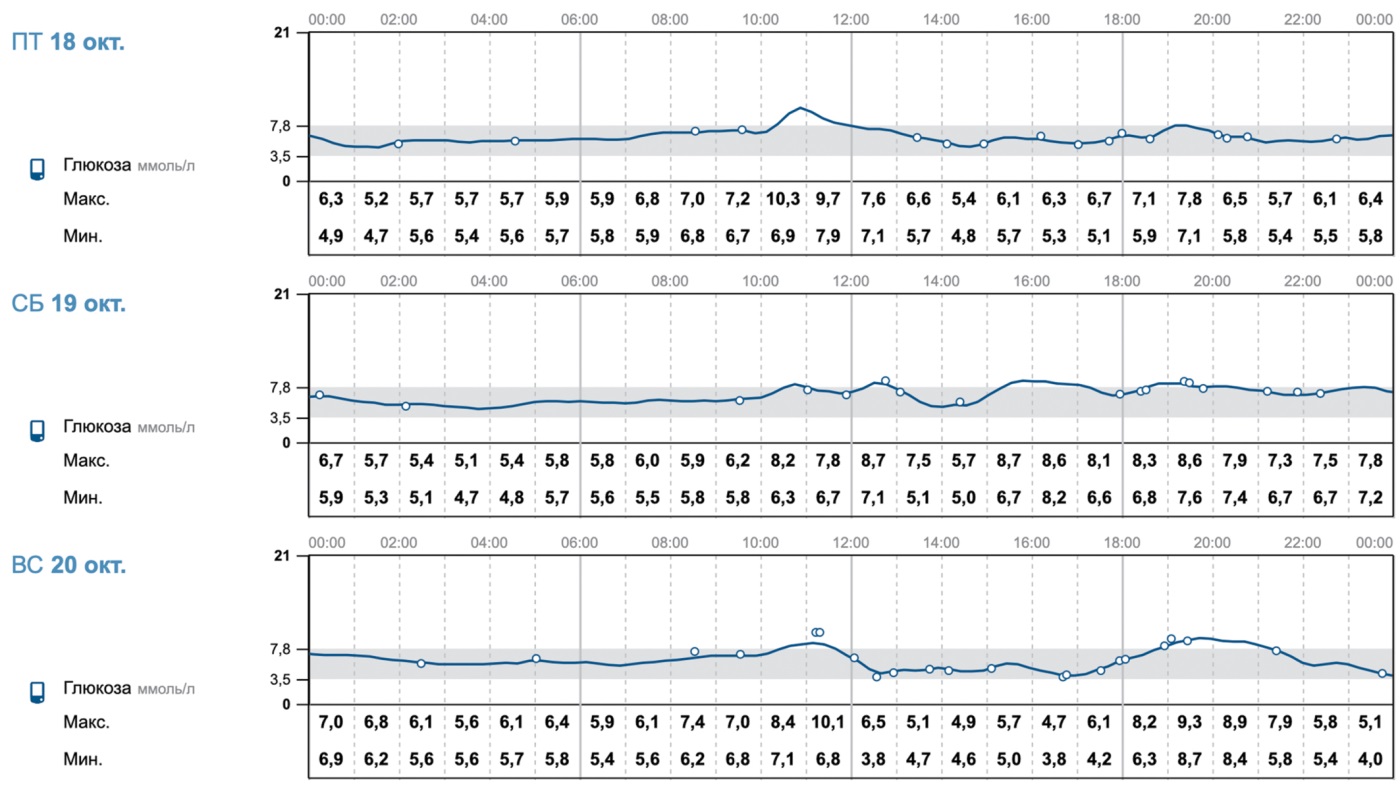
Рисунок 3. Показатели углеводного обмена пациентки О. на фоне коррекции
ОБСУЖДЕНИЕ
Синдромы липодистрофий ассоциированы с полной или частичной потерей подкожной жировой клетчатки, которая является местом синтеза лептина — гормона, ответственного за регуляцию энергетического гомеостаза, метаболизма и иммунной реакции благодаря своему воздействию на центральную нервную систему и периферические ткани. Именно гиполептинемия, обусловленная прямой зависимостью степени продукции гормона от содержания жировой ткани, является причиной метаболических нарушений, связанных с липодистрофией [5].
Метрелептин является препаратом патогенетической терапии, используемой при генерализованной липодистрофии, а также у пациентов с парциальной липодистрофией, у которых симптоматическое лечение не позволило достичь адекватного метаболического контроля заболевания [6]. Данный препарат аналогично действию эндогенного лептина влияет на энергетические процессы путем механизмов, направленных на коррекцию нарушений углеводного (снижение глюконеогенеза в печени и жировой ткани, усиление утилизации глюкозы в скелетных мышцах) и липидного (усиление окисления жирных кислот, уменьшение эктопического накопления липидов в печени и мышцах) обменов, а также контроля над чувством голода посредством воздействия на дугообразное ядро в гипоталамусе, подавляя секрецию орексигенных нейропептидов и стимулируя секрецию анорексигенных нейропептидов [7]. Благодаря описанным выше механизмам действия препарата удается достичь коррекции метаболических нарушений, нивелируя негативное влияние глюкозо- и липотоксичности на организм пациента, и повысить качество и продолжительность жизни таких пациентов. Вопрос влияния на продолжительность жизни пациентов с липодистрофиями социально значим, основными причинами смертности среди данной когорты пациентов являются кардиоваскулярные заболевания (кардиомиопатии, инфаркт миокарда, различные нарушения ритма сердца), рецидивирующие панкреатиты, заболевания печени, в том числе цирроз, который может осложняться геморрагическим синдромом и гепатоцеллюлярная карцинома. Помимо тяжелых органных осложнений важно помнить, что фенотип таких пациентов влияет на их эмоциональный фон, порождая неудовлетворенность в собственной внешности и суицидальные мысли [6].
K. Cook и соавт. провели исследование, оценивающее влияние терапии метрелептином на качество жизни пациентов с генерализованной и парциальной липодистрофиями. Анализ базировался на данных медицинских карт пациентов, получавших лечение в течение 12 месяцев, а также на результатах опроса здоровых добровольцев. Изучались изменения симптомов до и после терапии, а также их влияние на качество жизни. В эксперименте здоровые респонденты выбирали между гипотетическими профилями здоровья, различающимися по степени нарушений и продолжительности жизни. Эти данные были сопоставлены с клиническими показателями для расчета прироста качественно скорректированных лет жизни (QALY) — показателя, отражающего продолжительность и качество жизни, с учетом улучшений, достигнутых благодаря лечению. Результаты показали прирост QALY: на 0,313 для генерализованной формы и 0,117 для парциальной. Таким образом, терапия метрелептином сократила разрыв между состоянием пациентов, не получающих патогенетическое лечение, и идеальным здоровьем примерно на 59 и 31% соответственно [5].
Одним из характерных проявлений липодистрофий является СПЯ, обусловленный выраженной инсулинорезистентностью, являющейся ключевым медиатором образования кист яичников и причиной чрезмерной продукции андрогенов яичниками. СПЯ сопровождается такими клиническими проявлениями, как нарушения менструального цикла и репродуктивная дисфункция, обусловленная хронической ановуляцией, одним из механизмов развития которой является вызванная инсулином преждевременная фолликулярная атрезия и остановка дифференцировки на уровне антрального фолликула [8][9]. Помимо стимулирующего выработку андрогенов влияния инсулина на тека-клетки за счет повышенной активности Р450с 17 (17агидроксилаза/17,20-лиаза), в яичниках имеются рецепторы инсулиноподобного фактора роста 1 (ИФР-I), избыточное воздействие инсулина на которые может приводить к развитию гиперандрогении [9][10][11]. В гиперандрогении, обусловленной инсулинорезистентностью, отдельное место отводится ингибирующему влиянию, оказываемому инсулином на синтез глобулина, связывающего половые гормоны (ГСПГ), приводя к увеличению концентрации свободных андрогенов и, следовательно, действию периферического андрогена [9]. Известно также, что инсулин является фактором, стимулирующим секрецию андрогенов, в частности тестостерона, стимулируя экспрессию рецепторов к гонадотропин-рилизинг гормону (ГнРГ) в гипофизе, что усиливает выброс ЛГ [12]. В научной литературе приводятся данные, подтверждающие генетическую теорию СПЯ, однако среди предполагаемых генов не отмечено вариантов, ответственных за развитие синдромов липодистрофий [8].
В статье H. Mosbah, и соавт. приводятся данные, что именно жалобы гинекологического характера (60% опрошенных женщин заявили о нерегулярных менструациях, 24% — о нарушениях фертильности) мотивируют пациенток обращаться за консультацией к специалистам. Информированность врачей-гинекологов о синдромах липодистрофий приводит к верному диагностическому поиску и впоследствии клиническому диагнозу [13]. В литературном обзоре M.C. Vantyghem, и соавт. демонстрируются данные о том, что у пациенток с липодистрофиями частота бесплодия была выше, чем у женщин с СПЯ с аналогичным ИМТ, а уровень акушерских осложнений был не только выше, чем в общей популяции, но и выше, чем у пациенток с СПЯ без липодистрофии [14].
Помимо описанных выше механизмов развития СПЯ, еще одним механизмом является гиполептинемия, которая совместно с низкими уровнями адипонектина и интерлейкина-6, а также повышенным содержанием в крови фактора некроза опухоли -альфа (ФНО-α) способствует усилению инсулинорезистентности у пациенток с липодистрофиями и приводит к потере пульсирующей секреции гонадотропинов, что влияет на нерегулярную стимуляцию ЛГ, необходимого для нормальной работы репродуктивной системы [8][15]. Эффект влияния низкого уровня лептина на ультрадианический ритм секреции гонадотропина был доказан в ходе эксперимента на животных, а также на клетках яичников человека, подвергшихся воздействию лептина in vitro [11][16]. Экзогенное введение лептина может восстановить фертильность, однако M.C. Vantyghem, и соавт. приводят данные, что не только низкий уровень лептина, но и гиперлептинемия способствует снижению фертильности [14].
Лечение СПЯ осуществляется согласно международным или локальным клиническим рекомендациям, в соответствии с которыми в лечении данного синдрома применяются инсулиносенсибилизирующие методы терапии, такие как снижение массы тела или прием метформина. Основной линией лечения СПЯ является гормональная терапия КОК, однако применение препаратов данной группы ограничено у пациенток с подтвержденным диагнозом синдрома липодистрофии, что обусловлено влиянием эстрогенов на риск развития гипертриглицеридемии и как следствие последней — панкреатита и панкреонекроза [6]. Согласно международным консенсусам по ведению пациентов с синдромами липодистрофии [6], с целью коррекции нарушений менструального цикла рекомендовано применение препаратов прогестагенового ряда; для контрацепции следует рассмотреть возможность использования только прогестиновых или негормональных препаратов. При необходимости заместительной терапии эстрогенами, следует использовать трансдермальные формы, что является предпочтительным ввиду отсутствия метаболизма в печени данной группы препаратов и меньшего влияния на триглицериды [6][17].
Пациенткам с наследственными липодистрофиями особенно важно проводить прегравидарную подготовку с целью снижения гестационных и эмбриональных рисков. Сниженный уровень эндогенного лептина приводит к нарушению фертильности [7]. Согласно инструкции к метрелептину, имеются данные о повышении фертильности среди принимающих данный препарат пациенток и увеличении случаев незапланированной беременности. Такое влияние на репродуктивную функцию женщин обусловлено воздействием метрелептина на секрецию ЛГ [18]. Лептин за счет повышения экспрессии кисспептина — нейропептида, участвующего в процессах эндокринной регуляции репродукции, опосредованно приводит к усилению синтеза ГнРГ в медиальном базальном отделе гипоталамуса, за счет чего повышается высвобождение ЛГ из передней доли гипофиза, что в свою очередь оказывает стимулирующее влияние на выработку половых стероидов, устраняя проявления гипогонадотропного гипогонадизма [12]. Помимо вышеупомянутых эффектов, лептин оказывает прямое влияние на развитие фолликула, ооцита и эмбриона, а также на рецептивность эндометрия [16]. Полученные в ходе эксперимента данные показали, что у мышей, имеющих низкую фертильность, ожирение и подтвержденный дефицит лептина, невозможно было индуцировать овуляцию немедикаментозным путем (диетотерапия, направленная на уменьшение жировой ткани и снижение инсулинорезистентности). Восстановить фертильность и зачать потомство удалось только на фоне введения экзогенного лептина. Теми же авторами приводятся данные о пациентках с гипоталамической аменореей, введение лептина которым привело к восстановлению овуляторных менструальных циклов [16].
Зарубежные авторы публикуют результаты, полученные в ходе проводимых in vitro исследований, что на фоне терапии метрелептином увеличивалась ночная секреция ЛГ, в то время как дневная концентрация ЛГ не изменялась. Помимо этого, отмечалось возраст-зависимое увеличение ГнРГ-стимулированного выброса ЛГ [12]. Однако в исследовании C. Musso, и соавт. получены данные о независимом влиянии лептина на гипоталамо-гипофизарно-гонадную ось: отсутствие каких-либо изменений в уровнях базального ЛГ, фолликулостимулирующего гормона (ФСГ) или соотношении ЛГ/ФСГ на фоне годовой терапии метрелептином [10].
Таким образом, метрелептин способствует восстановлению фертильности за счет коррекции инсулинорезистентности, гиперандрогении и улучшения секреции ЛГ у пациенток с синдромами липодистрофии [12].
Однако несмотря на приведенные выше научные публикации, достоверных данных о влиянии метрелептина на течение беременности и состояние здоровья вынашиваемого плода крайне мало. Ранее были зарегистрированы случаи мертворождения и преждевременных родов среди женщин, получающих патогенетическую терапию данным препаратом, которые подтверждались экспериментальными данными на животных моделях. Впоследствии корреляционная зависимость не была подтверждена, однако риск эмбриотоксичного, фетотоксичного и тератогенного влияния препарата не может быть целиком исключен [18]. В научной литературе ранее был опубликован клинический случай спонтанного зачатия у молодой пациентки с врожденной генерализованной липодистрофией, длительное время находящейся на терапии метрелептином и продолжившей ее на протяжении всего срока гестации. Авторы статьи утверждают, что терапия метрелептином не только не оказала тератогенного действия, но и улучшила метаболический контроль во время беременности. Исходом данного клинического случая является рождение живого ребенка. Однако макросомия плода, резвившаяся в следствие неудовлетворительного гликемического контроля во время беременности привела к родовому травматизму новорожденного [16].
На данный момент проводится клиническое исследование (ClinicalTrials.gov ID NCT05419037), целью которого является получение объективных данных о необходимости и безопасности приема препарата во время беременности, об акушерском прогнозе оценке частоты метаболических осложнений липодистрофий на фоне отсутствия приема метрелептина в сравнении с группой пациенток, получающих метрелептин во время всего срока гестации. Помимо этого, одной из целей данного исследования является определение наличия в организме детей, рожденных от женщин, получавших метрелептин во время беременности, антител к лептину и их возможного отсроченного влияния на организм [19].
При анализе научной литературы за временной период с 2000 до 2024 гг. не было обнаружено ни одного случая описания пациенток с сочетанием таких редких генетических заболеваний, как синдром парциальной липодистрофии и MODY3. Мы впервые публикуем описание клинического случая пациентки, с сочетанием эти орфанных заболеваний. Согласно особенностям наследования, вероятность рождения ребенка, унаследовавшего оба орфанных заболевания от матери, равняется 25%, как и вероятность не унаследовать ни одного из описанных выше заболеваний или одно из них.
С целью поддержания репродуктивного здоровья у пациенток с липодистрофиями им должна оказываться профессиональная акушерско-гинекологическая и репродуктивная медицинская помощь специалистами, осведомленными о таком диагнозе, а также медикогенетическое консультирование при наличии условий для его проведения.
ЗАКЛЮЧЕНИЕ
Учитывая многогранность клинических проявлений липодистрофий, вариабельность терапевтических тактик в отношении компенсации метаболических осложнений, необходимо проводить разъяснительные беседы с пациентками репродуктивного возраста о планировании беременности, возможных рисках как для матери, так и Для плода, обусловленных не достижением полного метаболического контроля (преэклампсия, выкидыши, макросомия плода), подробно излагать информацию о возможных методах индукции овуляции и методах контрацепции.
Благоприятное протекание беременности в случае описанной нами пациентки достигнуто благодаря мультидисциплинарному подходу в ведении такой категории больных, в котором принимала участие команда специалистов, состоящих из эндокринологов, кардиологов, липидологов, акушеров-гинекологов, а также благодаря высокой мотивации, комплаентности пациентки, обусловленными доверием к рекомендациям специалистов. Однако остается ряд вопросов о рисках и пользе как для матери, так и Для плода, вероятности отсроченных последствий данной терапии и наличии альтернативных методов лечения парциальных липодистрофий. Необходимы дальнейшие клинические исследования в области молекулярно-генетических основ развития наследственных липодистрофий, моногенных форм СД, а также достоверно доказанной возможности ведения беременности на фоне приема патогенетической терапии в условиях отсутствия эмбриотоксичности. После родоразрешения планируется проведение генетического обследования ребенка с последующей публикацией дополнительных данных.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Финансирование. Работа была выполнена по инициативе авторов без спонсорской поддержки.
Вклад авторов: Фролкова Н.В., Радкевич Е.Р. — анализ медицинской документации пациентки, литературных данных и написание текста; Кокшарова Е.О. — разработка концепции, анализ литературных данных, окончательное утверждение для публикации рукописи; Бурумкулова Ф.Ф. — анализ полученных данных, написание текста; Васильев П.А., Минниахметов И.Р. — анализ данных молекулярно-генетических анализов, редактирование текста, окончательное утверждение для публикации рукописи; Еремина И.А. — анализ литературных данных, окончательное утверждение для публикации рукописи; Шестакова М.В. — разработка концепции и дизайна, анализ литературных данных, окончательное редактирование текста и утверждение для публикации рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Согласие пациентки. Авторы настоящей статьи получили письменное разрешение от упомянутой в статье пациентки на публикацию ее медицинских данных и фотографий в журнале «Сахарный диабет».
Список литературы
1. Соркина Е.Л., Тюльпаков А.Н. Наследственные и приобретенные липодистрофии: молекулярно-генетические и аутоиммунные механизмы // Ожирение и метаболизм. — 2018. — Т.15. — №1. — С. 39-42. doi: https://doi.org/10.14341/omet2018139-42
2. Patni N, Garg A. Lipodystrophy for the DiabetologistWhat to Look For. Curr Diab Rep. 2022;22(9):461-470. doi: https://doi.org/10.1007/s11892-022-01485-w
3. Hussain I, Patni N, Garg A. Lipodystrophies, dyslipidaemias and atherosclerotic cardiovascular disease. Pathology. 2019;51(2):202-212. doi: https://doi.org/10.1016/j.pathol.2018.11.004
4. Рыжкова О.П., Кардымон О.Л., Прохорчук Е.Б., и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2) // Медицинская генетика. — 2019. — Т. 18. — №2. — С. 3-23. doi: https://doi.org/10.25557/2073-7998.2019.02.3-23
5. Cook K, Adamski K, Gomes A, et al. Effects of Metreleptin on Patient Outcomes and Quality of Life in Generalized and Partial Lipodystrophy. J Endocr Soc. 2021 Feb 16;5(4):bvab019. doi: https://doi.org/10.1210/jendso/bvab019
6. Brown RJ, Araujo-Vilar D, Cheung PT, et al. The Diagnosis and Management of Lipodystrophy Syndromes: A Multi-Society Practice Guideline. J Clin Endocrinol Metab. 2016;101(12):4500-4511. doi: https://doi.org/10.1210/jc.2016-2466
7. von Schnurbein J, Zorn S, Nunziata A, et al. Classification of Congenital Leptin Deficiency. J Clin Endocrinol Metab. 2024;109(10):2602-2616. doi: https://doi.org/10.1210/clinem/dgae149
8. Joy TR, Hegele RA. Prevalence of reproductive abnormalities among women with familial partial lipodystrophy. Endocr Pract. 2008;14(9):1126-32. doi: https://doi.org/10.4158/EP.14.9.1126
9. Gambineri A, Zanotti L. Polycystic ovary syndrome in familial partial lipodystrophy type 2 (FPLD2): basic and clinical aspects. Nucleus. 2018;9(1):392-397. doi: https://doi.org/10.1080/19491034.2018.1509659
10. Musso C, Cochran E, Javor E, et al. The long-term effect of recombinant methionyl human leptin therapy on hyperandrogenism and menstrual function in female and pituitary function in male and female hypoleptinemic lipodystrophic patients. Metabolism. 2005;54(2):255-63. doi: https://doi.org/10.1016/j.metabol.2004.08.021
11. Lungu AO, Zadeh ES, Goodling A, et al. Insulin resistance is a sufficient basis for hyperandrogenism in lipodystrophic women with polycystic ovarian syndrome. J Clin Endocrinol Metab. 2012;97(2):563-7. doi: https://doi.org/10.1210/jc.2011-1896
12. Abel BS, Muniyappa R, Stratton P, et al. Effects of Recombinant Human Leptin (Metreleptin) on Nocturnal Luteinizing Hormone Secretion in Lipodystrophy Patients. Neuroendocrinology. 2016;103(3-4):402-7. doi: https://doi.org/10.1159/000439432
13. Mosbah H, Vatier C, Andriss B, et al. Patients’ perspective on the medical pathway from first symptoms to diagnosis in genetic lipodystrophy. Eur J Endocrinol. 2024;190(1):23-33. doi: https://doi.org/10.1093/ejendo/lvad169
14. Vantyghem MC, Vincent-Desplanques D, Defrance-Faivre F, et al. Fertility and obstetrical complications in women with LMNArelated familial partial lipodystrophy. J Clin Endocrinol Metab. 2008;93(6):2223-9. doi: https://doi.org/10.1210/jc.2007-2521
15. Patni N, Garg A. Congenital generalized lipodystrophies--new insights into metabolic dysfunction. Nat Rev Endocrinol. 2015;11(9):522-34. doi: https://doi.org/10.1038/nrendo.2015.123
16. Maguire M, Lungu A, Gorden P, Cochran E, Stratton P. Pregnancy in a woman with congenital generalized lipodystrophy: leptin’s vital role in reproduction [published correction appears in Obstet Gynecol. 2013 Jul;122(1):160]. Obstet Gynecol. 2012;119(2 Pt 2):452-455. doi: https://doi.org/10.1097/AOG.0b013e31822cecf7
17. Fourman LT, Lima JG, Simha V, et al. A rapid action plan to improve diagnosis and management of lipodystrophy syndromes. Front Endocrinol (Lausanne). 2024;15:1383318. doi: https://doi.org/10.3389/fendo.2024.1383318
18. Myalept [Internet]. Summary of Product Characteristics. 2020 [cited 6 Jul 2020]. Available from: https://www.ema.europa.eu/en/documents/product-information/myalepta-epar-product-information_en.pdf
19. US Clinical Trials Registry [интернет]. Clinical Trial NCT05419037 «Natural History of Pregnancy and Pregnancy Outcomes in Metreleptin-Treated vs Untreated Subjects With Lipodystrophy» [доступ от 23.10.2024]. Доступно по ссылке: https://ichgcp.net/clinical-trials-registry/NCT05419037
Об авторах
Н. В. ФролковаРоссия
Фролкова Надежда Викторовна – аспирант.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Нет
Е. Р. Радкевич
Россия
Радкевич Елизавета Романовна - клинический ординатор.
Москва
Конфликт интересов:
Нет
Е. О. Кокшарова
Россия
Кокшарова Екатерина Олеговна - н.с.
Москва
Конфликт интересов:
Нет
Ф. Ф. Бурумкулова
Россия
Бурумкулова Фатима Фархадовна - д.м.н., в.н.с.
Москва
Конфликт интересов:
Нет
П. А. Васильев
Россия
Васильев Петр Андреевич - н.с.
Москва
Scopus ID 57202745394; WoS Researcher ID AAN-4520-2020
Конфликт интересов:
Нет
И. Р. Минниахметов
Россия
Минниахметов Илдар Рамилевич - к.б.н.
Москва
Конфликт интересов:
Нет
И. А. Еремина
Россия
Еремина Ирина Александровна - к.м.н.
Москва
Researcher ID S-3979-2016; Scopus Author ID 6701334405
Конфликт интересов:
Нет
М. В. Шестакова
Россия
Шестакова Марина Владимировна - д.м.н., профессор, академик РАН.
Москва
Scopus Author ID 7004195530
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Внешний вид плазмы крови пациентки по окончании процедуры плазмафереза. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(453KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Фенотипические особенности пациентки О. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(845KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Показатели углеводного обмена пациентки О. на фоне коррекции инсулинотерапии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(663KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Фролкова Н.В., Радкевич Е.Р., Кокшарова Е.О., Бурумкулова Ф.Ф., Васильев П.А., Минниахметов И.Р., Еремина И.А., Шестакова М.В. Клинический случай беременности пациентки с сочетанием двух орфанных заболеваний: семейной парциальной липодистрофии 4 типа и HNF1A-MODY на фоне лептин-заместительной терапии. Сахарный диабет. 2025;28(3):305-315. https://doi.org/10.14341/DM13333
For citation:
Frolkova N.V., Radkevich E.R., Koksharova E.O., Burumkulova F.F., Vasiliev P.A., Minniakhmetov I.R., Eremina I.A., Shestakova M.V. A clinical case of pregnancy of a patient with a combination of two orphan diseases: familial partial lipodystrophy type 4 and HNF1A-MODY on the background of therapy with recombinant human methionyl leptin. Diabetes mellitus. 2025;28(3):305-315. (In Russ.) https://doi.org/10.14341/DM13333
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































