Перейти к:
Органопротективные возможности финеренона у пациентов с кардиоренометаболическим синдромом
https://doi.org/10.14341/DM13330
Аннотация
Сахарный диабет 2 типа (СД2) сопровождается гиперактивацией ренин-альдостерон-ангиотензиновой системы (РААС) и повышенной концентрацией альдостерона в крови, что приводит к развитию и прогрессированию хронической болезни почек (ХБП) и хронической сердечной недостаточности (ХСН). Высокие уровни альдостерона, усиливая инсулинорезистентность, вызывают нарушение микроциркуляции, митохондриальную дисфункцию, окислительный стресс, воспаление, дислипидемию и в итоге фиброз. Кроме того, у пациентов с СД2 в условиях персистирующего окислительного стресса и гипергликемии, даже в отсутствие избытка альдостерона или кортизола, запускается процесс патологической гиперактивации минералокортикоидных рецепторов (МКР), замыкающий порочный круг и усиливающий воспалительные и фиброзные изменения в сердце и почках пациента. В этой связи таргетная блокада МКР наиболее актуальна для снижения активности фиброза — наименее обратимого изменения при ХБП и ХСН. Однако спиронолактон не является строго селективным антагонистом МКР, что обуславливает множество его побочных эффектов, а эплеренон, обладая большей селективностью, имеет более низкое сродство к МКР, что обуславливает его более слабый кардиопротективный эффект. Финеренон — первый нестероидный антагонист МКР, рекомендуемый для лечения ХБП (с альбуминурией) у взрослых пациентов с СД2, обеспечивает наиболее выраженный противовоспалительный и антифиброзный эффект и не обладает побочными эффектами стероидных антагонистов МКР.
Целью настоящего обзора стала оценка результатов клинических исследований влияния финеренона на сердечно-сосудистые и почечные события у пациентов с СД2. В обзоре представлена и проанализирована актуальная информация о влиянии финеренона на сердечно-сосудистые и почечные события у пациентов с СД2. Систематизированы и описаны дополнительные положительные кардиопротективные эффекты при применении финеренона.
Ключевые слова
Для цитирования:
Бабенко А.Ю., Засыпкин Г.Г. Органопротективные возможности финеренона у пациентов с кардиоренометаболическим синдромом. Сахарный диабет. 2025;28(3):284-294. https://doi.org/10.14341/DM13330
For citation:
Babenko A.Y., Zasypkin G.G. The organoprotective effects of finerenone in patients with cardiorenal metabolic syndrome. Diabetes mellitus. 2025;28(3):284-294. (In Russ.) https://doi.org/10.14341/DM13330
ВВЕДЕНИЕ
В рамках кардиоренометаболического синдрома отмечается частое сочетание сахарного диабета 2 типа (СД2), хронической сердечной недостаточности (ХСН), хронической болезни почек (ХБП), которые взаимно усугубляют течение друг друга [1][2] (рис. 1). СД2 является самой частой причиной ХБП [3] и частой причиной ХСН, особенно фенотипа с сохраненной фракцией выброса левого желудочка [4]. Сочетание СД2 и ХБП дополнительно удваивает риск развития ХСН [5]. Это диктует необходимость комплексного подхода к лечению коморбидных пациентов с СД2, ХБП и ХСН путем назначения препаратов, обладающих как кардио-, так и нефропротективными эффектами [6].
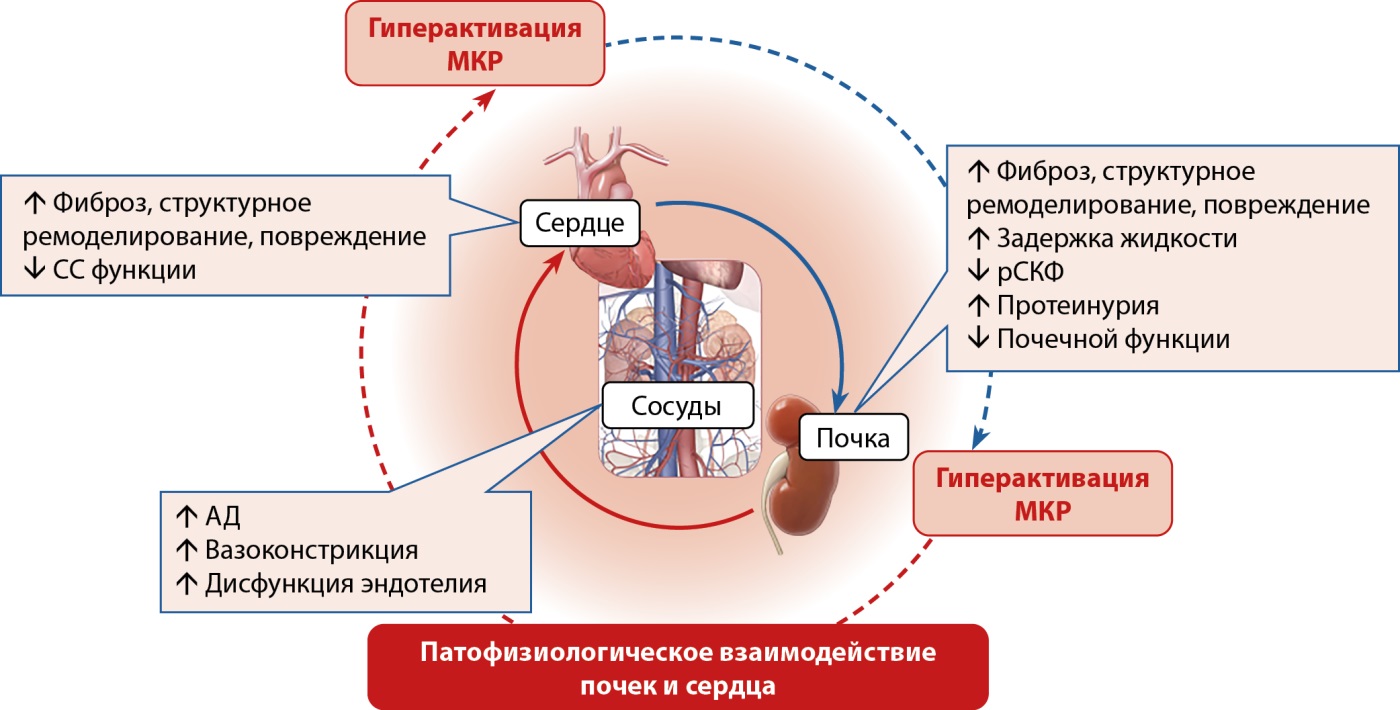
Рисунок 1. Патофизиологическое взаимодействие заболеваний почек и сердца.
Примечание. АД — артериальное давление; МКР — минералокортикоидные рецепторы; СС — сердечно-сосудистая; рСКФ — расчетная скорость клубочковой фильтрации.
Пациенты с СД2 характеризуются патологической гиперактивацией ренин-альдостерон-ангиотензиновой системы (РААС) и имеют повышенные концентрации альдостерона в крови [7]. На моделях мышей показано, что локальная секреция адипоцитами ангиотензиногена увеличивается при избыточном кормлении, что приводит к увеличению локального образования ангиотензина II (АТ II). Кроме того, связь между массой жировой ткани и артериальным давлением (АД) можно напрямую объяснить повышенной секрецией ангиотензиногена адипоцитами [8]. Известно, что жировая ткань продуцирует огромное количество эндокринных и воспалительных факторов, включая ангиотензиноген, АТ II и множество воспалительных факторов, активирующих РААС, продукция которых нарастает вместе с экспансией жировой ткани. Избыточная продукция АТ II и активация рецептора АТ II 1 типа приводит к увеличению выработки альдостерона, который еще больше ухудшает передачу сигналов инсулина, тем самым усиливая инсулинорезистентность и замыкая порочный круг, ведущий к прогрессии метаболического синдрома и развитию СД2. АТ II также может вызывать резистентность к инсулину, препятствуя стимулированному инсулином увеличению активности фосфатидилинозитол-3-киназы (PI3K), связанной с рецептором инсулина 1 типа. Важное место в реализации патологических эффектов РААС является ее локальная активация в тканях. Так, дополнительным компонентом в эффектах РААС на развитие СД является активация РААС в островках поджелудочной железы человека, экспрессия рецепторов которой чувствительна к концентрации глюкозы, а ингибирование связано со снижением окислительного стресса и улучшением секреции инсулина [9]. По мере формирования СД происходит гиперактивация локальной РААС в почках, увеличивается тканевая продукция АТ II [10][11], что приводит к развитию ХБП по механизмам, описанным далее.
Таким образом, хотя основным источником альдостерона является клубочковая зона коры надпочечников, под воздействием паракринных факторов альдостерон может продуцироваться многими структурами почки, включая проксимальные канальцы, плотное пятно (macula densa) и мезангий, а также адипоцитами жировой ткани ренального синуса. Повышенный уровень альдостерона напрямую стимулирует экспрессию минералокортикоидных рецепторов (МКР), их активацию и перемещение к ядру, где этот гормон-рецепторный комплекс регулирует транскрипцию генов и синтез белков, приводящих к повышению активности процессов воспаления и фиброза. Альдостерон также обеспечивает быстрые негеномные эффекты гиперактивации МКР, локализованных в эпителиальных клетках почечных канальцев: такие как задержка натрия и воды, усиление окислительного стресса, митохондриальная дисфункция и инсулинорезистентность. Эти эффекты опосредованы активацией протеинкиназы C и янк-киназы [12][13]. МКР также экспрессируются в тканях вне почки, включая гладкие мышцы кровеносных сосудов и эндотелиальные клетки [14], фибробласты [15] и моноциты [16]. Таким образом, блокада РААС, снижая уровень АТ II в жировой ткани, тканях почки и поджелудочной железы, благотворно влияет как на чувствительность к инсулину, так и на сердечно-сосудистую и почечную функцию у пациентов с СД.
Между тем МКР могут активироваться и альдостероном, и кортизолом, и этот процесс модулируется 11-бета-гидроксистероиддегидрогеназой 2 (11β-ГСД 2). В клетках, экспрессирующих 11β-ГСД 2, например, в эндотелиальных и гладкомышечных клетках, альдостерон является основным лигандом для МКР. Инактивируя кортизол, 11β-ГСД 2 позволяет альдостерону выборочно активировать сосудистые МКР [17][18]. Аномальная активация 11β-ГСД 1, фермента, преобразующего кортизон в кортизол, играет значительную роль в развитии инсулинорезистентности и метаболического синдрома [19]. Гиперактивность 11β-ГСД 1 приводит к увеличению тканевого уровня кортизола и индукции воспаления, фиброза, окислительного стресса и развитию диабетической нефропатии. Недавно было показано, что гиперактивность 11β-ГСД приводит к повышенной внутриклеточной продукции кортизола у пациентов с СД2, и в еще в большей степени у пациентов с ХБП на фоне СД2 [19]. Кроме того, гипергликемия при СД2 индуцирует активацию протеинкиназы C, что сопровождается повышением активности МКР [20]. МКР влияют на передачу инсулиновых сигналов в почке, включая мезангиальные клетки, подоциты и эпителиальные клетки канальцев [21]. Эти патофизиологические механизмы ухудшают передачу сигналов инсулина в почке, напрямую вызывая почечную дисфункцию, особенно на ранних стадиях развития диабетической нефропатии (рис. 1). Подоциты — ключевой компонент гломерулярного фильтра, обеспечивающий его фильтрационную функцию и предотвращающий попадание макромолекул в мочу [22]. Количество подоцитов напрямую связано с количеством здоровых функционирующих нефронов, и потеря даже 20% подоцитов ассоциирована с появлением альбуминурии и экспансией мезангия, определяющими развитие ХБП [23]. Гипергликемия при СД может способствовать дезадаптивным изменениям в подоцитах, приводя к их гибели и нарушению проницаемости фильтрационного барьера, что проявляется нарастанием альбуминурии [24]. Таким образом, у пациентов с СД2 может происходить гиперактивация МКР, запускающая ряд внутриклеточных механизмов, приводящих к гибели и утрате подоцитов [25]. В свою очередь блокада МКР уменьшает ремоделирование клубочков, подоцитов и уменьшает альбуминурию, редуцируя вызванные нарушением сигналинга инсулина окислительный стресс и метаболические нарушения [26].
Метаболические нарушения, происходящие у пациентов с СД2, напрямую способствуют гиперактивациии МКР посредством O-GlcNAc-гликозилирования рецепторов. Это особый вид модификации МКР, который делает их более устойчивыми к разрушению и активными в отношении запуска воспалительных и фиброзных процессов в органах-мишенях. Вначале происходит гликозилирование и стабилизация рецепторов: в условиях высокого уровня глюкозы молекула глюкозы присоединяется к МКР, предотвращая их разрушение. Это увеличивает количество активных МКР в клетках, особенно в тканях почек и сердечно-сосудистой (СС) системы. Далее у гликозилированных МКР повышается чувствительность к альдостерону, что в итоге приводит к тому, что рецепторы дольше остаются в активном состоянии и выполняют функцию «переключателя» для включения определенных генов, отвечающих за выработку медиаторов воспаления и фиброза (рис. 2) [27].
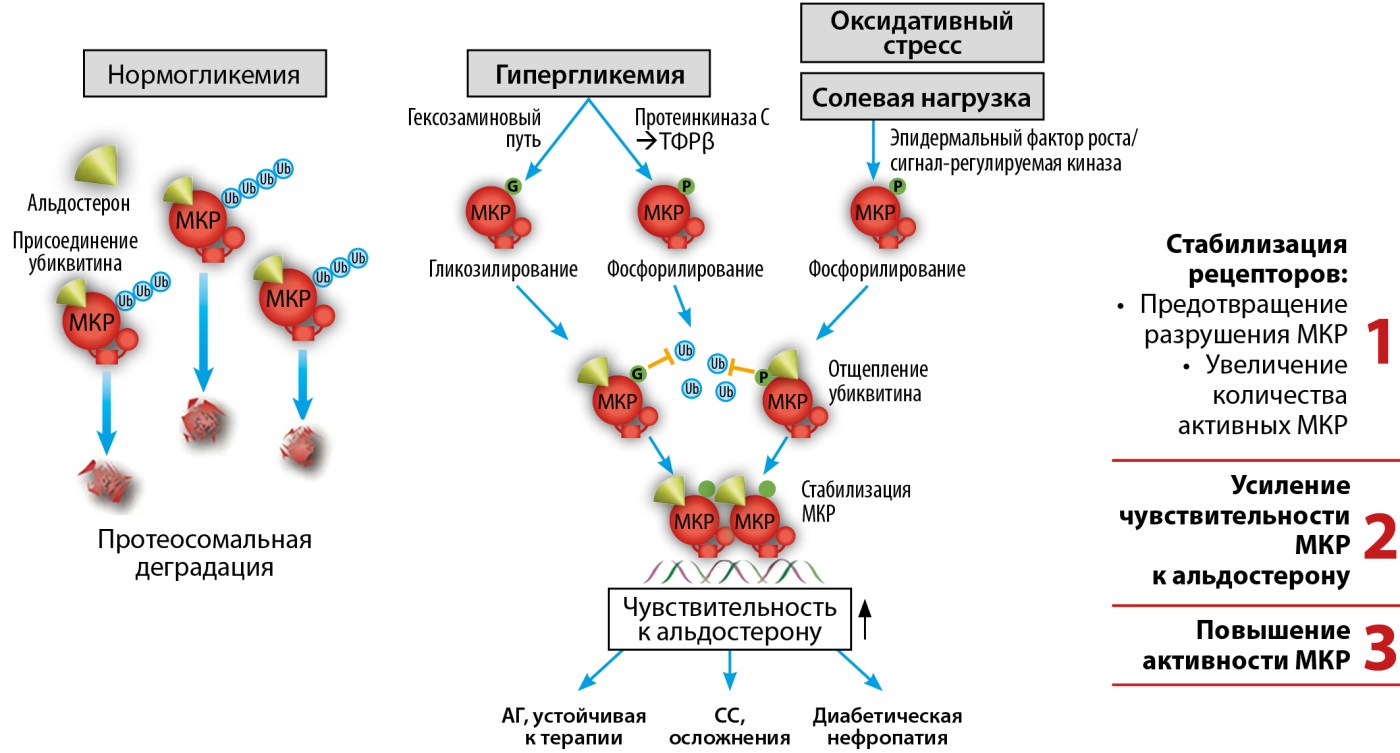
Рисунок 2. Процесс O-GlcNAc-гликозилирования минералокортикоидных рецепторов и их гиперактивации. Адаптировано из [27].
Примечание. АГ — артериальная гипертензия; МКР — минералокортикоидные рецепторы; СС — сердечно-сосудистые; ТФРβ — трансформирующий фактор роста-бета.
Высокий уровень альдостерона и гиперактивация МКР реализуют свои эффекты через целый ряд механизмов: нарушение микроциркуляции, митохондриальная дисфункция, окислительный стресс, воспаление, дислипидемия и дисбиоз в пищеварительном тракте [28]. Альдостерон известен как гормон с выраженной профиброгенной активностью, что способствует более раннему возникновению и быстрой прогрессии ХБП, ХСН, ишемической болезни сердца, фибрилляции предсердий и инсульта [29]. Усиление передачи сигналов МКР ухудшает передачу сигналов инсулина через путь фосфоинозитид-3-киназа/протеинкиназа В (PI3K/Akt) и снижает активность эндотелиальной NO-синтазы и биодоступность NO. Это приводит к снижению S-нитрозилирования и транслокации трансглутаминазы 2 во внеклеточный компартмент, усиливающий сшивку коллагена, тубулоинтерстициальный фиброз и микроциркуляторную дисфункцию. Кроме того, активация МКР стимулирует экспрессию профиброзных генов, включая трансформирующий фактор роста-бета 1 (TGF-b1) и фактор роста соединительной ткани (CTGF), которые являются ключевыми игроками в фиброзном процессе [30].
Поэтому таргетная блокада МКР является перспективной мишенью для замедления процесса фиброзирования — наименее обратимого изменения при ХБП и ХСН (рис. 3) [28].
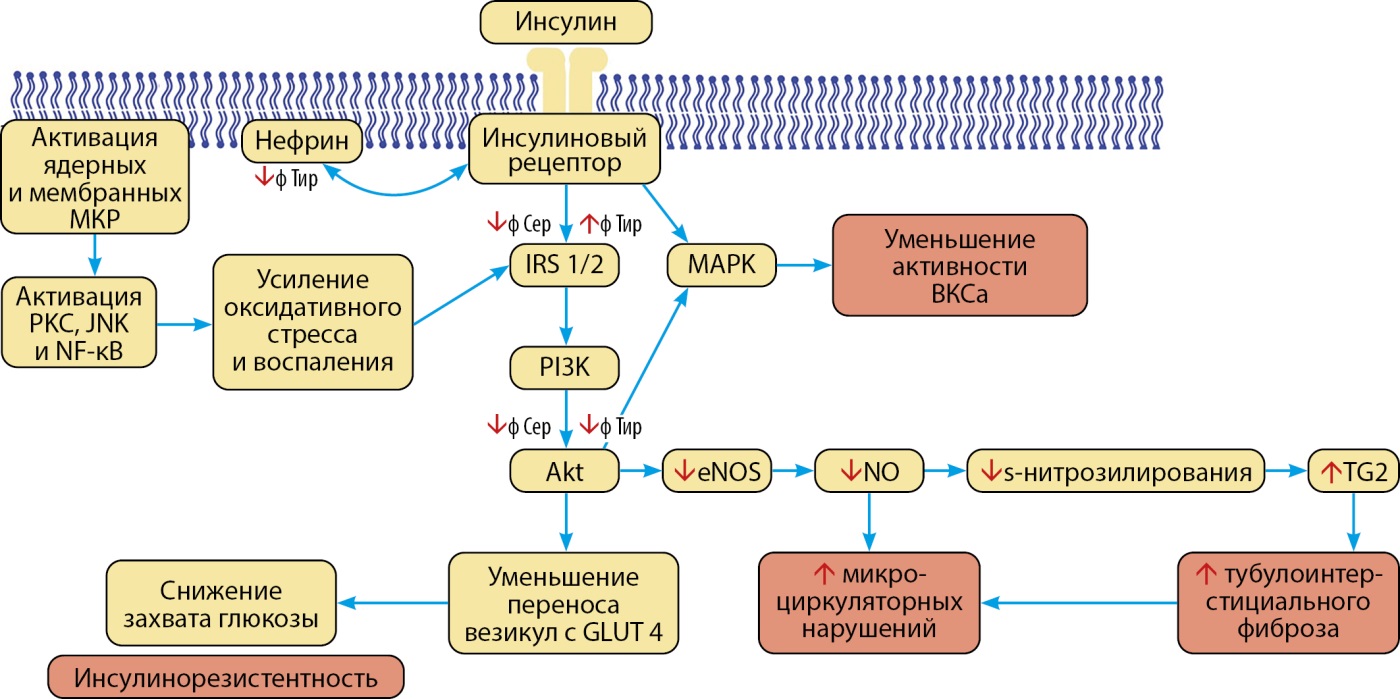
Рисунок 3. Патофизиологические последствия гиперактивации минералокортикоидных рецепторов. Адаптировано из [28].
Примечание. Akt — протеинкиназа В; ВКСа — порообразующие субъединицы Са-активируемых К-каналов; eNOS — эндотелиальная NO-синтаза; GLUT 4 — глюкозный транспортер тип 4; IRS-1/2 — субстрат инсулинового рецептора 1/2; JNK — N-концевые киназы c-Jun; NF-kB — ядерный фактор κB; NO — оксид азота; PI3K — фосфоинозитид-3-киназа; PKC — протеинкиназа С; TG2 — трансглутаминаза 2; ф Сер — фосфорилирование серина; ф Тир — фосфорилирование тирозина.
Примечание. Активация минералокортикоидных рецепторов (МКР) усиливает патологические пути протеинкиназы С (PKC), N-концевых киназ c-Jun (JNK) и ядерного фактора κB (NF-κB), которые вызывают окислительный стресс и воспаление, приводящие к нарушению метаболических сигналов инсулина в PI3K/Akt-путях и снижению фосфорилирования нефрина, и поглощению глюкозы. Патологические пути Akt и митоген-активируемой протеинкиназы (MAPK) также связаны с неактивностью порообразующих субъединиц Са-активируемых К-каналов (BKCa). Взаимодействие трансглутаминазы 2 (TG2) и оксида азота (NO) при активации МКР вызывает дисфункцию микрососудистого эндотелия, фиброз. Активация МКР ухудшает метаболическую сигнализацию инсулина в путях PI3K/Akt и снижает активность эндотелиальной NO-синтазы (eNOS) и биодоступность NO. Эти нарушения снижают уровень S-нитрозилирования, что приводит к перемещению TG2 во внеклеточный компартмент, усиливая сшивание коллагена, фиброз и нарушение микроциркуляции.
Блокада РААС препаратами из групп ингибиторов ангиотензинпревращающего фермента (ИАПФ) и сартанов является необходимой опцией при лечении ХБП у пациентов с СД2 и при лечении ХБП иного генеза. Однако в 10–40% случаев отмечается неполное подавление альдостерона при системной блокаде РААС ИАПФ или сартанами. Это явление называют эффектом «ускользания» альдостерона. Несмотря на то, что первоначально повышение уровня альдостерона приводит к повышению реабсорбции натрия в почечных канальцах и снижению его экскреции с мочой, в дальнейшем, под воздействием контррегуляторных механизмов, экскреция натрия с мочой наоборот увеличивается, что приводит к прогрессированию протеинурии. Известно, что ожирение, которое очень часто характеризует пациентов с СД2, может способствовать данному феномену. Процесс «ускользания» альдостерона запускает несколько механизмов. В дополнение к увеличению почечного перфузионного давления возросший объем циркулирующей крови снижает проксимальную реабсорбцию натрия и увеличивает доставку натрия к дистальным участкам нефрона. Повышенная доставка натрия перекрывает усиленную реабсорбцию альдостерона в месте действия минералокортикоидов. Кроме того, увеличение объема циркулирующей крови, вторичное по отношению к действию альдостерона, повышает уровень натрийуретического гормона в плазме крови и, следовательно, его ингибиторное действие на реабсорбцию натрия в собирательных трубочках [31]. Явление «ускользания» эффекта альдостерона связано с более быстрым снижением функции почек. Феномен «ускользания» эффекта альдостерона — одна из ключевых причин, из-за которой эффективность ИАПФ и сартанов в отношении снижения риска развития почечной недостаточности, смертности или больших СС событий (катастроф) у людей с протеинурической стадией ХБП остается недостаточной. Таргетное блокирование МКР с помощью антагонистов МКР (АМКР) может способствовать замедлению прогрессирования ХБП независимо от уровня альдостерона. АМКР могут уменьшить протеинурию и систолическое АД у взрослых с ХБП, особенно при добавлении к блокаторам РААС, но неселективные препараты, такие как спиронолактон, могут также снизить скорость клубочковой фильтрации (СКФ) и значительно увеличить риск гиперкалиемии, острого острого повреждения почек (ОПП) и гинекомастии. На сегодняшний день стероидные АМКР хорошо проявили себя как препараты, которые значительно снижают риск развития и улучшают течение сердечной недостаточности (СН) с низкой фракцией выброса левого желудочка и снижают риск внезапной сердечной смерти [32]. Следует отметить, что Для пациентов с тяжелой ХСН характерно еще одно явление, называемое «прорывом» альдостерона. Недостаточное наполнение артериального кровообращения при ХСН из-за снижения сердечного выброса еще больше активирует РААС и приводит к вторичному гиперальдостеронизму, способствуя прогрессии ХБП. Между тем роль стероидных АМКР в лечении ХБП остается неопределенной. С одной стороны, добавление их к блокаторам РААС дополнительно снижает протеинурию у пациентов с ХБП, как вследствие СД, так и недиабетического генеза [33]. С другой стороны, даже при использовании невысоких доз спиронолактона (25–50 мг/сут) было отмечено снижение СКФ, которое коррелировало с уменьшением альбуминурии [34]. Более современный Кохрейновский метаанализ 44 исследований показал, что АМКР могут снижать протеинурию, СКФ и систолическое АД у взрослых с ХБП 1–4 стадий, но могут увеличивать риск гиперкалиемии, ОПП и гинекомастии, особенно при добавлении к ИАПФ и/или блокаторам рецептора ангиотензина (БРА) [35].Существенно большая частота неблагоприятных побочных эффектов, таких как гиперкалиемия, гипотония и ОПП, была отмечена при комбинации блокаторов РААС с неселективными стероидными АМКР.
Таким образом, соотношение баланса польза/риск для стероидных АМКР оказалось недостаточным для их использования у пациентов с ХБП для коррекции альбуминурии.
Также следует отметить, что из стероидных АМКР спиронолактон не является строго селективным антагонистом МКР, что обуславливает его побочные действия не только на уровень калия и СКФ, но также и на соотношение тестостерона и эстрогенов у мужчин (гинекомастия и импотенция) и женщин (нарушения менструального цикла), углеводный метаболизм (вызывает его нарушение) [36–38]. Эплеренон гораздо более селективен, однако имеет более низкое сродство к МКР, чем спиронолактон [39].Фармакокинетические особенности молекулы определили ее более благоприятный профиль безопасности со стороны половой системы, но также обусловили менее выраженный кардиопротективный эффект [40][36].
Финеренон — первый нестероидный АМКР, который обладает большей селективностью к рецепторам, чем спиронолактон, и лучшим сродством к рецепторам, чем эплеренон in vitro [41]. Финеренон отличается от стероидных АМКР по целому ряду существенных параметров. В отличие от плоской (стероидной) структуры, финеренон имеет объемную (нестероидную) структуру, что, во-первых, обеспечивает большее сродство к рецептору, а во-вторых, меняет конфигурацию рецептора. Финеренон оказывает модулирующее действие в отношении набора кофакторов, отвечающих за активацию процессов воспаления и фиброза на геномном уровне. Нестероидная структура и особенности механизма связывания финеренона с рецептором предопределили его более выраженный противовоспалительный и антифиброзный эффект в сравнении со стероидными АМКР. В то же время финеренон обладает самой высокой селективностью к МКР при сравнении со спиронолактоном и эплереноном, что обеспечивает отсутствие побочных эффектов со стороны половой системы. Короткий период полувыведения (2–3 часа) и отсутствие активных метаболитов обеспечивают наиболее высокую безопасность препарата [42][43], мягкую выраженность эффектов на систолическое артериальное давление (САД) и уровень калия.
Итак, в силу очень высокой селективности, нестероидный антагонист МКР финеренон уменьшает протеинурию, воспаление, окислительный стресс и фиброз с существенно более низким риском гиперкалиемии [44][45]. Еще одной важной особенностью, которая определена высокой селективностью в отношении МКР и эффективностью финеренона, является отсутствие негативного влияния на метаболические параметры. В исследованиях, изучивших влияние стероидных АМКР, прежде всего спиронолактона, на метаболические параметры, были выявлены негативные эффекты на уровень гликированного гемоглобина. Эти данные подтверждены в достаточно крупных метаанализах [46][47]. Среди возможных причин обозначены повышение уровня кортизола, ухудшение секреции инсулина и адипокинового баланса со снижением уровня адипонектина [48][36].
В нескольких рандомизированных контролируемых исследованиях (РКИ) было показано, что финеренон снижает риски сердечно-сосудистых и почечных событий у пациентов с СД2 и ХБП и, в отличие от спиронолактона, не оказывает негативных эффектов на уровень половых стероидов и метаболические параметры.
ИССЛЕДОВАНИЕ FIDELIO-DKD
В исследование [49] были включены пациенты старше 18 лет с СД2 и ХБП, получавшие лечение ингибитором ИАПФ или БРА в максимально переносимой дозе. Пациенты имели стойкую умеренно повышенную альбуминурию (соотношение альбумина к креатинину в развой порции мочи (А/Кр) ≥30–<300 мг/г) с расчетной СКФ (рСКФ) ≥25–<60 мл/мин/1,73 м² и диабетическую ретинопатию, или стойкую, значительно повышенную альбуминурию (А/Кр≥300–≤5000 мг/г) и рСКФ ≥25–<75 мл/мин/1,73 м². Таким образом, в данное исследование были включены пациенты преимущественно с ХБП 3–4 стадии со значительно повышенной альбуминурией.
Первичная конечная точка представляла собой совокупность почечной недостаточности (терминальная стадия заболевания почек или рСКФ менее 15/мин/1,73 м²), устойчивого снижения рСКФ не менее чем на 40% от исходного уровня в течение периода не менее 4 недель или смерти от почечных причин.
Вторичная конечная точка представляла собой совокупность смерти от СС причин, нефатального инфаркта миокарда (ИМ), нефатального инсульта или госпитализации по поводу СН.
Частота возникновения почечной недостаточности, устойчивого снижения рСКФ не менее, чем на 40% от исходного уровня, или смерти от почечных причин была значительно ниже в группе финеренона, чем в группе плацебо, и наблюдалась у 504 пациентов (17,8%) и 600 пациентов (21,1%) соответственно.
Также было показано, что финеренон снижал на 31% А/Кр от исходного уровня к 4-му месяцу лечения по сравнению с плацебо.
Пациенты в группе финеренона также имели значительно более низкий риск смерти от СС причин, нефатального ИМ, нефатального инсульта или госпитализации по поводу СН, которые произошли у 367 пациентов (13,0%) в группе финеренона и у 420 пациентов (14,8%) в группе плацебо (коэффициент риска 0,86; 95% доверительный интервал (ДИ) от 0,75 до 0,99; P=0,03).
В рамках исследования FIDELIO-DKD также была проведена отдельная оценка влияния финеренона на СС события у пациентов с СД2 и ХБП. Была оценена частота наступления СС смерти, нефатального ИМ, нефатального инсульта или госпитализации по поводу СН в группах финеренона и плацебо. Полученные данные подтвердили результаты исследования Bakris GL с соавт., 2020 г. В предварительно определенных разведочных анализах частота смерти по причинам, связанным с СС заболеваниями, составила 4,5% (N=128) и 5,3% (N=150) пациентов в группах финеренона и плацебо соответственно (отношение рисков (ОР)=0,86 [ 95% ДИ 0,68–1,08]) [50].
FIGARO-DKD
В исследование [51] были включены пациенты старше 18 лет с СД2 и ХБП, получавшие лечение ИАПФ или БРА в максимально переносимой дозе. Пациенты имели устойчивую, умеренно повышенную альбуминурию (А/Кр≥30–<300 мг/г) с рСКФ≥25–≤90 мл/мин/1,73 м², или устойчивую, значительно повышенную альбуминурию (А/Кр≥300–≤5000 мг/г) и рСКФ≥60 мл/мин/1,73 м². Диапазон рСКФ в этом исследовании шире, чем в FIDELIO.
В РКИ FIGARO основные конечные точки были такими же, как в FIDELIO, однако в качестве первичных исходов наоборот оценивали риск развития СС событий, а вторичных — риск развития почечных событий. С этой целью в исследование были включены пациенты с более высоким верхним порогом рСКФ и менее выраженной альбуминурией.
Частота смерти от СС причин, нефатального ИМ, нефатального инсульта или госпитализации по поводу СН была значительно ниже в группе финеренона, чем в группе плацебо (458 из 3686 пациентов [ 12,4%] по сравнению с 519 из 3666 пациентов [ 14,2%]; ОР=0,87; 95% ДИ от 0,76 до 0,98; P=0,03). Частота госпитализаций по поводу сердечной недостаточности была ниже в группе финеренона, чем в группе плацебо (117 пациентов [ 3,2%] против 163 [ 4,4%]; ОР=0,71; 95% ДИ от 0,56 до 0,90). Число пациентов, которым было необходимо лечение финереноном для предотвращения одного события конечной первичной точки, составило 47 (95% ДИ от 26 до 226) на основе абсолютной разницы между группами в 2,1 процентных пункта (95% ДИ от 0,4 до 3,8) через 3,5 года.
FIGARO-DKD не выявило статистически значимых различий в отношении частоты возникновения компонентов вторичной конечной точки в группе финеренона и в группе плацебо (350 пациентов [ 9,5%] в группе финеренона и 395 [ 10,8%] в группе плацебо; ОР=0,87; 95% ДИ от 0,76 до 1,01). Это, вероятно, обусловлено более выраженными СС рисками по сравнению с почечными в данной группе пациентов и более коротким периодом наблюдения, не позволяющим в полной мере оценить эффекты в отношении ХБП, характеризующейся медленными темпами прогрессирования.
ОБЪЕДИНЕННЫЙ АНАЛИЗ FIDELITY (FIDELIO-DKD И FIGARO-DKD)
С целью получения наиболее надежных доказательств влияния финеренона на СС и почечные события, на этапе написания протокола РКИ было спланировано проведение объединенного анализа данных исследований FIDELIO и FIGARO в широкой популяции пациентов с СД2 и ХБП [52].
СС конечная точка определялась как время до наступления события: СС смерти, нефатального ИМ, нефатального инсульта или госпитализации по причине СН.
Финеренон снизил частоту СС событий (825 (12,7%) пациентов группы финеренона, 939 (14,4%) пациентов группы плацебо (ОР=0,86; 95% ДИ, 0,78–0,95; р=0,0018) и риск госпитализации по причине СН (ОР=0,78; 95% ДИ, 0,66–0,92 (р= 0,0030)). Не было выявлено разницы в частоте возникновения нефатального инсульта.
Частота возникновения почечных событий (время до первого наступления почечной недостаточности, устойчивое снижение рСКФ на ≥57% от исходного уровня в течение ≥4 недель или почечная смерть) была значительно ниже при применении финеренона по сравнению с плацебо и наблюдалась у 360 (5,5%) пациентов, получавших финеренон, и 465 (7,1%) пациентов, получавших плацебо (ОР=0,77; 95% ДИ, 0,67–0,88; р = 0,0002). Риск устойчивого снижения рСКФ на ≥57% снизился на 30% (ОР=0,70; 95% ДИ, 0,60–0,83; P<0,0001), а риск возникновения терминальной стадии ХБП, требующей инициации ЗПТ, снизился на 20% при применении финеренона по сравнению с плацебо (ОР=0,80; 95% ДИ, 0,64–0,99; P = 0,040). Риск устойчивого снижения рСКФ до <15 мл/мин/1,73 м² снизился на 19%.
Анализ подгрупп, разделенных по категориям рСКФ, показал, что самая высокая частота почечных исходов наблюдалась у пациентов с изначальной рСКФ <45 мл/мин/1,73 м² и у пациентов с исходным А/Кр ≥300 мг/г. Положительные эффекты финеренона в отношении СС и почечной конечной точки были однонаправленными независимо от уровня рСКФ и альбуминурии. Однако абсолютное снижение риска было более выраженным при применении финеренона по сравнению с плацебо в подгруппе с более высоким А/Кр по сравнению с подгруппой с более низким А/Кр. Поскольку почти 45% пациентов с ≥300 мг/г имели рСКФ ≥60 мл/мин/1,73 м², эти данные подчеркивают необходимость скрининга пациентов на А/Кр и важность раннего лечения для улучшения результатов при ХБП и СД2 [44].
ВАЖНЫЕ ДОПОЛНИТЕЛЬНЫЕ ЭФФЕКТЫ ФИНЕРЕНОНА
Отдельное исследование было проведено с целью уточнения влияния финеренона на уровень А/Кр. Первичным результатом была оценка уровня А/Кр на 90-й день по сравнению с исходным уровнем. Было выявлено, что финеренон дозозависимо снижал А/Кр, причем снижение А/Кр наблюдалось уже спустя месяц приема препарата с последующим его усилением [53].
В только что завершившемся РКИ было показано, что одновременное назначение финеренона и эмпаглифлозина у пациентов с ХБП и СД2 продемонстрировало выраженное снижение альбуминурии по сравнению с исходным уровнем на 52% на 180-й день наблюдения, что на 29% (95% ДИ 0,61–0,82; р<0,001) значимо больше по сравнению с группой монотерапии финереноном и на 32% (95% ДИ 0,59–0,79; р<0,001) значимо больше по сравнению с группой монотерапии эмпаглифлозином [54].
Как было показано в исследовании FIDELIO-DKD, финеренон не оказывал влияния на уровень HbA1c. В исследовании Agarwal R и соавт. [52] не было отмечено различий в кардио- и нефропротективных эффектах финеренона у пациентов с HbA1c< и ≥7,5%. В более широкой популяции исследования FIDELITY было получено подтверждение индифферентности финеренона в отношении HbA1c, а также независимости его кардионефропротективных эффектов от исходного значения HbA1c, длительности течения СД и применения инсулина для терапии СД2 [52][55]. При этом было сделано интересное наблюдение, которое заключалось в том, что при приеме финеренона гипогликемические нежелательные явления и серьезные нежелательные явления встречались реже, чем при приеме плацебо, особенно в подгруппах пациентов с HbA1c≥7,5% и у пациентов, получавших инсулин.
Субанализ исследования FIDELIO-DKD позволил оценить гипотензивный потенциал финеренона у пациентов с СД2 и ХБП, а также зависимость кардионефропротективных эффектов финеренона от исходного САД. В общей популяции финеренон оказывал благоприятный умеренный эффект в отношении АД, в т.ч. у пациентов, получавших комбинированную антигипертензивную терапию. В среднем финеренон к 4-му месяцу наблюдения снижал САД на 3,2 мм рт.ст. В то же время у пациентов с ХБП, СД2 и резистентной артериальной гипертонии (АГ) финеренон дополнительно снижал АД и позволял достичь целевых значений, снижая потребность в назначении дополнительных гипотензивных средств. Выраженность антигипертензивного эффекта финеренона к первому месяцу зависела от исходного уровня АД (рис. 4).
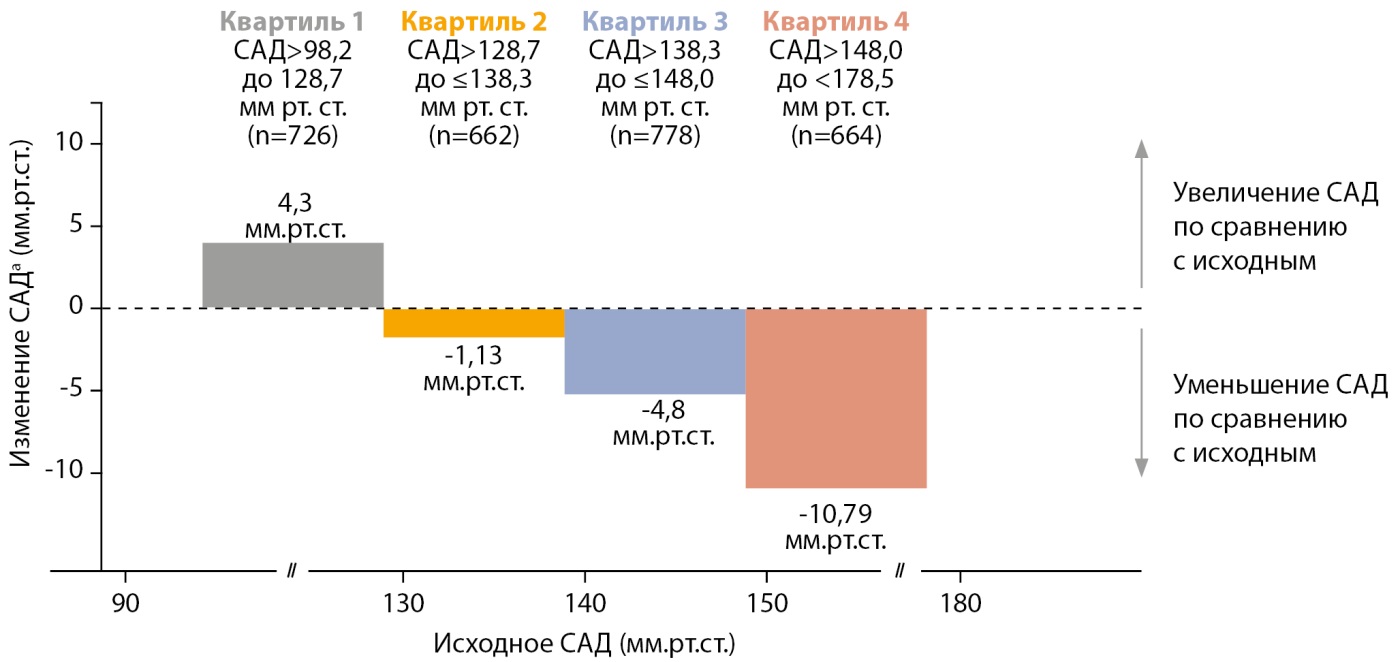
Рисунок 4. Эффекты финеренона на систолическое артериальное давление у пациентов с хронической болезнью почек и сахарным диабетом 2 типа.
Примечание. а — скорректированное среднее изменение САД по сравнению с исходным значением, рассчитанное методом наименьших квадратов (результаты группы плацебо не включены в анализ); САД — систолическое артериальное давление.
Важно отметить, что проведенный анализ также продемонстрировал независимость кардионефропротективных эффектов финеренона от его влияния на АД.
Европейское общество по АГ в клинических рекомендациях (КР) от 2023 г. рекомендовали назначение финеренона пациентам с АГ, ХБП и СД2 с целью кардионефропротекции в дополнение к антигипертензивной терапии (1А) [56]. Прописанный в данных КР подход к терапии пациентов с АГ и сопутствующей ХБП и СД2 также нашел свое отражение в опубликованных в конце 2024 г. КР Российского медицинского общества по артериальной гипертонии (РМОАГ) и Евразийской ассоциации кардиологов (ЕАК) по диагностике и лечению артериальной гипертонии (2024 г.) [57].
Кроме того, ряд исследований выявил дополнительные кардиопротективные эффекты финеренона у пациентов с ХБП и СД2.
В исследовании Filippatos G. и соавт., 2021 г., оценивался эффект финеренона на частоту впервые возникших фибрилляции предсердий/трепетании предсердий (ФП/ТП). Впервые возникшая ФП/ТП наблюдались у 82 (3,2%) пациентов, принимавших финеренон, и у 117 (4,5%) пациентов, принимавших плацебо (ОР=0,71; 95% ДИ 0,53–0,94; p=0,016). Таким образом, финеренон может снижать риск возникновения ФП/ТП у пациентов с СД2 и ХБП [58].
Субанализ исследования FIGARO-DKD показал, что терапия финереноном имеет потенциал к снижению риска развития СН у пациентов с ХБП на фоне СД2, не имеющих СН исходно: в группе финеренона частота событий была на 32% меньше, чем в группе пациентов, получавших плацебо в дополнение к стандартной терапии (ОР=0,68; 95% ДИ 0,50–0,93, р=0,016) [59].
Filippatos G. с соавт. оценили потенциал финеренона в отношении первичной и вторичной профилактики событий, связанных с СН в широкой популяции пациентов с ХБП и СД2. Согласно результатам, финеренон снижал риски первичной госпитализации по поводу СН на 22% (ОР=0,78; 95% ДИ 0,66–0,92, р=0,003), а также риск СС смерти и госпитализации по поводу СН на 17% (ОР=0,83; 95%ДИ 0,74–0,93, р=0,002) по сравнению с плацебо. Схожий благоприятный эффект финеренон продемонстрировал в отношении повторных событий, связанных с СН, снижая риск повторных госпитализаций по поводу СН на 21%, и риск СС смерти и повторных госпитализаций по СН на 18% по сравнению с плацебо соответственно [60].
Благоприятный профиль эффективности финеренона в отношении рисков, связанных с СН, стал основанием для его рекомендации пациентам с ХБП и СД2 с целью профилактики госпитализаций по поводу СН с наивысшим уровнем доказательств (А) согласно рекомендациям Европейского общества кардиологов «по диагностике и лечению сердечной недостаточности» и Американской ассоциации диабета «Стандарты оказания медицинской помощи при сахарном диабете» [61][62]. Также резолюция междисциплинарного совета экспертов определили необходимость включения финеренона в клинические рекомендации и важность применения в реальной клинической практике [63]. И наконец, в опубликованных в мае 2025 г. Алгоритмах специализированной медицинской помощи больным СД (12 выпуск) обозначено показание для назначения финеренона, начиная с первых проявлений ХБП, пациентам с СД2 и нормальной концентрацией калия в сыворотке для снижения риска как прогрессирования ХБП, так и Для профилактики развития кардиоваскулярных событий [64].
ВЫВОДЫ
В отличие от стероидных АМКР финеренон обладает существенной доказательной базой, подтверждающей его кардио- и нефропротективные свойства у пациентов с СД2 и ХБП. Поэтому назначение финеренона показано для снижения риска СС и почечных событий у пациентов с ХБП и СД2. Финеренон может позволить снизить риск смерти от СС причин, нефатального ИМ, нефатального инсульта или госпитализации по поводу СН, возникновения ФП/ТП у пациентов с СД2 и ХБП. Также согласно данным FIDELITY, финеренон может снизить частоту возникновения почечной недостаточности, устойчивого снижения рСКФ на ≥57% от исходного уровня, прогрессирования альбуминурии, смерти от почечных причин. Важной особенностью данного препарата является отсутствие негативных эффектов на уровень половых стероидов и метаболические параметры, в частности уровень HbA1c. Противовоспалительные и антифиброзные эффекты финеренона открывают перспективы для дальнейшего его изучения для лечения ХБП и ХСН в других популяциях пациентов, прежде всего у пациентов с ожирением и метаболическим синдромом, учитывая выраженную гиперактивацию МКР в этих субпопуляциях пациентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Исследование проводилось без привлечения источников финансирования.
Конфликт интересов. Публикация подготовлена при поддержке АО «Байер». Компания «Байер» поддерживала техническую редакцию статьи.
Участие авторов. Бабенко А.Ю. — разработка концепции и дизайна, проверка критически важного интеллектуального содержания, анализ и интерпретация данных, написание текста, окончательное утверждение для публикации рукописи; Засыпкин Г.Г. — сбор, анализ и интерпретация данных; написание текста, проверка критически важного интеллектуального содержания.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты публикации, подразумевающей надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Hatamizadeh P, Fonarow GC, Budoff MJ, et al. Cardiorenal syndrome: pathophysiology and potential targets for clinical management. Nat Rev Nephrol. 2013;9(2):99-111. doi: https://doi.org/10.1038/nrneph.2012.279
2. Song MK, Davies NM, Roufogalis BD, Huang TH. Management of cardiorenal metabolic syndrome in diabetes mellitus: a phytotherapeutic perspective. J Diabetes Res. 2014;2014:313718. doi: https://doi.org/10.1155/2014/313718
3. Vijay K, Neuen BL, Lerma EV. Heart Failure in Patients with Diabetes and Chronic Kidney Disease: Challenges and Opportunities. Cardiorenal Med. 2022;12(1):1-10. doi: https://doi.org/10.1159/000520909
4. Tousoulis D, Oikonomou E, Siasos G, Stefanadis C. Diabetes Mellitus and Heart Failure. EurCardiol. 2014;9(1):37-42. doi: https://doi.org/10.15420/ecr.2014.9.1.37
5. Birkeland KI, Bodegard J, Eriksson JW, et al. Heart failure and chronic kidney disease manifestation and mortality risk associations in type 2 diabetes: A large multinational cohort study. Diabetes Obes Metab. 2020;22(9):1607-1618. doi: https://doi.org/10.1111/dom.14074
6. Трубицына Н.П., Зайцева Н.В., Северина А.С., Шамхалова М.Ш. Хроническая болезнь почек у пациентов с сахарным диабетом 2 типа: новые мишени лекарственного воздействия // Сахарный диабет. — 2022. — Т. 25. — № 5. — С. 492-498. doi: https://doi.org/10.14341/DM12944
7. Hollenberg NK, Stevanovic R, Agarwal A, et al. Plasma aldosterone concentration in the patient with diabetes mellitus. Kidney Int. 2004;65(4):1435-1439. doi: https://doi.org/10.1111/j.1523-1755.2004.00524.x
8. Engeli S, Schling P, Gorzelniak K, et al. The adipose-tissue renin-angiotensin-aldosterone system: role in the metabolic syndrome? Int J Biochem Cell Biol. 2003;35(6):807-825. doi: https://doi.org/10.1016/s1357-2725(02)00311-4
9. Ribeiro-Oliveira A Jr, Nogueira AI, Pereira RM, et al. The renin-angiotensin system and diabetes: an update. Vasc Health Risk Manag. 2008;4(4):787-803 doi: https://doi.org/10.2147/VHRM.S1905
10. Giacchetti G, Sechi LA, Rilli S, Carey RM. The renin-angiotensin-aldosterone system, glucose metabolism and diabetes. Trends Endocrinol Metab. 2005;16(3):120-126. doi: https://doi.org/10.1016/j.tem.2005.02.003
11. Шестакова М.В. Роль тканевой ренин-ангиотензин-альдостероновой системы в развитии метаболического синдрома, сахарного диабета и его сосудистых осложнений // Сахарный диабет. — 2010. — Т. 13. — № 3. — С. 14-19. doi: https://doi.org/10.14341/2072-0351-5481
12. Jia G, Hill MA, Sowers JR. Vascular endothelial mineralocorticoid receptors and epithelial sodium channels in metabolic syndrome and related cardiovascular disease. J Mol Endocrinol. 2023;71(3):e230066. doi: https://doi.org/10.1530/JME-23-0066
13. Jia G, Lockette W, Sowers JR. Mineralocorticoid receptors in the pathogenesis of insulin resistance and related disorders: from basic studies to clinical disease. Am J Physiol Regul Integr Comp Physiol. 2021;320(3):R276-R286. doi: https://doi.org/10.1152/ajpregu.00280.2020
14. Galmiche G, Pizard A, Gueret A, et al. Smooth muscle cell mineralocorticoid receptors are mandatory for aldosterone-salt to induce vascular stiffness. Hypertension. 2014;63(3):520-526. doi: https://doi.org/10.1161/HYPERTENSIONAHA.113.01967
15. Lother A, Berger S, Gilsbach R, et al. Ablation of mineralocorticoid receptors in myocytes but not in fibroblasts preserves cardiac function. Hypertension. 2011;57(4):746-754. doi: https://doi.org/10.1161/HYPERTENSIONAHA.110.163287
16. Man JJ, Lu Q, Moss ME, et al. Myeloid Mineralocorticoid Receptor Transcriptionally Regulates P-Selectin Glycoprotein Ligand-1 and Promotes Monocyte Trafficking and Atherosclerosis. Arterioscler Thromb Vasc Biol. 2021;41(11):2740-2755. doi: https://doi.org/10.1161/ATVBAHA.121.316929
17. Jaffe IZ, Mendelsohn ME. Angiotensin II and aldosterone regulate gene transcription via functional mineralocortocoid receptors in human coronary artery smooth muscle cells. Circ Res. 2005;96(6):643-650. doi: https://doi.org/10.1161/01.RES.0000159937.05502.d1
18. Caprio M, Newfell BG, la Sala A, et al. Functional mineralocorticoid receptors in human vascular endothelial cells regulate intercellular adhesion molecule-1 expression and promote leukocyte adhesion. Circ Res. 2008;102(11):1359-1367. doi: https://doi.org/10.1161/CIRCRESAHA.108.174235
19. Gant CM, Minovic I, Binnenmars H, et al. Lower Renal Function Is Associated With Derangement of 11-β Hydroxysteroid Dehydrogenase in Type 2 Diabetes. J Endocr Soc. 2018;2(7):609-620. doi: https://doi.org/10.1210/js.2018-00088
20. Hayashi T, Shibata H, Kurihara I, et al. High Glucose Stimulates Mineralocorticoid Receptor Transcriptional Activity Through the Protein Kinase C β Signaling. Int Heart J. 2017;58(5):794-802. doi: https://doi.org/10.1536/ihj.16-649
21. Daza-Arnedo R, Rico-Fontalvo J, Aroca-Martínez G, et al. Insulin and the kidneys: a contemporary view on the molecular basis. Front Nephrol. 2023;3:1133352. doi: https://doi.org/10.3389/fneph.2023.1133352
22. Murray IV, Paolini MA. Histology, Kidney and Glomerulus. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2023
23. Haruhara K, Kanzaki G, Sasaki T, et al. Associations between nephron number and podometrics in human kidneys. Kidney Int. 2022;102(5):1127-1135. doi: https://doi.org/10.1016/j.kint.2022.07.028
24. Thomas MC, Brownlee M, Susztak K, et al. Diabetic kidney disease. Nat Rev Dis Primers. 2015;1:15018. doi: https://doi.org/10.1038/nrdp.2015.18
25. Shibata S, Nagase M, Yoshida S, Kawachi H, Fujita T. Podocyte as the target for aldosterone: roles of oxidative stress and Sgk1. Hypertension. 2007;49(2):355-364. doi: https://doi.org/10.1161/01.HYP.0000255636.11931.a2
26. Whaley-Connell A, Habibi J, Wei Y, et al. Mineralocorticoid receptor antagonism attenuates glomerular filtration barrier remodeling in the transgenic Ren2 rat. Am J Physiol Renal Physiol. 2009;296(5):F1013-F1022. doi: https://doi.org/10.1152/ajprenal.90646.2008
27. Jo R, Itoh H, Shibata H. Mineralocorticoid receptor overactivation in diabetes mellitus: role of O-GlcNAc modification. Hypertens Res. 2024;47(8):2126-2132. doi: https://doi.org/10.1038/s41440-024-01734-3
28. Jia G, Lastra G, Bostick BP, et al. The mineralocorticoid receptor in diabetic kidney disease. Am J Physiol Renal Physiol. 2024;327(3):F519-F531. doi: https://doi.org/10.1152/ajprenal.00135.2024
29. Calhoun DA. Aldosterone and cardiovascular disease: smoke and fire. Circulation. 2006;114(24):2572-2574. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.668715
30. Jia G, Habibi J, DeMarco VG, et al. Endothelial Mineralocorticoid Receptor Deletion Prevents Diet-Induced Cardiac Diastolic Dysfunction in Females. Hypertension. 2015;66(6):1159-1167. doi: https://doi.org/10.1161/HYPERTENSIONAHA.115.06015
31. Schrier RW. Aldosterone ‘escape’ vs ‘breakthrough’. Nat Rev Nephrol. 2010;6(2):61. doi: https://doi.org/10.1038/nrneph.2009.228
32. Chilton RJ, Silva-Cardoso J. Mineralocorticoid receptor antagonists in cardiovascular translational biology. Cardiovasc Endocrinol Metab. 2023;12(3):e0289. doi: https://doi.org/10.1097/XCE.0000000000000289
33. Bomback AS, Kshirsagar AV, Amamoo MA, Klemmer PJ. Change in proteinuria after adding aldosterone blockers to ACE inhibitors or angiotensin receptor blockers in CKD: a systematic review. Am J Kidney Dis. 2008;51(2):199-211. doi: https://doi.org/10.1053/j.ajkd.2007.10.040
34. van den Meiracker AH, Baggen RG, Pauli S, et al. Spironolactone in type 2 diabetic nephropathy: Effects on proteinuria, blood pressure and renal function. J Hypertens. 2006;24(11):2285-2292. doi: https://doi.org/10.1097/01.hjh.0000249708.44016.5c
35. Chung EY, Ruospo M, Natale P, et al. Aldosterone antagonists in addition to renin angiotensin system antagonists for preventing the progression of chronic kidney disease. Cochrane Database Syst Rev. 2020;10(10):CD007004. doi: https://doi.org/10.1002/14651858.CD007004.pub4
36. Pradhan A, Vohra S, Sethi R. Eplerenone: The Multifaceted Drug in Cardiovascular Pharmacology. J Pharm Bioallied Sci. 2020;12(4):381-390. doi: https://doi.org/10.4103/jpbs.JPBS_338_19
37. Chatterjee S, Moeller C, Shah N, et al. Eplerenone is not superior to older and less expensive aldosterone antagonists. Am J Med. 2012;125(8):817-825. doi: https://doi.org/10.1016/j.amjmed.2011.12.018
38. Funder JW. Aldosterone Research: 65 Years, and Counting. Vitam Horm. 2019;109:1-15. doi: https://doi.org/10.1016/bs.vh.2018.09.001
39. Messaoudi S, Azibani F, Delcayre C, Jaisser F. Aldosterone, mineralocorticoid receptor, and heart failure. Mol Cell Endocrinol. 2012;350(2):266-272. doi: https://doi.org/10.1016/j.mce.2011.06.038
40. Chung EYM, Strippoli GFM. Aldosterone Antagonists in Addition to Renin Angiotensin System Antagonists for Preventing the Progression of CKD: Editorial Summary of a Cochrane Review. Am J Kidney Dis. 2021;77(5):810-812. doi: https://doi.org/10.1053/j.ajkd.2020.11.019
41. Bärfacker L, Kuhl A, Hillisch A, et al. Discovery of BAY 94-8862: a nonsteroidal antagonist of the mineralocorticoid receptor for the treatment of cardiorenal diseases. Chem Med Chem. 2012;7(8):1385-1403. doi: https://doi.org/10.1002/cmdc.201200081
42. Kintscher U, Bakris GL, Kolkhof P. Novel non-steroidal mineralocorticoid receptor antagonists in cardiorenal disease. Br J Pharmacol. 2022;179(13):3220-3234. doi: https://doi.org/10.1111/bph.15747
43. Chaudhuri A, Ghanim H, Arora P. Improving the residual risk of renal and cardiovascular outcomes in diabetic kidney disease: A review of pathophysiology, mechanisms, and evidence from recent trials. Diabetes Obes Metab. 2022;24(3):365-376. doi: https://doi.org/10.1111/dom.14601
44. Bakris GL, Ruilope LM, Anker SD, et al. A prespecified exploratory analysis from FIDELITY examined finerenone use and kidney outcomes in patients with chronic kidney disease and type 2 diabetes. Kidney Int. 2023;103(1):196-206. doi: https://doi.org/10.1016/j.kint.2022.08.040
45. Agarwal R, Tu W, Farjat AE, et al. Impact of Finerenone-Induced Albuminuria Reduction on Chronic Kidney Disease Outcomes in Type 2 Diabetes: A Mediation Analysis. Ann Intern Med. 2023;176(12):1606-1616. doi: https://doi.org/10.7326/M23-1023
46. Korol S, Mottet F, Perreault S, Baker WL, White M, de Denus S. A systematic review and meta-analysis of the impact of mineralocorticoid receptor antagonists on glucose homeostasis. Medicine (Baltimore). 2017;96(48):e8719. doi: https://doi.org/10.1097/MD.0000000000008719
47. Zhao JV, Xu L, Lin SL, Schooling CM. Spironolactone and glucose metabolism, a systematic review and meta-analysis of randomized controlled trials. J Am Soc Hypertens. 2016;10(8):671-682. doi: https://doi.org/10.1016/j.jash.2016.05.013
48. Matsumoto S, Takebayashi K, Aso Y. The effect of spironolactone on circulating adipocytokines in patients with type 2 diabetes mellitus complicated by diabetic nephropathy. Metabolism. 2006;55(12):1645-1652. doi: https://doi.org/10.1016/j.metabol.2006.07.025
49. Bakris GL, Agarwal R, Anker SD, et al. Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020;383(23):2219-2229. doi: https://doi.org/10.1056/NEJMoa2025845
50. Filippatos G, Anker SD, Agarwal R, et al. Finerenone and Cardiovascular Outcomes in Patients With Chronic Kidney Disease and Type 2 Diabetes. Circulation. 2021;143(6):540-552. doi: https://doi.org/10.1161/CIRCULATIONAHA.120.051898
51. Pitt B, Filippatos G, Agarwal R, et al. Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes. N Engl J Med. 2021;385(24):2252-2263. doi: https://doi.org/10.1056/NEJMoa2110956
52. Agarwal R, Filippatos G, Pitt B, et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43(6):474-484. doi: 10.1093/eurheartj/ehab777. [Corrected and republished from: Eur Heart J. 2022;43(20):1989. doi: https://doi.org/10.1093/eurheartj/ehab886
53. Bakris GL, Agarwal R, Chan JC, et al. Effect of Finerenone on Albuminuria in Patients With Diabetic Nephropathy: A Randomized Clinical Trial. JAMA. 2015;314(9):884-894. doi: https://doi.org/10.1001/jama.2015.10081
54. Agarwal R, Green JB, Heerspink HJL, et al. Finerenone with Empagliflozin in Chronic Kidney Disease and Type 2 Diabetes. N Engl J Med. doi: https://doi.org/10.1056/NEJMoa2410659
55. McGill JB, Agarwal R, Anker SD, et al. Effects of finerenone in people with chronic kidney disease and type 2 diabetes are independent of HbA1c at baseline, HbA1c variability, diabetes duration and insulin use at baseline. Diabetes Obes Metab. 2023;25(6):1512-1522. doi: https://doi.org/10.1111/dom.14999
56. Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA) J Hypertens. 2023;41(12):1874-2071. doi:10.1097/HJH.0000000000003480. Corrected and republished from: J Hypertens. 2024;42(1):194. doi: https://doi.org/10.1097/HJH.0000000000003621
57. Чазова И.Е., Чихладзе Н.М., Блинова Н.В., и др. Клинические рекомендации Российского медицинского общества по артериальной гипертонии (РМОАГ) и Евразийской Ассоциации Кардиологов (ЕАК) по диагностике и лечению артериальной гипертонии (2024 г.) // Системные гипертензии. — 2024. — Т. 21. — № 4. — С. 5-110. doi: https://doi.org/10.38109/2075-082X-2024-4-5-109
58. Filippatos G, Bakris GL, Pitt B, et al. Finerenone Reduces New-Onset Atrial Fibrillation in Patients With Chronic Kidney Disease and Type 2 Diabetes. J Am Coll Cardiol. 2021;78(2):142-152. doi: https://doi.org/10.1016/j.jacc.2021.04.079
59. Filippatos G, Anker SD, Agarwal R, et al. Finerenone Reduces Risk of Incident Heart Failure in Patients With Chronic Kidney Disease and Type 2 Diabetes: Analyses From the FIGARO-DKD Trial. Circulation. 2022;145(6):437-447. doi: https://doi.org/10.1161/CIRCULATIONAHA.121.057983
60. Filippatos G, Anker SD, Pitt B, et al. Finerenone and Heart Failure Outcomes by Kidney Function/Albuminuria in Chronic Kidney Disease and Diabetes. JACC Heart Fail. 2022;10(11):860-870. doi: https://doi.org/10.1016/j.jchf.2022.07.013
61. McDonagh TA, Metra M, Adamo M, et al. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2023;44(37):3627-3639. doi:10.1093/eurheartj/ehad195. Corrected and republished from: Eur Heart J. 2024;45(1):53. doi: https://doi.org/10.1093/eurheartj/ehad613
62. American Diabetes Association Professional Practice Committee. 10. Cardiovascular Disease and Risk Management: Standards of Care in Diabetes-2024. Diabetes Care. 2024;47(Suppl 1):S179-S218. doi: https://doi.org/10.2337/dc24-S010
63. Шестакова М.В., Добронравов В.А., Аметов А.С., и др. Перспективы применения финеренона в российской популяции пациентов с хронической болезнью почек и сахарным диабетом 2 типа. Резолюция междисциплинарного Совета экспертов // Сахарный диабет. — 2023. — Т. 26. — № 5. — С. 492-499. doi: https://doi.org/10.14341/DM13020
64. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, О.Ю. Сухаревой. — 12-й вып. — М.; 2025. doi: https://doi.org/10.14341/algdc2025
Об авторах
А. Ю. БабенкоРоссия
Бабенко Алина Юрьевна - д.м.н., профессор.
Санкт-Петербург
Конфликт интересов:
Нет
Г. Г. Засыпкин
Россия
Засыпкин Герман Георгиевич – аспирант.
197341, Санкт-Петербург, ул. Аккуратова, д. 2
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Патофизиологическое взаимодействие заболеваний почек и сердца. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(640KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Процесс O-GlcNAc-гликозилирования минералокортикоидных рецепторов и их гиперактивации. Адаптировано из [27]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(658KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Патофизиологические последствия гиперактивации минералокортикоидных рецепторов. Адаптировано из [28]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(837KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Эффекты финеренона на систолическое артериальное давление у пациентов с хронической болезнью почек и сахарным диабетом 2 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(347KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Бабенко А.Ю., Засыпкин Г.Г. Органопротективные возможности финеренона у пациентов с кардиоренометаболическим синдромом. Сахарный диабет. 2025;28(3):284-294. https://doi.org/10.14341/DM13330
For citation:
Babenko A.Y., Zasypkin G.G. The organoprotective effects of finerenone in patients with cardiorenal metabolic syndrome. Diabetes mellitus. 2025;28(3):284-294. (In Russ.) https://doi.org/10.14341/DM13330

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































