Перейти к:
Ранние и отдаленные результаты трансплантационного лечения пациентов с хронической болезнью почек 4–5 стадий в исходе сахарного диабета 1 типа
https://doi.org/10.14341/DM13323
Аннотация
ОБОСНОВАНИЕ. Пациенты с диабетической природой хронической болезни почек (ХБП) 5 стадии являются наиболее тяжелой группой диализной популяции, период полужизни которых с момента начала заместительной почечной терапии не превышает 3,5–5 лет. Трансплантационное лечение является методом выбора в лечении указанной категории пациентов.
ЦЕЛЬ. Систематический анализ ранних и отдаленных результатов трансплантационного лечения пациентов с сахарным диабетом 1 типа (СД1) и ХБП 4–5 стадий.
МАТЕРИАЛЫ И МЕТОДЫ. За 17-летний период (с 2007 по 2023 гг.) в отделении трансплантации почки и поджелудочной железы было выполнено 146 трансплантаций почки (ТП) и 84 сочетанных трансплантаций почки и поджелудочной железы (СТПиПЖ) пациентам с ХБП в исходе СД1.
РЕЗУЛЬТАТЫ. За весь период наблюдения общая выживаемость пациентов, перенесших ТП, составила 67,1% (n=98), почечных трансплантатов — 59,6% (n=87); среди пациентов, перенесших СТПиПЖ, эти показатели составили 76,2% (n=64) и 70,2% (n=59) соответственно, при этом выживаемость трансплантата поджелудочной железы составила 64,3% (n=54).
ЗАКЛЮЧЕНИЕ. Представлены результаты трансплантационного лечения пациентов с СД1 и ХБП 4–5 стадий.
Ключевые слова
Для цитирования:
Дмитриев И.В., Лазарева К.Е., Балкаров А.Г., Журавель Н.С., Шмарина Н.В. Ранние и отдаленные результаты трансплантационного лечения пациентов с хронической болезнью почек 4–5 стадий в исходе сахарного диабета 1 типа. Сахарный диабет. 2025;28(4):332-341. https://doi.org/10.14341/DM13323
For citation:
Dmitriev I.V., Lazareva K.E., Balkarov A.G., Zhuravel N.S., Shmarina N.V. Early and long-term results of transplantation treatment of patients with stage 4–5 chronic kidney disease in the outcome of type 1 diabetes mellitus. Diabetes mellitus. 2025;28(4):332-341. (In Russ.) https://doi.org/10.14341/DM13323
ВВЕДЕНИЕ
Хроническая болезнь почек (ХБП) остается настоящим вызовом современному медицинскому сообществу и серьезным финансовым бременем для мирового здравоохранения. Согласно данным мировых регистров, заболеваниями почек страдает более 10% населения нашей планеты. Около 850 млн человек в мире страдают различными стадиями ХБП, терминальную стадию имеют 3,9 млн человек [1]. Средние годовые затраты на лечение ХБП на современном этапе составляют 3060, 3544, 5332 и 8736 долларов США из расчета на 1 пациента со стадиями ХБП 3a, 3b, 4 и 5 соответственно [2]. В нашей стране по состоянию на 31.12.2020 г. заместительную почечную терапию (ЗПТ) получали 60 547 пациентов с ХБП 5 стадии, 83,5% из них (n=50 563) получали диализные методы ЗПТ [3]. Возможности нетрансплантационного лечения этой нозологии весьма ограничены, однако позволяют пациентам выжить в ожидании трансплантации почки (ТП), являясь своего рода «мостом к трансплантации», которая остается лучшим методом ее хирургического лечения [4]. ТП позволяет статистически значимо увеличить продолжительность и качество жизни пациентов, а также уровень медико-социальной реабилитации по сравнению с группой пациентов, получающих диализные методы ЗПТ. Ежегодно в мире выполняют более 100 тысяч ТП. Так, в 2022 г. их было выполнено 102 090 [5], большую долю из них составляет ТП от посмертных доноров. Сохраняющееся несоответствие между потребностью и обеспеченностью трансплантологической помощью обусловлено критическим дефицитом донорских органов, несмотря на разумное расширение критериев пригодности и совершенствование методик консервации органов [6–8].
Сахарный диабет (СД) представляет собой гетерогенную группу метаболических заболеваний, которые характеризуются хронической гипергликемией, обусловленной нарушением секреции инсулина, его действия или сочетанием этих факторов. Он относится к категории хронических заболеваний с высокой социально-экономической значимостью за счет ранней инвалидизации и высокой смертности больных. Согласно данным Международной федерации диабета, количество пациентов с СД в возрасте 20–79 лет в мире достигло 537 млн человек [9]. Темпы роста количества пациентов с СД неутешительны и значительно опережают спрогнозированные ранее темпы прироста в ближайшие 10–12 лет. Так, к 2045 г. ожидается практически двукратное увеличение количества пациентов с этим заболеванием (до 783 млн человек) [9].
По последним сведениям Базы данных клинико-эпидемиологического мониторинга СД на территории Российской Федерации (РФ), общая численность пациентов с СД, состоявших на диспансерном учете на 01.01.2023 г., составляла более 4,9 млн человек (3,3% населения РФ), более 277 тысяч из них имели СД 1 типа (СД1) (5,6%). В РФ отмечается стабильный рост распространенности СД1, которая за 13-летний период (2010–2022 гг.) показала увеличение показателей со 146 человек на 100 тысяч населения до 191 человека на 100 тысяч населения [10]. Пациенты с СД составляют самую быстрорастущую группу реципиентов, получающих ЗПТ. Пациенты с диабетической этиологией ХБП, получающие диализные методы ЗПТ, характеризуются более низкими показателями выживаемости, по сравнению с пациентами с ХБП недиабетической этиологии. Несмотря на совершенствование диализных методов, медиана выживаемости пациентов с СД, получающих диализ, составляет около 3 лет. Долгосрочная выживаемость пациентов с СД, перенесших ТП, значимо выше таковой у пациентов с СД, получающих диализные методы ЗПТ [11].
Согласно данным некоторых исследований, одномоментная сочетанная ТП и поджелудочной железы (СТПиПЖ) характеризуется самыми высокими показателями выживаемости у пациентов с СД1 и ХБП 5 стадии в исходе диабетической нефропатии. Метод позволяет снизить летальность за счет снижения частоты сердечно-сосудистых осложнений и вторичных диабетических осложнений [12][13]. Однако СТП и ПЖ характеризуется большей частотой и тяжестью осложнений в течение первого года после операции по сравнению с пациентами, перенесшими изолированную ТП. Кроме того, у пациентов, перенесших СТПиПЖ, наблюдают более длительные сроки госпитализации, более высокую частоту повторной госпитализации в течение первых 30 дней после операции, более серьезные инфекционные осложнения и высокий риск периоперационной смертности [14–16]. В то же время в долгосрочной перспективе СТПиПЖ характеризовалась более высокой выживаемостью пациентов, особенно реципиентов с длительно функционирующим трансплантатом поджелудочной железы (ТПЖ). Так, 10-летняя выживаемость пациентов, перенесших СТПиПЖ, была на 50% выше по сравнению с пациентами после ТП [16][17]. К сожалению, дефицит донорских органов не позволяет выполнить СТПиПЖ всем реципиентам с СД1, поэтому в настоящее время ТП является наиболее оптимальным методом лечения ХБП и способствует повышению качества жизни и снижения летальности указанной категории пациентов [11][18].
МАТЕРИАЛЫ И МЕТОДЫ
В период с 2007 по 2023 гг. в отделении трансплантации почки и поджелудочной железы выполнили 2481 трансплантацию, из них 230 операций представляли собой трансплантационное лечение пациентов с СД1: 146 ТП и 84 СТПиПЖ. Данное исследование явилось одноцентровым, когортным, наблюдательным, продольным, ретроспективным (комитет по биомедицинской этике ГБУЗ г. Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ» №1-25 от «21» января 2025 г.).
Трансплантация почки
Реципиенты
Среди реципиентов почечного трансплантата было 58 мужчин (39,7%) и 88 женщин (60,3%), медиана возраста которых составила 41,5 [35–47] года, медиана индекса массы тела — 22,3 [ 19,8–25] кг/м². Медиана возраста наступления дебюта заболевания исчислялась 14,6 [ 9–17] годами. 128 реципиентов (87,7%) к моменту выполнения трансплантации получали ЗПТ: 86 пациентов (67,2%) посредством программного гемодиализа, 42 (32,8%) — посредством перитонеального диализа; 18 реципиентам (12,3%) выполнили додиализную трансплантацию. Продолжительность ЗПТ варьировала от нескольких месяцев до 15 лет, медиана составила 2 [ 1–4] года; у 17 реципиентов (13,3%) длительность составляла менее года, у 86 (67,2%) — от года до пяти лет, 22 (17,2%) реципиента получали ЗПТ более пяти лет и три реципиента (2,3%) находились на ЗПТ более 10 лет. В абсолютном большинстве пациентам выполнили первичную ТП, лишь у 6 (4,1%) из 146 реципиентов она была повторной. У 68 реципиентов (46,6%) до трансплантации отмечали сохранный диурез в объеме более одного литра в сутки. Помимо диабетической нефропатии, реципиенты имели и другие вторичные диабетические осложнения различной степени тяжести (диабетическую ретинопатию, диабетическую полинейропатию). Макроангиопатию в форме ишемической болезни сердца на дотрансплантационном этапе выявили у 31 реципиента (21,2%), у семи (22,6%) из них был острый инфаркт миокарда в анамнезе, девяти пациентам (29%) на этапе подготовки к ТП выполнили стентирование коронарных сосудов. Девять (6,2%) пациентов до трансплантации перенесли острое нарушение мозгового кровообращения (ОНМК). У 19 (13,0%) пациентов в анамнезе имелись указания на трофические язвы нижних конечностей, у 14 (73,7%) из них лечение закончилось ампутацией одного или нескольких пальцев, 22 пациента имели диабетическую остеоартропатию (15,1%).
Доноры
Донорами органов были 100 (68,5%) мужчин, 40 (27,4%) женщин, не было информации по половой принадлежности 6 доноров (4,1%). Медиана возраста доноров составила 46 [ 35,5–53] лет. Причиной смерти 99 доноров (67,8%) было ОНМК, 41(28,1%) — черепно-мозговая травма (ЧМТ), не удалось выяснить причину смерти четырех доноров (2,7%); двум реципиентам выполнили ТП от живого родственного донора (1,4%). На момент эксплантации уровень креатинина и мочевины крови составил 95,3 [ 72–112] мкмоль/л и 6,3 [ 4,7–59] ммоль/л соответственно. У 9 доноров (6,2%) микробиологический посев перфузата трансплантата выявлял наличие микрофлоры.
Иммуносупрессивная терапия
Пациентам проводили индукционную и базисную трехкомпонентную иммуносупрессивную терапию (ИСТ). Индукционную ИСТ моно- или поликлональными антителами провели 125 пациентам (85,6%): 98(78,4%) реципиентам — посредством инфузии анти-CD25 моноклональных антител (базиликсимаб (n=88), даклизумаб (n=9)), 27 (21,6%) реципиентам — посредством инфузии антитимоцитарных поликлональных антител (иммуноглобулин антитимоцитарный лошадиный (n=7), иммуноглобулин антитимоцитарный кроличий (n=20). У 21 реципиента (14,4%) в составе индукционной ИСТ использовали только метилпреднизолон. Поддерживающая трехкомпонентная ИСТ включала ингибиторы кальцинейрина, антиметаболиты/ингибиторы пролиферативного сигнала и кортикостероиды. Такролимус получали 109 реципиентов (74,7%), циклоспорин — 37 реципиентов (25,3%). В качестве второго компонента у 144 реципиентов использовали препараты микофеноловой кислоты (98,6%), два реципиента получали эверолимус (1,4%). Метилпреднизолон в составе комбинированной ИСТ получали 145 пациентов (99,3%), у одного пациента применили беcстероидную схему ИСТ (0,7%).
Сочетанная трансплантация почки и поджелудочной железы
Реципиенты
Среди реципиентов почки и поджелудочной железы было 33 мужчины (39,3%) и 51 женщина (60,7%), медиана возраста которых составила 35 [ 33,7–36,2] лет, медиана индекса массы тела — 20,8 [ 19,5–22,6] кг/м². Медиана возраста наступления дебюта заболевания исчислялась 10 [ 8–13] годами, медиана продолжительности СД к моменту трансплантации — 25 (24–26) годами. 79 реципиентов (94%) к моменту выполнения трансплантации получали ЗПТ: 55 пациентов (65,4%) посредством программного гемодиализа, 24 (28,6%) — посредством перитонеального диализа. Продолжительность ЗПТ варьировала от нескольких месяцев до 18 лет, медиана составила 2 [ 1–4] года. Пяти реципиентам (6%) выполнили додиализную трансплантацию. Во всех случаях пациентам выполнили первичную СТПиПЖ.
Доноры
Донорами органов были 72 (85,7%) мужчины, 12 (14,3%) женщин. Медиана возраста доноров составила 28,4 [ 27–29,8] года. Причиной смерти 30 доноров (35,7%) было ОНМК, 54 (64,3%) — ЧМТ. На момент эксплантации уровень креатинина и мочевины крови составлял 92,7 [ 86,6–98,8] мкмоль/л и 4,9 [ 3,9–6,5] ммоль/л соответственно. У 4 доноров (4,8%) микробиологический посев перфузата трансплантата выявлял наличие микрофлоры.
Техника операции
Внутрибрюшную трансплантацию поджелудочной железы (ТПЖ) с формированием дуоденоеюнального анастомоза выполнили 22 реципиентам (26,2%). Забрюшинную трансплантацию ТПЖ выполнили 62 пациентам (73,8%), у 50 из них (59,5%) отведение панкреатического сока осуществляли в двенадцатиперстную кишку и у 12 реципиентов (14,3%) — в отключенную по Ру петлю тонкой кишки. Реваскуляризацию ТПЖ осуществляли с использованием Y-образного сосудистого протеза с восстановлением кровоснабжения по селезеночной и верхней брыжеечной артериям у 74 пациентов (88,1%). Изолированное кровоснабжение ТПЖ по селезеночной артерии использовали у 9 реципиентов (10,7%), восстановление кровоснабжения по трем артериям (гастродуоденальной, верхней брыжеечной и селезеночной) — у 1 реципиента (1,2%).
Иммуносупрессивная терапия
Индукционную ИСТ выполняли в следующем объеме: 62 (73,8%) пациентам выполняли инфузию моноклональных антител (ингибиторов рецепторов интерлейкина-2 — базиликсимаба), 22 пациентам — поликлональных антител (14 пациентам (16,7%) — иммуноглобулина антитимоцитарного кроличьего, 8 (9,5%) пациентам — иммуноглобулина антитимоцитарного лошадиного). Пациенты получали базисную трехкомпонентную ИСТ. В качестве ингибитора кальцинейрина у всех пациентов использовали такролимус, однако у 2 пациентов (2,4%) в раннем послеоперационном периоде выполнили конверсию на циклоспорин из-за невозможности достижения референтных значений концентрации такролимуса в крови.
Сравнение групп
Реципиенты в обеих группах статистически достоверно различались по возрасту (в группе СТПиПЖ были моложе) и по возрасту дебюта СД (в группе СТПиПЖ СД дебютировал раньше). По полу достоверных различий не было. Доноры также по полу достоверно не различались. Доноры были статистически значимо младше в группе СТПиПЖ. Длительность консервации почечного аллотрансплантата (ПАТ) была достоверно меньше в группе СТПиПЖ. Протоколы иммуносупрессивной терапии не различались в группах по второму компоненту и индукции. По первому компоненту были выявлены различия, так как в группе ТП чаще использовался циклоспорин.
Сравнительная характеристика параметров реципиентов, доноров и протоколов ИСТ в исследуемых группах представлена в таблице 1.
Таблица 1. Сравнительный анализ параметров реципиентов, перенесших трансплантацию почки и сочетанную трансплантацию почки и поджелудочной железы, доноров и протоколов иммуносупрессивной терапии
|
Трансплантация почки (n=146) |
СТПиПЖ (n=84) |
р |
|
|
Реципиенты |
|||
|
Мужчины, n (%) |
58 (39,7%) |
33 (39,3%) |
0,948 |
|
Женщины, n (%) |
88 (60,3%) |
51 (60,7%) |
0,948 |
|
Возраст, M [ Q1; Q2], лет |
39,5 [ 35; 47] |
34 [ 31; 39] |
<0,001* |
|
Возраст дебюта сахарного диабета, M [ Q1; Q2], лет |
13 [ 9; 17] |
10 [ 8–13] |
0,001* |
|
Доноры |
|||
|
Мужчины, n (%) |
102 (69,7%) |
71 (84,5%) |
0,065 |
|
Женщины, n (%) |
44 (30,3%) |
13 (15,5%) |
0,065 |
|
Возраст, M [ Q1; Q2], лет |
46 [ 36; 53] |
27 [ 23,75; 32,25] |
<0,001* |
|
Длительность консервации ПАТ, M [ Q1; Q2], часов |
14 [ 11; 16] |
7,5 [ 6; 9,5] |
<0,001* |
|
Иммуносупрессивная терапия |
|||
|
Такролимус/циклоспорин |
109 (74,7%)/37 (25,3%) |
84 (100%)/0 |
0,001* |
|
Микофеноловая кислота/эверолимус |
144 (98,6%)/2 (1,4%) |
84 (100%)/0 |
0,188 |
|
МКАТ/ПКАТ/без АТ |
98 (78,4%)/27 (21,6%)/21 (14,4%) |
62 (73,8%)/22 (26,2%)/0 |
0,946 |
Примечание. СТПиПЖ — сочетанная трансплантация почки и поджелудочной железы, МКАТ—моноклональные антитела, ПКАТ — поликлональные антитела, АТ — антитела, ПАТ — почечный аллотрансплантат.
Определения
О первичной начальной функции трансплантата почки говорили, когда не требовалось проведения сеансов гемодиализа в первые 7 дней после трансплантации; при необходимости их проведения функцию оценивали как отсроченную. Под первично-нефункционирующим трансплантатом понимали трансплантат со стойко отсутствующей функцией с момента трансплантации, однако сохранным кровоснабжением, подтвержденным инструментальными методами исследования (ультразвуковое исследование, КТ); это требовало проведения диализных методов ЗПТ. Для постановки этого диагноза требуется проведение хотя бы одной пункционной биопсии трансплантата для исключения других причин, которые могут способствовать утрате функции [19].
При оценке хирургических осложнений определяли общую частоту хирургических осложнений и частоту клинически значимых осложнений, то есть тех, которые требовали какой-либо хирургической интервенции для их коррекции. Хирургические осложнения распределяли в соответствии с классификацией Clavien-Dindo, модифицированной и видоизмененной Т. Grochowiecki с учетом специфических потребностей в области клинической трансплантации органов [20–22].
К не цензурированной по смерти утрате ПАТ относили возвращение к диализным методам лечения, смерть с функционирующим трансплантатом или повторную додиализную ТП. Летальный исход с функционирующими ПАТ не учитывали в качестве утраты при расчете частоты цензурированной по смерти утраты ПАТ.
Исследование было проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации [23].
Статистическая обработка данных
Статистический анализ проводился с использованием языка программирования R version 4.0.3 в интегрированной среде разработки (Integrated Development Environment — IDE) RStudio/2024.04.0+735 (разработчик — Posit Software, PBC) и IBM SPSS Statistics v 24 (IBM, США). Количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин и стандартных отклонений. В случае отсутствия нормального распределения количественные данные описывали с помощью медианы и нижнего и верхнего квартилей. Категориальные данные описывали с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполняли с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна-Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполняли с помощью точного критерия Фишера (при значениях ожидаемого явления менее 10). Для расчета выживаемости пациентов и трансплантатов использовали метод Каплан-Майера. Сравнение выживаемости выполнялось с помощью теста лонг-ранг. Для оценки значимости отношения шансов рассчитывали границы 95% доверительного интервала. Различия считали статистически значимыми при р<0,05. Для создания диаграмм и графиков применяли графические редакторы Microsoft Office v 16.16.27. Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат Пирсона. Различия считали статистически значимыми при р<0,05. Для создания диаграмм и графиков применяли графические редакторы Microsoft Office v 16.16.27.
РЕЗУЛЬТАТЫ
Трансплантация почки
Начальная функция почечного аллогенного трансплантата
Первичную начальную функцию ПАТ отметили у 100 реципиентов (68,5%), отсроченную — у 46 реципиентов (31,5%). Медиана сроков нормализации азотемии у пациентов с первичной начальной функцией ПАТ составила 6 [ 3; 6] суток, у пациентов с отсроченной начальной функцией — 20,5 [ 14; 27] суток, медиана количества гемодиализов на этапе восстановления функции ПАТ составила 6,5 [ 4–9].
Частота хирургических осложнений
Общая частота хирургических осложнений составила 9,6% (n=14), частота клинически значимых хирургических осложнений составила 6,2% (n=9). У 7 реципиентов (4,8%) ранний послеоперационный период осложнился развитием несостоятельности неоуретероцистоанастомоза с развитием мочевого затека, причиной которой у шести из них был некроз дистальной части мочеточника, что потребовало проведения повторной операции с иссечением некротизированного участка мочеточника и формированием ренеоуретероцистоанастомоза (категории тяжести IIIb). У одного реципиента причиной несостоятельности явился инфекционный процесс вследствие трансплантации первично-инфицированного ПАТ, что привело к нагноению послеоперационной раны с развитием абсцесса ложа трансплантата (категория тяжести IVa). С жизнесохраняющей функцией выполнили нефротрансплантатэктомию.
У 6 пациентов (4,1%) ранний послеоперационный период осложнился развитием лимфоцеле ложа ПАТ. У 5 реципиентов осложнение требовало только динамического наблюдения (категория тяжести I), у 1 пациента — хирургической интервенции в объеме лапароскопической фенестрации лимфоцеле (категория тяжести IIIb).
У одного пациента (0,7%) развилась стриктура мочеточника с гидронефротической трансформацией ПАТ, что потребовало выполнения нефростомии с последующим проведением оперативного вмешательства в объеме иссечения мочеточника в области стриктуры с формированием ренеоуретероцистоанастомоза (категория тяжести IIIb).
Частота острого криза отторжения
Общая частота острого криза отторжения (ОКО) составила 12,3% (n=18). У всех пациентов клиническая картина проявлялась необоснованным снижением диуреза с резким повышением показателей азотемии, а также увеличением размеров трансплантата с признаками отека по результатам проведенного ультразвукового исследования (УЗИ). Диагноз «острый криз отторжения» был подтвержден гистологически. У девяти пациентов удалось купировать ОКО пульс-терапией метилпреднизолоном (3 введения, суммарно 1–1,25 г). Трем пациентам выполняли комбинированную противокризовую терапию в объеме пульс-терапии метилпреднизолоном и инфузий антитимоцитарных поликлональных антител, шести пациентам к этой терапии добавили проведение сеансов плазмафереза. У 17 пациентов отметили положительную динамику по лабораторным показателям и инструментальным методам исследования, что соответствовало восстановлению функции трансплантатов с нормализацией диуреза и азотемии. Проведенная противокризовая терапия не показала эффективности у одного пациента, трансплантат был признан нежизнеспособным, его пришлось удалить.
Частота инфекционных осложнений
Общая частота инфекционных осложнений составила 10,2% (n=15). У восьми пациентов ранний послеоперационный период осложнился развитием пиелонефрита трансплантата, что требовало проведения антибактериальной терапии с использованием препаратов широкого спектра действия с учетом чувствительности к ним по результатам микробиологического исследования мочи (Klebsiella pneumonia + Enterobacter spp.). У четырех больных отметили нагноение послеоперационной раны, что потребовало проведения ревизии и санации ложа ПАТ с заживлением раны вторичным натяжением. У двух пациентов ранний послеоперационный период осложнился развитием цитомегаловирусной (CMV) пневмонии. Отметили положительный эффект от проведенной противовирусной терапии ганцикловиром.
Лабораторные показатели при выписке
Медиана уровня креатинина и мочевины при выписке пациентов из стационара составили 123 [ 99–164] мкмоль/л и 10 [ 7,4–14] ммоль/л соответственно. Уровень гликемии натощак до трансплантации варьировал от 3,5 до 22 ммоль/л, медиана составила 9,8 [ 7,8; 12] ммоль/л; показали гликемии в первые трое суток после трансплантации варьировали от 3,3 до 30 ммоль/л, медиана составила 15 [ 12; 17] ммоль/л; при выписке пациентов из стационара минимум и максимум показателей составили 3,9 и 19,5 ммоль/л, соответственно, медиана — 8,1 [ 6,5; 10] ммоль/л. Суточная доза инсулина до трансплантации варьировала от 0,3 до 1,49 ЕД/кг, медиана составила 0,7 [ 0,55; 0,9] ЕД/кг; в первые трое суток после трансплантации показатели варьировали от 0,45 до 2,37 ЕД/кг, медиана — 0,99 [ 0,8; 1,25] ЕД/кг; при выписке минимум и максимум дозы инсулина составили 0,35 и 1,7 ЕД/кг, медиана — 0,88 [ 0,7; 1,1] ЕД/кг. Показатели гликированного гемоглобина до трансплантации варьировали от 4,4 до 13,4%, после трансплантации — от 5,5 до 11,3 %, медианы показателей составили 7,7 [ 6,9; 8,6]% и 7,3 [ 6,7; 8,3]% соответственно.
Выживаемость почечного аллогенного трансплантата и реципиентов
Госпитальная выживаемость реципиентов составила 100% (n=146), выживаемость трансплантатов — 95,2% (n=139). С функционирующим трансплантатом и показателями креатинина ниже 200 мкмоль/л выписали 126 пациентов (86,3%), с показателями креатинина выше 200 мкмоль/л, не требующими проведения ЗПТ, выписали 13 пациентов (8,9%). Одного пациента (0,69%) выписали для продолжения ЗПТ на амбулаторном этапе, функция ПАТ восстановилась в течение 2 месяцев после ТП. Морфологически верифицированный первично-нефункционирующий ПАТ отметили у 4 пациентов (2,74%), пациенты были выписаны для продолжения ЗПТ амбулаторно и поставлены в лист ожидания на повторную ТП. Двум пациентам (1,37%) выполнили госпитальное удаление ПАТ. У одного реципиента с отсроченной функцией причиной утраты ПАТ был некупируемый ОКО, трансплантат был признан нежизнеспособным и удален. У другого пациента ПАТ функционировал, однако вследствие пересадки первично-инфицированного трансплантата, ранний послеоперационный период осложнился нагноением послеоперационной раны с развитием абсцесса ложа трансплантата. С жизнесохраняющей целью пациенту выполнили нефротрансплантатэктомию, отмену ИСТ и лечение антибиотиками по результатам определения чувствительности возбудителя. 1-летняя выживаемость почечного трансплантата составила 92,5%, реципиентов — 96%.
По состоянию на 31.12.2024 г. 98 пациентов из 146 (67,1%) были живы, у 87 (59,6%) из них ПАТ функционировал. Структура причин утраты функции ПАТ у 11 (7,5%) живых пациентов: возвратная диабетическая нефропатия (n=4), рецидивирующие пиелонефриты трансплантата (n=4), ОКО (n=3). 48 (32,9%) реципиентов умерли в разные сроки после ТП, из них у 33 пациентов функция ПАТ была сохранена. Структура причин летальных исходов: инфекционные осложнения (n=22), сердечно-сосудистые заболевания (n=15), ОНМК (n=6), онкологические заболевания (n=3), гипогликемическая кома (n=1), тяжелая бытовая травма (n=1).
Сочетанная трансплантация почки и поджелудочной железы
Начальная функция почечного аллогенного трансплантата
Первичную начальную функцию ПАТ отметили у 70 реципиентов (83,3%), отсроченную — у 14 реципиентов (16,7%). Медиана сроков нормализации азотемии у пациентов с первичной начальной функцией ПАТ составила 3 [ 2; 3] суток, у пациентов с отсроченной начальной функцией — 20 [ 8; 28] суток, медиана количества гемодиализов на этапе восстановления функции ПАТ составила 3 [ 1; 8].
Частота хирургических и инфекционных осложнений
Общая частота хирургических осложнений составила 59,5% (85 осложнений у 50 реципиентов), частота клинически значимых хирургических осложнений составила 54,8% (54 осложнения у 46 пациентов). Общая частота инфекционных осложнений составила 16,7% (15 осложнений у 14 пациентов), общая частота развития сепсиса — 4,8% (4 случая).
В структуре осложнений превалировали несосудистые осложнения (68,3% по сравнению с 31,7% соответственно (р<0,001)). Структура осложнений: окклюзионный тромбоз верхней брыжеечной артерии (n=20, 23,8%), жидкостное парапанкреатическое скопление (n=17, 20,2%), парапанкреатическая инфекция (n=11, 13,1%), кровотечение в области сформированного кишечного анастомоза (n=8, 9,5%), парез кишечника (n=8, 9,5%), несостоятельность межкишечного анастомоза (n=4, 4,8%), окклюзионный артериальный тромбоз (n=4, 4,8%), окклюзионный венозный тромбоз (n=4, 4,8%), парапанкреатический абсцесс (n=3, 3,6%), неокклюзионный венозный тромбоз (n=3, 3,6%), кровотечение (венозное/артериальное) (n=2, 2,4%), стеноз селезеночной артерии (n=1, 1,2%). По категориям тяжести клинически значимые осложнения были распределены следующим образом: 27 хирургических осложнений категории тяжести IIIa у 21 пациента (25%), 10 осложнений категории тяжести IIIb у 10 пациентов (11,9%), 12 осложнений категории тяжести IVa у 10 пациентов (11,9%), 5 осложнений категории тяжести IVb у 5 пациентов (5,95%).
Клинически значимые инфекционные осложнения IIIa категории возникли у шести (7,1%) пациентов и были представлены нагноением жидкостных парапанкреатических скоплений. У данных пациентов мы проводили деэскалационную антибактериальную терапию с санационно-аспирационными методами лечения. Нами не было зарегистрировано генерализации инфекционного процесса, данные пациенты были выписаны в удовлетворительном состоянии с функционирующими трансплантатами. У одного пациента (1,2%) развилось осложнение IIIb категории, которое было представлено инфицированием парапанкреатического жидкостного скопления, которое потребовало выполнения релапаротомии, санации и дренирования ложа панкреатодуоденального трансплантата. Пациент также был выписан с функционирующими трансплантатами. У двух пациентов (2,4%) развилась несостоятельность межкишечного анастомоза с инфицированием ложа ТПЖ. Несмотря на выполненную трансплантатэктомию, у пациентов наблюдали отсутствие заживления дефекта кишечной стенки, на фоне которой произошла генерализация инфекции с развитием сепсиса, что привело к летальному исходу. Данные осложнения относились к IVb категории.
Общая частота острого криза отторжения
Частота ОКО составила 26,2% (29 осложнений у 22 реципиентов). Противокризовую терапию выполняли в следующем объеме:
- девяти пациентам — исключительно пульс-терапию метилпреднизолоном;
- восьми пациентам — пульс-терапию метилпреднизолоном, инфузию поликлональных антитимоцитарных антител и плазмаферез. В качестве поликлональных антител у 1 пациента использовали антитимоцитарный кроличий иммуноглобулин, у 7 - антитимоцитарный лошадиный иммуноглобулин;
- двум пациентам — пульс-терапию метилпреднизолоном и инфузию поликлональных антитимоцитарных антител;
- двум пациентам— инфузию поликлональных антитимоцитарных антител и проведение курса плазмаферезов;
- одному пациенту — пульс-терапию метилпреднизолоном и курс плазмаферезов.
Использованная противокризовая терапия показала высокую эффективность, лишь у 1 пациента не удалось справиться с ОКО и пришлось удалить почечный трансплантат.
Выживаемость трансплантатов и реципиентов
Госпитальная не цензурированная по смерти выживаемость ПАТ составила 85,7% (n=72), ТПЖ — 78,6 % (n=66), пациентов — 88,1% (n=74). Структура причин летальных исходов реципиентов: полиорганная недостаточность, развившаяся после удаления обоих трансплантатов (n=4); острая сердечно-сосудистая недостаточность в первые 4-6 суток после трансплантации на фоне адекватно функционирующих обоих трансплантатов (n=3); катетер-ассоциированная инфекция кровотока, развившаяся у пациента с первично нефункционировавшим ПАТ и адекватно функционировавшим ТПЖ (n=1); некупируемый ОКО ТПЖ, развившийся у пациента с нефункционировавшим ПАТ (n=1); полиорганная недостаточность у пациента с дисфункцией обоих трансплантатов (n=1).
1-летняя не цензурированная по смерти выживаемость ПАТ составила 84,5%, ТПЖ — 82,3%, реципиентов — 88,1%.
По состоянию на 31.12.2024: 64 пациента (76,2%) были живы, из них у 51 (60,7%) функционировали оба трансплантата, у 8 (9,5%) — только ПАТ, у 3 (3,6%) — только ТПЖ, у 2 (2,4%) утрачена функция обоих трансплантатов. В отдаленном послеоперационном периоде умерло 10 (11,9%) реципиентов, из них 8 (9,5%) пациентов с функционирующими обоими трансплантатами, 1 (1,2%) пациентка с функционирующим только ПАТ, 1 (1,2%) пациентка — с удаленными на госпитальном этапе обоими трансплантатами. Из 20 умерших пациентов у 11 была сохранная функция ТПЖ на момент летального исхода. Общая выживаемость ТПЖ составила 64,3% (54 трансплантат), цензурированная по смерти выживаемость ТПЖ — 73,8% (62 ТПЖ). Общая выживаемость ПАТ составила 70,2% (59 почек), цензурированная по смерти выживаемость ПАТ — 82,1% (69 почек).
На рисунках 1 и 2 представлены показатели выживаемости ПАТ и реципиентов, перенесших изолированную ТП и СТПиПЖ.
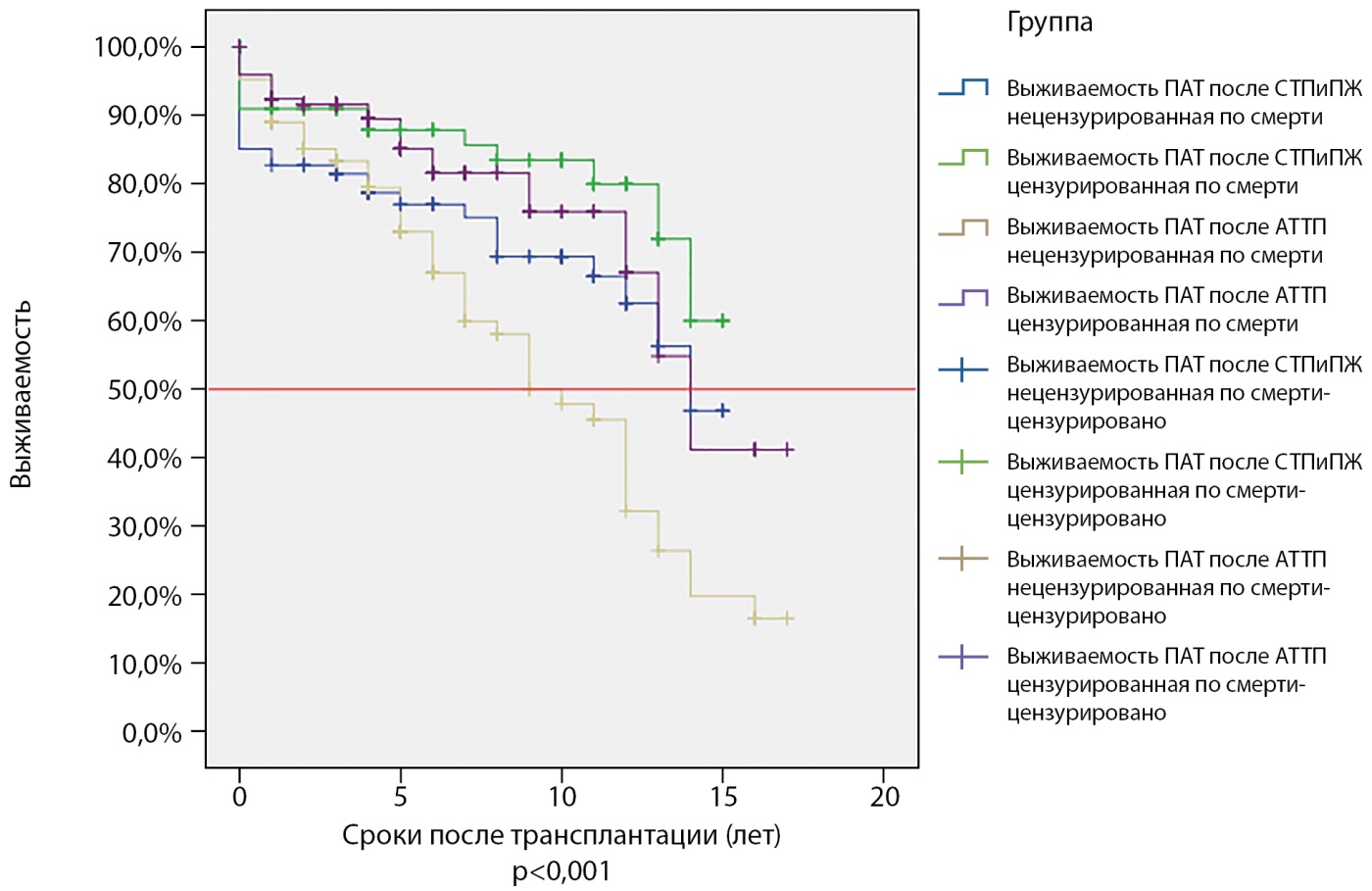
Рисунок 1. Цензурированная (выделенная зеленым и сиреневым цветом) и не цензурированная по смерти (выделенная синим и желтым) выживаемость почечных трансплантатов у пациентов с сахарным диабетом 1 типа после изолированной трансплантации почки (желтая и сиреневая кривая) и сочетанной трансплантации почки и поджелудочной железы (зеленая и синяя кривая). Красной линией отмечен уровень полужизни трансплантатов.
Примечание. ПАТ — почечный аллотрансплантат; СТПиПЖ — сочетанная трансплантация почки и поджелудочной железы; АТТП — аллотрансплантация трупной почки.
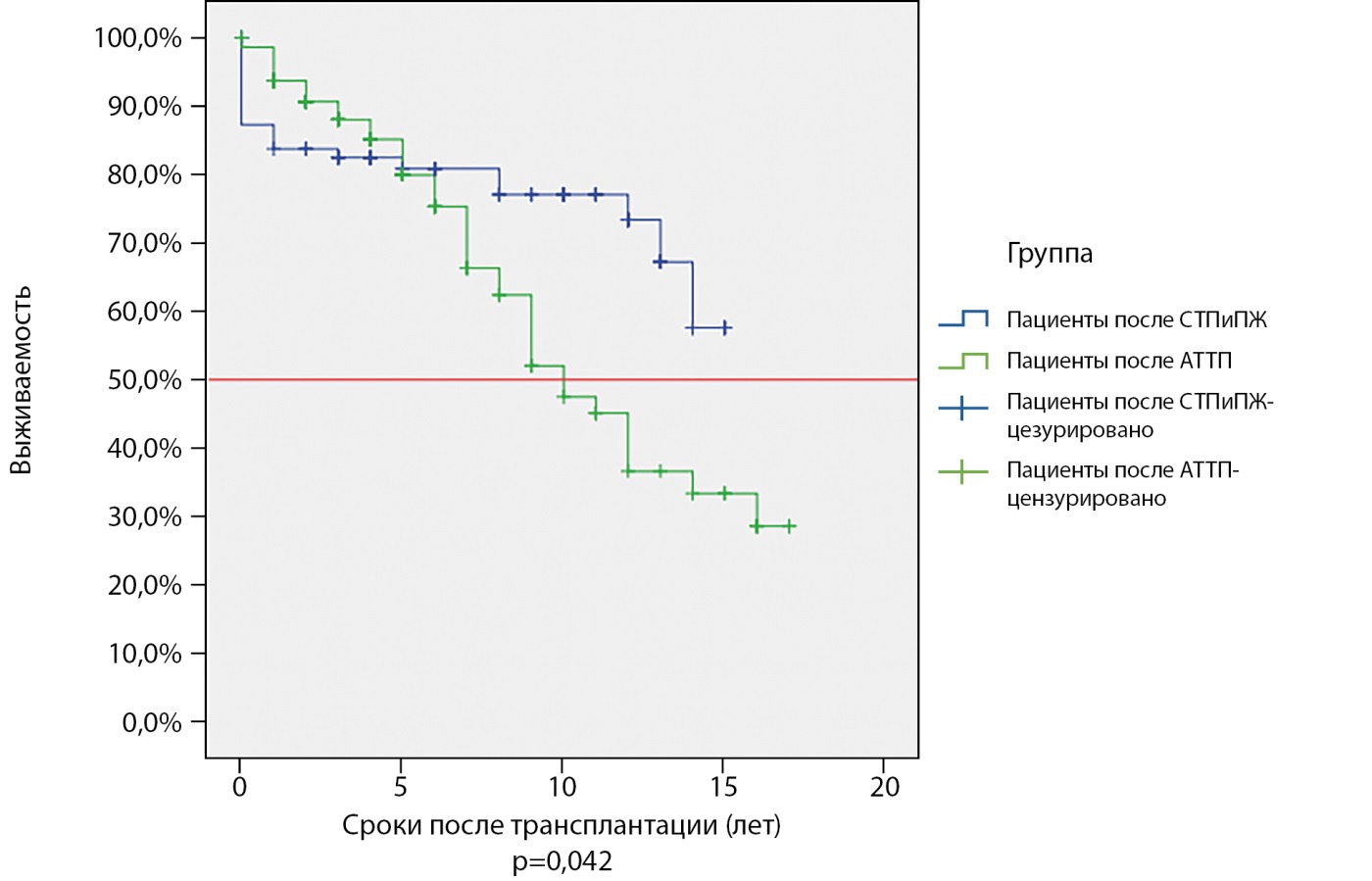
Рисунок 2. Выживаемость пациентов с сахарным диабетом 1 типа после трансплантации почки (выделено зеленым) и сочетанной трансплантации почки и поджелудочной железы (выделено синим цветом). Красной линией отмечен уровень полужизни реципиентов.
Примечание. СТПиПЖ — сочетанная трансплантация почки и поджелудочной железы; АТТП — аллотрансплантация трупной почки.
ОБСУЖДЕНИЕ
СД сохраняет статус социально-значимого заболевания, поскольку темпы роста заболеваемости остаются неутешительными, а развитие вторичных диабетических осложнений способствует высокой инвалидизации и летальности, а также значимо снижает качество жизни этой категории пациентов. Нетрансплантационные методы лечения ХБПС 5 стадии в исходе диабетической нефропатии ограничены в своей эффективности, поэтому ТП по-прежнему рассматривается в качестве метода выбора в лечении этих пациентов, которая значимо повышает продолжительность и качество жизни. Пациенты с диабетической этиологией ХБПС 5 стадии составляют самую быстрорастущую группу реципиентов, получающих ЗПТ. Согласно регистровым данным разных стран, СД занимает 2–3 место в структуре заболеваний пациентов, находящихся в листах ожидания ТП. У пациентов с более ранним дебютом СД и более тяжелым неконтролируемым течением быстрее развивались диабетические осложнения, в том числе приводящие к ХБП 5 стадии. По этой причине в нашем исследовании возраст реципиентов и доноров в группе СТПиПЖ статистически достоверно был меньше, чем в группе пациентов, перенесших изолированную ТП. Учитывая более старший возраст реципиентов ПАТ, им чаще назначался циклоспорин в качестве первого компонента ИСТ.
По данным ряда авторов, частота хирургических осложнений после ТП пациентам с СД1 колеблется в диапазоне от 1% до 30% [24–26]. Общая частота хирургических осложнений у пациентов, перенесших ТП, в нашем исследовании составила 9,6%, у пациентов после СТПиПЖ — 59,5%. Общая частота иммунологических осложнений, по данным доступной медицинской литературы, варьирует в пределах от 4,8 до 19% [26–27]. По полученным нами данным, частота иммунологических осложнений у пациентов после изолированной ТП составила 12,3%, после СТПиПЖ — 26,2%. Использованные протоколы диагностики, иммунологического мониторинга и противокризовой терапии показали высокую эффективность. Лишь у одного реципиента после ТП отметили утрату трансплантата по иммунологическим причинам.
Общая частота инфекционных осложнений в раннем послеоперационном периоде, по данным ряда исследований, исчисляется 2–25% [24][26][28]. По данным нашего центра, она составила 10,2% после ТП и 16,7% после СТПиПЖ. Выбранные протоколы антибиотикопрофилактики и проведенное лечение инфекционных осложнений способствовало сохранению трансплантатов, только у одного пациента после ТП с жизнесохраняющей целью была выполнена нефротрансплантатэктомия вследствие пересадки первично-инфицированного трансплантата. У 2 пациентов после СТПиПЖ, несмотря на выполненную трансплантатэктомию, произошла генерализация инфекции с развитием сепсиса, что на фоне незаживающего дефекта кишечной стенки привело к летальному исходу.
На момент окончания исследования среди пациентов, перенесших ТП, были живы 98 пациентов (67,1%), причем у 87 (59,6%) из них ПАТ функционировал. Среди причин утраты функции трансплантата преобладали возвратная диабетическая нефропатия, а также инфекционные и иммунологические причины; 48 (32,9%) реципиентов указанной группы умерли в разные сроки после трансплантации, у большей части из них (68,8%) ПАТ функционировал на момент летального исхода. Основными причинами летальных исходов были инфекционные осложнения (45,8%), сердечно-сосудистые заболевания (n=31,3%) и ОНМК (12,5%). Из пациентов, перенесших СТПиПЖ, на момент окончания исследования живыми были 64 пациента (76,2%), у 59 (70,2%) из них ПАТ функционировал, у 54 (64,3%) ТПЖ функционировал. Из 20 умерших пациентов у 13 ПАТ функционировал на момент наступления летального исхода, у 13 была сохранная функция ТПЖ. Среди причин летальных исходов на госпитальном этапе преобладали полиорганная недостаточность, развившаяся после удаления обоих трансплантатов (n=4), и острая сердечно-сосудистая недостаточность в первые 4–6 суток после трансплантации с адекватно функционирующими обоими трансплантатами (n=3); из причин летальных исходов в отдаленном послеоперационном периоде преобладали сердечно-сосудистые (n=4) и инфекционные осложнения (n=3).
ЗАКЛЮЧЕНИЕ
Пациенты с СД1 и ХБПС 5 стадии являются наиболее сложной группой диализных больных. Они требуют более тщательного обследования при постановке в лист ожидания трансплантационного лечения, более серьезной подготовки к трансплантации и ведения в раннем и отдаленном послеоперационном периоде. В исследовании отражена высокая смертность по причине сердечно-сосудистых осложнений у пациентов с утратой почечного трансплантата и вынужденными вернуться к продолжению диализных методов ЗПТ.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансовых средств.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Вклад авторов: Дмитриев И.В. — разработка концепции и дизайна, сбор материала, анализ и интерпретация данных для работы, написание статьи, редактирование, внесение исправлений, проверка критически важного интеллектуального содержания; Лазарева К.Е. — разработка концепции и дизайна, сбор материала, анализ и интерпретация данных для работы, написание статьи; Балкаров А.Г. — разработка концепции и дизайна, утверждение окончательного варианта рукописи; Журавель Н.С. — разработка концепции и дизайна, сбор материала, анализ и интерпретация данных для работы, написание статьи; Шмарина Н.В. — редактирование, внесение исправлений, проверка критически важного интеллектуального содержания.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022;12(1):7-11. doi: https://doi.org/10.1016/j.kisu.2021.11.003
2. Jha V, Al-Ghamdi SMG, Li G, et al. Global Economic Burden Associated with Chronic Kidney Disease: A Pragmatic Review of Medical Costs for the Inside CKD Research Programme. Adv Ther. 2023;40(10):4405-4420. doi: https://doi.org/10.1007/s12325-023-02608-9
3. Андрусев А.М., Перегудова Н.Г., Шинкарев М.Б., Томилина Н.А. Заместительная почечная терапия хронической болезни почек 5 стадии в Российской Федерации 2016–2020 гг. Краткий отчет по данным Общероссийского Регистра заместительной почечной терапии Российского диализного общества // Нефрология и диализ. — 2022. — Т. 24. — №4. — С. 555–565. doi: https://doi.org/10.28996/2618-9801-2022-4-555-565
4. Данович Г.М. Трансплантация почки: руководство: пер. с англ. — Москва: ГЭОТАР-Медиа, 2013.
5. Statista.com [Internet]. Estimated number of organ transplantations worldwide in 2023 [cited 2025 Jan 29]. Available from: https://www.statista.com/statistics/398645/global-estimation-of-organ-transplantations/
6. Tingle SJ, Figueiredo RS, Moir JA, Goodfellow M, Talbot D, Wilson CH. Machine perfusion preservation versus static cold storage for deceased donor kidney transplantation. Cochrane Database Syst Rev. 2019;3(3):CD011671. doi: https://doi.org/10.1002/14651858.CD011671.pub2
7. Hosgood SA, Callaghan CJ, Wilson CH, et al. Normothermic machine perfusion versus static cold storage in donation after circulatory death kidney transplantation: a randomized controlled trial. Nat Med. 2023;29(6):1511-1519. doi: https://doi.org/10.1038/s41591-023-02376-7
8. Malinoski D, Saunders C, Swain S, et al. Hypothermia or Machine Perfusion in Kidney Donors. N Engl J Med. 2023;388(5):418-426. doi: https://doi.org/10.1056/NEJMoa2118265
9. International Diabetes Federation [Internet]. IDF Diabetes Atlas, 10th ed. [cited 2025 Jan 29]. Available from: https://diabetesatlas.org/data/en/
10. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010 – 2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. doi: https://doi.org/10.14341/DM13035
11. Brunkhorst R, Lufft V, Dannenberg B, Kliem V, Tusch G, Pichlmayr R. Improved survival in patients with type 1 diabetes mellitus after renal transplantation compared with hemodialysis: a case-control study. Transplantation. 2003;76(1):115-119. doi: https://doi.org/10.1097/01.TP.0000070225.38757.81
12. Medina-Polo J, Domínguez-Esteban M, Morales JM, et al. Cardiovascular events after simultaneous pancreas-kidney transplantation. Transplant Proc. 2010;42(8):2981-2983. doi: https://doi.org/10.1016/j.transproceed.2010.07.046
13. Ziaja J, Chudek J, Kolonko A, et al. Does simultaneously transplanted pancreas improve long-term outcome of kidney transplantation in type 1 diabetic recipients?. Transplant Proc. 2011;43(8):3097-3101. doi: https://doi.org/10.1016/j.transproceed.2011.08.020
14. King EA, Kucirka LM, McAdams-DeMarco MA, et al. Early Hospital Readmission After Simultaneous Pancreas-Kidney Transplantation: Patient and Center-Level Factors. Am J Transplant. 2016;16(2):541-549. doi: https://doi.org/10.1111/ajt.13485
15. Schreiber PW, Laager M, Boggian K, et al. Surgical site infections after simultaneous pancreas kidney and pancreas transplantation in the Swiss Transplant Cohort Study. J Hosp Infect. 2022;128:47-53. doi: https://doi.org/10.1016/j.jhin.2022.07.009
16. Nagendra L, Fernandez CJ, Pappachan JM. Simultaneous pancreas-kidney transplantation for end-stage renal failure in type 1 diabetes mellitus: Current perspectives. World J Transplant. 2023;13(5):208-220. doi: https://doi.org/10.5500/wjt.v13.i5.208
17. Schreiber PW, Laager M, Boggian K, et al. Surgical site infections after simultaneous pancreas kidney and pancreas transplantation in the Swiss Transplant Cohort Study. J Hosp Infect. 2022;128:47-53. doi: https://doi.org/10.1016/j.jhin.2022.07.009
18. Esmeijer K, Hoogeveen EK, van den Boog PJM, et al. Superior Long-term Survival for Simultaneous Pancreas-Kidney Transplantation as Renal Replacement Therapy: 30-Year Follow-up of a Nationwide Cohort. Diabetes Care. 2020;43(2):321-328. doi: https://doi.org/10.2337/dc19-1580
19. Hamed MO, Chen Y, Pasea L, et al. Early graft loss after kidney transplantation: risk factors and consequences. Am J Transplant. 2015;15(6):1632-1643. doi: https://doi.org/10.1111/ajt.13162
20. Grochowiecki T, Gałązka Z, Madej K, et al. Multivariate analysis of complications after simultaneous pancreas and kidney transplantation. Transplant Proc. 2014;46(8):2806-2809. doi: https://doi.org/10.1016/j.transproceed.2014.08.010
21. Grochowiecki T, Gałązka Z, Madej K, et al. Surgical complications related to transplanted pancreas after simultaneous pancreas and kidney transplantation. Transplant Proc. 2014;46(8):2818-2821. doi: https://doi.org/10.1016/j.transproceed.2014.08.012
22. Grochowiecki T, Madej K, Gałązka Z, et al. Usefulness of Modified Dindo-Clavien Scale to Evaluate the Correlation Between the Severity of Surgical Complications and Complications Related to the Renal and Pancreatic Grafts After Simultaneous Kidney and Pancreas Transplantation. Transplant Proc. 2016;48(5):1677-1680. doi: https://doi.org/10.1016/j.transproceed.2016.01.091
23. World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 2013;310(20):2191-2194. doi: https://doi.org/10.1001/jama.2013.281053
24. Khadjibaev F, Sultanov P, Ergashev D, et al. Frequency of Complications After Kidney Transplant in the Early Postoperative Period. Exp Clin Transplant. 2024;22(Suppl 1):195-199. doi: https://doi.org/10.6002/ect.MESOT2023.P25
25. Timsit MO, Kleinclauss F, Richard V, Thuret R. Complications chirurgicales de la transplantation rénale [Surgical complications of renal transplantation]. Prog Urol. 2016;26(15):1066-1082. doi: https://doi.org/10.1016/j.purol.2016.09.052
26. Gutiérrez P, Marrero D, Hernández D, et al. Surgical complications and renal function after kidney alone or simultaneous pancreas-kidney transplantation: a matched comparative study. Nephrol Dial Transplant. 2007;22(5):1451-1455. doi: https://doi.org/10.1093/ndt/gfl771
27. Treckmann JW, Goldenberg A, Malamutmann E, et al. Kidney transplantation in patients with diabetes mellitus: surgical complications. Hepatogastroenterology. 2011;58(107-108):738-739
28. Siskind E, Huntoon K, Shah K, et al. Partial closure of skin wounds after kidney transplantation decreases the incidence of postoperative wound infections. Int J Angiol. 2012;21(2):85-88. doi: https://doi.org/10.1055/s-0032-1315797
Об авторах
И. В. ДмитриевРоссия
.
Дмитриев Илья Викторович - д.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
К. Е. Лазарева
Россия
Лазарева Ксения Евгеньевна - к.м.н., доцент.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. Г. Балкаров
Россия
Балкаров Аслан Галиевич - к.м.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. С. Журавель
Россия
Журавель Никита Сергеевич, к.м.н. - ст.н.с.
129090, Москва, Большая Сухаревская площадь, д. 3
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. В. Шмарина
Россия
Шмарина Нонна Валерьевна - к.м.н., ст.н.с.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Цензурированная (выделенная зеленым и сиреневым цветом) и не цензурированная по смерти (выделенная синим и желтым) выживаемость почечных трансплантатов у пациентов с сахарным диабетом 1 типа после изолированной трансплантации почки (желтая и сиреневая кривая) и сочетанной трансплантации почки и поджелудочной железы (зеленая и синяя кривая). Красной линией отмечен уровень полужизни трансплантатов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(619KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Выживаемость пациентов с сахарным диабетом 1 типа после трансплантации почки (выделено зеленым) и сочетанной трансплантации почки и поджелудочной железы (выделено синим цветом). Красной линией отмечен уровень полужизни реципиентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(444KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Дмитриев И.В., Лазарева К.Е., Балкаров А.Г., Журавель Н.С., Шмарина Н.В. Ранние и отдаленные результаты трансплантационного лечения пациентов с хронической болезнью почек 4–5 стадий в исходе сахарного диабета 1 типа. Сахарный диабет. 2025;28(4):332-341. https://doi.org/10.14341/DM13323
For citation:
Dmitriev I.V., Lazareva K.E., Balkarov A.G., Zhuravel N.S., Shmarina N.V. Early and long-term results of transplantation treatment of patients with stage 4–5 chronic kidney disease in the outcome of type 1 diabetes mellitus. Diabetes mellitus. 2025;28(4):332-341. (In Russ.) https://doi.org/10.14341/DM13323

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































