Перейти к:
Транскрипционные особенности аутоиммунного сахарного диабета: дифференциальная экспрессия генов в CD4+ и CD8+ субпопуляциях Т-клеток крови
https://doi.org/10.14341/DM13316
Аннотация
ОБОСНОВАНИЕ. Латентный аутоиммунный диабет взрослых (LADA, latent autoimmune diabetes mellitus in adults) рассматривается как промежуточная форма между сахарным диабетом 1 типа (СД1) и 2 типа (СД2), однако молекулярные механизмы, объясняющие его уникальные клинико-патогенетические особенности, остаются недостаточно изученными. Определение дифференциально экспрессируемых генов (ДЭГ) при LADA в сравнении с СД1 необходимо для разработки более персонифицированных подходов к диагностике и терапии.
ЦЕЛЬ. Определить ДЭГ в периферических мононуклеарах крови у пациентов с LADA по сравнению с СД1, а также оценить отличия этих двух групп от здоровых добровольцев.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование включены 60 человек (23 пациента с СД1 длительностью до 1 года, 15 пациентов с LADA длительностью до 5 лет и 22 здоровых добровольца). Средний возраст пациентов с LADA составил 40 [34; 45] лет, с СД1 — 26 [21; 31] лет. Дизайн — одномоментное наблюдательное одноцентровое исследование. У всех участников выделяли периферические мононуклеары крови и выполняли секвенирование РНК одиночных клеток (scRNA-seq). Дифференциальный анализ экспрессии генов проводили с использованием «псевдобалкового» подхода (pyDEseq2, p<0,05 с поправкой на множественные сравнения, |log2FoldChange|≥0,5). Статистический анализ осуществляли с применением непараметрических критериев (Краскела–Уоллиса, Манна–Уитни).
РЕЗУЛЬТАТЫ. У пациентов с LADA выявлено снижение экспрессии HLA-G, SPARC и C20orf204 и повышение AC002460.2 по сравнению со здоровыми добровольцами (p<0,05) в CD4+ наивных Т-клетках. В группе СД1 основные отличия касались CD4+ T клеток центральной памяти (IFIT1, CASP3, LAMP3, HIST1H2BN). При сравнении LADA и СД1 статистически значимо различался только один ген (C20orf204, p<0,05) в CD4+ наивных Т-клетках.
ЗАКЛЮЧЕНИЕ. Полученные данные свидетельствуют о близости молекулярно-генетических паттернов LADA и СД1. У пациентов с LADA наблюдаются умеренные изменения в экспрессии ряда генов, связанных с иммунной регуляцией и воспалением. Минимальные различия между этими формами СД подчеркивают сходство патогенеза.
Ключевые слова
Для цитирования:
Голодников И.И., Подшивалова Е.С., Чечехин В.И., Зубрицкий А.В., Матросова А.А., Дворяньчиков Я.В., Самсонова М.Д., Маркелова Е.К., Медведева Ю.А., Никонова Т.В., Бондаренко Е.В., Попов С.В., Минниахметов И.Р., Шестакова М.В. Транскрипционные особенности аутоиммунного сахарного диабета: дифференциальная экспрессия генов в CD4+ и CD8+ субпопуляциях Т-клеток крови. Сахарный диабет. 2025;28(2):124-135. https://doi.org/10.14341/DM13316
For citation:
Golodnikov I.I., Podshivalova E.S., Chechekhin V.I., Zubritsky A.V., Matrosova A.A., Dvoryanchikov Y.V., Samsonova M.D., Markelova E.K., Medvedeva Y.A., Nikonova T.V., Bondarenko E.V., Popov S.V., Minniakhmetov I.R., Shestakova M.V. Transcriptional features of autoimmune diabetes: differentially expressed genes in CD4+ and CD8+ subpopulations of blood T cells. Diabetes mellitus. 2025;28(2):124-135. (In Russ.) https://doi.org/10.14341/DM13316
ОБОСНОВАНИЕ
Латентный аутоиммунный диабет взрослых (LADA — Latent Autoimmune Diabetes in Adults) представляет собой уникальную форму сахарного диабета (СД), объединяющую черты СД 1 типа (СД1) и СД 2 типа (СД2). С одной стороны, патогенез LADA схож с СД1: наличие аутоантител к β-клеткам с постепенным снижением их функции вплоть до полной инсулинозависимости. С другой стороны, этому заболеванию присущи клинические характеристики СД2, такие как эффективность таблетированных сахароснижающих препаратов в начале заболевания, нередко сопровождающаяся избыточной массой тела [1]. Сочетание аутоиммунных механизмов повреждения β-клеток и метаболических нарушений, характерных для СД2, наглядно демонстрирует гетерогенность процесса, лежащего в основе развития LADA. Данный тип СД — это уникальная модель для фундаментальных исследований патогенеза заболевания. Однако ответа на вопрос, почему при одновременном наличии аутоантител к β-клеткам при LADA и СД1 скорость снижения их функциональной активности отличается, до сих пор нет.
Ранее были установлены общие черты патогенеза, например, для LADA и СД1 уже выявлен ряд общих генов HLA (Human Leukocyte Antigens), ассоциированных с повышенным риском развития заболевания — HLA-DRB1, HLA-DQA1 и HLA-DQB1 [2]. Многочисленные исследования свидетельствуют о том, что при СД1 существует ряд дифференциально экспрессируемых генов (ДЭГ), вовлеченных как в развитие заболевания, так и в формирование его осложнений. Так, в мультицентровом исследовании 2022 г., проведенном среди пациентов из Объединенных Арабских Эмиратов, было выявлено семь основных генов (SPINK9, TRDN, PVRL4, MYO3A, PDLIM1, KIAA1614 и GRP), уровень экспрессии которых повышался при различных осложнениях СД1 [3]. Наиболее заметными среди них оказались SPINK9 и MYO3A, особенно при дислипидемии, диабетической нейропатии и коморбидных состояниях. Дополнительные доказательства гетерогенности патогенеза СД1 получены в метаанализе, объединившем несколько наборов данных экспрессии генов при СД1. В ходе анализа было выявлено 3824 ДЭГ, из которых 2030 были гиперэкспрессированы, а 1794 — гипоэкспрессированны. При этом семь ключевых генов (TLN1, ANPEP, F13A1 и другие) демонстрировали исключительно специфическую экспрессию на протяжении течения СД1 [4].
CD4+ и CD8+ Т-лимфоциты играют ключевую роль в развитии аутоиммунного СД, так как именно они опосредуют инфильтрацию и последующую деструкцию β-клеток. Дифференциальная экспрессия генов в этих субпопуляциях позволяет выявить, какие молекулярные механизмы активно поддерживают или, наоборот, сдерживают аутоиммунный процесс. Сопоставление паттернов экспрессии в CD4+ и CD8+ клетках при LADA и СД1 помогает определить, чем именно эти формы заболевания отличаются на уровне иммунной регуляции и насколько сходны их ключевые факторы, влияющие на динамику β-клеточной деструкции.
Таким образом, имеющиеся данные подчеркивают многообразие патогенетических механизмов, лежащих в основе аутоиммунного СД, и подтверждают необходимость углубленного изучения молекулярных процессов, отличающих различные его формы. В частности, несмотря на прогресс в выявлении ДЭГ при СД1, вопрос о том, какие генетические и транскриптомные особенности определяют различия между LADA и СД1, остается открытым.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Определить ДЭГ в подтипах Т-клеток крови у пациентов с LADA по сравнению с СД1, а также оценить отличия этих двух групп от здоровых добровольцев.
МАТЕРИАЛЫ И МЕТОДЫ
Время и место проведения исследования
Исследование проводилось в ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России с февраля 2023-го по декабрь 2024 гг.
Изучаемая популяция
В исследование были включены 3 группы: здоровые добровольцы (22 человека), пациенты с СД1 (23 человека) длительностью до 1 года и с LADA (15 человек) длительностью до 5 лет, суммарно 60 человек.
Критерии включения
- Наличие подписанного информированного согласия.
- Пол: мужской и женский.
- Возраст — от 18 до 55 лет.
- Индекс массы тела (ИМТ) до 35 кг/м².
- Наличие одной из нозологий:
- СД1, длительность до 1 года;
- LADA, длительность до 5 лет.
Критерии исключения
- Наличие другого системного аутоиммунного заболевания (по данным медицинской документации).
- Заболевания поджелудочной железы или перенесенные ранее хирургические вмешательства на поджелудочной железе (по данным медицинской документации).
- Прием иммуносупрессивной терапии в течение предыдущего года (по данным медицинской документации).
Для постановки диагноза LADA были использованы следующие критерии: (1) повышенный титр антител (АТ) к компонентам β-клеток одного АТ или в сочетании (АТ к GAD>10 Ед/мл, АТ к ICA>1 Ед/мл, АТ к инсулину >10 Ед/мл, АТ к IA 2>10 Ед/мл) и (2) отсутствие потребности в инсулинотерапии в течение по крайней мере первых 6 месяцев после установления первоначального диагноза.
Способ формирования выборки
Выборка формировалась сплошным методом, включающим всех пациентов, соответствующих критериям и проходящих стационарное/амбулаторное лечение в указанный период. Исследование было наблюдательным, одномоментным, проведено в одном центре.
Методы
Изученные показатели включали уровень глюкозы на автоматическом биохимическом анализаторе «Architect c8000» («Abbott Laboratories», США); уровень гликированного гемоглобина (HbA1c) — по стандартизации NGSP.
Сбор материала
Сбор периферической венозной крови для измерения уровня глюкозы и HbA1c проводили в вакутейнеры, содержащие гель-разделитель и ЭДТА соответственно, объемом 4 мл (BD Vacutainer, США).
Забор образцов крови для выделения периферических мононуклеаров (ПМНК) осуществляли в CPT-пробирки (BD Vacutainer, США), содержащие гепарин натрия, фиколл и разделительный гель. Объем каждого образца составил 8 мл. После отбора крови каждую пробирку аккуратно переворачивали 3–4 раза для равномерного распределения антикоагулянта и хранили при комнатной температуре не более 2 часов. CPT-пробирки с кровью центрифугировали при температуре 20 °C в течение 20 минут при 1800 RCF с минимальными ускорением и торможением. Аккуратно механическим дозатором удаляли 5 мл супернатанта, а остаток плазмы с клеточной взвесью отбирали в индивидуальные конические пробирки объемом 50 мл для отмывки. В каждую пробирку добавляли 45 мл стерильного промывочного буфера (1x PBS, 1% инактивированная FBS, 1 мМ ЭДТА) и центрифугировали 10 мин при 300 RCF. Супернатант отбирали, к клеточному осадку добавляли 1х буфер для лизиса эритроцитов (ACK Lysing Buffer, ThermoFisher Scientific, США) и мягко ресуспендировали. Через 5 мин добавляли 25 мл промывочного буфера и снова центрифугировали 10 мин при 300 RCF. Супернатант удаляли, клеточный осадок ресуспендировали в 3 мл промывочного буфера, отбирали 10 мкл клеточной суспензии для подсчета клеток. Оставшиеся клетки осаждали центрифугированием 10 мин при 300 RCF, супернатант удаляли, а клеточный осадок ресуспендировали в 1 мл CryoStor CS10 (Stem Cell Tech, Канада) и замораживали при -80 °C. Длительное хранение образцов ПМНК осуществляли при -150 °C.
Подготовка образцов
Образцы ПМНК из криохранилища размораживали на водяной бане при 37 °C в течение 3 мин. Клеточные суспензии мягко ресуспендировали и переносили в конические пробирки объемом 15 мл, содержащие 14 мл среды RPMI-1640 (ПанЭко, Россия) c 10% инактивированной FBS (HyClone, США). Пробирки центрифугировали при 20 °C 10 мин при 300 RCF. Супернатант отбирали, клеточные осадки ресуспендировали в 3 мл среды RPMI-1640 + 10% FBS. Полученные клеточные суспензии фильтровали с помощью MACS SmartStrainer 30 μm (Miltenyi Biotec, Германия) в пробирки объемом 5 мл. Фильтрованные клеточные суспензии держали на льду во время всех дальнейших манипуляций. Для подсчета клеток смешивали 10 мкл отфильтрованной клеточной суспензии и 10 мкл трипанового синего. Подсчет проводили с помощью автоматического счетчика клеток Countess 3 FL (ThermoFisher Scientific, США). Клеточные суспензии центрифугировали при 4 °C в течение 10 мин при 300 RCF. Осадок ресуспендировали в среде RPMI-1640 + 10% FBS до концентрации 3000 клеток/мкл.
Секвенирование одиночных клеток
Анализ транскриптома одиночных клеток ПМНК осуществляли с использованием наборов для 5’-концевого секвенирования (Chromium Next GEM Single Cell 5’ Reagent Kits v2 (Dual Index), 10х genomics, США) согласно протоколам производителя. Образцы ПМНК загружались индивидуально по 50 000 клеток на лунку микрофлюидного чипа, помещаемого в платформу Chromium Controller. Для готовых библиотек проводили контроль качества с помощью Qubit dsDNA HS Assay Kit (ThermoScientific, США) для количественного определения ДНК и Agilent High Sensitivity D1000 ScreenTape Assay (Agilent Technologies, США).
Секвенирование готовых библиотек проводили на платформе Novaseq 6000 (Illumina Inc., США) с использованием наборов NovaSeq 6000 S4 Reagent Kit v1.5 (300 циклов) в режиме парноконцевых прочтений 151–10–10–151. На каждую ячейку загружали пул из 12 образцов с концентрацией в диапазоне 1,4–1,5 нМ.
Биоинформатический анализ
Данные для анализа были получены в результате 5’-секвенирования РНК ПМНК крови. Первичная обработка BCL-файлов, сформированных секвенатором, включала генерацию FASTQ-файлов с использованием программ CellRanger 7.1.0 и bcl2fastq2 12.20. Выравнивание ридов на референсный геном человека (GRCh38-2020-A) выполнено с помощью CellRanger 7.1.0 [5]. Для устранения контаминации окружающей РНК и детекции дублетов клеток применялись пакеты SoupX 1.6.2 и scDblFinder 1.12.0 в среде R 4.2.1 [6][7]. Отбор высококачественных клеток проводился по критериям доли митохондриальных генов (<6%), доли генов белков теплового шока (<2%) и количеству экспрессируемых генов (>200).
Дальнейший анализ осуществлялся в среде Python 3.9.16 с использованием пакета scanpy 1.10.2. Нормализация данных проводилась методом log-transformation с добавлением сдвига, а вариабельные гены определялись алгоритмом seurat_v3. Интеграция данных осуществлена с помощью scVI, scANVI (scvi-tools 1.1.5), Seurat RPCA (Seurat 5.1.0), Harmony (harmony-pytorch 0.1.8), scGen (2.1.1) и BBKNN (1.6.0), при этом выбор оптимального метода интеграции выполнен с использованием scib 1.1.5. Аннотация клеток производилась инструментами scParadise и Azimuth, а также на основе анализа экспрессии маркерных генов, полученных из баз данных CellMarker 2.0, PanglaoDb и GeneCards [8–12]. Выявление ДЭГ между подтипами клеток осуществлялось с помощью scanpy 1.10.2, а аннотация генов — с использованием gpofiler-official 1.0.0.
Для определения дифференциально экспрессированных генов между группами пациентов с LADA и СД1 был использован подход «псевдобалковой» (pseudo-bulk) агрегации, реализованный в пакете pyDEseq2 (версия 0.4.10). Суть псевдобалкового подхода заключается в том, что отдельные профили экспрессии генов на уровне одиночных клеток (scRNA-seq) в пределах каждой иммунной субпопуляции объединяются («агрегируются») в единый «балковый» профиль для каждого образца. Таким образом, сравнение экспрессии ведется между псевдобалковыми профилями, что повышает статистическую мощность и позволяет корректно учитывать вариабельность внутри каждой субпопуляции.
В исследовании был рассмотрен ряд субпопуляций иммунных клеток, в том числе: CD4+ наивные Т-клетки (CD4+ T Naive), CD4+ T центральной памяти (CD4+ T central memory), CD4+ T эффекторной памяти (CD4+ T effector memory), CD8+ наивные Т-клетки (CD8+ T Naïve), CD8+ T центральной памяти (CD8+ T central memory), CD8+ T эффекторной памяти (CD8+ T effector memory).
Для выявления статистически значимых изменений экспрессии использовали порог числа p, равный 0,05 (с поправкой на множественные сравнения методом Benjamini–Hochberg), и порог по величине log2FoldChange (|log2FC| ≥ 0,5). В качестве основной формы визуализации использовались графики рассеяния (Volcano Plot) для каждой из субпопуляций, где по оси x отложена log2FoldChange, а по оси y — –log10(p-value). Области «достоверного понижения/повышения экспрессии» определялись по сочетанию выбранных порогов числа p и log2FoldChange.
Статистический анализ
Статистический анализ клинических данных проводился с использованием IBM SPSS версии 23. Для каждой характеристики определялись медиана и 25‑й и 75‑й процентили. Нормальность распределения проверялась с помощью одновыборочного критерия Колмогорова-Смирнова (p=0,05). Для проверки равенства средних нескольких выборок применялся критерий Краскела–Уоллиса (p=0,05) с поправкой Бонферрони, двух выборок — критерий Манна-Уитни. Сравнение качественных признаков между группами проведено методом Хи-квадрат.
Этическая экспертиза
Протокол исследования был одобрен локальным этическим комитетом (Локальный этический комитет при ФГБУ «НМИЦ эндокринологии» Минздрава России, выписка из протокола №18 от 12 октября 2022 г). Одобрение процедуры проведения протокола получали по принципам Хельсинкской декларации.
РЕЗУЛЬТАТЫ
Общая характеристика полученной группы
Ключевые демографические и антропометрические показатели представлены в табл. 1.
Таблица 1. Основные клинические характеристики пациентов, включенных в исследование
|
Показатели |
СД1 N=23 |
LADA N=15 |
Здоровые добровольцы N=22 |
P |
|
Пол, муж., n (%) |
12 (52) |
7 (47) |
11 (50) |
>0,05 |
|
Возраст, лет |
26 [ 21; 31] |
40 [ 34; 45] |
33,5 [ 27; 42] |
<0,001 |
|
Длительность заболевания, мес |
6 [ 2; 8] |
38 [ 19; 53] |
Не применимо |
<0,001* |
|
ИМТ, кг/м² |
22,3 [ 20,1; 23,8] |
23 [ 20,1; 23,9] |
24,8 [ 20,6; 28,3] |
0,214 |
|
HbA1c, % |
7,8 [ 6,4; 10,4] |
7,1 [ 6,6; 8,8] |
5,1 [ 4,9; 5,4] |
<0,001 |
Примечание. *Критерий Манна-Уитни для групп СД1 и LADA.
СД1 — сахарный диабет 1 типа; LADA — латентный аутоиммунный диабет взрослых; ИМТ — индекс массы тела; HbA1c — гликированный гемоглобин.
Анализ распределения по полу показал, что в группе СД1 мужчины составили 52%, что согласуется с общемировыми данными о небольшом преобладании мужского пола в Европейской популяции, однако между группами при этом значимой разницы не выявлено [13]. В контрольной группе здоровых добровольцев мужчины и женщины были представлены в равной пропорции (50%), что обеспечивает необходимую репрезентативность для сопоставления с пациентами.
Медиана возраста пациентов с СД1 составила 26 [ 21; 31] лет, что отражает характерную манифестацию СД1 в молодом возрасте. Для LADA, напротив, медиана составила 40 лет [ 34; 45], что соответствует диапазону, при котором обычно диагностируется данная форма СД. В контрольной группе медиана возраста 33,5 [ 27; 42] года была сопоставима с показателями в исследуемых группах, повышая корректность сравнительного анализа.
У пациентов с СД1, LADA и здоровых добровольцев ИМТ соответствовал нормальным референсным значениям и не различался между группами.
Анализ дифференциальной экспрессии генов между группами
1. Сравнение пациентов с LADA со здоровыми добровольцами
При анализе ДЭГ при LADA относительно здоровых добровольцев выявлен ограниченный набор генов:
1) HLA-G демонстрировал значимое снижение уровня экспрессии в CD4+ наивных Т-клетках, CD4+ T центральной памяти, CD8+ T центральной памяти и CD8+ T эффекторной памяти;
2) в CD4+ наивных Т-клетках наблюдалось снижение экспрессии SPARC и C20orf204, а также повышение уровня AC002460.2.
Большинство остальных генов в исследованных субпопуляциях не показало статистически значимых различий между LADA и здоровыми добровольцами. Общая структура экспрессии указывала на преимущественно не измененный профиль, за исключением перечисленных выше генов (рис. 1).
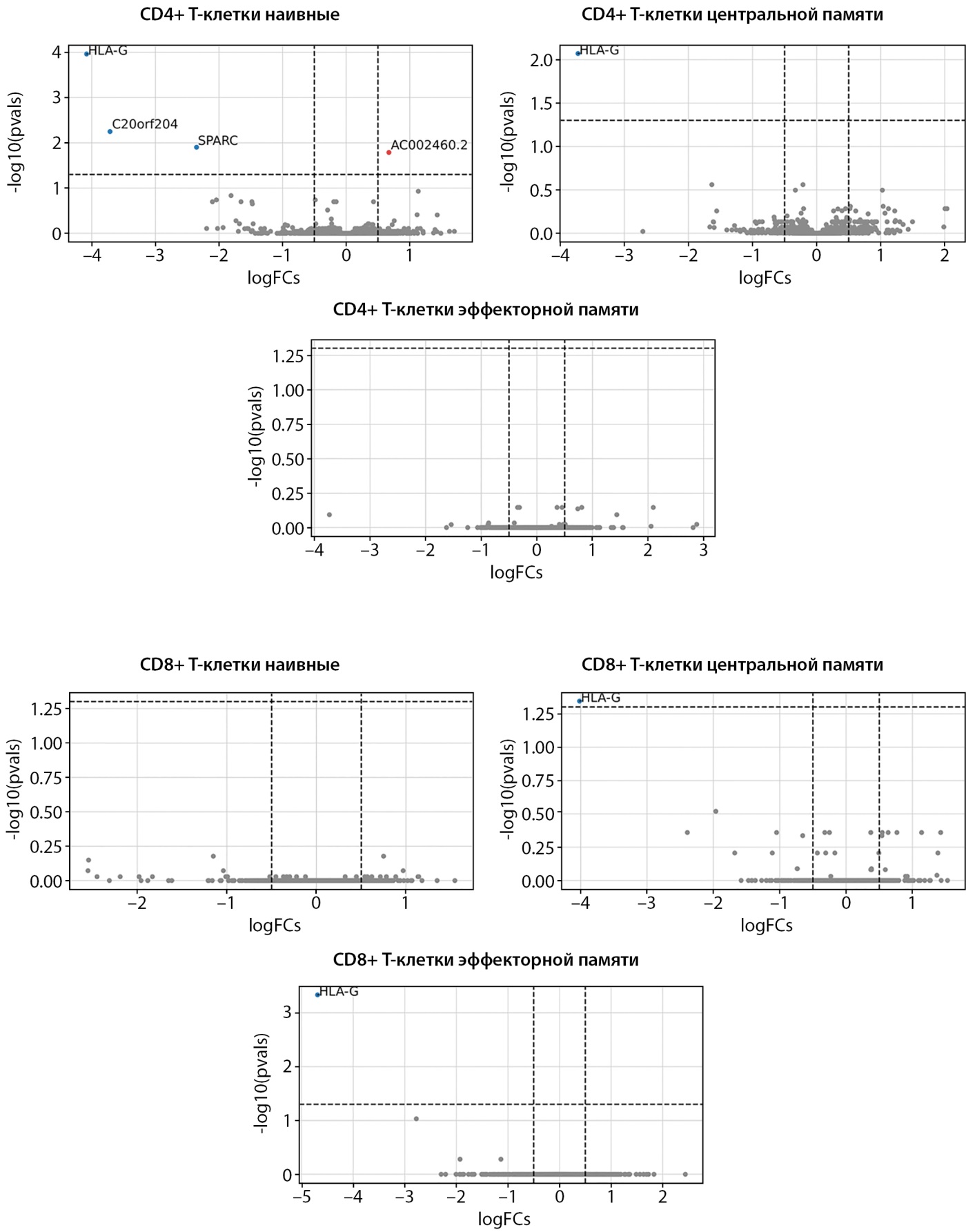
Рисунок 1. Дифференциальная экспрессия генов при сравнении латентного аутоиммунного диабета взрослых и здоровых добровольцев.
Примечание. На графике рассеяния представлены изменения экспрессии генов (log2FoldChange) в различных субпопуляциях иммунных клеток. Гены с достоверным снижением экспрессии при LADA (p<0,05, с поправкой на множественные сравнения) выделены синим цветом. Гены, экспрессия которых повышена, выделены красным цветом.
2. Сравнение пациентов с СД1 со здоровыми добровольцами
При сравнении пациентов с СД1 со здоровыми добровольцами выявлены следующие отличия:
1) в CD4+ наивных Т-клетках значимое повышение уровня транскриптов выявлено для гена HIST1H2BN;
2) в CD4+ T центральной памяти было отмечено повышение экспрессии IFIT1, AL163932.1, LAMP3, CASP3, HIST1H2BN и GPR18;
3) в CD4+ T эффекторной памяти выявлено снижение экспрессии гена TRBV2.
В субпопуляциях CD8+ наивных Т-клеток, CD8+ T центральной памяти и CD8+ T эффекторной памяти по заданным критериям (p<0,05 и |log2FC| ≥1) большинство генов не продемонстрировало статистически значимых различий.
Таким образом, в группе СД1 относительно здоровых добровольцев число ДЭГ оказалось ограниченным и сосредоточено преимущественно в CD4+ Т-клетках (рис. 2).
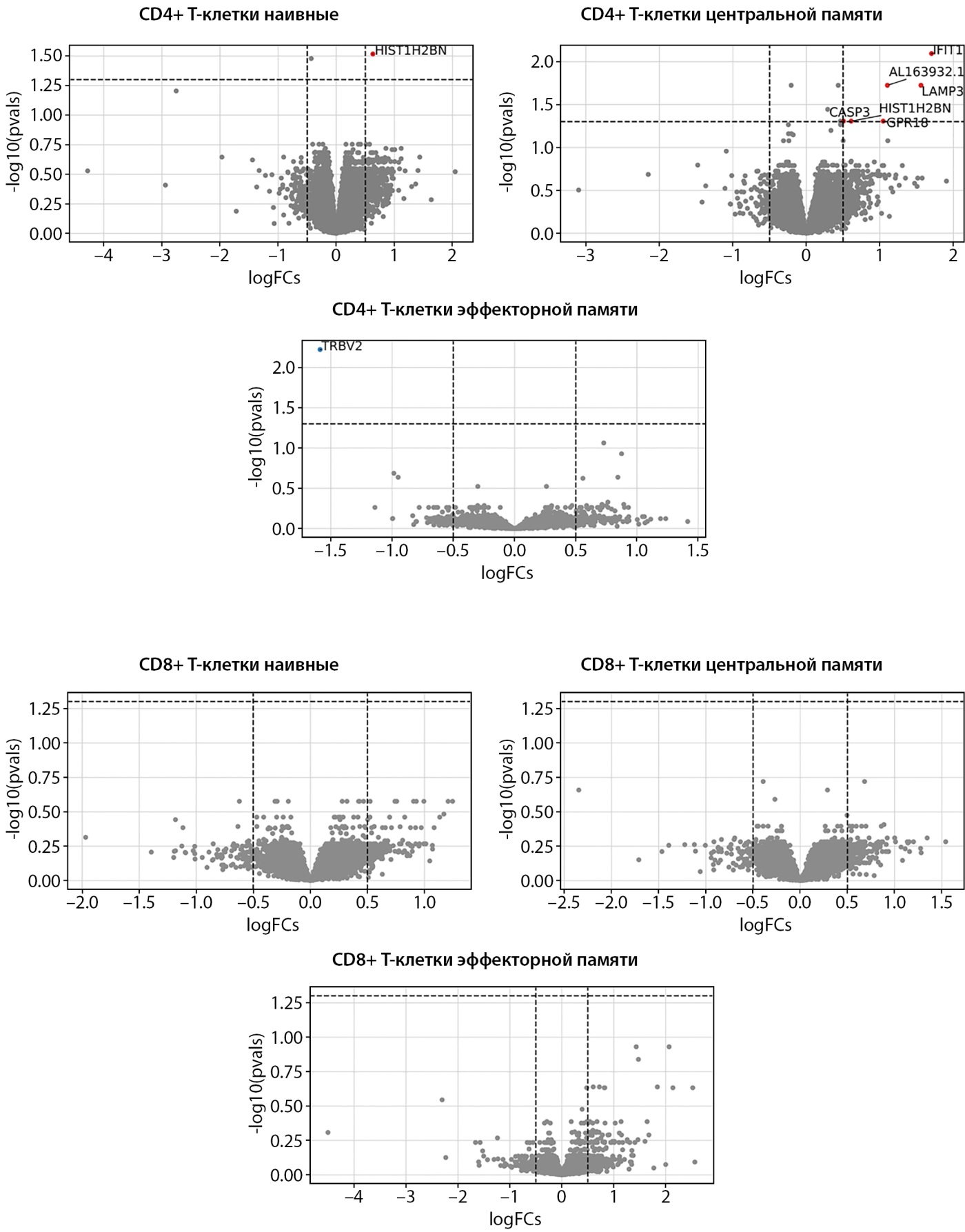
Рисунок 2. Дифференциальная экспрессия генов при сравнении пациентов с сахарным диабетом 1 типа и здоровых добровольцев.
Примечание. На графике рассеяния представлены изменения экспрессии генов (log2FoldChange) в различных субпопуляциях иммунных клеток. Гены с достоверным снижением экспрессии при СД1 (p<0,05, с поправкой на множественные сравнения) выделены синим цветом. Гены, экспрессия которых повышена, выделены красным цветом.
3. Сравнение пациентов с LADA с пациентами с СД1
Данная группа, предположительно, должна была продемонстрировать наибольшие изменения, однако результат позволил идентифицировать только один транскрипт — гипоэкспрессию C20orf204 в CD4+ наивных T-клетках, аналогично данным в первой группе (рис. 3).
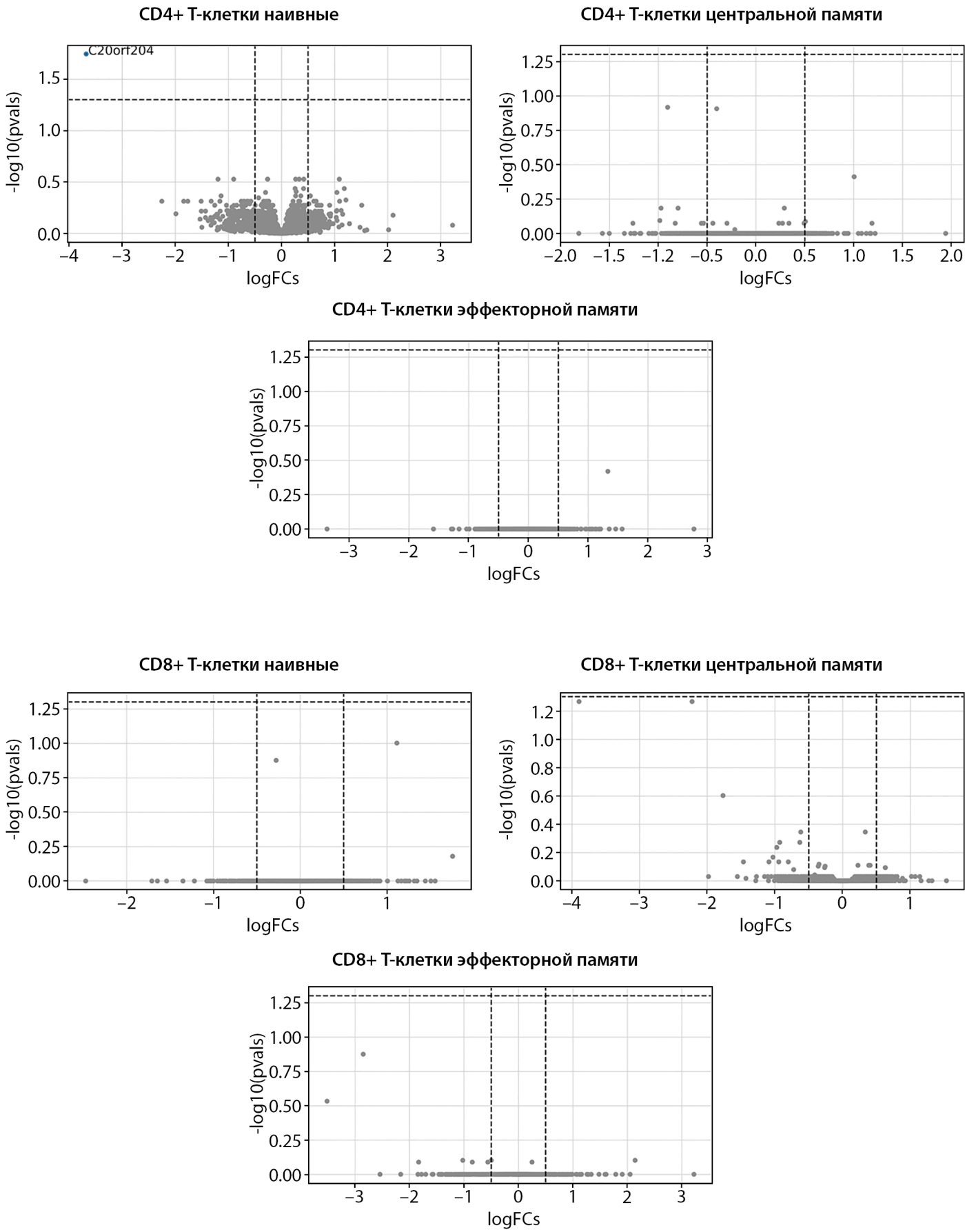
Рисунок 3. Дифференциальная экспрессия генов при сравнении латентного аутоиммунного диабета взрослых и сахарного диабета 1 типа.
Примечание. На графике рассеяния представлены изменения экспрессии генов (log2FoldChange) в различных субпопуляциях иммунных клеток. Гены со значимым снижением экспрессии при LADA (p<0,05, с поправкой на множественные сравнения) выделены синим цветом. Гены, экспрессия которых повышена, выделены красным цветом.
ОБСУЖДЕНИЕ
1. Сравнение пациентов с LADA со здоровыми добровольцами
1.1. Снижение экспрессии HLA-G
Ген HLA-G кодирует неклассический белок главного комплекса гистосовместимости (MHC) класса I, известный своими иммунорегуляторными свойствами. HLA-G широко изучается в контексте поддержания иммунной толерантности (например, во время беременности низкая экспрессия HLA-G клетками трофобласта связана с невынашиванием беременности), а также при трансплантации органов и аутоиммунных процессах. В частности, клетки меланомы экспрессируют большое количество HLA-G с целью уклонения от иммунного надзора и продолжения роста [14][15].
В настоящем исследовании снижение экспрессии HLA-G в ряде иммунокомпетентных клеток: CD4+ наивных T-клетках, CD4+ T центральной памяти, CD8+ T центральной памяти и CD8+ T эффекторной памяти может свидетельствовать о недостаточной или искаженной активации толерогенных механизмов. Поскольку LADA характеризуется более медленным темпом деструкции β-клеток по сравнению с классическим СД1, пониженный уровень HLA-G может указывать на особый баланс иммунной системы, при котором толерантность нарушена не столь резко, однако остается недостаточной для защиты β-клеток. Снижение активности HLA-G может способствовать активации аутоиммунных Т-клеток и усилению атаки на β-клетки поджелудочной железы.
1.2. Снижение экспрессии SPARC и C20orf204
SPARC (Secreted Protein Acidic and Rich in Cysteine) — белок, регулирующий взаимодействие клеток с внеклеточным матриксом и участвующий в процессах воспаления, ангиогенеза и ремоделирования тканей [16]. Снижение его экспрессии в CD4+ наивных T-клетках при LADA может отражать меньшую активность воспалительных каскадов или меньшее вовлечение механизмов тканевого ремоделирования по сравнению со здоровыми добровольцами. В ряде исследований в контексте СД1 или СД у животных наблюдалась повышенная экспрессия SPARC в условиях гипертрофии сосудов и повреждения тканей [17]. Кроме того, его связь с метаболическими нарушениями была продемонстрирована при изучении гестационного диабета, где повышенные уровни SPARC в плазме ассоциировались с инсулинорезистентностью, дислипидемией и системным воспалением [18].
Экспрессия C20orf204 может быть вовлечена в посттранскрипционную регуляцию и иммунный ответ. Гипоэкспрессия C20orf204 может отражать изменения в эпигенетической регуляции при LADA, когда уровень его транскрипции остается ниже, чем при более агрессивных аутоиммунных процессах. В 2021 г. было показано, что C20orf204 может не только регулировать активность других генов, но и кодировать белок в некоторых опухолях. Так, в клетках гепатоцеллюлярной карциномы обнаружен альтернативный сплайс-вариант, приводящий к синтезу белка длиной 189 аминокислот и ускоренному росту опухоли за счет повышенной продукции рибосомной РНК. Интересно, что в нормальных клетках печени этот белок практически не встречается, что может указывать на его специфическую роль в развитии опухолей. При этом в опухолевых клетках активация C20orf204 часто ассоциируется с эпигенетическими механизмами (например, посредством Myc) и, вероятно, способствует прогрессированию заболевания. Следовательно, пониженный уровень C20orf204 при LADA может свидетельствовать о «заглушении» данного гена эпигенетическими процессами и сохранении его в неактивном состоянии [19].
1.3. Гиперэкспрессия AC002460.2
Обнаруженное повышение экспрессии AC002460.2 в CD4+ наивных Т-клетках указывает на формирование при LADA особого пула регуляторных некодирующих РНК, отличного от здоровых пациентов. При этом известны самые разные механизмы работы подобных некодирующих РНК: они могут, например, взаимодействовать с транскрипционными факторами, изменять структуру хроматина или контролировать стабильность мРНК и тем самым влиять на продукцию цитокинов и экспрессию костимулирующих молекул. Однако конкретно для AC002460.2 экспериментальных данных о ее прямом воздействии на эти процессы нет, поэтому ее точную роль в иммунных реакциях еще предстоит выяснить [20].
2. Сравнение пациентов с СД1 со здоровыми добровольцами
2.1. Отличия ДЭГ в CD4+ Т-клетках
В группе СД1 наиболее выраженные изменения затронули популяцию CD4+ Т-клеток.
1. CD4+ наивные Т-клетки: повышение экспрессии HIST1H2BN. Данный ген относится к семейству гистонов, которые играют ключевую роль в компактизации ДНК и регуляции транскрипции [21][22]. Ген HIST1H2BN ранее биоинформатически предсказан как один из ключевых белков регуляторной сети белок-белковых взаимодействий при хронической болезни почек, развивающейся вследствие СД [23]. Повышение уровня гистоновых транскриптов может говорить о перестройке хроматина и активации Т-клеток в условиях аутоиммунного процесса.
2. CD4+ T центральной памяти: гиперэкспрессия IFIT1, AL163932.1, LAMP3, CASP3, HIST1H2BN, GPR18.
- IFIT1 (Interferon-Induced Protein with Tetratricopeptide Repeats 1) — это белок, кодируемый геном IFIT1, который активируется в ответ на интерфероны I типа, такие как IFNα и IFNβ. Он играет ключевую роль в противовирусной защите организма, подавляя репликацию вирусов и модулируя иммунный ответ [24, 25]. Исследования на мышах показали, что блокировка IFNα на стадии предиабета предотвращает развитие СД1. При этом было установлено, что IFNβ не оказывает аналогичного эффекта. Ингибирование IFNα препятствовало проникновению аутоагрессивных Т-лимфоцитов в островки поджелудочной железы и их деструктивному воздействию на β-клетки [26].
- LAMP3 (lysosome-associated membrane protein 3), известный также как DC-LAMP, участвует в антиген-презентации дендритными клетками.
Гиперэкспрессия LAMP3 при СД1 может быть связана с его ролью в антиген-презентации дендритными клетками. LAMP3 экспрессируется в зрелых дендритных клетках и участвует в процессах, связанных с иммунным ответом. Повышенная экспрессия LAMP3 может способствовать усилению аутоиммунной реакции против β-клеток поджелудочной железы, что характерно для патогенеза СД1. Кроме того, воспалительные процессы и повышенные уровни интерферонов, наблюдаемые при СД1, могут индуцировать экспрессию LAMP3, усиливая аутоиммунное разрушение β-клеток. Исследования показывают, что LAMP3+ дендритные клетки участвуют во взаимодействиях с Т-клетками, влияя на иммунный ответ [27]. Кроме того, LAMP3 участвует в активации Т-клеток и адаптивном иммунном ответе, что может быть связано с его гиперэкспрессией при аутоиммунных заболеваниях, таких как СД1 [28].
Ранее было показано, что блокирование плазматической мембранной формы белка того же семейства LAMP1 с помощью моноклональных антител в модели NOD-мышей снижало развитие инсулита и вероятность развития СД [29].
- CASP3 (Caspase 3) — ключевой фермент апоптоза, повышение уровня которого коррелирует с повреждением клеток, в том числе β-клеток. В нашем исследовании выявлено повышение его экспрессии при СД1 в сравнении со здоровыми добровольцами. CASP3 играет ключевую роль в апоптозе β-клеток, который не только способствует их разрушению, но и инициирует активацию Т-клеток, специфичных к β-клеткам, через механизмы антиген-кросс-презентации. У мышей с нокаутом гена CASP3 отсутствует инфильтрация лимфоцитов в островки поджелудочной железы и последующее развитие СД, что подчеркивает значимость CASP3 в запуске аутоиммунного процесса [30].
- GPR18 (G protein-coupled receptor 18) играет важную роль в формировании и поддержании популяции CD4+ T эффекторной памяти, особенно KLRG1+ клеток памяти. Этот рецептор способствует выживанию и накоплению этих клеток, участвующих в иммунном ответе на инфекцию и воспаление. Дефицит GPR18 приводит к снижению числа эффекторных CD8+ T-клеток, что подчеркивает его значимость в регуляции иммунной системы [31]. По нашим результатам выявлена гиперэкспрессия этого гена, что соотносится с патогенезом СД1, основанным на аутоиммунном процессе.
3. CD4+ T эффекторной памяти: отмечена гипоэкспрессия TRBV2 (T-cell receptor beta variable 2). Это локус вариабельности β-цепи T-клеточного рецептора, и изменение его экспрессии может указывать на перестройку антиген-специфичных Т-клонов [32].
2.2. Отсутствие значимых сдвигов в CD8+ Т-клетках
В CD8+ наивных Т-клеток, CD8+ T центральной памяти и CD8+ T эффекторной памяти подавляющее большинство генов не показало статистически значимых изменений. Это может отражать преимущественно CD4+T-клеточный опосредованный характер аутоиммунной реакции на момент исследования. Известно, что в патогенезе СД1 важную роль играют как CD4+, так и CD8+ Т-клетки, однако профиль экспрессии последних может значительно варьировать в зависимости от стадии заболевания и индивидуальных особенностей пациентов. Показано, что в ткани поджелудочной железы, полученной post mortem от пациентов с СД1, по количеству превалирует CD8+ T-клетки по сравнению c CD4+ T-клетками [33].
3. Сравнение пациентов с LADA и пациентов с СД1
Учитывая, что LADA нередко рассматривается как замедленная форма СД1 с частичным сохранением функций β-клеток, ожидалось более широкое расхождение между группами. Однако анализ выявил лишь один ген с достоверно отличной экспрессией — C20orf204 (гипоэкспрессия в LADA).
C20orf204: уже упоминавшийся белок-кодирующий ген, экспрессия которого также была снижена при сравнении пациентов с LADA со здоровыми донорами. Аналогичное снижение при сравнении с СД1 подтверждает, что именно при LADA его экспрессия остается ниже, чем как при нормальном иммунном ответе (здоровые добровольцы), так и при более типично протекающем аутоиммунном процессе (СД1). Это может свидетельствовать о том, что определенные посттранскрипционные механизмы в LADA активируются иначе, способствуя хронической «вялотекущей» аутоиммунной реакции.
Вероятная причина столь скромной разницы между LADA и СД1 кроется в их общей аутоиммунной основе. Большая часть транскрипционных сдвигов, характерная для СД1, вероятно, присуща и LADA, что и приводит к минимальному расхождению в экспрессии конкретных генов.
Ограничения исследования
Основным ограничением исследования является сравнительно небольшой размер выборки, особенно в группе пациентов с LADA, что могло повлиять на выявление менее выраженных различий в транскриптомном профиле. Кроме того, сравнительный, одномоментный и одноцентровый характер исследования ограничивают возможность обобщения результатов и оценки динамических изменений на разных этапах заболевания. Исследование сосредоточено на анализе экспрессии генов в нескольких ключевых субпопуляциях Т-клеток, что исключает вклад других иммунных клеток, а также эпигенетических и протеомных изменений. Несмотря на это, полученные данные дают ценное представление о молекулярных механизмах LADA и СД1, формируя основу для дальнейших исследований с использованием более крупных выборок и расширенных методологических подходов.
Направления дальнейших исследований
В продолжение данной работы целесообразно провести исследования, направленные на изучение более узких клеточных субпопуляций, таких как Tfh (фолликулярные Т-хелперы), Tr1 (регуляторные Т-клетки 1 типа), γδ-Т-клетки, а также редких популяций CD8+ T-клеток, включая клетки с характеристиками резидентной памяти (TRM). Анализ данных на уровне отдельных клеток с использованием более глубокого секвенирования и дополнительных биоинформатических методов позволит выявить редкие, но потенциально значимые молекулярные механизмы, недоступные для анализа на текущем уровне разрешения.
ЗАКЛЮЧЕНИЕ
Настоящее исследование продемонстрировало минимальное различие в транскриптомном профиле между LADA и СД1, выявив лишь один ген (C20orf204), уровень экспрессии которого при LADA оставался снижен по сравнению со здоровыми добровольцами и пациентами с СД1. При этом в обеих аутоиммунных группах наибольшее число ДЭГ обнаружено в субпопуляциях CD4+ T-клеток (наивных и центральной памяти), что подтверждает ведущую роль данного звена в аутоиммунном ответе на β-клетки.
Сравнительный анализ пациентов с LADA и здоровых добровольцев показал снижение экспрессии HLA-G, SPARC и C20orf204, а также повышение транскрипта AC002460.2, указывая на сложную регуляцию иммунологической толерантности. В группе СД1 относительно здоровых получены дифференциальные гены (IFIT1, LAMP3, CASP3, GPR18 и другие), преимущественно затрагивающие именно CD4+ T-клетки, что согласуется с хорошо известной аутоиммунной природой данного заболевания.
Минимальный объем выявленных различий в экспрессии генов между LADA и СД1 может отражать как реальную транскрипционную близость этих форм диабета, так и возможную недостаточность размера выборки. Вероятно, дальнейшее расширение исследований, включающее более крупные когорты пациентов и дополнительные методы молекулярного анализа (например, эпигенетические и протеомные исследования), позволит точнее охарактеризовать различия в патогенезе этих заболеваний.
В целом работа подтверждает, что LADA представляет собой особую форму СД с общей аутоиммунной природой, типичной для СД1, но обладающей собственными механизмами регуляции иммунного ответа. Глубокое понимание этих механизмов может способствовать разработке более персонифицированных стратегий лечения, направленных на модификацию иммунного ответа и сохранение остаточной функции β-клеток в течение более длительного периода.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено в рамках гранта «КНП № 075-15-2024-645 от 12 июля 2024 г.»
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Голодников И.И., Подшивалова Е.С., Чечехин В.И., Зубрицкий А.В., Матросова А.А., Дворяньчиков Я.В., Самсонова М.Д. и Маркелова Е.К. внесли существенный вклад в анализ данных и интерпретацию результатов, а также участвовали в написании статьи или внесли в рукопись значительные правки с целью повышения ее научной ценности. Медведева Ю.А., Никонова Т.В., Бондаренко Е.В., Попов С.В., Минниахметов И.Р. и Шестакова М.В. принимали участие в разработке концепции и дизайна исследования, а также участвовали в написании статьи и внесли в рукопись значительные правки. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Ravikumar V, Ahmed A, Anjankar A. A Review on Latent Autoimmune Diabetes in Adults. Cureus. 2023;15(10):e47915. doi: https://doi.org/10.7759/cureus.47915
2. Смирнова О.М., Кононенко И.В., Дедов И.И. Гетерогенность сахарного диабета. Аутоиммунный латентный сахарный диабет у взрослых (LADA): определение, распространенность, клинические особенности, диагностика, принципы лечения. // Сахарный диабет. — 2008. — Т. 11. — № 4. — С. 18-23. doi: https://doi.org/10.14341/2072-0351-5583
3. Mussa BM, Venkatachalam T, Srivastava A, et al. Identification of novel differentially expressed genes in type 1 diabetes mellitus complications using transcriptomic profiling of UAE patients: a multicenter study. Sci Rep. 2022;12(1):16316. doi: https://doi.org/10.1038/s41598-022-18997-w
4. Adewumi OO, Taiwo IA, Oladele EO. In-silico identification of differentially expressed genes in type 1 diabetes mellitus. Biokemistri, 2021;33(3):215-226
5. Release Notes for Cell Ranger. v7.1.0 Release Notes. 2022. 10X Genomics. [доступ от 20.01.2025]. Доступ по ссылке https://www.10xgenomics.com/support/software/cell-ranger/latest/release-notes/cr-release-notes
6. Young MD, Behjati S. SoupX removes ambient RNA contamination from droplet-based single-cell RNA sequencing data. Gigascience. 2020;9(12):giaa151. doi: https://doi.org/10.1093/gigascience/giaa151
7. Germain PL, Lun A, Garcia Meixide C, et al. Doublet identification in single-cell sequencing data using scDblFinder. F1000Res. 2021;10:979. doi: https://doi.org/10.12688/f1000research.73600.2
8. Hu C, Li T, Xu Y, et al. CellMarker 2.0: an updated database of manually curated cell markers in human/mouse and web tools based on scRNA-seq data. Nucleic Acids Res. 2023;51(D1):D870-D876. doi: https://doi.org/10.1093/nar/gkac947
9. Franzén O, Gan LM, Björkegren JLM. PanglaoDB: a web server for exploration of mouse and human single-cell RNA sequencing data. Database (Oxford). 2019;2019:baz046. doi: https://doi.org/10.1093/database/baz046
10. Stelzer G, Rosen N, Plaschkes I, et al. The GeneCards Suite: From Gene Data Mining to Disease Genome Sequence Analyses. Curr Protoc Bioinforma. 2016;54(1). doi: https://doi.org/10.1002/cpbi.5
11. Chechekhina E, Tkachuk V, Chechekhin V. scParadise: Tunable highly accurate multi-task cell type annotation and surface protein abundance prediction. bioRxiv. 2024:1-18. doi: https://doi.org/10.1101/2024.09.23.614509
12. Butler A, et al. Azimuth: A shiny app demonstrating a query-reference mapping algorithm for single-cell data. 2021. Github. [доступ от 20.01.2025]. Доступ по ссылке: https://github.com/satijalab/azimuth
13. Tatti P, Pavandeep S. Gender Difference in Type 1 Diabetes: An Underevaluated Dimension of the Disease. Diabetology. 2022; 3(2):364-368. doi: https://doi.org/10.3390/diabetology3020027
14. Carosella ED, Favier B, Rouas-Freiss N, Moreau P, Lemaoult J. Beyond the increasing complexity of the immunomodulatory HLA-G molecule. Blood. 2008;111(10):4862-4870. doi: https://doi.org/10.1182/blood-2007-12-127662
15. Alegre E, Díaz-Lagares A, Lemaoult J, et al. Maternal antigen presenting cells are a source of plasmatic HLA-G during pregnancy: longitudinal study during pregnancy. Hum Immunol. 2007;68(8):661-667. doi: https://doi.org/10.1016/j.humimm.2007.04.007
16. Ham SM, Song MJ, Yoon HS, et al. SPARC Is Highly Expressed in Young Skin and Promotes Extracellular Matrix Integrity in Fibroblasts via the TGF-β Signaling Pathway. Int J Mol Sci. 2023;24(15):12179. doi: https://doi.org/10.3390/ijms241512179
17. Jandeleit-Dahm K, Rumble J, Cox AJ, et al. SPARC gene expression is increased in diabetes-related mesenteric vascular hypertrophy. Microvasc Res. 2000;59(1):61-71. doi: https://doi.org/10.1006/mvre.1999.2189
18. Xu L, Ping F, Yin J, et al. Elevated plasma SPARC levels are associated with insulin resistance, dyslipidemia, and inflammation in gestational diabetes mellitus. PLoS One. 2013;8(12):e81615. doi: https://doi.org/10.1371/journal.pone.0081615
19. Burbano De Lara S, Tran DDH, Allister AB, et al. C20orf204, a hepatocellular carcinoma-specific protein interacts with nucleolin and promotes cell proliferation. Oncogenesis 2021;10(3):31. doi: https://doi.org/10.1038/s41389-021-00320-3
20. Atianand MK, Caffrey DR, Fitzgerald KA. Immunobiology of Long Noncoding RNAs. Annu Rev Immunol. 2017;35:177-198. doi: https://doi.org/10.1146/annurev-immunol-041015-055459
21. Bannister AJ, Kouzarides T. Regulation of chromatin by histone modifications. Cell Res. 2011;21(3):381-395. doi: https://doi.org/10.1038/cr.2011.22
22. NCBI AceView. Homo sapiens gene HIST1H2BN, encoding histone cluster 1, H2bn. [доступ от: 21.01.2025]; Доступно по ссылке: https://www.ncbi.nlm.nih.gov/IEB/Research/Acembly/av.cgi?db=human&c=Gene&l=HIST1H2BN.
23. Tang YL, Dong XY, Zeng ZG, Feng Z. Gene expression-based analysis identified NTNG1 and HGF as biomarkers for diabetic kidney disease. Medicine (Baltimore). 2020;99(1):e18596. doi: https://doi.org/10.1097/MD.0000000000018596
24. Pidugu VK, Pidugu HB, Wu MM, et al. Emerging Functions of Human IFIT Proteins in Cancer. Front Mol Biosci. 2019;6:148. doi: https://doi.org/10.3389/fmolb.2019.00148
25. Ivashkiv LB, Donlin LT. Regulation of type I interferon responses. Nat Rev Immunol. 2014;14(1):36-49. doi: https://doi.org/10.1038/nri3581
26. Marro BS, Ware BC, Zak J, et al. Progression of type 1 diabetes from the prediabetic stage is controlled by interferon-α signaling. Proc Natl Acad Sci U S A. 2017;114(14):3708-3713. doi: https://doi.org/10.1073/pnas.1700878114
27. Wang Z, Ji X, Zhang Y, et al. Interactions between LAMP3+ dendritic cells and T-cell subpopulations promote immune evasion in papillary thyroid carcinoma. J Immunother Cancer. 2024;12(5):e008983. doi: https://doi.org/10.1136/jitc-2024-008983
28. Wang Z, Wang X, Jin R, et al. LAMP3 expression in the liver is involved in T cell activation and adaptive immune regulation in hepatitis B virus infection. Front Immunol. 2023;14:1127572. doi: https://doi.org/10.3389/fimmu.2023.1127572
29. De Carvalho Bittencourt M, Herren S, Graber P, et al. Extracellular lysosome-associated membrane protein-1 (LAMP-1) mediates autoimmune disease progression in the NOD model of type 1 diabetes. Eur J Immunol. 2005;35(5):1501-1509. doi: https://doi.org/10.1002/eji.200425851
30. Liadis N, Murakami K, Eweida M, et al. Caspase-3-dependent beta-cell apoptosis in the initiation of autoimmune diabetes mellitus. Mol Cell Biol. 2005;25(9):3620-3629. doi: https://doi.org/10.1128/MCB.25.9.3620-3629.2005
31. Sumida H, Cyster JG. G-Protein Coupled Receptor 18 Contributes to Establishment of the CD8 Effector T Cell Compartment. Front Immunol. 2018;9:660. doi: https://doi.org/10.3389/fimmu.2018.00660
32. Mao XF, Chen XP, Jin YB, et al. The variations of TRBV genes usages in the peripheral blood of a healthy population are associated with their evolution and single nucleotide polymorphisms. Hum Immunol. 2019;80(3):195-203. doi: https://doi.org/10.1016/j.humimm.2018.12.007
33. Willcox A, Richardson SJ, Bone AJ, et al. Analysis of islet inflammation in human type 1 diabetes. Clin Exp Immunol. 2009;155(2):173-181. doi: https://doi.org/10.1111/j.1365-2249.2008.03860.x
Об авторах
И. И. ГолодниковРоссия
Голодников Иван Иванович, аспирант
117036 Москва, ул. Дм. Ульянова, д. 11
ResearcherID: AAJ-8843-2021;
Scopus Author ID: 57208628509
Е. С. Подшивалова
Россия
Подшивалова Елизавета Сергеевна
Москва
ResearcherID: ISB-5640-2023;
Scopus Author ID: 57214441739
В. И. Чечехин
Россия
Чечехин Вадим Игоревич, к.м.н.
Москва
ResearcherID: AAN-6190-2020;
Scopus Author ID: 57204779390
А. В. Зубрицкий
Россия
Зубрицкий Анатолий Валерьевич
Москва
Scopus Author ID: 57202420882
А. А. Матросова
Россия
Матросова Алина Антоновна
Москва
Я. В. Дворяньчиков
Россия
Дворяньчиков Ярослав Владимирович
Москва
М. Д. Самсонова
Россия
Самсонова Маргарита Денисовна
Москва
Е. К. Маркелова
Россия
Маркелова Екатерина Константиновна
Москва
Ю. А. Медведева
Россия
Медведева Юлия Анатольевна, к.б.н.
Москва
Т. В. Никонова
Россия
Никонова Татьяна Васильевна, д.м.н.
Москва
Е. В. Бондаренко
Россия
Бондаренко Екатерина Владимировна, к.м.н.
Москва
С. В. Попов
Россия
Попов Сергей Владимирович, к.б.н.
Москва
И. Р. Минниахметов
Россия
Минниахметов Илдар Рамилевич, к.б.н.
Москва
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
Москва
ResearcherID: D-9123-2012;
Scopus Author ID: 7004195530
Дополнительные файлы
|
|
1. Рисунок 1. Дифференциальная экспрессия генов при сравнении латентного аутоиммунного диабета взрослых и здоровых добровольцев. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(909KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Дифференциальная экспрессия генов при сравнении пациентов с сахарным диабетом 1 типа и здоровых добровольцев. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(1009KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Дифференциальная экспрессия генов при сравнении латентного аутоиммунного диабета взрослых и сахарного диабета 1 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(928KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Голодников И.И., Подшивалова Е.С., Чечехин В.И., Зубрицкий А.В., Матросова А.А., Дворяньчиков Я.В., Самсонова М.Д., Маркелова Е.К., Медведева Ю.А., Никонова Т.В., Бондаренко Е.В., Попов С.В., Минниахметов И.Р., Шестакова М.В. Транскрипционные особенности аутоиммунного сахарного диабета: дифференциальная экспрессия генов в CD4+ и CD8+ субпопуляциях Т-клеток крови. Сахарный диабет. 2025;28(2):124-135. https://doi.org/10.14341/DM13316
For citation:
Golodnikov I.I., Podshivalova E.S., Chechekhin V.I., Zubritsky A.V., Matrosova A.A., Dvoryanchikov Y.V., Samsonova M.D., Markelova E.K., Medvedeva Y.A., Nikonova T.V., Bondarenko E.V., Popov S.V., Minniakhmetov I.R., Shestakova M.V. Transcriptional features of autoimmune diabetes: differentially expressed genes in CD4+ and CD8+ subpopulations of blood T cells. Diabetes mellitus. 2025;28(2):124-135. (In Russ.) https://doi.org/10.14341/DM13316

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































