Перейти к:
Коморбидный пациент с тяжелой пролиферативной диабетической ретинопатией: анализ решенных и нерешенных вопросов диагностики и лечения диабетических поражений сетчатки с позиций реальной клинической практики и клинических рекомендаций
https://doi.org/10.14341/DM13290
Аннотация
ОБОСНОВАНИЕ. Диабетические поражения сетчатки — пролиферативная диабетическая ретинопатия (ПДР) и диабетический макулярный отек (ДМО), в большинстве случаев диагностируемый при ПДР, являются главными причинами снижения максимальной корригированной остроты зрения (МКОЗ). ПДР — позднее осложнение сахарного диабета (СД), в тяжелых случаях требующее витреоретинального хирургического вмешательства (ВРХВ). Учитывая высокий риск потери зрения и коморбидность пациентов с ПДР, выбор тактики офтальмологического лечения крайне актуален.
ЦЕЛЬ. Сопоставить выполнение клинических рекомендаций (КР) с реальной клинической практикой при анализе основных проблем лечения диабетических поражений сетчатки по данным когорты пациентов с СД, поступивших на ВРХВ в ФГБУ «НМИЦ эндокринологии» Минздрава России.
МАТЕРИАЛЫ И МЕТОДЫ. Объект исследования: данные историй болезни и эндокарт (клинико-статистических карт учета пациентов с СД ФГБУ «НМИЦ эндокринологии») 252 пациентов (260 глаз) с СД1 типа (СД1) (n=168) и СД 2 типа (СД2) (n=84), которым выполнялось ВРХВ с 2019 по 2023 гг., анализировались причины утяжеления ПДР, результаты ВРХВ, частота сердечно-сосудистых (СС) и диабетических осложнений, усиливающих риск СС событий: атеросклеротические заболевания, ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность (ХСН), острое нарушение мозгового кровообращения (ОНМК), хроническая болезнь почек (ХБП), синдром диабетической стопы (СДС). Критерий включения — осложнения ПДР, требующие ВРХВ, независимо от их тяжести. Выполнялось стандартное офтальмологическое обследование, ультразвуковое В-сканирование глаз, оптическая когерентная томография (ОКТ) сетчатки, фоторегистрация глазного дна. Оценивали МКОЗ до и через 1 мес после ВРХВ, стабилизацию пролиферативного процесса — от 1 мес до 5 лет.
РЕЗУЛЬТАТЫ. Медиана возраста при СД1/СД2 составила 39/63 года, длительности СД до ВРХВ — 19/17 лет, доля женщин — 63%/57%, соответственно. На 258 из 260 глаз (99,2%) до ВРХВ лазерная коагуляции сетчатки (ЛКС) была выполнена частично либо отсутствовала. МКОЗ через 1 месяц улучшилась у всех пациентов, однако напрямую зависела от исходной, обусловленной тяжестью осложнений ПДР, и составила до/после ВРХВ: 76 глаз (29%) — «светоощущение с правильной светопроекцией» — 0,05/0,01–0,08; 68 глаз (26%) — 0,06–0,1/0,08 –0,3; 62 глаза (24%) — 0,2–0,3/0,3–0,5; 54 глаза (21%) — 0,4–0,8/0,5–1,0 по десятичной системе, соответственно. Частота сопутствующей патологии при СД1/СД2 составила: атеросклероз — 47%/67%, ИБС — 9%/32%, ОНМК — 4%/9%, ХСН — 5%/30%, ХБП — 71%/63 (в том числе ХБП С5 стадии 27,4%/13,6%), СДС — 29%/17%, ампутации — 13%/17% случаев соответственно.
ЗАКЛЮЧЕНИЕ. В исследуемой когорте пациентов с тяжелой ПДР с высокой частотой сопутствующей патологии и риском СС событий в 99,2% случаев отсутствовал должный объем ЛКС, что привело к осложнениям, требующим ВРХВ. У коморбидных пациентов с ПДР панретинальная ЛКС должна выполняться безотлагательно, в соответствии с КР, и быть приоритетным методом лечения во избежание тяжелых потерь зрения.
Ключевые слова
Для цитирования:
Новикова-Билак Т.А., Железнякова А.В., Ильюхин О.Е., Липатов Д.В., Николаева А.М., Турко К.С., Викулова О.К., Шестакова М.В. Коморбидный пациент с тяжелой пролиферативной диабетической ретинопатией: анализ решенных и нерешенных вопросов диагностики и лечения диабетических поражений сетчатки с позиций реальной клинической практики и клинических рекомендаций. Сахарный диабет. 2025;28(1):68-79. https://doi.org/10.14341/DM13290
For citation:
Novikova-Bilak T.A., Zheleznyakova A.V., Iljukhin O.E., Lipatov D.V., Nikolaeva A.M., Turko K.S., Vikulova O.K., Shestakova M.V. Patient with severe proliferative diabetic retinopathy and comorbidity: analysis of solved and unsolved problems in diabetic retinal involvement diagnosis and treatment from the point of real-world clinical practice and clinical guidelines. Diabetes mellitus. 2025;28(1):68-79. (In Russ.) https://doi.org/10.14341/DM13290
ОБОСНОВАНИЕ
Успехи в диагностике и лечении сахарного диабета (СД) как 1 (СД1), так и 2 (СД2) типа позволяют значительно продлить жизнь пациентам, в связи с чем неизбежно увеличивается длительность заболевания и, как следствие, растет число макро- и микрососудистых осложнений. Поражение глаз при СД вследствие развития и прогрессирования диабетической ретинопатии (ДР), к сожалению, остается ведущей причиной слепоты у работоспособного населения. По данным клинико-эпидемиологического мониторинга СД в Российской Федерации (РФ), ДР является одним из самых распространенных микрососудистых осложнений СД, стабильно занимая в структуре диабетических осложнений 2 и 3 место с частотой встречаемости 28,9% при СД1 и 12,3% при СД2, после диабетической нейропатии и диабетического поражения почек [1]. На фоне проводимых мер по улучшению диабетологической помощи и активизации скрининга осложнений за 15-летний период с 2009 по 2023 гг. было отмечено снижение частоты встречаемости ДР у взрослых пациентов с СД1 и СД2 (35,1–27,3% и 17,7–11,6% соответственно), более позднее начало ДР после дебюта СД (при СД1 с 9,3 до 11,8 года, при СД2 с 5,1 до 7,6 года), увеличение среднего возраста выявления ДР (при СД1 с 36,1 до 37,3 года, при СД2 с 62,5 до 64,8 года) [2][3]. По данным опубликованного анализа выявления ДР, у пациентов с СД по стадиям в динамике с 2009 по 2023 гг. диагностика изменялась в сторону преимущественного выявления на ранних стадиях — непролиферативной ДР (НДР) — при СД1 — с 74,6 до 80% пациентов, при СД2 с 81,4 до 88,1% (рис. 1) [3]. Однако у каждого 5-го пациента с СД1 на этапе первичной диагностики выявляются выраженные и тяжелые стадии поражения глаз — препролиферативная ДР (ППДР) и пролиферативная диабетическая ретинопатия (ПДР), составляя суммарно 20% случаев вновь выявленных ДР. При СД2 суммарная доля ППДР и ПДР в первичной диагностике ДР составила 11,9%, то есть выраженные и тяжелые поражения глаз имел практически каждый девятый пациент (рис. 1).
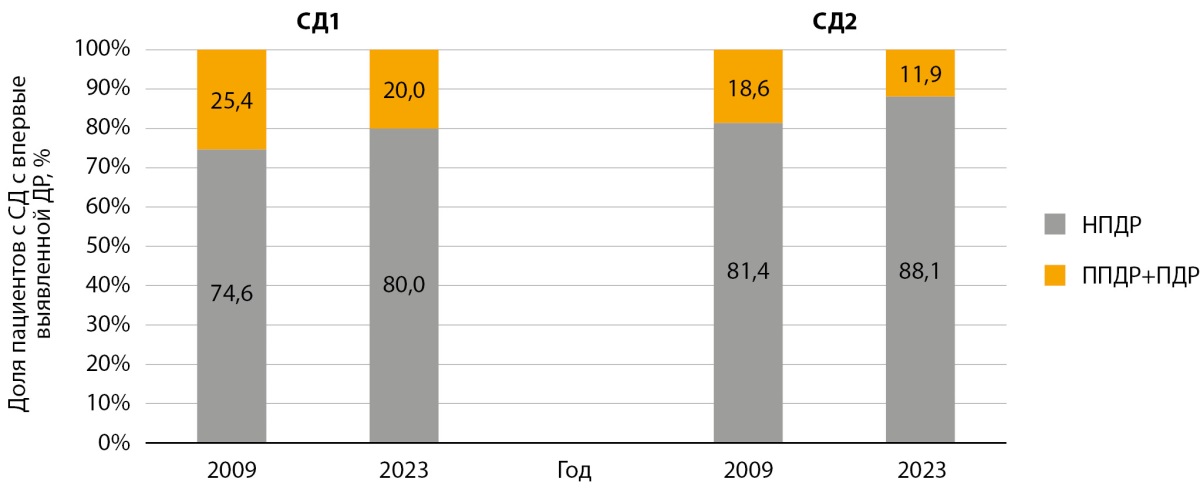
Рисунок 1. Первичная диагностика диабетической ретинопатии: распределение по стадиям новых случаев диабетической ретинопатии у взрослых пациентов с сахарным диабетом 1 типа и сахарным диабетом 2 типа в 2009 и 2023 гг. Адаптировано по опубликованным данным [3].
Примечание. СД — сахарный диабет; ДР — диабетическая ретинопатия; НПДР — непролиферативная диабетическая ретинопатия; ППДР — препролиферативная диабетическая ретинопатия; ПДР — пролиферативная диабетическая ретинопатия.
Одним из ключевых показателей качества оказания диабетологической помощи, отражающих эффективность профилактических мер, является снижение доли пациентов, достигших терминальных стадий диабетических осложнений, в случае ДР — слепоты.
Данные последнего опубликованного анализа за 13-летний период с 2010 по 2022 гг. показали снижение прироста новых случаев слепоты по отношению к новым случаям ДР в год: при СД1 с 3,7 до 2,3% и при СД2 с 1,3 до 0,9% при отсутствии уменьшения общего количества пациентов со слепотой при обоих типах СД [1]. Таким образом, становится очевидным, что несмотря на продвижение и развитие специализированной помощи пациентам с СД, процент пациентов с терминальными поражениями глаз, приводящими к полной потере зрения, остается на стабильно высоком уровне.
Диабетические поражения сетчатки — ПДР и диабетический макулярный отек (ДМО) — являются главными причинами снижения максимальной корригированной остроты зрения (МКОЗ) и ухудшения качества жизни пациентов [4]. ПДР более чем в 70% случаев сочетается с ДМО, что указывает на общность патогенетических механизмов этих поражений [5]. Еще в 80-х годах прошлого столетия исследовательской группой по изучению раннего лечения ДР (Еarly Тreatment Diabetic Retinopathy Study — ETDRS) было показано, что своевременно и в полном объеме выполненная панретинальная лазерная коагуляция сетчатки (ПРЛК) позволяет избежать тяжелых потерь зрения вследствие ПДР [6]. В настоящее время задачи современной офтальмодиабетологии значительно усложнились — целью является сохранение высокой МКОЗ, обеспечивающей пациентам надлежащее качество жизни (возможность чтения, вождения автомобиля и т.п.), что связано с состоянием макулы.
Современный уровень развития витреоретинального хирургического вмешательства (ВРХВ) в большинстве случаев позволяет частично восстановить зрение даже при тяжелых осложнениях ПДР. К сожалению, практика показывает, что этот вид сложного дорогостоящего хирургического вмешательства часто исправляет огрехи предыдущих этапов лечения: отсутствие или низкое качество скрининга, позднее обращение пациента, нерегулярное наблюдение, невыполнение рекомендаций эндокринолога и офтальмолога, невыполненную или незавершенную ПРЛК. В отделении диабетической ретинопатии и офтальмохирургии ФГБУ «НМИЦ эндокринологии» Минздрава России накоплен уникальный опыт междисциплинарного подхода к ведению пациентов с ПДР. В центре создана возможность оказания высокотехнологичных видов офтальмологической помощи: лазерного лечения, ВРХВ — пациентам с тяжелыми соматическими осложнениями, в т.ч. пациентам, находящимся на программном гемодиализе.
Под эгидой «НМИЦ эндокринологии» в результате совместной работы ведущих офтальмологов и эндокринологов РФ впервые в стране общероссийской общественной организацией «Ассоциация врачей-офтальмологов» и общественной организацией «Российская ассоциация эндокринологов» созданы клинические рекомендации (КР) по диагностике и лечению ДР и ДМО «Сахарный диабет: ретинопатия диабетическая, макулярный отек диабетический» [7]. На основе мирового и отечественного опыта в КР изложены современные взгляды на патогенез и подходы к диагностике и лечению пациентов с диабетической патологией глазного дна.
Согласно КР, диагностика ДР и ДМО должна быть направлена на выявление начальных изменений с целью сохранения зрения при СД. Биомикроскопия глазного дна с асферическими линзами при помощи щелевой лампы с широким зрачком является основным методом диагностики изменений глазного дна диабетического генеза, доступным на всех уровнях оказания медицинской помощи. При наличии технической возможности рекомендуется биомикрофотографирование глазного дна с использованием фундус-камеры. С целью диагностики ДМО рекомендуется выполнять оптическую когерентную томографию сетчатки (ОКТ) при наличии соответствующей аппаратуры. При выявлении ПДР показано безотлагательное выполнение ПРЛК, при которой в несколько сеансов наносится 1500–2000 ожогов (а при тяжелой ПДР — и более), а также возможно интравитреальное введение (ИВВ) средств, препятствующих новообразованию сосудов — ингибиторов ангиогенеза (ИАГ). Стабильную ПДР после ПРЛК рекомендуется наблюдать в динамике, и в случае появления активной неоваскуляризации выполнить дополнительную лазерную коагуляцию сетчатки (ЛКС) или ввести препараты, препятствующие новообразованию сосудов. При ДМО без вовлечения центра макулы показана фокальная ЛКС, при ДМО с вовлечением центра макулы — интравитреальное введение ИАГ или имплантов глюкокортикоидов без или в сочетании с ЛКС под контролем ОКТ в динамике. В КР подробно приводятся две схемы лечения ИАГ — ранибизумабом и афлиберцептом. Согласно КР, при лечении афлиберцептом рекомендовано назначать 5 последовательных ежемесячных инъекций, затем выполняют по 1 инъекции каждые 2 месяца. При лечении ранибизумабом может потребоваться 3 или более последовательные ежемесячные инъекции до достижения максимальной остроты зрения или до стабилизации заболевания. Обязателен ОКТ-контроль до лечения и в процессе лечения. В КР подчеркивается, что в каждом клиническом случае окончательное решение о показаниях к лечению ИАГ, выборе режима инъекций принимает врач на основе оценки клинической картины и течения заболевания. Для пациентов, которым трудно часто посещать клинику, и для пациентов с сердечно-сосудистой (СС) патологией в КР предусмотрено сочетание ИВВ имплантов глюкокортикоидов, которые действуют более длительное время, и лазерного лечения, а также сочетание ИВВ ранибизумаба или афлиберцепта с лазерным лечением макулы. При рефрактерном, устойчивом к медикаментозному лечению ДМО, с целью выявления ишемии как источника повышенной экспрессии сосудистого эндотелиального фактора роста, а также пациентам с ишемической макулопатией и для диагностики нарушения перфузии сетчатки рекомендована флюоресцентная ангиография (ФАГ).
Во всех случаях рекомендуется междисциплинарное ведение пациента, направленное на устранение факторов риска прогрессирования ДР — нормализация уровня гликемии, артериального давления, показателей липидного обмена.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Сопоставить выполнение КР с реальной клинической практикой (РКП), проанализировать основные проблемы диагностики и лечения диабетических поражений сетчатки, выявить причины, приведшие к утяжелению ПДР и необходимости ВРХВ, исследовать частоту встречаемости СС и диабетических осложнений, усиливающих риск СС событий, в когорте пациентов с ПДР, поступивших на ВРХВ в ФГБУ «НМИЦ эндокринологии» Минздрава России. Опираясь на КР, выработать оптимальную тактику офтальмологического лечения коморбидного пациента с ПДР.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования
Одноцентровое, наблюдательное, одномоментное, одновыборочное неконтролируемое исследование — изучалась одна популяция пациентов с СД1 и СД2 с диабетическим поражением глаз.
Изучаемая популяция
В исследование были включены пациенты с СД1 (n=169, женщин — 106, мужчин — 63) и СД2 (n=83, женщин — 47, мужчин — 36) с тяжелой ПДР, требующей ВРХВ, находившиеся на стационарном лечении в отделении диабетической ретинопатии и офтальмохирургии ФГБУ «НМИЦ эндокринологии» Минздрава России в период с 2019 по 2023 гг. Критерием включения в исследование были любые осложнения ПДР или их сочетание, требующие ВРХВ, независимо от их тяжести и выраженности: кровоизлияние в стекловидное тело, витреоретинальный тракционный синдром, эпиретинальные мембраны, фиброглиальные пролиферации, тракционная отслойка сетчатки. Учитывались только первичные ВРХВ. Всего в течение анализируемых 5 лет с 2019 по 2023 гг. выполнено 260 ВРХВ у 252 пациентов с СД. ВРХВ на одном глазу было выполнено 244 пациентам, на обоих глазах — 8 пациентам.
Методы
Клинико-анамнестические данные анализируемых пациентов были получены из историй болезни и эндокарт, которые представляют собой разработанный в ФГБУ «НМИЦ эндокринологии» инструмент системы учета пациентов с СД на основе унифицированных единых принципов клинико-эпидемиологического мониторинга с целью контроля характера течения и исходов заболевания.
В процессе подготовки к ВРХВ всем пациентам проводилось комплексное клинико-лабораторное обследование, включающее догоспитальный комплекс, определение компенсации углеводного обмена по уровню гликированного гемоглобина (HbA1c, %), оценку биохимических показателей (уровень креатинина с расчетом скорости клубочковой фильтрации (рСКФ), липидного профиля и др.). Пациенты были консультированы эндокринологом, кардиологом, по показаниям — нефрологом, специалистом отделения диабетической стопы.
Всем пациентам выполнялось стандартное офтальмологическое обследование, включавшее визометрию без коррекции и с коррекцией, пневмотонометрию, биомикроскопию, офтальмоскопию глазного дна с помощью асферических линз высокой диоптрийности в условиях мидриаза. Стандартное офтальмологическое обследование дополнялось В-сканированием глаз, а также ОКТ сетчатки и фоторегистрацией глазного дна на глазах, где позволяла прозрачность оптических сред. Оценивали объем ЛКС при первичном осмотре либо в ходе ВРХВ.
ВРХВ включало в себя витрэктомию, удаление эпиретинальных мембран, эндолазеркоагуляцию сетчатки. У 184 пациентов (184 глаза) при дооперационном обследовании были выявлены в различных сочетаниях: неоваскуляризация сетчатки и диска зрительного нерва (ДЗН), преретинальные геморрагии, твердый экссудат, эпиретинальный фиброз, фиброглиальные пролиферации, кровоизлияние в стекловидное тело; у 54 пациентов, помимо перечисленных осложнений, была выявлена локальная тракционная отслойка сетчатки, а у 14 пациентов (14 глаз) — распространенная или субтотальная отслойка сетчатки.
Функциональные результаты оценивались путем сравнения МКОЗ на момент поступления и через 1 месяц после ВРХВ, в дальнейшем наблюдение проводилось в динамике с разной кратностью и периодичностью, в зависимости от отдаленности региона проживания пациента, сроком до 5 лет. Согласно КР, стабилизацией считали сохранение или повышение МКОЗ, отсутствие геморрагической активности и прогрессирования пролиферативного процесса.
Этическая экспертиза
Исследования на основе данных эндокарт пациентов ФГБУ «НМИЦ эндокринологии» Минздрава России одобрены этическим комитетом (Протокол № 2 от 24 января 2024 г.). Все пациенты подписали добровольное информированное согласие на участие в исследовании при оформлении госпитализации в стационар.
РЕЗУЛЬТАТЫ
Выполнение ВРХВ у подавляющего большинства пациентов данного исследования стало возможным только благодаря совместной работе специалистов центра, направленной на коррекцию общего состояния пациента. Многим из пациентов было отказано в проведении ВРХВ как в ведущих офтальмологических научных медицинских центрах, так и в офтальмологических отделениях многопрофильных лечебных учреждений по причине сочетания далеко зашедших диабетических поражений сетчатки с декомпенсированным углеводным обменом, тяжелыми сопутствующими соматическими заболеваниями и высоким риском СС осложнений, что отражает анализ данных эндокарт.
Клиническая характеристика пациентов, включенных в исследование, представлена в табл. 1. Пациенты с СД1 (n=169) были молодого возраста: медиана составила 31,0 год, с длительным течением СД до момента проведения ВРХВ — 19 лет, женщины преобладали и составили 63% выборки, при этом отмечались нецелевой высокий уровень HbA1c — 8,45% и дислипидемия. Пациенты с СД2 (n=83) были старшей возрастной группы с медианой возраста 61,5 года, длительность СД до момента операции была сопоставима с пациентами СД1 и составила 17 лет, доля женщин — 57%, медиана индекса массы тела соответствовала I степени ожирения — 30,6 кг/м², аналогично пациентам с СД1 отмечался нецелевой уровень HbA1c — 8,5% и показателей липидного профиля, медиана рСКФ составила 58 мл/мин/1,73 м², что соответствует снижению почечной функции до хронической болезни почек (ХБП) С3а и ниже.
Таблица 1. Клиническая характеристика пациентов с сахарным диабетом 1 и 2 типов с проведенным витреоретинальным хирургическим вмешательством (n=252)
Параметр | СД 1 N=169 | СД 2 N=83 |
Me [ Q1; Q3]/% | Me [ Q1; Q3]/% | |
Возраст, лет | 31,0 [ 27,0; 42,0] | 61,5 [ 56,0; 67,0] |
Возраст постановки диагноза, лет | 12 [ 8; 17] | 45 [ 39; 50] |
Длительность СД до операции, лет | 19,0 [ 14,0; 26,0] | 17,0 [ 8,75; 23,0] |
Доля женщин, % | 63 | 57 |
ИМТ, кг/м² | 22,63 [ 20,5; 26,6] | 30,58 [ 26,8; 35,7] |
HbA1c, % | 8,45 [ 7,43; 9,68] | 8,50 [ 7,20; 9,63] |
Альбумин/креатинин мочи, мг/ммоль | 2,24 [ 1,13; 13,1] | 2,27 [ 1,21; 8,19] |
рСКФ, мл/мин/1,73 м² | 62,0 [ 34,0; 85,5] | 58,0 [ 39,0; 79,0] |
Холестерин, ммоль/л | 4,53 [ 3,65; 5,38] | 4,65 [ 3,68; 5,94] |
ЛПНП, ммоль/л | 2,64 [ 1,81; 3,42] | 2,80 [ 1,85; 4,03] |
ЛПВП, ммоль/л | 1,33 [ 1,09; 1,65] | 1,06 [ 0,87; 1,31] |
Триглицериды, ммоль/л | 1,07 [ 0,77; 1,52] | 1,70 [ 1,28; 2,23] |
Частота встречаемости диабетических осложнений, n (%) | ||
Атеросклероз | 79 (47) | 56 (67) |
ИБС | 15 (9) | 27 (32) |
ОНМК | 7 (4) | 7 (9) |
ХСН | 8 (5) | 25 (30) |
ХБП | 120 (71) | 52 (63) |
Анемия | 74 (44) | 18 (22) |
СДС | 49 (29) | 26 (31) |
Ампутация | 22 (13) | 14 (17) |
Лечение поражений сетчатки до ВРХВ, n (%) | ||
ЛКС в анамнезе, из них: | 167 (99) | 83 (100) |
•ЛКС в полном объеме | 2 (1,2) | 0 (0) |
•ЛКС выполнена фрагментарно | 165 (97,6) (на 1 глазу — 157 чел./157 глаз + на двух глазах — 8 чел./16 глаз) | 83 (100) |
Инъекции ИАГ в анамнезе | 9 (5) | 2 (2,4) |
Данные представлены в процентах, %, медианой и первым, третьим квартилями (Mediana [ Q1; Q3]).
Примечание. HbA1c — гликированный гемоглобин; ИАГ — ингибиторы ангиогенеза; ИМТ — индекс массы тела; рСКФ — расчетная скорость клубочковой фильтрации; ЛКС — лазерная коагуляция сетчатки; ЛПНП — липопротеины низкой плотности; ЛПВП — липопротеины высокой плотности; ИБС — ишемическая болезнь сердца; ОНМК — острое нарушение мозгового кровообращения; ХСН — хроническая сердечная недостаточность; ХБП — хроническая болезнь почек; СДС — синдром диабетической стопы; ВРХВ — витреоретинальное хирургическое вмешательство.
Индивидуальный анализ анамнестических данных показал, что только 2 пациента наблюдались офтальмологом и эндокринологом регулярно, остальные 250 наблюдались от случая к случаю, разными специалистами, часто в разных клиниках, где лечились по поводу других заболеваний и осложнений СД. Все пациенты были информированы о наличии у них диабетических поражений сетчатки и необходимости выполнения ПРЛК. Однако только у 2-х регулярно наблюдавшихся пациентов (2 глаза) с СД1 за 2 года до ВРХВ был выполнен полный объем ПРЛК (4 сеанса). ВРХВ у них потребовалось по причине рецидивирующих кровоизлияний в стекловидное тело, источником которых были новообразованные сосуды на диске зрительного нерва (область, где ЛКС не может быть выполнена), прорастающие на поверхность задней гиалоидной мембраны стекловидного тела. Еще у 2-х пациентов с СД1 (2 глаза) ЛКС до ВРХВ не выполнялась. Остальным 248 пациентам до поступления на ВРХВ по разным причинам удалось выполнить только по 1–2 сеанса ЛКС, но ЛКС не была завершена, коагуляты нанесены фрагментарно: при СД1 у 157 пациентов на одном глазу и у 8 пациентов на 2-х глазах, при СД2 — у 83 пациентов (83 глаза). Таким образом, суммарно при СД1 и СД2 ЛКС отсутствовала либо была выполнена фрагментарно на 258 из 260 глаз (99,2%) (табл. 1). Лазерное лечение у этих пациентов по разным причинам не было завершено, что привело к утяжелению ПДР и необходимости ВРХВ.
Визуализация глазного дна (хотя бы частичная) на глазу, где планировалось ВРХВ на момент поступления в стационар была возможна у 244 человек (244 глаза). У 8 пациентов (16 глаз) до операции глазное дно не офтальмоскопировалось даже фрагментарно, однако впоследствии, интраоперационно, также был установлен крайне малый объем ЛКС.
Вовлечение макулы в патологический процесс имело место на 242 глазах из 244 офтальмоскопируемых в виде сочетания в различных вариантах таких элементов как увеличение толщины сетчатки, эпиретинальные мембраны, грубый фиброз, витреоретинальный тракционный синдром, неоваскуляризация, эпиретинальные кровоизлияния, отложения твердого экссудата, тракционная отслойка сетчатки с распространением в макулярную зону.
Локальная тракционная отслойка сетчатки выявлена у 54-х пациентов при СД1 и СД2 — суммарно на 62 глазах (23,8% от всех анализируемых глаз). Распространенная или субтотальная отслойка сетчатки выявлялась у 14 пациентов на 14 глазах (5,4% от всех анализируемых глаз).
В анамнезе у 11 пациентов до поступления на ВРХВ перед ЛКС или в промежутках между сеансами ЛКС выполнялись единичные ИВВ ИАГ по поводу макулярного отека. Суммарно было выполнено 11 инъекций различных препаратов — при СД1 — 9 инъекций (9 глаз), при СД2 — 2 инъекции (2 глаза). (Табл. 1).
Исследование соматических осложнений показало, что несмотря на относительно компенсированные на фоне системной терапии лабораторные показатели на момент поступления на ВРХВ, во многих органах и системах произошли существенные патологические изменения по причине большой длительности и тяжелого течения диабета. Мы проанализировали в представленной когорте пациентов частоту встречаемости как СС осложнений, так и осложнений, которые являются эквивалентом СС риска или усиливают его. Было показано, что частота атеросклеротических сердечно-сосудистых заболеваний (АССЗ), в том числе ИБС, ОНМК, а также других эквивалентов высокого СС риска — ХСН, ХБП с сопутствующей анемией, ампутации и синдромом диабетической стопы (СДС) были высокими в когорте анализируемых пациентов (табл. 1). Атеросклероз сосудов встречался при СД1 практически у каждого второго пациента (47%), при СД2 у двух из трех пациентов (67%), ИБС регистрировалась при СД1 в 9%, при СД2 в 32%, ОНМК при СД1 в 4%, при СД2 в 9%, анемия при СД1 в 44%, при СД2 в 22% случаев, частота регистрации ХБП у пациентов с ВРХВ при СД1 составила 71%, при СД2 — 63% (табл. 1). Это еще раз подчеркивает тяжесть данной когорты пациентов, их высокую коморбидность и риск СС событий.
Пациенты подходили к ВРХВ с выраженными нарушениями почечной функции. При СД1 больше четверти пациентов находились на терминальной стадии поражения почек ХБП С5 — 27,4%, при СД2 13,6% (рис. 2). Доля пациентов с ВРХВ с относительно сохранной функцией почек — ХБП С1-2 стадии с рСКФ≥60 мл/мин/1,73 м² при СД1 составила 26,7%, при СД2 — 23,7% (рис. 2).
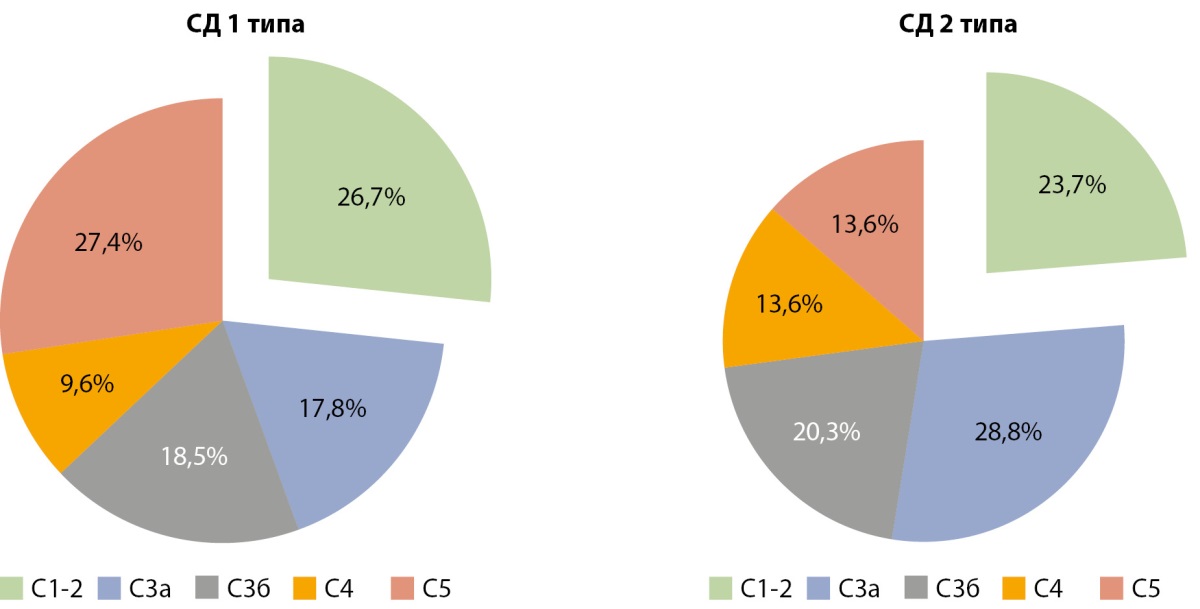
Рисунок 2. Распределение пациентов по стадиям хронической болезни почек С1-С5 по уровню расчетной скорости клубочковой фильтрации у пациентов с сахарным диабетом 1 и 2 типов.
Примечание. Стадии ХБП по рСКФ: С1 — 90–120 мл/мин/1,73 м², С2 — 60–89 мл/мин/1,73 м², С3а — 45–59 мл/мин/1,73 м², С3б — 30–44 мл/мин/1,73 м², С4 — 15–29 мл/мин/1,73 м², терминальная стадия поражения почек С5 — <15 мл/мин/1,73 м².
Результаты ВРХВ
Анатомический результат после ВРХВ — прилегание сетчатки, устранение витреоретинальных тракций — был достигнут у всех 252 пациентов на 260 глазах (100%).
У 184 пациентов (184 глаза, 70,8%) с различными изменениями без отслойки сетчатки операция была закончена введением в стекловидную полость воздуха или газа SF6, дальнейшие хирургические вмешательства не потребовались. У 54 пациентов с локальной тракционной отслойкой сетчатки для предотвращения рецидива отслойки сетчатки ВРХВ заканчивалось введением силиконового масла в витреальную полость суммарно — на 62 глазах (23,8%): на одном глазу — у 46 человек (46 глаз), на обоих глазах за период наблюдения — у 8 человек (16 глаз), в дальнейшем в различные сроки (от нескольких месяцев до 1 года) было необходимо повторное хирургическое вмешательство по замене силиконового масла на воздух или газ, либо повторное введение силиконового масла при угрозе рецидива отслойки сетчатки. 14 пациентам (14 глаз) (5,4%) с наиболее тяжелыми поражениями с распространенной или субтотальной отслойкой сетчатки для расправления сетчатки и достижения анатомического результата после витреэктомии в витреальную полость вводился перфтордекалин, через несколько дней выполнялась повторная операция по замене перфтордекалина на силиконовое масло. Этим пациентам также требовалась в дальнейшем повторная операция по замене силиконового масла на воздух или газ, либо повторное введение силиконового масла при угрозе рецидива отслойки сетчатки.
241 пациенту (257 глаз) для стабилизации пролиферативного процесса через 1 мес после ВРХВ требовалась дополнительная ЛКС.
В большинстве случаев ЛКС требовалась и на парных к оперируемым глазах. Функциональные результаты после ВРХВ зависели от исходной МКОЗ, которая была обусловлена тяжестью осложнений ПДР и длительностью их существования, а также вовлечением в патологический процесс макулярной зоны. У пациентов с изначально высокой МКОЗ функциональные результаты после ВРХВ были выше. При изначально низкой МКОЗ, несмотря на ее многократное увеличение, зрительные функции оставались низкими. МКОЗ по десятичной системе до и после ВРХВ составила: на 76 глазах (29%) до ВРХВ «светоощущение с правильной свето-проекцией»–0,05 и после вмешательства 0,01–0,08; на 68 глазах (26%) — до ВРХВ 0,06–0,1 и после вмешательства 0,08–0,3; на 62 глазах (24%) — до 0,2–0,3 и после 0,3–0,5; на 54 глазах (21%) — до 0,4–0,8 и после 0,5–1,0, соответственно.
При динамическом наблюдении стабилизация была достигнута на 254 глазах (97,7%). На трех глазах потребовалось повторное вмешательство из-за рецидива отслойки сетчатки или рецидивирующих кровоизлияний в витреальную полость. У двух пациентов, наблюдавшихся редко и нерегулярно впоследствии развилась неоваскулярная глаукома, что привело к быстрому снижению МКОЗ вплоть до полной потери зрения. Один пациент умер в послеоперационном периоде по причине инфаркта миокарда.
ОБСУЖДЕНИЕ
История подавляющего большинства пациентов, поступивших для ВРХВ, достаточно типична: большая длительность и декомпенсация СД, нерегулярное наблюдение офтальмолога и эндокринолога, часто в различных учреждениях, незавершенная ЛКС или полное отсутствие лазерного лечения, единичные инъекции ИАГ с временным положительным эффектом, многочисленные соматические осложнения СД и сопутствующие заболевания, требующие лечения в различных стационарах. Следует особо отметить, что большинство пациентов в течение года до поступления на ВРХВ были консультированы офтальмологами с рекомендацией проведения ПРЛК, которая по разным причинам не была выполнена безотлагательно и в полном объеме, как предусмотрено в КР [7]. Причинами невыполнения рекомендаций офтальмолога назывались срочная необходимость лечения в другом стационаре, очередь на лазерное лечение в учреждениях системы ОМС, удаленность или отсутствие квалифицированных специалистов и аппаратуры в регионе проживания, длительное ожидание квоты на высокотехнологичную медицинскую помощь, которая предоставляет возможность выполнения ПРЛК в условиях эндокринологического стационара, кровоизлияние в стекловидное тело и, как следствие, потеря технической возможности продолжить ЛКС, личные обстоятельства пациента. Не следует сбрасывать со счетов низкую приверженность лечению части пациентов с СД. Гармоничный тип реагирования на свою болезнь, трезвая оценка своего состояния, стремление во всем активно содействовать успеху лечения, к сожалению, свойственны не всем пациентам. Совокупность этих обстоятельств приводит к потере времени и развитию тяжелой ПДР, требующей ВРХВ.
Подавляющему большинству пациентов ВРХВ позволило не только сохранить, но и улучшить зрение. Однако в результате тяжелого дорогостоящего хирургического вмешательства, сопряженного с высоким риском СС осложнений, острота зрения, обеспечивающая возможность чтения — выше 0,5 по десятичной системе — была достигнута в лишь в 21% случаев, тогда как в 29% МКОЗ не превышала 0,1. Суммарно в 29,2% случаев было необходимо повторное хирургическое вмешательство, и подавляющему большинству пациентов после ВРХВ для стабилизации пролиферативного процесса была необходима дополнительная ЛКС. К огромному сожалению, высокий риск СС осложнений среди наших пациентов реализовался — мы потеряли одного пациента в результате инфаркта миокарда в послеоперационном периоде. Следует признать, что затраченные на ВРХВ и его сопровождение значительные материальные ресурсы и труд команды специалистов не могут восполнить отсутствие квалифицированного мониторинга и своевременного адекватного лазерного лечения, а потеря зрения и жизни не поддаются материальной оценке. Необходимо подчеркнуть, что ключевой причиной развития тяжелой ПДР, приведшей к необходимости ВРХВ в подавляющем большинстве случаев, явилась потеря времени и возможности выполнения ПРЛК. Совершенно очевидно, что соблюдение КР позволило бы избежать и тяжелых потерь зрения, и необходимости хирургических вмешательств, сопряженных для коморбидных пациентов с высоким риском СС событий.
Так, согласно КР и рекомендациям ETDRS, ПРЛК должна быть проведена безотлагательно при состояниях, угрожающих тяжелой потерей зрения, а именно: при выявлении неоваскуляризации диска зрительного нерва (ДЗН), размер которой превышает 1/3 площади ДЗН, неоваскуляризации сетчатки, размер которой превышает 1/2 площади ДЗН, витреальной или преретинальной геморрагии [6][7][8].
В оптимальном варианте лазерное лечение должно выполняться в 3–4 этапа, амбулаторно, с интервалами в 1–2 недели без госпитализации пациента с одновременной коррекцией соматической патологии [9]. В КР предусмотрено как амбулаторное, так и стационарное выполнение ПРЛК. В реальной клинической практике в медицинских учреждениях системы ОМС часто пациент вынужден ожидать в течение нескольких месяцев очереди на амбулаторное лазерное лечение. При выполнении лазерного лечения в условиях одной госпитализации, в рамках квоты на высокотехнологичную медицинскую помощь, ПРЛК выполняется форсированно, что сопряжено с большой ожоговой травмой, активацией субклинических воспалительных процессов, манифестацией либо прогрессированием уже имеющегося ДМО, риском геморрагических осложнений, снижением МКОЗ. Важное значение имеет квалифицированное наблюдение пациента в динамике и после ПРЛК, так как при возобновлении активности пролиферативного процесса необходимо своевременное выполнение дополнительной ЛКС. В КР подчеркивается, что высокая вероятность развития слепоты оправдывает применение дополнительного лазерного лечения, даже при ранее выполненной ПРЛК, несмотря на возможные побочные эффекты. Очевидно, что доступность и своевременность квалифицированной специализированной помощи — наличие подготовленных специалистов и современной аппаратуры в регионе проживания пациента имеют крайне важное значение для выполнения КР [10]. К сожалению, далеко не все пациенты, проживающие в отдаленных регионах, имеют возможность лечения и регулярного наблюдения в специализированных центрах.
Выбор тактики офтальмологического лечения пациента с СД часто определяется сочетанием ПДР и ДМО, что диктует необходимость выбора приоритетов в подходе к терапии. В контексте нашего исследования считаем необходимым обсудить этот вопрос применительно к высококоморбидному пациенту с ПДР и ДМО.
Возникновение ДМО, приводящего к утолщению сетчатки, связывают с нарушением гематоретинального барьера и транссудацией жидкости в межклеточное пространство нейроэпителия, снижением насосной функции пигментного эпителия сетчатки, изменением продукции целого ряда цитокинов, наиболее изученными из которых являются провоспалительные цитокины и цитокины семейства VEGF [11–14]. Ишемия и нарушение капиллярной перфузии имеют ключевое значение в запуске гиперпродукции факторов роста , приводящей к развитию эпиретинальной неоваскуляризации, более чем в 2/3 случаев сопровождающейся ДМО [5]. Патогенетическая связь этих поражений сетчатки очевидна. Единой классификации ДМО не существует. Условно принято выделять основные клинические формы диабетической макулопатии: ДМО, тракционная макулопатия, ишемическая макулопатия [14]. ДМО, затрагивающий центр макулы, который может привести к снижению остроты зрения, принято считать клинически значимым.
Внедрение в практику ОКТ и ОКТ-ангио дало широкие возможности диагностики и контроля эффективности лечения ДМО [4][8–13]. К сожалению, из-за отсутствия оборудования для выполнения ОКТ далеко не везде возможна ранняя диагностика ДМО. На ранних стадиях ДМО может не вызывать существенного снижения зрения и жалоб пациента. Между тем, раннее выявление ДМО и коррекция системных факторов риска его прогрессирования — гипергликемии, дислипидемии, артериальной гипертензии — чрезвычайно важны. При начальных проявлениях ДМО гораздо более эффективно и лазерное лечение, которое на протяжении нескольких десятилетий было золотым стандартом лечения [15]. Выполнялась фокальная ЛКС при ограниченных по площади отеках в зонах ликкеджа, выявляемых при ФАГ или ЛКС по типу «решетки» при диффузных отеках. Были разработаны специальные методики и протоколы для щадящего лазерного лечения макулы. Коагуляты наносились не ближе 500 мкм от центра макулы. Однако побочных эффектов — атрофии пигментного эпителия сетчатки (ПЭС), появления центральных скотом — не всегда удавалось избежать, в особенности у пациентов с обширными ДМО с большой толщиной сетчатки, требовавших лазерного воздействия большой мощности.
В настоящее время ИВВ ИАГ признаны терапией первой линии в лечении клинически значимого ДМО. КР по применению ИАГ были сформированы на основе рандомизированных клинических исследований (РКИ), подтвердивших эффективность этих препаратов в отношении ДМО [7][11–14].
Однако, выбирая тактику лечения коморбидного пациента с ПДР и ДМО, необходимо отдавать себе отчет в том, что рекомендовать схемы лечения, рассчитанные на длительный срок и частые посещения клиники, таким пациентам нецелесообразно. Высококоморбидному пациенту такие рекомендации заведомо трудно выполнять, что связано с большим количеством осложнений СД, сопутствующей патологии и необходимостью их лечения, в том числе в условиях различных стационаров. В течение 1–1,5 мес в 3–4 этапа может быть выполнен необходимый объем ПРЛК, предотвращающий тяжелую потерю зрения, чему и следует отдать приоритет. В отношении лечения ДМО необходим строго индивидуальный подход. У высококоморбидных пациентов представляется оправданным выбирать сочетание ИВВ ИАГ с лазерным лечением макулы, что позволяет уменьшить толщину сетчатки, выполнить ЛКС в зонах микроаневризм и ликкеджа более деликатно, с меньшей ожоговой травмой, минимизирует нежелательные побочные эффекты лазерного лечения, уменьшает частоту рецидивов ДМО, потребность в инъекциях ИАГ, число посещений клиники. К сожалению, отсутствие флуоресцеина на отечественном рынке не позволяет выполнить флюоресцентную ангиографию для выявления зон ликкеджа, что диктует необходимость проведения ЛКС в макуле, опираясь лишь на клиническую картину. В ряде случаев, даже одна инъекция ИВВ ИАГ может быть полезна в лечении тяжелых диабетических поражений сетчатки, ассоциированных с выраженной неоваскуляризацией и фиброглиальной пролиферацией [16]. Регресс неоваскуляризации, пусть временный, дает возможность выполнить ЛКС, а в дальнейшем, при необходимости, — ВРХВ с меньшими геморрагическими осложнениями [8][17][18]. Также для коморбидных пациентов с высоким кардиоваскулярным риском, для тех, кому тяжело соблюдать график визитов в клинику, целесообразен выбор ИВВ импланта глюкокортикоида, обеспечивающего более длительный эффект, в сочетании с лазерным лечением макулы, что предусмотрено КР.
Таким образом, сочетая единичные ИВВ с лазерным лечением там, где это возможно, мы сводим к минимуму известные недостатки лечения как ИАГ — инвазивность, кратковременность действия, высокую стоимость препаратов, необходимость частых повторных многократных визитов (госпитализаций) в клинику, так и имплантов глюкокортикоидов — инвазивность, высокую стоимость препаратов, более продолжительный, чем у ИАГ, однако все равно временный эффект уменьшения толщины сетчатки, риск подъема внутриглазного давления [19–21]. Одной из причин рефрактерного по отношению к медикаментозному лечению макулярного отека может быть ишемия периферических отделов сетчатки, поддерживающая экспрессию сосудистого эндотелиального фактора роста, что указывает на общность патогенеза ПДР и ДМО. ЛКС периферических отделов сетчатки может быть полезна для устранения ДМО. К сожалению, из-за отсутствия флюоресцеина выполнение ФАГ, предусмотренное КР для диагностики зон неперфузии на периферии глазного дна, невозможно.
В последнее время все чаще появляются сообщения о существенных различиях эффективности препаратов ИАГ при лечении ДМО в РКИ и в РКП. В РКИ включаются пациенты, соответствующие строгим критериям отбора. В РКП, в особенности при тяжелой ПДР, четкое разграничение ДМО и тракционной макулопатии далеко не всегда возможно, так как имеют место изменения витреоретинального интерфейса (эпиретинальные мембраны, адгезия задней гиалоидной мембраны стекловидного тела к сетчатке), в той или иной степени влияющие на возникновение и поддержание ДМО за счет тангенциальных и витреоретинальных тракций. В таких случаях пациенты не получают выраженного улучшения зрения после инъекций, что не способствует приверженности лечению ИАГ [19–21]. В глубоком и всестороннем исследовании нуждаются системные эффекты ИАГ. Производители препаратов указывают на отсутствие системного воздействия ИАГ при интравитреальном введении. Однако имеются данные о том, что ИВВ ИАГ сопровождается падением уровня VEGF в течение довольно длительного времени как на местном, в стекловидном теле и слезной жидкости, уровне, так и в крови [22, 23]. Является ли этот системный эффект опасным при повторных инъекциях в отношении соматических осложнений у коморбидных пациентов? Данные о более высоком риске СС осложнений на фоне длительного применения ИАГ противоречивы. Имеются исследования, свидетельствующие о более высоком риске смерти и инсульта при двухлетнем применении ИАГ [24][25], в то же время результаты другого метаанализа не выявили повышенного риска развития осложнений, обусловленных тромбозом артерий, при применении анти-VEGF-препаратов для лечения ДМО [26].
В 2023 г. появилось сообщение о том, что у пациентов с ДМО, получавших ИВВ ИАГ в рамках РКИ, в течение 2-летнего курса лечения наблюдалось ухудшение функции почек — снижение рСКФ, что особенно опасно у пациентов с исходно низкой рСКФ [27], этот же побочный эффект был отмечен у части пациентов в другом аналогичном исследовании [28].
Сопоставив данные исследований своей выборки с данными приведенных публикаций, приходим к выводу, что вопрос о том, несет ли длительное применение ИАГ, предусматривающее многократные инъекции, дополнительные риски СС событий и прогрессирования ХБП у пациентов с ДМО и ПДР, становится все более острым. Еще один, на наш взгляд, важный момент, связанный с применением ИАГ у коморбидных пациентов с ПДР, требует обсуждения. Оценка достаточности ПРЛК и стабилизации пролиферативного процесса у пациентов с ПДР и ДМО на фоне лечения ИАГ требуют особого внимания и длительного наблюдения. Временный регресс новообразованных сосудов под действием ИАГ создает картину стабилизации ПДР, тогда как по окончании действия препарата неоваскулярные процессы могут активизироваться, несмотря на выполненный стандартный объем ПРЛК. Необходимо учитывать, что в случае возобновления активности пролиферативного процесса может потребоваться дополнительная ЛКС, что предусмотрено КР.
Таким образом, тактика лечения ПДР и ДМО у коморбидного пациента в каждом конкретном случае требует взвешенного и продуманного подхода.
Очевидно, что приоритетным методом лечения для этих пациентов должна быть ПРЛК, как метод, позволяющий избежать тяжелых потерь зрения и предотвратить необходимость ВРХВ, сопряженного с высоким риском СС событий. При этом чрезвычайно важно обеспечить этим пациентам безотлагательное выполнение ПРЛК и квалифицированное динамическое наблюдение, предусмотренные КР. Считаем, что персонализированный подход и выбор приоритетов в лечении пациентов с сочетанным поражением сетчатки — ПДР и ДМО — должен осуществляться офтальмологом при непосредственном участии эндокринолога с учетом высокой коморбидности этих пациентов. Учитывая трудности регулярного посещения офтальмолога и наличие коморбидной патологии, в зависимости от клинической ситуации, целесообразно сочетание единичных ИВВ ИАГ или имплантов глюкокортикоидов для уменьшения толщины сетчатки в макуле сочетать с лазерным лечением ДМО [16].
Создание протокола лечения ПДР с приоритетом ПРЛК, учитывающего системные осложнения СД, помогло бы избежать тяжелых поражений сетчатки и необходимости их хирургического лечения у высоко коморбидных пациентов, сохранить зрение и обеспечить выполнение КР в широкой клинической практике.
Ограничения исследования
Задача данной статьи была сформулирована как представление анализа когорты пациентов с СД и выполненным ВРХВ в реальной клинической практике в рамках работы отделения диабетической ретинопатии и офтальмохирургии ФГБУ «НМИЦ эндокринологии». Представлено описание группы с целью характеристики тяжести пациентов. Использование групп контроля и сравнения не предполагалось при планировании данной работы.
ЗАКЛЮЧЕНИЕ
В исследуемой когорте пациентов с тяжелой ПДР, отличавшихся коморбидностью и высоким риском СС событий, в 99,2% случаев отсутствовал должный объем ЛКС. Недостаточный объем ЛКС был главной причиной, приведшей к прогрессированию ПДР и развитию осложнений, которые угрожали потерей зрения и требовали ВРХВ. Пациенты подходили к ВРХВ с кардиоваскулярной патологией и множественными соматическими осложнениями диабета, усиливающими риск СС событий. Атеросклероз выявлялся при СД1 и СД2 в 47 и 67%, ИБС — в 9 и 32%, ОНМК — в 4 и 9%, ХСН — в 5 и 30%, СДС — 29 и 31% соответственно, в том числе ампутации были у 13%/17% пациентов, соответственно. У большинства пациентов диагностировались выраженные нарушения почечной функции — ХБП с рСКФ меньше 60 мл/мин/1,73 м² выявлялась при СД1 в 71% и 63% при СД2, при этом имели терминальную стадию поражения почек, ХБП С5, 27,4% пациентов с СД1, 13,6% с СД2. Функциональные результаты ВРХВ зависели от исходных зрительных функций. ВРХВ в большинстве случаев позволяет улучшить зрение и избежать слепоты, однако не может восполнить недостаток квалифицированного скрининга, мониторинга и своевременного выполнения ПЛКС.
У коморбидных пациентов с ПДР панретинальная ЛКС должна выполняться безотлагательно в соответствии с КР и быть приоритетным методом лечения во избежание тяжелых потерь зрения и необходимости выполнения ВРХВ на фоне тяжелой соматической патологии. При сочетании ПДР и ДМО, там, где это возможно, ИВВ ИАГ или имплантов глюкокортикоидов следует дополнять лазерным лечением ДМО, избегая трудновыполнимых для этой категории пациентов схем лечения, рассчитанных на длительный срок, предусматривающих частые регулярные посещения клиники.
Для выполнения КР в широкой клинической практике необходимо создание региональных эндокринологических центров с хорошо оснащенной офтальмологической службой, что способствовало бы увеличению доступности специализированной помощи и лучшему взаимодействию офтальмологов и эндокринологов, ранней диагностике, своевременному лечению диабетических поражений сетчатки.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансовых средств.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Новикова-Билак Т.А. — проведение исследования и подготовка статьи: определение концепции статьи, получение, анализ данных или интерпретация результатов, написание текста статьи; Железнякова А.В., Викулова О.К. — разработка эндокарты, дизайна исследования, проведение исследования, анализ данных, написание текста статьи; Ильюхин О.Е. — проведение оперативных вмешательств, одобрение финальной версии рукописи; Липатов Д.В. — организационное обеспечение исследования, одобрение финальной версии рукописи; Николаева А.М. — статистический анализ; Турко К.С. — работа с базами данных литературы, экспертный перевод протоколов РКИ, написание текста статьи; Шестакова М.В. — разработка темы исследования, финальный анализ и редактирование текста рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. — 2023. — Т. 26. — №2. — С. 104-123. doi: https://doi.org/10.14341/DM13035
2. Липатов Д.В., Викулова О.К., Железнякова А.В., и др. Эпидемиология диабетической ретинопатии в Российской Федерации по данным Федерального регистра пациентов с сахарным диабетом (2013–2016 гг.) // Сахарный диабет. — 2018. — Т. 21. — №4. — С. 230-240. doi: https://doi.org/10.14341/DM9797
3. Александрова В.К., Чистяков Т.А., Бессмертная Е.Г., и др. Cтруктура диабетической ретинопатии по данным федерального регистра сахарного диабета Российской Федерации за период 2009-2023 годов // Инновационные технологии в эндокринологии (ИТЭ 2024): Сборник тезисов V (XXX) Национального конгресса эндокринологов с международным участием, Москва, 21–24 мая 2024 года. — М.: Общество с ограниченной ответственностью «Типография «Печатных Дел Мастер»; 2024. doi: https://doi.org/10.14341/Cong21-24.05.24-51
4. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск // Сахарный диабет. — 2023. — Т.26. — №2S. — С.1-157. doi: https://doi.org/10.14341/DM13042
5. Бикбов М.М., Файзрахманов Р.Р., Зайнуллин Р.М., и др. Макулярный отек как проявление диабетической ретинопатии // Сахарный диабет. — 2017. — Т. 20. — №4. — С. 263-269. doi: https://doi.org/10.14341/DM8328
6. Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology. 1991;98(5 Suppl):766-785
7. Ассоциация врачей-офтальмологов, Российская ассоциация эндокринологов. Клинические рекомендации «Сахарный диабет: диабетическая ретинопатия, диабетический макулярный отек», 2023. Доступно по ссылке: https://cr.minzdrav.gov.ru/preview-cr/115_2 [
8. Ixcamey M, Palma C. Diabetic macular edema. Dis Mon. 2021;67(5):101138. doi: https://doi.org/10.1016/j.disamonth.2021.101138
9. Шадричев Ф.Е. Протокол офтальмологического ведения больных сахарным диабетом // Офтальмологические ведомости. — 2008. — Т.1. — №2. — С. 54-61
10. Нероев В.В., Катаргина Л.А., Зайцева О.В., и др. Состояние медицинской помощи пациентам с диабетической ретинопатией в Российской Федерации по результатам оценки в рамках программы ВОЗ «TADDS» // Российский офтальмологический журнал. — 2016. — Т. 9. — №2. — С. 5–10. doi: https://doi.org/10.21516/2072-0076-2016-9-2-5-10
11. Aiello LP. Vascular endothelial growth factor and the eye: biochemical mechanisms of action and implications for novel therapies. Ophthalmic Res. 1997;29(5):354-362. doi: https://doi.org/10.1159/000268033
12. Miller K, Fortun JA. Diabetic Macular Edema: Current Understanding, Pharmacologic Treatment Options, and Developing Therapies. Asia Pac J Ophthalmol (Phila). 2018;7(1):28-35. doi: https://doi.org/10.22608/APO.2017529
13. Romero-Aroca P, Baget-Bernaldiz M, Pareja-Rios A, et al. Diabetic Macular Edema Pathophysiology: Vasogenic versus Inflammatory. J Diabetes Res. 2016;2016:2156273. doi: https://doi.org/10.1155/2016/2156273
14. Haller JA, et al. Update on the pathophisiology, molecular biology, and treatment of macular edema. Advanced studies in ophthalmology. 2007;4(7):178-190
15. Photocoagulation for diabetic macular edema. Early Treatment Diabetic Retinopathy Study report number 1. Early Treatment Diabetic Retinopathy Study research group. Arch Ophthalmol. 1985;103(12):1796-1806
16. Липатов Д.В., Лышканец О.И. Интравитреальная терапия диабетического макулярного отека в России: современное состояние проблемы // Вестник офтальмологии. — 2019. — Т.135. — №4. — С.128–139. doi: https://doi.org/10.17116/oftalma2019135041128
17. Diabetic Retinopathy Clinical Research Network. A randomized trial comparing intravitreal triamcinolone acetonide and focal/grid photocoagulation for diabetic macular edema. Ophthalmology. 2008;115(9):1447-145010. doi: https://doi.org/10.1016/j.ophtha.2008.06.015
18. Boyer DS, Yoon YH, Belfort R Jr, et al. Three-year, randomized, sham-controlled trial of dexamethasone intravitreal implant in patients with diabetic macular edema. Ophthalmology. 2014;121(10):1904-1914. doi: https://doi.org/10.1016/j.ophtha.2014.04.024
19. Бобыкин Е.В., Крохалев В.Я., Буслаев Р.В., Морозова О.В. Факторы, определяющие приверженность пациентов с заболеваниями макулы, получающих антиангиогенную терапию, к долгосрочному наблюдению в условиях реальной клинической практики // Российский офтальмологический журнал. — 2021. — Т.14. — №1. — С. 21-29. doi: https://doi.org/10.21516/2072-0076-2021-14-1-21-29
20. Бобыкин Е.В. Анти-VEGF-терапия диабетического макулярного отека: актуальные подходы к ведению пациентов с высокими и низкими исходными функциональными параметрами // Клиническая офтальмология. — 2022. — Т.22 — №3. — С.181-186. doi: https://doi.org/10.32364/2311-7729-19
21. Фурсова А.Ж., Дербенева А.С., Тарасов М.С., и др. Клиническая эффективность антиангиогенной терапии диабетического макулярного отека в реальной клинической практике (2-летние результаты) // Российский офтальмологический журнал. — 2021. — Т.14. — №2. — С.42-49. doi: https://doi.org/10.21516/2072-0076-2021-14-2-42-49
22. Слепова О.С., Нероев В.В., Илюхин П.А., Сарыгина О.И. Иммунологический контроль при хирургическом лечении больных с пролиферативной диабетической ретинопатией с предварительным интравитреальным введением Луцентиса // Российский офтальмологический журнал. — 2012. — Т.5. — №1. — С.69-74.
23. Hirano T, Toriyama Y, Iesato Y, Imai A, Murata T. Changes in plasma vascular endothelial growth factor level after intravitreal injection of bevacizumab, aflibercept, or ranibizumab for diabetic macular edema. Retina. 2018;38(9):1801-1808. doi: https://doi.org/10.1097/IAE.0000000000002004
24. Avery RL, Gordon GM. Systemic safety of prolonged monthly anti-vascular endothelial growth factor therapy for diabetic macular edema: a systematic review and meta-analysis. JAMA Ophthalmol. 2016;134(1):21-29. doi: https://doi.org/10.1001/jamaophthalmol.2015.4070
25. Kitchens J. Systematic Review of Safety Across the Phase 2 and 3 Clinical Trials of Intravitreal Aflibercept Injection in Neovascular Age-Related Macular Degeneration, Macular Edema Following Retinal Vein Occlusion, and Diabetic Macular Edema. Invest Ophthalmol Vis Sci. 2015;56(7):4606
26. Massin P, Bandello F, Garweg JG, et al. Safety and efficacy of ranibizumab in diabetic macular edema (RESOLVE Study): a 12-month, randomized, controlled, double-masked, multicenter phase II study. Diabetes Care. 2010;33(11):2399-2405. doi: https://doi.org/10.2337/dc10-0493
27. Fang YC, Lai IP, Lai TT, et al. Long-Term Change in Renal Function After Intravitreal Anti-VEGF Treatment for Diabetic Macular Edema: A 2-Year Retrospective Cohort Study. Ophthalmol Ther. 2023;12(6):2977-2988. doi: https://doi.org/10.1007/s40123-023-00771-4
28. Bunge CC, Dalal PJ, Gray E, et al. The Association of Intravitreal Anti-VEGF Injections With Kidney Function in Diabetic Retinopathy. Ophthalmol Sci. 2023;3(4):100326. doi: https://doi.org/10.1016/j.xops.2023.100326
Об авторах
Т. А. Новикова-БилакРоссия
Новикова-Билак Татьяна Анатольевна, к.м.н.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
А. В. Железнякова
Россия
Железнякова Анна Викторовна, к.м.н.
О. Е. Ильюхин
Россия
Ильюхин Олег Евгеньевич, к.м.н.
Д. В. Липатов
Россия
Липатов Дмитрий Валентинович, д.м.н., профессор
А. М. Николаева
Россия
Николаева Александра Максимовна
К. С. Турко
Россия
Турко Кирилл Сергеевич
О. К. Викулова
Россия
Викулова Ольга Константиновна, д.м.н., доцент
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
Дополнительные файлы
|
|
1. Рисунок 1. Первичная диагностика диабетической ретинопатии: распределение по стадиям новых случаев диабетической ретинопатии у взрослых пациентов с сахарным диабетом 1 типа и сахарным диабетом 2 типа в 2009 и 2023 гг. Адаптировано по опубликованным данным [3]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(147KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Распределение пациентов по стадиям хронической болезни почек С1-С5 по уровню расчетной скорости клубочковой фильтрации у пациентов с сахарным диабетом 1 и 2 типов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(132KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Новикова-Билак Т.А., Железнякова А.В., Ильюхин О.Е., Липатов Д.В., Николаева А.М., Турко К.С., Викулова О.К., Шестакова М.В. Коморбидный пациент с тяжелой пролиферативной диабетической ретинопатией: анализ решенных и нерешенных вопросов диагностики и лечения диабетических поражений сетчатки с позиций реальной клинической практики и клинических рекомендаций. Сахарный диабет. 2025;28(1):68-79. https://doi.org/10.14341/DM13290
For citation:
Novikova-Bilak T.A., Zheleznyakova A.V., Iljukhin O.E., Lipatov D.V., Nikolaeva A.M., Turko K.S., Vikulova O.K., Shestakova M.V. Patient with severe proliferative diabetic retinopathy and comorbidity: analysis of solved and unsolved problems in diabetic retinal involvement diagnosis and treatment from the point of real-world clinical practice and clinical guidelines. Diabetes mellitus. 2025;28(1):68-79. (In Russ.) https://doi.org/10.14341/DM13290

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































