Перейти к:
Показатели овариального резерва, оксидативного стресса, гликемического профиля у женщин с сахарным диабетом 1 типа, использующих различные режимы инсулинотерапии
https://doi.org/10.14341/DM13265
Аннотация
ОБОСНОВАНИЕ. Несмотря на успехи в диабетологии, женщины с сахарным диабетом 1 типа (СД1) до настоящего времени имеют высокую частоту нарушений менструального цикла, меньшее количество беременностей и высокую частоту перинатальных осложнений. Появление новых методов контроля гликемического профиля предоставляет новые возможности для анализа эффективности различных режимов инсулинотерапии в сохранении репродуктивного здоровья женщин с СД1.
ЦЕЛЬ. Изучить связь различных вариантов гликемического профиля, статуса прооксидантной и антиоксидантной систем и показателей овариального резерва у пациенток с СД1.
МАТЕРИАЛЫ И МЕТОДЫ. Обследовано 60 женщин с СД1, 30 пациенток, использовавших режим множественных инъекций инсулина (МИИ) — 1 группа была разделена на 2 подгруппы: не превышающая целевой диапазон уровня глюкозы более 35% времени суток (1А группа) и превышающая данный диапазон (1Б группа). Возраст женщин составил 33,0 [20,0; 35,0] года. Режим постоянной подкожной инфузии инсулина (ППИИ) получали 30 женщин, составивших 2 группу. Они были разделены идентично — 2А группа и 2Б группа. Проведен анализ данных непрерывного мониторинга глюкозы (НМГ) с использованием Flesh-мониторинга Libra. Определены уровни малонового диальдегида, активность каталазы и уровень нитротирозина. Проведена оценка овариального резерва: объема яичников, количества антральных фолликулов, уровня антимюллерова гормона и фолликулостимулирующего гормона.
РЕЗУЛЬТАТЫ. Отличий времени в целевом диапазоне (ВЦД) уровня глюкозы в группах 1А и 2А не выявлено. HbA1c был больше в группе, превышающей время целевого диапазона (ВВД), у женщин, использующих МИИ. Уровень нитротирозина у женщин ВВД (1Б группа) составил 161,4 [110,6; 232,1] нмоль/л и отличался от данного показателя в группе 2Б — 42,4 [19,1; 64,9] нмоль/л (p<0,01). Выявлена зависимость изменения активности каталазы и уровня растворимого рецептора конечных продуктов гликирования (sRAGE) в группе 2А (rs=0,857; p<0,05). Тенденция к увеличению количества антральных фолликулов получена при превышении целевого диапазона уровня глюкозы выше 7,8 ммоль/л более 35% времени суток.
ЗАКЛЮЧЕНИЕ. Получены предварительные данные о взаимосвязи гипергликемии, превышающей уровень 7,8 ммоль/л более 35% времени суток с показателями оксидативного стресса, уровнем sRAGE и тенденцией к увеличению антральных фолликулов у женщин с СД1.
Ключевые слова
Для цитирования:
Тиселько А.В., Мишарина Е.В., Ярмолинская М.И., Милютина Ю.П., Залозняя И.В., Кореневский А.В. Показатели овариального резерва, оксидативного стресса, гликемического профиля у женщин с сахарным диабетом 1 типа, использующих различные режимы инсулинотерапии. Сахарный диабет. 2025;28(4):323-331. https://doi.org/10.14341/DM13265
For citation:
Tiselko A.V., Misharina E.V., Yarmolinskaya M.I., Milyutina Yu.P., Zalozniaia I.V., Korenevsky A.V. Ovarian reserve, oxidative stress and glycemic profile parameters in women with type 1 diabetes mellitus using different insulin therapy regimens. Diabetes mellitus. 2025;28(4):323-331. (In Russ.) https://doi.org/10.14341/DM13265
ОБОСНОВАНИЕ
Сахарный диабет (СД) — это заболевание, распространенность которого во всем мире растет. По данным Диабетического атласа Международной федерации диабета, в 2021 г. в мире насчитывалось 537 млн человек с СД [1]. Число женщин репродуктивного возраста, у которых диагностирован СД, увеличилось, и распространенность репродуктивных нарушений, вызванных СД, впоследствии будет иметь тенденцию к повышению. В настоящее время существует представление о негативном влиянии гипергликемии на репродуктивное здоровье. Данные о частоте и тяжести различных проявлений овариальной недостаточности, снижения фертильности у пациентов с СД в литературе противоречивы и недостаточны. По данным ряда авторов, репродуктивные нарушения наблюдаются у 30–70% женщин с CД 1 типа (СД1) [2][3]. В связи с тем, что СД1 возникает в молодом возрасте, одной из важнейших целей лечения является сохранение репродуктивного здоровья. В ходе анализа функциональных нарушений в гипоталамо-гипофизарно-гонадной оси высказано предположение, что недостаток инсулина в дебюте заболевания может вызвать функциональный гипогонадотропный гипогонадизм, обусловленный катаболическими процессами в организме, снижением уровня лептина и подавлением экспрессии киспептина в центральной нервной системе, который является стимулятором выработки гонадотропин-рилизинг гормона (ГнРГ), что и приводит к функциональному гипогонадизму [4]. Женщины с СД1 чаще имеют нарушения менструального цикла, такие как олигоменорея или аменорея, особенно при отсутствии компенсации углеводного обмена [5]. У здоровых людей инсулин попадает в печень через воротную вену для первого внутрипеченочного клиренса. В случаях подкожного введения у пациентов с СД1 инсулин минует печень, и высокие уровни инсулина поступают через системный кровоток. В результате избыточное количество инсулина связывается с рецепторами IGF-1 яичников и стимулирует выработку андрогенов из тека-клеток и может нарушать фолликулогенез яичников. Продемонстрировано эффективное снижение уровня HbA1c при использовании более низких суточных доз инсулина при применении режима постоянной подкожной инфузии инсулина (ППИИ) [6]. Оптимизация дозы инсулина с помощью ППИИ может быть профилактикой передозировки экзогенного инсулина, которая обуславливает гиперандрогению и формирование мультифолликулярного изменения яичников.
В 90-х гг. ХХ в. с целью имитации физиологической секреции инсулина у больных СД1 была внедрена схема базис-болюсной инсулинотерапии. Внедрение интенсивной инсулинотерапии в качестве стандартного лечения для всех пациентов с СД1 снизило частоту диабетической ретинопатии, нефропатии и полинейропатии (по результатам исследования Diabetes Control and Complications Trial (DCCT/EDIC)). В рамках исследования DCCT/EDIC изучались маркеры овариальной недостаточности у женщин с СД1 репродуктивного возраста. У 30% женщин с СД1 был выявлен синдром поликистозных яичников (СПЯ) и гиперандрогения [7]. В когорте женщин с СД1 было обнаружено повышение уровня антимюллерова гормона (АМГ) у 1/3, что согласуется с наличием у них СПЯ и объясняет причины снижения фертильности.
Для достижения целевых значений гликемии у пациентов с СД1 необходим эффективный и безопасный режим инсулинотерапии. Уже более 40 лет для оптимизации гликемического контроля используется режим ППИИ с помощью инсулиновой помпы. За последние десятилетия значительно улучшились технические возможности ее использования, в инсулиновые дозаторы внедрен калькулятор болюсов, который оптимизирует дозу болюсного инсулина на еду или на коррекцию гипергликемии. Эта функция инсулиновой помпы позволяет получить постпрандиальный профиль глюкозы, близкий к физиологическому. Одной из важных функций инсулиновой помпы является возможность снижения скорости или прекращение подачи инсулина, которая является основным механизмом, имитирующим уменьшение секреции инсулина при понижении уровня глюкозы в крови здорового человека. Гипогликемия является частой причиной патологической вариабельности глюкозы (ВГ). Высказано предположение, что не только гипергликемия, но гипогликемия и ВГ являются предикторами развития оксидативного стресса (ОС) и могут инициировать развитие макро- и микрососудистых осложнений СД [8]. Гипергликемия является одной из основных причин ОС у женщин СД, при которой происходит повышение продукции супероксидного аниона в митохондриях, вызванное увеличением пирувата и образованием никотинамидадениндинуклеотида (НАДН). В результате активируются полиоловый и гексозаминовый пути, последний из которых блокирует пентозофосфатный путь, а также происходит активация протеинкиназы С и накопление конечных продуктов гликирования (КПГ), что, в свою очередь, вызывает повышение уровня активных форм кислорода (АФК) и развитие ОС [9].
В 2019 г. произошло значимое событие в диабетологии, были внедрены новые критерии оценки углеводного обмена, полученные по результатам использования систем непрерывного мониторирования глюкозы (НМГ) [10]. Впервые стал возможен анализ различных характеристик гликемического профиля: ВГ, времени в целевом диапазоне (ВЦД), времени выше диапазона (ВВД), оценка частоты и тяжести гипогликемических состояний. Существует подтверждение, что использование ППИИ одновременно с НМГ снижает частоту гипогликемических состояний и ВГ [11][12]. В настоящее время в научной литературе недостаточно информации о характеристиках гликемического профиля, полученных с помощью НМГ, необходимых для сохранения фертильности у больных СД1 и СД2. В работе Тиселько А.В. и соавт. [13] представлены предварительные результаты о влиянии длительности гипергликемии, субнормального уровня глюкозы и патологической ВГ на состояние антиоксидантной системы у больных с СД1, продемонстрирована отрицательная корреляция времени гипогликемического состояния и количества антральных фолликулов (КАФ), выявлена связь между патологической ВГ и объемом яичника. Данных о воздействии этих вариантов дисгликемии на овариальную функцию в литературе недостаточно.
Представляется важным изучить влияние различных типов гликемического профиля на оксидантную и прооксидантную системы и состояние фолликулярного аппарата женщин с СД1, при использовании различных режимов инсулинотерапии. Полученные данные позволят индивидуализировать выбор вида инсулинотерапии на основании характера гликемического профиля с целью сохранения репродуктивного здоровья женщин с СД.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено одноцентровое проспективное исследование по изучению показателей овариального резерва у женщин с СД1 при различных вариантах дисгликемии, использующих различные режимы интенсивной инсулинотерапии. Обследовано 60 женщин с СД1 репродуктивного возраста (19–38 лет) с длительностью заболевания не менее 5 лет. Проведена оценка состояния углеводного обмена с помощью определения уровня HbA1c. Анализ производился на анализаторе Diastat (США); НМГ с использованием Flesh-мониторинга Libra (first-generation FreeStyle Libre System (Abbott Diabetes Care, Witney, UK). Исследование гликемического профиля в среднем продолжалось 65 [ 28; 84] дней. Оценка результатов НМГ проводилась с помощью новых критериев компенсации углеводного обмена. Показатели НМГ рассчитывались для процента времени ВЦД 3,9–7,8 ммоль/л, ВВД (гипергликемии >7,8 ммоль/л), время ниже целевого диапазона (ВНД) <3,9 ммоль/л. В группе исследования целевой диапазон был выбран 3,9–7,8 ммоль/л, так как женщины репродуктивного возраста уже на этапе планирования беременности должны стремиться к уровню гликемии, соответствующему рекомендациям [14] — на этапе планирования беременности уровень гликемии в диапазоне 3,9–7,8 ммоль/л и уровень HbA1c≤6,5%. Женщины с СД1 были разделены на 2 группы в зависимости от лечения: 1 группа использовала режим множественных инъекций инсулина (МИИ), 2 группа — режим ППИИ. Для оценки влияния различных состояний дисгликемии на показатели ОС, овариального резерва каждая группа была разделена на 2 подгруппы. Пациенты, достигающие целевого диапазона глюкозы ≥70% времени суток (группа удовлетворительного контроля — 1А, использующая МИИ), и группа 2А, использующая ППИИ. В нашем исследовании пациенты, имеющие показатели ВЦД более 25% времени суток и не достигающие 70% времени в целевом диапазоне, были дополнительно разделены на подгруппы ВВД<35% и ВВД>35%, как в группе МИИ — 1Б, так и на ППИИ — группа 2Б. Выбор данного диапазона был обусловлен тем, что в ряде исследований продемонстрировано, что у пациентов с СД1, использующих различные режимы инсулинотерапии, время нахождения ВВД в среднем составляло 30–40% времени суток [15][16]. Необходимо отметить, что 50% пациенток на ППИИ не использовали многие функции инсулиновой помпы (редко или совсем не включали функцию временного базального режима, остановки помпы на гипогликемию); подключали многоволновые болюсы только в 40% случаев. В исследовании применялись инсулиновые помпы Medtronic MiniMed 720G MMT-1859, ММТ-722 Медтроник Парадигм (Medtronic Paradigm PRT) и инсулиновая помпа Accu-Chek Combo (Акку-Чек Комбо) — сопоставимые по функциям и возможностям. В исследовании применялись только аналоги инсулина продленного и ультракороткого действия. Учитывая, что средняя продолжительность СД составила 16,0 [5,0, 30,1] лет, оценивали состояния прооксидантной и антиоксидантной систем: в сыворотке крови определяли уровень малонового диальдегида (МДА), активность каталазы и уровень нитротирозина. Методом твердофазного иммуноферментного анализа с использованием коммерческих тест-систем в сыворотке крови определяли содержание 3-нитротирозина HBT Nitrotyrosine, ELISA (Hycult Biotech, Нидерланды) и уровень растворимого рецептора конечных продуктов гликирования (sRAGE) (Quantikine, R & D Systems, США). Уровень перекисного окисления липидов в сыворотке крови измеряли по интенсивности окрашенного комплекса активных форм тиобарбитуровой кислоты (ТБК), образовавшихся при взаимодействии конечного продукта перекисного окисления липидов — МДА с 2-ТБК при высокой температуре в кислой среде. Количество ТБК-активных продуктов в бутанольной фракции измеряли на длинах волн 535 и 580 нм. Для определения активности каталазы использовался модифицированный метод Гота с раствором молибдата аммония. Он основан на определении количества стойкого окрашенного комплекса, образовавшегося в результате взаимодействия раствора перекиси с раствором молибдата аммония (Вектон, Россия). Максимум поглощения образующегося окрашенного комплекса находится при λ=374 нм. С целью изучения овариального резерва у женщин с СД1 проводилась оценка объема яичников, КАФ, уровня антимюллерова гормона (АМГ) с использованием хемилюминесцентного иммуноферментного метода с использованием парамагнитных частиц (Beckman Coulter (США)). Уровень фолликулостимулирующего гормона (ФСГ) определяли в сыворотке с помощью иммуноферментного метода «Алкор Био» (Россия) для анализатора Alisei (Италия).
Статистический анализ
Нормальность данных проверялась с помощью критерия Шапиро-Уилка. Для множественных сравнений изучаемых показателей применялся непараметрический H-критерий Крускала-Уоллиса. Данные были представлены в виде медианы и квартилей (Me [ Q1; Q3]), а также минимума и максимума. Коэффициент корреляции Спирмена (rs) был использован для выявления силы и направления взаимосвязи между изучаемыми маркерами. Статистический анализ проводили с помощью программы STATISTICA 10.0 (StatSoft, США). Значения p<0,05 считались статистически значимыми.
Этическая экспертиза
Исследование выполнено в соответствии нормам биомедицинской этики и в рамках темы ФНИ «Стратегия сохранения здоровья женщин с гинекологическими и эндокринными заболеваниями в разные возрастные периоды: патогенетическое обоснование медикаментозной реабилитации и разработка новых направлений органосохраняющих оперативных вмешательств» №1021062812154-3-3.2.2, этический комитет №114 от 14.12.2021 при Федеральном государственном бюджетном научном учреждении «Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта»» одобрил исследование по указанной теме. Все пациенты подписали информированное добровольное согласие на участие в исследовании до включения в исследование.
РЕЗУЛЬТАТЫ
В табл. 1 представлена характеристика групп исследования.
Таблица 1. Характеристика групп исследования
|
Параметр |
МИИ (n=30) |
ППИИ (n=30) |
p |
|
|
Возраст, лет |
33,0 [ 30,0; 35,0] |
31,0 [ 28,0; 34,0] |
>0,05 |
|
|
Вес, кг |
60,0 [ 58,0; 67,0] |
62,5 [ 57,0; 69,0] |
>0,05 |
|
|
ИМТ, кг/м² |
22,3 [ 20,4; 24,5] |
22,0 [ 20,8; 25,1] |
>0,05 |
|
|
Длительность сахарного диабета, лет |
15,5 [ 10,5; 23,0] |
18,0 [ 13,0; 20,0] |
>0,05 |
|
|
Суточная доза инсулина, Ед/1 кг веса |
0,51 [ 0,43; 0,65] |
0,56 [ 0,53; 0,63] |
>0,05 |
|
|
Возраст менархе, лет |
13,8 [ 11,0; 15,0] |
12,9 [ 12,0; 14,9] |
>0,05 |
|
|
Нарушение менструального цикла |
олигоменорея, n (%) |
6 (20) |
10 (33) |
>0,05 |
|
аномальные маточные кровотечения, n (%) |
10 (33) |
8 (27) |
>0,05 |
|
|
Частота диабетической ретинопатии |
непролиферативная, n (%) |
15 (50) |
16 (53) |
>0,05 |
|
пролиферативная, n (%) |
2 (7) |
4 (13) |
>0,05 |
|
|
Частота диабетической нефропатии |
ХБП С1-С2, А1, n (%) |
12 (40) |
12 (40) |
>0,05 |
|
ХБП С2-С3, А2-А3, n (%) |
1 (3) |
2 (7) |
>0,05 |
|
|
Частота диабетической нейропатии |
дистальная форма, n (%) |
14 (47) |
24 (80) |
<0,01 |
|
автономная нейропатия, n (%) |
2 (7) 1 пациентка — нарушение распознавания гипогликемий |
3 (10) 2 пациентки — нарушение распознавания гипогликемий |
>0,05 |
|
Примечание: ИМТ — индекс массы тела; МИИ — множественные инъекции инсулина; ППИИ — постоянная подкожная инфузия инсулина; ХБП — хроническая болезнь почек.
Длительность нахождения в целевом диапазоне в группах 1А (на МИИ) и в группе 2А (на ППИИ) значимо не отличалась и составила 74,0 [ 70,0; 81,0]% и 68,0 [ 64,0; 77,0]% времени суток соответственно, p>0,15. Отличий длительности гипогликемического состояния в группе 1А и в группе 2А также не выявлено: 3,0 [ 1,0; 8,0] и 3,0 [ 1,0; 6,0]% времени суток, p>0,9. В подгруппе женщин с СД1, использующих МИИ (1Б), показатель ВВД составил: 82,0 [ 57,0; 90,0]% времени суток, в группе использующих ППИИ (2Б) — 52,5 [ 42,0;76,0]% (p<0,01). Уровень глюкозы в целевом диапазоне в подгруппе 1Б (МИИ) был 16,0 [ 10,0; 37,0]% времени суток, в подгруппе 2Б (ППИИ) — 40,0 [ 23,0; 53,0]%, p<0,05. С целью изучения влияния ОС на состояние овариального резерва женщин с СД1 проведен анализ показателей одного из наиболее информативных маркеров ОС — нитротирозина. Уровень нитротирозина не отличался в группе женщин, использующих МИИ (гипергликемия у которых не превышала более 35% времени суток), и составил 49,6 [ 16,5; 102,40] нмоль/л, у женщин на ППИИ — 38,2 [ 6,4; 59,9] нмоль/л. В группе женщин с хронической гипергликемией, превышающей 35% времени суток, группа 1Б, этот показатель составил 161,4 [ 110,6; 232,1] нмоль/л и был значительно выше, чем в группе ППИИ (2Б) 42,4 [ 19,1; 64,9] нмоль/л, p<0,01 (рис. 1а). Различия в уровне продуктов перекисного окисления липидов — МДА между женщинами, использующими МИИ и ППИИ, установлены исключительно в отношении группы с ВВД<35% (рис. 1б). Зависимости изменения активности каталазы и уровня sRAGE от используемого режима инсулинотерапии обнаружено не было (рис. 1в, г), однако показана их корреляционная зависимость в группе 2А (rs=0,857; p<0,05). В данной группе уровень sRAGE положительно коррелировал с уровнем HbA1c (rs=0,821; p<0,05) и отрицательно — с объемом яичника (rs=-0,785; p<0,05). В группе МИИ показана положительная корреляция sRAGE с HbA1с (rs=0,701; p<0,05). Среди всей выборки уровень sRAGE положительно коррелировал с процентом времени нахождения выше целевого диапазона (rs=0,431; p<0,05) и, соответственно, отрицательно — с длительностью нахождения в целевом диапазоне (rs=-0,424; p<0,05).
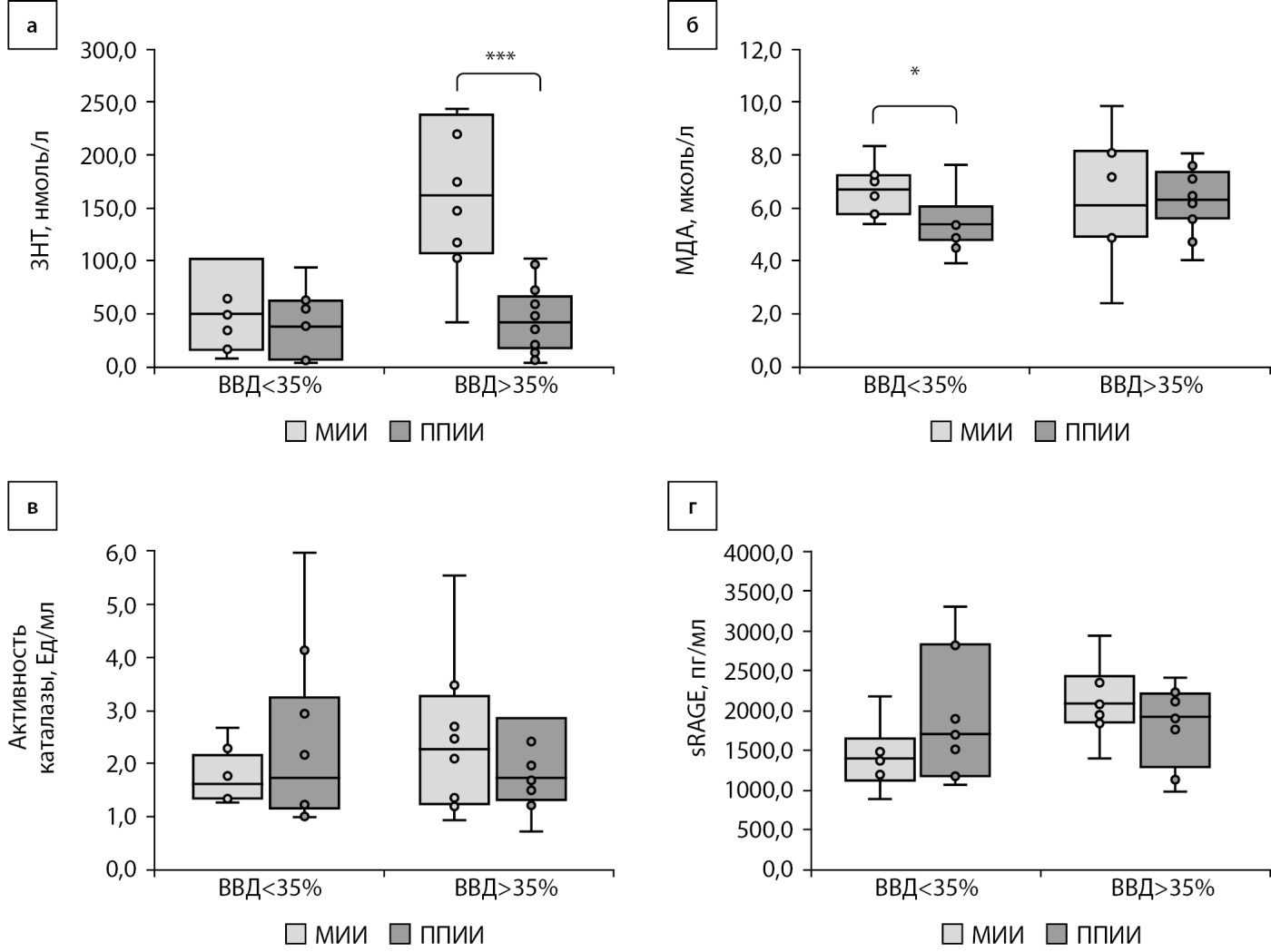
Рисунок 1. Содержание нитротирозина, малонового деальдегида, активности каталазы и уровня растворимого рецептора конечных продуктов гликирования у больных с сахарным диабетом 1 типа, использующих режимы множественных инъекций инсулина и постоянной подкожной инфузии инсулина, не имеющих превышение целевого диапазона гликемии более 35% и превышающих уровень целевой гликемии более 35%.
Примечание: sRAGE — растворимый рецептор конечных продуктов гликирования; 3НТ — 3-нитротирозин; ВВД — время выше целевого диапазона; МДА — малоновый диальдегид; МИИ — множественные инъекции инсулина; ППИИ — постоянная подкожная инфузия инсулина.
Длительность ВНД в группах неудовлетворительного контроля (1Б и 2Б) значимо не отличалась и составила 0,0 [ 0,0; 2,0]% и 1,5 [ 0,0; 5,0]% времени суток соответственно (p>0,05) (рис. 2а).
Уровень HbA1c был сопоставим у женщин с СД1, использующих МИИ и ППИИ, не превышающих длительность нахождения выше целевого диапазона более 35%, и был выше у женщин, использующих МИИ, в группе ВВД более 35% (рис. 2в).
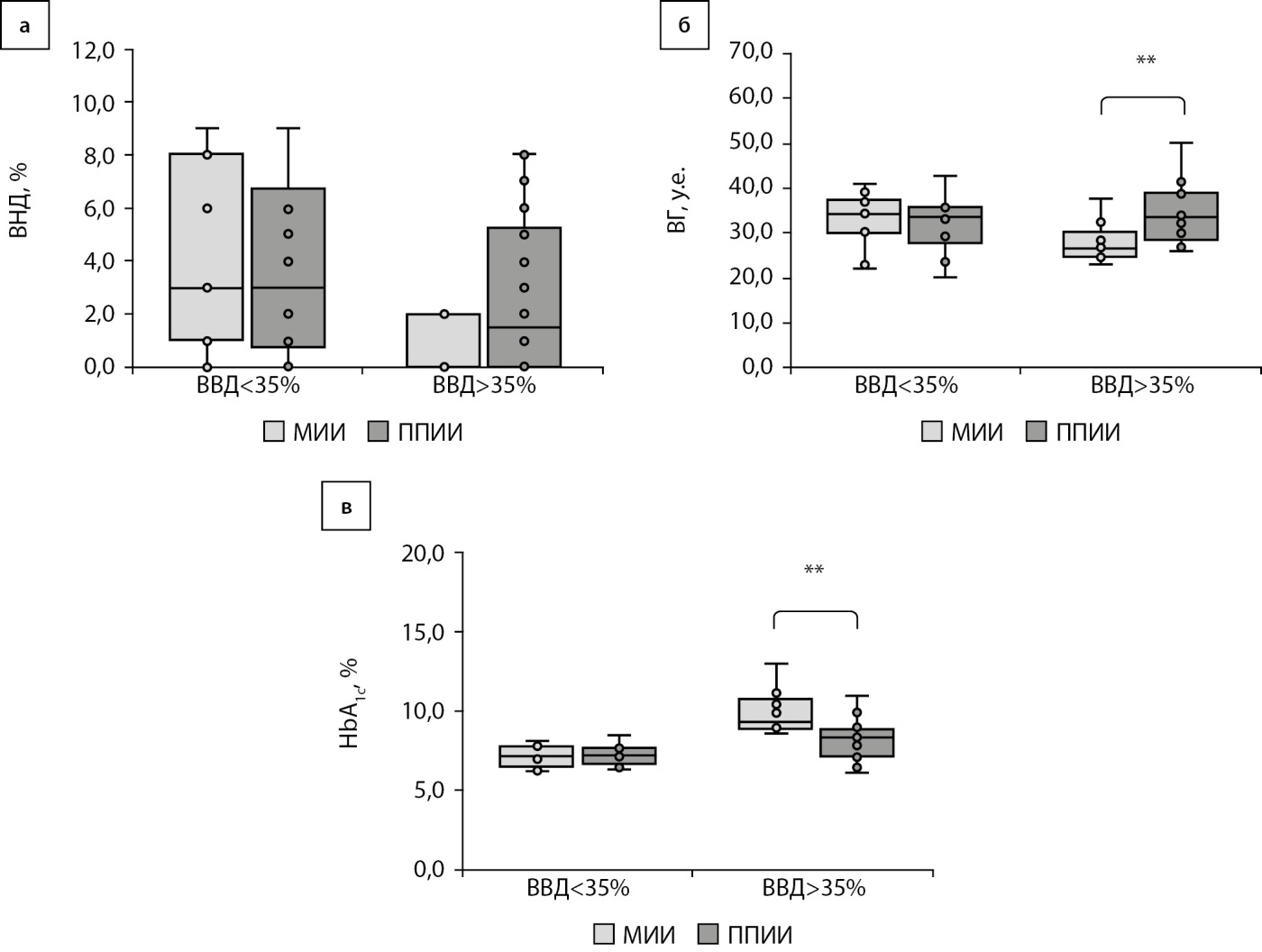
Рисунок 2. Показатели (а) длительности времени ниже целевого диапазона, (б) вариабельности гликемии (CV%) и (в) уровня гликированного гемоглобина у женщин, использующих режимы множественных инъекций инсулина и постоянной подкожной инфузии инсулина, не имеющих превышение целевого диапазона гликемии более 35% и превышающих данный уровень целевой гликемии более 35% времени.
Примечание: ВГ — вариабельность гликемии; HbA1c — гликированный гемоглобин; ВВД — время выше целевого диапазона; ВНД — время ниже целевого диапазона; МИИ — множественные инъекции инсулина; ППИИ — постоянная подкожная инфузия инсулина.
ВГ является одним из предикторов развития сосудистых осложнений СД. В группе женщин удовлетворительного контроля 1А и 2А показатель ВГ в группе МИИ составил 34,3 [ 30,1; 37,3]%, в группе ППИИ — 33,5 [ 29,2; 35,7]%. В подгруппах с преобладанием гипергликемии 1Б и 2Б показатель ВГ у женщин, использующих МИИ, был 26,6 [ 25,0; 28,4], в группе женщин на ППИИ — 33,5 [ 28,4; 38,8] (рис. 2б). Тенденция к изменению КАФ была выявлена при превышении целевого диапазона (уровня глюкозы выше 7,8 ммоль/л) более 35% времени суток. Уровень ФСГ в группах, использующих МИИ и ППИИ, соответствовал референсному интервалу, отличий данного показателя в группах сравнения не было. Уровень АМГ имел тенденцию к повышению в группе женщин, использующих ППИИ, особенно в группе с ВВД>35% (p<0,05), но не превышал референсного интервала в обеих группах (рис. 3а). КАФ при неудовлетворительном контроле составило в группе 1Б — 8,0 [ 6,0; 8,0], в группе 2Б — 12,0 [ 11; 12,0], p<0,01. Объем яичника в группе 1Б был 6,0 [ 5,4; 7,5] см³ в группе 2Б — 9,4 [ 6,5; 10,8], p<0,05 (рис. 3 б, в).
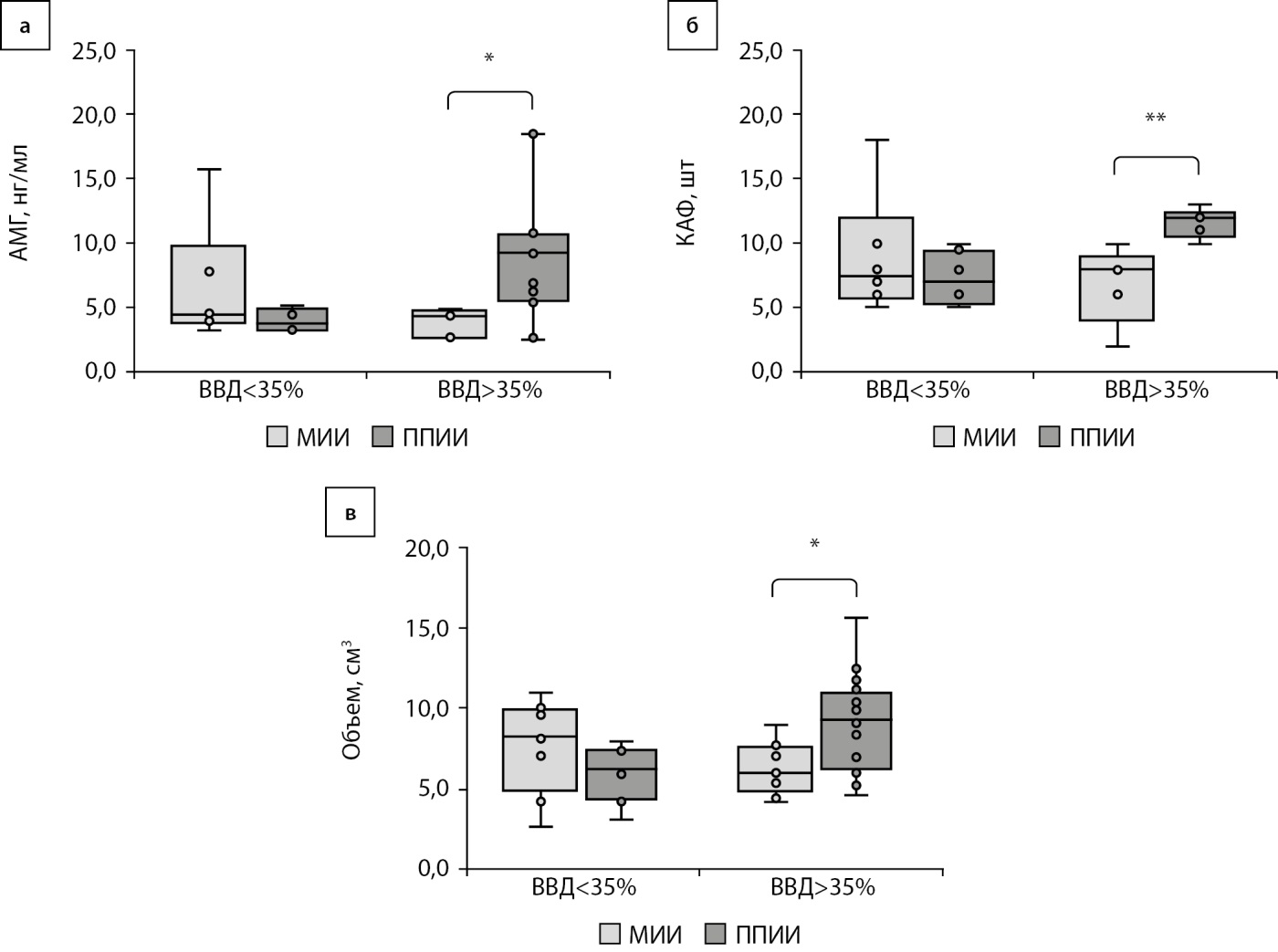
Рисунок 3. Показатели антимюллерова гормона, количества антральных фолликулов, объем яичников у женщин с сахарным диабетом 1 типа при времени выше целевого диапазона более или менее 35%.
Примечание: АМГ — антимюллеров гормон; ВВД — время выше целевого диапазона; КАФ — количество антральных фолликулов; МИИ — множественные инъекции инсулина; ППИИ — постоянная подкожная инфузия инсулина.
Доза инсулина/кг веса не отличалась в группе МИИ и в группе ППИИ 0,50 [ 0,27; 0,92] соответственно (p>0,18). Обращает на себя внимание тот факт, что в группе женщин, использующих МИИ, доза инсулина была явно недостаточной, так как уровень HbA1c в группах женщин неудовлетворительного контроля составил 9,3 [ 8,9;10,4]%, в группе ППИИ 8,3 [ 7,2; 8,8]%.
ОБСУЖДЕНИЕ
Несмотря на заметные достижения диабетологии, СД1 остается заболеванием, определяющим высокую частоту нарушений менструального цикла, бесплодия и неблагоприятных исходов беременности и родов. Внедрение в клиническую практику метода НМГ позволило получить большое количество данных об особенностях гликемического профиля. Работ, посвященных изучению влияния различных паттернов дисгликемии, использования различных режимов инсулинотерапии и их влияния на состояние овариального резерва у женщин с СД1 в литературе недостаточно, что и послужило основанием для проведения представленного исследования. Уровень АМГ у женщин с СД1 коррелирует с количеством фолликулов и может быть использован в качестве показателя овариального резерва и фертильности у женщин с СД1, что было подтверждено в отчете рабочей группы EDIC Research Group (Ovarian reserve in women with type 1 diabetes in the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study) [17]. Оптимизация дозы инсулина у пациентов с СД1 имеет большое значение, так как инсулин является одним из стимуляторов секреции ГнРГ [2].
Использование интенсивных схем базис-болюсной инсулинотерапии, постоянной подкожной инфузии инсулина в течение последних десятилетий улучшило гликемический контроль у пациентов с СД, снизило частоту гипогликемических событий и привело к положительному влиянию на возраст наступления менархе у девушек с СД1. В исследовании Mochizuki M. и соавт. [18] уровни HbA1c были ниже — 8,0%, у пациенток, использующих ППИИ, по сравнению с группой, использующей МИИ (9,3%), повышение HbA1c на 1% увеличивало продолжительность менструального цикла на 5,1 дня, изменчивость цикла была связана с более высокой суточной дозой инсулина. В нашем исследовании уровень HbA1c был также ниже в группе женщин, использующих режим ППИИ. Известно, что в случаях подкожного введения экзогенного инсулина у пациентов с СД1 он становится избыточным, попадая в системный кровоток, и стимулирует выработку андрогенов из клеток теки в период созревания гипоталамо-гипофизарно-яичниковой оси [2]. Снижение уровня портального инсулина может привести к более низким уровням глобулина, связывающего половые гормоны. В литературе отсутствуют сравнительный анализ различных показателей функционирования гипоталамо-гипофизарной-яичниковой оси у женщин, использующих различные режимы инсулинотерапии.
В настоящее время определены критерии компенсации углеводного обмена для пациенток различных возрастных групп и группы беременных женщин с целью профилактики осложнений. В нашей работе проведен анализ длительности гипергликемического состояния по результатам НМГ и представлены данные об изменении показателей ОС, овариального резерва при уровне глюкозы >7,8 ммоль/л ВВД более чем в 35% времени суток. Худшие показатели были отмечены в подгруппе женщин, использующих режим МИИ. Zaimi M. и соавт. указали, что хроническая гипергликемия оказывает глюкозотоксичный эффект на гипоталамические нейроны ГнРГ и может являться еще одним вероятным механизмом развития овариальной недостаточности [2]. Эти данные согласуются с результатами нашего предыдущего исследования, которые продемонстрировали, что длительная гипергликемия выше целевого диапазона ассоциирована с повышением маркеров оксидативного стресса и тенденцией к увеличению антральных фолликулов и объема яичника [13]. Уровни sRAGE, которые повышены у пациентов с СД1, могут действовать как ловушки, захватывать воспалительные лиганды RAGE внеклеточно и защищать клетки от повреждения, вызванного повышением КПГ, скорость образования которых стремительно увеличивается при гипергликемии и может привести к развитию ОС [19]. Известно, что повышение АФК, вызванное гипергликемией, усиливает экспрессию и активность матриксных металлопротеиназ, приводящих к повышению уровня sRAGE [20], что согласуется с полученной в данном исследовании положительной корреляцией между количеством sRAGE, временем нахождения выше целевого диапазона и уровнем HbA1c. Более эффективное применение ППИИ для снижения длительности ВВД подтверждается наличием у данных пациенток положительной корреляции между уровнем sRAGE и активностью каталазы. Инсулинотерапия не только увеличивает экспрессию RAGE, но и стимулирует отделение sRAGE от мембраносвязанных рецепторов. В связи с этим более длительное течение заболевания и, соответственно, использование инсулина, может способствовать повышению уровня sRAGE [21]. Сопоставимые показатели длительности диабета и дозы инсулина в группах МИИ и ППИИ, предположительно, являются причиной отсутствия изменения уровня sRAGE в проведенном нами исследовании. С появлением НМГ в клинической практике оценка ВГ стала не только возможной, но и необходимой. В обзоре Zhou Z. и соавт. представлен обширный перечень неблагоприятных клинических исходов патологической вариабельности глюкозы, но данные о влиянии ВГ на овариальную функцию не представлены [22]. В настоящее время рекомендованный показатель ВГ не должен превышать 36%, но определен он только для диапазона гликемии 3,9–10 ммоль/л. В проведенном исследовании, как в группах удовлетворительного, так и неудовлетворительного контроля, показатель ВГ превышал уровень физиологических значений, тогда как диапазон гликемии, рекомендованный женщинам с СД1 на этапе планирования беременности 3,9–7,8 ммоль, практически соответствует уровню здорового человека. Значение ВГ у людей без диабета составляет 20% по результатам исследования этого показателя Климонтовым В.В. и соавт. [23].
ЗАКЛЮЧЕНИЕ
В проведенной работе получены предварительные данные о влиянии гипергликемии, превышающей уровень 7,8 ммоль/л более чем в 35% времени суток на показатели маркеров ОС у женщин, использующих режим МИИ. Продемонстрирована тенденция к увеличению КАФ при уровне ВГ более 33,5 [ 28,4; 38,8]% у женщин при неудовлетворительном контроле, использующих режим ППИИ. При анализе возможностей инсулиновой помпы обращает на себя внимание тот факт, что пациенты на ППИИ достигали более значимого снижения HbA1c по сравнению с МИИ, что сопровождалось уменьшением продуктов окислительной модификации липидов и белков, но недостаточно использовали режимы временной базальной скорости и остановки инсулиновой помпы (только 25% пациентов) с целью предотвращения гипогликемических состояний и патологической ВГ. Для достижения целевой гликемии у пациентов с СД1, использующих режим ППИИ, необходимо обучение в режиме реального времени с целью использования всех функций инсулиновой помпы. В группах удовлетворительного контроля, как при использовании режима МИИ, так и при использовании режима ППИИ, отличий показателей АМГ, КАФ, объема яичника, ФСГ обнаружено не было. С целью выявления предикторов нарушения в гипоталамо-гипофизарно-яичниковой оси у женщин с СД1, использующих различные режимы инсулинотерапии, необходимы дальнейшие исследования.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена на основе поисковой темы ФНИ 2022-2024: Стратегия сохранения здоровья женщин с гинекологическими и эндокринными заболеваниями в разные возрастные периоды: патогенетическое обоснование медикаментозной реабилитации и разработка новых направлений органосохраняющих оперативных вмешательств ФНИ № 1021062812154-3-3.2.2.
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи.
Участие авторов: Тиселько А.В. — концепция, сбор материала, анализ результатов, написание текста статьи; Мишарина Е.В. — сбор и обработка материала, написание текста статьи; Ярмолинская М.И. — концепция и дизайн исследования; Милютина Ю.П. — сбор и обработка материала, оценка маркеров оксидативного стресса, написание текста статьи; Залозняя И.В. — сбор материала, обработка материала, Кореневский А.В. — анализ результатов, рецензирование.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Healthdata.org [internet]. Global Burden of Disease Collaborative Network. Global Burden of Disease Study 2019. Results. Institute for Health Metrics and Evaluation. 2020 [cited 2024 Sept 16]. Available from: https://vizhub.healthdata.org/gbd-results/
2. Zaimi M, Michalopoulou O, Stefanaki K, et al. Gonadal dysfunction in women with diabetes mellitus. Endocrine. 2024;85(2):461-472. doi: https://doi.org/10.1007/s12020-024-03729-z
3. Мишарина Е.В., Ярмолинская М.И., Тиселько А.В. Cахарный диабет 1-го типа; овариальный резерв; антимюллеров гормон; овариальная функция // Журнал акушерства и женских болезней. - 2024. - Т. 73. - №4. - C. 31-42. doi: https://doi.org/10.17816/JOWD631790
4. Мишарина Е.В., Осиновская Н.С., Ярмолинская М.И. Значение полиморфных вариантов гена кисспептина в патогенезе недостаточности яичников у пациенток с сахарным диабетом 1-го типа, наружным генитальным эндометриозом и при их сочетании // Журнал акушерства и женских болезней. — 2023. — Т. 72. — №4. — C. 25-36. doi: https://doi.org/10.17816/JOWD346690
5. Gaete X, Vivanco M, Eyzaguirre FC, et al. Menstrual cycle irregularities and their relationship with HbA1c and insulin dose in adolescents with type 1 diabetes mellitus. Fertil Steril. 2010;94(5):1822-1826. doi: https://doi.org/10.1016/j.fertnstert.2009.08.039
6. Farrar D, Tuffnell DJ, West J, West HM. Continuous subcutaneous insulin infusion versus multiple daily injections of insulin for pregnant women with diabetes. Cochrane Database Syst Rev. 2016;2016(6):CD005542. doi: https://doi.org/10.1002/14651858.CD005542.pub3
7. Escobar-Morreale HF, Roldán-Martín MB. Type 1 Diabetes and Polycystic Ovary Syndrome: Systematic Review and Meta-analysis. Diabetes Care. 2016;39(4):639-648. doi: https://doi.org/10.2337/dc15-2577
8. Šoupal J, Škrha J Jr, Fajmon M, et al. Glycemic variability is higher in type 1 diabetes patients with microvascular complications irrespective of glycemic control. Diabetes Technol Ther. 2014;16(4):198-203. doi: https://doi.org/10.1089/dia.2013.0205
9. Yan LJ. Redox imbalance stress in diabetes mellitus: Role of the polyol pathway. Animal Model Exp Med. 2018;1(1):7-13. doi: https://doi.org/10.1002/ame2.12001
10. Battelino T, Danne T, Bergenstal RM, et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care. 2019;42(8):1593-1603. doi: https://doi.org/10.2337/dci19-0028
11. Keyu G, Jiaqi L, Liyin Z, et al. Comparing the effectiveness of continuous subcutaneous insulin infusion with multiple daily insulin injection for patients with type 1 diabetes mellitus evaluated by retrospective continuous glucose monitoring: A real-world data analysis. Front Public Health. 2022;10:990281. doi: https://doi.org/10.3389/fpubh.2022.990281
12. Rimon MTI, Hasan MW, Hassan MF, Cesmeci S. Advancements in Insulin Pumps: A Comprehensive Exploration of Insulin Pump Systems, Technologies, and Future Directions. Pharmaceutics. 2024;16(7):944. doi: https://doi.org/10.3390/pharmaceutics16070944
13. Tiselko AV, Misharina EV, Yarmolinskaya MI, et al. Evaluation of folliculogenesis and oxidative stress parameters in type 1 diabetes mellitus women with different glycemic profiles. Endocrine. 2024;85(3):1131-1140. doi: https://doi.org/10.1007/s12020-024-03805-4
14. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск. // Сахарный диабет. — 2023. — Т. 26. — №2S. — С. 1-157. doi: https://doi.org/10.14341/DM13042
15. Laffel LM, Kanapka LG, Beck RW, et al. Effect of Continuous Glucose Monitoring on Glycemic Control in Adolescents and Young Adults With Type 1 Diabetes: A Randomized Clinical Trial. JAMA. 2020;323(23):2388-2396. doi: https://doi.org/10.1001/jama.2020.6940
16. Miller KM, Bauza C, Kanapka LG, et al. Continuous Glucose Monitoring Provides Durable Glycemic Benefit in Adolescents and Young Adults with Type 1 Diabetes: 12-Month Follow-Up Results. Pediatr Diabetes. 2023;2023:6718115. doi: https://doi.org/10.1155/2023/6718115
17. Kim C, Dunn RL, Braffett B, et al. Ovarian reserve in women with Type 1 diabetes in the Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications Study. Diabet Med. 2016;33(5):691-692. doi: https://doi.org/10.1111/dme.13072
18. Mochizuki M, Kikuchi T, Urakami T, et al. Improvement in glycemic control through changes in insulin regimens: findings from a Japanese cohort of children and adolescents with type 1 diabetes. Pediatr Diabetes. 2017;18(6):435-442. doi: https://doi.org/10.1111/pedi.12409
19. Chen Q, Liu L, Ke W, et al. Association between the soluble receptor for advanced glycation end products and diabetes mellitus: systematic review and meta-analysis. BMC Endocr Disord. 2024;24(1):232. doi: https://doi.org/10.1186/s12902-024-01759-2
20. Prasad K. Low levels of serum soluble receptors for advanced glycation end products, biomarkers for disease state: myth or reality. Int J Angiol. 2014;23(1):11-16. doi: https://doi.org/10.1055/s-0033-1363423
21. Lam JK, Wang Y, Shiu SW, et al. Effect of insulin on the soluble receptor for advanced glycation end products (RAGE). Diabet Med. 2013;30(6):702-709. doi: https://doi.org/10.1111/dme.12166
22. Zhou Z, Sun B, Huang S, et al. Glycemic variability: adverse clinical outcomes and how to improve it?. Cardiovasc Diabetol. 2020;19(1):102. doi: https://doi.org/10.1186/s12933-020-01085-6
23. Климонтов, В.В. Вариабельность гликемии при сахарном диабете / В.В. Климонтов, Н.Е. Мякина. – 2-е изд-е, испр. и доп. – Новосибирск: Новосибирский национальный исследовательский государственный университет, 2018.
Об авторах
А. В. ТиселькоРоссия
Тиселько Алена Викторовна - д.м.н., в.н.с.
199034, Санкт-Петербург, Менделеевская линия, д. 3
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи
Е. В. Мишарина
Россия
Мишарина Елена Владимировна - к.м.н., с.н.с.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи
М. И. Ярмолинская
Россия
Ярмолинская Мария Игоревна - д.м.н., профессор.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи
Ю. П. Милютина
Россия
Милютина Юлия Павловна - к.б.н., с.н.с.; ResearcherID: AAE-6182-2019; Scopus Author ID: 24824836300; eLibrary SPIN: 6449-5635.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи
И. В. Залозняя
Россия
Залозняя Ирина Владимировна - к.б.н., с.н.с.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи
А. В. Кореневский
Россия
Кореневский Андрей Валентинович - д.б.н., в.н.с.; ResearcherID: K-3444-2013; Scopus Author ID: 16037015200; eLibrary SPIN: 7942-6016.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие конфликта интересов, связанного с публикацией статьи
Дополнительные файлы
|
|
1. Рисунок 1. Содержание нитротирозина, малонового деальдегида, активности каталазы и уровня растворимого рецептора конечных продуктов гликирования у больных с сахарным диабетом 1 типа, использующих режимы множественных инъекций инсулина и постоянной подкожной инфузии инсулина, не имеющих превышение целевого диапазона гликемии более 35% и превышающих уровень целевой гликемии более 35%. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(500KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Показатели (а) длительности времени ниже целевого диапазона, (б) вариабельности гликемии (CV%) и (в) уровня гликированного гемоглобина у женщин, использующих режимы множественных инъекций инсулина и постоянной подкожной инфузии инсулина, не имеющих превышение целевого диапазона гликемии более 35% и превышающих данный уровень целевой гликемии более 35% времени. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(221KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Показатели антимюллерова гормона, количества антральных фолликулов, объем яичников у женщин с сахарным диабетом 1 типа при времени выше целевого диапазона более или ¬менее 35%. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(388KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Тиселько А.В., Мишарина Е.В., Ярмолинская М.И., Милютина Ю.П., Залозняя И.В., Кореневский А.В. Показатели овариального резерва, оксидативного стресса, гликемического профиля у женщин с сахарным диабетом 1 типа, использующих различные режимы инсулинотерапии. Сахарный диабет. 2025;28(4):323-331. https://doi.org/10.14341/DM13265
For citation:
Tiselko A.V., Misharina E.V., Yarmolinskaya M.I., Milyutina Yu.P., Zalozniaia I.V., Korenevsky A.V. Ovarian reserve, oxidative stress and glycemic profile parameters in women with type 1 diabetes mellitus using different insulin therapy regimens. Diabetes mellitus. 2025;28(4):323-331. (In Russ.) https://doi.org/10.14341/DM13265

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































