Перейти к:
Сравнительное исследование нейропротективных свойств ингибиторов натрий-глюкозного котранспортера-2 и агонистов рецепторов глюкагоноподобного пептида-1 у пациентов с сахарным диабетом 2 типа
https://doi.org/10.14341/DM13255
Аннотация
ОБОСНОВАНИЕ. Хроническая недостаточность мозгового кровообращения (ХНМК) — частое осложнение сахарного диабета 2 типа (СД2), приводящее к развитию когнитивной дисфункции и деменции. Несмотря на наличие данных о способности агонистов рецепторов глюкагоноподобного пептида-1 (арГПП-1) и ингибиторов натрий-глюкозного котранспортера (иНГЛТ-2) снижать риск инсульта при СД2, их влияние на ХНМК изучено недостаточно.
ЦЕЛЬ. Оценить и сопоставить влияние иНГЛТ-2 различной селективности и арГПП-1 на биохимические и функциональные параметры повреждения центральной нервной системы (ЦНС) у пациентов с СД2.
МАТЕРИАЛЫ И МЕТОДЫ. Пациенты с СД2 с целевым уровнем гликированного гемоглобина (HbA1c) на монотерапии метформином были включены в группу «МЕТ» (n=43), с нецелевым HbA1c были разделены на группы: «МЕТ+ЭМПА», n=47 (терапия эмпаглифлозином), «МЕТ+КАНА», n=41 (терапия канаглифлозином), «МЕТ+арГПП-1», n=66 (терапия инъекционными арГПП-1). Группу «Контроль» (n=23) составили здоровые добровольцы. В группах «Контроль» и «МЕТ» исходно, а в группах «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1» также через 3 и 6 мес. определялся уровень нейрон-специфической енолазы (НСЕ), легких цепей нейрофиламента (ЛЦН) в сыворотке крови и оценивался когнитивный статус.
РЕЗУЛЬТАТЫ. Уровень НСЕ был выше у всех пациентов с СД2, чем в контрольной группе. Терапия арГПП-1 не привела к снижению НСЕ. Концентрация НСЕ значимо снизилась в группе «МЕТ+ЭМПА» через 3 мес., в группе «МЕТ+КАНА» — через 6 мес. Уровень ЛЦН был повышен у пациентов с нецелевым HbA1c по сравнению с группой «Контроль». Оба иНГЛТ-2 вызвали более выраженное снижение ЛЦН, чем арГПП-1 через 3 мес., через 6 мес. концентрация ЛЦН во всех группах терапии не отличалась от группы «Контроль». Исходно все пациенты с СД2 имели нарушение когнитивной функции по валидизированным международным шкалам (Монреальская шкала когнитивной оценки (MOCA), Краткая шкала оценки психического статуса (MMSE)). Терапия эмпаглифлозином вызвала улучшение, но не нормализацию когнитивного статуса по шкале МОСА. Терапия канаглифлозином привела к нормализации когнитивной функции уже через 3 мес. терапии и удержанию эффекта. Применение арГПП-1 было ассоциировано с нормализацией ментальной функции через 6 мес. терапии. Во всех группах был достигнут удовлетворительный контроль гликемии.
ЗАКЛЮЧЕНИЕ. СД2 характеризуется повреждением ЦНС даже при удовлетворительном контроле гликемии. арГПП-1 и иНГЛТ-2 обладают защитным эффектом в условиях ХНМК при СД2, протективный потенциал низкоселективного канаглифлозина, вероятно, является более выраженным, так как проявляется в улучшении биохимических и функциональных параметров. Нейротропный эффект арГПП-1 и иНГЛТ-2 обусловлен не только их влиянием на гликемический профиль.
Ключевые слова
Для цитирования:
Мурашева А.B., Каронова Т.Л., Фукс О.С., Тимкина Н.В., Федотова А.Д., Гринева Е.Н., Шляхто Е.В. Сравнительное исследование нейропротективных свойств ингибиторов натрий-глюкозного котранспортера-2 и агонистов рецепторов глюкагоноподобного пептида-1 у пациентов с сахарным диабетом 2 типа. Сахарный диабет. 2025;28(2):187-197. https://doi.org/10.14341/DM13255
For citation:
Murasheva A.V., Karonova T.L., Fuks O.S., Timkina N.V., Fedotova A.D., Grineva E.N., Shlyakhto E.V. Comparative evaluation of SGLT-2i and GLP-1RA neuroprotective properties in type 2 diabetic patients. Diabetes mellitus. 2025;28(2):187-197. (In Russ.) https://doi.org/10.14341/DM13255
ОБОСНОВАНИЕ
Сахарный диабет 2 типа (СД2) остается одним из наиболее распространенных и значимых с социально-экономической точки зрения заболеваний. Это связано прежде всего с тем, что выявление СД2 в настоящее время приходится на активный и трудоспособный возраст (45–46 лет) [1]. В структуре смертности пациентов с СД2, согласно базе данных клинико-эпидемиологического мониторинга СД на территории РФ 2023 года, одну из ведущих позиций продолжает занимать острое нарушение мозгового кровообращения, составляя около 10% причин смерти больных [2]. Хорошо известно, что инсульт при СД2 характеризуется тяжелым течением, высокой степенью инвалидизации и большой частотой летальных исходов [3].
Помимо того, что СД2 является независимым фактором риска развития инсульта, хроническая недостаточность мозгового кровообращения (ХНМК) также встречается с высокой частотой у данной когорты пациентов [4]. В основе патогенеза ХНМК лежит повреждение головного мозга по типу лакунарных инсультов и, реже, микрогеморрагий, которые, не вызывая очаговой или общемозговой симптоматики, приводят к нарушению когнитивного статуса, прогрессирующего вплоть до развития деменции или изменений, подобных таковым при болезни Альцгеймера [5]. Методы нейровизуализации позволяют обнаружить участки гиперинтенсивности белого вещества, церебральной атрофии и уменьшение объема серого вещества, а также собственно очаги ишемических лакунарных инсультов.
Современные российские и зарубежные клинические рекомендации отдают предпочтение сахароснижающим лекарственным средствам с доказанным протективным потенциалом — прежде всего, в отношении сердечно-сосудистой системы и почек [6][7]. Двумя приоритетными классами препаратов с кардио- и нефропротективными свойствами признаны ингибиторы натрий-глюкозного котранспортера-2 (иНГЛТ-2) и агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1) [8]. Однако их влияние на центральную нервную систему (ЦНС) остается предметом изучения. По данным рандомизированных клинических исследований, только два представителя арГПП-1 способны снижать риск ишемического инсульта [9]. В то же время накапливаются сведения о позитивном влиянии иНГЛТ-2 на течение фибрилляции предсердий, а следовательно, об их возможности снижать риск кардиоэмболического инсульта [10]. При этом данные о способности арГПП-1 и/или иНГЛТ 2 типа улучшать течение ХНМК у пациентов с СД2 крайне немногочисленны. Нами не были обнаружены российские или зарубежные исследования, направленные на прямое сравнение нейропротективного потенциала иНГЛТ-2 и арГПП-1 в условиях ХНМК при СД2.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить и сопоставить влияние иНГЛТ-2 различной селективности и арГПП-1 на биохимические и функциональные параметры повреждения ЦНС у пациентов с СД2.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Исследование выполнено на базе НМИЦ им. В.А. Алмазова.
Время исследования. Включение пациентов в исследование и проспективное наблюдение за ними продолжалось с июля 2022 по июнь 2024 гг.
Изучаемые популяции
В исследование были включены мужчины и женщины 40–75 лет с СД2 на монотерапии метформином. Пациенты, имевшие целевой уровень гликированного гемоглобина (HbA1c), в соответствии с Алгоритмами специализированной медицинской помощи больным сахарным диабетом [6], были включены в группу «МЕТ» — у них метформин был продолжен последующие 6 мес. Если HbA1c превышал целевой уровень не более, чем на 2,5%, то терапия была усилена одним из препаратов: эмпаглифлозином (группа «МЕТ+ЭМПА»), канаглифлозином («МЕТ+КАНА») или одним из арГПП-1: лираглутидом, инъекционной формой семаглутида или дулаглутидом («МЕТ+арГПП-1»). Соответствующая терапия продолжалась 6 мес.
Критерии включения:
- возраст 40–75 лет;
- монотерапия МЕТ не менее 3 мес. до включения в исследование;
- стабильная эффективная антигипертензивная, гиполипидемическая и другая сопутствующая терапия не менее 3 мес. до включения в исследование.
Основные критерии невключения:
- доказанные несосудистые причины когнитивных расстройств;
- хроническая болезнь почек 4 стадии и выше;
- уровень АЛТ, АСТ в крови в 3 и более раз выше верхней границы нормы, уровень билирубина в 2 и более раз выше верхней границы нормы;
- хроническая сердечная недостаточность III и IV функционального класса;
- фибрилляция предсердий;
- острое нарушение мозгового кровообращения в анамнезе;
- злокачественные новообразования;
- гастропарез любой этиологии;
- инфекция мочевыводящих путей;
- острый панкреатит в анамнезе или наличие верифицированного хронического панкреатита.
Участие пациентов в исследовании прекращалось при развитии некупируемых нежелательных эффектов исследуемых препаратов (непереносимости), основные из которых рвота на фоне терапии арГПП-1, мочевые инфекции на фоне терапии иНГЛТ-2.
Дополнительно была создана группа здорового контроля («Контроль») — мужчины и женщины 40–75 лет без СД2, с неотягощенным сердечно-сосудистым анамнезом и не имеющие других значимых патологий.
Способ формирования выборки из изучаемой популяции
Выборка формировалась путем распределения больных в группы терапевтического вмешательства.
Дизайн исследования
Исследование представляло собой проспективное сравнительное интервенционное исследование.
В группах «Контроль» и «МЕТ» однократно, а в группах «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1» исходно, через 3 мес. и 6 мес. выполнялись следующие исследования:
- сбор и анализ жалоб и данных анамнеза, осмотр, оценка антропометрических параметров;
- анализ крови на HbA1c;
- анализ крови на маркеры нейронального повреждения: нейрон-специфическую енолазу (НСЕ), легкие цепи нейрофиламента (ЛЦН);
- исследование когнитивного статуса с помощью валидизированных международных шкал (Монреальская шкала когнитивной оценки (MOCA), Краткая шкала оценки психического статуса (MMSE), Батарея лобных тестов, Тест рисования часов, Таблицы Шульте).
Описание медицинского вмешательства
В случае, если исходный уровень HbA1c превышал целевой не более, чем на 2,5%, терапия была усилена вторым сахароснижающим препаратом:
- группа «МЕТ+ЭМПА» — таб. эмпаглифлозин (Джардинс, Берингер Ингельхайм Фарма, Германия) в дозе 10 мг per os 1 раз в день;
- группа «МЕТ+КАНА» — таб. канаглифлозин (Инвокана, Янссен Орто ЛЛС, США) 100 мг per os 1 раз в день;
- группа «МЕТ+арГПП-1»:
- раствор лираглутид (Виктоза, НовоНордиск, Дания) 0,6 мг п/к 1 раз в день в течение 7 дней, затем 1,2 мг мг п/к 1 раз в день;
- раствор семагутид (Оземпик, НовоНордиск, Дания) 0,25 мг п/к 1 раз в 7 дней в течение 1 месяца, затем 0,5 мг п/к 1 раз в 7 дней;
- раствор дулаглутид (Трулисити, Эли Лилли энд Компани, США) 0,75 мг п/к 1 раз в 7 дней.
Через 3 мес. повторно оценивался HbA1c; если на фоне терапии целевой уровень был достигнут, дозы препаратов оставляли прежними. В случае недостижения целевого уровня HbA1с через 3 мес. дозы препаратов увеличивали согласно инструкции — эмпаглифлозина до 25 мг, канаглифлозина до 300 мг, лираглутида до 1,8 мг, семаглутида до 1,0 мг и дулаглутида до 1,5 мг. Помимо этого, с пациентами осуществлялся дистанционный контакт для оценки эффективности терапии и приверженности к лечению. В случае если, по данным самоконтроля гликемии, пациент описывал недостижение целевых показателей, он приглашался на внеочередной визит для коррекции дозы препаратов.
Через 6 мес. пациентам, имевшим удовлетворительный контроль гликемии, было рекомендовано продолжить проводимую терапию. При недостижении целевого HbA1c или снижении концентрации HbA1c менее, чем на 1,0% за 6 мес., терапия корректировалась, в том числе с добавлением третьего препарата.
Методы
Концентрации НСЕ и ЛЦН определялись в сыворотке крови иммуноферментным методом на анализаторе Cobas Roche с использованием наборов NSE Elycsis (Roche) и Bio-Techne соответственно.
Когнитивный статус исследовался при помощи валидизированных шкал: MOCA (норма — 26–30 баллов), MMSE (норма — 28–30 баллов, умеренные когнитивные нарушения — 25–27 баллов, легкая деменция — 20–24 балла, умеренная деменция — 11–19 баллов, тяжелая деменция — 0–10 баллов), Батареи лобных тестов (норма — 16–18 баллов, умеренная лобная дисфункция — 12–15 баллов, деменция лобного типа — менее 11 баллов), Теста рисования часов (норма — 10 баллов), Таблиц Шульте (норма — 25–30 сек).
Статистический анализ
Статистическая обработка полученных данных производилась при помощи программного пакета IBM SPSS Statistics-26 (разработчик — IBM Corporation). Статистический анализ производился при помощи непараметрических методов. Значимость различий между группами оценивалась с помощью непараметрического критерия Краскела-Уоллиса и Манна-Уитни для независимых выборок с применением непараметрического дисперсионного анализа (апостериорное попарное сравнение групп при помощи критерия Данна), внутри группы — с помощью критерия Фридмана и Вилкоксона с введением поправки Бонферрони c false discovery rate. Все показатели представлены в виде «медиана [ 25%; 75%]». Значения p меньше 0,05 рассматривались как значимые.
Этическая экспертиза
Пациентам разъяснялась суть исследования и осуществлялось подписание информированного согласия. Исследование одобрено этическим комитетом НМИЦ им. В.А. Алмазова 04.07.2022 г. (протокол №07-22-01С).
РЕЗУЛЬТАТЫ
Исходные характеристики
В исследование были включены 23 здоровых добровольца, составившие группу «Контроль», и 197 пациентов с СД2 на монотерапии МЕТ, из которых 43 человека имели удовлетворительный контроль гликемии и были включены в группу «МЕТ», а 154 человека были распределены на группы «МЕТ+ЭМПА» (n=47), «МЕТ+КАНА» (n=41) и «МЕТ+арГПП-1» (n=66). Среди пациентов группы «МЕТ+арГПП-1» 6 человек получали лираглутид, 26 — семаглутид и 34 — дулаглутид.
Пациенты групп «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1» значимо не различались по анамнестическим и лабораторным параметрам, в том числе по возрасту, уровню HbA1c, длительности СД2. Кроме того, пациенты с нецелевым уровнем гликемии также не отличались от пациентов группы «МЕТ» по длительности анамнеза СД2, наличию и длительности анамнеза гипертонической болезни (ГБ), а также по основным антропометрическим характеристикам — массе тела, индексу массы тела (ИМТ) (табл. 1).
Таблица 1. Основные исходные клинико-лабораторные характеристики пациентов исследуемых групп
|
Параметр |
Контроль (n=23) |
МЕТ (n=43) |
МЕТ+ЭМПА (n=47) |
МЕТ+КАНА (n=41) |
МЕТ+арГПП-1 (n=66) |
|
Пол, муж, n (%) |
7 (30,4) |
15 (34,9) |
13 (27,7) |
12 (29,3) |
20 (30,3) |
|
Возраст, лет |
53 [ 49; 61] |
58 [ 50; 67] |
64 [ 61; 69]*# |
58 [ 54; 64] |
50 [ 47; 54] |
|
Масса тела, кг |
79 [ 63; 87] |
95 [ 85; 103]* |
93 [ 84; 110]* |
85 [ 79; 106]* |
95 [ 79; 116]* |
|
ИМТ, кг/м² |
29,8 [ 23,4; 32,4] |
32,2 [ 30,0; 6,4]* |
33,1 [ 30,3; 36,0]* |
30,0 [ 28,6; 35,0] |
33,4 [ 31,1; 42,5]* |
|
ОТ, см |
94 [ 83; 99] |
107 [ 94; 118] |
108 [ 99; 112]* |
99 [ 92; 110]§ |
120 [ 108; 130]*# |
|
HbA1c, % |
- |
6,3 [ 6,0; 6,6] |
8,1 [ 7,3; 8,7]*# |
7,5 [ 7,2; 8,9]*# |
8,0 [ 7,2; 9,5]*# |
|
Длительность СД, лет |
- |
5 [ 2; 10] |
5 [ 4; 9] |
3 [ 1; 8] |
5 [ 1; 11] |
|
Наличие полинейропатии, n (%) |
- |
20 (46,5) |
15 (31,9) |
12 (29,3) |
19 (28,8) |
|
Наличие ГБ, n (%) |
- |
37 (86,0) |
33 (70,2) |
31 (75,6) |
40 (60,6) |
|
Длительность ГБ, лет |
- |
10 [ 3; 12] |
10 [ 6; 20] |
10 [ 4; 12] |
10 [ 6; 12] |
|
Наличие ИБС, n (%) |
- |
6 (14,0) |
4 (8,5) |
3 (7,3) |
10 (15,2) |
Примечание. *р<0,05 по сравнению с группой «Контроль»,
#р<0,05 по сравнению с группой «МЕТ»,
§р<0,05 по сравнению с группой «МЕТ+арГПП-1».
HbA1c — гликированный гемоглобин; арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1; ГБ — гипертоническая болезнь; ИБС — ишемическая болезнь сердца; ИМТ — индекс массы тела; КАНА — канаглифлозин; МЕТ — метформин; ОТ — окружность талии; СД — сахарный диабет; ЭМПА — эмпаглифлозин.
Оценка эффективности и переносимости терапии. Влияние исследуемых препаратов на гликемический профиль и антропометрические показатели
Применение всех препаратов привело к улучшению гликемического профиля через 3 мес. и в большинстве случаев сохранению удовлетворительного контроля гликемии. При этом уровень HbA1c в группе «МЕТ+КАНА» был ниже такового в группе «МЕТ+ЭМПА» через 3 и через 6 мес. терапии (табл. 2). В то же время через 6 мес. у 3 пациентов группы «МЕТ+ЭМПА», 1 пациента группы «МЕТ+КАНА» и 5 пациентов группы «МЕТ+арГПП-1» (1 на терапии лираглутидом, 2 на терапии дулаглутидом, 2 на терапии семаглутидом) уровень HbA1c не соответствовал целевому, в связи с чем терапия была интенсифицирована третьим препаратом.
Таблица 2. Динамика уровня гликированного гемоглобина (%) в исследуемых группах больных сахарным диабетом 2 типа на различной сахароснижающей терапии
|
Визит |
МЕТ |
МЕТ+ЭМПА |
МЕТ+КАНА |
МЕТ+арГПП-1 |
|
Исходно |
6,30 [ 5,98; 6,63] |
8,10 [ 7,30; 8,70]# |
7,50 [ 7,20; 8,90]# |
8,04 [ 7,20; 9,50]# |
|
3 мес. |
- |
7,10 [ 6,90; 8,30]#~ |
6,70 [ 6,50; 7,10]#¶~ |
6,40 [ 6,00; 8,20]~ |
|
6 мес. |
- |
7,65 [ 6,85; 8,05]# |
6,80 [ 6,28; 7,25]¶ |
7,00 [ 5,90; 7,75] |
Примечание. #р<0,05 по сравнению с группой «МЕТ»,
¶р<0,05 между группами «МЕТ+ЭМПА» и «МЕТ+КАНА»,
~р<0,05 по сравнению с предыдущим измерением.
арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1; КАНА — канаглифлозин; МЕТ — метформин; ЭМПА — эмпаглифлозин.
Одна пациентка из группы «МЕТ+ЭМПА» и один пациент из группы «МЕТ+КАНА» прекратили участие в исследовании на ранних сроках в связи с развитием побочной реакции со стороны мочеполовой системы; их данные не были включены в анализ. В остальном переносимость исследуемых препаратов была удовлетворительной во всех группах.
Исходная масса тела во всех группах пациентов с СД2 была больше таковой в контрольной группе (табл. 3). Все исследуемые препараты вызвали снижение массы тела через 3 мес., причем масса тела и ИМТ в группе «МЕТ+КАНА» через 3 и 6 мес. были ниже, чем в группе «МЕТ+ЭМПА». Терапия обоими иНГЛТ-2 привела к значимому снижению массы тела в течение первых трех месяцев с момента ее инициации, а в дальнейшем наблюдалась стабилизация массы тела, в то время как терапия арГПП-1 сопровождалась проградиентным снижением массы тела в течение 6 мес. наблюдения. Все исследуемые препараты вызвали уменьшение окружности талии, то есть оказали положительное влияние на выраженность абдоминального ожирения (табл. 3).
Таблица 3. Динамика антропометрических показателей в исследуемых группах
|
Параметр |
Визит |
Контроль |
МЕТ |
МЕТ+ЭМПА |
МЕТ+КАНА |
МЕТ+арГПП-1 |
|
Масса тела, кг |
Исходно |
79 [ 63; 87] |
95 [ 85; 103]* |
93 [ 84; 110]* |
85 [ 79; 106]* |
95 [ 79; 116]* |
|
3 мес. |
- |
- |
90 [ 83; 106]*#~ |
79 [ 75; 100]#¶~ |
90 [ 75; 107]*#~ |
|
|
6 мес. |
- |
- |
90 [ 83; 109]*# |
80 [ 75; 94]#¶ |
85 [ 70; 85]#~ |
|
|
ИМТ, кг/м² |
Исходно |
29,8 [ 23,4; 32,4] |
32,2 [ 30,0; 36,4]* |
33,1 [ 30,3; 36,0]* |
30,0 [ 28,6; 35,0] |
33,4 [ 31,0; 42,5]* |
|
3 мес. |
- |
- |
32,0 [ 30,9; 37,1]*~ |
28,2 [ 26,5; 32,2]#¶~ |
31,5 [ 28,5; 35,6]*~ |
|
|
6 мес. |
- |
- |
33,0 [ 31,1; 36,7]* |
28,6 [ 26,8; 34,4]# |
28,2 [ 26,5; 38,4]# |
|
|
ОТ, см |
Исходно |
94 [ 83; 100] |
107 [ 94; 118] |
108 [ 99; 113]* |
99 [ 92; 110]§ |
120 [ 108; 130]*# |
|
3 мес. |
- |
- |
103 [ 98; 117]* |
93 [ 83; 100]#~ |
116 [ 111; 116]* |
|
|
6 мес. |
- |
- |
105 [ 96; 117]* |
94 [ 83; 100]# ¶§ |
112 [ 104; 112]* |
Примечание.
*р<0,05 по сравнению с группой «Контроль»,
#р<0,05 по сравнению с группой «МЕТ»,
¶р<0,05 между группами «МЕТ+ЭМПА» и «МЕТ+КАНА»,
§р<0,05 по сравнению с группой «МЕТ+арГПП-1»,
~р<0,05 по сравнению с предыдущим измерением.
арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1; ИМТ — индекс массы тела; КАНА — канаглифлозин; МЕТ — метформин; ОТ — окружность талии; ЭМПА — эмпаглифлозин.
Влияние исследуемых препаратов на концентрацию маркеров нейронального повреждения
Во всех группах пациентов с СД2 исходный уровень НСЕ был выше, чем у здоровых добровольцев, при этом в группах «МЕТ+КАНА» и «МЕТ+арГПП-1» концентрация НСЕ была выше, чем в группе «МЕТ» (р=0,000 и р=0,026, соответственно). Добавление к терапии иНГЛТ-2 привело к снижению НСЕ по сравнению с исходным уровнем. В группе «МЕТ+ЭМПА» уровень НСЕ не отличался от такового в группе «Контроль» уже через 3 мес., в группе «МЕТ+КАНА» — через 6 мес. В то же время в группе «МЕТ+арГПП-1» данный показатель оставался выше, чем в контрольной группе, все время наблюдения (рис. 1А).
Исходно концентрация ЛЦН в сыворотке крови была наибольшей в группах пациентов с СД2 с неудовлетворительным контролем гликемии. Все исследуемые препараты вызвали снижение ЛЦН по сравнению с исходным уровнем, при этом через 3 мес. уровень ЛЦН в группах «МЕТ+ЭМПА» и «МЕТ+КАНА» был достоверно ниже, чем в группе «МЕТ+арГПП-1», различий между иНГЛТ-2 не было. Через 6 мес. терапии концентрация ЛЦН во всех группах терапии не отличалась от контрольной группы (рис. 1Б).
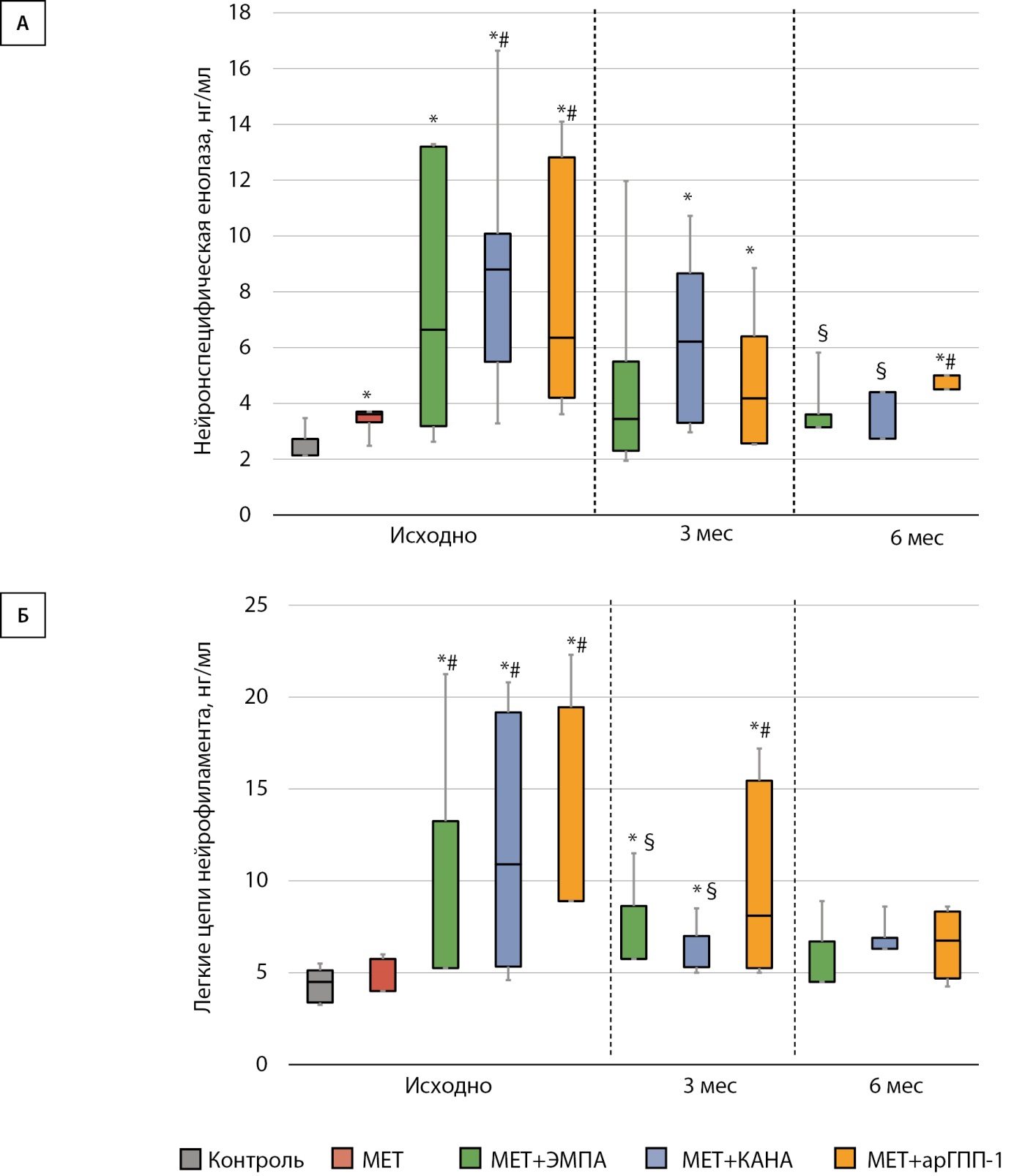
Рисунок 1. Динамика маркеров нейронального повреждения на фоне терапии ингибиторами натрий-глюкозного котранспортера 2 типа или агонистами рецепторов глюкагоноподобного пептида-1.
(А) Динамика концентрации нейрон-специфической енолазы.
(Б) Динамика концентрации легких цепей нейрофиламента.
Примечание. *р<0,05 по сравнению с группой «Контроль»,
#р<0,05 по сравнению с группой «МЕТ»,
§р<0,05 по сравнению с группой «МЕТ+арГПП-1».
арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1; МЕТ — метформин.
Мы выявили 14 случаев (6 в группе «МЕТ+ЭМПА», 5 в группе «МЕТ+КАНА» и 3 в группе «МЕТ+арГПП-1») нарастания уровня НСЕ через 3 мес. с дальнейшим снижением через 6 мес. Так, исходный уровень НСЕ у этих пациентов был 6,19 [ 3,16; 10,42] нг/мл, а через 3 мес. — 8,92 [ 3,77; 11,50] нг/мл (р=0,023). При этом подобной тенденции в отношении уровня ЛЦН у данных больных не наблюдалось. Мы сравнили исходные ключевые характеристики пациентов, имевших нарастание НСЕ, с характеристиками остальных пациентов исследуемых групп и не выявили различий в возрасте, уровне HbA1c, длительности СД2, массе тела и ИМТ. В то же время пациенты, демонстрировавшие транзиторное нарастание НСЕ, имели выраженный положительный ответ на проводимую сахароснижающую терапию, а следовательно, более значительное снижение уровня HbA1c за первые 3 мес. терапии. Так, дельта снижения HbA1c за первые три мес. составила 0,5 [ 0,3; 1,5], 0,5 [ 0,4; 0,8] и 1,1 [ 0,5; 1,8]% в группах «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1» соответственно, и 1,60 [ 0,70; 2,10] % в группе пациентов с нарастанием НСЕ (р<0,05, по сравнению со всеми группами).
Влияние исследуемых препаратов на когнитивную функцию
Большинство пациентов с СД2 имели когнитивную дисфункцию, при оценке по шкалам МОСА и MMSE. Выраженность когнитивного дефицита достоверно не различалась у пациентов группы «МЕТ» и групп «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1». Терапия эмпаглифлозином вызвала нарастание количества баллов по шкале МОСА через 3 мес. и сохранение данного уровня через 6 мес. (рис. 2А), однако в течение всего периода наблюдения когнитивный статус в этой группе оставался хуже, чем в группе здорового контроля. Применение канаглифлозина привело к уменьшению когнитивного дефицита через 3 мес. и сохранению данного показателя через 6 мес., когнитивный статус в группе «МЕТ+КАНА» не отличался от такового в группе «Контроль», по данным обеих шкал (рис. 2А, 2Б). В то же время в группе арГПП-1 было отмечено более медленное нарастание числа баллов (рис. 2А, 2Б).
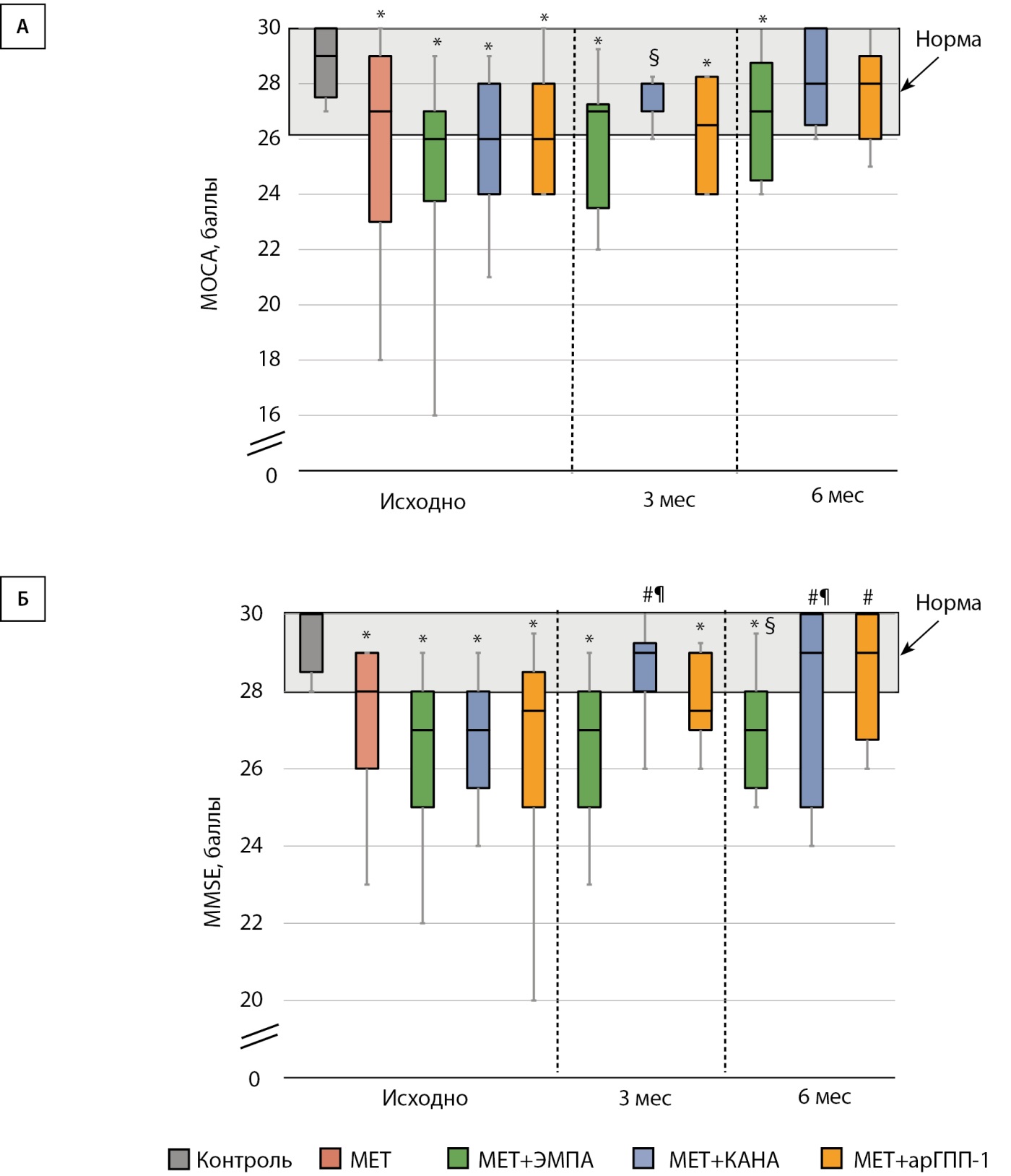
Рисунок 2. Динамика параметров когнитивного статуса на фоне терапии ингибиторами натрий-глюкозного котранспортера 2 типа или агонистами рецепторов глюкагоноподобного пептида-1.
(А) Данные по Монреальской шкале когнитивной оценки (МОСА).
(Б) Данные по Краткой шкале оценки психического статуса (MMSE).
Примечание. *р<0,05 по сравнению с группой «Контроль»,
#р<0,05 по сравнению с группой «МЕТ»,
¶р<0,05 между группами «МЕТ+ЭМПА» и «МЕТ+КАНА»,
§р<0,05 по сравнению с группой «МЕТ+арГПП-1».
арГПП-1 — агонисты рецепторов глюкагоноподобного пептида-1; КАНА — канаглифлозин; МЕТ — метформин; ЭМПА — эмпаглифлозин.
Корреляционный анализ выявил взаимосвязь между уровнем ЛЦН и количеством баллов по MMSE (r=-0,321, p=0,012), что может отражать патогенетическую взаимосвязь между биохимическими и функциональными параметрами.
У 14 пациентов, имевших нарастание НСЕ, не наблюдалось одновременного ухудшения когнитивного статуса по шкалам МОСА и MMSE. Так, эти пациенты имели исходно 24,0 [ 23,0; 26,0] и 26,0 [ 24,0; 27,25] баллов по шкалам МОСА и MMSE соответственно, 26,0 [ 24,5; 27,0] и 28,0 [ 27,5; 28,5] баллов через 3 мес.
По данным Батареи лобных тестов, мы выявили исходное снижение количества баллов в группе «МЕТ+ЭМПА» (15,5 [ 14,0; 17,0]) по сравнению с группами «Контроль» (17,0 [ 17,0; 18,0]) и «МЕТ» (17,0 [ 15,0; 18,0] баллов) и постепенное нарастание количества баллов в данной группе. В то же время выявленные изменения представляются клинически незначимыми, так как медиана во всех группах находилась в пределах нормальных значений во всех точках измерения (кроме исходного значения в группе «МЕТ+ЭМПА»).
В соответствии с Тестом рисования часов, все пациенты с СД2 демонстрировали когнитивные нарушения по сравнению со здоровыми людьми, без значимых различий между группами. Так, количество баллов составило 10,0 [ 9,0; 10,0] в группе «Контроль», 9,0 [ 4,5; 10,0], 9,0 [ 4,0; 9,5], 8,0 [ 4,5; 9,0], 8,0 [ 4,5; 9,0 баллов] в группах «МЕТ», «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1» соответственно. Характер назначенной терапии не повлиял на данный показатель.
Исходно все пациенты с СД2 имели замедление скорости реакции, определенной при помощи таблиц Шульте; достоверных различий между группами не было. Так, скорость поиска чисел составила 40,0 [ 39,5; 48,5] сек. в группе «Контроль», 47,0 [ 35,0; 59,75], 46,0 [ 38,5; 58,5], 44,0 [ 38,25; 55,0], 45,0 [ 40,0; 57,0] сек. в группах «МЕТ», «МЕТ+ЭМПА», «МЕТ+КАНА» и «МЕТ+арГПП-1» соответственно. В группе «МЕТ+ЭМПА» отсутствовала динамика показателей. В группе «МЕТ+КАНА» через 6 мес. терапии было обнаружено значимое улучшение скорости реакции (42,0 [ 40,0; 43,0] сек.), последняя не отличалась от группы контроля и была лучше, чем в группе «МЕТ+ЭМПА» (51,0 [ 48,0; 79,0] сек.). На фоне терапии арГПП-1 наблюдалось транзиторное улучшение показателей через 3 мес. (37,0 [ 31,75; 60,0] сек.) и возвращение к исходному уровню через 6 мес. (48,0 [ 34,0; 60,0] сек.).
ОБСУЖДЕНИЕ
Репрезентативность выборок
Используемые выборки представляются репрезентативными, так как включают пациентов с СД2 и классическим спектром сопутствующих патологий, таких как ГБ, ожирение, без значимого ограничения по спектру получаемой сопутствующей терапии.
Сопоставление с другими публикациями
Наше исследование показало, что СД2 характеризуется повреждением ЦНС, что отражается в повышении маркеров нейронального повреждения и в нарушении когнитивного статуса. Указанные изменения мы наблюдали даже у пациентов, имевших удовлетворительный контроль гликемии, что подтверждает гипотезу о том, что СД2 характеризуется повреждением ЦНС вне прямой зависимости от уровня гликемии. Вероятно, негативную роль может оказывать длительная экспозиция неудовлетворительного контроля гликемии в анамнезе, так называемая негативная «метаболическая память» [11].
Полученные нами данные соотносятся с данными других исследователей. Так, Varghese SМ с соавт. показали, что СД2, а также предиабет являются независимыми факторами риска как развития когнитивной дисфункции, так и ее прогрессирования до деменции, подчеркивая тем самым, что даже незначительное повышение гликемии, не соответствующее диагнозу СД2, ассоциировано с повреждением ЦНС. При этом авторы показали, что наиболее выраженное негативное влияние оказывает сочетание нарушений углеводного обмена и сердечно-сосудистых заболеваний [12].
В рамках настоящего исследования мы впервые провели прямое сравнение влияния иНГЛТ-2 с различной селективностью и арГПП-1 в отношении метаболических параметров и повреждения ЦНС в условиях ХНМК.
На фоне всех вариантов сахароснижающей терапии удалось достичь удовлетворительного контроля гликемии, что позволяет рассматривать эффекты исследуемых препаратов в отношении ЦНС как самостоятельные, не обусловленные исключительно влиянием на гликемический профиль. Все препараты вызвали уменьшение массы тела, причем выраженность данного эффекта на фоне применения иНГЛТ-2 не уступала таковой на фоне терапии арГПП-1, что идет несколько вразрез с имеющимися литературными данными о более выраженном анорексигенном эффекте арГПП-1 [13]. Эффект канаглифлозина в отношении массы тела превосходил таковой у эмпаглифлозина, что, наиболее вероятно, связано со способностью канаглифлозина дополнительно ингибировать натрий-глюкозный котранспортер (НГЛТ) 1 типа, локализующийся в кишечнике, тем самым уменьшая всасывание глюкозы [14].
Мы продемонстрировали, что как иНГЛТ-2, так и арГПП-1 обладают защитным эффектом в отношении ЦНС в условиях ХНМК при СД2. Ранее мы изучали нейропротективный потенциал эмпаглифлозина у больных с СД2 и показали, что данный препарат способен снижать уровень ЛЦН, а также улучшать когнитивный статус [15]. В условиях эксперимента мы выяснили, что защитное действие эмпаглифлозина при ХНМК на фоне СД2 реализуется как путем прямого положительного влияния на нейроны [15], так и путем снижения патологической гиперактивации микроглии [16].
В ходе настоящего исследования мы провели прямое сравнение нейротропного эффекта иНГЛТ-2 с различной селективностью и показали, что низкоселективный канаглифлозин имеет преимущества над высокоселективным эмпаглифлозином. Терапия обоими иНГЛТ-2 была ассоциирована со снижением концентрации маркеров нейронального повреждения НСЕ и ЛЦН, однако влияние канаглифлозина на функциональные параметры, а именно на когнитивный статус, определенный при помощи шкал когнитивной оценки МОСА, MMSE и таблиц Шульте, превосходило таковое у эмпаглифлозина.
Приоритет канаглифлозина по сравнению с эмпаглифлозином, наиболее вероятно, обусловлен способностью канаглифлозина дополнительно ингибировать НГЛТ 1 типа, который широко представлен в ткани головного мозга: в пирамидальных клетках коры, клетках Пуркинье мозжечка, пирамидальных и гранулярных клетках гиппокампа [17].
Предположительно, именно активация 1 типа НГЛТ может являться звеном патогенеза повреждения ЦНС в условиях острой и хронической ишемии. Так, НГЛТ-1 оказывается вовлечен в развитие и прогрессирование асептического воспаления, усиление ишемического-реперфузионного повреждения с последующей гибелью нейронов, и, как следствие, нарастание когнитивной дисфункции [17].
Клинические данные о влиянии иНГЛТ-2 на течение ХНМК и когнитивную дисфункцию на настоящий момент немногочисленны. В августе 2024 г. опубликованы результаты исследования эффекта иНГЛТ-2 по сравнению с ингибиторами дипептидилпептидазы-4 (иДПП-4) в отношении развития деменции у пациентов с СД2 [18]. Было показано, что иНГЛТ-2 имеют преимущества, причем прежде всего у пациентов старше 60 лет, у которых они снижают риск развития как сосудистой деменции, так и болезни Альцгеймера.
По результатам нашего исследования, терапия арГПП-1 также продемонстрировала нейропротективный потенциал при СД2, однако менее выраженный, чем низкоселективный иНГЛТ-2 канаглифлозин. Так, применение арГПП-1 практически не оказало влияния на уровень НСЕ, а снижение концентрации ЛЦН было медленнее, чем в группе терапии канаглифлозином. Аналогично улучшение когнитивного статуса в группе терапии арГПП-1 происходило медленнее, нормализация была достигнута через 6 мес.
Как известно, именно арГПП-1 представляют собой класс сахароснижающих препаратов с доказанными нейропротективными свойствами, однако они касаются прежде всего способности этих препаратов уменьшать риск инсульта [8], что описано для арГПП-1 пролонгированного действия дулаглутида и семаглутида [9].
Нейропротективные свойства арГПП-1 в условиях ХНМК начинают активно изучаться лишь в последние годы. Было показано позитивное влияние лираглутида на когнитивную дисфункцию у пациентов с предиабетом и недавно выявленным СД2. Лираглутид улучшал ряд когнитивных параметров, в том числе краткосрочную и долгосрочную память [19]. В 2022 г. были обобщены результаты трех двойных слепых плацебо-контролируемых исследований, суммарно включавших более 15 000 пациентов, и данные Национального регистра Дании, включавшего более 120 000 пациентов. Было выявлено, что арГПП-1 обладают способностью снижать риск развития деменции по сравнению с плацебо, а также обладают доказанным преимуществом в этом отношении по сравнению с производными сульфонилмочевины, меглитинидами, иДПП-4 и инсулином [20]. Как мы показали ранее, механизм нейропротективного эффекта арГПП-1 при диабет-индуцированном повреждении ЦНС является комплексным и включает прямое воздействие на структуру нейронов и уменьшение активации микроглии [21].
В то же время, насколько нам известно, ранее не выполнялось прямых сравнительных клинических исследований нейропротективных свойств арГПП-1 и иНГЛТ-2.
Таким образом, результаты проведенного исследования показали, что как арГПП-1, так и иНГЛТ-2, оказывают нейропротективный эффект при СД2, однако защитное действие низко-селективного иНГЛТ-2 канаглифлозина более выражено, чем эмпаглифлозина, и, вероятно, является более комплексным, чем у арГПП-1, так как проявляется в улучшении как биохимических, так и функциональных показателей.
Необходимо отметить, что у нескольких пациентов наблюдалось парадоксальное нарастание уровня НСЕ через 3 мес. от начала терапии с последующим снижением этого показателя. Указанный феномен не сопровождался негативными функциональными изменениями. Мы выявили, что у этих 14 пациентов с транзиторным подъемом НСЕ имела место быстрая динамика снижения гликемии на фоне инициации терапии иНГЛТ-2 или арГПП-1, несмотря на то, что титрация дозы производилась традиционным путем. Мы полагаем, что данное нарастание маркера повреждения ЦНС может считаться клинически незначимым, так как не сопровождалось отрицательными клиническими проявлениями. В то же время полученные данные позволяют нам рекомендовать избегать быстрых титраций доз препаратов в клинической практике с целью профилактики транзиторной негативной реакции со стороны ЦНС у больных СД2.
Клиническая значимость результатов
СД2, даже при удовлетворительном контроле гликемии, характеризуется повреждением ЦНС, что диктует необходимость назначения ранней эффективной сахароснижающей терапии с дополнительным защитным действием в отношении головного мозга. Такой нейропротективый потенциал, по нашим данным, присутствует у арГПП-1 и иНГЛТ-2, причем наиболее выраженный защитный эффект оказывает низкоселективный иНГЛТ-2 канаглифлозин, в связи с чем он может быть рекомендован в качестве препарата выбора у пациентов с ХНМК на фоне СД2.
Ограничения исследования
Ограничением нашего исследования является применение лишь биохимических и функциональных тестов для оценки выраженности повреждения ЦНС. Предпочтительно проведение дополнительного исследования с использованием методов нейровизуализации.
Направления дальнейших исследований
Изучение нейропротективного потенциала арГПП-1 и иНГЛТ-2 у пациентов после перенесенного ОНМК в анамнезе, то есть имеющих неврологический дефицит как на фоне ХНМК, так и в качестве последствия ОНМК.
ЗАКЛЮЧЕНИЕ
СД2 может характеризоваться повреждением ЦНС, даже в условиях эугликемии, в случае применения препаратов без дополнительного нейротропного потенциала. Данное повреждение проявляется биохимическими и функциональными изменениями и является потенциально обратимым. Современные классы сахароснижающих препаратов, арГПП-1 и иНГЛТ-2 обладают защитным действием в отношении ЦНС у пациентов с СД2 с признаками ХНМК. Наиболее выраженный нейропротективный потенциал выявлен у низко-селективного иНГЛТ-2 канаглифлозина, так как он проявляется в комплексном улучшении биохимических и функциональных параметров. Нейротропный эффект арГПП-1 и иНГЛТ-2 не обусловлен только их влиянием на гликемический профиль.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при поддержке Министерства здравоохранения Российской Федерации (соглашение № 124021600064-8), Министерства науки и высшего образования Российской Федерации (соглашение № 075-15-2022-301 от 20.04.2022).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Гринева Е.Н., Шляхто Е.В. — существенный вклад в концепцию исследования; Каронова Т.Л. — существенный вклад в дизайн исследования, внесение в рукопись существенной правки с целью повышения научной ценности статьи; Мурашева А.В., Фукс О.С., Тимкина Н.В., Федотова А.Д. — существенный вклад в получение, анализ и интерпретацию результатов, написание статьи. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Carrillo-Larco RM, Guzman-Vilca WC, Xu X, Bernabe-Ortiz A. Mean age and body mass index at type 2 diabetes diagnosis: Pooled analysis of 56 health surveys across income groups and world regions. Diabet Med. 2024;41(2):e15174. doi: https://doi.org/10.1111/dme.15174
2. Dedov II, Shestakova MV, Vikulova OK, et al. Diabetes mellitus in the Russian Federation: dynamics of epidemiological indicators according to the Federal Register of Diabetes Mellitus for the period 2010–2022. Diabetes mellitus. 2023;26(2):104-123. (In Russ). doi: https://doi.org/10.14341/DM13035
3. Tang H, Zhang S, Yan S, et al. Unfavorable neurological outcome in diabetic patients with acute ischemic stroke is associated with incomplete recanalization after intravenous thrombolysis. J Neurointerv Surg. 2016;8(4):342-346. doi: https://doi.org/10.1136/neurintsurg-2014-011643
4. Cao F, Yang F, Li J, et al. The relationship between diabetes and the dementia risk: a meta-analysis. Diabetol Metab Syndr. 2024;16(1):101. doi: https://doi.org/10.1186/s13098-024-01346-4
5. Roy B, Ehlert L, Mullur R, et al. Regional Brain Gray Matter Changes in Patients with Type 2 Diabetes Mellitus. Sci Rep. 2020;10(1):9925. doi: https://doi.org/10.1038/s41598-020-67022-5
6. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под редакцией И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск // Сахарный диабет. – 2023. — Т. 26. — № 2S. — С. 1-157. doi: https://doi.org/10.14341/DM13042
7. Davies MJ, Aroda VR, Collins BS, et al. Management of Hyperglycemia in Type 2 Diabetes, 2022. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2022;45(11):2753-2786. doi: https://doi.org/10.2337/dci22-0034
8. Giugliano D, Scappaticcio L, Longo M, Bellastella G, Esposito K. GLP-1 receptor agonists vs. SGLT-2 inhibitors: the gap seems to be leveling off. Cardiovasc Diabetol. 2021;20(1):205. doi: https://doi.org/10.1186/s12933-021-01400-9
9. Bellastella G, Maiorino MI, Longo M, et al. GlucagonLike Peptide-1 Receptor Agonists and Prevention of Stroke Systematic Review of Cardiovascular Outcome Trials With Meta-Analysis. Stroke. 2020;51(2):666-669. doi: https://doi.org/10.1161/STROKEAHA.119.027557
10. Li HL, Lip GYH, Feng Q, et al. Sodium-glucose cotransporter 2 inhibitors (SGLT2i) and cardiac arrhythmias: a systematic review and meta-analysis [published correction appears in Cardiovasc Diabetol. 2021 Sep 4;20(1):177. doi: https://doi.org/10.1186/s12933-021-01371-x.]. Cardiovasc Diabetol. 2021;20(1):100. doi: https://doi.org/10.1186/s12933-021-01293-8
11. Testa R, Bonfigli AR, Prattichizzo F, La Sala L, De Nigris V, Ceriello A. The «Metabolic Memory» Theory and the Early Treatment of Hyperglycemia in Prevention of Diabetic Complications. Nutrients. 2017;9(5):437. doi: https://doi.org/10.3390/nu9050437
12. Varghese SM, Joy N, John AM, George G, Chandy GM, Benjamin AI. Sweet Memories or Not? A Comparative Study on Cognitive Impairment in Diabetes Mellitus. Front Public Health. 2022;10:822062. doi: https://doi.org/10.3389/fpubh.2022.822062
13. Ma H, Lin YH, Dai LZ, Lin CS, Huang Y, Liu SY. Efficacy and safety of GLP-1 receptor agonists versus SGLT-2 inhibitors in overweight/ obese patients with or without diabetes mellitus: a systematic review and network meta-analysis. BMJ Open. 2023;13(3):e061807. doi: https://doi.org/10.1136/bmjopen-2022-061807
14. Yu AS, Hirayama BA, Timbol G, et al. Functional expression of SGLTs in rat brain. Am J Physiol Cell Physiol. 2010;299(6):C1277-C1284. doi: https://doi.org/10.1152/ajpcell.00296.2010
15. Симаненкова А.В., Фукс О.С., Тимкина Н.В., и др. Высокоселективный ингибитор натрий-глюкозного котранспортера 2 типа эмпаглифлозин как средство защиты головного мозга в условиях хронической недостаточности мозгового кровообращения (клиникоэкспериментальное исследование) // Проблемы Эндокринологии. — 2024. — Т. 70. — № 4. — С. 44-56. doi: https://doi.org/10.14341/probl13336
16. Simanenkova AV, Fuks ОS, Timkina NV, et al. An experimental study of the neuroprotective effect of sodium–glucose cotransporter type 2 inhibitors. Journal of Evolutionary Biochemistry and Physiology. 2022;58(5):1540-1553. doi: https://doi.org/10.1134/S0022093022050234
17. Pawlos A, Broncel M, Woźniak E, Gorzelak-Pabiś P. Neuroprotective Effect of SGLT2 Inhibitors. Molecules. 2021;26(23):7213. doi: https://doi.org/10.3390/molecules26237213
18. Shin A, Koo BK, Lee JY, Kang EH. Risk of dementia after initiation of sodium-glucose cotransporter-2 inhibitors versus dipeptidyl peptidase-4 inhibitors in adults aged 40-69 years with type 2 diabetes: population based cohort study [published correction appears in BMJ. 2024 Sep 2;386:q1911. doi: https://doi.org/10.1136/bmj.q1911.]. BMJ. 2024;386:e079475. doi: https://doi.org/10.1136/bmj-2024-079475
19. Vadini F, Simeone PG, Boccatonda A, et al. Liraglutide improves memory in obese patients with prediabetes or early type 2 diabetes: a randomized, controlled study. Int J Obes (Lond). 2020;44(6):1254-1263. doi: https://doi.org/10.1038/s41366-020-0535-5
20. Nørgaard CH, Friedrich S, Hansen CT, et al. Treatment with glucagonlike peptide-1 receptor agonists and incidence of dementia: Data from pooled double-blind randomized controlled trials and nationwide disease and prescription registers. Alzheimers Dement (N Y). 2022;8(1):e12268. doi: https://doi.org/10.1002/trc2.12268
21. Simanenkova A, Fuks O, Timkina N, et al. Microglia Involvement into Acute and Chronic Brain Damage in Diabetic Rats: Impact of GLP-1RA and SGLT-2i. Front Biosci (Landmark Ed). 2024;29(7):265. doi: https://doi.org/10.31083/j.fbl2907265
Об авторах
А. B. МурашеваРоссия
Мурашева Анна Владимировна, к.м.н.
197341, Санкт-Петербург, ул. Аккуратова, д. 2
ResearcherID: AAG-9468-2020;
Scopus Author ID: 55418812500
Т. Л. Каронова
Россия
Каронова Татьяна Леонидовна, д.м.н., профессор
Санкт-Петербург
ResearcherID: V-7179-2018;
Scopus Author ID: 56953234200
О. С. Фукс
Россия
Фукс Оксана Станиславовна
Санкт-Петербург
ResearcherID: HMV-2293-2023;
Scopus Author ID: 57226561049
Н. В. Тимкина
Россия
Тимкина Наталья Владимировна
Санкт-Петербург
ResearcherID: ABG-3536-2021;
Scopus Author ID: 57222553770
А. Д. Федотова
Россия
Федотова Арина Дмитриевна
Санкт-Петербург
Е. Н. Гринева
Россия
Гринева Елена Николаевна, д.м.н., профессор, член-корреспондент РАН
Санкт-Петербург
ResearcherID: V-8221-2018;
Scopus Author ID: 6507138145
Е. В. Шляхто
Россия
Шляхто Евгений Владимирович, д.м.н., профессор, академик РАН
Санкт-Петербург
ResearcherID: A-6939-2014;
Scopus Author ID: 16317213100
Дополнительные файлы
|
|
1. Рисунок 1. Динамика маркеров нейронального повреждения на фоне терапии ингибиторами натрий-глюкозного котранспортера 2 типа или агонистами рецепторов глюкагоноподобного пептида-1. (А) Динамика концентрации нейрон-специфической енолазы. (Б) Динамика концентрации легких цепей нейрофиламента. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(530KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Динамика параметров когнитивного статуса на фоне терапии ингибиторами натрий-глюкозного котранспортера 2 типа или агонистами рецепторов глюкагоноподобного пептида-1. (А) Данные по Монреальской шкале когнитивной оценки (МОСА). (Б) Данные по Краткой шкале оценки психического статуса (MMSE). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(535KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Мурашева А.B., Каронова Т.Л., Фукс О.С., Тимкина Н.В., Федотова А.Д., Гринева Е.Н., Шляхто Е.В. Сравнительное исследование нейропротективных свойств ингибиторов натрий-глюкозного котранспортера-2 и агонистов рецепторов глюкагоноподобного пептида-1 у пациентов с сахарным диабетом 2 типа. Сахарный диабет. 2025;28(2):187-197. https://doi.org/10.14341/DM13255
For citation:
Murasheva A.V., Karonova T.L., Fuks O.S., Timkina N.V., Fedotova A.D., Grineva E.N., Shlyakhto E.V. Comparative evaluation of SGLT-2i and GLP-1RA neuroprotective properties in type 2 diabetic patients. Diabetes mellitus. 2025;28(2):187-197. (In Russ.) https://doi.org/10.14341/DM13255

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































