Перейти к:
Диабетическая кардиомиопатия: дефиниция, право на существование
https://doi.org/10.14341/DM13250
Аннотация
Известно, что при сахарном диабете (СД) патология сердца может развиться не только вследствие поражения коронарных артерий. Не менее значимую роль играет некоронарогенная дисфункция миокарда, в том числе связанная с хронической гипергликемией. В 2024 г. опубликован консенсусный документ, разработанный экспертами Ассоциации специалистов по хронической сердечной недостаточности (ХСН) при Европейском обществе кардиологов (ESC) и рабочей группой по заболеваниям миокарда и перикарда ESC, в котором впервые предложен термин «Диабетическое заболевание миокарда», или «Диабетическая дисфункция миокарда». Данное состояние определяется как систолическая и/или диастолическая дисфункция миокарда при СД и развивается под сочетанным влиянием нескольких факторов, при этом главенствующая роль отводится гипергликемии. Понятие «диабетическая кардиомиопатия» (ДКМ) в течение долгого времени активно используется учеными, однако к настоящему моменту не внедрено на уровне осложнений СД по аналогии с диабетической нефропатией и не входит в спектр заболеваний, причисленных к диабетической макроангиопатии. Патологические процессы, характерные для ДКМ и ХСН с сохраненной фракцией выброса (ХСНсФВ) при СД, сходны, в связи с чем данные состояния нередко приравниваются. Диагностическая концепция ХСНсФВ совершенствуется. Пациентам с СД 2 типа (СД2) и бессимптомными структурными и/или функциональными аномалиями миокарда, согласно современным представлениям, диагностируется субклиническая ХСН. Важность своевременного распознавания этой стадии заключается в том, что текущие возможности терапии при СД2 позволяют остановить или замедлить ее прогрессирование до симптоматической ХСН. В настоящей статье обсуждаются актуальные взгляды на этиопатогенез ДКМ у пациентов с СД, резюмируются рекомендации по диагностическим возможностям диастолической дисфункции миокарда, субклинической ХСН и ХСНсФВ, подчеркивается значимость своевременной оценки риска развития клинически манифестной ХСН у пациентов с СД2.
Ключевые слова
Для цитирования:
Маркова Т.Н., Овчинникова М.А., Шкодкина В.В., Беляева О.А. Диабетическая кардиомиопатия: дефиниция, право на существование. Сахарный диабет. 2025;28(4):384-393. https://doi.org/10.14341/DM13250
For citation:
Markova T.N., Ovchinnikova M.A., Shkodkina V.V., Belyaeva O.A. Diabetic cardiomyopathy: definition, right to exist. Diabetes mellitus. 2025;28(4):384-393. (In Russ.) https://doi.org/10.14341/DM13250
ВВЕДЕНИЕ
В июне 2024 г. «European Journal of Heart Failure» разместил экспертное консенсуальное заявление, подготовленное Ассоциацией специалистов по хронической сердечной недостаточности (ХСН) при Европейском обществе кардиологов (ESC) и рабочей группой по заболеваниям миокарда и перикарда ESC [1], в котором признано серьезное значение сахарного диабета 2 типа (СД2) и гипергликемии в развитии ХСН, что получило отражение в понятии «Диабетическое заболевание миокарда» (ДЗМ), или «Диабетическая дисфункция миокарда» (ДДМ). Данное состояние подразумевает систолическую и/или диастолическую дисфункцию миокарда при наличии СД2. Подчеркивается, что СД2 редко является единственной причиной диабетического заболевания миокарда; обычно его патологическое воздействие на сердечную ткань реализуется при сопутствующем ожирении, артериальной гипертензии (АГ), хронической болезни почек (ХБП) и/или ишемической болезни сердца (ИБС).
Еще в 90-е годы ученые обратили внимание на то, что у ряда пациентов с СД2 без установленной ранее сердечной патологии выявлялись ранние нарушения работы левого желудочка, в особенности диастолическая дисфункция [2]. Более того, при СД2, независимо от наличия у больных АГ и ожирения, выявлялась гипертрофия левого желудочка [3]. Данные наблюдения послужили основой формирования концепции «диабетической кардиомиопатии» (ДКМ), а вышеуказанные признаки впоследствии стали ключевыми критериями диагностики ХСН с сохраненной фракцией выброса (ХСНсФВ) — уникального фенотипа ХСН, который является доминирующим в мире и значительно влияет на прогноз пациентов, повышая риск госпитализации и летального исхода [4]. По мере накопления научных исследований в этой области этиопатогенетическая картина совершенствовалась, и к настоящему моменту описаны более детальные и развернутые механизмы развития патологии миокарда при СД2. На сегодня не вызывает сомнений, что ДКМ является результатом миокардиального фиброза и патологического ремоделирования сердца, которые способствуют формированию ригидности стенки миокарда в диастолу при его сохраненной сократительной функции. Однако не всегда диастолическая дисфункция протекает изолированно, у ряда пациентов с СД2 она может независимо сочетаться со снижением систолической функции, проявляющейся уменьшенной ФВ [5].
ЭВОЛЮЦИЯ ПОНИМАНИЯ И ОПРЕДЕЛЕНИЯ ПАТОЛОГИЧЕСКИХ ПРОЦЕССОВ В МИОКАРДЕ ПРИ СД2
Сердечно-сосудистые заболевания (ССЗ) остаются основной причиной смерти и инвалидности среди пациентов с СД2, при этом ИБС и ХСН признаны главными виновниками этой негативной тенденции [6]. ИБС и АГ принято считать ведущими причинами развития ХСН при СД2, однако не менее важное значение имеет прямое влияние нарушений углеводного обмена (НУО) на ткань миокарда [7]. На сегодня понятие ХСН объединяет несколько фенотипов, которые отличаются не только различными фракциями выброса, но и этиопатогенезом, причем в случае ХСНсФВ последствия ишемии миокарда играют не первостепенную роль. Так, установлено, что у пациентов с СД2 наблюдается дисфункция левого желудочка даже при отсутствии ИБС, поскольку при СД2 имеют место уникальные изменения в стенке сердца, не зависящие от классических факторов риска, включающих не только ИБС, но и АГ, пороки клапанов сердца и др. [8]. Проведены многочисленные клинические исследования, в ходе которых у пациентов с СД2 установлены определенные структурные и функциональные аномалии со стороны сердца. Во-первых, более высокая масса и толщина стенки ЛЖ, артериальная ригидность и снижение систолической функции по сравнению с лицами без СД [9]. При этом выявленные изменения не зависели от индекса массы тела (ИМТ) и артериального давления. Во-вторых, удлинение интервала времени перед сердечным выбросом и укороченное время самого выброса, которые коррелировали со снижением ФВЛЖ в покое и снижением систолической функции [10]. У пациентов с СД2 также выявлено более низкое усиление перфузии миокарда и более интенсивное повышение давления в легочной артерии в ответ на физическую нагрузку, что свидетельствует об уменьшении сердечного резерва [11]. В-третьих, диастолическая дисфункция, которая может быть частично обусловлена увеличением массы миокарда ЛЖ. Например, отношение E/e’>15 (маркер повышенного диастолического давления ЛЖ) наблюдалось у 23% из 1760 обследованных пациентов с СД2 [12], причем большая диастолическая дисфункция отмечалась при худшем гликемическом контроле и сопутствующей АГ [13]. В другом исследовании была установлена связь между уровнем гликированного гемоглобина (HbA1c) и соотношением E/e’, а также уменьшением расстояния шестиминутной ходьбы [14]. Таким образом, для ранней стадии ДКМ характерны следующие патологические изменения: гипертрофия миокарда, интерстициальный фиброз, ригидность сердечной стенки и, как следствие, диастолическая дисфункция [15].
По данным литературы, ДКМ все чаще описывают как типичную ХСНсФВ, характеризующуюся диастолической дисфункцией в сочетании с концентрической гипертрофией миокарда. Именно диастолическую дисфункцию принято считать первым идентифицируемым функциональным изменением при ДКМ, хотя на цикл сокращение — расслабление могут влиять и другие факторы, например, возраст, ИМТ, АГ [8]. Однако в последнее время данная концепция подвергается сомнению, и в литературе можно встретить противоречивые данные. Так, в исследовании Laura Ernande и соавт. показано, что при сохраненной ФВЛЖ и нормальной диастолической функции у ряда пациентов определялось изменение важного эхокардиографического показателя — продольной систолической деформации ЛЖ (стрейн) [16], в связи с чем диастолическую дисфункцию, возможно, не следует рассматривать как первый признак доклинической ДКМ. Это предположение находит подтверждение при использовании эхокардиографии (ЭХО-КГ) с оценкой другого функционального показателя — индекса производительности миокарда (Myocardial Performance Index, MPI) [8]. В частности, зарегистрированы более высокие значения MPI у пациентов с ДКМ. Нельзя исключить, что данный неинвазивный инструментальный маркер может быть одним из самых ранних диагностических критериев ДКМ.
ЭТИОЛОГИЧЕСКИЕ АСПЕКТЫ РАЗВИТИЯ ДКМ
В настоящее время выделяют несколько патогенетически связанных с СД2 нарушений, которые могут способствовать развитию дисфункции ткани миокарда [1]. Основные из них схематично представлены на рисунке 1. Например, инсулинорезистентность и гиперинсулинемия, лежащие в основе СД2, могут вызывать гипертрофию ЛЖ и связанную с ней диастолическую дисфункцию, которая широко распространена среди пациентов с СД2 [17].
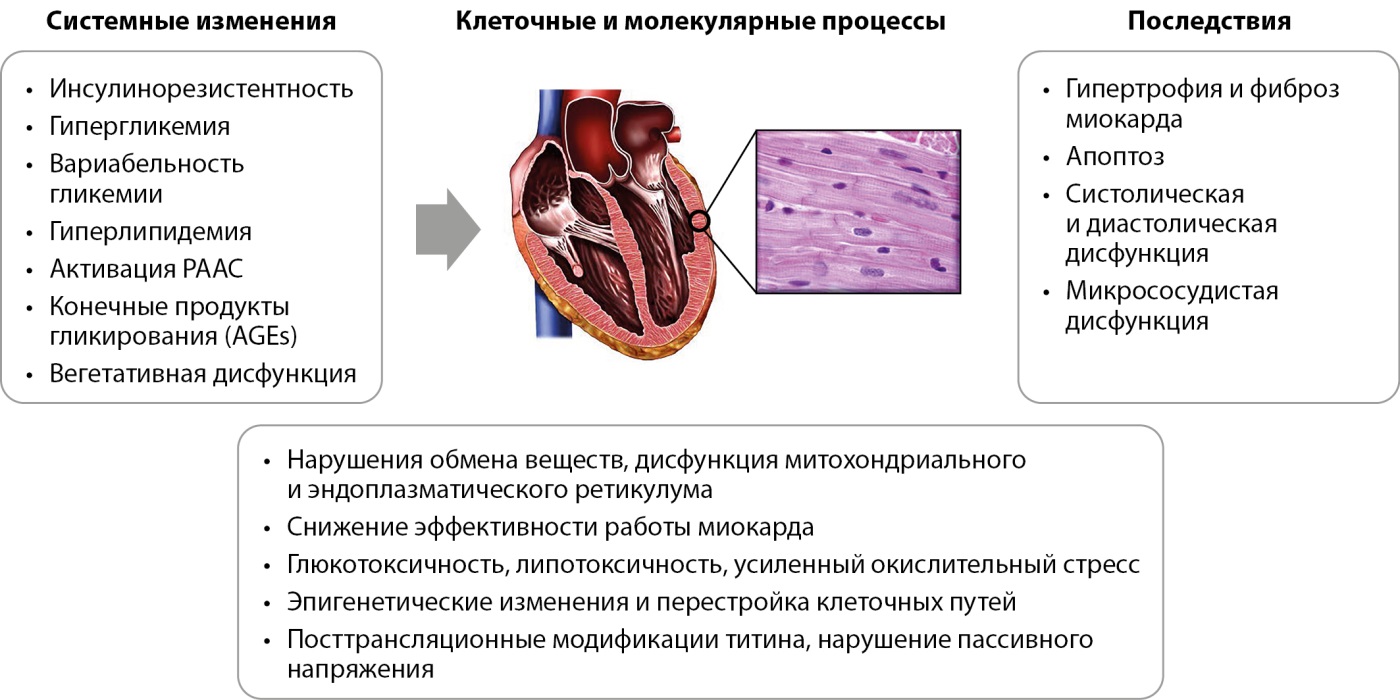
Рисунок 1. Механизмы, лежащие в основе дисфункции миокарда при сахарном диабете 2 типа. Адаптировано из [1].
Примечание: РААС — ренин-ангиотензин-альдостероновая система.
Гипергликемия способствует образованию конечных продуктов гликирования (advanced glycation end product, AGE), которые представляют собой гликированные вследствие длительного воздействия глюкозы белки или липиды [18]. Отложение AGE может увеличивать диастолическую ригидность ЛЖ и нарушать релаксацию сердца напрямую за счет механического сшивания коллагена или опосредованно за счет усиления образования коллагена и снижения биодоступности оксида азота [19][20]. Помимо этого, продукция AGE приводит к накоплению активных форм кислорода (АФК), воспалению, повреждению митохондрий и апоптозу [21]. В исследовании Hitsumoto T. продемонстрировано, что более выраженная диастолическая дисфункция наблюдается у пациентов с высоким уровнем AGE, определенных методом аутофлуоресценции кожи [22].
Принципиальный вклад гипергликемии в развитие ДКМ подтверждают результаты недавнего крупного исследования, в котором установлена причинно-следственная связь СД 1 типа (СД1) и неишемической кардиомиопатии с учетом поправки на сопутствующие факторы, включая ИМТ, наличие инсулинорезистентности и АГ [23].
Имеются данные, что вариабельность гликемии приводит к более выраженному окислительному стрессу, чем стойкая хроническая гипергликемия [24]. В свою очередь окислительный стресс тесно коррелирует с образованием AGE, которые накапливаются в миокарде и вызывают структурные изменения ткани [25]. По данным Gu J. и соавт., вариабельность гликемии связана с развитием ХСНсФВ [26]. В другом исследовании выявлены более высокие эхокардиографические показатели диастолической дисфункции в группе пациентов с высокой вариабельностью гликемии, несмотря на сопоставимый уровень HbA1c [27].
Особое внимание уделяется вегетативной нейропатии при СД2 [28]. Известно, что симпатическая стимуляция увеличивает сокращение ЛЖ, а также скорость релаксации ЛЖ; последнее возможно за счет облегчения поглощения кальция саркоплазматическим ретикулумом. При аутопсии у пациентов с СД2 выявляется истощение запасов катехоламинов в стенке сердца, что может привести к нарушению как систолической, так и диастолической функций [29]. Эти изменения, вероятно, связаны с функциональными нарушениями в миокардиальных симпатических нервных волокнах [30].
Способность сосудистого русла обеспечивать метаболические потребности миокарда может быть неудовлетворительной из-за аномального тонуса эпикардиальных сосудов и микроваскулярной дисфункции. У больных СД2 нарушена эндотелий-зависимая релаксация — дефект, который связан с инактивацией оксида азота (NO), предположительно, конечными продуктами гликирования и повышенной продукцией свободных радикалов [31]. Микроваскулярное ремоделирование и аномальный вазодилатационный ответ при СД2 наблюдается в том числе в микроциркуляторном русле коронарных сосудов (vasa vasorum). Считается, что патологические изменения могут быть частично обусловлены подавлением экспрессии фактора роста эндотелия сосудов (VEGF) [32], а также снижением уровня NO.
ХСН и/или диабетическая болезнь почек (ДБП), наблюдается у ∼50% пациентов с СД2. Так, нами было продемонстрировано, что у каждого второго пациента с ХСН имеется ХБП С3а и более и/или А2 и более, и наоборот [33]. ДБП способствует развитию вторичной гипертензии и анемии, а также связана с повышенной госпитализацией и смертностью при ХСНсФВ. Снижение почечной перфузии и повышенное центральное венозное давление являются наиболее важными гемодинамическими факторами. Кроме того, ренин-ангиотензин-альдостероновая система (РААС) и симпатическая нервная система гиперактивируются при СД2, что приводит к липолизу и развитию инсулинорезистентности [15]. Снижение экскреции натрия поддерживает провоспалительное состояние. Так формируется прочный порочный круг, образованный почечной и сердечной дисфункцией, именуемый в литературе «кардиоренальным континуумом».
Накопление в миокарде липидов и других токсических продуктов метаболизма свободных жирных кислот (СЖК) (т.н. феномен липотоксичности) [34], нарушение метаболизма внутриклеточного кальция [35], повышение регуляции РААС [36], гиперпродукция АФК и митохондриальные дефекты [21] вносят существенный вклад в медленно прогрессирующую и зачастую бессимптомную сердечную дисфункцию.
Инсулинорезистентность и гиперинсулинемия — важный фактор развития ДКМ. Избыток висцерального жира стимулирует хроническое асептическое вялотекущее воспаление, связанное с гиперактивацией иммунных клеток как в самих адипоцитах, так и во всем организме [37]. Под влиянием активина А — цитокина из семейства трансформирующего фактора роста-β, вырабатываемого эпикардиальной жировой тканью (ЭЖТ), активируется фиброз миокарда, потенцируется развитие диастолической дисфункции и ДКМ. [38][39]. Селективное ингибирование активинов является потенциальной терапевтической мишенью при кардиометаболических заболеваниях, в т.ч. ХСНсФВ [40]. Важную роль играют секретируемые висцеральной ЖТ провоспалительные цитокины, в частности фактор некроза опухоли альфа (ФНО-альфа) и интерлейкина-6 (ИЛ-6). Накопление ИЛ-6 стимулирует продукцию триглицеридов за счет увеличения синтеза СЖК и нарушает чувствительность рецепторов к инсулину, приводя к развитию инсулинорезистентности [41]. ФНО-альфа может увеличивать накопление АФК, тем самым запуская окислительный стресс и усугубляя процесс апоптоза в миокарде [42]. Увеличение концентрации провоспалительных цитокинов при ожирении стимулирует активность фибробластов, усугубляет гипертрофию миокарда, что в дальнейшем приводит к ремоделированию сердечной стенки, диастолической дисфункции и развитию ХСНсФВ [43][44]. Помимо этого, патологическое увеличение ЭЖТ приводит к нарушению гемодинамики из-за механической компрессии сосудов [45]. Так, установлена корреляционная связь между количеством висцеральной ЖТ и субклиническими изменениями сердца: пациенты с более выраженным отложением абдоминального жира имеют худшие структурно-функциональные показатели ЛЖ по данным ЭХО-КГ, а увеличение ЭЖТ ассоциировано с нарушением диастолической функции и увеличением риска заболеваний сердца [46].
В качестве источника энергии кардиомиоциты используют глюкозу, длинноцепочечные ЖК и лактат. Глюкоза поступает в миокард посредством транспортеров глюкозы 1 и 4 (ГЛЮТ-1, ГЛЮТ-4). В условиях инсулинорезистентности наблюдается снижение количества ГЛЮТ-переносчиков на мембранах клеток сердца, при этом количество PPAR-альфа (рецепторов, активируемых пролифератором пероксисом) увеличивается, вследствие чего окисление глюкозы подавляется [47]. Здоровый миокард использует СЖК как основной источник энергии (65–75%), на долю глюкозы отводится лишь 20–25%. В состоянии инсулинорезистентности миокард практически полностью переключается на окисление СЖК, что стимулирует гиперпродукцию АФК и дисфункцию митохондрий. Повышается потребность миокарда в кислороде, что впоследствии ведет к относительной ишемии сердечной стенки [48]. Интенсивно поглощаемые СЖК и некоторые их промежуточные соединения (церамид, диацилглицерин) приводят к дестабилизации сигнальной системы инсулина, а также нарушению выработки NO [49]. Кроме того, СЖК оседают на стенке миокарда, что приводит к локальной жировой дистрофии и утолщению стенок артериол. Описанные изменения сопровождаются снижением кровотока в коронарных сосудах и, как следствие, развитием метаболических нарушений и патологических структурных процессов в ткани миокарда [50].
С учетом вышесказанного становится очевидно, что строгий контроль уровня глюкозы имеет колоссальное значение для клинических исходов ДКМ. На рисунке 2 суммированы этиологические факторы развития ХСНсФВ.
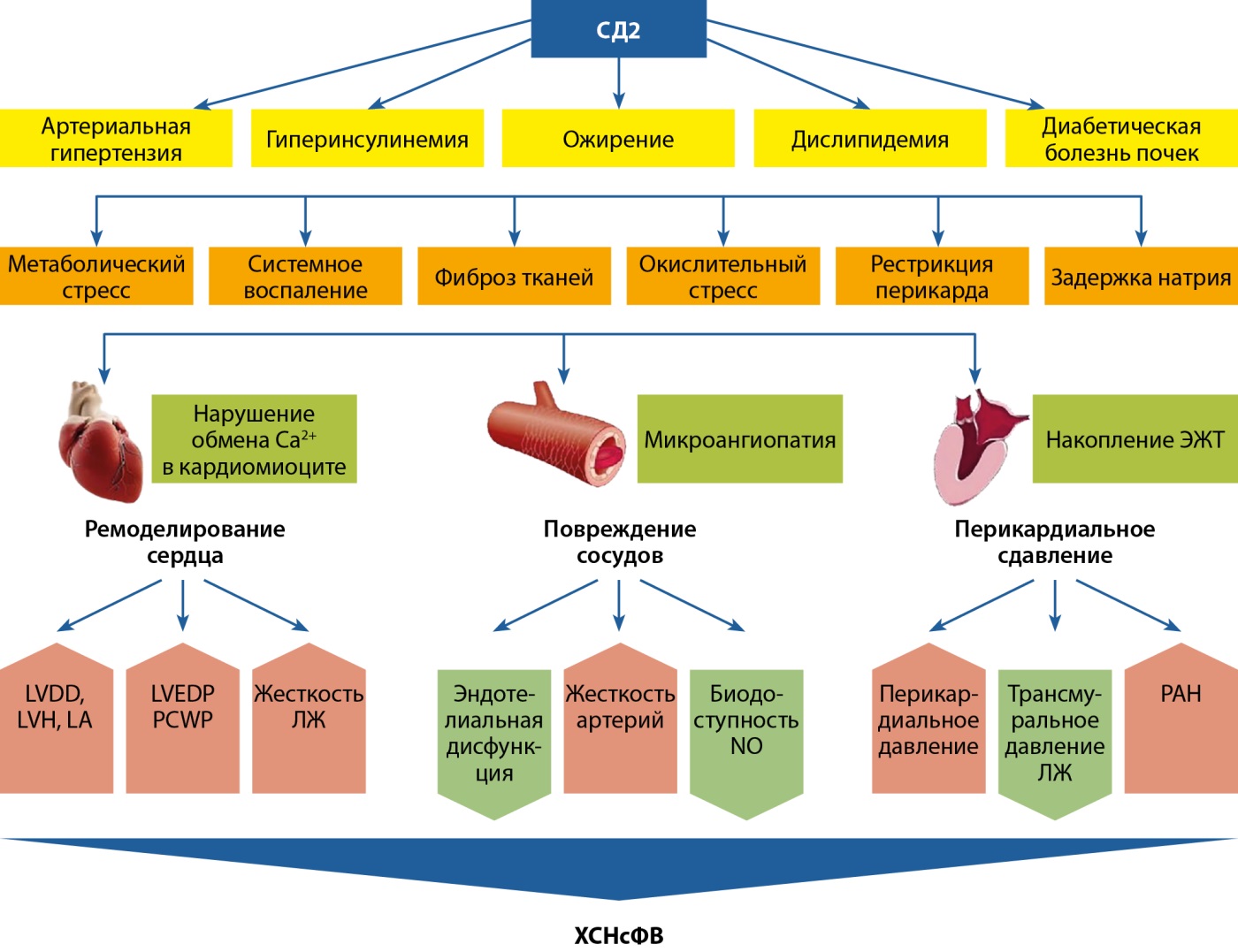
Рисунок 2. Метаболические нарушения, ведущие к развитию хронической сердечной недостаточности с сохраненной фракцией выброса. Адаптировано из [15].
Примечание: LV (ЛЖ) — left ventricular (левый желудочек); LVDD — LV diastolic dysfunction (диастолическая дисфункция ЛЖ); LVH — LV hypertrophy (гипертрофия ЛЖ); LA — left atrium (левое предсердие); LVEDP — LV end diastolic pressure (конечное диастолическое давление ЛЖ); PCWP — pulmonary capillary wedge pressure (давление заклинивания легочных капилляров); PAH — pulmonary arterial hypertension (легочная АГ); ЭЖК — эпикардиальная жировая ткань.
Таким образом, ДКМ, или ДЗМ, или ДДМ — это состояния, клинически проявляющиеся ХСНсФВ при СД, в патогенезе которых важное значение имеет гипергликемия, гиперинсулинемия и инсулинорезистентность.
НЮАНСЫ ДИАГНОСТИКИ ХСНСФВ
В консенсусе ESC указана важность своевременного выявления бессимптомных структурных и функциональных нарушений при ДЗМ [1]. Рекомендован регулярный контроль симптомов и/или клинических признаков ХСН у пациентов с СД2, определение уровня N-концевого фрагмента предшественника мозгового натрийуретического пептида (NT-proBNP) при подозрении на манифестацию ХСН, а также периодическая оценка риска развития ХСН с помощью валидированных шкал (WATCH-DM, TRS-HFDM), что полностью соответствует Рекомендациям ESC по лечению ССЗ у пациентов с СД от 2023 г. [51]. Алгоритмы специализированной медицинской помощи больным СД для диагностики ХСН также предлагают руководствоваться критериями постановки диагноза ESC [52]. Так, помимо оценки факторов риска ХСН (СД2, ожирение, АГ, пожилой возраст, фибрилляция предсердий), характерных особенностей клинического и физикального статуса больного, вышеупомянутые критерии включают обязательное определение NT-proBNP в крови и проведение ЭХО-КГ. Установление диагноза ХСН со сниженной ФВ (ФВ ЛЖ<40%) и ХСН с умеренно сниженной ФВ (40–49%) не требует пояснения, в отличие от ХСНсФВ (≥50%), диагностическая сложность которой определяется необходимостью расчета ряда переменных: соотношения скорости раннего диастолического наполнения ЛЖ и усредненной скорости подъема основания ЛЖ в раннюю диастолу (E/e’), индекса массы миокарда ЛЖ (ИММЛЖ) или индексированного объема левого предсердия (ИОЛП), пиковой скорости трикуспидальной регургитации (ТР), систолического давления в легочной артерии (СДЛА).
Экспертами Американской коллегии кардиологов одобрены два алгоритма, которые позволяют оценить наличие вероятности ХСНсФВ и объективизировать ее неинвазивным методом, доступным в ежедневной врачебной практике [53]. Их активное внедрение может помочь стандартизировать диагностику ХСНсФВ. Одна из таких шкал, имеющая аббревиатуру «H2FPEF», оценивает шесть параметров: возраст и ИМТ пациента, наличие одышки, фибрилляции предсердий (ФП) и легочной гипертензии (ЛГ), использование ≥2 антигипертензивных препаратов и давление наполнения ЛЖ, однако не учитывает уровень натрийуретических пептидов (НУП). Второй унифицированный диагностический алгоритм — «HFA-PEFF» — ранжирует по балльной системе функциональные и морфологические параметры, выявленные с помощью ЭХО-КГ, а также уровни НУП (NT-proBNP или BNP). Диагноз «ХСНсФВ» считается верифицированным при наборе не менее 5 баллов. Однако, не выявив повышенный уровень NT-proBNP, подтвердить диагноз по данной шкале затруднительно.
В случае сомнительного результата (2–4 балла по шкале «HFA-PEFF») или парадоксальной ситуации, когда у пациента при уровне NT-proBNP<125 пг/мл присутствует характерная симптоматика ХСН (NYHA ≥2 ФК), инфаркт миокарда (ИМ) и коронарное стентирование в анамнезе, и диагностический алгоритм «HFA-PEFF» рассчитывает невалидный результат (<5 баллов), рекомендуется использовать ряд более надежных, но трудоемких и часто малопригодных для рутинной практики методов обследования. К ним относятся: диастолическая стресс-ЭХО-КГ, стрейн ЛЖ, МРТ сердца с контрастированием (количественная оценка степени фиброза), инвазивный гемодинамический тест с физической нагрузкой (золотой стандарт диагностики ХСНсФВ) [53]. Стрейн, или глобальная продольная деформация ЛЖ, определяется при ЭХО-КГ и представляет собой относительно недавно внедренный маркер систолической дисфункции, снижение которого при ХСНсФВ выявляется в 50–60% случаев («продольное укорочение ЛЖ» <16%). Стрейн признан более чувствительным и объективным показателем систолической дисфункции, чем ФВ ЛЖ, и в ряде стран его рекомендуется измерять рутинно, в дополнение к ФВ у пациентов с подозрением на ХСНсФВ [54]. Тем не менее корректная оценка данного параметра требует определенного навыка от специалистов ЭХО-КГ и достаточного уровня осведомленности от лечащего врача, что затрудняет его активное интегрирование в повседневную работу.
Следует учитывать, что в покое диастолическая дисфункция определяется не у всех пациентов с ХСНсФВ [16], а NT-proBNP имеет особенности интерпретации и не может использоваться как мономаркер ХСН, о чем будет сказано ниже [55]. Таким образом, на сегодня вопросы патогенеза и диагностики ХСНсФВ остаются не до конца изученными.
Известно, что значительное количество пациентов с СД2 (~80%) имеют ожирение. Рассмотрим влияние ожирения на уровень НУП.
ИНТЕРПРЕТАЦИЯ НУП У ПАЦИЕНТОВ С ОЖИРЕНИЕМ
NT-proBNP может быть ложно занижен у пациентов с ожирением [56]. Во-первых, из-за увеличения объема эпикардиального жира возможно снижение высвобождения NT-proBNP миокардом в кровоток. Во-вторых, при НУО нельзя исключить гликирование предшественника NT-proBNP, вследствие чего ингибируется превращение прогормона в NT-proBNP и BNP [57]. Имеются данные, что НУП, секретируемые кардиомиоцитами, благоприятно влияют на распределение жира в организме, а дефицит НУП у пациентов с ожирением, в свою очередь, приводит к неблагоприятным последствиям — увеличению висцерального и, в частности, ЭПЖ [58]. Как известно, висцеральный жир ассоциирован с развитием гиперинсулинемии и усилением инсулинорезистентности, которая также способна ослаблять секрецию и активность НУП (рис. 3) [59].
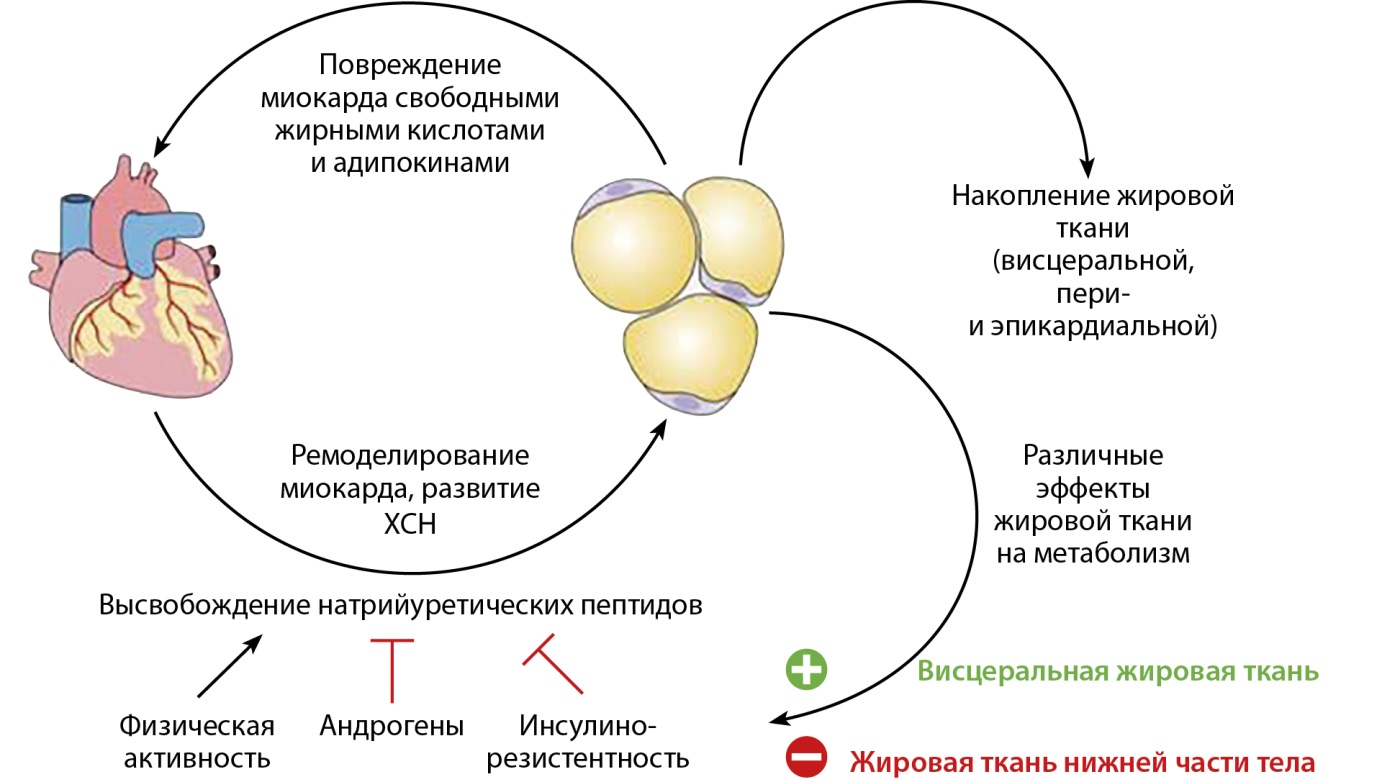
Рисунок 3. Модель, демонстрирующая петлю обратной связи между жировой тканью и тканью миокарда. Адаптировано из [59].
Интересен тот факт, что в ряде исследований предполагается двунаправленная взаимосвязь между ожирением и маркером BNP [60]. В нормальных условиях BNP, действуя через рецептор NPR-A (Natriuretic Peptide Receptor A, НУП-рецептор типа А), индуцирует передачу сигналов посредством цГМФ (циклического гуанозинмонофосфата), что приводит к липолизу в адипоцитах, митохондриальному биогенезу и окислению жиров в скелетных мышцах. Благодаря данным механизмам обеспечивается защита от ожирения и инсулинорезистентности. Предполагается, что низкий уровень BNP может способствовать снижению липолиза и, таким образом, влиять на развитие ожирения и инсулинорезистентности. Последнее, как упоминалось выше, приводит к подавлению выработки BNP кардиомиоцитами, формируя порочный круг. На молекулярном уровне данное явление проявляется изменением рецепторного соотношения NPR-A:NPR-C (Natriuretic Peptide Receptor С, НУП-рецептор типа С), в результате чего ухудшается передача сигналов NPR-A/цГМФ/cGK1 (cGMP-dependent protein kinase 1, cGMP-зависимая протеинкиназа 1). Описанный механизм изображен на рисунке 4.
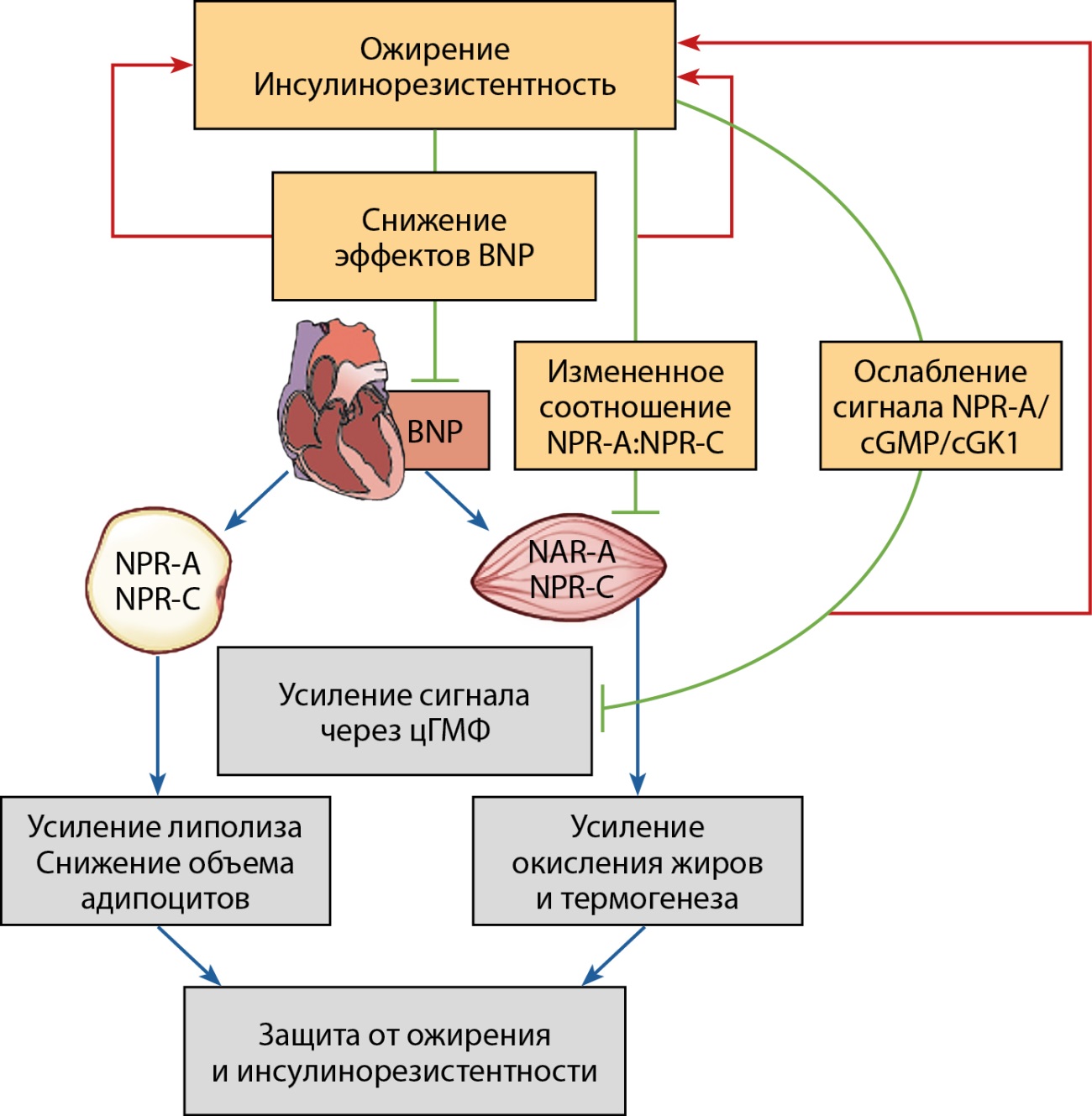
Рисунок 4. Двунаправленная связь между мозговым натрийуретическим пептидом и ожирением. Адаптировано из [60].
Примечание: Синие стрелки — физиологические эффекты BNP. Зеленые стрелки — тормозящее влияние ожирения и инсулинорезистентности на сигнальные пути BNP. Красные стрелки — результат недостатка эффектов BNP.
BNP — brain natriuretic peptide, мозговой натрийуретический пептид; NPR-A — Natriuretic Peptide Receptor A, НУП-рецептор типа А; NPR-С — Natriuretic Peptide Receptor С, НУП-рецептор типа С; cGMP — cyclic guanosine monophosphate, циклический гуанозинмонофосфат (цГМФ); cGK1 — cGMP-dependent protein kinase 1, cGMP-зависимая протеинкиназа 1.
Таким образом, единый консенсус о решении проблемы диагностики ХСНсФВ у пациентов с ожирением на сегодняшний день отсутствует. Принято считать, что, несмотря на обратную корреляцию между уровнем NT-proBNP и ИМТ, прогностическая ценность NT-proBNP сохраняется при любой степени ИМТ, хотя доказательная база у пациентов с ИМТ>40 кг/м² ограничена [55]. Тем не менее некоторые исследователи предлагают снижать пороговое значение NT-proBNP при ожирении, поскольку в клинических исследованиях с участием пациентов с ХСНсФВ показатели кардиореспираторной выносливости и диастолической дисфункции существенно не различались в группах с высоким и низким NT-proBNP (пороговый уровень — 125 пг/мл) [61]. При этом в одних работах предлагается снижать пороговое значение NT-proBNP пропорционально ИМТ, в других — на фиксированную долю от референса после определенного показателя ИМТ. ESC рекомендует снизить установленные пороговые концентрации НУП до 50% у пациентов с ожирением независимо от его степени [55]. Вопрос остается дискутабельным, в связи с чем требуются дальнейшие исследования в этой области.
МОДЕЛЬ КАРДИО-РЕНО-МЕТАБОЛИЧЕСКОГО СИНДРОМА — ПОНЯТИЕ СУБКЛИНИЧЕСКОЙ ХСН
В соответствии с рекомендациями президиума Американской кардиологической ассоциации от 2023 г., кардио-рено-метаболический синдром (КРМС) ассоциирован с ожирением, СД2, ХБП и ССЗ, включая ХСН, ФП, ИБС, инсульт и заболевания периферических артерий [62]. Разработана модель стадирования КРМС: стадия 0 — отсутствие факторов риска КРМС; 1 стадия — избыточное или дисфункциональное накопление жира (пациенты с избыточным весом или ожирением, абдоминальным ожирением, нарушенной толерантностью к глюкозе); 2 стадия — метаболические факторы риска (гипертриглицеридемия, АГ, СД2, метаболический синдром) и ХБП (неметаболического генеза); 3 стадия — субклинические ССЗ (в т.ч. субклиническая ХСН) или эквивалентные факторы риска ССЗ (высокий прогнозируемый риск ССЗ или ХБП стадии 4-5); 4 стадия — ССЗ (ИБС, ХСН, ФП, острое нарушение мозгового кровообращения, заболевания артерий нижних конечностей).
В рамках КРМС субклиническая ХСН диагностируется при выявлении аномальной структуры или функции сердца по данным визуализирующих методов исследования или при повышении ряда сердечных биомаркеров, к которым относится не только вышеупомянутый NT-proBNP, но и высокочувствительный (high-sensitivity, HS) тропонин Т≥14 нг/л у женщин и ≥22 нг/л у мужчин и HS-тропонин I≥10 нг/л у женщин и ≥12 нг/л у мужчин. Сочетание эхокардиографических структурно-функциональных изменений сердца и повышения сердечных биомаркеров ассоциировано с высоким риском прогрессирования субклинической ХСН (3 стадия КРМС) до симптоматической ХСН (4 стадия КРМС) [62].
ЗАКЛЮЧЕНИЕ
В настоящее время термины ДКМ и ХСНсФВ при СД2 зачастую приравниваются, поскольку в основе их развития лежат идентичные патологические процессы. Кроме того, научным сообществом предложены новые понятия, такие как «субклиническая ХСН» и «диабетическое заболевание миокарда», также отражающие систолическую и/или диастолическую дисфункцию ЛЖ у пациентов с СД2. Вероятно, термин «диабетическое заболевание миокарда» будет внедрен по аналогии с ХБП, определяя мультифакториальность патогенеза поражения сердца при СД. Несмотря на многообразие понятий, важно понимать, что данное состояние является серьезным осложнением СД и имеет неблагоприятный отдаленный прогноз в отношении госпитализации по поводу ХСН и смертности от сердечно-сосудистых причин. Однако в принятой на сегодня классификации осложнений СД ХСНсФВ или ДКМ нет.
Помимо назначения препаратов с кардионефропротективным действием, важно достигать строгого контроля уровня глюкозы в крови и регулярного мониторинга сердечной функции у больных СД с целью своевременной профилактики поражения миокарда. На наш взгляд, ДКМ имеет право на существование и емко отражает патологические процессы в сердце с учетом влияния нарушений углеводного обмена. Ранняя диагностика ДКМ у бессимптомных пациентов с СД позволит не допустить развития необратимых морфологических изменений в миокарде.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Маркова Т.Н. — концепция, дизайн и редактирование статьи; Овчинникова М.А., Шкодкина В.В., Беляева О.А. — написание текста, сбор и обработка иллюстративного материала. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Seferović PM, Paulus WJ, Rosano G, et al. Diabetic myocardial disorder. A clinical consensus statement of the Heart Failure Association of the ESC and the ESC Working Group on Myocardial & Pericardial Diseases. Eur J Heart Fail. 2024;26(9):1893-1903. doi: https://doi.org/10.1002/ejhf.3347
2. Shehadeh A, Regan TJ. Cardiac consequences of diabetes mellitus. Clin Cardiol. 1995;18(6):301-305. doi: https://doi.org/10.1002/clc.4960180604
3. Devereux RB, Roman MJ, Paranicas M, et al. Impact of diabetes on cardiac structure and function: the strong heart study. Circulation. 2000;101(19):2271-2276. doi: https://doi.org/10.1161/01.cir.101.19.2271
4. Borlaug BA. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2020;17(9):559-573. doi: https://doi.org/10.1038/s41569-020-0363-2
5. Regan TJ, Lyons MM, Ahmed SS, et al. Evidence for cardiomyopathy in familial diabetes mellitus. J Clin Invest. 1977;60(4):884-899. doi: https://doi.org/10.1172/JCI108843
6. Дедов И.И., Шестакова М.В., Викулова О.К., и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010–2022 гг. // Сахарный диабет. — 2023. — Т.26. — №2 — С.104-123. doi: https://doi.org/10.14341/DM13035
7. Seferović PM, Petrie MC, Filippatos GS, et al. Type 2 diabetes mellitus and heart failure: a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2018;20(5):853-872. doi: https://doi.org/10.1002/ejhf.1170
8. Gilca GE, Stefanescu G, Badulescu O, et al. Diabetic Cardiomyopathy: Current Approach and Potential Diagnostic and Therapeutic Targets. J Diabetes Res. 2017;2017:1310265. doi: https://doi.org/10.1155/2017/1310265
9. Yap J, Tay WT, Teng TK, et al. Association of Diabetes Mellitus on Cardiac Remodeling, Quality of Life, and Clinical Outcomes in Heart Failure With Reduced and Preserved Ejection Fraction. J Am Heart Assoc. 2019;8(17):e013114. doi: https://doi.org/10.1161/JAHA.119.013114
10. Preiss D, van Veldhuisen DJ, Sattar N, et al. Eplerenone and new-onset diabetes in patients with mild heart failure: results from the Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure (EMPHASIS-HF). Eur J Heart Fail. 2012;14(8):909-915. doi: https://doi.org/10.1093/eurjhf/hfs067
11. Regensteiner JG, Bauer TA, Reusch JE, et al. Cardiac dysfunction during exercise in uncomplicated type 2 diabetes. Med Sci Sports Exerc. 2009;41(5):977-984. doi: https://doi.org/10.1249/MSS.0b013e3181942051
12. Stahrenberg R, Edelmann F, Mende M, et al. Association of glucose metabolism with diastolic function along the diabetic continuum. Diabetologia. 2010;53(7):1331-1340. doi: https://doi.org/10.1007/s00125-010-1718-8
13. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38. UK Prospective Diabetes Study Group. BMJ. 1998;317(7160):703-713
14. Guria RT, Prasad MK, Mishra B, Marandi S, Kumar A, Dungdung A. Association of Glycosylated Haemoglobin (HbA1c) Level With Left Ventricular Diastolic Dysfunction in Patients With Type 2 Diabetes. Cureus. 2022;14(11):e31626. doi: https://doi.org/10.7759/cureus.31626
15. Abudureyimu M, Luo X, Wang X, et al. Heart failure with preserved ejection fraction (HFpEF) in type 2 diabetes mellitus: from pathophysiology to therapeutics. J Mol Cell Biol. 2022;14(5):mjac028. doi: https://doi.org/10.1093/jmcb/mjac028
16. Ernande L, Bergerot C, Rietzschel ER, et al. Diastolic dysfunction in patients with type 2 diabetes mellitus: is it really the first marker of diabetic cardiomyopathy?. J Am Soc Echocardiogr. 2011;24(11):1268-1275.e1. doi: https://doi.org/10.1016/j.echo.2011.07.017
17. An D, Rodrigues B. Role of changes in cardiac metabolism in development of diabetic cardiomyopathy. Am J Physiol Heart Circ Physiol. 2006;291(4):H1489-H1506. doi: https://doi.org/10.1152/ajpheart.00278.2006
18. Basta G, Schmidt AM, De Caterina R. Advanced glycation end products and vascular inflammation: implications for accelerated atherosclerosis in diabetes. Cardiovasc Res. 2004;63(4):582-592. doi: https://doi.org/10.1016/j.cardiores.2004.05.001
19. van Heerebeek L, Hamdani N, Handoko ML, et al. Diastolic stiffness of the failing diabetic heart: importance of fibrosis, advanced glycation end products, and myocyte resting tension. Circulation. 2008;117(1):43-51. doi: https://doi.org/10.1161/CIRCULATIONAHA.107.728550
20. Heymes C, Vanderheyden M, Bronzwaer JG, et al. Endomyocardial nitric oxide synthase and left ventricular preload reserve in dilated cardiomyopathy. Circulation. 1999;99(23):3009-3016. doi: https://doi.org/10.1161/01.cir.99.23.3009
21. De Geest B, Mishra M. Role of Oxidative Stress in Diabetic Cardiomyopathy. Antioxidants (Basel). 2022;11(4):784. doi: https://doi.org/10.3390/antiox11040784
22. Hitsumoto T. Skin Autofluorescence as a Predictor of First Heart Failure Hospitalization in Patients With Heart Failure With Preserved Ejection Fraction. Cardiol Res. 2020;11(4):247-255. doi: https://doi.org/10.14740/cr1097
23. Zhao Y, Quan E, Zeng T, et al. Type 1 diabetes, its complications, and non-ischemic cardiomyopathy: a mendelian randomization study of European ancestry. Cardiovasc Diabetol. 2024;23(1):31. doi: https://doi.org/10.1186/s12933-023-02117-7
24. Tay J, Thompson CH, Brinkworth GD. Glycemic Variability: Assessing Glycemia Differently and the Implications for Dietary Management of Diabetes. Annu Rev Nutr. 2015;35:389-424. doi: https://doi.org/10.1146/annurev-nutr-121214-104422
25. Aragno M, Mastrocola R, Medana C, et al. Oxidative stress-dependent impairment of cardiac-specific transcription factors in experimental diabetes. Endocrinology. 2006;147(12):5967-5974. doi: https://doi.org/10.1210/en.2006-0728
26. Gu J, Fan YQ, Zhang JF, Wang CQ. Association of hemoglobin A1c variability and the incidence of heart failure with preserved ejection fraction in patients with type 2 diabetes mellitus and arterial hypertension. Hellenic J Cardiol. 2018;59(2):91-97. doi: https://doi.org/10.1016/j.hjc.2017.08.001
27. Yokota S, Tanaka H, Mochizuki Y, et al. Association of glycemic variability with left ventricular diastolic function in type 2 diabetes mellitus. Cardiovasc Diabetol. 2019;18(1):166. doi: https://doi.org/10.1186/s12933-019-0971-5
28. Agashe S, Petak S. Cardiac Autonomic Neuropathy in Diabetes Mellitus. Methodist Debakey Cardiovasc J. 2018;14(4):251-256. doi: https://doi.org/10.14797/mdcj-14-4-251
29. Asbun J, Villarreal FJ. The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy. J Am Coll Cardiol. 2006;47(4):693-700. doi: https://doi.org/10.1016/j.jacc.2005.09.050
30. Lisco G, De Tullio A, Iovino M, et al. Dopamine in the Regulation of Glucose Homeostasis, Pathogenesis of Type 2 Diabetes, and Chronic Conditions of Impaired Dopamine Activity/Metabolism: Implication for Pathophysiological and Therapeutic Purposes. Biomedicines. 2023;11(11):2993. doi: https://doi.org/10.3390/biomedicines11112993
31. Dhananjayan R, Koundinya KS, Malati T, Kutala VK. Endothelial Dysfunction in Type 2 Diabetes Mellitus. Indian J Clin Biochem. 2016;31(4):372-379. doi: https://doi.org/10.1007/s12291-015-0516-y
32. Wieczór R, Gadomska G, Ruszkowska-Ciastek B, et al. Impact of type 2 diabetes on the plasma levels of vascular endothelial growth factor and its soluble receptors type 1 and type 2 in patients with peripheral arterial disease. J Zhejiang Univ Sci B. 2015;16(11):948-956. doi: https://doi.org/10.1631/jzus.B1500076
33. Анциферов М.Б., Лысенко М.А., Маркова Т.Н., и др. Эволюция распространенности кардиоренального континуума у госпитализированных пациентов с сахарным диабетом 2 типа в реальной клинической практике (опыт городской клинической больницы № 52 Департамента здравоохранения города Москвы) // Эндокринология: новости, мнения, обучение. — 2023. — Т. 12. — № 4. — C. 16-27. doi: https://doi.org/10.33029/2304-9529-2023-12-4-16-27
34. McGavock JM, Lingvay I, Zib I, et al. Cardiac steatosis in diabetes mellitus: a 1H-magnetic resonance spectroscopy study. Circulation. 2007;116(10):1170-1175. doi: https://doi.org/10.1161/CIRCULATIONAHA.106.645614
35. Sheikh AQ, Hurley JR, Huang W, et al. Diabetes alters intracellular calcium transients in cardiac endothelial cells. PLoS One. 2012;7(5):e36840. doi: https://doi.org/10.1371/journal.pone.0036840
36. Batista JPT, Faria AOV, Ribeiro TFS, Simões E Silva AC. The Role of Renin-Angiotensin System in Diabetic Cardiomyopathy: A Narrative Review. Life (Basel). 2023;13(7):1598. doi: https://doi.org/10.3390/life13071598
37. Юдаева А.Д., Стафеев Ю.С., Мичурина С.С., и др. Взаимодействие воспаления и инсулиновой резистентности: молекулярные механизмы в инсулинопродуцирующих и инсулинозависимых тканях // Сахарный диабет. — 2023. — T. 26. — № 1. — C. 75-81. doi: https://doi.org/10.14341/DM12981
38. Chen WJ, Greulich S, van der Meer RW, et al. Activin A is associated with impaired myocardial glucose metabolism and left ventricular remodeling in patients with uncomplicated type 2 diabetes. Cardiovasc Diabetol. 2013;12:150. doi: https://doi.org/10.1186/1475-2840-12-150
39. Tsai YL, Chou RH, Kuo CS, et al. Circulating Activin A Is a Surrogate for the Incidence of Diastolic Dysfunction and Heart Failure in Patients With Preserved Ejection Fraction. Circ J. 2019;83(7):1514-1519. doi: https://doi.org/10.1253/circj.CJ-18-0837
40. Swan J, Szabó Z, Peters J, et al. Inhibition of activin receptor 2 signalling ameliorates metabolic dysfunction-associated steatotic liver disease in western diet/L-NAME induced cardiometabolic disease. Biomed Pharmacother. 2024;175:116683. doi: https://doi.org/10.1016/j.biopha.2024.116683
41. Maculewicz E, Antkowiak B, Antkowiak O, et al. IL-6 Polymorphisms Are Not Related to Obesity Parameters in Physically Active Young Men. Genes (Basel). 2021;12(10):1498. doi: https://doi.org/10.3390/genes12101498
42. Sethi JK, Hotamisligil GS. Metabolic Messengers: tumour necrosis factor. Nat Metab. 2021;3(10):1302-1312. doi: https://doi.org/10.1038/s42255-021-00470-z
43. Ramesh P, Yeo JL, Brady EM, McCann GP. Role of inflammation in diabetic cardiomyopathy. Ther Adv Endocrinol Metab. 2022;13:20420188221083530. doi: https://doi.org/10.1177/20420188221083530
44. Nakamura K, Miyoshi T, Yoshida M, et al. Pathophysiology and Treatment of Diabetic Cardiomyopathy and Heart Failure in Patients with Diabetes Mellitus. Int J Mol Sci. 2022;23(7):3587. doi: https://doi.org/10.3390/ijms23073587
45. Kotha S, Plein S, Greenwood JP, Levelt E. Role of epicardial adipose tissue in diabetic cardiomyopathy through the lens of cardiovascular magnetic resonance imaging - a narrative review. Ther Adv Endocrinol Metab. 2024;15:20420188241229540. doi: https://doi.org/10.1177/20420188241229540
46. Bai J, Gao C, Li X, et al. Correlation analysis of the abdominal visceral fat area with the structure and function of the heart and liver in obesity: a prospective magnetic resonance imaging study. Cardiovasc Diabetol. 2023;22(1):206. doi: https://doi.org/10.1186/s12933-023-01926-0
47. Zhao X, Liu S, Wang X, et al. Diabetic cardiomyopathy: Clinical phenotype and practice. Front Endocrinol (Lausanne). 2022;13:1032268. doi: https://doi.org/10.3389/fendo.2022.1032268
48. Ghosh N, Chacko L, Bhattacharya H, et al. Exploring the Complex Relationship between Diabetes and Cardiovascular Complications: Understanding Diabetic Cardiomyopathy and Promising Therapies. Biomedicines. 2023;11(4):1126. doi: https://doi.org/10.3390/biomedicines11041126
49. Sharma U, Chakraborty M, Chutia D, Bhuyan NR. Cellular and molecular mechanisms, genetic predisposition and treatment of diabetes-induced cardiomyopathy. Curr Res Pharmacol Drug Discov. 2022;3:100126. doi: https://doi.org/10.1016/j.crphar.2022.100126
50. Ritchie RH, Abel ED. Basic Mechanisms of Diabetic Heart Disease. Circ Res. 2020;126(11):1501-1525. doi: https://doi.org/10.1161/CIRCRESAHA.120.315913
51. Marx N, Federici M, Schütt K, et al. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes [published correction appears in Eur Heart J. 2023 Dec 21;44(48):5060. doi: 10.1093/eurheartj/ehad774] [published correction appears in Eur Heart J. 2024 Feb 16;45(7):518. doi: 10.1093/eurheartj/ehad857]. Eur Heart J. 2023;44(39):4043-4140. doi: https://doi.org/10.1093/eurheartj/ehad192
52. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск. // Сахарный диабет. — 2023. — T.26. — №2S — C.1-157. doi: https://doi.org/10.14341/DM13042
53. Kittleson MM, Panjrath GS, Amancherla K, et al. 2023 ACC Expert Consensus Decision Pathway on Management of Heart Failure With Preserved Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2023;81(18):1835-1878. doi: https://doi.org/10.1016/j.jacc.2023.03.393
54. Smiseth OA, Morris DA, Cardim N, et al. Multimodality imaging in patients with heart failure and preserved ejection fraction: an expert consensus document of the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2022;23(2):e34-e61. doi: https://doi.org/10.1093/ehjci/jeab154
55. Mueller C, McDonald K, de Boer RA, et al. Heart Failure Association of the European Society of Cardiology practical guidance on the use of natriuretic peptide concentrations. Eur J Heart Fail. 2019;21(6):715-731. doi: https://doi.org/10.1002/ejhf.1494
56. Das SR, Drazner MH, Dries DL, et al. Impact of body mass and body composition on circulating levels of natriuretic peptides: results from the Dallas Heart Study. Circulation. 2005;112(14):2163-2168. doi: https://doi.org/10.1161/CIRCULATIONAHA.105.555573
57. Semenov AG, Postnikov AB, Tamm NN, et al. Processing of pro-brain natriuretic peptide is suppressed by O-glycosylation in the region close to the cleavage site. Clin Chem. 2009;55(3):489-498. doi: https://doi.org/10.1373/clinchem.2008.113373
58. Neeland IJ, Poirier P, Després JP. Cardiovascular and Metabolic Heterogeneity of Obesity: Clinical Challenges and Implications for Management. Circulation. 2018;137(13):1391-1406. doi: https://doi.org/10.1161/CIRCULATIONAHA.117.029617
59. Singh S, Pandey A, Neeland IJ. Diagnostic and prognostic considerations for use of natriuretic peptides in obese patients with heart failure. Prog Cardiovasc Dis. 2020;63(5):649-655. doi: https://doi.org/10.1016/j.pcad.2020.09.006
60. Madamanchi C, Alhosaini H, Sumida A, Runge MS. Obesity and natriuretic peptides, BNP and NT-proBNP: mechanisms and diagnostic implications for heart failure. Int J Cardiol. 2014;176(3):611-617. doi: https://doi.org/10.1016/j.ijcard.2014.08.007
61. Buckley LF, Canada JM, Del Buono MG, et al. Low NT-proBNP levels in overweight and obese patients do not rule out a diagnosis of heart failure with preserved ejection fraction. ESC Heart Fail. 2018;5(2):372-378. doi: https://doi.org/10.1002/ehf2.12235
62. Correction to: Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory From the American Heart Association. Circulation. 2024;149(13):e1023. doi: https://doi.org/10.1161/CIR.0000000000001241
Об авторах
Т. Н. МарковаРоссия
Маркова Татьяна Николаевна - д.м.н., профессор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
М. А. Овчинникова
Россия
Овчинникова Маргарита Александровна – аспирант.
127473, Москва, ул. Делегатская, д. 20, стр. 1
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. В. Шкодкина
Россия
Шкодкина Виктория Витальевна - клинический ординатор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
О. А. Беляева
Россия
Беляева Ольга Александровна - клинический ординатор.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Механизмы, лежащие в основе дисфункции миокарда при сахарном диабете 2 типа. Адаптировано из [1]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(651KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Метаболические нарушения, ведущие к развитию хронической сердечной недостаточности с сохраненной фракцией выброса. Адаптировано из [15]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(953KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Модель, демонстрирующая петлю обратной связи между жировой тканью и тканью миокарда. Адаптировано из [59]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(477KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Двунаправленная связь между мозговым натрийуретическим пептидом и ожирением. Адаптировано из [60]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(504KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Маркова Т.Н., Овчинникова М.А., Шкодкина В.В., Беляева О.А. Диабетическая кардиомиопатия: дефиниция, право на существование. Сахарный диабет. 2025;28(4):384-393. https://doi.org/10.14341/DM13250
For citation:
Markova T.N., Ovchinnikova M.A., Shkodkina V.V., Belyaeva O.A. Diabetic cardiomyopathy: definition, right to exist. Diabetes mellitus. 2025;28(4):384-393. (In Russ.) https://doi.org/10.14341/DM13250

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































