Перейти к:
Спасение нижних конечностей у больных сахарным диабетом: невозможное возможно
https://doi.org/10.14341/DM13245
Аннотация
Поражения нижних конечностей при сахарном диабете — сложная и актуальная проблема современной медицины. Высокая распространенность сахарного диабета (СД), значительные трудности своевременной диагностики, дифференциальной диагностики и выбора лечебной тактики, позволяющей сохранить опорную функцию конечности, определяют сложности в ведении лиц с нарушением углеводного обмена. За последние десятилетия произошли значимые изменения в структуре оказания специализированной медицинской помощи пациентам с синдромом диабетической стопы, что позволило значимо снизить количество высоких ампутаций, улучшить качество и продолжительность жизни пациентов. В статье представлены результаты многолетнего опыта отделения диабетической стопы ФГБУ «НМИЦ эндокринологии» в лечении данной категории больных.
Ключевые слова
Для цитирования:
Галстян Г.Р., Артемова Е.В., Бардюгов П.С., Бондаренко О.Н., Джемилова З.Н., Доронина Л.П., Егорова Д.Н., Зайцева Е.Л., Митиш В.А., Сергеева С.В., Ситкин И.И., Токмакова А.Ю., Ярославцева М.В., Шестакова М.В. Спасение нижних конечностей у больных сахарным диабетом: невозможное возможно. Сахарный диабет. 2025;28(1):56-67. https://doi.org/10.14341/DM13245
For citation:
Galstyan G.R., Artemova E.V., Bardiugov P.S., Bondarenko O.N., Dzhemilova Z.N., Doronina L.P., Egorova D.N., Zaitseva E.L., Mitish V.A., Sergeeva S.V., Sitkin I.I., Tokmakova A.Y., Yaroslavceva M.V., Shestakova M.V. Lower extremity limb salvage in diabetic patients: the impossible is possible. Diabetes mellitus. 2025;28(1):56-67. (In Russ.) https://doi.org/10.14341/DM13245
Поражения нижних конечностей при сахарном диабете (СД) — сложная и актуальная проблема современной медицины, для решения которой необходимы совместные усилия многих специалистов (эндокринологов, хирургов, ангиохирургов, ортопедов-травматологов, организаторов здравоохранения и т.д.). Сложность задачи определяется как высокой распространенностью самого СД, так и значительными трудностями своевременной диагностики, дифференциальной диагностики и выбора лечебной тактики, позволяющей сохранить опорную функцию конечности у лиц с нарушением углеводного обмена.
Согласно современным данным, синдром диабетической стопы (СДС) (инфекция, язва и/или деструкция глубоких тканей, связанная с неврологическими нарушениями и/или снижением магистрального кровотока в артериях нижних конечностей различной степени тяжести) [1] регистрируется у 15–25% всех больных диабетом. По данным Базы клинико-эпидемиологического мониторинга СД на территории Российской Федерации (РФ) [2], частота СДС в российской популяции больных составляет 2,9% среди пациентов СД 1 типа (СД1) и 1,3% среди лиц с СД 2 типа (СД2).
СДС — основная причина ампутаций нижних конечностей при диабете, которые производятся в 17–45 раз чаще, чем у лиц без нарушения углеводного обмена. Это может приводить к ранней инвалидизации и повышению уровня летальности. В России частота ампутаций варьирует от 0,76 до 8,2 случая на 1000 больных (в среднем по стране 6,4 на 1000 больных СД). По данным Базы клинико-эпидемиологического мониторинга СД на территории РФ, в 2022 г. высокие ампутации конечности были выполнены у 1% больных СД1 и 0,7% при СД2 [2]. Эти данные не могут считаться абсолютно достоверными, т.к. пациенты с СД и тяжелыми поражениями нижних конечностей зачастую проходят лечение в хирургических клиниках под другими кодами МКБ-10 (флегмона, гангрена, остеомиелит и т.д.).
ИСТОРИЯ РАЗВИТИЯ СИСТЕМЫ МЕДИЦИНСКОЙ ПОМОЩИ ПАЦИЕНТАМ С СИНДРОМОМ ДИАБЕТИЧЕСКОЙ СТОПЫ
До конца ХХ в. лечением пациентов с диабетом и поражениями нижних конечностей занимались в основном хирургические клиники. Так, в нашей стране большой опыт оказания помощи больным СД с гнойными инфекциями мягких тканей нижних конечностей был накоплен сотрудниками отделения ран и раневых инфекций Института хирургии им. А.В. Вишневского [3]. Специалисты отделения хирургии сосудов того же института начали достаточно широко использовать метод дистального шунтирования аутовеной для коррекции ишемии конечности у лиц с диабетом [4].
Во многих европейских странах еще в первой половине прошлого века были организованы и до настоящего времени успешно функционируют Foot Hospital — амбулаторные медицинские учреждения, оказывающие помощь больным с различными поражениями конечностей, в том числе на фоне диабета. В подобных клиниках работают специалисты со средним медицинским образованием (медицинские сестры, подиатры). Задача таких госпиталей — решение широкого спектра проблем нижних конечностей (уход за стопами, лечение длительно незаживающих раневых дефектов, изготовление различных ортопедических корректоров и т.д.).
Несмотря на очевидные успехи в решении сложной задачи предотвращения ампутаций у лиц с диабетом, до начала 90-х годов прошлого века отсутствовала единая стратегия оказания специализированной помощи при этом эндокринном заболевании и его поздних микро- и макрососудистых осложнениях. Принципиальных изменений в этой области медицины удалось достичь благодаря Сент-Винсенской декларации. Данный документ был разработан по инициативе Международной федерации диабета (IDF) и ООН и принят в 1989 г. [5]. Среди основных целей декларации было и снижение риска потери конечности вследствие осложнений диабета на 50% в течение ближайших 5 лет.
Первый анализ результатов реализации Сент-Винсенской декларации, к которой присоединилось подавляющее большинство европейских стран, в том числе Россия, показал, что ряду государств удалось достичь поставленных задач. Во многом это объяснялось модернизацией системы оказания специализированной медицинской помощи больным СД (создание диабетологических центров, активное использование структурированных программ обучения пациентов, появление новых инсулинов и сахароснижающих препаратов, средств самоконтроля и т.д.), а также прогрессом медицинских технологий, разработкой и активным внедрением методов сосудистой и рентгенэндоваскулярной хирургии в арсенал средств, используемых и в комплексной терапии пациентов с поражениями нижних конечностей.
Прогресс в изучении и лечении СД и его осложнений в нашей стране привел к созданию в 1989 г. Института диабета в составе Эндокринологического научного центра РАМН СССР. В 1993 г. было организовано отделение диабетической стопы.
Новый стимул к совершенствованию помощи пациентам с СД и его осложнениями был дан 7 октября 1996 г., когда правительством РФ была утверждена Федеральная целевая программа (ФЦП) «Сахарный диабет». Основными задачами ФЦП были организация доступной и высокопрофессиональной диабетологической службы на всей территории страны, основанной на единых стандартах оказания медицинской помощи больным СД с целью снижения заболеваемости, инвалидизации и смертности населения РФ от СД и его осложнений. В рамках выполнения этой программы в РФ стали открываться амбулаторные кабинеты диабетической стопы и организовываться профильные отделения на базе областных и краевых клинических больниц [6].
Повышению качества медицинский помощи пациентам с СДС способствует и широкое внедрение в практику специализированных кабинетов и отделений клинических рекомендаций по диагностике, лечению и профилактике этого осложнения диабета. Впервые клинические рекомендации по лечению СДС были разработаны Международной рабочей группой по Диабетической стопе (International Work Group of Diabetic Foot, IWGDF) в 1999 г. Рекомендации базировались на результатах мультицентровых исследований и мнениях экспертов в данной области медицины. Этот документ регулярно обновляется и актуализируется, последняя редакция была выполнена в 2023 г. [7].
В 2022 г. раздел «Синдром диабетической стопы» впервые был включен в отечественные клинические рекомендации «Сахарный диабет 1 типа у взрослых» и «Сахарный диабет 2 типа у взрослых». Клинические рекомендации являются основой для разработки стандартов оказания помощи, которые регламентируют экономические и организационные аспекты здравоохранения, в том числе в разделе помощи больным диабетом [8].
ПАТОГЕНЕЗ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ
В последние годы продолжаются исследования возможных патогенетических механизмов развития поражений мягких тканей и костных структур нижних конечностей у лиц с нарушенным углеводным обменом, а также поиск возможных предикторов СДС.
Известно, что в основе формирования данного осложнения лежит группа факторов. В первую очередь, это нарушение периферической иннервации (диабетическая полинейропатия) и артериального кровотока [9–11]. Диабетическая периферическая нейропатия (ДПН) — комплекс клинических и субклинических синдромов, каждый из которых характеризуется диффузным поражением периферических и/или автономных нервных волокон в результате СД. Исследования показали, что частота и выраженность нейропатии напрямую зависит от длительности течения СД. Результаты выполненных работ свидетельствуют, что даже у молодых лиц с СД1 поражение периферических нервов выявляется в 13% случаев при длительности заболевания более 10 лет, тогда как при длительности болезни менее 10 лет этот показатель не превышает 5%. Аналогичная разница и при СД2 — 36% при длительности заболевания более 10 лет и 19% при длительности диабета менее 10 лет [12].
Заболевания артерий нижних конечностей у пациентов с СД рассматриваются в рамках атеросклеротических сердечно-сосудистых заболеваний. Клинически значимым поражением артерий нижних конечностей в зарубежной литературе обозначается как заболевание периферических артерий (ЗПА) — окклюзирующее поражение артерий атеросклеротического генеза протяженностью от аорты до стопы с клиническими симптомами и/или признаками артериального поражения при неинвазивной или инвазивной сосудистой оценке, приводящее к нарушению кровообращения в одной или нескольких конечностях [13].
Окклюзирующие поражения периферических артерий при СД являются одной из основных причин развития хронических раневых дефектов мягких тканей и гангрены стопы [14]. По сравнению со здоровой популяцией, как мужчины, так и женщины с нарушенным углеводным обменом, имеют повышенный риск ампутации конечности. У пациентов с ишемической и нейроишемической формой СДС распространенность окклюзирующего поражения артерий нижних конечностей составляет 50% [15]. Современные медицинские технологии позволяют достаточно успешно лечить ЗПА у пациентов с СД, при условии своевременного обращения пациента за специализированной медицинской помощью [13][16].
ПРИНЦИПЫ ЛЕЧЕНИЯ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ
Основными принципами успешного лечения ран при СД принято считать устранение избыточного давления в области поражения, восстановление артериального кровотока, контроль инфекции, компенсацию углеводного обмена и сопутствующих заболеваний, местное лечение раневых дефектов [9][17]. Важнейшими условиями профилактики рецидивов является терапевтическое обучение пациентов и обеспечение их адекватной обувью [17–20].
ДИАГНОСТИКА И ЛЕЧЕНИЕ ЗАБОЛЕВАНИЯ АРТЕРИЙ НИЖНИХ КОНЕЧНОСТЕЙ
Важнейшая роль в лечении СДС принадлежит восстановлению артериального кровоснабжения пораженной конечности. Показанием к проведению реваскуляризации у пациентов с СДС является наличие критической ишемии нижней конечности — постоянная боль в покое, требующая регулярного приема анальгетиков в течение двух недель и более, и/или наличие трофической язвы или гангрены пальцев или стопы, возникшей на фоне хронической артериальной недостаточности [21]. В последнее десятилетие активно вводится новый термин — хроническая ишемия, угрожающая потерей нижней конечности (ХИУПК), который в своей основе предполагает стратификацию риска потери конечности, в зависимости от степени язвенного поражения, тяжести ишемии и инфекционного поражения нижних конечностей [16]. Согласно данным Базы клинико-эпидемиологического мониторинга СД на территории РФ, у 40% больных СД1 и более чем у 50% больных СД2 имеет место поражение периферических артерий с развитием критической ишемии нижних конечности (КИНК) с тяжелыми трофическими и гнойно-некротическими изменениями мягких тканей стопы [22]. Согласно данным литературы, своевременное выполнение реваскуляризирующих операций на артериях нижних конечностей у больных с нарушенным углеводным обменом позволяет снизить риск высокой ампутации в 10–12 раз [23]. В связи с этим особую актуальность приобретает проблема максимально ранней диагностики нарушений кровоснабжения конечностей. Однако ввиду специфического поражения артерий нижних конечностей и особенностей клинического течения КИНК у пациентов с СД, стандартные методы диагностики, позволяющие определить тяжесть ишемии нижних конечностей (оценка систолического лодыжечного и пальцевого давления, ЛПИ, ППИ, транскутанная оксиметрия), имеют ограничения к применению у данной группы пациентов, а также сложности в интерпретации результатов исследования [24].
Перспективным направлением в решении проблем диагностики ишемии нижних конечностей можно считать метод флуоресцентной ангиографии (ФАГ) с использованием индоцианина зеленого. Впервые в РФ на базе отделения диабетической стопы ФГБУ «НМИЦ эндокринологии» Минздрава России совместно с институтом общей физики им А.М. Прохорова, лабораторией лазерной биоспектрометрии применен метод флуоресцентной ангиографии с индоцианином зеленым с целью оценки микроциркуляции мягких тканей нижних конечностей у пациентов с диабетом [25] и разработан алгоритм диагностики пациентов с СД и ХИУПК. Метод был запатентован в 2020 г. [26].
Наиболее эффективным методом лечения КИНК в настоящее время является реваскуляризация [13][27]. Среди подобных вмешательств у пациентов с КИНК выделяют открытые сосудистые реконструктивные операции, эндоваскулярные вмешательства и гибридные операции. Выбор того или иного метода восстановления кровотока, имеющего свои преимущества и недостатки, является важной клинической проблемой [24]. К открытым хирургическим методам реваскуляризации относят артериальное шунтирование и эндартерэктомию; эндоваскулярная хирургия включает ангиопластику, стентирование и/или атерэктомию. Гибридная реваскуляризация применяется чаще при многоуровневом поражении. Чрескожная транслюминальная баллонная ангиопластики (ЧТБА) является в настоящее время основным методом лечения КИНК при СД и относится к вмешательствам среднего хирургического риска (1–5%) [24]. Данный способ восстановления кровотока характеризуется малой травматичностью, хорошей переносимостью, достаточно высокой эффективностью и возможностью повторного проведения многоуровневых вмешательств, включая артерии голени и стопы. Среди недостатков ЧТБА отмечают высокую частоту рестенозов вследствие пролиферации клеток гладкой мускулатуры сосудов и миоинтимальной гиперплазии. В последнее время для лечения КИНК стали применять стенты с лекарственным покрытием с целью уменьшения развития гиперплазии неоинтимы.
Атерэктомия является еще одним способом эндоваскулярного лечения ишемии нижних конечностей у пациентов с СД. Устройства первого поколения не показали хороших результатов по сравнению с ЧТБА, кроме того, технические сложности и высокая стоимость вмешательства препятствовали широкому внедрению метода [28]. Развитие данной технологии привело к созданию устройств для вмешательств на сосудах нижних конечностей диаметром 3–7 мм, что значительно повысило эффективность лечения. Еще одним вариантом эндоваскулярной атерэктомии является лазерная атерэктомия, при которой используется источник света низкой энергии с длиной волны 308 нм, проходящего через оптоволоконный катетер и разрушающего атеросклеротическую бляшку. В настоящее время лазерная атерэктомия остается достаточно дорогой технологией, не имеющей доказательств преимущества перед ЧТБА [29].
По результатам, представленным в зарубежных публикациях, у больных СД и КИНК частота рестенозов после ЧТБА была небольшой (6,4%, 7,3%, 9,6%), что объясняется относительно небольшим числом пациентов с выраженными микрососудистыми осложнениями диабета, в первую очередь диабетической нефропатией на стадии терминальной почечной недостаточности, получающих заместительную почечную терапию, включенных в эти исследования [30][31]. Напротив, в недавно опубликованной работе, целью которой было установление частоты клинических рецидивов КИНК при СД после выполнения ЧТБА [32], показано, что в повторном проведении ЧТБА вследствие клинического рецидива КИНК нуждались 24,3% больных, а среднее время до повторной ЧТБА составляло 3,5±0,64 мес (наблюдали 304 больных с СД после ЧТБА в течение 12,5±6,6 мес, при этом 31,4% пациентов получали заместительную почечную терапию). Группа больных с повторной реваскуляризацией имела достоверно более низкую скорость заживления раны, более высокую частоту рецидива язвенно-некротического дефекта, высокую частоту ампутаций и смерти.
В работе, выполненной в отделении диабетической стопы ФГБУ «НМИЦ эндокринологии» [33] проведен анализ отдаленных результатов ЧТБА и клинических исходов при СД и хронической болезни почек (ХБП). Было показано, что больные с терминальной стадией ХБП, получающие терапию программным гемодиализом, имеют высокую частоту развития КИНК, причем особенности поражения сосудов (медиакальциноз, диффузное поражение) и проведение сеансов гемодиализа способствуют худшим результатам ЧТБА. Сравнивались результаты лечения 48 больных, имеющих расчетную скорость клубочковой фильтрации (рСКФ)>60 мл/мин/1,73 м² и 46 пациентов с рСКФ<60 мл/мин/1,73 м². Выявлено, что у больных при рСКФ<60 мл/мин/1,73 м² первичная проходимость артерий нижних конечностей была значительно меньше (лишь 39%), а количество повторных эндоваскулярных вмешательств — значительно больше, чем в группе больных при рСКФ>60 мл/мин/1,73 м². Причем в большинстве случаев развитие реокклюзий целевых сосудов было отмечено в течение первого года наблюдения. Сохранение конечности было достигнуто в 98,2% случаев при рСКФ>60 мл/мин/1,73 м² и в 74% случаев при рСКФ<60 мл/мин/1,73 м². После выполнения ЧТБА у больных с ХБП выявлялась высокая частота рестенозов, что требовало повторных эндоваскулярных вмешательств. Результат ЧТБА артерий голени и стопы пациента с СД представлен на рис. 1.
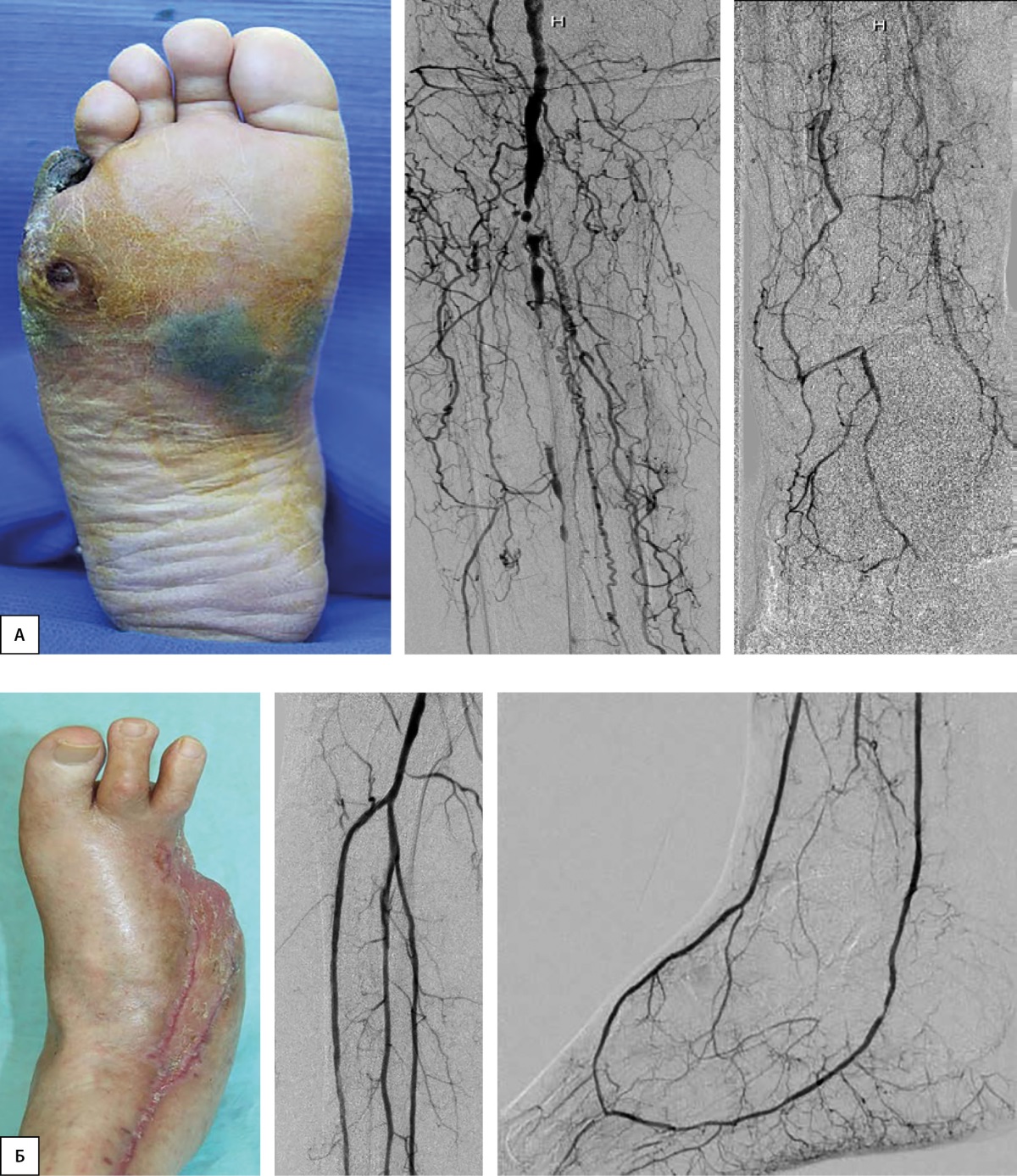
Рисунок 1. Результат комплексного лечения пациента с нейроишемической формой синдрома диабетической стопы с использованием чрескожной транслюминальной баллонной ангиопластики артерий голени и стопы.
А — вид конечности и ангиограммы исходно; Б — клинический и ангиографический результат лечения.
В настоящее время остается дискутабельным вопрос сравнения эффективности эндоваскулярной реваскуляризации и шунтирования при ишемии конечности. В одном из немногих рандомизированных исследований, где пациенты наблюдались в течение 5 лет и более, показано, что частота ампутаций конечностей и качество жизни пациентов после шунтирующих операций не отличались от таковых после ЧТБА, однако расходы на шунтирование были на треть выше, чем на эндоваскулярные вмешательства [34].
Гибридная реваскуляризация чаще применяется при многоуровневом поражении, при этом сочетание хирургических вмешательств и эндоваскулярных процедур используется с целью снижения рисков, возникающих вследствие инвазивных вмешательств.
Внедрение современных технологий в лечение сложных анатомических моделей поражений дистального артериального русла с применением минимально инвазивных подходов привело к предпочтению эндоваскулярного подхода у пациентов с КИНК и СД, в то время как шунтирование остается второстепенной альтернативой. Однако имеющиеся в настоящее время доказательства указывают на необходимость применения алгоритма селективной реваскуляризации на основании клинических и анатомических особенностей заболеваний артерий нижних конечностей.
ДИАБЕТИЧЕСКАЯ НЕЙРООСТЕОАРТРОПАТИЯ
Диабетическая нейропатия, являющаяся наиболее распространенным осложнением СД, — причина развития и прогрессирования нейроостеоартропатии (ДНОАП) [35][36]. Несмотря на длительность изучения этой патологии, поражающей кости и суставы нижних конечностей у лиц с СД [11][37][38], до сегодняшнего дня существуют значительные трудности в ранней диагностике, выборе терапевтической тактики и профилактике этого осложнения, что ведет к прогрессивному росту числа пациентов с выраженными деформациями нижних конечностей, нарушениями их опорной функции и формированием обширных раневых дефектов, угрожающих ампутацией.
По данным литературы, частота ДНОАП в популяции пациентов с диабетом составляет около 0,16% [39], а среди больных диабетической нейропатией может достигать 29%. Сведения о распространенности этого осложнения диабета зависят от метода диагностики поражения костно-суставной системы и длительности заболевания диабетом исследуемой группы. Если диагностический поиск основывается лишь на клинической картине, то выявляемость этого осложнения может составить около 6%, тогда как при использовании инструментальных методик ДНОАП может диагностироваться у 75% обследованных [40].
Согласно современным международным и отечественным клиническим рекомендациям, комплексная терапия пациентов с ДНОАП включает достижение и поддержание индивидуальных целевых показателей углеводного и липидного обменов, иммобилизацию пораженных суставов с помощью индивидуальной разгрузочной повязки или ортеза (в активной стадии ДНОАП), использование сложной ортопедической обуви (в неактивной стадии осложнения). Однако даже использование адекватной обуви не всегда позволяет добиться снижения избыточного нагрузочного давления в зонах пролабирования костных фрагментов на подошвенной поверхности и предотвратить формирование и рецидивирование хронических раневых дефектов. С этой целью в последние годы активно разрабатываются и внедряются в клиническую практику методики хирургической ортопедической коррекции деформаций стопы при ДНОАП.
На сегодняшний день в практику отделения диабетической стопы ФГБУ «НМИЦ эндокринологии» вошел ряд хирургических методик, позволяющих достаточно эффективно скорректировать уже сформировавшиеся деформации и предотвратить образование хронических раневых дефектов, способных привести к потере конечности.
В 2007 г. началось активное внедрение метода резекции пролабирурющих костей среднего отдела стопы с последующей пластикой дефекта местными тканями [41][42]. До настоящего времени выполнено уже около 200 таких вмешательств. При проведении оценки отдаленных результатов этого вида лечения путем анкетирования было установлено, что рецидив деформации развился только у 8% ранее прооперированных и только в тех случаях, когда отмечалась низкая приверженность соблюдению врачебных рекомендаций. Ни одному из пациентов спустя 10 лет после выполнения реконструктивного оперативного вмешательства не проводилась ампутация конечности. Это свидетельствует о высокой эффективности данного вида хирургического вмешательства при деформациях среднего отдела стопы вследствие ДНОАП [43]. Клинический результат такого вмешательства представлен на рис. 2.
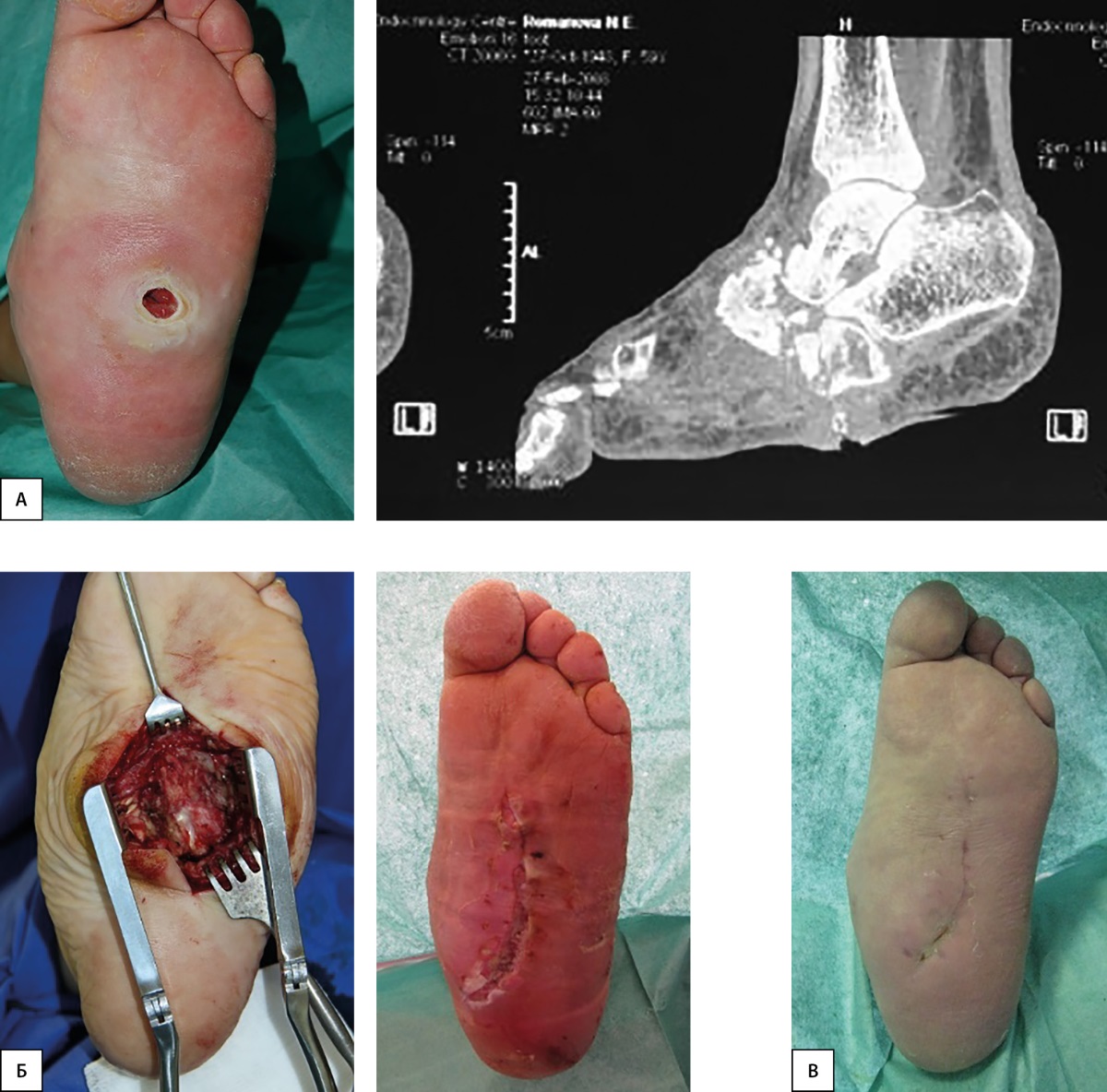
Рисунок 2. Результат хирургической коррекции деформации среднего отдела стопы у пациента с нейроостеоартропатией.
А — вид стопы и результат мультиспиральной компьютерной томографии до лечения; Б — этапы операции; В — результат проведенного вмешательства.
Очень непростая клиническая ситуация — деформация голеностопного сустава как исход ДНОАП. Анализ современной медицинской литературы показывает, что все большую распространенность получают ортопедические корригирующие вмешательства даже в активной стадии ДНОАП [35][36].
Еще более сложную проблему представляют собой грубые деформации по типу «стопа-качалка» с пролапсом продольного свода стопы и деформацией области голеностопного сустава как исход ДНОАП. Данный вид нарушения архитектоники и биомеханики дистального сегмента нижних конечностей служит причиной не только появления язвенных дефектов в области повышенного механического воздействия «на высоте деформации», но и нарушения опороспособности конечности. Именно такие проявления запущенной ДНОАП чаще всего являются показанием для высокой ампутации. Для этой группы пациентов методом выбора хирургического лечения являются реконструктивные ортопедические операции (РОО) с применением металлоостеосинтеза. Это направление хирургического лечения ДНОАП, по зарубежным данным, применяется более 25 лет, становясь все более распространенным по мере накопления хирургического опыта и развития технологий [44–46].
Реконструктивные оперативные вмешательства на костно-суставном аппарате с использованием металлоостеосинтеза и аппарата внешней фиксации в ФГБУ «НМИЦ эндокринологии» выполняются с лета 2020 г. За 4 года выполнено более 130 таких операций не менее чем в половине случаев в качестве альтернативы высокой ампутации, прибегнуть к которой все-таки пришлось у одного пациента. Многим пациентам с угрозой ампутации удалось не только сохранить опорную конечность, но и минимизировать потерю функции и активности, вернуть работоспособность за счет применения остеозамещающих технологий (за счет формирования дистракционного регенерата), открытие которых является отечественным научным продуктом в области травматологии-ортопедии, и связано с деятельностью Г.А. Илизарова.
Показания для реконструктивных вмешательств на костно-суставном аппарате были следующие: наличие нейропатического язвенного дефекта, не поддающегося консервативной терапии, нарушение опороспособности конечности. Относительным показанием можно считать необходимость применения индивидуальных сложных ортопедических изделий (тутор, обувь), что снижает качество жизни. Объективным критерием выбора данного направления хирургического лечения является степень выраженности деформации.
В мире нет единого подхода к выбору метода хирургической костной фиксации [47][48]. В ФГБУ «НМИЦ эндокринологии» применяется метод внешней фиксации при помощи аппарата Илизарова как наиболее оправданный способ стабильного остеосинтеза в условиях высокого риска гнойных осложнений, который избавляет пациента от необходимости технически сложного удаления внутренних металлоконструкций, часто самих по себе являющихся причиной имплант-ассоциированных осложнений. Кроме того, широчайшие возможности, доступность аппарата Илизарова позволяют считать этот метод предметом выбора для описываемой категории больных [49]. Результаты такого лечения представлены на рис. 3.
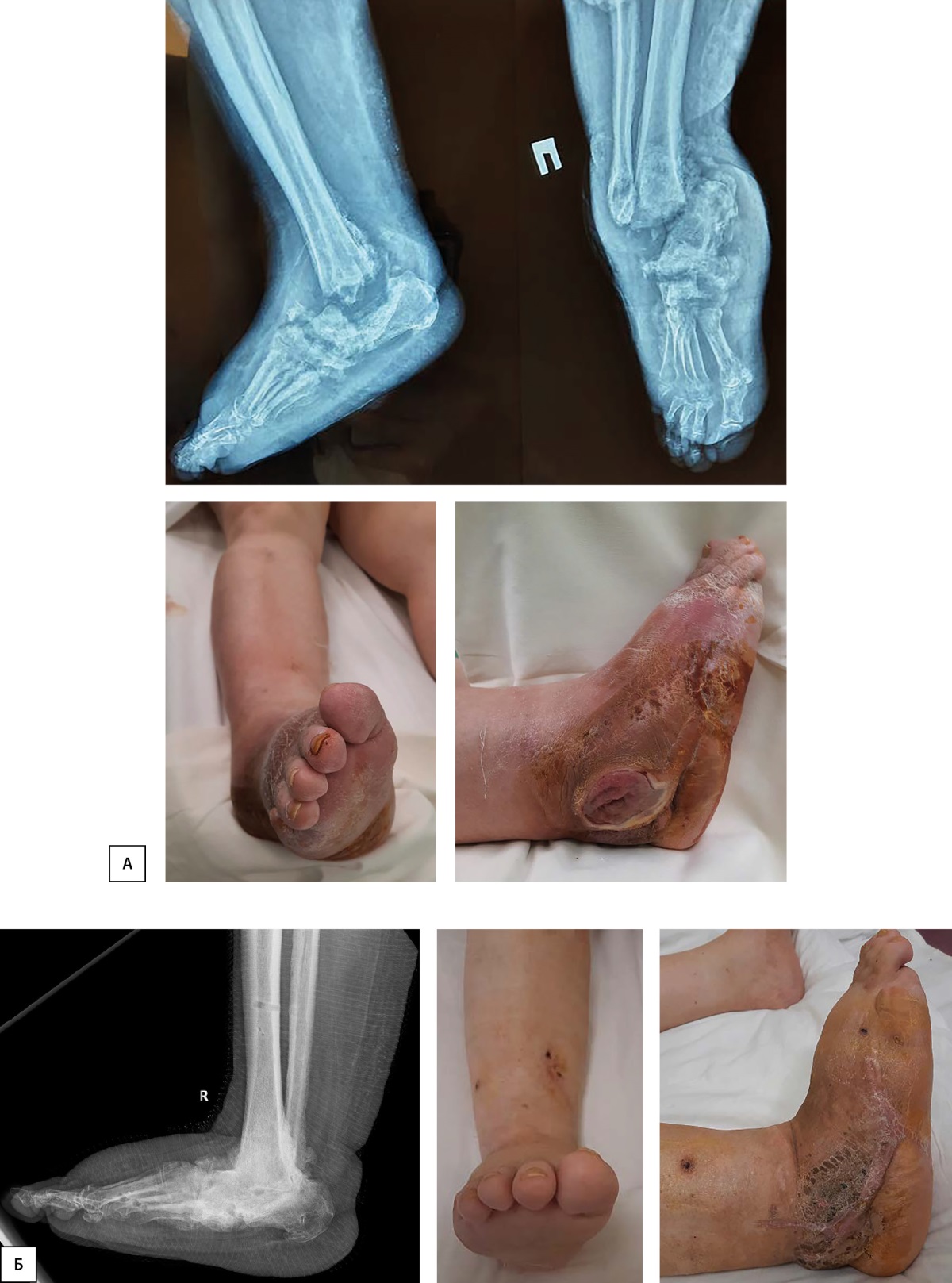
Рисунок 3. Результат лечения пациентки с сахарным диабетом 2 типа (асептический некроз таранной кости, внутренней лодыжки, утрата опорной функции конечности, рана в проекции верхушки наружной лодыжки сообщающаяся с образовавшейся полостью).
А — внешний вид конечности и рентгенограмма исходно; Б — клинический и рентгенографический результат проведенного лечения (заживление раны вторичным натяжением, формирование костного анкилоза, восстановление опорной функции конечности).
АДЪЮВАНТНЫЕ МЕТОДЫ ЛЕЧЕНИЯ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ
Известно, что репаративные процессы в условиях стойкой гипергликемии замедлены, в связи с чем стандартные методы местного лечения не всегда позволяют достичь своевременной эпителизации. В случае, когда сроки заживления превышают 4 недели, рекомендуется решить вопрос об использовании дополнительных (адъювантных) методов терапии.
В настоящее время разработаны и применяются высокотехнологичные аналоги кожи для закрытия длительно незаживающих ран различной этиологии, в том числе при СДС. Это биоинженерные продукты, представляющие собой двухслойную культуру тканей: живые клетки дермы в пласте межклеточного матрикса, покрытые эпителием. В настоящее время эти покрытия рекомендованы при больших размерах ран и неудовлетворительной репарации.
Одним из перспективных направлений в лечении хронических раневых дефектов является использование ростовых факторов. В настоящее время зарегистрированы такие средства, как препараты рекомбинантного человеческого тромбоцитарного фактора роста, рекомбинантного человеческого эпидермального фактора роста (рчЭФР), продолжаются исследования препаратов рекомбинантного фактора роста фибробластов. В ходе проведенных исследований выявлено статистически значимое клиническое улучшение и сокращение сроков заживления язвенных дефектов при СДС на фоне применения рекомбинантных факторов роста (p<0,01) [50].
В недавно опубликованном метаанализе было показано, что в группе, где локально применялся рчЭФР, доля полностью заживших ран была статистически значимо выше по сравнению с контрольной группой [51]. В отделении диабетической стопы ФГБУ «НМИЦ эндокринологии» достаточно давно проводится изучение эффектов рчЭФР у больных с нейропатической и нейроишемической (без критической ишемии) клиническими формами СДС. В ходе исследования отдаленных результатов такой местной терапии ран у пациентов была подтверждена его клиническая эффективность и безопасность [52]. Усилению эффекта данного вида лечения способствует комбинация его с локальным отрицательным давлением. Эта методика комплексной терапии ран у больных диабетом была запатентована ФГБУ «НМИЦ эндокринологии» (декабрь 2020 г.) [53].
В РФ и мире достаточно активно ведутся разработки и других инновационных методов местного лечения ран у лиц с СД.
Терапия стволовыми клетками (СК). В исследовании Albehairy и соавт. была показана статистически значимая разница в 12-недельном заживлении резистентных ран и уменьшении их площади при использовании инъекций из мезенхимальных (68%) или мононуклеарных (59%) СК по сравнению с группой контроля (6,25%, p<0,05). Существенной разницы между двумя группами СК не было [54].
В исследовании Moon и соавт. [55] клеточный гидрогель из жировой ткани показал простоту своего использования и эффективность: полное закрытие хронических ран к 12-й неделе было достигнуто у 82% в испытуемой группе и 53% в группе контроля. Исследование Lonardi и соавт. [56] продемонстрировало эффективность такой технологии в заживлении ран после ампутации нижней конечности: 80% через 6 месяцев в группе исследования по сравнению с 46% в группе контроля.
Генная терапия. Существуют технологии по введению молекул с вирусными векторами в поврежденные ткани с целью заживления ран [57].
В 1 и 2 фазах испытания аденовирусного вектора с геном трансформирующего фактора роста бета (ТФР) человека, использовавшегося в качестве дополнения к стандартной терапии, была доказана безопасность и хорошая переносимость данной терапии. Также у исследованных 15 пациентов наблюдалось быстрое закрытие раневых дефектов, однако для доказательства эффективности названного метода необходимы дальнейшие клинические исследования [58].
В исследовании Kwon и соавт. [59] невирусного вектора на мышах было показано, что комбинация плазмидной кольцевой ДНК, кодирующей фактор роста эндотелия сосудов (VEGF), с аргининовым катионным дендримером PAM-RG4 имеет положительный эффект в заживлении ран. Необходимо продолжать исследования безопасности и эффективности метода.
ЗАКЛЮЧЕНИЕ
Своевременная диагностика, адекватное комплексное лечение и профилактика хронических раневых дефектов нижних конечностей у больных СД — одна из важнейших задач современной медицины, решение которой позволит сохранить опорную функцию конечности у большого числа пациентов. Совершенствование специализированной медицинской помощи, внедрение новых методов диагностики, консервативного и хирургического лечения в медицинских учреждениях разного уровня в рамках Федерального проекта «Борьба с сахарным диабетом» поможет с успехом разрешить эту непростую проблему.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Галстян Г.Р. — внесение в рукопись существенной правки, одобрение финальной версии рукописи; Артемова Е.В. — написание статьи; Бардюгов П.С. — написание статьи; Бондаренко О.Н. — написание статьи; Джемилова З.Н. — написание статьи; Доронина Л.П. — написание статьи; Егорова Д.Н. — написание статьи; Зайцева Е.Л. — написание статьи; Митиш В.А. — внесение в рукопись существенной правки, одобрение финальной версии рукописи; Сергеева С.В. — написание статьи; Ситкин И.И. — написание статьи; Токмакова А.Ю. — написание статьи, внесение в рукопись существенной правки, одобрение финальной версии рукописи; Ярославцева М.В. — написание статьи; Шестакова М.В. — внесение в рукопись существенной правки, одобрение финальной версии рукописи.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Галстян Г.Р., Токмакова А.Ю., Егорова Д.Н., и соавт. Клинические рекомендации по диагностике и лечению синдрома диабетической стопы // Раны и раневые инфекции. Журнал имени проф. Б.М. Костючёнка. — 2015. — Т.2. — №3. — С.63–83. doi: https://doi.org/10.17650/2408-9613-2015-2-3-63-83
2. Дедов И.И., Шестакова М.В., Викулова О.К., и соавт. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010 – 2022 гг. // Сахарный диабет. — 2023. — Т.26. — №2. — С.104-123. doi: https://doi.org/10.14341/DM13035
3. Костюченок Б.М., Амирасланов Ю.А., Щерба С.Г. Гнойная хирургическая инфекция у больных сахарным диабетом. Раны и раневая инфекция, изд. 2-е. / Под ред. М.И. Кузина, Б.М. Костюченок. — М.: «Медицина»; 1990.
4. Покровский А.В. Роль сосудистой хирургии в лечении больных сахарным диабетом // Вестник Российской академии медицинских наук. — 2012. — Т.67. — №1. – С.27-30. doi: https://doi.org/10.15690/vramn.v67i1.106
5. Diabetes care and research in Europe: the Saint Vincent declaration. Diabet Med. 1990;7(4):360
6. Дедов И.И., Шестакова М.В., Сунцов Ю.И., и соавт. Результаты реализации подпрограммы «Сахарный диабет» федеральной целевой программы «Предупреждение и борьба с социально значимыми заболеваниями 2007-2012 годы» // Сахарный диабет. — 2013. — Т.16. — №2S. — С.1-48. doi: https://doi.org/10.14341/2072-0351-3879
7. IWGDF Guidelines. IWGDF Guidelines on the prevention and management of diabetes-related foot disease. Available from: https://iwgdfguidelines.org/wp-content/uploads/2023/07/IWGDF-Guidelines-2023.pdf
8. Клинические рекомендации [интернет]. Рубрикатор клинических рекомендаций [доступ от 10.01.2025]. Доступ по ссылке: https://cr.minzdrav.gov.ru/clin-rec
9. Armstrong DG, Tan TW, Boulton AJM, Bus SA. Diabetic Foot Ulcers: A Review. JAMA. 2023;330(1):62-75. doi: https://doi.org/10.1001/jama.2023.10578
10. Pop-Busui R, Boulton AJ, Feldman EL, et al. Diabetic Neuropathy: A Position Statement by the American Diabetes Association. Diabetes Care. 2017;40(1):136-154. doi: https://doi.org/10.2337/dc16-2042
11. Артемова Е.В., Джемилова З.Н., Горбачева А.М., и соавт. Нейрогуморальная регуляция репарации тканей при сахарном диабете. – М.: ООО Издательство «КУРС»; 2022.
12. Jaiswal M, Divers J, Dabelea D, et al. Prevalence of and Risk Factors for Diabetic Peripheral Neuropathy in Youth With Type 1 and Type 2 Diabetes: SEARCH for Diabetes in Youth Study. Diabetes Care. 2017;40(9):1226-1232. doi: https://doi.org/10.2337/dc17-0179
13. Fitridge R, Chuter V, Mills J, et al. The intersocietal IWGDF, ESVS, SVS guidelines on peripheral artery disease in people with diabetes and a foot ulcer. Diabetes Metab Res Rev. 2024;40(3):e3686. doi: https://doi.org/10.1002/dmrr.3686
14. Boulton AJM. The pathway to ulceration: aetiopathogenesis. In: Boulton AJM, Cavanagh PR, Rayman G. The Diabetic Foot (4-th edition). Wiley;2008:51-67
15. Stoberock K, Kaschwich M, Nicolay SS, et al. The interrelationship between diabetes mellitus and peripheral arterial disease. Vasa. 2021;50(5):323-330. doi: https://doi.org/10.1024/0301-1526/a000925
16. Conte MS, Bradbury AW, Kolh P, et al. Global vascular guidelines on the management of chronic limb-threatening ischemia [published correction appears in J Vasc Surg. 2019 Aug;70(2):662. doi: 10.1016/j.jvs.2019.06.102]. J Vasc Surg. 2019;69(6S):3S-125S.e40. doi: https://doi.org/10.1016/j.jvs.2019.02.016
17. Дедов И.И., Шестакова М.В., Майоров А.Ю., и соавт. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 11-й выпуск // Сахарный диабет. — 2023. — Т.26. — №2S. — С.1-157. doi: https://doi.org/10.14341/DM13042
18. Bus SA, Sacco ICN, Monteiro-Soares M, et al. Guidelines on the prevention of foot ulcers in persons with diabetes (IWGDF 2023 update). Diabetes Metab Res Rev. 2024;e3651. doi: https://doi.org/10.1002/dmrr.3651
19. van Netten JJ, Raspovic A, Lavery LA, et al. Prevention of foot ulcers in persons with diabetes at risk of ulceration: A systematic review and meta-analysis. Diabetes Metab Res Rev. 2024;40(3):e3652. doi: https://doi.org/10.1002/dmrr.3652
20. Bus SA, Waaijman R, Arts M, et al. Effect of custom-made footwear on foot ulcer recurrence in diabetes: a multicenter randomized controlled trial. Diabetes Care. 2013;36(12):4109-4116. doi: https://doi.org/10.2337/dc13-0996
21. Norgren L, Hiatt WR, Dormandy JA, et al. Inter-Society Consensus for the Management of Peripheral Arterial Disease (TASC II). J Vasc Surg. 2007;45 Suppl S:S5-S67. doi: https://doi.org/10.1016/j.jvs.2006.12.037
22. Галстян Г.Р., Викулова О.К., Исаков М.А., и соавт. Эпидемиология синдрома диабетической стопы и ампутаций нижних конечностей в Российской Федерации по данным Федерального регистра больных сахарным диабетом (2013–2016 гг.) // Сахарный диабет. — 2018. — Т.21. — №3. — С.170-177. doi: https://doi.org/10.14341/DM9688
23. Robson MC, Barbul A. Guidelines for the best care of chronic wounds. Wound Repair Regen. 2006;14(6):647-648. doi: https://doi.org/10.1111/j.1524-475X.2006.00173.x
24. Бондаренко О.Н., Галстян Г.Р., Дедов И.И. Особенности клинического течения критической ишемии нижних конечностей и роль эндоваскулярной реваскуляризации у больных сахарным диабетом // Сахарный диабет. — 2015. — Т.18. — №3. — С.57-69. doi: https://doi.org/10.14341/DM2015357-69
25. Джемилова З.Н., Галстян Г.Р. Оценка тканевой перфузии методом флуоресцентной ангиографии с индоцианином зеленым у пациентов с нейроишемической формой синдрома диабетической стопы после эндоваскулярного лечения // Хирургия. Журнал им. Н.И. Пирогова. — 2023. — Т.9. — №2. — С.43–53. https://doi.org/10.17116/hirurgia202309243
26. Патент РФ на изобретение №2734275 C1/14.10.2020. Грачев П.В., Лощенов В.Б., Балыко И.А., и соавт. Способ диагностики степени кровенаполненности биологических тканей и оценки параметров кровотока и лимфотока.
27. Gerhard-Herman MD, Gornik HL, Barrett C, et al. 2016 AHA/ACC Guideline on the Management of Patients With Lower Extremity Peripheral Artery Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines [published correction appears in Circulation. 2017 Mar 21;135(12):e791-e792. doi: 10.1161/CIR.0000000000000502]. Circulation. 2017;135(12):e726-e779. doi: https://doi.org/10.1161/CIR.0000000000000471
28. Ahn SS, Concepcion B. Current status of atherectomy for peripheral arterial occlusive disease. World J Surg. 1996;20(6):635-643. doi: https://doi.org/10.1007/s002689900097
29. Rastan A, Sixt S, Schwarzwälder U, et al. Initial experience with directed laser atherectomy using the CLiRpath photoablation atherectomy system and bias sheath in superficial femoral artery lesions. J Endovasc Ther. 2007;14(3):365-373. doi: https://doi.org/10.1583/06-2046.1
30. Faglia E, Clerici G, Clerissi J, et al. Long-term prognosis of diabetic patients with critical limb ischemia: a population-based cohort study [published correction appears in Diabetes Care. 2009 Jul;32(7):1355. Luppattelli, Tommaso [corrected to Lupattelli, Tommaso]]. Diabetes Care. 2009;32(5):822-827. doi: https://doi.org/10.2337/dc08-1223
31. Uccioli L, Gandini R, Giurato L, et al. Long-term outcomes of diabetic patients with critical limb ischemia followed in a tertiary referral diabetic foot clinic. Diabetes Care. 2010;33(5):977-982. doi: https://doi.org/10.2337/dc09-0831
32. Meloni M, Izzo V, Giurato L, et al. Recurrence of Critical Limb Ischemia After Endovascular Intervention in Patients with Diabetic Foot Ulcers. Adv Wound Care (New Rochelle). 2018;7(6):171-176. doi: https://doi.org/10.1089/wound.2017.0778
33. Аюбова Н.Л., Бондаренко О.Н., Галстян Г.Р., и соавт. Особенности поражения артерий нижних конечностей и клинические исходы эндоваскулярных вмешательств у больных сахарным диабетом с критической ишемией нижних конечностей и хронической болезнью почек // Сахарный диабет. — 2013. — Т.16. — №4. — С.85-94. doi: https://doi.org/10.14341/DM2013485-94
34. Adam DJ, Beard JD, Cleveland T, et al. Bypass versus angioplasty in severe ischaemia of the leg (BASIL): multicentre, randomised controlled trial. Lancet. 2005;366(9501):1925-1934. doi: https://doi.org/10.1016/S0140-6736(05)67704-5
35. Wukich DK, Schaper NC, Gooday C, et al. Guidelines on the diagnosis and treatment of active Charcot neuro-osteoarthropathy in persons with diabetes mellitus (IWGDF 2023). Diabetes Metab Res Rev. 2024;40(3):e3646. doi: https://doi.org/10.1002/dmrr.3646
36. Raspovic KM, Schaper NC, Gooday C, et al. Diagnosis and treatment of active charcot neuro-osteoarthropathy in persons with diabetes mellitus: A systematic review. Diabetes Metab Res Rev. 2024;40(3):e3653. doi: https://doi.org/10.1002/dmrr.3653
37. Ульянова И.Н., Ярославцева М.В., Галстян Г.Р. Диабетическая нейроостеоартропатия: особенности костного метаболизма у пациентов с сахарным диабетом // Медицина критических состояний. — 2009. — № 3. — С. 36-41.
38. Ярославцева М.В., Бондаренко О.Н., Эль-Тарави Я.А., и др. Этиопатогенетические особенности костного метаболизма пациентов с сахарным диабетом, осложненным диабетической нейроостеоартропатией // Проблемы эндокринологии. — 2024. — Т.70. — №4. — С.57-64. doi: https://doi.org/10.14341/probl13362
39. Armstrong DG, Peters EJ. Charcot’s arthropathy of the foot. J Am Podiatr Med Assoc. 2002;92(7):390-394. doi: https://doi.org/10.7547/87507315-92-7-390
40. McEwen LN, Ylitalo KR, Herman WH, Wrobel JS. Prevalence and risk factors for diabetes-related foot complications in Translating Research Into Action for Diabetes (TRIAD). J Diabetes Complications. 2013;27(6):588-592. doi: https://doi.org/10.1016/j.jdiacomp.2013.08.003
41. Патент РФ №2570970 C1/20.12.2015. Митиш В.А., Пасхалова Ю.С., Доронина Л.П., Гаряева В.В. Способ хирургического лечения диабетической нейроостеоартропатии среднего отдела стопы в стадии трофических нарушений.
42. Патент РФ №2561286 C1/27.08.2015. Митиш В.А., Пасхалова Ю.С., Доронина Л.П., Гаряева В.В. Способ хирургического лечения диабетической нейроостеоартропатии среднего отдела стопы в стадии гнойных осложнений.
43. Каландия М.М., Доронина Л.П., Митиш В.А., и соавт. Отдаленные результаты корригирующих хирургических вмешательств у пациентов с диабетической нейроостеоартропатией среднего отдела стопы // Сахарный диабет. — 2023. — Т.26. — №5. — С.464-472. doi: https://doi.org/10.14341/DM13000
44. Ha J, Hester T, Foley R, et al. Charcot foot reconstruction outcomes: A systematic review. J Clin Orthop Trauma. 2020;11(3):357-368. doi: https://doi.org/10.1016/j.jcot.2020.03.025
45. Kwaadu KY. Charcot Reconstruction: Understanding and Treating the Deformed Charcot Neuropathic Arthropathic Foot. Clin Podiatr Med Surg. 2020;37(2):247-261. doi: https://doi.org/10.1016/j.cpm.2019.12.002
46. Cianni L, Bocchi MB, Vitiello R, et al. Arthrodesis in the Charcot foot: a systematic review. Orthop Rev (Pavia). 2020;12(Suppl 1):8670. doi: https://doi.org/10.4081/or.2020.8670
47. Hartig N, Krenn S, Trnka HJ. Operative Versorgung des Charcot-Fußes am Rückfuß : Langzeitergebnisse und systematischer Überblick [Surgical treatment of the Charcot foot : long-term results and systematic review]. Orthopade. 2015;44(1):14-24. doi: https://doi.org/10.1007/s00132-014-3058-8
48. Stapleton JJ, Zgonis T. Surgical reconstruction of the diabetic Charcot foot: internal, external or combined fixation? Clin Podiatr Med Surg. 2012;29(3):425-433. doi: https://doi.org/10.1016/j.cpm.2012.04.003
49. Бардюгов П.С., Паршиков М.В., Галстян Г.Р., Ярыгин Н.В. Показания к различным вариантам ортопедической коррекции деформаций стопы при диабетической нейроостеоартропатии // Сахарный диабет. — 2020. — Т.23. — №4. — С.374-385. doi: https://doi.org/10.14341/DM12271
50. Barrientos S, Stojadinovic O, Golinko MS, Brem H, Tomic-Canic M. Growth factors and cytokines in wound healing. Wound Repair Regen. 2008;16(5):585-601. doi: https://doi.org/10.1111/j.1524-475X.2008.00410.x
51. Yang Q, Zhang Y, Yin H, Lu Y. Topical Recombinant Human Epidermal Growth Factor for Diabetic Foot Ulcers: A Meta-Analysis of Randomized Controlled Clinical Trials. Ann Vasc Surg. 2020;62:442-451. doi: https://doi.org/10.1016/j.avsg.2019.05.041
52. Зайцева Е.Л., Жиляев В.М., Галстян Г.Р. Отдаленные результаты лечения хронических ран стоп рекомбинантным человеческим эпидермальным фактором роста у пациентов с осложнениями сахарного диабета // Сахарный диабет. — 2020. — Т.23. — №6. — С.532-540. doi: https://doi.org/10.14341/DM12701
53. Патент РФ №2754383 C1/2021.09.01.Зайцева Е.Л., Доронина Л.П., Токмакова А.Ю., Галстян Г.Р., Шестакова М.В. Способ лечения неинфицированного послеоперационного раневого дефекта стопы при отсутствии признаков критической ишемии конечности у больных с нейропатической и нейроишемической формой синдрома диабетической стопы.
54. Albehairy A, Kyrillos F, Gawish H, et al. Autologous Mononuclear Versus Mesenchymal Stem Cells in Healing of Recalcitrant Neuropathic Diabetic Foot Ulcers. In: Diabetic Foot Study Group (DFSG) Berlin 2018; 2018 Oct 2. Available from: https://www.easd.org/media-centre/home.html#!resources/autologous-mononuclear-versus-mesenchymal-stem-cells-in-healing-of-recalcitrant-neuropathic-diabetic-foot-ulcers
55. Moon KC, Suh HS, Kim KB, et al. Potential of Allogeneic Adipose-Derived Stem Cell-Hydrogel Complex for Treating Diabetic Foot Ulcers. Diabetes. 2019;68(4):837-846. doi: https://doi.org/10.2337/db18-0699
56. Lonardi R, Leone N, Gennai S, Trevisi Borsari G, Covic T, Silingardi R. Autologous micro-fragmented adipose tissue for the treatment of diabetic foot minor amputations: a randomized controlled single-center clinical trial (MiFrAADiF). Stem Cell Res Ther. 2019;10(1):223. doi: https://doi.org/10.1186/s13287-019-1328-4
57. Dixon D, Edmonds M. Managing diabetic foot ulcers: pharmacotherapy for wound healing. Drugs. 2021;81(1):29-56. doi: https://doi.org/10.1007/s40265-020-01415-8
58. Mulder G, Tallis AJ, Marshall VT, et al. Treatment of nonhealing diabetic foot ulcers with a platelet-derived growth factor gene-activated matrix (GAM501): results of a phase 1/2 trial. Wound Repair Regen. 2009;17(6):772-779. doi: https://doi.org/10.1111/j.1524-475X.2009.00541.x
59. Kwon MJ, An S, Choi S, et al. Effective healing of diabetic skin wounds by using nonviral gene therapy based on minicircle vascular endothelial growth factor DNA and a cationic dendrimer. J Gene Med. 2012;14(4):272-278. doi: https://doi.org/10.1002/jgm.2618
Об авторах
Г. Р. ГалстянРоссия
Галстян Гагик Радикович, д.м.н., профессор
117292, Москва, ул. Дм. Ульянова, д. 11
Е. В. Артемова
Россия
Артемова Екатерина Викторовна
117292, Москва, ул. Дм. Ульянова, д. 11
П. С. Бардюгов
Россия
Бардюгов Петр Сергеевич
117292, Москва, ул. Дм. Ульянова, д. 11
О. Н. Бондаренко
Россия
Бондаренко Ольга Николаевна, к.м.н., в.н.с.
117292, Москва, ул. Дм. Ульянова, д. 11
З. Н. Джемилова
Россия
Джемилова Зера Нусредовна
117292, Москва, ул. Дм. Ульянова, д. 11
Л. П. Доронина
Россия
Доронина Людмила Петровна, к.м.н.
117292, Москва, ул. Дм. Ульянова, д. 11
Д. Н. Егорова
Россия
Егорова Дарья Никитична, к.м.н., ст.н.с.
117292, Москва, ул. Дм. Ульянова, д. 11
Е. Л. Зайцева
Россия
Зайцева Екатерина Леонидовна, к.м.н.
117292, Москва, ул. Дм. Ульянова, д. 11
В. А. Митиш
Россия
Митиш Валерий Афанасьевич, д.м.н.
117292, Москва, ул. Дм. Ульянова, д. 11
С. В. Сергеева
Россия
Сергеева Светлана Викторовна
117292, Москва, ул. Дм. Ульянова, д. 11
И. И. Ситкин
Россия
Ситкин Иван Иванович, д.м.н., ст.н.с
117292, Москва, ул. Дм. Ульянова, д. 11
А. Ю. Токмакова
Россия
Токмакова Алла Юрьевна, д.м.н.
117292, Москва, ул. Дм. Ульянова, д. 11
М. В. Ярославцева
Россия
Ярославцева Марианна Викторовна, к.м.н., ст.н.с.
117292, Москва, ул. Дм. Ульянова, д. 11
М. В. Шестакова
Россия
Шестакова Марина Владимировна, д.м.н., профессор, академик РАН
117292, Москва, ул. Дм. Ульянова, д. 11
Дополнительные файлы
|
|
1. Рисунок 1. Результат комплексного лечения пациента с нейроишемической формой синдрома диабетической стопы с использованием чрескожной транслюминальной баллонной ангиопластики артерий голени и стопы. А — вид конечности и ангиограммы исходно; Б — клинический и ангиографический результат лечения. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(954KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Результат хирургической коррекции деформации среднего отдела стопы у пациента с нейроостеоартропатией. А — вид стопы и результат мультиспиральной компьютерной томографии до лечения; Б — этапы операции; В — результат проведенного вмешательства. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(540KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Результат лечения пациентки с сахарным диабетом 2 типа (асептический некроз таранной кости, внутренней лодыжки, утрата опорной функции конечности, рана в проекции верхушки наружной лодыжки сообщающаяся с образовавшейся полостью). А — внешний вид конечности и рентгенограмма исходно; Б — клинический и рентгенографический результат проведенного лечения (заживление раны вторичным натяжением, формирование костного анкилоза, восстановление опорной функции конечности). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(595KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Галстян Г.Р., Артемова Е.В., Бардюгов П.С., Бондаренко О.Н., Джемилова З.Н., Доронина Л.П., Егорова Д.Н., Зайцева Е.Л., Митиш В.А., Сергеева С.В., Ситкин И.И., Токмакова А.Ю., Ярославцева М.В., Шестакова М.В. Спасение нижних конечностей у больных сахарным диабетом: невозможное возможно. Сахарный диабет. 2025;28(1):56-67. https://doi.org/10.14341/DM13245
For citation:
Galstyan G.R., Artemova E.V., Bardiugov P.S., Bondarenko O.N., Dzhemilova Z.N., Doronina L.P., Egorova D.N., Zaitseva E.L., Mitish V.A., Sergeeva S.V., Sitkin I.I., Tokmakova A.Y., Yaroslavceva M.V., Shestakova M.V. Lower extremity limb salvage in diabetic patients: the impossible is possible. Diabetes mellitus. 2025;28(1):56-67. (In Russ.) https://doi.org/10.14341/DM13245
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































