Перейти к:
Клинический парадокс: инсулинома у пациента с сахарным диабетом 1 типа
https://doi.org/10.14341/DM13240
Аннотация
Инсулинома — редкая нейроэндокринная опухоль, происходящая из бета-клеток поджелудочной железы. Диагностика инсулиномы может оказаться затруднительной, особенно у пациентов с сопутствующим сахарным диабетом, причиной развития аналогичной клинической картины у которых может являться некорректная схема сахароснижающей терапии. В литературе встречаются описания случаев диагностики инсулиномы у пациентов с сахарным диабетом 2 типа (СД2). Более парадоксальной клинической ситуацией является развитие инсулиномы у пациента с сахарным диабетом 1 типа (СД1). При анализе большого массива литературных источников было обнаружено всего три статьи с описанием инсулиномы у пациентов с СД1. Во всех случаях опухоли оказались злокачественными. Мы представляем впервые описанный в мировой и отечественной литературе клинический случай диагностики и лечения инсулиномы у пациента с латентным аутоиммунным диабетом взрослых (LADA-диабет), а также обзор литературы по данной теме. Постепенное снижение потребности в препаратах экзогенного инсулина в сочетании с рецидивирующими гипогликемиями позволило заподозрить диагноз, который был подтвержден в результате пробы с голоданием, а также в ходе тщательного инструментального поиска опухоли с применением компьютерной томографии и эндоскопического УЗИ.
Ключевые слова
Для цитирования:
Аметов А.С., Тавобилов М.М., Карпов А.А., Закурдаев Е.И., Пашкова Е.Ю., Анциферова Д.М. Клинический парадокс: инсулинома у пациента с сахарным диабетом 1 типа. Сахарный диабет. 2025;28(3):295-304. https://doi.org/10.14341/DM13240
For citation:
Ametov A.S., Tavobilov M.M., Karpov A.A., Zakurdaev E.I., Pashkova E.Y., Antsiferova D.M. Clinical paradox: insulinoma in a patient with type 1 diabetes mellitus. Diabetes mellitus. 2025;28(3):295-304. (In Russ.) https://doi.org/10.14341/DM13240
ВВЕДЕНИЕ
Инсулинома — наиболее распространенная нейроэндокринная опухоль поджелудочной железы (ПЖ), впервые описанная в 1927 г. [1]. Частота новых случаев инсулином остается низкой и составляет в среднем 1–4 случая на 1 миллион человек в год, однако со временем отмечается тенденция к увеличению количества заболевших [2][3].
Несмотря на то, что первое описание инсулиномы касалось злокачественной опухоли, впоследствии выяснилось, что большинство из них являются доброкачественными [2][3]. Злокачественные инсулиномы составляют 5–10% случаев [4], и данные о них все еще ограничены. Есть сведения, что общая выживаемость при злокачественной инсулиноме значительно хуже, чем при доброкачественной [3].
В большинстве случаев инсулиномы выявляются у людей с исходно нормальным углеводным обменом. Диагностика основана на выявлении классической триады Уиппла: нейрогликопенические симптомы, которые развиваются на фоне гипогликемии и купируются приемом углеводов [5]. Встречаемость инсулиномы, особенно злокачественной, у больных сахарным диабетом (СД) крайне низка, а диагностика может быть затруднена из-за сопутствующего приема сахароснижающих препаратов, ошибочно принимаемых за причину гипогликемии.
Хотя клинические проявления инсулиномы и СД 2 типа (СД2) могут показаться взаимоисключающими, об их сосуществовании все же периодически сообщается. В ретроспективном исследовании, проведенном клиникой Майо в 1993 г., из 313 случаев инсулиномы за 65-летний период наблюдений был только один случай инсулиномы, диагностированной у пациента с СД2 [6].
Еще более парадоксальной и вызывающей множество вопросов клинической ситуацией является развитие инсулиномы у пациента с СД 1 типа (СД1). При анализе большого массива литературных источников нам удалось обнаружить всего три публикации с описанием инсулиномы у пациентов с СД1, все опухоли были злокачественными, и подробное описание этих случаев будет приведено в обсуждении. Под нашим наблюдением находился пациент с инсулиномой и ранее диагностированным латентным аутоиммунным диабетом взрослых (LADA-диабет).
КЛИНИЧЕСКИЙ СЛУЧАЙ
В феврале 2023 г. в эндокринологическое отделение ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ поступил пациент 39 лет с направительным диагнозом: «Сахарный диабет 1 типа». Основной жалобой пациента являлись частые гипогликемии, преимущественно в ночное время и снижение потребности в препаратах инсулина вплоть до полной отмены.
Из анамнеза известно, что впервые жалобы на слабость, сухость во рту, учащенное мочеиспускание, снижение массы тела на 20 кг появились в феврале 2017 г. (в возрасте 33 лет). При обследовании в поликлинике по месту жительства в мае 2017 г. впервые было зафиксировано повышение гликемии до 13,1 ммоль/л. С целью дообследования и определения дальнейшей тактики лечения пациент был госпитализирован. При поступлении гликемия — 11,4 ммоль/л. По результатам обследований гликированный гемоглобин — 10,3%, глюкозурия — 28 ммоль/л, кетоновые тела в моче отрицательные, С-пептид — 1,03 нг/мл. Тогда же был установлен диагноз СД1 и инициирована базис-болюсная инсулинотерапия.
С целью более точной верификации диагноза пациент продолжил обследование после выписки из стационара. Учитывая избыточную массу тела (ИМТ — 27 кг/м²), отсутствие кетонурии на момент дебюта заболевания, для проведения дифференциальной диагностики было рекомендовано определение аутоантител, специфичных для СД1. Получены следующие результаты: антитела к глутаматдекарбоксилазе >2000 Ед/мл (<10), титр антител к бета-клеткам ПЖ 1:256 (<1:4), антитела к инсулину — 1,18 Ед/мл (<10). Таким образом диагноз «СД1» подтвердился.
При анализе дневника самоконтроля гликемии за тот период симптоматических гипогликемий зафиксировано не было, однако в ночное время часто отмечалось снижение глюкозы крови до 2 ммоль/л.
С учетом избыточного веса в декабре 2017 г. врачом-эндокринологом по месту жительства в дополнение к инсулинотерапии был рекомендован прием метформина (!) по 850–1000 мг 2 раза в день, который пациент принимал по февраль 2022 г. Тогда же, в декабре 2017 г., пациент стал отмечать частое развитие гипогликемических состояний, в связи с чем в дальнейшем неоднократно самостоятельно прекращал инъекции базального инсулина. Со слов, на фоне проводимой терапии (метформин+инсулин ультракороткого действия (ИУКД) аспарт) гликемия — 5–7 ммоль/л.
На представленной терапии пациент находился в течение 4 лет, врач-эндокринолог корректировал дозы инсулина, однако жалобы на частые гипогликемии сохранялись.
В феврале 2022 г. другим врачом-эндокринологом в поликлинике по месту жительства метформин отменен и рекомендовано возобновление базис-болюсной инсулинотерапии. В течение нескольких месяцев пациент придерживался данных рекомендаций, однако в связи с появлением более глубоких и частых гипогликемий, преимущественно в ночное время, самостоятельно прервал использование базального инсулина окончательно.
При поступлении в эндокринологическое отделение ГКБ им. С.П. Боткина в феврале 2023 г. терапия была представлена нерегулярными инъекциями ИУКД аспарт. В будние дни пациент не выполнял инъекции, регулярно занимался спортом, при использовании ИУКД отмечал гипогликемии. Со слов, гликемия колебалась в пределах 5–10 ммоль/л в течение дня. В выходные дни больной периодически осуществлял инъекции ИУКД по 2–6 ЕД перед приемами пищи с обильным содержанием углеводов. Правилами подсчета углеводов по системе хлебных единиц (ХЕ) не владеет. Объем инъекции определяет интуитивно, в зависимости от калорийности пищи и ее объема.
При поступлении в отделение гликемия — 5,4 ммоль/л. На тот момент пациент не применял никакой сахароснижающей терапии в течение 4 дней и при этом предъявлял жалобы на колебания гликемии от 2 до 18 ммоль/л и частые гипогликемии. Самоконтроль гликемии регулярный (2–4 р/д), в том числе перед занятиями спортом и в ночное время. Обращала на себя внимание избыточная масса тела пациента с наличием абдоминального ожирения (рост — 170 см, масса тела — 88 кг, ИМТ — 30,4 кг/м²). На фоне соблюдения диеты за 2 месяца потерял в весе 7 кг. Наследственность по СД не отягощена. Кетонурии не было.
При анализе данных медицинской документации выяснилось, что в течение всего периода заболевания гликированный гемоглобин пациента находился в пределах целевых значений несмотря на неоднозначную схему сахароснижающей терапии (табл. 1).
Таблица 1. Результаты лабораторных исследований за все время заболевания
|
05.17 |
10.18 |
04.19 |
11.19 |
03.20 |
10.20 |
07.21 |
05.22 |
12.22 |
02.23 |
|
|
HbA1c, % |
10,3 |
5,5 |
5,4 |
6,5 |
6,2 |
5,4 |
5,9 |
5,9 |
6 |
|
|
С-пептид, нг/мл |
1,15 |
1,89 |
3,1 |
При исследовании гликемической кривой за первый день госпитализации у пациента на фоне отсутствия сахароснижающей терапии отмечалось неоднократное снижение гликемии между примами пищи, минимально до 2,0 ммоль/л в ночное время (рис. 1). Данное состояние купировалось приемом углеводов.
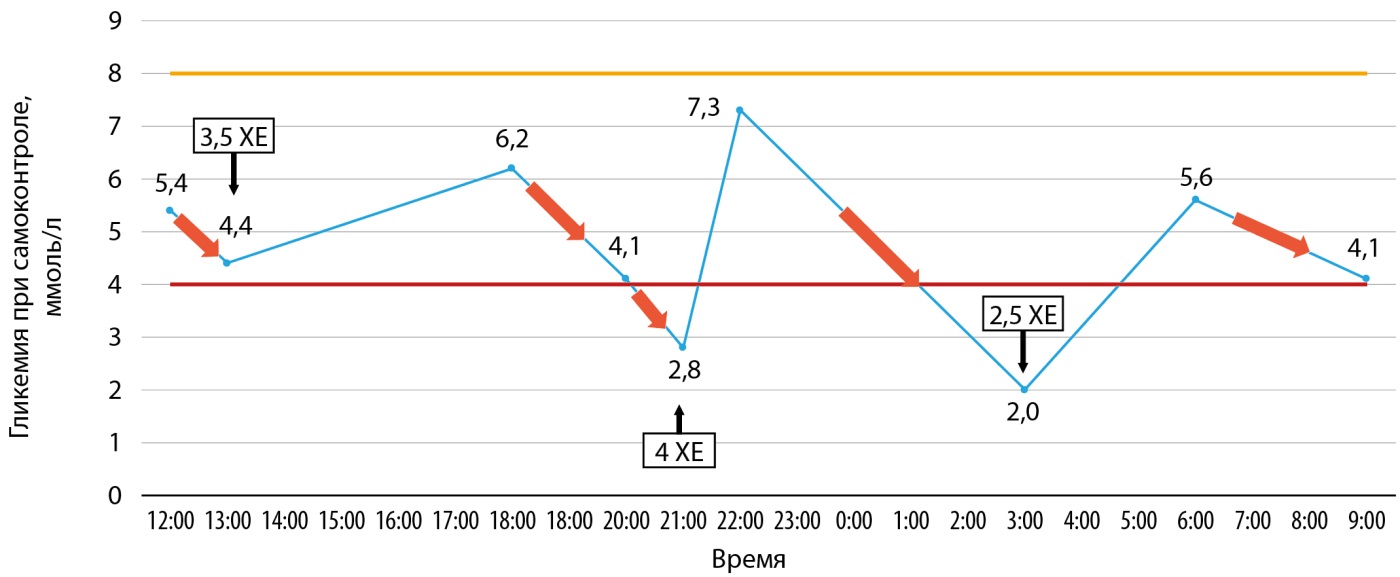
Рисунок 1. Результаты самоконтроля гликемии.
ХЕ — хлебные единицы.
Было заподозрено наличие эндогенного гиперинсулинизма и принято решение о проведении пробы с голоданием. Перед началом пробы гликемия по глюкометру — 4,1 ммоль/л. В течение дальнейших 2,5 часов наблюдалось планомерное снижение гликемии вплоть до 2,1 ммоль/л по глюкометру, когда у пациента отметилось появление жалоб на общую слабость, головокружение, головную боль. После приема углеводов вышеуказанные симптомы регрессировали. Результаты пробы с голоданием представлены в таблице 2.
Таблица 2. Результаты пробы с голоданием
|
8:30 |
11:00 |
|
|
Гликемия по глюкометру, ммоль/л |
4,1 |
2,1 |
|
Гликемия (венозная плазма), ммоль/л |
3,24 |
1,85 |
|
Уровень инсулина, мкМЕ/мл |
21,12 |
12,8 |
|
С-пептид, нг/мл |
3,1 |
2,34 |
Учитывая уровень инсулина (12,8 мкмоль/мл) при гипогликемии, высокое соотношение инсулин/глюкоза (более 0,4), отсутствие адекватного подавления секреции инсулина в ходе пробы с голоданием, результат теста — положительный.
Таким образом, у пациента с СД1 выявлен эндогенный гиперинсулинизм, и с целью поиска инсулиномы был проведен ряд инструментальных обследований. По результатам УЗИ органов брюшной полости определяются признаки диффузных изменений ПЖ, объемных образований выявлено не было. По данным мультиспиральной компьютерной томографии (МСКТ) органов брюшной полости с болюсным контрастированием определялись умеренные диффузные изменения печени и ПЖ. Патологических структурных изменений врачом лучевой диагностики не выявлено.
Учитывая результаты стандартных методов диагностики, было принято решение о проведении эндоскопического УЗИ. При сканировании в области перешейка ПЖ ближе к крючковидному отростку визуализировано объемное образование 13*12 мм, изоэхогенное, с четкими ровными контурами, однородной структуры, с тонкой гиперэхогенной капсулой. Образование интимно прилежало к воротной вене к зоне конфлюенса. При доплеровском сканировании определялись единичные локусы кровотока. В теле ПЖ визуализируются множественные аналогичные по эхоструктуре образования округлой формы от 2 до 5 мм в диаметре (рис. 2). С целью уточнения количества, размеров и локализации всех образований для дальнейшего решения вопроса о тактике лечения рассматривалось проведение позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ) с ⁶⁸Ga-DOTA-TATE, однако данный метод считается неинформативным при наличии образований размером менее 6 мм.
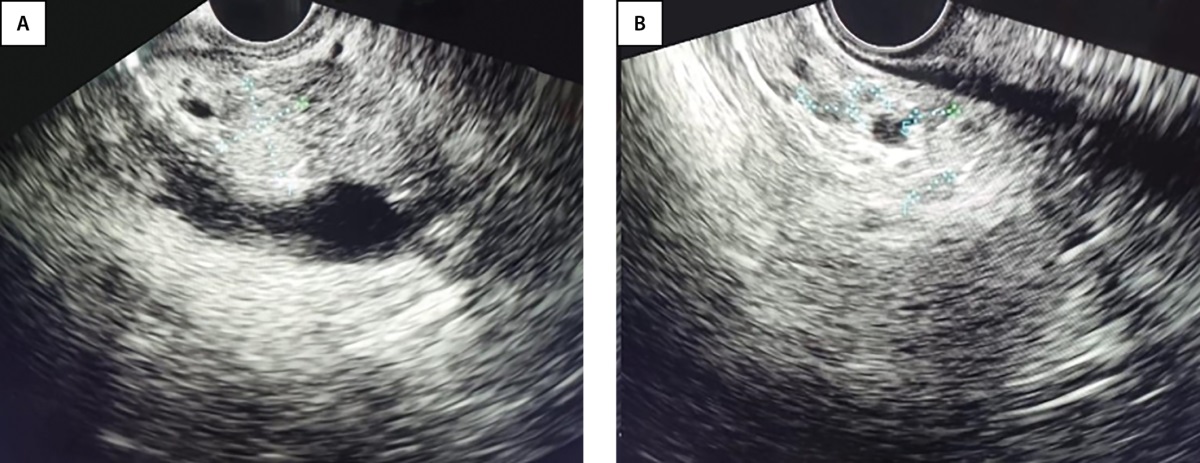
Рисунок 2. Эндо-УЗИ.
А — Объемное образование в области перешейка поджелудочной железы. В — Множественные образования в теле поджелудочной железы.
Необходимо отметить, что при повторном изучении результатов компьютерной томографии (КТ) консилиумом специалистов при обсуждении тактики лечения в головке ПЖ все же было визуализировано образование, описанное в дальнейшем на эндо-УЗИ.
Сочетание частых гипогликемических состояний, положительной пробы с голоданием и множественных образований ПЖ позволяет установить пациенту с СД1 конкурирующий диагноз: «Эндогенный гиперинсулинизм, множественные инсулиномы головки и тела ПЖ».
При повторном определении антител, ассоциированных с СД, получены следующие результаты: АТ к инсулину — 2,2 МЕ/мл (0–10), АТ к бета-клеткам ПЖ — 0,86 (<0,95), АТ-GAD — 1,00 ОЕ/мл (<1,0 — не обнаружено, 1,00–1,05 — сомнительный результат, >1,05 — обнаружено). Подобное снижение титра антител обусловлено стиханием активности аутоиммунного процесса, что типично для длительного течения СД1/LADA-диабета.
С целью обеспечения полномасштабного контроля за гликемией в периоперационном периоде пациенту была установлена система флэш-мониторирования гликемии. По данным непрерывного мониторирования глюкозы (НМГ) в течение нескольких дней до операции (рис. 3), отмечалась ежедневная тенденция к снижению гликемии в ночное время и тенденция к гипергликемии в вечернее время.
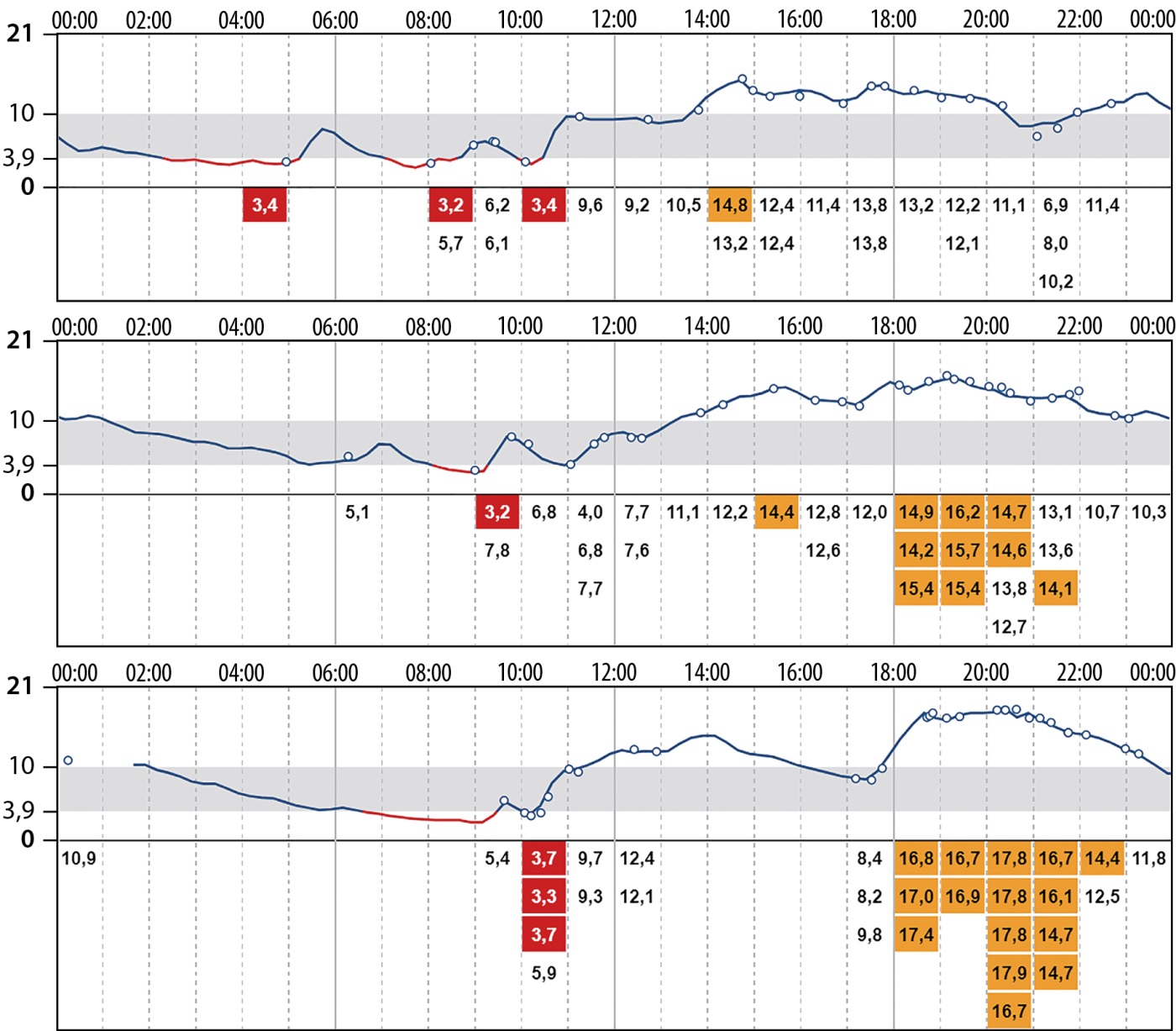
Рисунок 3. Результаты непрерывного мониторирования глюкозы до операции.
Наличие множественных инсулином ПЖ стало показанием к выполнению тотальной дуоденопанкреатэктомии (ТДПЭ). Пациенту была проведена робот-ассистированная ТДПЭ с сохранением селезенки в модификации Kimura: удалены двенадцатиперстная кишка, ПЖ, общий желчный проток, желчный пузырь, 20 см начальных отделов тощей кишки. Послеоперационный период протекал без осложнений.
При патологоанатомическом исследовании операционного материала панкреатодуоденальной резекции в головке ПЖ имелась округлая желто-коричневая дольчатая опухоль 1,6х2,1 см (рис. 4). В остальном патологических изменений не было выявлено.
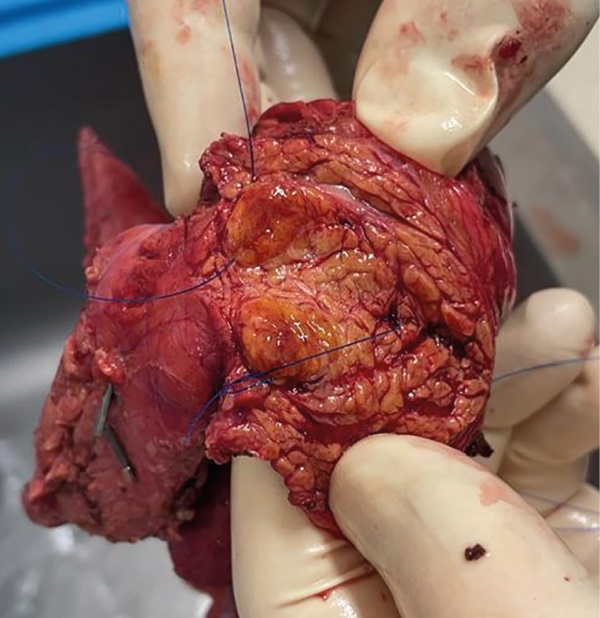
Рисунок 4. Опухоль головки поджелудочной железы на разрезе.
Микроскопически опухоль головки ПЖ была представлена гнездами, трабекулами и псевдожелезистыми структурами из мелких и средних клеток с эозинофильной и амфофильной цитоплазмой, однородными округлыми ядрами с крапчатым хроматином, редкими митозами. Опухоль не имела фиброзной капсулы, но была довольно четко отграниченной от окружающей паренхимы ПЖ, которая не отличалась какими-либо изменениями (рис. 5).
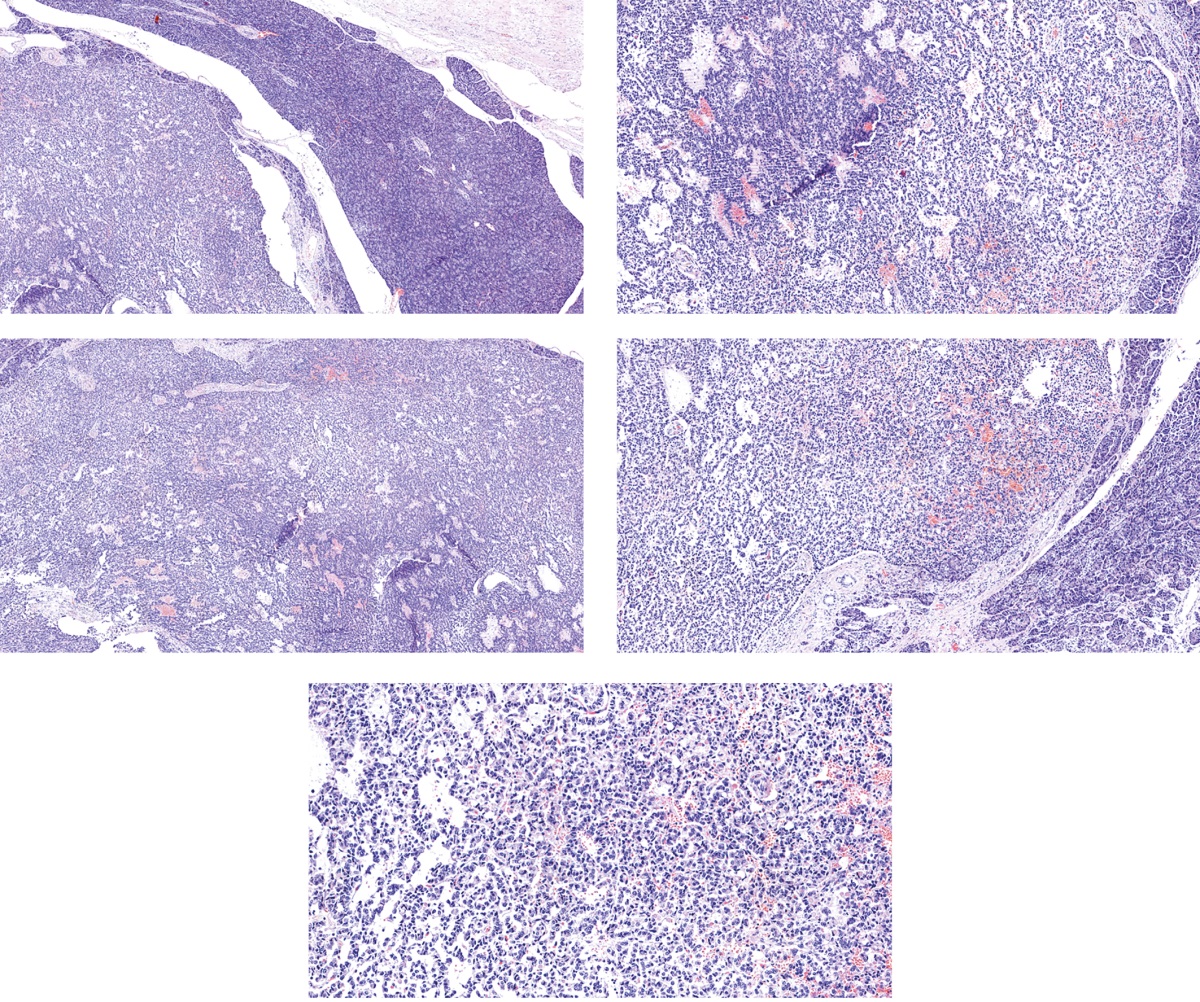
Рисунок 5. Гистологическая картина нейроэндокринной опухоли поджелудочной железы.
В 15 регионарных лимфоузлах метастазов не выявлено.
Иммуногистохимическое исследование (рис. 6) показало диффузную экспрессию опухолевыми клетками нейроэндокринных маркеров (CD56, Synaptophysin, Chromogranin). Пролиферативная активность опухолевых клеток по Ki67 была повышена и составила 9%.
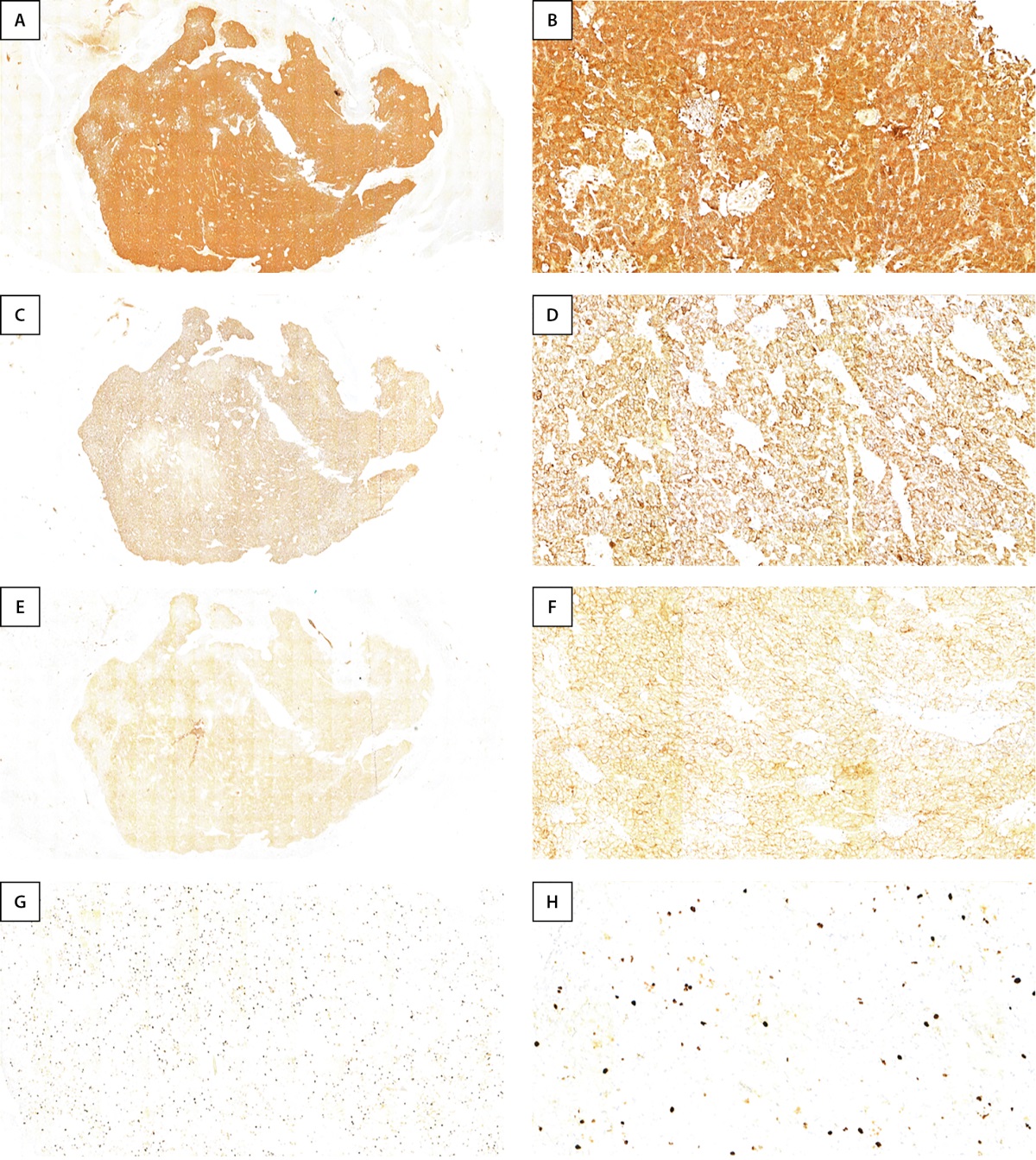
Рисунок 6. Иммуногистохимические реакции в ткани нейроэндокринной опухоли с Synaptophysin (a-b), chromogranin (c-d), cd56 (e-f), ki67 (g-h).
Строма опухоли и периопухолевая ткань были скудно инфильтрирована лимфоцитами (2% опухолевого микроокружения). Среди Т-лимфоцитов преобладали CD8-клетки, CD4-клеток было меньше (соотношение 1:3).
В микроокружении опухоли с использованием маркера CD68 выявлены и макрофаги, они занимали около 4% опухолевой стромы.
С учетом морфологии и иммунофенотипа опухоли сделано заключение о наличии в головке ПЖ высокодифференцированной нейроэндокринной опухоли 2-й степени злокачественности (Grade 2).
В контексте с клинико-инструментальными данными нейроэндокринная опухоль головки ПЖ являлась инсулиномой.
После проведенного оперативного вмешательства был установлен диагноз: «Сахарный диабет в исходе тотальной дуоденопанкреатэктомии» и инициирована непрерывная внутривенная инфузия инсулина через инфузомат.
После стабилизации состояния пациент был переведен на базис-болюсную инсулинотерапию. В рамках госпитализации была подобрана схема: базальный инсулин детемир по 13 ЕД утром и по 7 ЕД на ночь и инсулин ультракороткого действия аспарт с учетом индивидуальных углеводных коэффициентов (1ХЕ:3ЕД перед завтраком и обедом, 1ХЕ:2,5 ЕД перед ужином). Помимо этого, у пациента имело место повышение гликемии в ранние утренние часы, что свидетельствовало о наличии феномена «утренней зари» и требовало введения ИУКД по 2–6 ЕД в 05:00 в зависимости от гликемии.
Во время госпитализации пациент в индивидуальном порядке был обучен подсчету углеводов по системе ХЕ, технике инъекций инсулина и способам самостоятельной коррекции инсулинотерапии.
В отделении, даже при тщательном учете углеводов пищи, были отмечены значимые колебания гликемии при введении одинакового количества инсулина на равное количество ХЕ в одно и то же время суток. Таким образом, у пациента имеет место лабильное течение заболевания, что типично для СД в исходе ТДПЭ. Именно поэтому целевой уровень гликированного гемоглобина установлен на уровне 7%.
На фоне проводимой терапии наблюдалась стабилизация показателей гликемии на уровне целевых значений. По результатам самоконтроля гликемии с использованием системы флеш-мониторирования время в целевом диапазоне — 80%, время ниже целевого диапазона — 2%, время выше целевого диапазона — 18%, что соответствует рекомендованным значениям (рис. 7).
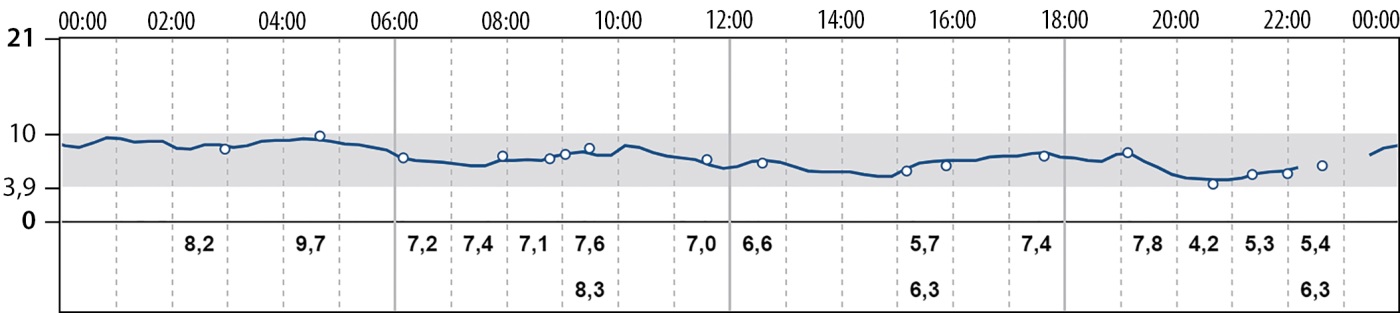
Рисунок 7. Результаты непрерывного мониторирования глюкозы на фоне базис-болюсной инсулинотерапии после панкреатэктомии.
В связи с внешнесекреторной недостаточностью ПЖ пациенту рекомендован прием полиферментных препаратов микронизированного панкреатина по 120 000 ЕД перед основными приемами пищи и по 80 000 ЕД перед перекусами.
ОБСУЖДЕНИЕ
В данной статье описан случай верификации высокодифференцированной инсулинпродуцирующей нейроэндокринной опухоли G2 у пациента с СД1. Учитывая возраст манифестации диабета (33 года), постепенное начало, сохранную собственную секрецию инсулина в дебюте заболевания (базальный С-пептид 1,03 нг/мл), отсутствие кетонурии в дебюте, а также высокий титр антител к глутаматдекарбоксилазе, вероятнее всего, у пациента имел место латентный аутоиммунный диабет взрослых.
Данный случай относится к редким и, можно сказать, казуистическим клиническим наблюдениям. Хорошо известно, что Для СД1 характерен абсолютный дефицит инсулина вследствие тотальной деструкции β-клеток, поэтому наличие инсулин-продуцирующей опухоли вызывает вопросы о механизмах ее возникновения. В связи с этим стоит кратко рассмотреть ранее описанные наблюдения пациентов с СД1 и инсулиномой.
Первый случай выявления инсулиномы у пациента с СД1 был описан в 1996 г. [7]. Пациентка 33 лет с 20-летней длительностью СД1 обратилась за медицинской помощью в связи с жалобами на частые гипогликемии и четырехкратное развитие гипогликемических ком несмотря на снижение доз инсулина и последующий полный отказ от инсулинотерапии. В течение полугода до обращения за помощью пациентка отмечала наличие болей в животе, преимущественно в левом подреберье. Также в течение этого времени пациентка потеряла в весе 7 кг. При обследовании сывороточный инсулин и С-пептид составляли 86 мЕД/л (норма<20) и 2,8 нмоль/л (норма<1,9) соответственно, что явно указывало на эндогенную выработку инсулина. В ходе диагностической лапаротомии была выявлена опухоль в хвосте ПЖ с парапанкреатическим ростом и метастазами печени, а также опухоль яичника. Гистопатологическое исследование опухоли яичника и опухоли ПЖ показало, что недифференцированная аденокарцинома имела нейроэндокринное происхождение. В опухоли была выявлена реакция аргирофилов (Гримелиус) и иммунореактивность к хромогранину и гастрину, в то время как инсулин, соматостатин, глюкагон, РР и вазоактивный интестинальный полипептид (ВИП) были отрицательными. Пациентке была выполнена резекция хвоста ПЖ с удалением прилегающей опухолевой ткани и спленэктомия.
Авторы заявляют, что данный пациент является первым описанным в литературе случаем СД1 и инсулиномы. В данном случае инсулинома была злокачественной, а плюрипотентность клеток злокачественных эндокринных опухолей ПЖ хорошо известна, что, возможно, объясняет выработку инсулина и других пептидов опухолью.
В 2012 г. были описаны еще два случая инсулиномы в сочетании с СД1 [8].
Первым авторы описывают случай 71-летней пациентки, которая в течение 25 лет отмечала регулярное развитие синкопальных состояний. Во время одного из таких эпизодов потери сознания пациентка была доставлена в стационар, где определялось снижение гликемии до 1,33 ммоль/л, уровень иммунореактивного инсулина составил 42,4 пмоль/л, уровень С-пептида 0,93 нмоль/л, что указывает на то, что секреция эндогенного инсулина физиологически не подавлялась, несмотря на тяжелую гипогликемию. Гликированный гемоглобин — 4,6%. При визуализирующем исследовании была обнаружена опухоль размером 22 мм, локализованная в головке ПЖ. Проведена хирургическая энуклеация опухоли. Патанатомический диагноз: «Нейроэндокринное новообразование ПЖ, вырабатывающее инсулин (инсулинома)».
Через 3 месяца после операции уровень глюкозы в плазме крови пациентки натощак составил 8,49 ммоль/л, уровень HbA1c — 9,2%, а уровень С-пептида в сыворотке крови снизился до 0,30 нмоль/л. Нагрузочный тест с 1 мг глюкагона показал, что уровень С-пептида в сыворотке крови составил 0,30 нмоль/л до стимуляции и 0,53 нмоль/л через 6 мин после стимуляции, что указывает на нарушение секреции эндогенного инсулина. Кроме того, у нее был положительный результат на антитела к глутаматдекарбоксилазе (GAD) (130 ЕД/мл), (HLA)-DR4- гаплотип HLA II класса, ассоциированный с развитием СД1, что указывает на наличие аутоиммунного СД1.
Во втором случае пациент 49 лет в течение 4 месяцев страдал от повторяющихся приступов головокружения и изменений личности, связанных с гипогликемией. Анализы крови натощак показали уровень глюкозы в плазме крови 1,55 ммоль/л, уровень иммунореактивного инсулина — 43,8 пмоль/л и уровень С-пептида в сыворотке крови — 1,10 нмоль/л, что свидетельствует о неадекватной секреции инсулина. Гликированный гемоглобин — 6%. В последующем были выявлены и удалены две опухоли (18 мм в головке ПЖ, 7 мм в хвосте ПЖ).
Сразу после удаления опухолей уровень глюкозы в крови пациента повысился примерно до 22,2 ммоль/л, а в сыворотке крови уровень С-пептида снизился до 0,03 нмоль/л. У него также были обнаружены антитела к GAD (1228 ед/мл), что характерно для СД1.
В ходе гистологического исследования опухолевые клетки показали положительный результат на инсулин, но не на глюкагон (данные не показаны). Патологоанатомический диагноз: «Инсулинома». Интересно, что воспалительные клетки густо инфильтрировали часть очагов инсулиномы, аналогично инсулиту, наблюдаемому при типичном СД1.
Как отмечают авторы, подобные гистологические данные не наблюдались при типичной инсулиноме у других пациентов без СД1 (данные не приведены). В то же время в неопухолевой ткани ПЖ наблюдалась небольшая инфильтрация воспалительными клетками вокруг остаточных островков, которые состояли исключительно из глюкагон-положительных клеток, без инсулин-положительных клеток, что может быть связано с разрушением β-клеток аутоантителами. Количественная оценка показала, что положительные CD8 клетки были обнаружены в 36,7% (11 из 30) островков, а положительные CD68 клетки (моноциты) были обнаружены в 50% (15 из 30) островков, что свидетельствует о частичном сохранении антиостровкового аутоиммунитета.
Общей чертой этих двух пациентов было развитие гипергликемии после удаления инсулиномы, что можно отнести на счет сопутствующего СД1.
Учитывая, что у первой пациентки через нескольких месяцев после удаления инсулиномы в сыворотке крови был обнаружен относительно низкий уровень С-пептида, а также высокий титр антител к GAD и HLA-DR4, было сделано заключение, что у нее имелся медленно прогрессирующий СД1. Поскольку окружающая инсулиному непораженная ткань ПЖ не содержала никаких панкреатических островков в теле или хвосте, затруднительно ответить на вопрос, существовал ли в нормальной ткани ПЖ инсулит, приведший к СД1.
Любопытным моментом в этом исследовании является то, что у второго пациента описаны многочисленные воспалительные клетки, инфильтрировавшие инсулиному. Что касается этих результатов, исследование на животных показало, что у одной трансгенной мыши-диабетика без ожирения развился аутоиммунный диабет с сопутствующей инсулиномой в ПЖ. Очаги инсулиномы были инфильтрированы воспалительными клетками, а в неопухолевой ткани ПЖ выявлен типичный для СД1 инсулит [9].
Последний описанный случай сосуществования СД1 и инсулиномы относится к 2015 г. [10].
Приводится история пациента 31 года с СД1 с 3 лет. Верификация СД1 была основана на дефиците массы тела, склонности к развитию кетоацидоза и возрасте манифестации. Исследование антител, специфичных для СД1, на тот момент было недоступно, однако спустя 28 лет определялись незначительно повышенные антитела к GAD (1,2 МЕ/мл (< 1)).
На момент обращения за медицинской помощью гликированный гемоглобин составлял 15%, что говорит о преобладании гипергликемий у данного пациента. В дальнейшем, в связи с развитием частых гипогликемий, пациент был вынужден снизить суточную дозу инсулина, а затем отказаться от инсулинотерапии окончательно. На фоне отсутствия терапии в течение 4 месяцев кетоацидоза зафиксировано не было, вес пациента оставался стабильным, а гликированный гемоглобин снизился до 8,2%.
В ходе проведенной пробы с голоданием отметилось снижение гликемии до 2,1 ммоль/л, инсулин — 18,06 мМЕ/мл (<13), С-пептид — 7,81 нг/мл (<3,53). Прием препаратов сульфонилмочевины был исключен лабораторно. По результатам КТ визуализировалась опухоль в головке ПЖ 63*56 мм в диаметре, которая в дальнейшем была удалена хирургически.
Патологоанатомический диагноз указывал на высокодифференцированную нейроэндокринную опухоль G2 (частота митозов 6/10 HPF, индекс деления >5%). Иммуногистохимическое окрашивание подтвердило экспрессию инсулина в цитоплазме 10% опухолевых клеток. Были обнаружены два метастатических узла, что окончательно подтвердило злокачественность. Анализ перитуморальной ткани ПЖ не выявил остаточных островков Лангерганса. Внутри- или околоопухолевой лимфоцитарной инфильтрации обнаружено не было.
Авторами одной из приведенных статей поднят вопрос о парадоксальном отсутствии аутоиммунного ответа к клеткам злокачественной инсулиномы при СД1. Известно, что лимфоциты пациентов с СД1 демонстрируют цитотоксичность по отношению к клеткам инсулиномы человека in vitro по сравнению с лимфоцитами здоровых людей, не страдающих СД [11][12]. Быстрое развитие деструктивного инсулита является хорошо известным явлением при трансплантации нормальных аллогенных эндокринных β-клеток реципиентам с СД1, и это было подтверждено сообщениями об исходах трансплантации ПЖ у монозиготных близнецов [13].
Такое бегство от аутоиммунного надзора может быть объяснено несколькими механизмами: клетки инсулиномы могут по-разному экспрессировать аутоантигены-мишени; процессинг нормальных аутоантигенов антигенпрезентирующими клетками может быть изменен; передача сигналов цитотоксическим Т-клеткам памяти может быть изменена посредством неизвестного механизма. Нет никаких доказательств в пользу какого-либо одного объяснения, за исключением того, что отсутствие инсулита вокруг или внутри опухолевой ткани свидетельствует против экспансии регуляторных Т-клеток, в то время как сохранение низких уровней аутоантител к GAD может быть объяснено некоторой степенью иммуногенности опухоли и/или незначительным количеством остаточных здоровых β-клеток. Клетки инсулиномы грызунов и человека обычно сохраняют свою иммунореактивность in vitro и in vivo [14–16].
ЗАКЛЮЧЕНИЕ
Данный клинический случай является первым в мировой и отечественной литературе описанием возникновения злокачественной инсулиномы у пациента с LADA-диабетом. Постепенное снижение потребности в препаратах экзогенного инсулина в сочетании с рецидивирующими гипогликемиями позволило заподозрить диагноз, который был подтвержден в результате пробы с голоданием.
Хотелось бы сделать акцент на том, что после лабораторного подтверждения эндогенного гиперинсулинизма необходимо провести тщательный инструментальный поиск опухоли. КТ может быть недостаточно чувствительной для диагностики инсулиномы небольших размеров, и в нашей практике ранее встречались подобные пациенты с несомненной клинико-лабораторной картиной эндогенного гиперинсулинизма и отсутствием образования в поджелудочной железе по данным КТ. В такой ситуации необходим пересмотр результатов КТ одним или по возможности несколькими экспертами. При отсутствии визуализации образования по данным КТ показано проведение эндоскопического УЗИ врачом экспертного уровня.
Необходимо подчеркнуть, что с учетом данных литературы инсулинома у пациента с СД1 с большой долей вероятности будет злокачественной. Данный клинический пример наглядно демонстрирует неожиданную возможную причину рецидивирующих гипогликемий у пациента с СД1.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Источники финансирования. Работа выполнена по инициативе авторов без привлечения финансирования.
Участие авторов. Аметов А.С. — участие в консилиуме, редактирование текста статьи, внесение правок с целью повышения научной ценности статьи, утверждение рукописи для публикации; Тавобилов М.М. — проведение хирургического вмешательства, участие в консилиуме, заведующий отделением хирургии печени и поджелудочной железы, редактирование текста статьи, внесение правок с целью повышения научной ценности статьи; Карпов А.А. — участие в консилиуме, редактирование текста статьи, внесение правок с целью повышения научной ценности статьи; Закурдаев Е.И. — патологоанатомическое исследование операционного материала, написание текста, внесение в текст статьи правок с целью повышения научной ценности статьи; Пашкова Е.Ю. — заведующий отделением эндокринологии, лечащий врач, написание текста, редактирование текста статьи, внесение правок с целью повышения научной ценности статьи, обработка, анализ и интерпретация данных; Анциферова Д.М. — клинический ординатор отделения эндокринологии, написание текста, обзор публикаций по теме статьи, оформление статьи, обработка, анализ и интерпретация данных. Все авторы одобрили финальную версию статьи перед публикацией и выразили согласие нести ответственность за все аспекты проведенной работы.
Список литературы
1. Wilder RM, Allan FN, Power MH, et al. Carcinoma of the islands of the pancreas: hyperinsulinism and hypoglycemia. JAMA. 1927;89(5):348-355. doi: https://doi.org/10.1001/JAMA.1927.02690050014007
2. Crippa S, Zerbi A, Boninsegna L, et al. Surgical management of insulinomas: short- and long-term outcomes after enucleations and pancreatic resections. Arch Surg. 2012;147(3):261-266. doi: https://doi.org/10.1001/ARCHSURG.2011.1843
3. Service FJ, McMahon MM, O’Brien Peter C, et al. Functioning insulinoma--incidence, recurrence, and long-term survival of patients: a 60-year study. Mayo Clin Proc. 1991;66(7):711-719. doi: https://doi.org/10.1016/S0025-6196(12)62083-7
4. Giannis D, Moris D, Karachaliou GS, et al. Insulinomas: from diagnosis to treatment. A review of the literature. J BUON. 2020;25(3):1302-1314
5. Rostambeigi N, Thompson GB. What should be done in an operating room when an insulinoma cannot be found? Clin Endocrinol (Oxf ). 2009;70(4):512-515. doi: https://doi.org/10.1111/J.1365-2265.2009.03527.X
6. Kane LA, Grant CS, Nippoldt TB, et al. Insulinoma in a patient with NIDDM. Diabetes Care. 1993;16(9):1298-1300. doi: https://doi.org/10.2337/DIACARE.16.9.1298
7. Svartberg J, Stridsberg M, Wilander E, et al. Tumour-induced hypoglycaemia in a patient with insulin-dependent diabetes mellitus. J Intern Med. 1996;239(2):181-185. doi: https://doi.org/10.1046/J.1365-2796.1996.405750000.X
8. Oikawa Y, Katsuki T, Kawasaki M, et al. Insulinoma may mask the existence of Type 1 diabetes. Diabet Med. 2012;29(7):e138-41. doi: https://doi.org/10.1111/J.1464-5491.2012.03615.X
9. Zwicker K, Chatten C, Gratton K, et al. Spontaneous autoimmunity sufficiently potent to induce diabetes mellitus is insufficient to protect against insulinoma. J Immunol. 2009;183(3):1705-1714. doi: https://doi.org/10.4049/JIMMUNOL.0800902
10. Lablanche S, Chobert-Bakouline M, Risse O, et al. Malignant insulinoma may arise during the course of type 1 diabetes mellitus: A case report. Diabetes Metab. 2015;41(3):258-261. doi: https://doi.org/10.1016/J.DIABET.2014.08.004
11. Roep BO, Arden SD, De Vries RRP, et al. T-cell clones from a type-1 diabetes patient respond to insulin secretory granule proteins. Nature. 1990;345(6276):632-634. doi: https://doi.org/10.1038/345632A0
12. Huang SW, MacLaren NK. Insulin-dependent diabetes: a disease of autoaggression. Science. 1976;192(4234):64-66. doi: https://doi.org/10.1126/SCIENCE.769160
13. Ishida-Oku M, Iwase M, Sugitani A, et al. A case of recurrent type 1 diabetes mellitus with insulitis of transplanted pancreas in simultaneous pancreas-kidney transplantation from cardiac death donor. Diabetologia. 2010;53(2):341-345. doi: https://doi.org/10.1007/S00125-009-1593-3
14. Vliet E Van, Roep BO, Meulenbroek L, et al. Human T cell clones with specificity for insulinoma cell antigens. Eur J Immunol. 1989;19(1):213-216. doi: https://doi.org/10.1002/EJI.1830190136
15. Monetini L, Cavallo MG, Barone F, et al. T cell reactivity to human insulinoma cell line (CM) antigens in patients with type 1 diabetes. Autoimmunity. 1999;29(3):171-177. doi: https://doi.org/10.3109/08916939908998532
16. Bashratyan R, Sheng H, Regn D, et al. Insulinoma-released exosomes activate autoreactive marginal zone-like B cells that expand endogenously in prediabetic NOD mice. Eur J Immunol. 2013;43(10):2588-2597. doi: https://doi.org/10.1002/EJI.201343376
Об авторах
А. С. АметовРоссия
Аметов Александр Сергеевич - д.м.н., профессор.
Москва
Конфликт интересов:
Нет
М. М. Тавобилов
Россия
Тавобилов Михаил Михайлович - к.м.н., доцент.
Москва
Конфликт интересов:
Нет
А. А. Карпов
Россия
Карпов Алексей Андреевич.
Москва
Конфликт интересов:
Нет
Е. И. Закурдаев
Россия
Закурдаев Евгений Иванович - к.м.н.
Москва
Конфликт интересов:
Нет
Е. Ю. Пашкова
Россия
Пашкова Евгения Юрьевна - к.м.н., доцент.
125284, Москва, 2-й Боткинский пр-д, д. 5
Конфликт интересов:
Нет
Д. М. Анциферова
Россия
Анциферова Дарья Михайловна – аспирант.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
|
|
1. Рисунок 1. Результаты самоконтроля гликемии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(359KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Эндо-УЗИ. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(670KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Результаты непрерывного мониторирования глюкозы до операции. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(905KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Опухоль головки поджелудочной железы на разрезе. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(358KB)
|
Метаданные ▾ | |
|
|
5. Рисунок 5. Гистологическая картина нейроэндокринной опухоли поджелудочной железы. Окраска гематоксилин эозин, ув. х5-х20. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(3MB)
|
Метаданные ▾ | |
|
|
6. Рисунок 6. Иммуногистохимические реакции в ткани нейроэндокринной опухоли с Synaptophysin (a-b), chromogranin (c-d), CD56 (e-f), Ki-67 (g-h). | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(3MB)
|
Метаданные ▾ | |
|
|
7. Рисунок 7. Результаты непрерывного мониторирования глюкозы на фоне базис-болюсной инсулинотерапии после панкреатэктомии. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(253KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Аметов А.С., Тавобилов М.М., Карпов А.А., Закурдаев Е.И., Пашкова Е.Ю., Анциферова Д.М. Клинический парадокс: инсулинома у пациента с сахарным диабетом 1 типа. Сахарный диабет. 2025;28(3):295-304. https://doi.org/10.14341/DM13240
For citation:
Ametov A.S., Tavobilov M.M., Karpov A.A., Zakurdaev E.I., Pashkova E.Y., Antsiferova D.M. Clinical paradox: insulinoma in a patient with type 1 diabetes mellitus. Diabetes mellitus. 2025;28(3):295-304. (In Russ.) https://doi.org/10.14341/DM13240
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































