Перейти к:
Новая эра кардионефропротекции у больных с сахарным диабетом 2 типа: как использовать возможности терапии препаратом финеренон
https://doi.org/10.14341/DM13222
Аннотация
Основной задачей современного здравоохранения является повышение продолжительности и качества жизни пациентов, особенно с социально значимыми заболеваниями, такими как сахарный диабет 2 типа (СД2) и его осложнения. Хроническая болезнь почек (ХБП) — одно из наиболее частых осложнений СД2, которым страдают свыше 160 млн человек и является независимым фактором риска сердечно-сосудистых (СС) осложнений, терминальной стадии почечной недостаточности, требующей проведения гемодиализа или трансплантации почек. Эффективное управление кардиоренальными рисками и осложнениями СД2 с помощью назначения пациентам блокаторов ренин-ангиотензин-альдостероновой системы и ингибиторов натрий-глюкозного котранспортера 2 типа дополнилось в 2023 г. новым селективным нестероидным антагонистом минералокортикоидных рецепторов — финереноном. Этот единственный в своем классе препарат позволяет значительно улучшить управляемость процессами воспаления, фиброза в почках и ремоделирования миокарда. В данной публикации представлены эффекты финеренона в отношении темпов ежегодного снижения расчетной скорости клубочковой фильтрации как основного показателя функции почек, а также предложены практические рекомендации по обеспечению безопасной инициации тройной кардионефропротективной терапии ХБП при СД2 в соответствии с действующими клиническими рекомендациями.
Ключевые слова
Для цитирования:
Халимов Ю.Ш., Полякова Е.А., Шутова Ю.А. Новая эра кардионефропротекции у больных с сахарным диабетом 2 типа: как использовать возможности терапии препаратом финеренон. Сахарный диабет. 2024;27(6):620-628. https://doi.org/10.14341/DM13222
For citation:
Khalimov I.S., Polyakova E.A., Shutova Yu.A. A new era of cardiac nephroprotection in patients with type 2 diabetes mellitus: the role of Finerenone. Diabetes mellitus. 2024;27(6):620-628. (In Russ.) https://doi.org/10.14341/DM13222
ВВЕДЕНИЕ
Хроническая болезнь почек (ХБП) — это одно из наиболее тяжелых осложнений сахарного диабета 2 типа (СД2), сопровождающееся признаками повреждения структуры и функции почек, определяемых в клинической практике как снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин/1,73 м² и/или появление альбуминурии, сохраняющиеся при повторных исследованиях в течение 3 месяцев и более [1].
Распространенность ХБП очень высока и сопоставима с частотой встречаемости СД2 и гипертонической болезни (ГБ) [2]. Лидирующими причинами ХБП являются вторичные поражения почек при сердечно-сосудистых заболеваниях (артериальной гипертонии и системном атеросклерозе) и СД2 [2]. Распространенность нефропатии подобного генеза в популяции достаточна высока и продолжает стремительно увеличиваться из-за роста числа пациентов, страдающих СД2, ожирением, ГБ, а также вследствие повышения среднего возраста населения, диеты с повышенным содержанием простых углеводов и насыщенных жиров, а также гиподинамии [3][4].
Высокая встречаемость ХБП, ассоциированной с СД2, обусловлена несколькими ведущими причинами. Во-первых, на фоне увеличения продолжительности жизни этих больных за счет повышения частоты назначения статинов и блокаторов ренин-ангиотензин-альдостероновой системы (РААС), также и летальность от инфаркта миокарда и инсульта снизилась, что повысило вероятность дожития до развития значимого поражения почек [4]. Во-вторых, несмотря на значительные успехи в борьбе с СД2, ГБ и атеросклерозом, контроль этих состояний не является полным, поскольку не предупреждает развития ХБП [5]. Так, в последние годы значительно большая доля больных с СД2 и ГБ доживает до терминальной стадии ХБП, но на этом «успехи» заканчиваются. Поздние стадии ХБП сопровождаются необходимостью проведения того или иного варианта заместительной почечной терапии, а риск развития сердечно-сосудистых осложнений (ССО) возрастает у таких пациентов в десятки раз по сравнению с лицами без поражения почек [3][5].
Риск ССО резко возрастает уже с первой стадии ХБП, поэтому на всех стадиях ХБП необходимо проводить как нефропротективное лечение, так и кардиопротективные мероприятия [1][5].
Диабетическая нефропатия является проблемой для врачей смежных специальностей: эндокринологов, кардиологов, нефрологов и врачей общей практики. За счет высокой распространенности коморбидной патологии течение диабетической нефропатии могут усугублять артериальная гипертония, ожирение и атеросклероз почечных артерий.
ТЕМПЫ ПРОГРЕССИРОВАНИЯ ХБП ИНДИВИДУАЛЬНЫ И МОГУТ ОПРЕДЕЛЯТЬСЯ ГЕНЕТИЧЕСКИ, ЧТО ОБУСЛОВЛИВАЕТ НЕОБХОДИМОСТЬ РАННЕЙ ДИАГНОСТИКИ И ИНДИВИДУАЛЬНОГО ПОДХОДА
Понятным клиницисту показателем, отражающим состояние почечной функции, является уровень расчетной СКФ (рСКФ). Согласно современной 5-стадийной классификации ХБП, в соответствии с действующими национальными клиническими рекомендациями Ассоциации нефрологов РФ и рекомендациями Kidney Disease Improving Global Outcomes (KDIGO), персистирующее в течение 3 месяцев снижение рСКФ<60 мл/мин/1,73 м², и у пациента с СД2 даже в отсутствие альбуминурии, свидетельствует о нарушении функции почек и требует постановки диагноза ХБП [6][7]. Данная классификация основана на данных, полученных в общей популяции, и не учитывает возраст и индивидуальные характеристики пациента, в то время как пороговое значение рСКФ, ассоциированное с риском смерти, отличается для молодых и более пожилых пациентов. РСКФ выше 60 мл/мин/1,73 м² имеет отрицательное прогностическое значение для пациентов младше 40 лет, в то же время рСКФ ниже 60 мл/мин/1,73 м² при отсутствии белка в моче у пациентов старше 65 лет может быть снижением почечной функции, ассоциированным с процессами старения [8].
Человек с рождения имеет фиксированное количество нефронов, которое определяет индивидуальный резерв его почечной функции и продолжительность жизни почек, так как ежегодно до 0,7–1 мл/мин/1,73 м² происходят потери фильтрующего объема почек под воздействием различных факторов среды и образа жизни [9]. Повышенная нагрузка объемом потребляемой жидкости, высокая солевая нагрузка, высокобелковое питание, беременность, прием препаратов, оказывающих нефротоксическое действие (например, нестероидные противовоспалительные средства (НПВС)), и т.д. также способствуют снижению функции почек. При сохранении адекватного уровня нагрузки на единицу нефрона у человека с достаточным почечным резервом (т.е. количеством функциональных нефронов) почки могут адаптироваться, выдерживая даже значительные нагрузки без развития ХБП. Примечательно, при возраст-ассоциированном нефросклерозе у относительно здоровых людей снижение рСКФ не осложнено такими признаками повреждения почек, как альбуминурия, поскольку метаболическая нагрузка у этих пациентов уменьшается соразмерно функции их почек [10].
Однако у пациентов с СД2, ГБ и ожирением повышенная нагрузка на почки приобретает хронический характер, что ведет к неминуемой гибели нефронов. Оставшиеся нефроны берут на себя дополнительную нагрузку для поддержания почечного гомеостаза и обеспечения необходимого уровня фильтрации [9]. Вследствие хронического воздействия на почечные клубочки и канальцы гемодинамических, метаболических, воспалительных и профибротических факторов, нефроны переходят в состояние гиперфильтрации (функциональной перегрузки), которое и отличает ХБП от физиологичного снижения почечной функции. Повышенное внутриклубочковое давление приводит к адаптивным изменениям со стороны эпителиальных и мезангиальных клеток клубочка и канальца (развивается гипертрофия), однако адаптивные возможности подоцитов сильно ограничены, что ведет к необратимым структурным изменениям нефрона и утрате сначала клеток (фокальный гломерулосклероз), а потом и всего нефрона как функциональной единицы [10].
Темпы прогрессирования ХБП у пациента с СД2 индивидуальны и могут варьировать, достигая 6–10 мл/год (рис. 1) [11].
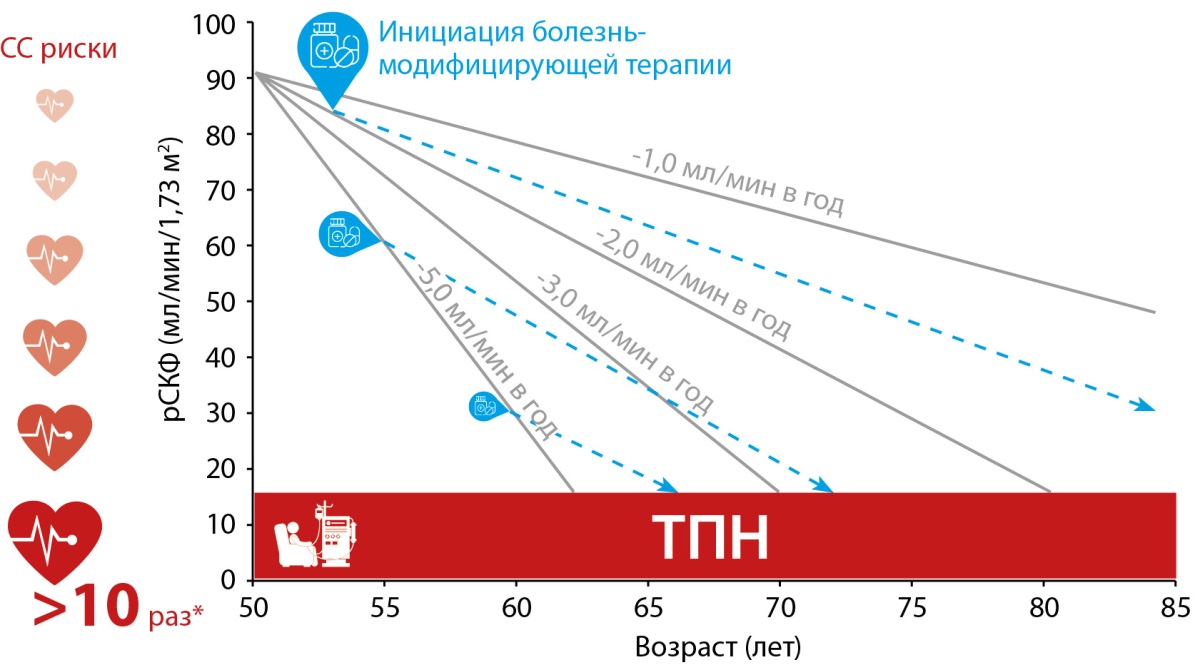
Рисунок 1. Возможные траектории прогрессирования хронической болезни почек.
Примечание. *По сравнению с пациентами с рСКФ 90–104 мл/мин и альбуминурией <10 мг/г. Адаптировано из Wilmer WA с соавт. [11].
ТПН — терминальная почечная недостаточность; СС риски — сердечно-сосудистые риски; рСКФ — расчетная скорость клубочковой фильтрации.
Поскольку точно спрогнозировать темпы снижения функции почек у конкретного пациента с СД2 невозможно, принципиально важное значение имеет ранняя диагностика и своевременно назначенная терапия, направленная на замедление этого необратимого процесса [10].
Таким образом, важной клинической задачей ведения пациента с СД2 является назначение препаратов с нефропротективным потенциалом для ранней профилактики поражения почек и предупреждения развития или прогрессирования ХБП, если все же предупредить развитие этого осложнения не удалось.
«ОКНО ВОЗМОЖНОСТЕЙ» ДЛЯ РАННЕЙ ДИАГНОСТИКИ
В случае наличия у пациента начальных стадий протеинурии прогрессирование ХБП в некоторых случаях характеризуется сверхфизиологичным повышением рСКФ до >130–140 мл/мин/1,73 м² (при расчете по формуле CKD-EPI) в ответ на возросшую нагрузку [12]. Несмотря на то, что гиперфильтрация является первым признаком ХБП, в клинической практике она, наоборот, может маскировать начальные этапы нефропатии. К примеру, при уровне рСКФ 120 мл/мин/1,73 м² в разные периоды времени у одного и того же пациента могут функционировать 100% нефронов или же оставшиеся перегруженные 50% (рис. 2) [12].
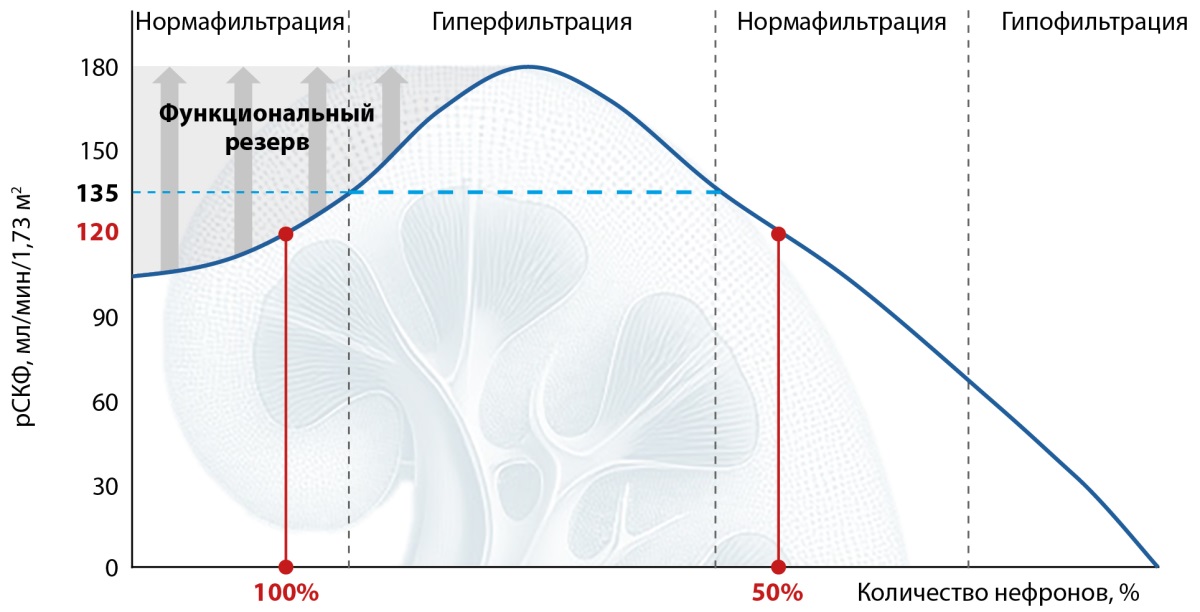
Рисунок 2. Почечная функция в зависимости от количества оставшихся функциональных нефронов. Адаптировано из Tonneijck L и соавт. [12].
Примечание. рСКФ — расчетная скорость клубочковой фильтрации.
К моменту верификации ХБП на основании критерия рСКФ <60 мл/мин/1,73 м² у пациента уже может быть утеряно до 50% функционирующих нефронов [13]. Несовершенства дискретной оценки рСКФ подчеркивают необходимость динамического наблюдения для своевременного контроля темпов прогрессирования ХБП. Кроме того, наряду с рСКФ требуется оценка дополнительных маркеров снижения функции почек таких как альбуминурия [6][7].
Альбуминурия является важным диагностическим и прогностическим маркером в отношении кардиоренальных исходов у пациентов с ХБП и СД2, оказывая прямое повреждающее действие на нефроны. Выраженность альбуминурии характеризует темпы прогрессирования нарушения функции почек до терминальной почечной недостаточности (ТПН), а также стойко ассоциирована с кратно возрастающим риском ССО. Поэтому рутинное измерение альбуминурии всем пациентам с СД2, включая пациентов с уже диагностированной ХБП, позволяет не только оценить прогноз в отношении кардиоренальных рисков, но также может служить критерием для оценки нефропротективного эффекта терапии [7][13][15].
ТЕМПЫ СНИЖЕНИЯ РСКФ КАК ПРЕДИКТОР СЕРДЕЧНО-СОСУДИСТЫХ И ПОЧЕЧНЫХ РИСКОВ
Значимость оценки таких клинико-лабораторных параметров, как HbА1c, АД, холестерин ЛПНП и неЛПВП, в управлении рисками осложнений у пациента с СД2 очевидна. Более точный подход к управлению микро- и макрососудистыми рисками у пациента с СД2 может включать оценку темпов снижения рСКФ: динамику наклона кривой рСКФ [16].
Метаанализ 15 исследований выявил ассоциацию темпов снижения рСКФ у пациентов с СД2 с развитием различных осложнений. Пациенты с более выраженным снижением рСКФ в течение года характеризовались более высоким риском смерти от всех причин, СС событиями, прогрессированием до ТПН, микрососудистыми осложнений (не включая ТПН) в 2,31 раза (95%ДИ 1,70–3,15), в 1,73 раза (95%ДИ 1,43–2,08), в 1,54 раза (95%ДИ 1,45–1,64), в 2,07 раза (95%ДИ 1,57–2,73) соответственно. Суммарно риск любых осложнений у пациентов с более выраженным ежегодным снижением рСКФ был выше в 1,82 раза (95%ДИ 1,72–1,92) по сравнению с пациентами с более пологим наклоном снижения рСКФ. Причем по мере увеличения темпов ежегодного снижения рСКФ возрастали риски СС и почечных событий [16].
Клинические рекомендации KDIGO определяют быстрые темпы прогрессирования ХБП как снижение рСКФ на 5 и более мл/мин/1,73 м² в год [17]. В то же время в ряде исследований была выявлена взаимосвязь менее выраженного снижения рСКФ с неблагоприятным прогнозом, составляющая 3 мл/мин/1,73 м² в год [18][19].
Полученные результаты позволяют сделать вывод о том, что ежегодное снижение рСКФ значимо влияет на прогноз у пациентов с СД2 и по предсказательной ценности неблагоприятных исходов может быть сопоставим с HbA1c [16]. Таким образом, оценка рСКФ в динамике может способствовать лучшей управляемости СС и почечными рисками у каждого конкретного пациента.
ТЕМПЫ СНИЖЕНИЯ СКФ НА ФОНЕ ТЕРАПИИ КАК КРИТЕРИЙ ОЦЕНКИ ЕЕ ЭФФЕКТИВНОСТИ
Одной из основных целей нефропротективной терапии является замедление темпов снижения функции почек, а общепринятой суррогатной конечной точкой в РКИ по оценке эффективности новых методов лечения ХБП является отклонение рСКФ от исходного значения на 57%, что соответствует удвоению сывороточного креатинина и характеризует выраженное нарушение функции почек. Вместе с тем высокая потребность пациентов в новых эффективных методах лечения требует поиска альтернативных критериев [20]. В 2012 г. рабочая группа NKF-FDA утвердила в качестве такого порогового критерия снижение рСКФ на 40% от исходного значения на основании накопленных данных. Однако применение последней суррогатной конечной точки ограничено у пациентов на ранних стадиях ХБП, а также при оценке эффективности терапии препаратами с потенциальным гемодинамическим эффектом. Оказывая влияние на внутриклубочковую гемодинамику, такие нефропротективные препараты, как ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов ангиотензина II (иАПФ/БРА), ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2) и единственный в своем классе нестероидный антагонист минералокортикоидных рецепторов (нсАМКР) препарат финеренон снижают внутриклубочковое давление, снимая избыточную нагрузку с нефронов, что может сопровождаться снижением общей рСКФ почек в ранний период после инициации терапии. Несмотря на то, что в долгосрочной перспективе назначение таких препаратов сопровождалось замедлением темпов снижения рСКФ, ранний эффект в виде снижения рСКФ всего на <1,25 мл/мин/1,73 м² в первые три месяца может занижать реальный эффект терапии. Поэтому в исследованиях финеренона FIGARO, FIDELIO, FIDELITY оценивались оба этих параметра: снижение рСКФ на 40 и 57%, что позволило продемонстрировать значимый нефропротективный эффект финеренона и предоставить пациентам с ХБП и СД2 новую возможность для замедления необратимого процесса утраты функциональной почечной ткани [21][22][23].
Позднее, в 2018 г. рабочая группа NKF в коллаборации с FDA и EMA утвердили новую суррогатную точку, применимую для оценки эффективности нефропротективной терапии у пациентов на ранних стадиях ХБП [20]. Особенную важность представляет данный факт в связи с тем, что у пациента с СД2 на ранних стадиях ХБП (С1-2) значимо возрастают СС риски, в то время как почечная функция не достигнет ТПН еще несколько лет. Такие пациенты часто погибают от ССО, не дожив до заместительной почечной терапии, при этом уровень диагностики ХБП у них остается на очень низком уровне. Для более точной и своевременной оценки рисков у пациентов на ранних стадиях ХБП важно учитывать не только и не столько риск развития ТПН, сколько оценить риски прогрессирования ХБП и учесть возрастающие СС риски [6]. Трудность заключается в том, что общепринятые формулы расчета абсолютного риска, разработанные для пациентов с ХБП С3-5, являются недостаточно точными и не рекомендованы для расчета рисков у пациентов с более ранними стадиями заболевания. В то же время на ранних стадиях возможно значительное снижение рСКФ в течение 2–5 лет без достижения терминальной почечной недостаточности. Так, у гипотетического пациента 50 лет с СД2, рСКФ 80 мл/мин/1,73 м² и соотношением А/Кр 10 мг/г риск развития ТПН в течение 5 лет составляет всего 0,23%, в то время как риск прогрессирования ХБП в течение 3 лет может быть более 10%. В этой связи наблюдение за темпами ежегодного снижения рСКФ может обеспечить более раннее выявление пациентов высокого риска с возможностью коррекции этих рисков у пациента [24].
Эффект фармакологических препаратов в отношении наклона кривой рСКФ отражает их влияние на почечный прогноз и позволяет оценить эффект у пациентов даже на ранних стадиях заболевания почек. По данным метаанализа 47 рандомизированных клинических исследований замедление темпов снижения рСКФ в течение 3 лет на фоне терапии на каждые 0,75 мл/мин/1,73 м² в год ассоциировалось со снижением риска развития почечных событий на 27% [25]. Исследования реальной клинической практики показали, что уменьшение наклона кривой рСКФ в течение 2 лет на фоне терапии на 0,75 мл/мин/1,73 м² в год способствует снижению риска развития ТПН на ~30% в более долгосрочной перспективе [26].
Таким образом, изменение наклона кривой рСКФ является клинически подкрепленной валидированной суррогатной конечной точкой и может использоваться в РКИ III фазы для оценки нефропротективного эффекта новых методов терапии наряду с выраженным снижением рСКФ на 57% от исходного значения: разница в уменьшении наклона кривой рСКФ на 0,5–1,0 мл/мин/1,73 м² в год является порогом, необходимым для демонстрации большего нефропротективного эффекта препарата и его влияния на клинические исходы [20]. Для препаратов, инициация терапии которыми ассоциирована со снижением рСКФ в краткосрочном периоде, анализ общего наклона кривой рСКФ является непоказательным. В этом случае следует оценивать хронический наклон кривой рСКФ, исключая первые три месяца после назначения терапии, когда препараты нормализуют внутриклубочковое давление [21][22]. Независимо от способа оценки эффективности терапии, практический интерес представляет сохранение каждого миллилитра фильтрационной способности почек, поскольку это снижает почечные риски и отдаляет прогрессирование ХБП до терминальной стадии.
НОВЫЕ ВОЗМОЖНОСТИ ДЛЯ СОХРАНЕНИЯ ПОЧЕЧНОЙ ФУНКЦИИ У ПАЦИЕНТОВ С ХБП НА ФОНЕ СД2
Современные стандарты лечения ХБП при СД2 предлагают многофакторное воздействие на разные пути прогрессирования заболевания (гемодинамические, метаболические, воспалительные и профибротические факторы) и подразумевают необходимость назначения всех 3 составляющих базовой кардионефропротективной терапии, включая иАПФ/БРА, иНГЛТ-2 и единственный в своем классе нсАМКР — финеренон. Каждый из трех классов препаратов независимо от других способствует замедлению темпов снижения рСКФ, отдаляя наступление ТПН и снижая риск ССО, что подтверждено результатами крупных многоцентровых исследований [27].
Финеренон является первым представителем нсАМКР, показанным для лечения взрослых пациентов с ХБП и альбуминурией на фоне СД2 с целью кардионефропротекции. Финеренон был зарегистрирован в РФ в 2023 г. и доступен для назначения пациентам [28]. Селективный нсАМКР финеренон был изучен в 2-х комплементарных РКИ 3 фазы (FIDELIO-DKD и FIGARO-DKD), а также в их объединенном анализе FIDELITY, доказав свое влияние на прогноз в дополнение к стандартной терапии максимально переносимыми дозами иАПФ/БРА в широкой популяции среди 13 026 пациентов с СД2 и разными стадиями ХБП (С1-4). В течение 3 лет финеренон значимо снижал риск развития комбинированной почечной конечной точки (развитие ТПН, устойчивое снижение рСКФ на 57%, смерть от почечных причин) на 23% (ОР=0,77, 95%ДИ 0,67-0,88) независимо от исходных значений рСКФ и соотношения А/Кр [29][30]. Уникальность финеренона заключается в его способности таргетно воздействовать на процессы воспаления и фиброза, блокируя гиперактивацию минералокортикоидных рецепторов в почках и сердце, что получило подтверждение на уровне доклинических исследований, а также в анализе лабораторных данных исследования FIGARO-DKD, продемонстрировавших значимое снижение концентрации маркеров воспаления и фиброза на фоне терапии финереноном [31]. Кроме того, распределение препарата в тканях почек и сердца, равное 1:1 и короткий период полувыведения (2–3 часа) в значительной степени обеспечили финеренону благоприятный профиль безопасности в отношении риска развития гиперкалиемии [32]. Общая частота случаев повышения уровня калия в крови была выше в группе пациентов, получающих финеренон по сравнению с плацебо, однако частота случаев клинически значимой гиперкалиемии в группе финеренона была невысокой. Случаев гиперкалиемии, приведшей к смерти, за 3 года наблюдения среди 13 тысяч пациентов зарегистрировано не было [30]. Эти и другие клинические отличия финеренона от стероидных антагонистов минералокортикоидных рецепторов (cАМКР) определили его текущую позицию в клинических рекомендациях (доказательность уровня А) по лечению ХБП у пациентов с СД2, а эксперты ADA подчеркнули, что результаты терапии финереноном не могут быть экстраполированы на другие препараты, поскольку сАМКР и нсАМКР являются разными классами [33].
Финеренон, как и иАПФ/БРА или иНГЛТ-2, способен снижать внутриклубочковое давление, а его назначение может сопровождаться снижением рСКФ в раннем периоде за счет снижения нагрузки на нефроны [34]. В общей популяции FIDELITY финеренон, начиная с 4-го месяца терапии и до ее окончания, замедлял темпы ежегодного снижения рСКФ по сравнению с плацебо (–2,5 мл/мин/1,73 м² в группе финеренона по сравнению с –3,7 мл/мин/1,73 м² в группе плацебо соответственно; р<0,0001) (рис. 3). Анализ подгрупп выявил, что способность финеренона уменьшать наклон кривой рСКФ не зависела от исходного значения рСКФ [30].
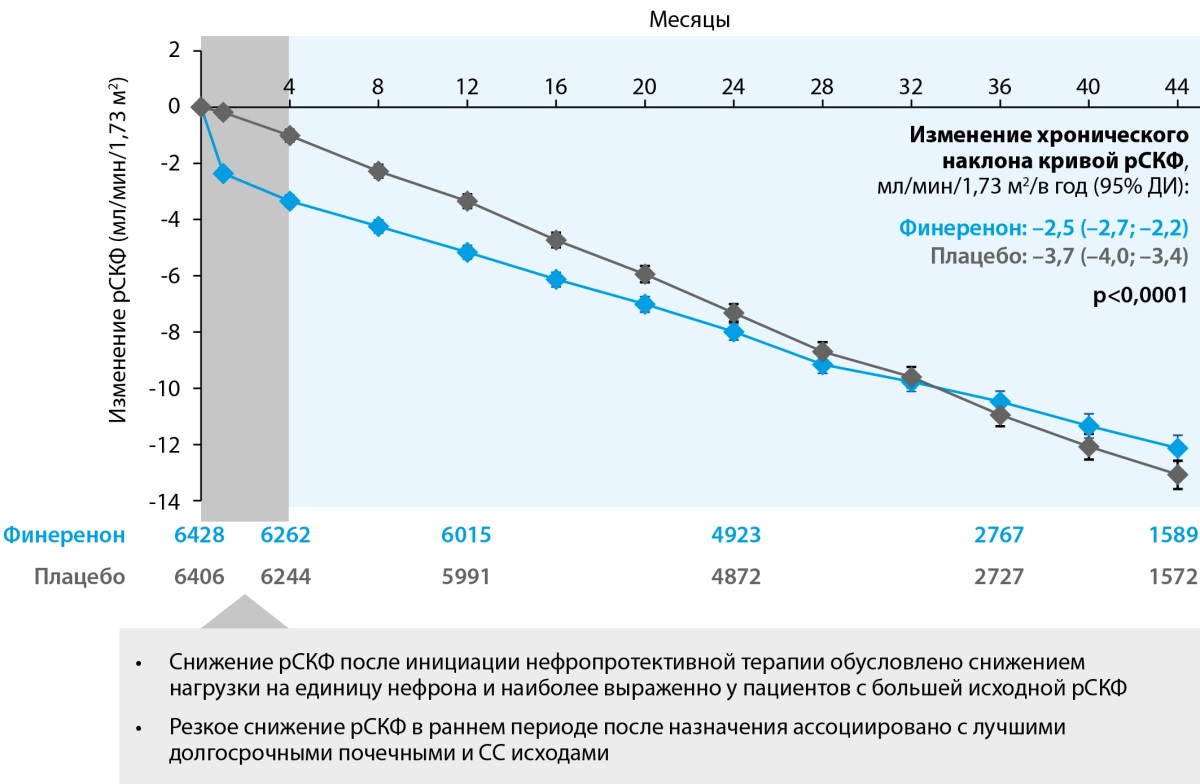
Рисунок 3. Долгосрочные эффекты терапии финереноном в отношении замедления темпов снижения расчетной скорости клубочковой фильтрации. Адаптировано из Bakris GL с соавт. [30].
Примечание. СС исходы — сердечно-сосудистые исходы; рСКФ — расчетная скорость клубочковой фильтрации; ДИ — доверительный интервал.
Важно отметить, что финеренон и иНГЛТ-2 имеют потенциал усиливать эффекты друг друга в отношении замедления темпов ежегодного снижения рСКФ. Вместе с тем Rossing P. и соавт. показали, что эффекты финеренона не зависели от исходной терапии иНГЛТ-2. В то же время выраженность нефропротективного эффекта была наибольшей в группе пациентов, единовременно получавших финеренон и иНГЛТ-2, что может говорить о синергии этих двух классов в отношении замедления темпов снижения функции почек (рис. 4) [35].
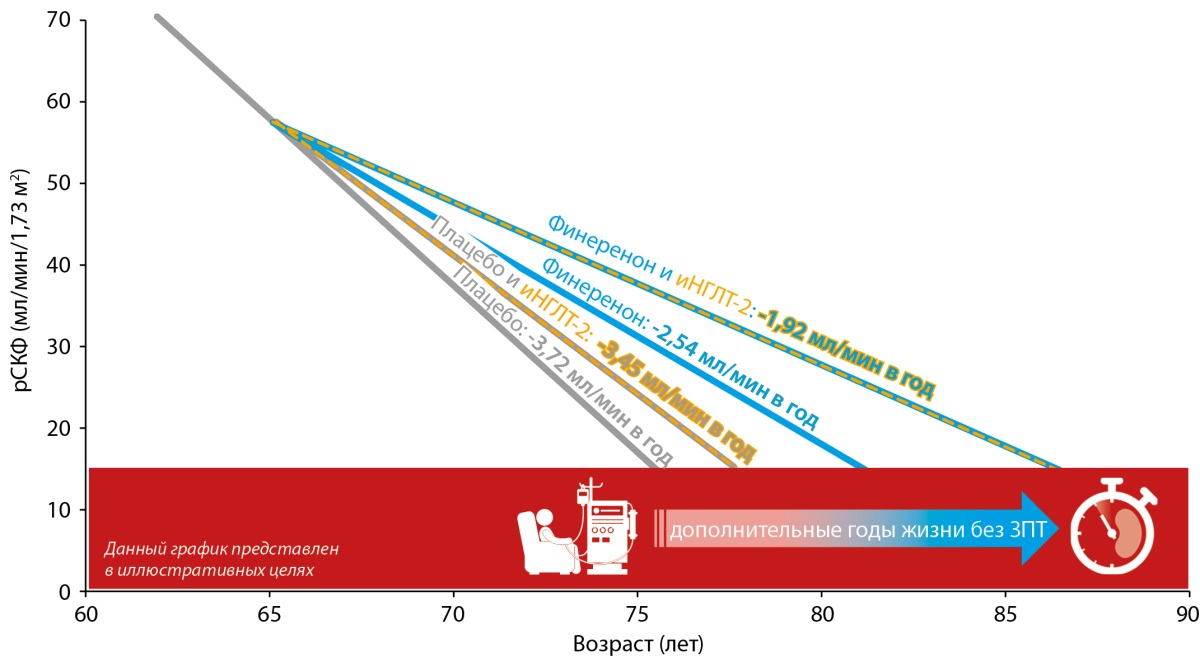
Рисунок 4. Возможный потенциал комбинированной терапии финереноном и ингибиторами натрий-глюкозного контранспортера 2 типа у пациентов с хронической болезнью почек и сахарным диабетом 2 типа в отношении замедления темпов снижения расчетной скорости клубочковой фильтрации. Представленный график основан на экстраполяции темпов снижения расчетной скорости клубочковой фильтрации, наблюдавшихся в течение 3 лет у пациентов с хронической болезнью почек и сахарным диабетом 2 типа из подгруппы FIDELITY [35].
Примечание. иНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера 2 типа; ЗПТ — заместительная почечная терапия; рСКФ — расчетная скорость клубочковой фильтрации.
Таким образом, комплексный подход к кардионефропротективной терапии ХБП при СД2, включающий единовременное использование иАПФ/БРА, иНГЛТ-2 и финеренона, обладает наибольшим потенциалом в целях сохранения функции почек. Пациенты, получающие все три компонента кардионефропротективной терапии единовременно, могут иметь более высокие шансы на замедление прогрессирования ХБП.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НАЗНАЧЕНИЮ НЕФРОПРОТЕКТИВНОЙ ТЕРАПИИ
В ранний период после инициации терапии нефпротективными препаратами, включая иАПФ, БРА, иНГЛТ-2, нсАМКР (финеренон), возможно снижение рСКФ/повышение сывороточного креатинина на 10–30%. Выраженность инициального изменения рСКФ может варьировать в зависимости от объема жидкости, употребляемой пациентом, исходных цифр АД, сопутствующей терапии диуретиками, бета-блокаторами и др. [34].
Некоторое снижение рСКФ после назначения нефропротективной терапии может вызвать серьезные опасения о безопасности и целесообразности дальнейшей терапии как со стороны врача, так и пациента, снижая комплаентность к проводимому лечению. Нередки ситуации, когда врач единовременно прекращает терапию нефропротективными препаратами и диуретиками в связи с повышением уровня сывороточного креатинина в первый месяц после начала терапии. Однако важно помнить, что нефропротективные препараты оказывают благоприятное влияние на отдаленный прогноз независимо от инициального изменения рСКФ. Cherney и соавт. опубликовали анализ, согласно которому инициальное снижение рСКФ на фоне терапии иНГЛТ-2 наоборот ассоциировалось с улучшением почечной функции в отдаленном периоде [34][36]. Pozo Garcia и соавт. показали, что эффективность в отношении клинически значимых СС и почечных событий, а также профиль безопасности финеренона не зависели от степени инициального снижения рСКФ. Кроме того, инициальное снижение рСКФ на фоне терапии финереноном, которое, как описано выше, может быть ассоциировано с уменьшением гиперфильтрации и уменьшением избыточной нагрузки на нефроны, также ассоциировалось с лучшими исходами [37]. Важно помнить, что в случаях повышения уровня креатинина в крови на 30% и более врач должен исключить у пациента состояние гиповолемии, стеноз почечных артерий и сопутствующую терапию НПВС [34].
Во избежание резкого снижения рСКФ после назначения нефропротективной терапии рекомендуется начинать терапию каждым их трех компонентов с некоторым интервалом по времени, составляющим не менее недели, с целью оптимизации их влияния на внутриклубочковое давление. Также существует мнение, что перед назначением финеренона и иНГЛТ-2 следует временно прекратить терапию диуретиками с возможностью ее возобновления спустя неделю [38].
ЗАКЛЮЧЕНИЕ
ХБП — одно из наиболее частых осложнений СД2, являющаяся вместе с тем независимым фактором риска ССО. ХБП при СД2 страдают более 160 млн человек, что приводит к развитию терминальной стадии почечной недостаточности с необходимостью проведения гемодиализа или трансплантации почек.
В настоящее время в арсенале врача для лечения больных ХБП на фоне СД2 есть три «независимых» группы кардионефропротективнных препаратов: иАПФ/БРА, иНГЛТ-2 и нсАМКР (финеренон), которые должны быть назначены совместно в рамках многофакторной стратегии и не являются альтернативой друг другу. В соответствии с результатами недавних рандомизированных клинических исследований, у пациентов с ХБП и СД2 терапия финереноном обеспечивает снижение риска прогрессии ХБП и СС событий, в сравнении с плацебо. На сегодняшний день единственный в своем классе препарат финеренон имеет доказанный кардионефропротективный эффект у пациентов с СД2 и ХБП, что делает его безальтернативным для контроля патологического пути гиперактивации минералокортикоидных рецепторов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Публикация подготовлена при поддержке АО «Байер». Компания «Байер» поддерживала техническую редакцию статьи, Ю.А. Шутова является сотрудником АО «Байер».
Участие авторов. Халимов Ю.Ш. — разработка концепции и дизайна, проверка критически важного интеллектуального содержания, анализ и интерпретация данных, написание текста, окончательное утверждение для публикации рукописи; Полякова Е.А. — сбор, анализ и интерпретация данных, написание текста; Шутова Ю.А. — сбор, анализ и интерпретация данных, коррекция текста.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты публикации, подразумевающей надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Sebastian SA, Padda I, Johal G. Cardiovascular-Kidney-Metabolic (CKM) syndrome: A state-of-the-art review. Curr Probl Cardiol. 2024;49(2):102344. https://doi.org/10.1016/j.cpcardiol.2023.102344
2. Lauder L, Mahfoud F, Azizi M, et al. Hypertension management in patients with cardiovascular comorbidities. Eur Heart J. 2023;44(23):2066-2077. https://doi.org/10.1093/eurheartj/ehac395
3. Hahr AJ, Molitch ME. Management of Diabetes Mellitus in Patients With CKD: Core Curriculum 2022. Am J Kidney Dis. 2022;79(5):728-736. https://doi.org/10.1053/j.ajkd.2021.05.023
4. Шамхалова М.Ш., Викулова О.К., Железнякова А.В., и др. Эпидемиология хронической болезни почек у пациентов с диабетом в Российской Федерации по данным Федерального регистра сахарного диабета (2010–2022 гг.) // Сахарный диабет. — 2023. — Т. 26. — №5. — С. 404-417. https://doi.org/10.14341/DM13090
5. Трубицына Н.П., Зайцева Н.В., Северина А.С., Шамхалова М.Ш. Хроническая болезнь почек у пациентов с сахарным диабетом 2 типа: новые мишени лекарственного воздействия. // Сахарный диабет. — 2022. — Т. 25. — №5. — С. 492-498. https://doi.org/10.14341/DM12944
6. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024;105(4S):S117-S314. https://doi.org/10.1016/j.kint.2023.10.018
7. Клинические рекомендации. Хроническая болезнь почек (ХБП). Нефрология. 2021;25(5):10-82. [Clinical recommendations. Chronic kidney disease (CKD). Nephrology (Saint-Petersburg). 2021;25(5):10-82. (In Russ.)]
8. Alfano G, Perrone R, Fontana F, et al. Rethinking Chronic Kidney Disease in the Aging Population. Life (Basel). 2022;12(11):1724. https://doi.org/10.3390/life12111724
9. Mueller TF, Luyckx VA. Potential utility of renal functional reserve testing in clinical nephrology. Curr Opin Nephrol Hypertens. 2024;33(1):130-135. https://doi.org/10.1097/MNH.0000000000000930
10. Luyckx VA, Rule AD, Tuttle KR, et al. Nephron overload as a therapeutic target to maximize kidney lifespan. Nat Rev Nephrol. 2022;18(3):171-183. https://doi.org/10.1038/s41581-021-00510-7
11. Wilmer WA, Rovin BH, Hebert CJ, et al. Management of glomerular proteinuria: a commentary. J Am Soc Nephrol. 2003;14(12):3217-32. https://doi.org/10.1097/01.asn.0000100145.27188.33
12. Tonneijck L, Muskiet MH, Smits MM, et al. Glomerular Hyperfiltration in Diabetes: Mechanisms, Clinical Significance, and Treatment. J Am Soc Nephrol. 2017;28(4):1023-1039. https://doi.org/10.1681/ASN.2016060666
13. Ruilope LM, Ortiz A, Lucia A, et al. Prevention of cardiorenal damage: importance of albuminuria. Eur Heart J. 2023;44(13):1112-1123. https://doi.org/10.1093/eurheartj/ehac683
14. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. «Алгоритмы специализированной медицинской помощи больным сахарным диабетом». Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 10-й выпуск. // Сахарный диабет. — 2021. —Т. 24. — №1S. — С. 1-148. https://doi.org/10.14341/DM12802
15. American Diabetes Association. Chronic Kidney Disease and Risk Management. Diabetes Care. 2024;47(Suppl. 1):S219–S230. https://doi.org/10.2337/dc24-S011
16. Sartore G, Ragazzi E, Deppieri E, Lapolla A. Is eGFR Slope a Novel Predictor of Chronic Complications of Type 2 Diabetes Mellitus? A Systematic Review and Meta-Analysis. J Diabetes Res. 2024;2024:8859678. https://doi.org/10.1155/2024/8859678
17. Stevens PE, Levin A. Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann Intern Med. 2013;158(11):825-30. https://doi.org/10.7326/0003-4819-158-11-201306040-00007
18. Cabrera CS, Lee AS, Olsson M, et al. Impact of CKD Progression on Cardiovascular Disease Risk in a Contemporary UK Cohort of Individuals With Diabetes. Kidney Int Reports. 2020;5(10):1651-1660. https://doi.org/10.1016/j.ekir.2020.07.029
19. Oshima M, Jun M, Ohkuma T, et al. The relationship between eGFR slope and subsequent risk of vascular outcomes and all-cause mortality in type 2 diabetes: the ADVANCE-ON study. Diabetologia. 2019. https://doi.org/10.1007/s00125-019-4948-4
20. Levey AS, Gansevoort RT, Coresh J, et al. Change in Albuminuria and GFR as End Points for Clinical Trials in Early Stages of CKD: A Scientific Workshop Sponsored by the National Kidney Foundation in Collaboration With the US Food and Drug Administration and European Medicines Agency. Am J Kidney Dis. 2020;75(1):84-104. https://doi.org/10.1053/j.ajkd.2019.06.009
21. Holtkamp F, Gudmundsdottir H, Maciulaitis R, et al. Change in Albuminuria and Estimated GFR as End Points for Clinical Trials in Early Stages of CKD: A Perspective From European Regulators. Am J Kidney Dis. 2020;75(1):6-8. https://doi.org/10.1053/j.ajkd.2019.07.019
22. Thompson A, Smith K, Lawrence J. Change in Estimated GFR and Albuminuria as End Points in Clinical Trials: A Viewpoint From the FDA. Am J Kidney Dis. 2020;75(1):4-5. https://doi.org/10.1053/j.ajkd.2019.08.007
23. Levey AS, Inker LA, Matsushita K, et al. GFR decline as an end point for clinical trials in CKD: a scientific workshop sponsored by the National Kidney Foundation and the US Food and Drug Administration. Am J Kidney Dis. 2014;64(6):821-35. https://doi.org/10.1053/j.ajkd.2014.07.030
24. Grams ME, Brunskill NJ, Ballew SH, et al. Development and validation of prediction models of adverse kidney outcomes in the population with and without diabetes. Diabetes Care. 2022;45(9):2055–2063. https://doi.org/10.2337/dc22-0698
25. Inker LA, Heerspink HJL, Tighiouart H, et al. GFR Slope as a Surrogate End Point for Kidney Disease Progression in Clinical Trials: A Meta-Analysis of Treatment Effects of Randomized Controlled Trials. J Am Soc Nephrol. 2019 Sep;30(9):1735-1745. https://doi.org/10.1681/ASN.2019010007
26. Grams ME, Sang Y, Ballew SH, et al. Evaluating Glomerular Filtration Rate Slope as a Surrogate End Point for ESKD in Clinical Trials: An Individual Participant Meta-Analysis of Observational Data. J Am Soc Nephrol. 2019;30(9):1746-1755. https://doi.org/10.1681/ASN.2019010008
27. Дедов И.И., Шестакова М.В., Майоров А.Ю., и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (11-й выпуск) // Сахарный диабет. — 2023. —Т. 26. — №S2. — С. 1-231. https://doi.org/10.14341/DM13042
28. Общая характеристика лекарственного препарата. Bayer Pharmaceuticals Россия. Available at: https://pharma.bayer.ru/files/Firialta.pdf
29. Agarwal R, Filippatos G, Pitt B, et al. FIDELIO-DKD and FIGARO-DKD investigators. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43(6):474-484. https://doi.org/10.1093/eurheartj/ehab777
30. Bakris GL, Ruilope LM, Anker SD, et al. FIDELIO-DKD and FIGARO-DKD Investigators. A prespecified exploratory analysis from FIDELITY examined finerenone use and kidney outcomes in patients with chronic kidney disease and type 2 diabetes. Kidney Int. 2023;103(1):196-206. https://doi.org/10.1016/j.kint.2022.08.040
31. González-Juanatey JR, Górriz JL, Ortiz A, et al. Cardiorenal benefits of finerenone: protecting kidney and heart. Ann Med. 2023;55(1):502-513. https://doi.org/10.1080/07853890.2023.2171110
32. Kintscher U, Bakris GL, Kolkhof P. Novel non-steroidal mineralocorticoid receptor antagonists in cardiorenal disease. Br J Pharmacol. 2022;179(13):3220-3234. https://doi.org/10.1111/bph.15747
33. ElSayed NA, Aleppo G, Aroda VR, et al. On behalf of the American Diabetes Association. Summary of Revisions: Standards of Care in Diabetes-2023. Diabetes Care. 2023;46(Suppl 1):S5-S9. https://doi.org/10.2337/dc23-Srev
34. Bakris GL, Weir MR. Initial Drops in Glomerular Filtration Rate with Certain Drug Classes Retard Kidney Disease Progression. Am J Nephrol. 2022;53(7):513-515. https://doi.org/10.1159/000524890
35. Rossing P, Anker SD, Filippatos G, et al. FIDELIO-DKD and FIGARO-DKD Investigators. Finerenone in Patients With Chronic Kidney Disease and Type 2 Diabetes by Sodium-Glucose Cotransporter 2 Inhibitor Treatment: The FIDELITY Analysis. Diabetes Care. 2022;45(12):2991-2998. https://doi.org/10.2337/dc22-0294
36. Cherney DZI, Cosentino F, Dagogo-Jack S, et al. VERTIS CV Investigators. Initial eGFR Changes with Ertugliflozin and Associations with Clinical Parameters: Analyses from the VERTIS CV Trial. Am J Nephrol. 2022;53(7):516-525. https://doi.org/10.1159/000524889
37. Pozo Garcia L, Thomas SS, Rajesh H, Navaneethan SD. Progress in the management of patients with diabetes and chronic kidney disease. Curr Opin Nephrol Hypertens. 2022;31(5):456-463. https://doi.org/10.1097/MNH.0000000000000811
38. Blazek O, Bakris GL. The evolution of «pillars of therapy» to reduce heart failure risk and slow diabetic kidney disease progression. Am Heart J Plus. 2022;19:100187. https://doi.org/10.1016/j.ahjo.2022.100187
Об авторах
Ю. Ш. ХалимовРоссия
Халимов Юрий Шавкатович - д.м.н., профессор.
Санкт-Петербург
Конфликт интересов:
Публикация подготовлена при поддержке АО «Байер». Компания «Байер» поддерживала техническую редакцию статьи
Е. А. Полякова
Россия
Полякова Екатерина Анатольевна - д.м.н., профессор.
197022, Санкт-Петербург, ул. Льва Толстого, д. 6-8
Конфликт интересов:
Публикация подготовлена при поддержке АО «Байер». Компания «Байер» поддерживала техническую редакцию статьи
Ю. А. Шутова
Россия
Шутова Юлия Александровна
Санкт-Петербург
Конфликт интересов:
является сотрудником АО «Байер»
Дополнительные файлы
|
|
1. Рисунок 1. Возможные траектории прогрессирования хронической болезни почек. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(222KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Почечная функция в зависимости от количества оставшихся функциональных нефронов. Адаптировано из Tonneijck L и соавт. [12]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(449KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Долгосрочные эффекты терапии финереноном в отношении замедления темпов снижения расчетной скорости клубочковой фильтрации. Адаптировано из Bakris GL с соавт. [30]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(638KB)
|
Метаданные ▾ | |
|
|
4. Рисунок 4. Возможный потенциал комбинированной терапии финереноном и ингибиторами натрий-глюкозного контранспортера 2 типа у пациентов с хронической болезнью почек и сахарным диабетом 2 типа в отношении замедления темпов снижения расчетной скорости клубочковой фильтрации. Представленный график основан на экстраполяции темпов снижения расчетной скорости клубочковой фильтрации, наблюдавшихся в течение 3 лет у пациентов с хронической болезнью почек и сахарным диабетом 2 типа из подгруппы FIDELITY [35]. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(615KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Халимов Ю.Ш., Полякова Е.А., Шутова Ю.А. Новая эра кардионефропротекции у больных с сахарным диабетом 2 типа: как использовать возможности терапии препаратом финеренон. Сахарный диабет. 2024;27(6):620-628. https://doi.org/10.14341/DM13222
For citation:
Khalimov I.S., Polyakova E.A., Shutova Yu.A. A new era of cardiac nephroprotection in patients with type 2 diabetes mellitus: the role of Finerenone. Diabetes mellitus. 2024;27(6):620-628. (In Russ.) https://doi.org/10.14341/DM13222
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































