Перейти к:
Терапия хронических трофических язв у больных сахарным диабетом с применением генных модификаций клеточного трансплантата
https://doi.org/10.14341/DM13215
Аннотация
У пациентов с сахарным диабетом (СД) системные нарушения в организме могут вызывать целый ряд осложнений. Одним из основных осложнений является нарушение процессов заживления ран, что может привести к развитию диабетической язвы стопы (ДЯС) и последующей ампутации конечности. Модифицированные мезенхимальные стволовые клетки (ГМ-МСК) как средство терапии хронических ран позволяют снизить homing (хоуминг), обладают повышенным пролиферативным потенциалом, терапевтическими противоопухолевыми и поддерживающими функции поджелудочной железы свойствами. Для терапии ДЯС изучают нативные и генно-модифицированные клетки из аллогенных или аутологичных источников. В обзоре представлен мировой опыт применения стволовых клеток в терапии в доклинических и клинических исследованиях, собраны данные о предложенных технологиях терапии диабетических язв с применением ГМ-МСК: совместная трансплантация ГМ-МСК с островками поджелудочной железы, регуляция процессов миграции при помощи изменения экспрессии интегринов, блокирование сигналов эстрогена, повышенная экспрессия ряда генов, таких как SDF-1α, c-JUN, MALAT1, для повышения жизнеспособности и стимуляции пролиферации мезенхимальных стволовых клеток. Клетки, временно несущие терапевтические генно-инженерные конструкции, в доклинических испытаниях показывают высокую эффективность их применения.
Для цитирования:
Абакушина Е.В., Воробьева И.Г., Степанова И.А., Румянцев С.А. Терапия хронических трофических язв у больных сахарным диабетом с применением генных модификаций клеточного трансплантата. Сахарный диабет. 2024;27(6):611-619. https://doi.org/10.14341/DM13215
For citation:
Abakushina E.V., Vorobyova I.G., Stepanova I.A., Roumiantsev S.A. Therapy of chronic skin ulcers in patients with diabetes mellitus using gene modifications of cell transplant. Diabetes mellitus. 2024;27(6):611-619. (In Russ.) https://doi.org/10.14341/DM13215
ВВЕДЕНИЕ. МЕЗЕНХИМАЛЬНЫЕ СТВОЛОВЫЕ КЛЕТКИ ПРИ РЕГЕНЕРАЦИИ ДИАБЕТИЧЕСКОЙ ЯЗВЫ
Одним из основных осложнений сахарного диабета (СД) является нарушение регенерации ран; раны, которые не заживают в течение четырех недель, считаются хроническими и требуют дополнительного терапевтического вмешательства. Длительно незаживающие язвы стопы при диабете (ДЯС) представляют собой комплексную проблему при терапии из-за того, что существуют гипо- и гипергликемия, а также нарушения ангиогенеза и хроническая воспалительная реакция, связанная с началом СД. ДЯС наблюдаются по меньшей мере у 34% пациентов с СД [1]. Одним из ключевых аспектов лечения хронических ран, возникающих при СД, является изучение применения мезенхимальных стволовых клеток (МСК). Клеточная терапия может способствовать как восстановлению функции поджелудочной железы, так и снижению уровня провоспалительных цитокинов. Это было продемонстрировано на моделях СД первого типа (СД1) у грызунов и показало, что введение МСК позволяет нормализовать уровень глюкозы и увеличивать выработку инсулина благодаря восстановлению островков Лангерганса поджелудочной железы. Источник МСК может быть аутологичным или аллогенным [2]. Клетки из обоих источников исследуют для терапии как без обработки — с минимальными манипуляциями, так и модифицированные генно-инженерными методами. Это особенно важно для стволовых клеток, полученных от пациентов с СД, так как было показано, что такие клетки обладают сниженными жизнеспособностью и пролиферативным потенциалом. За последние годы создано несколько технологий генной терапии на основе транзиторной трансфекции стволовых клеток жировой ткани и показано их преимущество для лечения ДЯС (табл. 1). На данный момент эффективность показана только в доклинических испытаниях на мышиных моделях.
Таблица 1. Препараты на основе стволовых клеток (модифицировано по статье [2]).
Название препарата | Год регистрации | Страна | Патология |
Hearticellgram-AMI | 2012 | Корея | Острый инфаркт миокарда |
Cuepistem | 2012 | Корея | Осложненная болезнь Крона |
Cartistem | 2014 | Корея | Дегенеративный артрит |
Prochymal/remestemcel-L | 2014 | Канада | «Трансплантат против хозяина» |
Neuronata-R | 2015 | Корея | Боковой склероз спинного мозга |
Temcell HS | 2016 | Япония | «Трансплантат против хозяина» |
Stempeucel | 2016 | Индия | Тяжелая ишемия конечностей |
Alofisel | 2018 | Япония и Бельгия | Осложненная болезнь Крона |
Holoclar | 2015 | Италия | Восстановление эпителия роговицы |
MPC | 2010 | Австралия | Заживление переломов и заживление диска |
ChondroCelect | 2009 | Бельгия | Остеоартроз коленного сустава |
Prochymal | 2009 | США | Сахарный диабет 1 типа |
MultiStem | 2012 | США | Ишемический инсульт |
Maci | 2016 | США | Костно-хрящевые повреждения |
Hemacord | 2011 | США | Геморрагическая болезнь |
Лечение ДЯС дополнительно осложняется другими факторами риска, такими как невропатия и заболевания периферических артерий. Гипо- и особенно гипергликемия, которая возникает при СД, способствует образованию язв за счет прогрессирования атеросклероза, нарушения работы популяций клеток кожи и периферической нейропатии [3]. Гипергликемия также нарушает белковый синтез, миграцию и пролиферацию кератиноцитов, фибробластов и поддерживает в ДЯС непрекращающийся воспалительный процесс, что может приводить к инфицированию стопы и увеличивает риск ампутации [4].
В настоящий момент для трансплантации МСК пациентам, кроме клеток костного мозга, применяется пул клеток жировой ткани МСК. Жировая ткань состоит из стромальной сосудистой фракции (SVF), которая содержит различные типы клеток и зрелых адипоцитов. До 3% выделенного из жировой ткани клеточного пула занимают МСК [5]. МСК под действием хемокинов и медиаторов воспаления мигрируют к очагу патологического процесса, ускоряя восстановление тканей. Благодаря таким свойствам МСК используются при системной красной волчанке, для восстановления хряща, функций почек и конечностей после ишемии, при заболеваниях легких, болезни «трансплантат против хозяина» (GvHD), инсульте, инфаркте, лечении онкологических заболеваний, а также при апластической или серповидно-клеточной анемии и других заболеваниях [6]. Список зарегистрированных препаратов представлен в табл. 2 [7][8].
Таблица 2. Клинические испытания препаратов на основе стволовых клеток различного происхождения для заживления диабетической язвы стопы [7][8].
Год публикации | Номер клинического исследования | Диагноз и количество пациентов с ДЯС | Тип стволовых клеток | Критерии эффективности |
2021 | ChiCTR2200055885 | СД 59 пациентов | МСК жировой ткани | Размер язвы, время закрытия, кровоток в сосудах, эластичность артериальной стенки |
NCT04689425 | СД2 20 пациентов | Мононуклеарные клетки из пуповинной крови | Скорость закрытия раны, среднее время закрытия раны | |
2020 | NCT03267784 | СД2 23 пациентов | Алло-APZ2-DFU Суспензия ABCB5+ МСК | Процент уменьшения площади раневой поверхности, абсолютное уменьшение площади раны, оценка раневой инфекции, время до первого полного закрытия раны |
2019 | NCT03230175 | СД1 и СД2 32 пациентов | Криоконсервированный аллотрансплантат пуповины (TTAX01) | Время до первого полного закрытия раны |
NCT02092870 | СД1 и СД2 25 пациентов | МСК жировой ткани | Процентное изменение размера раны по сравнению с исходным уровнем через 12 недель | |
NCT02844660 | СД1 и СД2 130 пациентов | Аллотрансплантат пуповины человека | Доля пациентов, достигших полного закрытия раны, скорость закрытия раны | |
NCT04255004 | СД1 и СД2 76 пациентов | Аутологичные мононуклеарные клетки периферической крови | Вариация чрескожного измерения кислорода, время заживления, сравнение боли в покое | |
NCT03865394 | СД1 и СД2 46 пациентов | Аллогенные МСК жировой ткани | Процент полного закрытия раны, среднее время, необходимое для закрытия раны | |
2016 | NCT01859117 | СД 15 пациентов | МСК плацентарной ткани | Увеличение дистанции безболезненной ходьбы, улучшение перфузии ног, чрескожного давления кислорода (TcO2) |
NCT02619877 | СД1 и СД2 59 пациентов | ALLO-ASC-DFU | Доля повторной эпителизации, время для повторной эпителизации | |
NCT02394886 | СД1 и СД2 5 пациентов | Аллогенные МСК жировой ткани | Количество участников с нежелательными явлениями как мера безопасности и переносимости | |
2015 | NCT02209051 | СД2 29 пациентов | Аллотрансплантат амниотической мембраны человека | Время для полного закрытия раны целевой язвы, скорость закрытия раны, частота, тяжесть и тип нежелательных явлений |
NCT02092870 | СД2 25 пациентов | МСК жировой ткани | Процентное изменение размера раны по сравнению с исходным уровнем через 12 недель | |
2013 | NCT00987363 | СД1 и СД2 60 пациентов | Аутологичные МСК костного мозга | Клинически объективное улучшение конечности |
2012 | NCT01065337 | СД1 и СД2 30 пациентов | Стволовые клетки костного мозга | Частота высоких ампутаций, частота пациентов с полным заживлением язв, улучшение чрескожного парциального давления кислорода (TcPO2) |
2010 | NCT00955669 | СД1 и СД2 40 пациентов | Аутологичные МСК костного мозга и мононуклеарные клетки | Магнитно-резонансная ангиография |
NCT01232673 | СД1 и СД2 90 пациентов | Аутологичные МСК | Высокая ампутация конечности через 120 дней, измерения перфузии тканей |
МСК, выделенные из жировой ткани пациентов с диабетом, обладают сниженной пролиферацией и способностью к дифференцировке в фибробласты, а также быстрым апоптозом, что приводит к уменьшению терапевтического эффекта при их применении [9]. При хронических воспалительных процессах в организме снижена возможность распознавать и убивать патогенные клетки. Также нарушение иммунной защиты кожи возникает за счет подавления синтеза антимикробных пептидов при диабете [10]. Механизм действия МСК для заживления ДЯС может быть связан как с изменением контактов между клетками в ране, так и с паракринным эффектом [4].
Показано, что МСК обладают иммуномодулирующим действием на клетки кожи мышей с СД1. Используя совместную трансплантацию МСК с островками поджелудочной железы, авторы показали, что МСК способны снижать воспаление и усиливать терапевтический эффект трансплантата островков Лангерганса [11]. В присутствии МСК увеличивается пролиферативная активность дифференцированных фибробластов, повышается экспрессия факторов заживления ран и коллагеновых волокон первого и третьего типа. Использование стволовых клеток жировой ткани приводит не только к ускоренному заживлению, но и подавлению фиброза. Фиброз вызывается чрезмерным отложением компонентов внеклеточного матрикса (ECM — extracellular matrix), фибробластами и миофибробластами. Синтез и деградация матрикса регулируется активностью дермальных фибробластов, которые производят белки ЕСМ, такие как коллаген и их ингибиторы. Показано, что экспрессия на мембране фибробластов фактора роста эндотелия сосудов (VEGF), расположенных по краю раневой поверхности, играет существенную роль в ускорении процесса заживления. Этот фактор воздействует на клетки эндотелия при взаимодействии с рецепторами VEGFR 1, 2 и 3 типов. Он также увеличивает экспрессию фактора роста фибробластов (bFGF), полноразмерного VEGFR 2 и фактора роста тромбоцитов (PDGF), что способствует образованию новых кровеносных сосудов и заживлению ран [12]. Технология, направленная на транзиторное усиление экспрессии VEGF165 в МСК, прошла клинические испытания в России, в 2016 году [ NCT02538705], однако данные по ней пока не представлены. Терапия ГМ-МСК жировой ткани может быть лучшим решением для лечения ДЯС, чем немодифицированными клетками, поскольку эндогенные МСК у пациентов с СД имеют низкую жизнеспособность и нарушенную пролиферацию [9]. При этом если введение МСК связано с повышенным риском нецелевого homing (хоуминга), то при использовании ГМ-МСК при незаживающих кожных поражениях может быть безопасной и перспективной методикой. За последние годы создано несколько технологий генной терапии на основе транзиторной трансфекции стволовых клеток и показано их преимущество для лечения ДЯС (табл. 2). На данный момент эффективность показана только в доклинических испытаниях на мышиных моделях ДЯС. Источник МСК, их количество и качественные характеристики становятся важны для успеха трансплантации при измененном состоянии иммунной системы при диабете. Известно, что с увеличением возраста пациента пролиферативный потенциал мезенхимальных клеток жировой ткани не снижается [13], что делает эти клетки наиболее перспективными для использования. Выделение МСК из жировой ткани — метод с минимальным риском поражения донорского органа. Показано, что популяция МСК костного мозга у пациентов с диабетом критически уменьшается [14], поэтому МСК жировой ткани — основные кандидаты для временных генетических модификаций в целях терапии ДЯС.
К преимуществам аллогенного источника для трансплантации относят возможность выбрать донора (в том числе с оптимальным индексом массы тела (ИМТ), цитокиновым профилем и производством ангиогенных факторов и жизнеспособностью у трансплантата), возможность заранее отбирать и хранить данный материал. Недостатками данного источника клеток являются: потенциальная возможность реакции трансплантата против хозяина (РТПХ), передача латентных вирусов с материалом, необходимость тщательных и дорогостоящих исследований донорского материала.
Цитокиновый профиль, секретируемый МСК жировой ткани, может смещаться в сторону воспалительного фенотипа у пациентов с ожирением, а низкий ИМТ у доноров жировой ткани позволяет выделять клеточные фракции с оптимальной способностью к пролиферации и дифференцировке. Замораживание клеток изменяет экспрессию интерферона-γ (IFN-γ), из-за чего снижается их противовоспалительное терапевтическое действие [15]. Использование клеток, не подвергавшихся заморозке, не всегда возможно в клинической практике.
Очевидным достоинством аутологичного материла является его безопасность, аутологичная ткань для трансплантации не несет в себе многих терапевтических рисков [16]. Однако стволовые клетки могут активировать онкологические процессы из-за миграции в патологическую ткань, изменяя ее воспалительный фенотип — делая ее «невидимой» для иммунной системы и активизируя процессы ангиогенеза — за счет производимых факторов и микро-РНК. Микро-РНК влияют на фенотип стволовых клеток, контролируя профили экспрессии, пролиферацию и дифференцировку стволовых клеток. Профили микро-РНК для различных типов тканей уникальны, поэтому местоположение жировой ткани, из которой выделяют клетки, влияет на эффективность трансплантации [17]. Выбор места забора донорной ткани, пол пациента, масса тела, возраст донора и контроль микро-РНК-статуса МСК жировой ткани важны для качества и количества получаемых стволовых клеток и играют ключевую роль в безопасности клеточной трансплантации.
ИММУНОМОДУЛИРОВАНИЕ И БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ МСК
Иммуномодулирующие и поддерживающие ангиогенез свойства МСК были описаны в ряде работ [10][11][17]. Эти клеточные популяции лишены человеческого лейкоцитарного антигена (HLA), что дает возможность тестировать для применения в клинической практике разные источники МСК жировой ткани [18]. Тестируются аутологичный (собственные клетки пациента) и аллогенный (клетки донора) источники клеток жировой ткани. Считается, что МСК являются иммунопривилегированными или иммунодефицитными из-за отсутствия или крайне низкой экспрессии генов комплексов гистосовместимости (MHC) I и II типа. Однако повторные введения донорного материала показывают значительную реакцию воспаления сустава на аллогенные МСК, но не аутологичные МСК [17]. Цитокины, в частности IFN-γ и TNFα, определяют иммунный фенотип стволовых клеток, индуцируя пролиферацию и дифференцировку МСК (рис. 1, модифицировано по статье [18]).
Экспрессия белков MHC и иммуногенность аллогенного клеточного продукта изменяется провоспалительным IFN-γ. Интерфероны, в том числе IFN-γ, взаимодействуя с каскадом белков, регулирующих работу промоторов, отвечающих за экспрессию генов МНС-II, активируют связывание транскрипционного фактора IRF9 с регуляторной последовательностью ДНК, называемой элементом регуляторного ответа интерферона (ISRE), запуская экспрессию гена [19].
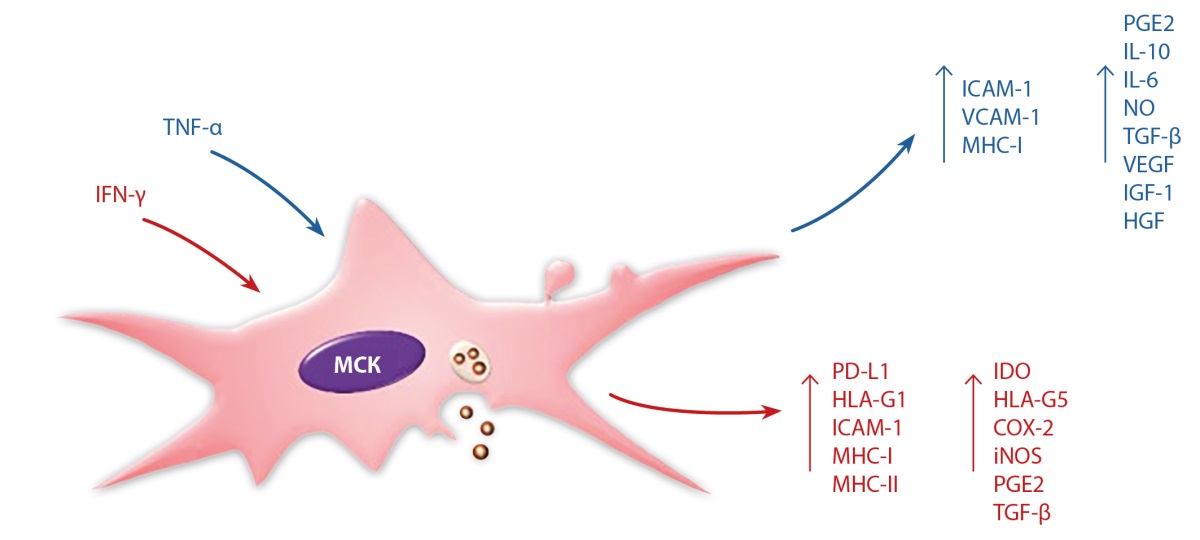
Рисунок 1. Интерферон-гамма (IFN-γ) и фактор некроза опухоли альфа (TNF-α) определяют иммунный фенотип мезенхимальных стволовых клеток.
Интерлейкин-6 (IL-6) и моноцитарный колониестимулирующий фактор (M-CSF), которые продуцируют МСК, играют роль в дифференцировке дендритных клеток (ДК). Высокие уровни IL-6, которые секретируют МСК, способствуют дифференцировке ДК к миелоидному фенотипу. Простагландин второго типа (PGE2) способствует созреванию ДК, блокада синтеза PGE2 в МСК может вызывать снижение активности T-клеток. При ДЯС вырабатываются медиаторы воспаления, что приводит к привлечению Т-клеток и увеличению синтеза факторов воспаления, таких как TNF-α, хемокинов и их рецепторов, например, CC Motif Chemokine Receptor 4 (CCR4) на поверхности клеток в язве [20]. Экспрессия воспалительных хемокинов увеличивается в ответ на активацию TNF-α или IL-1β. В результате МСК мигрируют к месту воспаления, что осуществляется за счет градиента хемокинов SDF-1 и CX3CL, которые взаимодействуют напрямую с рецепторами CXCR4 или CX3CR1 на их мембране [21]. CXCR4 располагается поверхности клеток только у 3,9% МСК жировой ткани, при этом большая часть его содержится внутри клеток. Рецептор CXCR4, вероятно, перемещается на поверхность после стимуляции хемокинами, что способствует миграции МСК. Повышенная экспрессия рецептора CXCR4 определяет направление миграции МСК не только к ДЯС, но и к опухоли [22], помогая ее инвазии в строму. Блокировка ключевых факторов миграции, например, интегрина β1, и трансплантация непосредственно в патологический очаг, возможно, будет делать терапию более безопасной. Было показано снижение количества МСК в миокарде при блокаде интегрина β1, клетки вводились в кровоток. Интегрин α4/β1 может создавать прикрепление стволовых клеток к местам миграции и обеспечивать взаимодействие с клетками эндотелия сосудов и клеточным матриксом через рецептор VCAM-1, который связывается с интегринами α4β1, β1, α4β7 и фибронектином [23]. МСК взаимодействуют с клетками эндотелия благодаря интегринам α4, β1, VCAM-1, P-селектину и секреции цитокинов. Интегрины β1 и β2 играют важную роль в межклеточном взаимодействии клеток и адгезии с компонентами внеклеточного матрикса [24]. Одним из решений, помогающих избежать осложнений МСК-терапии, является локальное использование этих клеток вблизи места повреждения. Поскольку для восстановления кожного покрова основная масса трансплантированных клеток не должна попадать в кровоток, чтобы избежать нецелевой их миграции. Возможно, временная блокировка интегринов — перспективное средство для контроля локализации терапевтических МСК.
Повышенные титры некоторых гормонов — эстрогена, прогестерона, лептина — способствуют малигнизации тканей и запуску провоспалительных реакций [25]. Так, МСК, которые были получены из подкожной жировой ткани брюшной полости пациентов с ожирением, усиливали канцерогенез после совместного культивирования с лептином. Профиль экспрессии генов стволовых клеток демонстрировал изменения, вызванные ожирением. Блокирование сигналов эстрогена с помощью лептин-нейтрализующего антитела уменьшало негативное влияние клеток жировой ткани, полученных от пациентов с ожирением, которое вызывает значительные изменения в фенотипе клеточного трансплантата, усиливая канцерогенез через эстрогензависимые пути ER+/PR+ [25]. Кроме того, стволовые клетки способны подавлять рост трансформированных клеток, останавливая клеточный цикл, также ингибируя пролиферацию и блокируя путь PI3K/AKT [26]. МСК, трансплантированные в модели мыши с гепатоцеллюлярной карциномой, раком поджелудочной железы, раком простаты и меланомы подавляли рост опухоли [27]. Учитывая эти противоречивые данные, при трансплантации необходим контроль миграции и изменения фенотипа введенных МСК на уровне цитокинов, гормонов и микро-РНК.
ГМ-МСК ТЕСТИРУЮТСЯ ДЛЯ ПОДАВЛЕНИЯ КАНЦЕРОГЕНЕЗА
Одной из первых работ, в которой использовали ГМ-МСК, было подавление ксенотрансплантата меланомы человека у мыши. Клетки с повышенной экспрессией интерферона-β (IFN-β) вводили в приживленную опухоль, что приводило к снижению скорости ее роста, а также двукратному повышению выживаемости мышей по сравнению с контрольной группой после проведения таких инъекций [28]. В мышиной модели ксенографта также продемонстрировано, что добавление низких доз цитостатика цисплатина к IFN-β-модифицированным МСК значительно усиливает эффективность противоопухолевой терапии [29].
На сегодняшний день выделен ряд генов, относящихся к опухолевым супрессорам, чьи генетические модификации исследуются для терапии ГМ-МСК. Одним из многообещающих терапевтических агентов является индуцирующий апоптоз цитокин — рецептор фактора некроза опухоли (TRAIL), который обнаружен на поверхности злокачественных клеток. В ГМ-МСК с повышенным синтезом TNF-α в сочетании с лучевым воздействием значительно возрастает уровень экспрессии TRAIL. Противоопухолевая эффективность подобных модифицированных клеток была описана для различных видов опухолей. Кроме того, показано, что модификации IFN-γ у ГМ-МСК уровень экспрессии TRAIL увеличен [30].
Для применения таких клеток необходимо проводить тестирование патологических тканей на наличие экспрессии Х-сцепленного ингибитора белка апоптоза (XIAP). Некоторые опухоли могут проявлять устойчивость к высоким уровням TRAIL, что связано с увеличенной экспрессией XIAP, способного снижать активность каспаз 3 и 9. Анти-апоптотические свойства XIAP регулируются другим активатором каспазы, получаемым из митохондрий (Smac), который предотвращает физическое взаимодействие между XIAP и каспазами, тем самым блокируя ингибирование апоптоза [31].
В качестве противоопухолевых агентов, кроме IFN-β и TRAIL, также рассматриваются интерлейкины IL-2, IL-12 и IL-21, так как они играют важную роль в регуляции воспалительных и иммунных реакций. IL-12-модифицированные ГМ-МСК способствуют снижению степени метастазирования и индуцируют апоптоз опухолевых клеток у мышей с гепатоцеллюлярной карциномой, раком легких и меланомой, активируя при этом цитотоксические Т-лимфоциты и NК-клетки [32]. Доказано, что введение ГМ-МСК, полученных из околоплодных вод и экспрессирующих IL-2, приводило к индукции апоптоза в клетках рака яичников у мышей. Кодируемый геном PTEN белок — фосфатаза и гомолог тензина PTEN (phosphatase and tensin homolog) — представляет собой один из основных опухолевых супрессоров у человека. Показано, что стволовые клетки суперэкспрессирующие белок PTEN могут трансформироваться в клетки глиобластомы in vivo [33].
Транспорт белка с помощью стволовых клеток к местам повреждения и их противоопухолевые свойства описаны для таких белков, как IFN-α, IFN-γ, CX3CL1, апоптин, PEGF и микро-РНК - miR124 и miR145. Модификация стволовых клеток для одновременной экспрессии нескольких терапевтических белков может повысить их противоопухолевый потенциал. Было показано, что TRAIL и модифицированные тимидинкиназой вируса простого герпеса (HSV-TK) МСК значительно снижают скорость роста опухоли и увеличивают выживаемость мышей со злокачественной глиобластомой [34].
РАЗРАБАТЫВАЕМЫЕ ТЕХНОЛОГИИ ГЕНЕТИЧЕСКИХ МОДИФИКАЦИЙ АУТОЛОГИЧНЫХ МСК ЖИРОВОЙ ТКАНИ ПРИ ЛЕЧЕНИИ ДЯС
Генные модификации клеток могут быть постоянные и временные. Для каждого типа модификаций критерии безопасности продукта на основе ГМ-МСК отличаются. Стабильно измененные клетки должны быть получены из моноклона, т.е. быть потомством одной модифицированной клетки, так как в таком случае, после генного анализа линии, будет известно, куда встроились инженерные конструкции и сколько их, насколько генетически стабильна линия, не становится ли клетка патогенной из-за инсерционного мутагенеза. При таком типе модификаций сохранить тонкие биохимические настройки клеток сложно, так как и быстрое проникновение рекомбинантной ДНК с повреждением клеточной стенки электропорацией, и длительные процессы культивирования, и встройки в геном будут способствовать проявлению воспалительного фенотипа клеток. Транзиторная (временная) модификация ДНК возможна при использовании генных каркасов, аденоассоциированных вирусов, фагоцитозу фрагментов ДНК/РНК. Такое изменение сохраняется в клетке несколько дней — пока рекомбинантные нуклеиновые кислоты не уничтожатся клеточными нуклеазами, при этом инженерная кассета не встраивается в геном. Не создавая стабильных изменений, следовательно, избегая инсерционного мутагенеза, такая технология основана на защитных механизмах самих иммунных клеток, не меняет их биологических свойств на постоянной основе. Элиминация чужеродного генетического материала происходит на 3–5 сутки после поглощения.
Предложено несколько методов генетической модификации аутологичных МСК жировой ткани при лечении ДЯС на основе временной экспрессии ряда генов. Транзиторная сверхэкспрессия для восстановления терапевтического потенциала — увеличения пролиферации и жизнеспособности трансплантируемых клеток одного из генов — SDF-1α и MALAT1 [36], c-Jun [35], IL-7 [37], а также некоторых микро-РНК [38].
Ген С-Jun представляет собой основной элемент фактора транскрипции AP-1, который участвует в регуляции дифференцировки, миграции, пролиферации и апоптоза клеток, а также в звеньях воспалительных процессов и онкогенезе. Этот фактор также связан с метаболизмом EGF, что подчеркивает его важную роль в процессе заживления кожных ран. Клетки с повышенной экспрессией c-Jun демонстрируют более активную пролиферацию и продукцию факторов роста, что стимулирует заживление ран у крыс с диабетом по сравнению с контролем [35].
Действие гена SDF-1α для восстановления регенеративного потенциала МСК показало [38], что клетки несут конструкцию с повышенной экспрессией гена SDF-1α, активированного этим геном. SDF-1α действует как хемокин, рекрутируя клетки в месте раны и стимулируя ангиогенез [38]. Этот ген улучшает жизнеспособность МСК. Показано, что скаффолд, применяемый в ране в виде генного каркаса, активированного геном SDF-1α, усиливает ангиогенез, что способствует ускоренному заживлению раны.
Экспрессия VEGF — избыточная экспрессия MALAT1 — также оказывает сильное влияние на количество белка VEGF в клетке. MALAT1 производит полноразмерную некодирующую РНК, конкурентно ингибирует miR-205, которая при отсутствии механизмов подавления связывается с 3’ участком РНК гена VEGF и блокирует синтез белка. Оказалось, что трансплантация МСК, транзиторно экспрессирующих MALAT1, оказывает влияние не только на ускоренное заживление ран, но и стимулируют выживаемость бета-клеток поджелудочной железы у мышей [39].
Цитокин IL-7 выполняет значимую роль в процессах заживления ран, выступая в качестве фактора выживания для определенных видов клеток. В случае временного повышения экспрессии гена IL-7 в стволовых клетках усиливается экспрессия основных ангиогенных факторов, таких как: VEGF, фактор роста гепатоцитов [HGF], рецептора VEGF 1 и 2 типов. Было экспериментально подтверждено ускоренное заживление ДЯС при такой модификации [40].
Некоторые малые РНК, например, miR-205, miR-206, miR-130a-3p, являются прямыми регуляторами трансляции белка VEGF [39]. Снижение экспрессии miR-205 увеличивает количество белка VEGF, производимого стволовыми клетками, что облегчает лечение ДЯС. Внутриклеточная модуляция этих микро-РНК в МСК способствует репарации кожи и снижает проонкогенный риск.
Процессы ангиогенеза являются мишенью для малых РНК, таких как miR-205-5p, miR-23a-3p и miR-130a-3p, которые нацелены на большинство генов, связанных с этим. VEGF может усиленно экспрессироваться благодаря транзиторно увеличенной дозе гена регуляторной РНК в стволовой клетке. Такая регуляция VEGF может быть более безопасной, чем конститутивная сверхэкспрессия генов ангиогенеза, которая часто происходит в малигнизированных тканях.
ЗАКЛЮЧЕНИЕ
Заживление ДЯС при состояниях с измененным иммунным статусом (в т.ч. из-за изменения концентрации глюкозы в крови) в сочетании с хроническим воспалительным процессом, как при СД, — длительный процесс, который может закончиться ампутацией пораженной конечности или смертью из-за сепсиса. Рецидивы воспаления, вторичные инфекции в открытой ране, заживающей в течение нескольких месяцев, делают даже небольшие повреждения серьезным испытанием для иммунной системы организма.
Новые клеточные технологии помогают контролировать заживление ран, успешно разрабатываются для терапии хронических язв, возникающих зачастую при диабете. К таким клеточным технологиям относятся: увеличение жизнеспособности стволовых клеток за счет использования генного каркаса эпидермального фактора роста или SDF-1α, временной повышенной экспрессии генов Neurotrophin-3, c-Jun и IL-7, экспрессия гена MALAT1 для снижения активности микроРНК-205-5p. Такое свойство трансплантируемых клеток, как миграция к местам воспаления в организме, делает их незаменимым инструментом для переноса различных терапевтических агентов к местам патологического процесса. Для того чтобы использовать такие технологии в клинической практике, они должны быть максимально безопасны. Однако показано, что терапия стволовыми клетками имеет и побочные эффекты, которые могут усугубить хронические воспалительные процессы, часто возникающие как последствие диабета. Эти технологии находятся в процессе разработки и требуют валидации и оценки клинической эффективности перед применением. Следовательно, если введение МСК сопровождается временными генными модификациями, которые способны контролировать миграцию, жизнеспособность и паракринный эффект трансплантата, то это, несомненно, сделает клеточную терапию ДЯС более эффективной и безопасной.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источник финансирования. Cтатья подготовлена на основании результатов, полученных в ходе реализации Соглашения о предоставлении гранта в форме субсидий из федерального бюджета на осуществление государственной поддержки создания и развития научных центров мирового уровня, выполняющих исследования и разработки по приоритетам научно-технологического развития от 20 апреля 2022 года № 075-15-2022-310.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Участие авторов. Абакушина Е.В. — разработка концепции научной работы, анализ научной работы, критический пересмотр с внесением ценного интеллектуального содержания; Воробьева И.Г. — написание статьи, подбор литературы по теме статьи; Степанова И.А. — анализ научной литературы; составление черновика рукописи; Румянцев С.А. — обработка результатов, критический пересмотр с внесением ценного интеллектуального содержания.
Список литературы
1. Armstrong DG, Boulton AJM, Bus SA. Diabetic Foot Ulcers and Their Recurrence. N Engl J Med. 2017;376(24):2367-2375. https://doi/10.1056/NEJMra1615439
2. Liu J, Ding Y, Liu Z, Liang X. Senescence in Mesenchymal Stem Cells: Functional Alterations, Molecular Mechanisms, and Rejuvenation Strategies. Front Cell Dev Biol. 2020;8:258. https://doi.org/10.3389/fcell.2020.00258
3. Hanefeld M, Duetting E, Bramlage P. Cardiac implications of hypoglycemia in patients with diabetes - a systematic review. Cardiovasc Diabetol. 2013;12:135. https://doi.org/10.1186/1475-2840-12-135
4. Skrepnek GH, Mills JL Sr, Armstrong DG. A Diabetic Emergency One Million Feet Long: Disparities and Burdens of Illness among Diabetic Foot Ulcer Cases within Emergency Departments in the United States, 2006-2010. PLoS One. 2015;10(8):e0134914. https://doi.org/10.1371/journal.pone.0134914
5. Shao J, Zhang W, Yang T. Using mesenchymal stem cells as a therapy for bone regeneration and repairing. Biol Res. 2015;48:62. https://doi.org/10.1186/s40659-015-0053-4
6. Najar M, Melki R, Khalife F, et al. Therapeutic Mesenchymal Stem/Stromal Cells: Value, Challenges and Optimization. Front Cell Dev Biol. 2022;9:716853. https://doi.org/10.3389/fcell.2021.716853
7. ClinTrials.gov [Internet]. National Library of Medicine [cited 2024 Aug 7]. Available from: https://clinicaltrials.gov/.
8. Chinese Clinical Trial Registry [Internet]. ChiCTR. [cited 2024 Aug 7]. Available from: https://www.chictr.org.cn.
9. Otero-Viñas M, Falanga V. Mesenchymal Stem Cells in Chronic Wounds: The Spectrum from Basic to Advanced Therapy. Adv Wound Care (New Rochelle). 2016;5(4):149-163. https://doi.org/10.1089/wound.2015.0627
10. Rivas-Santiago B, Trujillo V, Montoya A, et al. Expression of antimicrobial peptides in diabetic foot ulcer. J Dermatol Sci. 2012;65(1):19-26. https://doi.org/10.1016/j.jdermsci.2011.09.013
11. Rahavi H, Hashemi SM, Soleimani M, et al. Adipose tissue-derived mesenchymal stem cells exert in vitro immunomodulatory and beta cell protective functions in streptozotocin-induced diabetic mice model. J Diabetes Res. 2015;2015:878535. https://doi.org/10.1155/2015/878535
12. Sriram G, Bigliardi PL, Bigliardi-Qi M. Fibroblast heterogeneity and its implications for engineering organotypic skin models in vitro. Eur J Cell Biol. 2015;94(11):483-512. https://doi.org/10.1016/j.ejcb.2015.08.001
13. Warsinske HC, Ashley SL, Linderman JJ, et al. Identifying Mechanisms of Homeostatic Signaling in Fibroblast Differentiation. Bull Math Biol. 2015;77(8):1556-82. https://doi.org/10.1007/s11538-015-0096-2
14. Tang QL, Han SS, Feng J, et al. Moist exposed burn ointment promotes cutaneous excisional wound healing in rats involving VEGF and bFGF. Mol Med Rep. 2014;9(4):1277-82. https://doi.org/10.3892/mmr.2014.1921
15. Gentile P, Casella D, Palma E, Calabrese C. Engineered Fat Graft Enhanced with Adipose-Derived Stromal Vascular Fraction Cells for Regenerative Medicine: Clinical, Histological and Instrumental Evaluation in Breast Reconstruction. J Clin Med. 2019;8(4):504. https://doi.org/10.3390/jcm8040504
16. Cassidy FC, Shortiss C, Murphy CG, et al. Impact of Type 2 Diabetes Mellitus on Human Bone Marrow Stromal Cell Number and Phenotypic Characteristics. Int J Mol Sci. 2020;21(7):2476. https://doi.org/10.3390/ijms21072476
17. Moll G, Alm JJ, Davies LC, et al. Do cryopreserved mesenchymal stromal cells display impaired immunomodulatory and therapeutic properties? Stem Cells. 2014;32(9):2430-42. https://doi.org/10.1002/stem.1729
18. López-García L, Castro-Manrreza ME. TNF-α and IFN-γ Participate in Improving the Immunoregulatory Capacity of Mesenchymal Stem/Stromal Cells: Importance of Cell-Cell Contact and Extracellular Vesicles. Int J Mol Sci. 2021;22(17):9531. https://doi.org/10.3390/ijms22179531
19. Fukumoto R. Mesenchymal stem cell therapy for acute radiation syndrome. Mil Med Res. 2016;3:17. https://doi.org/10.1186/s40779-016-0086-1
20. Krampera M, Galipeau J, Shi Y, et al. MSC Committee of the International Society for Cellular Therapy (ISCT). Immunological characterization of multipotent mesenchymal stromal cells--The International Society for Cellular Therapy (ISCT) working proposal. Cytotherapy. 2013;15(9):1054-61. https://doi.org/10.1016/j.jcyt.2013.02.010
21. Joswig AJ, Mitchell A, Cummings KJ, et al. Repeated intra-articular injection of allogeneic mesenchymal stem cells causes an adverse response compared to autologous cells in the equine model. Stem Cell Res Ther. 2017;8(1):42. https://doi.org/10.1186/s13287-017-0503-8
22. Lourenco S, Teixeira VH, Kalber T, et al. Macrophage migration inhibitory factor-CXCR4 is the dominant chemotactic axis in human mesenchymal stem cell recruitment to tumors. J Immunol. 2015;194(7):3463-74. https://doi.org/10.4049/jimmunol.1402097
23. Carraro A, Trevellin E, Fassan M, et al. Esophageal adenocarcinoma microenvironment: Peritumoral adipose tissue effects associated with chemoresistance. Cancer Sci. 2017;108(12):2393-2404. https://doi.org/10.1111/cas.13415
24. Segers VF, Van Riet I, Andries LJ, et al. Mesenchymal stem cell adhesion to cardiac microvascular endothelium: activators and mechanisms. Am J Physiol Heart Circ Physiol. 2006;290(4):H1370-7. https://doi.org/10.1152/ajpheart.00523.2005
25. Jabłońska-Trypuć A, Matejczyk M, Rosochacki S. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs. J Enzyme Inhib Med Chem. 2016;31(sup1):177-183. https://doi.org/10.3109/14756366.2016.1161620
26. Sheng H, Wang Y, Jin Y, et al. A critical role of IFNgamma in priming MSC-mediated suppression of T cell proliferation through up-regulation of B7-H1. Cell Res. 2008;18(8):846-57. https://doi.org/10.1038/cr.2008.80
27. Barros JF, Waclawiak I, Pecli C, et al. Role of Chemokine Receptor CCR4 and Regulatory T Cells in Wound Healing of Diabetic Mice. J Invest Dermatol. 2019;139(5):1161-1170. https://doi.org/10.1016/j.jid.2018.10.039
28. Du J, Liu A, Zhu R, et al. The Different Effects of IFN-β and IFN-γ on the Tumor-Suppressive Activity of Human Amniotic Fluid-Derived Mesenchymal Stem Cells. Stem Cells Int. 2019;2019:4592701. https://doi.org/10.1155/2019/4592701
29. Ahn JO, Lee HW, Seo KW, et al. Anti-tumor effect of adipose tissue derived-mesenchymal stem cells expressing interferon-β and treatment with cisplatin in a xenograft mouse model for canine melanoma. PLoS One. 2013;8(9):e74897. https://doi.org/10.1371/journal.pone.0074897
30. Yang X, Du J, Xu X, et al. IFN-γ-secreting-mesenchymal stem cells exert an antitumor effect in vivo via the TRAIL pathway. J Immunol Res. 2014;2014:318098. https://doi.org/10.1155/2014/318098
31. Hörnle M, Peters N, Thayaparasingham B, et al. Caspase-3 cleaves XIAP in a positive feedback loop to sensitize melanoma cells to TRAIL-induced apoptosis. Oncogene. 2011;30(5):575-87. https://doi.org/10.1038/onc.2010.434
32. Yang ZS, Tang XJ, Guo XR, et al. Cancer cell-oriented migration of mesenchymal stem cells engineered with an anticancer gene (PTEN): an imaging demonstration. Onco Targets Ther. 2014;7:441-6. https://doi.org/10.2147/OTT.S59227
33. Guo XR, Hu QY, Yuan YH, et al. PTEN-mRNA engineered mesenchymal stem cell-mediated cytotoxic effects on U251 glioma cells. Oncol Lett. 2016;11(4):2733-2740. https://doi.org/10.3892/ol.2016.4297
34. Etich J, Bergmeier V, Pitzler L, Brachvogel B. Identification of a reference gene for the quantification of mRNA and miRNA expression during skin wound healing. Connect Tissue Res. 2017;58(2):196-207. https://doi.org/10.1080/03008207.2016.1210606
35. Yue C, Guo Z, Luo Y, et al. c-Jun Overexpression Accelerates Wound Healing in Diabetic Rats by Human Umbilical Cord-Derived Mesenchymal Stem Cells. Stem Cells Int. 2020;2020:7430968. https://doi.org/10.1155/2020/7430968
36. Laiva AL, O’Brien FJ, Keogh MB. SDF-1α Gene-Activated Collagen Scaffold Restores Pro-Angiogenic Wound Healing Features in Human Diabetic Adipose-Derived Stem Cells. Biomedicines. 2021;9(2):160. https://doi.org/10.3390/biomedicines9020160
37. Sun X, Luo L, Li J. LncRNA MALAT1 facilitates BM-MSCs differentiation into endothelial cells via targeting miR-206/VEGFA axis. Cell Cycle. 2020;19(22):3018-3028. https://doi.org/10.1080/15384101.2020.1829799
38. Zhu J, Luo Y, Zhao Y, et al. circEHBP1 promotes lymphangiogenesis and lymphatic metastasis of bladder cancer via miR-130a-3p/TGFβR1/VEGF-D signaling. Mol Ther. 2021;29(5):1838-1852. https://doi.org/10.1016/j.ymthe.2021.01.031
39. Li X, Song Y, Liu F, et al. Long Non-Coding RNA MALAT1 Promotes Proliferation, Angiogenesis, and Immunosuppressive Properties of Mesenchymal Stem Cells by Inducing VEGF and IDO. J. Cell. Biochem. 2017;118(9):2780-2791. https://doi.org/10.1002/jcb.25927
40. Khalid RS, Khan I, Zaidi MB, et al. IL-7 overexpression enhances therapeutic potential of rat bone marrow mesenchymal stem cells for diabetic wounds. Wound Repair and Regeneration. 2019;27(3):235-248. https://doi.org/10.1111/wrr.12706
Об авторах
Е. В. АбакушинаРоссия
Абакушина Елена Вячеславовна - д.м.н.; ResearcherID: O-6947-2014; Scopus Author ID: 15844847700.
117292, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. Г. Воробьева
Россия
Воробьева Ива Глебовна - к.б.н., ст.н.с.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
И. А. Степанова
Россия
Степанова Ирина Анатольевна - к.б.н., н.с.; ResearcherID: U-5075-2018; Scopus Author ID: 56086276200.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
С. А. Румянцев
Россия
Румянцев Сергей Александрович - д.м.н., профессор; ResearcherID: L-1428-2018; Scopus Author ID: 6506470384.
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Дополнительные файлы
|
|
1. Рисунок 1. Интерферон-гамма (IFN-γ) и фактор некроза опухоли альфа (TNF-α) определяют иммунный фенотип мезенхимальных стволовых клеток. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(359KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Абакушина Е.В., Воробьева И.Г., Степанова И.А., Румянцев С.А. Терапия хронических трофических язв у больных сахарным диабетом с применением генных модификаций клеточного трансплантата. Сахарный диабет. 2024;27(6):611-619. https://doi.org/10.14341/DM13215
For citation:
Abakushina E.V., Vorobyova I.G., Stepanova I.A., Roumiantsev S.A. Therapy of chronic skin ulcers in patients with diabetes mellitus using gene modifications of cell transplant. Diabetes mellitus. 2024;27(6):611-619. (In Russ.) https://doi.org/10.14341/DM13215
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































