Перейти к:
Клинико-лабораторные и генетические особенности семейных форм сахарного диабета 1 типа
https://doi.org/10.14341/DM13200
Аннотация
ОБОСНОВАНИЕ. Семейные формы сахарного диабета 1 типа (СД1) представляют особый интерес в связи с высокой концентрацией заболевания, что может быть обусловлено особыми генетическими и средовыми факторами. Их изучение может позволить лучше понять и выявить новые иммунологические и генетические особенности СД1.
ЦЕЛЬ. Изучить клинико-лабораторные и генетические особенности семейных форм СД1.
МАТЕРИАЛЫ И МЕТОДЫ. Одноцентровое одномоментное исследование, включающее 267 пациентов с семейной формой СД1, и 681 пациента со спорадической формой СД1, госпитализированных в ФГБУ «НМИЦ эндокринологии» МЗ РФ в 2016–2023 гг., у которых проведена оценка клинических, лабораторных и генетических параметров.
РЕЗУЛЬТАТЫ. Медиана возраста манифестации была значимо ниже у детей с семейной формой СД1 (5,2 [3,0; 8,0] и 6,4 [3,6; 9,2] соответственно, p<0,001). Острая манифестация заболевания в состоянии кетоза или диабетического кетоацидоза (ДКА) отмечалась чаще в группе со спорадической формой СД1 (90,3% vs 74%, p<0,001). Частота ДКА в дебюте заболевания в группе сибсов, заболевших в семье первыми, составила 50,5%, в группе сибсов, заболевших вторыми и третьими, — 19,5%, в то время как у детей из семей, где один или оба родителя имеют СД1, — 21% (p<0,001). У детей с семейной формой СД1 чаще выявлялись антитела IAA и GAD (p<0,013 и p<0,003 соответственно). Значимых различий в показателях метаболической компенсации СД1 в исследуемых группах не отмечалось. Предрасполагающие HLA-гаплотипы DRB1*04-DQA1*03:03-DQB1*03:02 и DRB1*07-DQA1*02:01-DQB1*02:02 чаще встречались при семейной форме СД1 (p<0,001 и p<0,001), в то время как протекторный гаплотип DRB1*08-DQA1*04:01-DQB1*04:02 — при спорадической форме.
ЗАКЛЮЧЕНИЕ. Семейные формы СД1 характеризуются более ранним возрастом, меньшим, но все еще значимым риском ДКА при манифестации заболевания, а также особенностями иммунологического профиля и распределения предрасполагающих и защитных HLA-гаплотипов. Полученные данные будут способствовать улучшению прогнозирования рисков и дальнейшим исследованиям в области изучения патогенеза СД1.
Для цитирования:
Зуфарова Ю.М., Лаптев Д.Н., Минниахметов И.Р., Хусаинова Р.И., Попов С.В., Титович Е.В., Еремина И.А., Петеркова В.А. Клинико-лабораторные и генетические особенности семейных форм сахарного диабета 1 типа. Сахарный диабет. 2024;27(6):520-527. https://doi.org/10.14341/DM13200
For citation:
Zufarova I.M., Laptev D.N., Minniahmetov I.R., Khusainova R.I., Popov S.V., Titovich E.V., Eremina I.A., Peterkova V.A. Clinical, biochemical and genetic characteristics of familial forms of type 1 diabetes. Diabetes mellitus. 2024;27(6):520-527. (In Russ.) https://doi.org/10.14341/DM13200
ОБОСНОВАНИЕ
Сахарный диабет 1 типа (СД1) — многофакторное заболевание, при котором возникает аутоиммунный процесс с последующим разрушением бета-клеток поджелудочной железы, обусловленное влиянием генетических и средовых факторов [1]. При наличии нескольких близких (дети или родители) членов семьи с СД1 выделяют так называемую семейную форму заболевания, в отличие от спорадической формы, когда в семье болен только один человек. Семейные формы, в свою очередь, могут быть разделены на два типа: несколько сибсов с СД1 или родитель и ребенок с СД1. Распространенность семейных форм составляет около 10–15% от всех случаев СД1 [1][2]. Риск развития СД1 у родственников первой линии в 8–15 раз выше в сравнении с общепопуляционным [3–5]. При этом риск СД1 варьирует в зависимости от больного члена семьи: при наличии ребенка с СД1 риск заболевания у сибса составляет 4–5%, а заболевание развивается в более раннем возрасте [6][7]. Дети от отцов с СД1 имеют более высокий риск развития СД1 (3,6–8,5%) по сравнению с детьми от матерей с СД1 (1,1–3,6%) [3][8][9].
Семейная кластеризация подчеркивает значимость генетической предрасположенности, что обусловлено более высокой распространенностью HLA и не-HLA вариантов, ассоциированных с риском развития заболевания, у членов семьи с СД1. Между тем неполная конкордантность у гомозиготных близнецов предполагает участие в патогенезе заболевания других, в том числе средовых, факторов.
В связи с повышенным риском развития СД1 в течение жизни родственники первой линии являются кандидатами в исследования по изучению этиологии и патогенеза заболевания, а также привлекаются к участию в клинических интервенционных исследованиях для предупреждения или замедления прогрессирования заболевания [10].
Предполагается, что патогенез СД1 различается в спорадических и семейных случаях, однако имеющиеся данные противоречивы [1][11][12]. Исследования, проведенные в Финляндии, показали, что профиль специфических островковых антител аналогичен при семейной и спорадических формах, что предполагает сходный патогенетический процесс разрушения бета-клеток [11][12]. С другой стороны, различие генетического и клинического профилей может указывать на то, что патофизиология между различными формами может быть разной [13].
Ассоциация различных HLA аллелей с риском СД1 была и остается предметом исследований в течение последних десятилетий. Основными предрасполагающими HLA гаплотипами для Европейских (включая Российскую) популяций являются DRB1*04-DQA1*03:01- DQB1*03:02 (DR4-DQ8) и DRB1*03-DQA1*05:01- DQB1*02:01 (DR3-DQ2). В то же время к основным защитным HLA-гаплотипам относятся: DRB1*15-DQA1*01:02-DQB1*06:02; DRB1*13-DQA1*01:03-DQB1*0603 [14].
Данные о семейных формах СД1 в Российской Федерации ограничены. В связи с тем, что СД1 в большинстве представлен спорадическими случаями, именно семейные формы представляют собой особый интерес в связи с высокой концентрацией заболевания, что может быть обусловлено особыми генетическими и средовыми факторами. Изучение семейных форм может позволить лучше понять и выявить новые иммунологические и генетические особенности СД1.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить клинико-лабораторные и генетические особенности семейных форм СД1.
МАТЕРИАЛЫ И МЕТОДЫ
Место и время проведения исследования
Место проведения. Обследование и лечение пациентов проводились в детском отделении СД ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России.
Время исследования. В исследование включены данные пациентов, проходивших стационарное обследование с 2021 по 2024 гг.
Изучаемая популяции
В исследование включено 267 пациентов с семейной формой СД1 (177 сибсов с СД1, 90 детей от родителей с СД1), группу контроля составил 681 пациент со спорадической формой СД1, сопоставимый по полу и возрасту на момент обследования. Распределение на группы представлено на рис. 1.
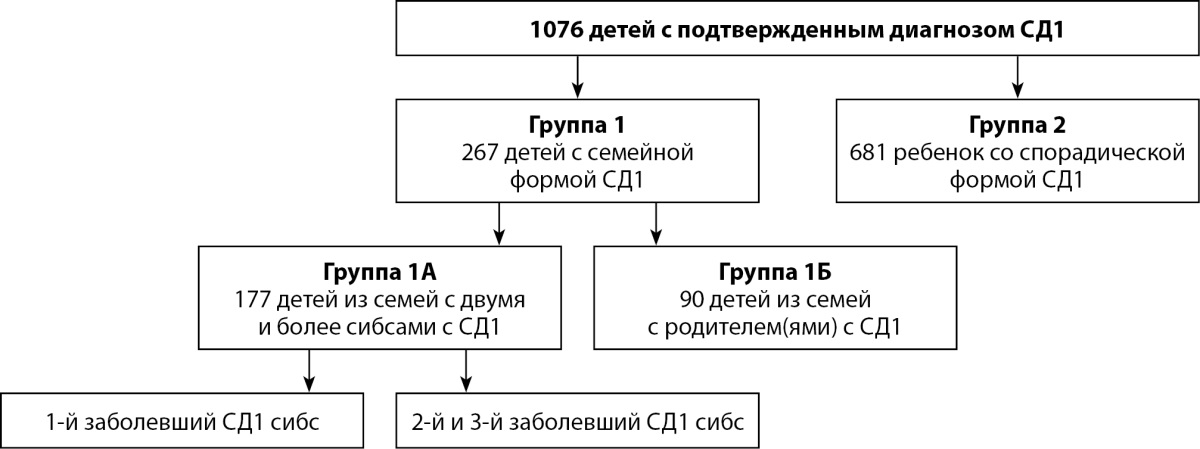
Рисунок 1. Изучаемая группа пациентов.
Дизайн исследования
Одноцентровое одномоментное исследование.
Методы
Общеклинические данные включали показатели возраста диагностики СД1, тип манифестации, наследственный анамнез, возраст на момент обследования пациентов, наличие специфических осложнений, сопутствующей аутоиммунной патологии.
Гликированный гемоглобин (HbA1c) определялся методом жидкостной ионообменной хроматографии на анализаторе Diastat (BioRad, США).
Иммунологическое исследование: количественное определение аутоантител (ААт) к GAD и IAA проводилось с помощью иммуноферментных наборов Isletest-GADA, IAA фирмы Biomerica, Ат IA-2 — наборов Medizym фирмы Medipan MGBH, Ат к ZnT8 — иммуноферментных наборов Zinc Transporter 8 Autoantibody Human ELISA фирмы BioVendor. Результаты считались положительными при титрах ZnT8 — >15 ед/мл; IA-2, GAD, IAA — >20 ед/мл.
Статистический анализ
Статистическая обработка проводилась в Python 3.10.2 с использованием открытой библиотеки statsmodels 0.13.2 [9].
Совокупности количественных показателей описывались при помощи значений медианы (Me) и нижнего и верхнего квартилей [Q1; Q3]. Различие между количественными признаками в независимых выборках с помощью критерия Манна–Уитни.
Номинативные данные описывались в виде абсолютной (n) и относительной частоты (%). Доверительный интервал (ДИ) для биноминальных пропорций (частот) рассчитывался методом Агрести-Коулла. Для сравнения частот в каждой изучаемой группе использовались таблица кросстабуляции и статистика χ² с поправкой на непрерывность, когда это необходимо (количество ожидаемых наблюдений в любой из ячеек <5). Корректировка на конфаундеры была выполнена с использованием логистической регрессии. В случае множественных сравнений применялась поправка Бонферрони.
Генетическое исследование HLA
Геномную ДНК извлекали роботизированной станцией Allsheng Autopure-96 (Hangzhou Allsheng Instruments Co., Ltd., China) из периферической крови с использованием набора для выделения геномной ДНК из цельной крови NucleoMag Blood (MN). Выделенную ДНК качественно и количественно анализировали с помощью спектрофотометра Eppendorf Biospectrometer Fluorescence (Eppendorf AG, Germany) и набора Qubit dsDNA HS Assay (Invitrogen, Carlsbad, CA, USA) соответственно.
Подготовку полногеномной библиотеки (KAPA HyperPlus, Roche, Швейцария) и обогащение матрицы ДНК (KAPA HyperCapture, Roche, Швейцария) производили в соответствии с протоколами производителя, используя набор зондов KAPA HyperExome (Roche, Швейцария). Исследование проведено методом массового параллельного секвенирования (next-generation sequencing, NGS) на платформе Illumina методом парно-концевого чтения (2x100 п.о.).
Обработка данных секвенирования проведена с использованием автоматизированного алгоритма, включающего выравнивание прочтений на референсную последовательность генома человека (HG38), постпроцессинг выравнивания, выявление вариантов и фильтрацию вариантов по качеству, а также аннотацию выявленных вариантов по всем известным транскриптам каждого гена из базы RefSeq с применением компьютерных алгоритмов предсказания патогенности вариантов (SIFT, PolyPhen-2 HDIV, Polyphen-2 HVAR, PROVEAN, CADD). Для оценки популяционных частот выявленных вариантов использованы данные международного проекта gnomAD Exomes для экзонных вариантов и базы gnomAD Genomes для интронных вариантов. Для предсказания эффекта изменений в сайтах сплайсинга и прилежащих к сайту сплайсинга интронных участках использованы программы SpliceAI и AdaBoost.
Типирование HLA II класса проводилось с помощью HLA-HD с настройками по умолчанию.
Для анализа ассоциаций были отобраны ранее описанные в литературе предрасполагающие и протекторные в отношении СД1 DR-DQ гаплотипы; при этом в анализ были включены только аллели с частотой встречаемости не менее 0,5% во всей выборке: DRB1*04-DQA1*03:01(3)-DQB1*03:02, DRB1*03-DQA1*05:01-DQB1*02:01, DRB1*07-DQA1*02:01-DQB1*02:02, DRB1*13-DQA1*01:03-DQB1*0603, DRB1*01-DQA1*01:01-DQB1*05:01, DRB1*04-DQA1*03:03-DQB1*03:01, DRB1*08-DQA1*04:01-DQB1*04:02 [15].
Этическая экспертиза
Протокол исследования одобрен локальным комитетом по этике ФГБУ «НМИЦ эндокринологии» Минздрава России (выписка из протокола №26 от 22.12.2021). Все родители и официальные опекуны пациентов подписывали информированное согласие до включения в исследование.
РЕЗУЛЬТАТЫ
Пациенты из 1 и 2 групп были сопоставимы по возрасту на момент обследования, уровень HbA1c и суточная доза инсулина статистически значимо не отличались (p<0,098 и p<0,599 соответственно). Медиана возраста манифестации в 1 группе (n=267, 5,2 [ 3,0; 8,0]) была статистически значимо ниже в сравнении со 2 группой (n=681, 6,4 [ 3,6; 9,2]), p<0,001.
Клинико-лабораторная характеристика пациентов представлена в табл. 1.
Таблица 1. Клинико-лабораторная характеристика обследованных пациентов
Семейный СД1 | Спорадический СД1 | p | |
Количество пациентов, n | 267 | 681 | - |
Соотношение полов (м:ж) | 1:0,96 | 1:1,09 | 0,396 |
Возраст на момент диагностики, лет | 5,2 [ 3,0; 8,0] | 6,4 [ 3,6; 9,2] | <0,001 |
Возраст на момент обследования, лет | 9,7 [ 6,5; 13,2] | 10,0 [ 6,7; 12,5] | 0,567 |
HbA1c на момент обследования, % | 7,7 [ 6,9; 8,7] | 7,6 [ 6,8; 8,5] | 0,098 |
Суточная доза инсулина, Ед/кг/сут | 0,8 [ 0,6; 1,0] | 0,8 [ 0,6; 1,0] | 0,599 |
Примечание. Данные представлены в виде медианы и интерквантильного размаха: Me [ Q1; Q3]. СД1 — сахарный диабет 1 типа; HbA1c — гликированный гемоглобин.
Характеристика манифестации заболевания
Возраст манифестации СД1 у детей в группе 1А (n=177) был значимо (p<0,016) меньше по сравнению с детьми из группы 1Б и составил 4,8 [ 2,7; 7,8] и 6,4 [ 3,4; 8,9] года соответственно. При анализе 1А группы установлено, что медиана возраста манифестации первого заболевшего сибса составила 3,9 года [ 2,2; 6,7], второго и третьего (при наличии) сибсов — 4,9 года [ 2,9; 7,9]. Статистически значимой разницы в возрасте манифестации сибсов в одной семье не отмечалось (p<0,189).
Острая манифестация заболевания в состоянии кетоза или диабетического кетоацидоза (ДКА) отмечалась чаще в группе со спорадической формой СД1: при спорадической форме диагноз в остром состоянии устанавливался в 90,3% случаев, при семейной форме — в 74% (p<0,001). Уровень HbA1c на момент манифестации был значимо выше в группе спорадического СД1, где медиана показателя составила 11,3 [ 9,2; 13,0], в то время как в группе семейного СД1 медиана HbA1c соответствовала 8,9 [ 7,1; 10,2], p<0,001. Статистически значимой разницы уровня HbA1c между семейными формами не выявлено (1А — 8,8 [ 7,1; 9,9], 1Б — 8,9 [ 7,1; 10,4], p<0,676).
При анализе характера манифестации в группах семейного СД1 отмечалась статистически значимая разница в частоте ДКА (p<0,001). Так, частота ДКА в дебюте заболевания в группе сибсов, заболевших в семье первыми, составила 50,5%, в группе сибсов, заболевших вторыми и третьими — 19,5%, в то время как у детей из семей, где один или оба родителя имеют СД1, — 21% (рис. 2). Также между этими группами отмечена значимая разница в отношении частоты бессимптомной гипергликемии или глюкозурии (p<0,001): у сибсов, заболевшими первыми в семье, — 10,5%, у сибсов, заболевших вторыми и третьими, — 34%, у детей от родителей с СД1 — 25%. Частота кетоза в группах значимо не отличалась (p<0,158). Острая манифестация в семьях, где СД1 болен отец, встречалась в 81% случаев, в семьях, где СД1 установлен у матери в 70%.
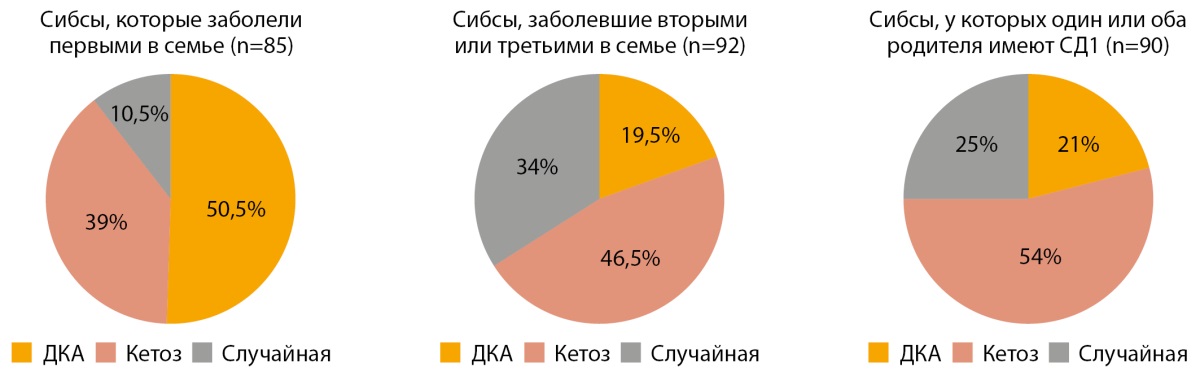
Рисунок 2. Характер манифестации заболевания в группах с семейной формой сахарного диабета 1 типа.
Примечание. ДКА — диабетический кетоацидоз; случайная диагностика — бессимптомная гипергликемия или глюкозурия; СД1 — сахарный диабет 1 типа.
Особенности иммунологического статуса
В группе семейного СД1 статистически значимо чаще обнаруживались островковые ААт к IAA и GAD на момент обследования (p<0,013 и p<0,003, соответственно) (рис. 3). Статистически значимых различий уровня ААт к IA-2, ZnT8 в группах не получено (p<0,666 и p<0,994, соответственно).
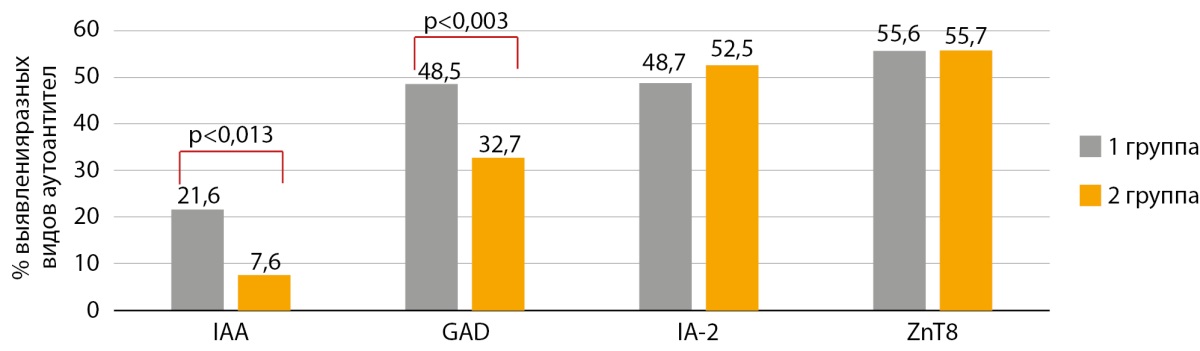
Рисунок 3. Частота аутоантител (IAA, GAD, IA-2, ZnT8) у детей с разной формой сахарного диабета 1 типа.
Примечания: IAA — аутоантитела к инсулину; IA-2 — аутоантитела к тирозинфосфатазе; GAD — аутоантитела к глутаматдекарбоксилазе; ZnT8 — аутоантитела к транспортеру цинка 8. Для сравнения групп использовались критерий Хи-квадрат с поправкой на длительность заболевания.
Осложнения СД1 и сопутствующие заболевания
Частота специфических диабетических осложнений и сопутствующей аутоиммунной патологии (аутоиммунный тиреоидит) значимо не различалась между семейной и спорадической формами СД1 (табл. 2).
Таблица 2. Частота специфических осложнений и сопутствующих заболевания при различных формах сахарного диабета 1 типа
Семейный СД1 | Спорадический СД1 | р* | |||
n | n | ||||
Диабетическая полинейропатия | 265 | 17 (12,8–22,2) | 680 | 9 (7,0–11,4) | 0,372 |
Диабетическая ретинопатия | 265 | 2,3 (0,9–5,1) | 680 | 0,6 (0,2–1,6) | 0,333 |
Диабетическая нефропатия | 262 | 0,4 (0,0–2,4) | 530 | 2,1 (1,1–3,8) | 0,090 |
Наличие АТ к тканям щитовидной железы | 249 | 17,7 (13,3–23,1) | 590 | 18,5 (15,5–21,9) | 0,400 |
Примечания: *с поправкой на длительность СД1. Данные представлены как % (95% ДИ). Для сравнения частот между групп использовались статистика χ². Корректировка на конфаундеры была выполнена с использованием логистической регрессии.
Анализ HLA II класса
Исследование DR-DQ гаплотипов показало (табл. 3), что у детей с разными формами СД1 предрасполагающие гаплотипы DR3-DQ2/DR4-DQ8 встречался с одинаковой частотой (p=0,079 и p=1). В то же время частота гаплотипа DRB1*04-DQA1*03:03-DQB1*03:02, входящего в состав гаплотипа DR4-DQ8 была выше у детей с семейной формой СД1 (p<0,001). Среди предрасполагающих гаплотипов частота DRB1*07-DQA1*02:01-DQB1*02:02 также была выше в группе семейных форм (p<0,001). Напротив у детей со спорадической формой СД1 чаще присутствовал протекторный гаплотип DRB1*08-DQA1*04:01-DQB1*04:02 (в 6,6% по сравнению с 1%, р<0,024). Частота других гаплотипов значимо не различалась между групп.
Таблица 3. DR-DQ гаплотипы в группах детей с разными формами сахарного диабета 1 типа
Гаплотип | Семейный СД1 (n=101) | Спорадический СД1 (n=456) | р | р* | ||||
DRB1 | DQA1 | DQB1 | % | 95% ДИ | % | 95% ДИ | ||
Предрасполагающие | ||||||||
04 | 03:01 | 03:02 | 59,4 | 49,2–68,9 | 59,40 | 54,8–63,9 | 0,733 | 1 |
04 | 03:03 | 03:02 | 5 | 1,8–11,7 | 0 | 0–1 | <0,001 | <0,001 |
03 | 05:01 | 02:01 | 38,6 | 29,2–48,9 | 48,2 | 43,6–52,9 | 0,079 | 0,712 |
07 | 02:01 | 02:02 | 4 | 1,3–10,4 | 0,0 | 0–1 | <0,001 | <0,001 |
Протекторные | ||||||||
01 | 01:01 | 05:01 | 15,8 | 9,6–24,8 | 18 | 14,6–21,9 | 0,609 | 1 |
04 | 03:0X | 03:01 | 6,9 | 3,1–14,2 | 5,5 | 3,7–8,1 | 0,571 | 1 |
13 | 01:03 | 06:03 | 2 | 0,3–7,7 | 2,9 | 1,6–5,0 | 0,625 | 1 |
08 | 04:01 | 04:02 | 1 | 0,1–6,2 | 6,6 | 4,6–9,4 | 0,027 | 0,240 |
Примечание. Данные представлены как % (95% ДИ). Для сравнения частот между групп использовались статистика χ².
* с поправкой множественные сравнения. ДИ — доверительный интервал; СД1 — сахарный диабет 1 типа.
Учитывая, что в выборку детей с семейным СД1 составляют в том числе сибсы из одной семьи, т.е. близкие родственники, и чтобы избежать возможного смещения выборки, отдельно был проведен анализ DR-DQ гаплотипов в выборке (n=57) неродственных сибсов и детей от родителей с СД1 (табл. 4). Полученные результаты были полностью сопоставимы с проведенной оценкой на всей выборке семейных случаев СД1.
Таблица 4. DR-DQ гаплотипы у не родственных между собой случаев семейного сахарного диабета 1 типа и детей со спорадической формой сахарного диабета 1 типа
Гаплотип | Семейный СД1 (n=57) | Спорадический СД1 (n=456) | р | р* | ||||
DRB1 | DQA1 | DQB1 | % | 95% ДИ | % | 95% ДИ | ||
Предрасполагающие | ||||||||
04 | 03:01 | 03:02 | 56,1 | 42,4–69,0 | 58,6 | 53,9–63,1 | 0,728 | 1 |
04 | 03:03 | 03:02 | 7,0 | 2,3–17,8 | 0 | 0,0–1,0 | <0,001 | <0,001 |
03 | 05:01 | 02:01 | 38,6 | 26,3–52,4 | 48,2 | 43,6–52,9 | 0,169 | 1 |
07 | 02:01 | 02:02 | 5,3 | 1,4–15,5 | 0 | 0,0–1,0 | <0,001 | <0,001 |
Протекторные | ||||||||
01 | 01:01 | 05:01 | 0 | 0,0–7,9 | 0,7 | 0,2–2,1 | 0,539 | 1 |
04 | 03:0X | 03:01 | 8,8 | 3,3–20,0 | 5,5 | 3,7–8,1 | 0,318 | 1 |
13 | 01:03 | 06:03 | 3,5 | 0,6–13,2 | 2,9 | 1,6–5,0 | 0,781 | 1 |
08 | 04:01 | 04:02 | 0 | 0,0–7,9 | 6,6 | 4,6–9,4 | 0,046 | 0,368 |
Примечание. Данные представлены как % (95% ДИ). Для сравнения частот между групп использовались статистика χ². * с поправкой множественные сравнения. ДИ — доверительный интервал; СД1 — сахарный диабет 1 типа.
ОБСУЖДЕНИЕ
Согласно множеству проведенных исследований, риск развития СД1 у родственников первой линии значительно выше общепопуляционного [16][17], что определяет необходимость изучения и наблюдения данной группы. В нашей работе на достаточной выборке представлен детальный анализ клинических, иммунологических и генетических особенностей детей с семейной формой СД1 в Российской популяции.
Возраст манифестации заболевания среди детей с семейной формой в нашей выборке был значимо ниже в сравнении с группой спорадического СД1. У пациентов, имеющих брата или сестру с СД1, возраст дебюта был так же значимо ниже, чем у пациентов, у которых один или оба родителя имеют СД1. В то время, как сравнение возраста развития заболевания у первого, второго и третьего сибсов в семьях не показало различий. Результаты отличаются от исследований финской и израильской популяций, описывающих одинаковый возраст манифестации в спорадических и семейных формах [18][19], но согласуются с данными немецкой группы исследователей [20]. Установлено, что более ранний возраст манифестации у первого сибса увеличивает риск развития заболевания у других детей в семье [14][17][20], что, вероятно, обусловлено наличием генетической предрасположенности в сочетании с влиянием схожих средовых факторов.
Предыдущие исследования показали, что заболевание у пациентов, имеющих родственников первой степени родства с СД1, как правило, устанавливается до развития жизнеугрожающих состояний [1][13]. По результатам нашего исследования, в группе с семейной формой СД1 отмечалась более низкая в сравнении со спорадической формой частота острой манифестации, однако процент выявления заболевания в состоянии кетоза или ДКА все равно был высоким и составил 74%. Ожидаемо, ДКА у сибсов, заболевших вторыми и третьими, а также у детей в семьях с больным родителем, встречался реже, что, очевидно, обусловлено осведомленностью родителей о симптомах заболевания. Что интересно, исследование B. Karges и соавт. [19] показало, что наличие СД1 у родственников второй и третьей линии увеличивает частоту случайного выявления гипергликемии у детей, что приводит к раннему выявлению заболевания и своевременному назначению инсулинотерапии. Стоит отметить, что в нашей выборке отмечалось несколько случаев, когда у первого сибса манифестация была случайная, в то время как второму ребенку диагноз был установлен после развития ДКА. Кроме того, по нашим данным, даже несмотря на осведомленность о заболевании в семьях, где уже один из членов семьи имеет СД1, в 20–21% случаев манифестация сопровождается развитием ДКА. Эти факты подчеркивают важность информирования родителей о возможности развития СД1 у других членов семьи.
Наличие у ребенка СД1 повышает риск развития других аутоиммунных заболеваний [21]. Распространенность аутоиммунного тиреоидита (АИТ) в детской популяции с СД1 составляет 3–30% [22]. В то же время, по результатам нашей работы, частота носительства антител к тканям ЩЖ была схожей во всех группах и составила 17,5–18%. Возможно, это является результатом тенденции к несколько старшему возрасту пациентов в исследуемой популяции, так как частота сопутствующих заболеваний напрямую связанна с возрастом пациента. Также это может отражать различия в патогенезе аутоиммунных заболеваний.
Метаболическая компенсация, оцениваемая по уровню гликированного гемоглобина, а также частота развития осложнений не различалась в наших группах, что соотносится с результатами других работ [20][23][24]. Наличие нескольких членов семьи с СД1 предрасполагает к лучшему уровню знаний о самоконтроле, однако высокая социальная нагрузка на семью может препятствовать достижению целевых показателей гликемии [23][24].
Предположительно, высокий риск СД1 при семейных случаях обусловлен в первую очередь генетическими факторами. Самый высокий генетический риск СД1 связан с гаплотипами HLA класса II, определяемыми аллелями в локусах HLA-DR и -DQ. Показано, что в финской популяции предрасполагающий гаплотип DR4-DQ8 встречается чаще у пациентов с семейными формами СД1, особенно у детей, у которых отец болеет СД1. Такой разницы не наблюдалось в распространенности предрасполагающего гаплотипа DR3-DQ2 [1]. По данным Veijola и соавт., самая высокая частота генотипа DR3/DR4 наблюдалась у детей с больным братом или сестрой, тогда как генотип DR4/X (X-любой гаплотип) наиболее часто встречался у детей с больным родителем [12]. Мы не получили разницы во встречаемости предрасполагающих гаплотипов DR3-DQ2 и DR4-DQ2 у детей с разными формами СД1, что может быть обусловлено малым объемом изучаемой выборки. В то же время при анализе отдельных аллелей, составляющих гаплотип DR4-DQ8, были показаны различия в частоте DRB1*04-DQA1*03:03-DQB1*03:02. Сочетание аллелей DQA1*03:01 и DQB1*03:02 (DQ8) является одним из основных предрасполагающих гаплотипов в Европейской популяции. В то же время недавно показано, что в гаплотип DQ8, помимо аллеля DQA1*03:01, вносит значительный вклад аллель DQA1*03:03 [25]. Таким образом, большая частота гаплотипа DRB1*04-DQA1*03:03-DQB1*03:02 может быть одной из характерных особенностей семейных форм СД1. Также у детей с семейной формой СД1 чаще встречался предрасполагающий гаплотип DRB1*07-DQA1*02:01-DQB1*02:02. Наличие большей частоты предрасполагающих гаплотипов может объяснять высокий риск СД1 среди семейных случаев. Напротив, большая частота встречаемости протекторного гаплотипа DRB1*08-DQA1*0104-DQB1*0402 в группе спорадического СД1 может объяснять отсутствие развития СД1 у других членов семьи.
Изучение генетики семейных форм СД1 с использованием более углубленного анализа (экзомное, геномное секвенирование) на большей выборке может позволить выявить новые генетические маркеры и сигнальные пути, задействованные в патогенезе СД1, что будет способствовать разработке и совершенствованию методов прогнозирования и профилактики.
ЗАКЛЮЧЕНИЕ
В нашем исследовании на большой выборке детей с СД1 было показано, что семейные формы заболевания характеризуются более ранним возрастом, меньшим, но все еще значимым риском ДКА при манифестации заболевания, а также особенностями иммунологического профиля и распределения предрасполагающих и защитных HLA-гаплотипов. В условиях формирования программ раннего выявления СД1 полученные данные могут быть использованы для оптимизации алгоритмов прогнозирования рисков. Учитывая различие клинической, иммунологической и генетической характеристики семейных и спорадических форм СД1 в российской популяции, целесообразно более детальное изучение факторов, которые могут обуславливать эти различия, включая проведение полногеномного секвенирования.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Исследование выполнено при поддержке Министерства науки и высшего образования Российской Федерации (соглашение №075-15-2024-645).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Зуфарова Ю.М. — концепция и дизайн исследования, набор материала, написание текста, получение, анализ, статистическая обработка и интерпретация полученных данных; Минниахметов И.Р., Хусаинова Р.И., Попов С.В. — анализ и интерпретация данных, редактирование текста; Петеркова В.А. — концепция и дизайн исследования, редактирование текста; Еремина И.А. — концепция и дизайн исследования, набор материала, редактирование текста; Титович Е.В. — концепция и дизайн исследования, набор материала, редактирование текста; Лаптев Д.Н. — концепция и дизайн исследования, набор материала, написание и редактирование текста, получение, анализ, статистическая обработка и интерпретация полученных данных.
Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
1. Parkkola A, Härkönen T, Ryhänen SJ, et al. Extended family history of type 1 diabetes and phenotype and genotype of newly diagnosed children. Diabetes Care. 2013. doi: https://doi.org/10.2337/dc12-0445
2. Couper JJ, Haller MJ, Greenbaum CJ, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Stages of type 1 diabetes in children and adolescents. Pediatr Diabetes. 2018;19:20-27. doi: https://doi.org/10.1111/pedi.12734
3. Tuomilehto J, Podar T, Tuomilehto-Wolf E, Virtala E. Evidence for importance of gender and birth cohort for risk of IDDM in offspring of IDDM parents. Diabetologia. 1995. doi: https://doi.org/10.1007/BF00400588
4. Weires M, Tausch B, Haug P, et al. Familiality of Diabetes Mellitus. Exp Clin Endocrinol Diabetes. 2007;115(10):634-640. doi: https://doi.org/10.1055/s-2007-984443
5. Harjutsalo V, Reunanen A, Tuomilehto J. Differential transmission of type 1 diabetes from diabetic fathers and mothers to their offspring. Diabetes. 2006. doi: https://doi.org/10.2337/db05-1296
6. Harjutsalo V, Podar T, Tuomilehto J. Cumulative incidence of type 1 diabetes in 10,168 siblings of finnish young-onset type 1 diabetic patients. Diabetes. 2005. doi: https://doi.org/10.2337/diabetes.54.2.563
7. Shaltout AA, Channanath AM, Thanaraj TA, et al. Ketoacidosis at first presentation of type 1 diabetes mellitus among children: a study from Kuwait. Sci Rep. 2016;6(1):27519. doi: https://doi.org/10.1038/srep27519
8. Warram JH, Krolewski AS, Gottlieb MS, Kahn CR. Differences in Risk of Insulin-Dependent Diabetes in Offspring of Diabetic Mothers and Diabetic Fathers. N Engl J Med. 1984. doi: https://doi.org/10.1056/nejm198407193110304
9. Familial risk of type I diabetes in European children. The Eurodiab Ace Study Group and The Eurodiab Ace Substudy 2 Study Group [published correction appears in Diabetologia 1999 Feb;42(2):262]. Diabetologia. 1998;41(10):1151-1156. doi: https://doi.org/10.1007/s001250051044
10. Herold KC, Bundy BN, Long SA, et al. An Anti-CD3 Antibody, Teplizumab, in Relatives at Risk for Type 1 Diabetes. N Engl J Med. 2019. doi: https://doi.org/10.1056/nejmoa1902226
11. O’Leary LA, Dorman JS, LaPorte RE, et al. Familial and sporadic insulin-dependent diabetes: evidence for heterogeneous etiologies? Diabetes Res Clin Pract. 1991;14(3):183-190. doi: https://doi.org/10.1016/0168-8227(91)90019-A
12. Veijola R, Reijonen H, Vähäsalo P, et al. HLA-DQB1-defined genetic susceptibility, beta cell autoimmunity, and metabolic characteristics in familial and nonfamilial insulin-dependent diabetes mellitus. J Clin Invest. 1996. doi: https://doi.org/10.1172/JCI119067
13. Lebenthal Y, De Vries L, Phillip M, Lazar L. Familial type 1 diabetes mellitus - gender distribution and age at onset of diabetes distinguish between parent-offspring and sib-pair subgroups. Pediatr Diabetes. 2010;11(6):403-411. doi: https://doi.org/10.1111/j.1399-5448.2009.00621.x
14. Gillespie KM, Aitken RJ, Wilson I, Williams AJK, Bingley PJ. Early Onset of Diabetes in the Proband Is the Major Determinant of Risk in HLA DR3-DQ2/DR4-DQ8 Siblings. Diabetes. 2014;63(3):1041-1047. doi: https://doi.org/10.2337/db13-0994
15. Redondo MJ, Geyer S, Steck AK, et al. A Type 1 Diabetes Genetic Risk Score Predicts Progression of Islet Autoimmunity and Development of Type 1 Diabetes in Individuals at Risk. Diabetes Care. 2018;41(9):1887-1894. doi: https://doi.org/10.2337/dc18-0087
16. Tillil H, Köbberling J. Age-Corrected Empirical Genetic Risk Estimates for First-Degree Relatives of IDDM Patients. Diabetes. 1987;36(1):93-99. doi: https://doi.org/10.2337/diab.36.1.93
17. Redondo MJ, Jeffrey J, Fain PR, et al. Concordance for Islet Autoimmunity among Monozygotic Twins. N Engl J Med. 2008;359(26):2849-2850. doi: https://doi.org/10.1056/NEJMc0805398
18. Turtinen M, Härkönen T, Parkkola A, et al. Characteristics of familial type 1 diabetes: effects of the relationship to the affected family member on phenotype and genotype at diagnosis. Diabetologia. 2019;62(11):2025-2039. doi: https://doi.org/10.1007/s00125-019-4952-8
19. Zung A, Na’amnih W, Bluednikov Y, et al.; Israel IDDM Registry Study Group (IRRSG). The proportion of familial cases of type 1 diabetes is increasing simultaneously with the disease incidence: Eighteen years of the Israeli Pediatric Diabetes Registry. Pediatr Diabetes. 2018;19(4):693-698. doi: https://doi.org/10.1111/pedi.12617
20. Karges B, Prinz N, Placzek K, et al. A Comparison of Familial and Sporadic Type 1 Diabetes Among Young Patients. Diabetes Care. 2021;44(5):1116-1124. doi: https://doi.org/10.2337/dc20-1829
21. Umpierrez GE, Latif KA, Murphy MB, et al. Thyroid Dysfunction in Patients With Type 1 Diabetes. Diabetes Care. 2003;26(4):1181-1185. doi: https://doi.org/10.2337/diacare.26.4.1181
22. Brenta G. Diabetes and thyroid disorders. Br J Diabetes Vasc Dis. 2010;10(4):172-177. doi: https://doi.org/10.1177/1474651410371321
23. Fox LA, Mubasher M, Wolfsdorf JI, et al. Characteristics of youth with type 1 diabetes (T1D) with and without a parent with T1D in the T1D exchange clinic registry. J Diabetes. 2016;8(6):834-838. doi: https://doi.org/10.1111/1753-0407.12363
24. Lebenthal Y, Shalitin S, Yackobovitch-Gavan M, et al. Retrospective comparative analysis of metabolic control and early complications in familial and sporadic type 1 diabetes patients. J Diabetes Complications. 2012;26(3):219-224. doi: https://doi.org/10.1016/j.jdiacomp.2012.03.016
25. Enczmann J, Balz V, Hoffmann M, et al. Next Generation Sequencing Identifies the HLA-DQA1*03:03 Allele in the Type 1 Diabetes Risk-Associated HLA-DQ8 Serotype. Genes (Basel). 2021;12(12):1879. doi: https://doi.org/10.3390/genes12121879
Об авторах
Ю. М. ЗуфароваРоссия
Зуфарова Юлдуз Муроджоновна; Researcher ID: AGE-4004-2022.
117036, Москва, ул. Дм. Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Д. Н. Лаптев
Россия
Лаптев Дмитрий Никитич, д.м.н..; Researcher ID: O-1826-2013; Scopus Author ID: 24341083800
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. Р. Минниахметов
Россия
Минниахметов Илдар Рамилевич - к.б.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Р. И. Хусаинова
Россия
Хусаинова Рита Игоревна - д.б.н. ; Researcher ID: E-6061-2014; Scopus Author ID: 6602798130.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
С. В. Попов
Россия
Попов Сергей Владимирович - к.б.н.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. В. Титович
Россия
Титович Елена Витальевна - к.м.н.; Researcher ID: AAO-2567-2020; Scopus Author ID: 6507024916.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
И. А. Еремина
Россия
Еремина Ирина Александровна - к.м.н. ; Researcher ID: S-3979-2016; Scopus Author ID: 6701334405.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
В. А. Петеркова
Россия
Петеркова Валентина Александровна - д.м.н., профессор, академик РАН.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рисунок 1. Изучаемая группа пациентов. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(278KB)
|
Метаданные ▾ | |
|
|
2. Рисунок 2. Характер манифестации заболевания в группах с семейной формой сахарного диабета 1 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(285KB)
|
Метаданные ▾ | |
|
|
3. Рисунок 3. Частота аутоантител (IAA, GAD, IA-2, ZnT8) у детей с разной формой сахарного диабета 1 типа. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Посмотреть
(189KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Зуфарова Ю.М., Лаптев Д.Н., Минниахметов И.Р., Хусаинова Р.И., Попов С.В., Титович Е.В., Еремина И.А., Петеркова В.А. Клинико-лабораторные и генетические особенности семейных форм сахарного диабета 1 типа. Сахарный диабет. 2024;27(6):520-527. https://doi.org/10.14341/DM13200
For citation:
Zufarova I.M., Laptev D.N., Minniahmetov I.R., Khusainova R.I., Popov S.V., Titovich E.V., Eremina I.A., Peterkova V.A. Clinical, biochemical and genetic characteristics of familial forms of type 1 diabetes. Diabetes mellitus. 2024;27(6):520-527. (In Russ.) https://doi.org/10.14341/DM13200
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC BY-NC-ND 4.0).















































